La elaboración de estas guías nacen de la necesidad creciente de desarrollar estudios basados en la evidencia y teniendo en cuenta que este tipo de práctica es un mecanismo para mejorar la calidad en la atención de los pacientes, para reducir los errores clínicos y minimizar la variabilidad en la práctica clínica. Entre estas, algunas pautas para el manejo de las enfermedades urológicas más frecuentes, además la importancia de estandarizar conductas y procedimientos en el abordaje de un paciente con enfermedad urológica. La Sociedad Colombiana de Urología, gracias a su equipo de publicaciones, y la revista Urología Colombiana, gracias a su comité editorial, en cabeza del Dr. William Quiroga Matamoros, a través de un análisis minucioso de la literatura actualmente disponible, ha preparado este documento para ayudar a los urólogos colombianos en la toma de decisiones clínicas en el manejo de cáncer vesical.
Materiales y métodosLos miembros del panel realizaron el proceso de adaptación de las guías tomando en cuenta las recomendaciones de la New Zealand Guidelines-Group. Se llevó a cabo una búsqueda en la literatura de los últimos 5 años, desde el 1 junio de 2009 hasta el 31 de mayo de 2014 en PubMed incluyendo los términos Mesh y Desc, en inglés y español, «Neoplasias de la vejiga urinaria» (Urinary bladder neoplasms), «Guías como asunto» (Guidelines as topic). Adicionalmente se incluyeron guías internacionales de las principales sociedades científicas (EAU, AUA, NCCN, NICE) y en el US Clearing House (www.guidelines.gov o www.guidelines-international.net). Se obtuvieron 32 archivos, de los cuales se excluyeron duplicados, versiones anteriores de las mismas guías, obteniéndose 7 documentos, los cuales fueron evaluados a través del instrumento Agree II, y teniendo en cuenta su alcance y aplicabilidad, se seleccionaron las guías para cáncer de vejiga (CV) no músculo-invasivo (CVNMI) y músculo-invasivo (CVMI) y mestastásico, en cáncer vesical de la Sociedad Europea de Urología del año 2014. Posteriormente se evaluaron las guías seleccionadas en su contenido, aplicabilidad, los aspectos clínicos cubiertos por la guía, y que estos fueran aplicables a nuestras condiciones de trabajo; se decidió complementarlas, aplicando una nueva estrategia de búsqueda, con el fin de determinar los aspectos más importantes referentes a la epidemiología, diagnóstico, manejo y seguimiento del CVMI y CVNMI. Posteriormente se procedió a recopilar toda la información y plasmarla en este documento.
Niveles de evidenciaEl nivel de evidencia fue seleccionado para ser plasmado y la interpretación de la información de la guía fue graduada de acuerdo con los nivel de de evidencia del Centro de Medicina Basada en la Evidencia de Oxford (grado de recomendación [GR] y nivel de evidencia [NE]) (tablas 1 y 2).
Niveles de evidencia científica
| Grado | Tipo de datos científicos |
|---|---|
| 1a | Datos científicos procedentes de metaanálisis de ensayos aleatorizados |
| 1b | Datos científicos procedentes de al menos un ensayo aleatorizado |
| 2a | Datos científicos procedentes de un estudio controlado bien diseñado sin aleatorización |
| 2b | Datos científicos procedentes de al menos un estudio semiexperimental bien diseñado de otro tipo |
| 3 | Datos científicos procedentes de estudios no experimentales bien diseñados, como estudios comparativos, estudios de correlación y casos clínicos |
| 4 | Datos científicos procedentes de informes u opiniones de comités de expertos o de la experiencia clínica de autoridades en la materia |
Grados de recomendación científica
| Grado | Naturaleza de las recomendaciones |
|---|---|
| A | Basada en estudios clínicos de buena calidad y coherencia en los que se abordan las recomendaciones concretas y que incluyen al menos un ensayo aleatorizado |
| B | Basada en estudios clínicos bien realizados, pero sin ensayos clínicos aleatorizados |
| C | Emitida a pesar de la ausencia de estudios clínicos de buena calidad directamente aplicables |
Modificada del Centro de Oxford para evidencia basada en niveles de evidencia medicinales (mayo 2001).
El CV es la neoplasia maligna más frecuente del tracto urinario, y es la novena más diagnosticada en el mundo. La tasa mundial de incidencia estandarizada por edad es de 9/100.000 hombres y 2/100.000 para las mujeres (datos de 2008). La mortalidad estandarizada mundial es de 3/100.000 hombres y 1/100.000 mujeres, y produce aproximadamente 150.000 muertes/año. Aproximadamente el 70% de los pacientes con CV presentan también una enfermedad confinada (estadio Ta, carcinoma in situ [CIS], T1).
De los pacientes con CVMI, de los tratados con cistectomía radical, el 43% fue inicialmente diagnosticado como no invasivos (progresión), un tercio de los pacientes con CVMI tiene metástasis no detectadas al momento del tratamiento y un 25% de los pacientes con CVMI tiene invasión nodal al momento de la cirugía.
Factores de riesgo- •
El tabaco es el factor de riesgo más importante (el 50% de los casos). (NE: 3)
- •
La exposición ocupacional a aminas aromáticas, hidrocarburos aromáticos policíclicos y los hidrocarburos clorados es el segundo factor de riesgo más importante (el 10% de los casos). (NE: 3)
- •
Esquistosomiasis asociada a cistitis crónica es causa de CV. (NE:3)
- •
Incrementan el riesgo: uso crónico de catéteres vesicales, radiación ionizante, exposición al arsénico, uso de ciclofosfamida y pioglitazona, estrato socioeconómico bajo e historia familiar en primer grado. (NE: 3)
- •
Incluir el subtipo histológico (pronóstico).
- •
Profundidad de la invasión.
- •
Márgenes de resección.
- •
Representación de la extensión linfática.
- •
Invasión linfovascular.
Tabla 3.Clasificación TNM de 2009 del cáncer de vejiga
T-tumor primario N-ganglios linfáticos M-metástasis a distancia TX No se puede evaluar el tumor primario NX No se pueden evaluar los ganglios linfáticos regionales T0 Ausencia de datos de tumor primario
Ta Carcinoma papilar no invasivoN0 Ausencia de metástasis ganglionares regionales M0 Ausencia de metástasis a distancia Tis Carcinoma in situ: «tumor plano» T1 El tumor invade el tejido conjuntivo subepitelial N1 Metástasis en un solo ganglio linfático en la pelvis verdadera (hipogástricos, obturadores, ilíacos externos o presacros) M1 Metástasis a distancia T2 El tumor invade el músculo
• T2a El tumor invade el músculo superficial (mitad interna)
• T2b El tumor invade el músculo profundo (mitad externa)N2 Metástasis en varios ganglios linfáticos en la pelvis verdadera (hipogástricos, obturadores, ilíacos externos o presacros) T3 El tumor invade el tejido perivesical
• T3a Microscópicamente
• T3b Macroscópicamente (masa extravesical)N3 Metástasis en uno o varios ganglios linfáticos ilíacos comunes T4 El tumor invade cualquiera de las estructuras siguientes: próstata, útero, vagina, pared de la pelvis, pared abdominal
• T4a El tumor invade la próstata, el útero o la vagina
• T4b El tumor invade la pared de la pelvis o la pared abdominalTabla 4.Graduación histológica de los tumores vesicales no músculo-invasivos de la Organización Mundial de la Salud y la Sociedad Internacional de Patología Urológica del 2004
Lesiones planas Lesiones papilares Hiperplasia Papiloma urotelial Atipia reactiva Neoplasia urotelial papilar de bajo potencial maligno Atipia de significado indeterminado Displasia urotelial Carcinoma urotelial papilar de bajo grado Carcinoma in situ Carcinoma urotelial papilar de alto grado Graduación de la Organización Mundial de la Salud de 2004.
- •
CIS primario: CIS aislado, alejado CIS sin tumores papilares anteriores o simultáneos y no CIS anterior.
- •
CIS secundario: CIS detectado durante el seguimiento de los pacientes con un tumor anterior que no era CIS.
- •
CIS concurrente: CIS en la presencia de cualquier otro tumor urotelial en la vejiga.
- •
CIS recurrente: Ocurrencia repetida o aislada de CIS después de la respuesta inicial exitosa al tratamiento intravesical.
- •
La historia clínica completa que incluya factores de riesgo y síntomas sospechosos (GR: A) es lo más importante en el paciente con sospecha de CV.
- •
La hematuria es el síntoma más frecuente.
- •
Sospechar CIS, en pacientes con LUTS refractarios al manejo médico.
- •
Urografía intravenosa (UIV): no se recomienda de rutina. (NE: 2a, GR: A)
- •
La incidencia de tumores del tracto superior es del 1,8%, pero aumenta al 7,5% si hay tumor localizado en el trígono. (NE: 2b, GR: B)
- •
La urografía por tomografía computarizada (TC) se prefiere como imagen del tracto superior, sobre la UIV. (GR: B)
- •
Ecografía renal y de vías urinarias: a menudo sirve como imagen inicial de los pacientes con hematuria (GR: C), sin embargo no excluye la presencia de tumores del tracto urinario superior.
- •
Citología urinaria: tiene alta sensibilidad en tumores de alto grado, pero baja sensibilidad en tumores de bajo grado.
- •
Se considera útil en la detección del CIS, donde su sensibilidad varía del 28-100%. (NE: 2b)
- •
La citología urinaria positiva puede indicar un tumor urotelial en cualquier parte del tracto urinario (manos expertas, especificidad del 90%). (NE:2b)
- •
La citología se debe realizar en orina fresca (no orina de la mañana por citólisis).
- •
Una sola lámina citológica es suficiente.
- •
Es razonable repetir la muestra en una citología positiva. (NE: 3)
- •
En pacientes con citología positiva pero cistoscopia negativa, se deben excluir tumores del tracto urinario superior, y CIS de la vejiga (biopsias aleatorizadas o fotodinámicas de la vejiga, que incluyan muestra de la uretra prostática).
- •
El uso de marcadores moleculares en CV aun no se recomienda. Ninguno de los marcadores ha sido aceptado en el diagnóstico o seguimiento estándar en la urología de rutina. El análisis por microsatélites es el método más prometedor.
- •
Cistoscopia: en la exploración de la hematuria ninguna prueba reemplaza la cistoscopia. (GR: A)
- •
Debe realizarse en los pacientes con síntomas sugestivos de CV.
- •
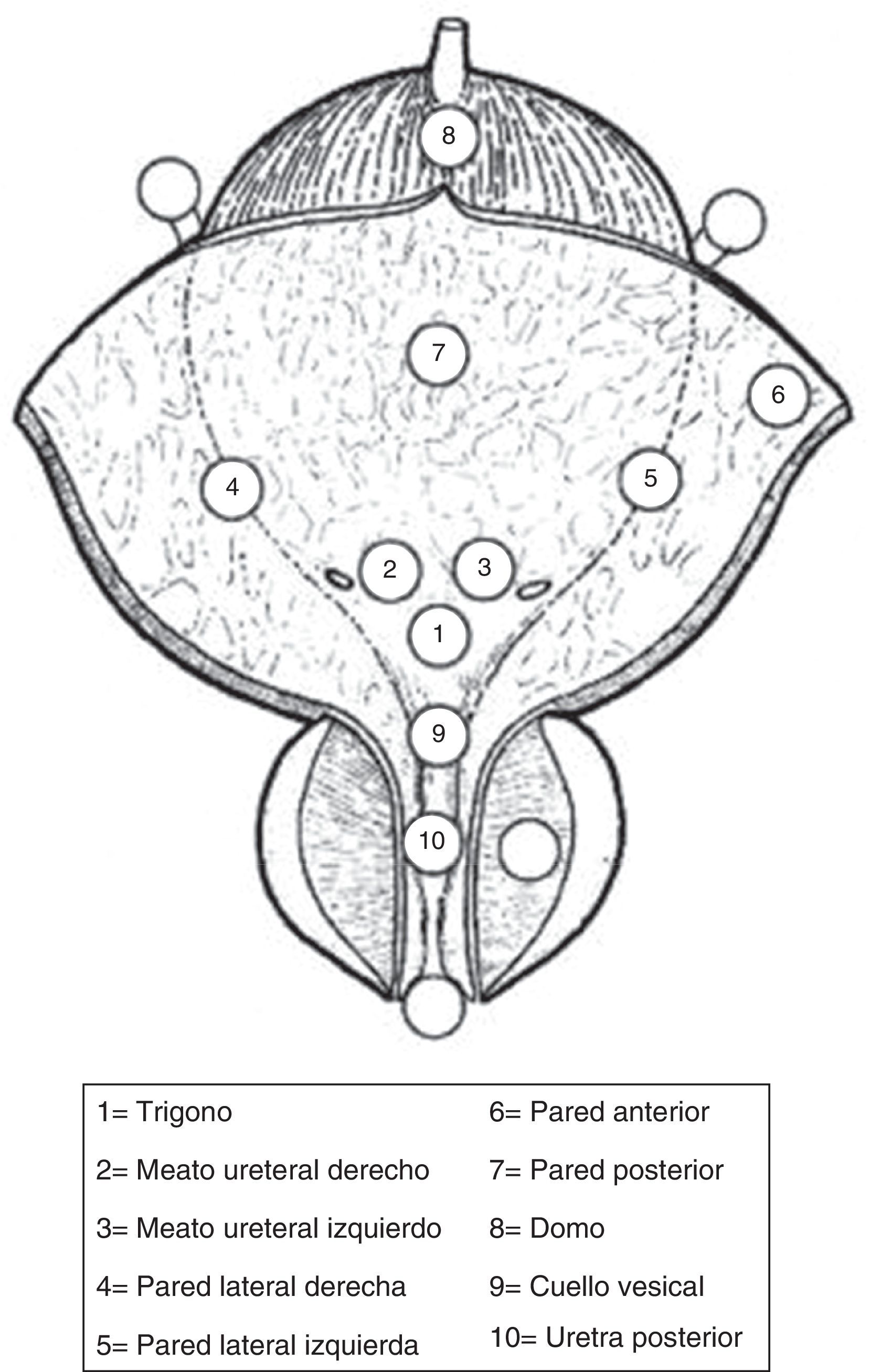
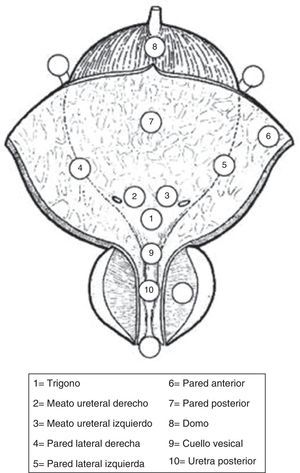
Se debe describir todos los rasgos de una lesión (tamaño, sitio, número y apariencia); se recomienda el diagrama vesical. (GR: C)
El objetivo de la resección transuretral (RTU) vesical en los tumores Ta-T1 de vejiga es realizar un correcto diagnóstico y eliminar todas las lesiones visibles..
Recomendaciones para el abordaje primario del cáncer vesical no músculo-invasivo
| Diagnóstico | GR |
|---|---|
| La historia del paciente debe ser recolectada y registrada con toda la información importante, establecer una posible asociación con CV, incluyendo factores de riesgo y síntomas sospechosos | A |
| La ecografía renal y de vías urinarias se pueden utilizar durante la evaluación inicial de los pacientes con hematuria | C |
| En el momento del diagnóstico inicial de CV, la urografía por TC o intravenosa debe ser realizada en casos seleccionados | B |
| La cistoscopia se recomienda en todos los pacientes con síntomas sugestivos de CV. No se puede sustituir por la citología o por cualquier otro examen no invasivo | A |
| La cistoscopia debe describir todas las características macroscópicas del tumor (localización, tamaño, número y apariencia) y alteraciones de la mucosa. Se recomienda un diagrama de vejiga | C |
| La citología urinaria predice tumores de alto grado previo a la RTU tumor vesical | C |
| La citología se debe realizar en la orina fresca con una fijación adecuada. La orina de la mañana no es adecuada debido a la presencia frecuente de citólisis | C |
CV: cáncer vesical; GR: grado de recomendación; RTU: resección transuretral; TC: tomografía computarizada.
Técnica de RTU vesical (GR: C): la RTU se debe realizar sistemáticamente como sigue:
- •
Inicio del procedimiento con la palpación bimanual cuidadosa bajo anestesia general o epidural.
- •
Inserción del resectoscopio, en los hombres menores de orientación visual, con la inspección de toda la uretra.
- •
Inspección de todo el revestimiento urotelial de la vejiga.
- •
Biopsia de uretra prostática
- •
Biopsias frío taza de la vejiga.
- •
Resección del tumor.
- •
Resección en bloque de tumores<1cm pueden ser resecados en bloque.
- •
Resección en 2 partes en tumores grandes, la parte exofítica y la base del tumor. (NE: 3)
- •
La ausencia de músculo en el espécimen de RTU vesical se asocia con alto riesgo de recaída. (NE: 2b).
- •
Citología positiva en ausencia de lesión macroscópica, se deben tomar muestras de uretra prostática (compromiso hasta del 11,3%). (NE: 2b, GR: C)
- •
En Ta y T1 no se recomiendan de rutina, el riesgo de CIS es extremadamente bajo (<2%). (NE: 2a)
- •
La técnica fotodinámica ha mostrado mejor sensibilidad que la endoscopia de luz en la toma de biopsia (63 vs. 81%). (GR: B)
- •
Se ha demostrado que la segunda RTU vesical ha mejorado la supervivencia libre de enfermedad. (NE: 2a) (fig. 1).
- •
Después de la RTU inicial incompleta.
- •
Si no hay un músculo en la muestra después de la resección inicial, con excepción de los tumores TaG1 y CIS primarios.
- •
En todos los tumores T1.
- •
En todos los tumores G3, excepto CIS primario (tablas 7 y 8)
Tabla 7.Recomendaciones para RTU vesical
RTU tumor vesical GR RTU tumor vesical debe realizarse sistemáticamente en pasos individuales C • Palpación bimanual bajo anestesia • lnserción del resectoscopio, bajo control visual con la inspección de toda la uretra • Inspección de todo el revestimiento urotelial de la vejiga • Biopsia de la uretra prostática (si está indicado) • Biopsias en frío de vejiga (si está indicado); • Resección del tumor • Palpación bimanual después de la resección • Formulación de protocolo • Formulación de formulario de pedido para la evaluación patológica Realizar la resección en una sola pieza para los pequeños tumores papilares<1cm, incluyendo parte de la subyacente pared de la vejiga B Realizar la resección en las fracciones (incluyendo el tejido muscular) para tumores>1cm de diámetro B Las biopsias deben tomarse de urotelio de aspecto anormal. Las biopsias de mucosa de aspecto normal (trígono, cúpula de la vejiga, y la izquierda, la derecha, las paredes anterior y posterior de la vejiga) solo se recomiendan cuando la citología es positiva o cuando el tumor exofítico tiene una apariencia no papilar B Se recomienda la biopsia de la uretra prostática para los casos de tumor de cuello de la vejiga, cuando CIS está presente o se sospecha, cuando hay citología positiva sin evidencia de tumor en la vejiga, o cuando hay anormalidades de la uretra prostática visibles. Si la biopsia no se realiza durante el procedimiento inicial, debe ser completada en el momento de la segunda resección C Biopsia de la uretra prostática debe tomarse de áreas anormales y de la zona de precolicular (entre las 5 y las 7 del reloj) utilizando un asa de resección. En tumores no músculo-invasivo primarios, cuando no se sospecha invasión del estroma, puede ser realizada la biopsia en frío con pinza C Si el equipo está disponible, se debe realizar la biopsia guiada por fluorescencia cuando se sospecha CIS o tumor de alto grado (por ejemplo, citología positiva, recurrente o un tumor con historia previa de una lesión de alto grado) B Las muestras de diferentes biopsias y fracciones de resección deben ser referidos al patólogo en recipientes individuales y etiquetados por separado C El protocolo RTU tumor vesical debe describir todos los pasos del procedimiento, así como el alcance y exhaustividad de la resección C Una segunda RTU tumor vesical se recomienda en las siguientes situaciones A • Después de una RTU vesical inicial incompleta • Si no hay un músculo en la muestra después de la resección inicial, con excepción de los tumores TaG1 y CIS primario • En todos los tumores T1 • En todos los tumores G3, excepto CIS primario Una segunda RTU tumor vesical debe realizarse dentro de 2-6 semanas después de la resección inicial C CIS: carcinoma in situ; GR: grado de recomendación; RTU: resección transuretral.
Tabla 8.Análisis patológico
Clasificación e informe patológico GR La profundidad de la invasión del tumor se clasifica según el sistema TNM A Para la clasificación histológica, se pueden usar los sistemas de clasificación tanto de 1973 como de 2004 de la OMS. Sin embargo, la clasificación de la OMS 2004 es validado por más ensayos prospectivos y se incorpora en los modelos de pronóstico A Siempre que se utilice la terminología CVNMI en casos individuales, el estadio tumoral y el grado deben ser mencionados A El informe patológico debe especificar la ubicación del tumor, grado tumoral, la profundidad de la invasión tumoral, presencia de CIS, y si el músculo detrusor está presente en la muestra A El informe patológico debe especificar la presencia de invasión linfovascular A CIS: carcinoma in situ; CVNMI: cáncer de vejiga no músculo-invasivo; GR: grado de recomendación; OMS: Organización Mundial de la Salud.
- •
Se recomienda el uso de los factores descritos por la EORTC y la estratificación con las calculadoras de riesgo individual (tabla 9).
Tabla 9.Grupos de estadificación de riesgo
Grupo de riesgo Características Tumores de bajo riesgo Primarios, solitarios, Ta, G1, <3cm, no CIS Tumores de riesgo intermedio Tumores no definidos en las 2 categorías adyacentes Tumores de alto riesgo Cualquiera de las siguientes: T1, G3, CIS, múltiples, recurrentes y grandes (>3cm), Ta G1-G2 CIS: carcinoma in situ.
Las calculadoras de riesgo pueden ser consultadas en: http://www.eortc.be/tools/bladdercalculator.
- •
Dejar de fumar. (GR: B, NE: 2-3)
- •
Se ha confirmado que el tabaquismo aumenta el riesgo de recurrencia y progresión tumoral.
- •
A todos los fumadores con casos confirmados de CVNMI debe aconsejarles que deje de fumar.
- •
El tratamiento debe ser dado de acuerdo a los tipos de riesgo.
- •
La quimioterapia intravesical inmediata posterior a RTU vesical está indicada en todos los grupos de riesgo, se recomienda la instilación inmediata o hasta dentro de 24h. (NE: 3, GR: A)
- •
En pacientes de bajo riesgo la instilación postoperatoria es considerada como tratamiento adyuvante completo. (GR: A)
- •
En los pacientes con tumores Ta de riesgo intermedio, una instilación inmediata de quimioterapia debe ser seguida por un año de tratamiento con bacilo de Calmette-Guérin (BCG) a dosis plenas, o por más instilación de quimioterapia un máximo de un año (esquema aun no establecido). (GR: A)
- •
Si se administra la quimioterapia intravesical, se aconseja utilizar el fármaco en su pH óptimo y mantener la concentración del medicamento durante la instilación mediante la reducción de la ingesta de líquidos (GR: B). Duración 1-2horas (GR: C).
- •
En los pacientes con tumores de alto riesgo, está indicada la dosis completa de BCG intravesical durante 1-3 años. (GR: A)
- •
En los pacientes con CIS en la uretra prostática, se puede ofrecer RTU de la próstata seguido por instilación intravesical de BCG. (GR: C)
- •
En pacientes con falla a la BCG no elegibles para la cistectomía radical son opciones la gemcitabina o MMC en combinación con la hipertermia. (GR: C)
- •
Las contraindicaciones absolutas de la instilación de BCG intravesical son:
- o
Durante las primeras 2 semanas después de la RTU;
- o
en pacientes con hematuria macroscópica;
- o
después de la cateterización traumática;
- o
en pacientes con infección urinaria (síntomas) (tablas 10–12)
Tabla 10.Opciones de manejo para efectos adversos asociados con BCG intravesical
Síntomas de cistitis
Usar fenazopiridina, bromuro de propantelina o AINESi los síntomas mejoran, continuar con las instilaciones Si los síntomas persisten o empeoran a. Posponer las instilaciones b. Realizar un cultivo de orina c. Iniciar tratamiento antibiótico empírico Si los síntomas persisten a pesar del tratamiento antibiótico d. Con cultivo positivo: tratamiento antibiótico según sensibilidad e. Con cultivo negativo: las quinolonas y potencialmente instilaciones con antiinflamatorio analgésico una vez al día durante 5 días (ciclo de repetición si es necesario) Si los síntomas persisten: antituberculosos+corticosteroides Si no hay respuesta al tratamiento y/ o hay contracturas vesicales: cistectomía radical Hematuria Si hay presencia de otros síntomas, realizar cultivo de orina para excluir la cistitis hemorrágica Si hematuria persiste, realizar la cistoscopia para evaluar la presencia de tumor de vesical Prostatitis granulomatosa sintomática Rara vez se presentan síntomas: realizar urocultivo Inicio de quinolonas Si las quinolonas no son efectivas: isoniacida (300mg/día) y rifampicina (600mg/día) durante 3 meses Detener la terapia intravesical Orquiepididimitis Realizar urocultivo e iniciar quinolonas Detener la terapia intravesical Si hay absceso o no hay respuesta a tratamiento, realizar orquidectomía Opciones de manejo para efectos adversos sistémicos Malestar general y fiebre Generalmente resuelve en las primeras 48h con o sin antipiréticos Artralgia o artritis Complicación rara, usualmente se debe a una reacción autoinmune Artralgia: tratamiento con AINE. Artritis: AINE Si hay respuesta parcial o no hay respuesta, proceder con corticosteroides, altas dosis de quinolonas o medicamentos antituberculosos AINE: antiinflamatorios no esteroideos; BCG: bacilo de Calmette-Guérin.
Tabla 11.Falla a la terapia intravesical con BCG
Cuando se detecta un tumor músculo-invasivo durante el seguimiento Tumor refractario a BCG 1. De alto grado, cuando el tumor papilar no músculo-invasivo está presente en los siguientes 3 meses. Además el tratamiento conservador con BCG se asocia con mayor riesgo de progresión (NE: 3) 2. El CIS (sin tumor papilar concomitante) está presente en ambos, 3 y 6 meses, los pacientes con CIS presente a los 3 meses, un curso de BCG adicional puede alcanzar una respuesta completa en más del 50% de los casos (NE: 3) 3. Aparece un tumor de alto grado durante la terapia con BCG Recurrencia de alto grado después de BCG, después de terapia de mantenimiento, a pesar de repuesta inicial adecuadaa Intolerancia a la terapia con BCG Efectos adversos severos después de un ciclo de inducción completo BCG: bacilo de Calmette-Guérin; CIS: carcinoma in situ; NE: nivel de evidencia.
Tabla 12.Recomendaciones de adyuvancia para Ta y T1, y terapia para CIS
GR Los pacientes con cáncer de vejiga no músculo-invasivo deben ser asesorados para dejar de fumar B El tipo de terapia intravesical debe basarse en los grupos de riesgo anteriormente presentados A Se recomienda terapia intravesical inmediata en los pacientes que se presumen de bajo o de riesgo intermedio B En los pacientes con tumores de bajo riesgo, una instilación inmediata de quimioterapia se recomienda como tratamiento adyuvante completo A En los pacientes con tumores Ta de riesgo intermedio, una instilación inmediata de quimioterapia debe ser seguida de un año de tratamiento con BCG de dosis completa, o por más de quimioterapia intravesical para un máximo de un año A En los pacientes con tumores de alto riesgo, la dosis completa de BCG intravesical está indicada durante 1-3 años A En los pacientes con CIS en el revestimiento epitelial de la uretra prostática, se puede ofrecer C RTU de la próstata, seguido de instilación intravesical de BCG En los pacientes con alto riesgo de progresión tumoral (tabla 11), la cistectomía radical inmediata debería ser considerada C En los pacientes con falla a la terapia con BCG, está indicada la cistectomía radical B En los pacientes con falla a la terapia con BCG, no elegibles para la cistectomía radical, son una opción la gemcitabina o MMC en combinación con hipertermia C Quimioterapia Intravesical Una instilación inmediata se debe administrar dentro de las 24h después de la RTU vesical C Se debe omitir la instilación inmediata de quimioterapia en caso de documentarse o de sospechada de perforación intra-/ extraperitoneal de la vejiga, después de una extensa RTU, o hemorragia que requiere irrigación de la vejiga C El mejor esquema de instilación de quimioterapia intravesical y su duración no está definido, y este no debe exceder un año C Si se administra la quimioterapia intravesical, se aconseja utilizar el fármaco a su pH óptimo y mantener la concentración del fármaco durante la instilación mediante la reducción de la ingesta de líquidos B La duración de la instilación individual debe ser de 1-2h C BCG inmunoterapéutica intravesical Las contraindicaciones absolutas de instilación con BCG intravesical son C • Durante las primeras 2 semanas después de la RTU; • En pacientes con hematuria macroscópica; • Después de la cateterización traumática; • En los pacientes con infección urinaria. BCG: bacilo de Calmette-Guérin; CIS: carcinoma in situ; GR: grado de recomendación; RTU: resección transuretral.
- o
Se determina como cistectomía radical temprana aquella cistectomía antes de la progresión patológica (confirmada) a un tumor músculo-invasivo.
Son varias las razones para considerar la cistectomía radical temprana en pacientes con CVNMI.
- 1.
La precisión de la estadificación de tumores T1 por RTU es baja, con el 27-51% de los pacientes que están siendo reclasificados a tumores músculo-invasivos en la cistectomía radical. (NE:3)
- 2.
Algunos pacientes con tumores no músculo-invasivos experimentan progresión de la enfermedad a lesiones músculo-invasivas.
- 3.
Se ha demostrado retrospectivamente que los pacientes con tumores de alto riesgo no musculo-invasivos que se someten a una cistectomía radical temprana por una recidiva tumoral después del tratamiento inicial con RTU y BCG tienen una mejor tasa de supervivencia vs. a los que se les realiza una cistectomía radical diferida. (NE:3)
El beneficio potencial de la cistectomía radical debe sopesarse contra el riesgo, la morbilidad y el impacto en la calidad de vida. Es razonable proponer una cistectomía radical inmediata a aquellos pacientes con tumor no músculo-invasivo que están en mayor riesgo de progresión (NE: 3), incluyendo:
- •
Tumores múltiples y/ o grandes (>3cm) T1, alto grado (G3);
- •
T1, alto grado (G3) con tumor CIS concurrente;
- •
T1 recurrente, tumores de alto grado (G3);
- •
T1G3 y CIS en uretra prostática;
- •
Presencia de histología inusual de carcinoma urotelial;
- •
Presencia de invasión linfovascular;
- •
Mal funcionamiento de la vejiga.
Los beneficios y riesgos de la cistectomía inmediata y retardada se deben discutir con los pacientes. Los pacientes deben ser informados acerca de los beneficios y los riesgos de ambos enfoques. Los factores individuales como el género, la edad o la localización del tumor en (seudo) divertículo, se deben considerar a causa del peor pronóstico en las mujeres, riesgo de progresión después de BCG en los tumores de alto riesgo y el riesgo potencial de los tumores en el divertículo.
La cistectomía radical es muy recomendable en pacientes con tumores BCG-refractarios, como se ha mencionado anteriormente. Un retraso en la cistectomía radical podría conducir a la disminución de la supervivencia específica de la enfermedad (NE: 3). En los pacientes en los que la cistectomía radical se realiza en el estadio patológico no músculo-invasivo de la enfermedad, la tasa de supervivencia libre de enfermedad a los 5-años supera el 80% (tablas 13 y 14).
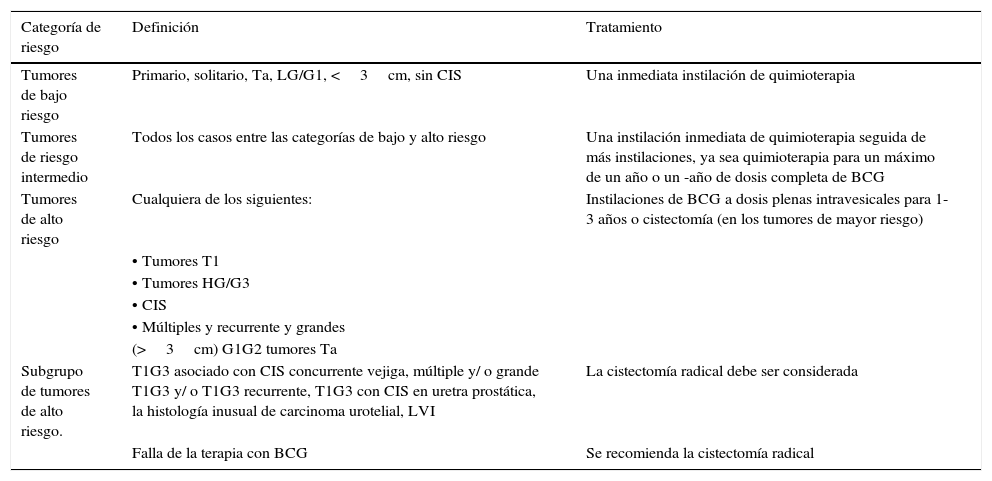
Recomendaciones de tratamiento en Ta, tumores T1 de acuerdo con la estratificación de riesgo
| Categoría de riesgo | Definición | Tratamiento |
|---|---|---|
| Tumores de bajo riesgo | Primario, solitario, Ta, LG/G1, <3cm, sin CIS | Una inmediata instilación de quimioterapia |
| Tumores de riesgo intermedio | Todos los casos entre las categorías de bajo y alto riesgo | Una instilación inmediata de quimioterapia seguida de más instilaciones, ya sea quimioterapia para un máximo de un año o un -año de dosis completa de BCG |
| Tumores de alto riesgo | Cualquiera de los siguientes: | Instilaciones de BCG a dosis plenas intravesicales para 1-3 años o cistectomía (en los tumores de mayor riesgo) |
| • Tumores T1 | ||
| • Tumores HG/G3 | ||
| • CIS | ||
| • Múltiples y recurrente y grandes | ||
| (>3cm) G1G2 tumores Ta | ||
| Subgrupo de tumores de alto riesgo. | T1G3 asociado con CIS concurrente vejiga, múltiple y/ o grande T1G3 y/ o T1G3 recurrente, T1G3 con CIS en uretra prostática, la histología inusual de carcinoma urotelial, LVI | La cistectomía radical debe ser considerada |
| Falla de la terapia con BCG | Se recomienda la cistectomía radical |
BCG: bacilo de Calmette-Guérin; CIS: carcinoma in situ; HG: alto grado; LG: bajo grado; LVI: invasión linfovascular.
Recomendaciones de tratamiento para falla de la terapia con BCG y recurrencias después de BCG
| Categoría | Recomendación de tratamiento | Grado de recomendación |
|---|---|---|
| Tumor refractario a BCG | 1. Cistectomía radical | B |
| 2. Estrategias preservadoras de vejiga en pacientes no candidatos a cistectomía radical | ||
| Tumor de alto grado recurrente después de BCG | 1. Cistectomía radical | C |
| 2. Repetir curso de BCG | ||
| 3. Estrategias preservadoras de vejiga | ||
| Tumor de alto grado no recurrente después de BCG para un tumor de riesgo intermedio | 1. Repetir BCG o quimioterapia | C |
| 2. Cistectomía radical |
BCG: bacilo de Calmette-Guérin.
- •
La primera cistoscopia después de la RTU a los 3 meses es un indicador pronóstico muy importante para la recurrencia. (NE: 1a)
- •
En los tumores de bajo riesgo, el riesgo de recurrencia, después de 5 años libre de recurrencia, es bajo (253). (NE: 3)
- •
En los tumores originalmente intermedio o de alto riesgo, las recidivas después de 10 años libre de tumor no son inusuales (NE: 3). Por lo tanto, se recomienda un seguimiento durante toda la vida.
- •
Los pacientes con tumores de alto riesgo deben ser sometidos a cistoscopia y citología urinaria a los 3 meses. Si es negativo, posterior cistoscopia y la citología debe repetirse cada 3 meses durante un período de 2 años, y después cada 6 meses hasta 5 años, y luego anualmente. (GR: C)
- •
Se recomienda de forma regular (anual) realizar imágenes del tracto superior (TC-UIV o UIV) para los tumores de alto riesgo. (GR: C)
- •
La biopsia vesical bajo anestesia está indicada si la cistoscopia muestra hallazgos sospechosos o si la citología urinaria da positivo. (GR: B)
- •
En pacientes con citología positiva, sin evidencia macroscópica a la cistoscopia de luz, se recomiendan biopsias aleatorizadas o con equipo fotodinámico además de la investigación de lugares extravesicales (urografía por TC, biopsia de uretra prostática). (GR: B)
Los pacientes con CVNMI, manejados con quimioterapia, con recurrencia de CVNMI, pueden beneficiarse de BCG. La quimioterapia intravesical previa no tiene impacto en el efecto de la instilación de BCG. (NE: 1a)
Cáncer de vejiga músculo-invasivoEl tratamiento de elección es la cistectomía radical.
Recomendaciones de la enfermedad- •
Fijación temprana en formol, corte de la uretra a la cúpula vesical;
- •
Examen macroscópico difícil, se debe incluir la totalidad de la muestra (ulcerada o retraída);
- •
Estudio de uretra, próstata y uréteres y márgenes;
- •
Todos los ganglios deben ser contados y medidos, además debe reportarse si hay o no rotura capsular y porcentaje de invasión, así como presencia o no de émbolos vasculares;
- •
Si hay metástasis en grasa perivesical sin estructuras de ganglios, esta localización debe clasificarse como N+;
- •
La subestadificación del pT2a/b solamente se debe hacer con el espécimen quirúrgico, no en muestra de RTU vesical;
- •
La extensión del CIS en los ductos y el ácido de la próstata deben ser considerados como CIS, y la participación del tracto gastrointestinal como pT4.
- •
No se recomiendan marcadores tumorales de rutina en los tumores de alto riesgo músculos-invasivos.
Los parámetros de imagen en la estadificación del CVMI requiere evaluar:
- 1.
La extensión local del tumor;
- 2.
Invasión a ganglios linfáticos;
- 3.
Invasión de tracto urinario superior y otros órganos a distancia.
Estatificación local del CVMI: tanto la TC como la resonancia magnética (RM) pueden ser utilizadas para la evaluación de la invasión local, pero no son capaces de diagnosticar con precisión la invasión microscópica de la grasa perivesical (T3a). Por tanto, el objetivo principal de la TC y la RM es detectar la enfermedad T3b o superior.
Resonancia magnéticaPara la estadificación del CVMI, la RM tiene una resolución superior en contraste de tejidos blandos en comparación con la TC, pero una resolución espacial más pobre. En estudios realizados antes de la disponibilidad de la TC multidetector, la RM se informó como más exacta en la evaluación local. La precisión de la RM en la estadificación del tumor primario varía del 73 al 96% (media 85%). Estos valores fueron del 10-33% (media 19%) superiores a los obtenidos con la TC. La fase dinámica con contraste RM puede ayudar a diferenciar tumor de vejiga de los tejidos circundantes o de reacción posbiopsia (se identifica neovascularización).
Tomografía computarizada en estadificación del cáncer de vejiga invasivoLas ventajas de la TC incluyen la alta resolución espacial, menor tiempo de adquisición, ampliación de la cobertura en una sola apnea y menor susceptibilidad a los factores del paciente variables. La TC es incapaz de diferenciar entre las etapas Ta y los tumores T3a, pero es útil para la detección de la invasión en la grasa perivesical (T3b) y los órganos adyacentes. La precisión de la TC en la determinación de la extensión del tumor extravesical varía del 55-92% y aumenta con la enfermedad más avanzada.
Determinación de la invasión nodal por imágenesLa evaluación de la metástasis en los ganglios linfáticos basada únicamente en tamaño está limitada por la incapacidad de la TC y la RM para identificar metástasis en ganglios de tamaño normal o mínimamente aumentados. La sensibilidad para la detección de metástasis en los ganglios linfáticos es baja (48-87%). La especificidad también es baja porque la ampliación nodal puede ser debida a la enfermedad benigna. En general, la TC y la RM muestran resultados similares en la detección de metástasis en los ganglios linfáticos en una variedad de tumores pélvicos primarios. Nodos con diámetro de eje corto, nodos pélvicos>8mm y nodos abdominales>10mm, detectados por TC o RM deben considerarse como patológicamente aumentados.
Actualmente no hay evidencia que apoye el uso rutinario de la tomografía por emisión de positrones en la estadificación ganglionar del CV, aunque el método se ha evaluado con resultados variables en pequeños ensayos prospectivos.
Estudio del tracto urinario superior:La urografía por TC es la técnica de imagen con la mayor precisión diagnóstica de carcinoma urotelial del tracto urinario superior, y ha sustituido la urografía intravenosa convencional y la ultrasonografía como la prueba de imagen
de primera línea para la investigación de los pacientes de alto riesgo. La sensibilidad de la urografía por tac para el diagnóstico del carcinoma urotelial del tracto urinario superior, se informa que puede variar desde 0,67 hasta 1,0 y especificidad 0,93-0,99, dependiendo de la técnica utilizada. Debe haber confirmación histopatológica.
Evaluación de metástasis a distancia:La TC y la RM son las técnicas de diagnóstico de elección para detectar metástasis pulmonares y hepáticas. Las metástasis en hueso y las metástasis cerebrales son raras en el momento de presentación del CV invasivo. Una gammagrafía ósea e imágenes del cerebro adicionales no se indican de forma rutinaria, a menos que el paciente tenga síntomas o signos que muestren metástasis óseas o cerebrales. La RM es más sensible para detectar metástasis óseas que la gammagrafía.
Conclusiones- •
Las imágenes proporcionan una estadificación adecuada y una selección apropiada del tratamiento. (NE: 2b)
- •
No se recomienda el uso de FDG-tomografía por emisión de positrones en la estadificación del CVMI.
- •
La forma idónea de estadificación es la TC toraco-abdomino-pélvica con fase excretora con urografía para la evaluación del tracto urinario superior (GR: B); RM en casos en el que el tac está contraindicado. (GR: C)
- •
Se recomienda la biopsia guiada por ureteroscopia para la confirmación histopatológica preoperatoria del carcinoma urotelial del tracto urinario superior. (GR: C)
- •
Se recomienda TC o RM para la estadificación de la enfermedad localmente avanzada o metastásica, en pacientes en los que se considera un tratamiento radical. (GR: B)
- •
La TC y la RM son generalmente equivalentes en el diagnóstico de metástasis abdominales locales y distantes pero la TC se prefiere para el diagnóstico de las metástasis pulmonares. (GR: C)
El tratamiento estándar para pacientes con cáncer vesical infiltrante es la cistectomía radical. Sin embargo, este patrón solo proporciona supervivencia a 5 años en alrededor del 50% de los pacientes. Con el fin de mejorar estos resultados insatisfactorios, el uso de quimioterapia preoperatoria se ha explorado desde la década de 1980. Pese a un gran número de estudios de fase iii, con un alto nivel de evidencia que apoya su uso, la quimioterapia neoadyuvante todavía se utiliza con poca frecuencia.
Hay muchas ventajas y desventajas en la administración de quimioterapia antes de la cirugía definitiva, prevista para los pacientes con carcinoma urotelial de la vejiga con invasión muscular, con ganglios clínicamente negativos (cN0):
- 1.
La quimioterapia se realiza en el punto temporal más temprano, cuando se espera que la carga de la enfermedad micrometastásica sea baja.
- 2.
Potencial reflejo de quimiosensibilidad in vivo.
- 3.
La tolerabilidad de la quimioterapia y el cumplimiento del paciente se espera que sean mejor antes y no después de la cistectomía.
- 4.
Los pacientes pueden responder a la terapia neoadyuvante y revelar un estado patológico favorable, determinado principalmente por el logro pT0, un estado de los ganglios linfáticos negativos y márgenes quirúrgicos negativos.
- 5.
La cistectomía diferida podría comprometer el resultado en los pacientes no sensibles a la quimioterapia, aunque los estudios publicados sobre el efecto negativo del retraso en la práctica de la cistectomía, solo implican series de pacientes con quimioterapia previa
- 6.
No hay ensayos o grandes series de pacientes que indiquen que la cirugía tardía, debido a la quimioterapia neoadyuvante, tiene un impacto negativo en la supervivencia.
La quimioterapia neoadyuvante no parece afectar el resultado de la morbilidad quirúrgica, y no tiene ningún efecto negativo importante en el porcentaje de cistectomías realizables. En el análisis por intención de tratamiento, la frecuencia de la cistectomía fue del 86% en el grupo experimental y del 87% en el grupo control, mientras que el 71% de los pacientes recibieron todos 3 ciclos de quimioterapia (tabla 15).
- •
La cirugía reconstructiva debe ser considerada, si no se expone el paciente a un riesgo excesivo (edad y comorbilidades);
- •
No se recomienda cirugía reconstructiva en pacientes mayores de 80 años;
- •
La vejiga ortotópica puede ser considerada en casos de N1, pero no en N2 y N3;
- •
La sección congelada uretral tiene que ser realizada en la cistoprostatectomía justo debajo del verumontanum para los hombres y en los límites inferiores de la vejiga y el cuello para las mujeres;
- •
La estadificación clínica mediante la palpación bimanual, TC o RM puede a menudo resultar en infraestadificación y tienen una precisión solo del 70%. El tratamiento insuficiente es la posible consecuencia negativa.
Conclusiones y recomendaciones para la quimioterapia neoadyuvante
| Conclusión | NE |
|---|---|
| La quimioterapia de combinación con cisplatino neoadyuvante mejora la supervivencia global (5-8% a los 5 años) | 1a |
| El tratamiento neoadyuvante de respondedores y especialmente en los pacientes que muestran respuesta favorable completa (pT0 N0) tiene un impacto importante en la supervivencia | 2 |
| Actualmente no hay herramientas disponibles para seleccionar a los pacientes que tienen una mayor probabilidad de beneficiarse de la quimioterapia neoadyuvante. En el futuro, los marcadores genéticos, en un ambiente de la medicina personalizada, pueden facilitar la selección de los pacientes para la quimioterapia neoadyuvante y diferenciar los respondedores de los no respondedores |
NE: nivel de evidencia.
La cistectomía radical es el tratamiento estándar para MIBC localizada en la mayoría de los países occidentales. El reciente interés en los pacientes por la calidad de vida ha aumentado la tendencia hacia modalidades de tratamiento de preservación de la vejiga, como la radio- y/ o quimioterapia. El estado funcional y la edad influyen en la elección del tratamiento primario, así como en el tipo de derivación urinaria, reservándose la cistectomía para pacientes jóvenes, sin enfermedad concomitante y con un mejor estado funcional.
Existe gran controversia sobre la edad, la cistectomía radical y el tipo de derivación urinaria. La cistectomía se asocia con una reducción mayor del riesgo de muerte relacionada y no relacionada con la enfermedad en pacientes>80años de edad. El estudio más grande, retrospectivo, de una sola institución en cistectomía actualizada encontró que en los pacientes>80años había aumentado la morbilidad postoperatoria, pero no hubo aumento de la mortalidad.
Retraso en la cistectomíaEn una serie retrospectiva de 153 pacientes, con una clara indicación para la cirugía radical de vejiga por cáncer localmente avanzado, encontraron que los pacientes tratados durante más de 90 días después del diagnóstico primario mostraron un aumento significativo en enfermedad extravesical (81 vs. 52%). El retraso en la cistectomía afecta el resultado del tratamiento y el tipo de derivación urinaria (el retraso en la cistectomía se asocia más con derivaciones con conducto ileal).
Indicaciones de cistectomía- •
CVMI T2-T4a, N0-Nx, M0.
- •
Tumores de alto riesgo y los tumores superficiales recurrentes, BCG resistente Tis, T1G3.
- •
Enfermedad papilar tan extensa que no puede ser controlada con RTU y terapia intravesical sola.
- •
La cistectomía de rescate está indicada para los no respondedores a la terapia conservadora, la recurrencia después de tratamiento conservador de vejiga y carcinomas no uroteliales (estos tumores no responden bien a la quimio- y radioterapia).
- •
Una intervención puramente con paliativos, incluso en la formación de fístulas, para el dolor o hematuria visible recurrente (hematuria macroscópica).
Las complicaciones relacionadas con la cistectomía radical pueden estar directamente relacionadas con una comorbilidad preexistente, el procedimiento quirúrgico en sí, o por la anastomosis intestinal o derivación urinaria. La edad avanzada se ha identificado como un factor de riesgo para las complicaciones derivadas de la cistectomía radical, a pesar de que la edad cronológica es menos importante que la edad biológica. Otros factores de riesgo de morbilidad incluyen cirugía abdominal previa, enfermedad extravesical y radioterapia previa, mientras que un mayor índice de masa corporal se asocia con una mayor tasa de dehiscencia de la herida y hernia.
Evaluación de las comorbilidades. Más edad se asocia con mayor riesgo de mortalidad por otra causa, pero no con aumento de la muerte específica por cáncer, mientras que la etapa de tumor localmente avanzado fue el predictor más fuerte de disminución de la supervivencia específica del cáncer. La estratificación de los pacientes de edad avanzada de acuerdo a su perfil de riesgo-beneficio utilizando un enfoque multidisciplinario ayudará a seleccionar a los pacientes con más probabilidades de beneficiarse de la cirugía radical y optimizar los resultados del tratamiento. Desafortunadamente, la mayoría de las series que evalúan la cistectomía radical no incluyen índices de comorbilidad en la evaluación del paciente.
Escalas de comorbilidad. Una gama de escalas de comorbilidad se han desarrollado, 6 de las cuales han sido validadas. (NE: 3):
- •
Escala de valoración acumulativa de enfermedad (CIRS);
- •
Índice de Kaplan-Feinstein;
- •
Índice de comorbilidad de Charlson (CCI);
- •
Índice de enfermedades coexistentes (ICD);
- •
ACE-27;
- •
Índice de carga de enfermedad total (TIBI).
El CCI va de 0 a 30, de acuerdo con la importancia de la comorbilidad descrita en 4 niveles y es calculado por profesionales de la salud de las historias clínicas de los pacientes. En pacientes con CV resultó ser un factor pronóstico independiente de mortalidad perioperatoria, mortalidad general y mortalidad específica por cáncer. Solo la versión ajustada por edad del CCI se correlacionó con la mortalidad específica por cáncer y otras causas.
Interpretación:
- 1.
Calcular Charlson (calificación o índice)=i.
- a.
Añadir puntuación de comorbilidad de puntuación edad.
- b.
Total denotado como «i» en el cálculo de probabilidad de Charlson (ver más abajo). i=suma de puntuación de comorbilidad de puntuación de edad.
- a.
- 2.
Calcular Charlson probabilidad (de 10 años la mortalidad).
- a.
Calcular Y=10 (i× 0,9).
- b.
Calcular Z=0,983Y (donde Z es la supervivencia a 10 años) (tabla 16).
Tabla 16.Cálculo del índice de Charlson
Puntos Condición 1 50-60 años Infarto de miocardio
Insuficiencia cardíaca
Insuficiencia vascular periférica
Enfermedad cerebrovascularDemencia Enfermedad pulmonar crónica
Enfermedad del tejido conectivo
ÚlceraEnfermedad hepática leve
Diabetes2 61-70 años
HemiplejíaEnfermedad renal moderada a severa
La diabetes con daño de órganoLos tumores de cualquier origen 3 71-80 años Enfermedad hepática moderada a severa 4 81-90 años 5 >90 años 6 Tumor metastásico sólido Sida.
- a.
La evaluación del estado de salud de los pacientes oncológicos se debe complementar con la medición de su nivel de actividad. Extermann et al. han demostrado que no existe una correlación entre la morbilidad y el nivel de actividad competitiva (4). EL Eastern Cooperative Oncology Group (ECOG) marca el estado funcional y el índice de Karnofsky se ha validado para medir la actividad del paciente (NE: 3). El estado funcional se correlaciona con OS del paciente después de cistectomía radical y la quimioterapia paliativa.
La puntuación ASA ha sido validada para evaluar, antes de la cirugía, el riesgo de complicaciones postoperatorias. En el entorno del CV, las puntuaciones ASA>3 están asociadas con complicaciones mayores, en particular las relacionadas con el tipo de derivación urinaria (tabla 17).
Puntuación ASA
| 1. Sin enfermedad orgánica, o pacientes en los que el proceso patológico es localizado y no causa ninguna alteración sistémica o anormalidad |
| 2. Una alteración sistémica moderada pero definida, causada ya sea por la condición que se va a tratar o por la intervención quirúrgica, ya sea por otros procesos patológicos existentes |
| 3. Alteración sistémica grave de cualquier causa o causas. No es posible afirmar una medida absoluta de la gravedad, ya que esto es una cuestión de juicio clínico |
| 4. Trastornos sistémicos extremos que ya se han convertido en una amenaza inminente para la vida, sin importar el tipo de tratamiento. Debido a su duración o su naturaleza, ya ha habido daños en el organismo que son irreversible |
| 5. Pacientes moribundos los cuales no se espera que sobrevivan 24h, con o sin cirugía |
- •
En los hombres, la cistectomía radical estándar incluye la extirpación de la vejiga, la próstata, las vesículas seminales, uréter distal y los ganglios linfáticos regionales.
- •
En las mujeres, la cistectomía radical estándar incluye la extirpación de la vejiga, toda la uretra y la vagina adyacente, el útero, uréter distal y los ganglios linfáticos regionales.
- •
La extensión de la linfadenectomía no ha sido establecida.
- •
Hay un beneficio terapéutico en la linfadenectomía extendida (estándar vs. limitada).
- •
La cistectomía laparoscópica+linfadenectomía todavía se considera un procedimiento experimental debido al poco número de casos.
- •
La cistectomía laparoscópica con o sin robot con linfadenectomía solo debe ser realizada en centros con experiencia.
Desde un punto de vista anatómico, en la actualidad se utilizan 3 alternativas después de la cistectomía:
- •
Desvío abdominal, tal como una ureterocutaneostomía, conducto ileal o conducto de colon, y diversas formas de una bolsa continente.
- •
Desviación uretral, que incluye diversas formas de bolsas gastrointestinales unidas a la uretra, derivaciones ortotópicas urinarias (neovejiga, sustitución vesical ortotópica).
- •
Desvíos rectosigmoideos, como uretero-(ileo) rectostomía.
Para cistectomía, los preparativos generales son necesarios como para cualquier otro tipo de cirugía pélvica y abdominal mayor. Si la derivación urinaria se construye a partir de segmentos gastrointestinales, se deben considerar la longitud o el tamaño de los segmentos respectivos y su fisiopatología cuando la orina se almacena.
A pesar de la interrupción necesaria y reanastomosis del intestino, una preparación intestinal formal puede no ser necesaria. Además, la recuperación del intestino se ha reducido por el uso de la movilización temprana, oralización temprana, y la estimulación gastrointestinal con la metoclopramida y la goma de mascar.
Los pacientes sometidos a derivación urinaria continente deben estar motivados tanto para aprender acerca de su desviación como para ser hábiles manualmente en la manipulación de su desvío. Las contraindicaciones para formas más complejas de derivación urinaria incluyen:
- •
Enfermedades neurológicas y enfermedades psiquiátricas debilitantes.
- •
La esperanza de vida limitada.
- •
Insuficiencia hepática o renal.
- •
Carcinoma de células transicionales con margen uretral u otros márgenes quirúrgicos.
La cistectomía radical y la derivación urinaria son las 2 etapas de una operación. Sin embargo, la literatura reporta uniformemente las complicaciones de la cistectomía radical, sin tener en cuenta el hecho de que la mayoría de las complicaciones están relacionadas con la derivación urinaria. La edad, por sí sola, no es un criterio para ofrecer derivación continente, La comorbilidad, función cardíaca y pulmonar, y la función cognitiva son factores importantes que deben ser considerados, junto con el apoyo social del paciente y las preferencias del mismo.
Ureterostomía cutáneaEs una derivación urinaria simple. Debido al diámetro más pequeño de los uréteres, la estenosis del estoma se ha observado con más frecuencia que con estomas intestinales.
En una comparación retrospectiva reciente con una mediana de seguimiento de 16 meses, la tasa de complicaciones relacionadas con la ureterostomía cutánea fue considerablemente menor, en comparación con conducto ileal y una vejiga ortotópica. Hay que tener en cuenta que la complicación más frecuente es la estenosis del uréter a nivel de piel y la IVU. En un estudio retrospectivo comparando diversas formas de derivación intestinal, los conductos ileales tuvieron menos complicaciones tardías que las bolsas abdominales.
Conductos ilealesEl conducto ileal es todavía una opción establecida con resultados conocidos/predecibles. Sin embargo, hasta un 48% de los pacientes desarrollan complicaciones tempranas, incluyendo infecciones del tracto urinario, pielonefritis, fugas ureteroileales y estenosis. Las principales complicaciones en los estudios de seguimiento a largo plazo son las complicaciones del estoma en hasta un 24% de los casos y los cambios funcionales y/ o morfológicas del tracto urinario superior en hasta un 30%. Un aumento de las complicaciones se vio en la serie de Berna de 131 pacientes seguidos durante un mínimo de 5 años (mediana de seguimiento de 98 meses); la tasa de complicaciones aumentó de un 45% a los 5 años a un 94% en los que sobreviven más de 15 años. En este último grupo, el 50% de los pacientes desarrollaron cambios en el tracto urinario superior y el 38% desarrolló litiasis.
Neovejigas ortotópicasHoy en día la sustitución vesical ortotópica a la uretra se utiliza tanto en hombres como en mujeres. Informes previos documentan la seguridad y la fiabilidad a largo plazo de este procedimiento. En varios centros grandes, esto se ha convertido en la elección para la mayoría de los pacientes sometidos a cistectomía. En los pacientes de edad avanzada (>80 años), sin embargo, rara vez se lleva a cabo, incluso en los centros de experiencia de alto volumen. El íleon terminal es el segmento gastrointestinal más frecuente para sustitución vesical, hay menos experiencia con el colon ascendente, incluyendo el ciego, y la sigmoide. El vaciado del reservorio anastomosado a la uretra requiere esfuerzo abdominal, el peristaltismo intestinal y la relajación del esfínter.
Las complicaciones a largo plazo incluyen incontinencia diurna (8-10%) y nocturna (20-30%), estrechez ureterointestinal (3-18%), trastornos metabólicos y deficiencia de vitamina B12. En un estudio reciente que comparó el control del cáncer y los patrones de recurrencia de la enfermedad en pacientes con neovejiga y conducto ileal, no hubo diferencia en la supervivencia específica por cáncer entre los 2 grupos al ajustar por estadio patológico. Las recurrencias uretrales en la neovejiga son raras (1,5-7%).
En conclusión, la cistectomía radical estándar en pacientes varones con tumores de vejiga incluye la eliminación de toda la vejiga, próstata, vesículas seminales, uretra distal (longitud del segmento no definido), y la correspondiente de ganglios linfáticos (extensión no definida) (NE: 2b). Actualmente, no es posible recomendar un tipo particular de derivación urinaria. Sin embargo, la mayoría de las instituciones prefiere sustitución vesical ileal y conductos ileales, basados en la experiencia clínica.
MorbimortalidadEn 2 estudios a largo plazo, y un estudio de cohorte de base poblacional, la mortalidad perioperatoria fue reportada como del 1,2-3% a los 30 días y del 2,3-5,7% a los 90 días. Las complicaciones tempranas (dentro de los 3 meses desde la cirugía) se observaron en el 58% de los pacientes. La morbilidad tardía puede ser debida al tipo de derivación urinaria. La morbilidad precoz asociada a la cistectomía radical para CVNMI (con alto riesgo de progresión de la enfermedad) es similar y no menor que la asociada con tumores músculo-invasivos.
SupervivenciaLa supervivencia libre de recidiva a los 5 años es del 58% y la supervivencia específica por cáncer fue del 66% en series antiguas y recientes.
Sin embargo, en pacientes con un bajo nivel de metástasis en los ganglios linfáticos, la supervivencia es mejor.
Tumores no resecablesLa cistectomía radical primaria en el CV T4b no es una opción curativa.
Las indicaciones de cistectomía paliativa son síntomas graves, irritación miccional, dolor severo y hematuria que requiere transfusiones. El estudio reportó un mayor riesgo de morbimortalidad perioperatoria en los ancianos, especialmente en aquellos con enfermedades pélvicas malignas muy avanzadas, que habían sido sometidos a cistectomía paliativa (tabla 18).
Formas intestinales o extraintestinales de derivación urinaria pueden utilizarse con o sin cistectomía paliativa (obstrucción ureteral)
| Recomendaciones | GR |
|---|---|
| En los pacientes con tumores inoperables localmente avanzado (T4b), la cistectomía radical primaria es una opción paliativa y no puede ser ofrecida como tratamiento curativo | B |
| Antes de cualquier otra intervención, la morbilidad y la calidad de vida relacionada con la cirugía deben ser plenamente discutidas con el paciente | B |
GR: grado de recomendación.
- •
La radioterapia preoperatoria no está recomendada y no mejora la supervivencia. (GR: A)
- •
La radioterapia también se puede utilizar para detener el sangrado del tumor cuando el control local no puede lograrse mediante la manipulación transuretral debido al crecimiento local extenso. (GR: B)
- •
La radioterapia sola es menos eficaz que la cirugía y solo se recomienda como una opción terapéutica cuando el paciente no es apto para la cistectomía o cuando el tratamiento escogido es preservador de vejiga en un enfoque multimodal. (GR: B)
- •
La quimioterapia sola no se recomienda como tratamiento primario del CVMI. (GR:A)
- •
Quimioterapia adyuvante combinada basada en cisplatino se puede ofrecer a los pacientes con enfermedad pN + si no se ha dado la quimioterapia neoadyuvante. (GR: C)
- •
La quimioterapia adyuvante se debe administrar solamente dentro de los ensayos clínicos, siempre que sea posible. No hay evidencia que la apoye. (NE: 1a, GR: A)
Aproximadamente el 30% de los pacientes con cáncer urotelial se presentan con enfermedad músculo-invasiva, y aproximadamente la mitad recae después de la cistectomía radical. La recidiva local representa el ∼30% de las recaídas, mientras que las metástasis a distancia son más comunes. Del 10-15% de los pacientes tienen al momento del diagnóstico enfermedad metastásica (tablas 19 y 20).
Conclusiones para enfermedad metastásica
| Conclusiones | NE |
|---|---|
| El estado de rendimiento general (ECOG) y la presencia o ausencia de metástasis viscerales son factores pronósticos independientes de supervivencia | 1b |
| Los factores pronósticos negativos son: las metástasis hepáticas, ECOG>1 y hemoglobina baja (<10g/dl) | 1b |
| La quimioterapia a base de cisplatino puede lograr una supervivencia media de hasta 14 meses, con una supervivencia libre de enfermedad a largo plazo reportada en ∼15% de los pacientes con enfermedad ganglionar y buen rendimiento general (ECOG) | 1b |
| La quimioterapia de un solo agente ofrece bajas tasas de respuesta y generalmente de corta duración | 2a |
| La quimioterapia de combinación con carboplatino es menos eficaz que la quimioterapia basada en cisplatino, en términos de respuesta completa y supervivencia | 2a |
| La quimioterapia combinada sin platino produce respuestas sustanciales en los ajustes de primera y de segunda línea, pero no ha sido probado contra la quimioterapia estándar en pacientes que son aptos o no aptos para la quimioterapia de combinación con cisplatino | 2a |
| No existe una quimioterapia estándar definida para los pacientes no aptos con cáncer urotelial avanzado o metastásico | 2b |
| Vinflunina alcanza el mayor nivel de evidencia reportado como terapia de segunda línea | 1b |
| La cirugía después de la quimioterapia tras de la respuesta parcial o completa puede contribuir a la supervivencia libre de enfermedad a largo plazo | 3 |
| El ácido zoledrónico y denosumab han sido aprobados para todos los tipos de cáncer, incluyendo el cáncer urotelial, porque reducen y retrasan eventos esqueléticos relacionados en la enfermedad ósea metastásica | 1b |
ECOG: Eastern Cooperative Oncology Group; NE: nivel de evidencia.
Recomendaciones para enfermedad metastásica
| Recomendaciones | GR |
|---|---|
| Primera línea para pacientes elegibles | |
| Use quimioterapia que contenga cisplatino, como gemcitabina/cisplatino), paclitaxel/gemcitabina/cisplatino), metotrexate/vinblastina/adriamicina y cisplatino, preferiblemente con factor estimulante de colonias de granulocitos, o intensidad de alta dosis de metotrexate/vinblastina/adriamicina y cisplatino, con factor estimulante de colonias de granulocitos | A |
| No se recomienda el carboplatino y la quimioterapia combinada sin platino | B |
| Primera línea de tratamiento en pacientes no elegibles para cisplatino | |
| Utilice la quimioterapia de combinación con carboplatino o agentes individuales | C |
| En pacientes no elegibles con mal estado general ECOG>2 o insuficiencia renal, así como aquellos con ninguno o un factor de mal pronóstico, el tratamiento con quimioterapia de combinación con carboplatino, preferiblemente con gemcitabina/carboplatino está indicado | A |
| Segunda línea de tratamiento | |
| En pacientes que están progresando después de la quimioterapia de combinación basada en platino, para la enfermedad metastásica, debe ofrecerse vinflunina. Alternativamente, se puede ofrecer ingresar a un ensayo clínico | A |
| El ácido zoledrónico o denosumab se recomienda para el tratamiento de las metástasis óseas | B |
ECOG: Eastern Cooperative Oncology Group; GR: grado de recomendación.
Un protocolo de seguimiento de la enfermedad se debe basar en:
- •
Tiempo natural de la recurrencia;
- •
Probabilidad de recurrencia de la enfermedad y el sitio de recidiva;
- •
Monitorización funcional después derivación urinaria;
- •
Posibilidades de tratamiento de una recurrencia.
La recidiva local se puede considerar una recurrencia en los tejidos blandos en el sitio o en los ganglios linfáticos quirúrgicos originales en el área de la LND. El compromiso de los ganglios linfáticos por encima de la bifurcación aórtica puede considerarse recidiva metastásica. En las series de cistectomía contemporáneas se ha demostrado un 15,5% de probabilidad de recurrencia pélvica. La mayoría de las recurrencias se manifiestan durante los primeros 24 meses, a menudo dentro de los 6-18 meses después de la cirugía. Sin embargo, las recurrencias tardías se han producido hasta 5 años después de la cistectomía. El estado patológico de los nodos linfáticos fueron factor predictivo de recurrencia pélvica, así como bordes positivos, extensión de la enfermedad nodal y el uso de quimioterapia perioperatoria.
Los pacientes tienen un mal pronóstico después de la recurrencia pélvica. Incluso con tratamiento, la supervivencia media oscila entre 4-8 meses después del diagnóstico.
Una terapia definitiva a veces puede proporcionar una supervivencia prolongada, pero en la mayoría de los casos aporta paliación significativa de los síntomas. El tratamiento consiste en quimioterapia sistémica, la cirugía local o la radioterapia.
Hasta en el 50% de los pacientes tratados con cistectomía se ven recurrencias distantes. Nuevamente los factores de riesgo son pTN y pN. La recurrencia sistémica es más común en la enfermedad localmente avanzada (pT3-pT4), que va del 32-62% y en los pacientes con afectación ganglionar (rango 52-70%). Los sitios más probables para las recurrencias a distancia son los ganglios linfáticos, los pulmones, el hígado y los huesos. En cerca del 90%, las recurrencias aparecerán a distancia en los primeros 3 años de la cistectomía radical y sobre todo en los primeros 24 meses; a pesar de todo, se han descrito recidivas tardías, después de más de 10 años. La mediana de supervivencia de los pacientes con enfermedad progresiva tratados con rangos de quimioterapia a base de platino se sitúa entre los 9 y los 26 meses. A pesar de la supervisión periódica, más de la mitad de las metástasis se diagnostican después de la aparición de los síntomas (tabla 21).
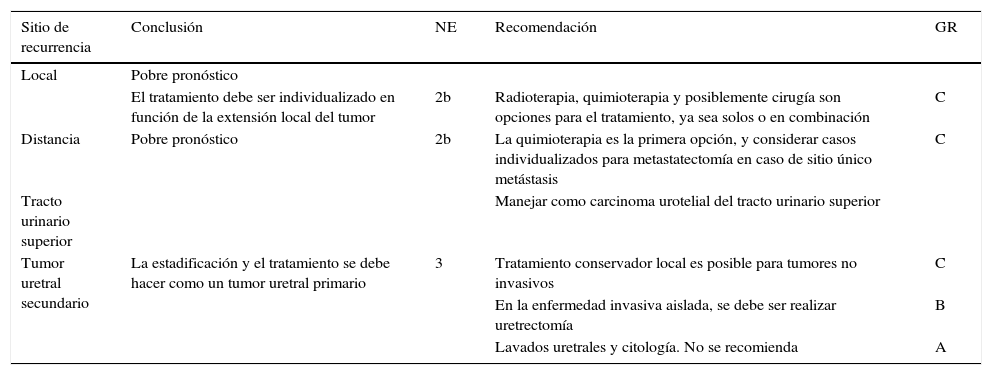
Conclusiones y recomendaciones para sitios específicos de recurrencia
| Sitio de recurrencia | Conclusión | NE | Recomendación | GR |
|---|---|---|---|---|
| Local | Pobre pronóstico | |||
| El tratamiento debe ser individualizado en función de la extensión local del tumor | 2b | Radioterapia, quimioterapia y posiblemente cirugía son opciones para el tratamiento, ya sea solos o en combinación | C | |
| Distancia | Pobre pronóstico | 2b | La quimioterapia es la primera opción, y considerar casos individualizados para metastatectomía en caso de sitio único metástasis | C |
| Tracto urinario superior | Manejar como carcinoma urotelial del tracto urinario superior | |||
| Tumor uretral secundario | La estadificación y el tratamiento se debe hacer como un tumor uretral primario | 3 | Tratamiento conservador local es posible para tumores no invasivos | C |
| En la enfermedad invasiva aislada, se debe ser realizar uretrectomía | B | |||
| Lavados uretrales y citología. No se recomienda | A |
GR: grado de recomendación; NE: nivel de evidencia.
Estas guías no serían posibles de no ser por la entrega de los profesionales urólogos adjuntos al comité editorial y científico de la Sociedad Colombiana de Urología, y a los médicos -residentes de urología del Hospital Militar Central quienes participaron de la elaboración de este documento.