Se han desarrollado múltiples herramientas que buscan predecir el riesgo de encontrar cáncer en pacientes con indicación de biopsia prostática. Diversos modelos predictivos conocidos como nomogramas han sido propuestos. Uno de los más importantes es el Prostate Cancer Prevention Trial Risk Calculator (PCPTRC), calculadora de riesgo que permite predecir la probabilidad de encontrar cáncer de próstata y enfermedad de alto grado. No obstante, esta herramienta carece de validación en cohortes con características heterogéneas. Este estudio realiza una validación externa del PCPTRC en una cohorte colombiana y determina su utilidad.
Materiales y métodosSe realizó un estudio de corte transversal, involucrando una muestra de 410 pacientes que fueron llevados a biopsia de próstata, entre enero de 2008 y abril de 2013, en la Clínica Universitaria Colombia. Se valoraron las características operativas, las curvas de calibración, las pruebas de bondad de ajuste, y se creó un análisis de decisión para el calculador de riesgo. Estos valores se compararon con los resultados obtenidos al utilizar el antígeno prostático específico (PSA).
ResultadosSe encontró una prevalencia del 33% de cáncer de próstata y un PSA medio de 17ng/ml. EL PCPTRC alcanzó una precisión de 0,55 para diagnóstico de cáncer y de 0,63 para alto grado. La calibración del modelo mostró sobrevaloración general. Los análisis de decisión limitan la utilidad del PCPTRC a valores entre el 30 y el 50%, pero su aplicación no aumentó el beneficio en selección de biopsiado respecto al uso del PSA. El análisis multivariado mostró pobre aplicabilidad del PCPTRC en la cohorte.
ConclusionesEl uso del PCPTRC en el diagnóstico de cáncer de próstata tiene utilidad marginal e inferior a otras ayudas diagnósticas como el PSA. Debe realizarse una adecuada validación externa de cada nomograma, en forma previa a su implementación clínica.
Numerous tools aimed at predicting the risk of finding cancer in patients with an indication for a prostate biopsy have been developed, and a variety of predictive models known as nomograms have been proposed. One of the most important models is the Prostate Cancer Prevention Trial Risk Calculator (PCPTRC), a risk calculator that predicts the probability of finding prostate cancer and high-grade disease. However, this tool lacks validation in cohorts with heterogeneous characteristics. This study performs an external validation of PCPTRC in a Colombian cohort and assesses its performance.
Materials and methodsA cross sectional study was performed on a sample of 410 patients with suspicion of prostate cancer, who underwent prostate biopsy, between January 2008 and April 2013, at the Clínica Universitaria Colombia. An evaluation was carried out on the operating characteristics, calibration curves, goodness of fit test, and a decision analysis for the risk calculator was created. These values were compared with the results obtained using the prostate specific antigen (PSA) test.
ResultsA prevalence of 33% of prostate cancer and a medium PSA of 17ng/mL was found. The PCPTRC obtained a precision of 0.55 for cancer diagnosis and 0.63 for high-grade disease. The calibration of the model showed a general over-estimation. The decision analysis limited the usefulness of the PCPTRC to values between 30% and 50%, but its application did not increase the benefit of selecting for biopsies compared to the use of PSA. Multivariate analysis showed poor applicability of the PCPTRC in this cohort.
ConclusionsThe use of PCPTRC for the diagnosis of prostate cancer in our cohort has shown to be of marginal use, and is lower than other diagnostic tools, such as PSA. There should be an adequate external validation of each nomogram, prior to clinical implementation.
El cáncer de próstata constituye la mayor incidencia de cáncer en Colombia, siendo la segunda causa de mortalidad en la población masculina (14% de las muertes por cáncer en hombres)1,2. Se estima una incidencia de aproximadamente 8.000 casos y 2.400 muertes por año3. El riesgo de padecerlo a lo largo de la vida es del 17%, y el riesgo de mortalidad, del 3%3,4.
Actualmente se realizan múltiples esfuerzos dirigidos a establecer el riesgo individual de diagnosticar cáncer de próstata. En las últimas décadas hemos contado con el antígeno prostático específico (PSA) como factor predictor; sin embargo, estudios como el Prostate Cancer Prevention Trial (PCPT) han hecho evidente la existencia de otras variables, como la raza, la edad, la historia familiar, el tacto rectal y la historia de biopsia, que influyen en el diagnóstico4-6.
El Prostate Cancer Prevention Trial Risk Calculator (PCPTRC) para cáncer de próstata es un modelo predictivo que ha permitido realizar una valoración individualizada del riesgo de tener cáncer de próstata y el riesgo de tener enfermedad de alto grado en hombres que son llevados a biopsia de próstata. Este modelo fue desarrollado a partir del grupo placebo del PCPT7. La calculadora de riesgo se encuentra disponible online y es de fácil aplicación, convirtiéndola en una de las más utilizadas en nuestro medio5.
Este modelo ha sido evaluado en diferentes cohortes con distintos resultados, permitiendo señalar que el PCPTRC puede mostrarse impreciso al ser aplicado en cohortes con características disímiles a las de la cohorte donde fue desarrollado6–8. Este estudio busca evaluar la validez externa del PCPTRC con una cohorte colombiana y determinar su utilidad clínica en el diagnóstico inicial de cáncer de próstata.
Materiales y métodosSe diseñó un estudio de tipo corte transversal, con inicio temporal en enero de 2008 y terminación en abril de 2013.
Se seleccionaron los pacientes con las siguientes características: hombres mayores de 55años, vinculados al programa de cribado por oportunidad de la Organización Sanitas Internacional - Bogotá, en quienes se realizó por primera vez una biopsia de próstata bajo técnica transrectal, con 12 cores, ecodirigida, reporte de patología en escala de Gleason para valor y score. Dicha biopsia fue indicada por el médico tratante, según guías de manejo por elevación del PSA y/o anomalías en el examen rectal. Se excluyeron los pacientes con antecedente de biopsia de próstata previa, pacientes sometidos a procedimientos que involucren la próstata en un intervalo menor a un mes de la toma del PSA, y procesos infecciosos demostrados al momento de la toma de la biopsia.
Las variables evaluadas fueron: PSA medido en sangre, por el laboratorio central de la Organización Sanitas Internacional, resultado del examen rectal del médico tratante, antecedente de cáncer de próstata en la familia y/o uso de 5alfareductasa.
A la población seleccionada se le aplicó el calculador de riesgo como prueba diagnóstica, comparando con el PSA y el tacto rectal como pruebas diagnósticas iniciales. El patrón de referencia lo constituyó el reporte de patología obtenido con la biopsia (inicial).
La variable de desenlace correspondió al diagnóstico histológico del adenocarcinoma prostático y su grado de diferenciación, donde se definieron como mal diferenciados los tumores con Gleason score igual o superior a 8.
Se realizó una descripción general de la población incluida, y posteriormente se realizaron análisis bivariados comparando las variables descritas en presencia o no de cáncer y según el grado de diferenciación. Para el contraste de hipótesis se utilizaron la prueba de Wilcoxon con variables numéricas, y para las variables categóricas la prueba chi cuadrado. Se desarrolló un modelo de análisis multivariado por medio de una regresión logística incluyendo las variables da la calculadora de riesgo. Se evaluaron entonces las características operativas del modelo de la calculadora de riesgo y pruebas de bondad de ajuste junto con las del PSA y del tacto rectal.
Los resultados de la realización del PSA y de la aplicación de la calculadora de riesgo fueron utilizados para la construcción de las curvas ROC, donde se calculó el área bajo la curva de cada una de las pruebas y se compararon para estimar la capacidad de discriminación del calculador de riesgo. Los valores obtenidos con la aplicación de la calculadora de riesgo fueron utilizados para la realización de un análisis de calibración entre la aplicación del modelo y los valores observados de la presencia del adenocarcinoma en la muestra. Finalmente se realizó un análisis de decisión, que permitió calcular el beneficio neto de la aplicación del modelo de estudio.
El análisis estadístico se realizó con el programa estadístico STATA versión 12.
ResultadosSe incluyeron 405 pacientes en la muestra. Los casos se obtuvieron a través de una estrategia de muestreo aleatorizado, estratificado, teniendo como referencia el año de realización de la biopsia. En forma aleatoria se seleccionaron los casos entre los años 2008 a 2011, que cumplieron criterios descritos hasta completar la muestra.
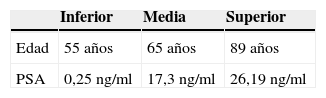
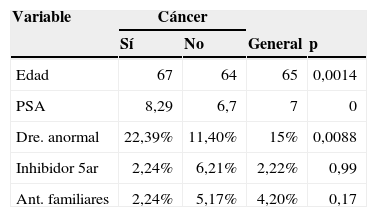
Como se observa en la tabla 1, se encontró una edad media de 65años, y dadas las características de nuestra población, el predominio de la raza fue la hispánica (99%).
Descripción general de la muestra
| Inferior | Media | Superior | |
|---|---|---|---|
| Edad | 55 años | 65 años | 89 años |
| PSA | 0,25 ng/ml | 17,3 ng/ml | 26,19 ng/ml |
| Presente | Ausente | |
|---|---|---|
| Antecedente CaP | 17 (4,19%) | 388 (95,8%) |
| Hispano | Afrocolombiano | |
|---|---|---|
| Raza | 404 (99%) | 1 (1%) |
| Normal | Anormal | |
|---|---|---|
| Tacto rectal | 338 (83,4%) | 61 (15%) |
| Sí | No | |
|---|---|---|
| CaP | 134 (33%) | 271 (67%) |
| Utiliza | No utiliza | |
|---|---|---|
| 5 alfa reductasa | 9 (2,2%) | 396 (97,8%) |
| 6 | 7 | 8-10 | |
|---|---|---|---|
| Gleason Score | 80% | 8% | 12% |
No es frecuente el antecedente familiar de cáncer de próstata entre la muestra seleccionada (4% de los casos). La descripción de la presencia de hallazgos anormales al examen rectal fue del 15%. Tampoco es frecuente el uso de inhibidores de 5 alfa reductasa, siendo del 2,2%.
El PSA presentó un rango intercuartílico que se ubicó entre los valores de PSA de 5,29 y 10,3ng/ml. Solo el 1% tuvo valores inferiores a 2,5ng/ml. El 90% de los casos tenían un PSA con valor inferior a 20ng/ml.
Un total de 134 pacientes presentaron adenocarcinoma de próstata, correspondiente con una prevalencia global del 33%.
En el análisis bivariado se valoró la distribución de las variables independientes respecto a la presencia de adenocarcinoma y al grado de diferenciación. Las variables de la raza, antecedentes familiares y antecedente de uso de inhibidores de 5 alfa reductasa de acuerdo al adenocarcinoma no muestran una diferencia significativa.
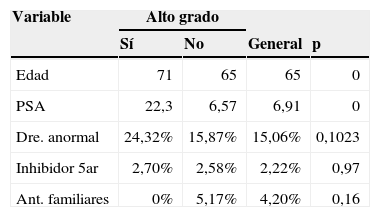
Para el caso del diagnóstico del alto grado tumoral, las variables del examen rectal, el uso de inhibidor de 5 alfa reductasa y los antecedentes familiares no muestran una diferencia estadísticamente significativa.
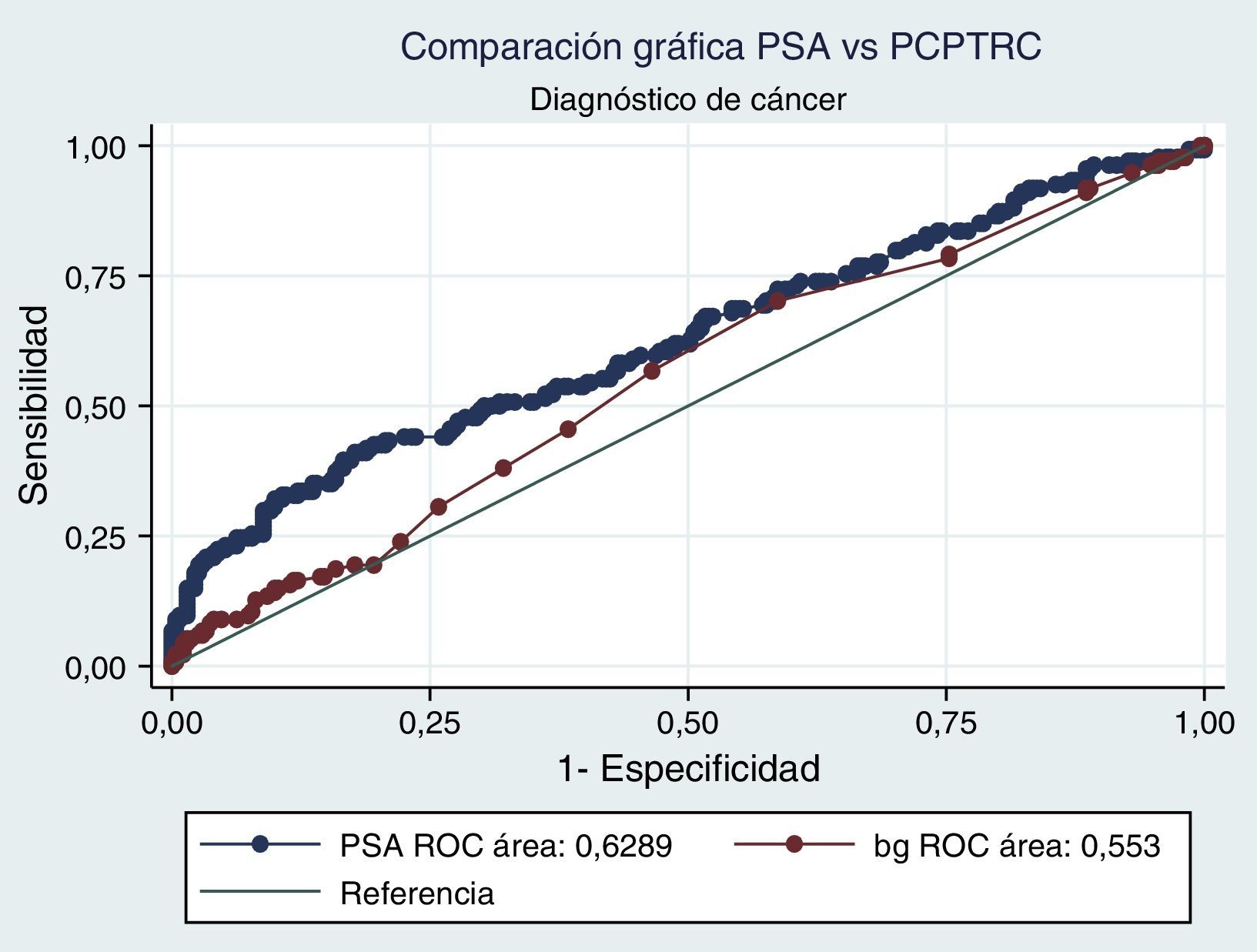
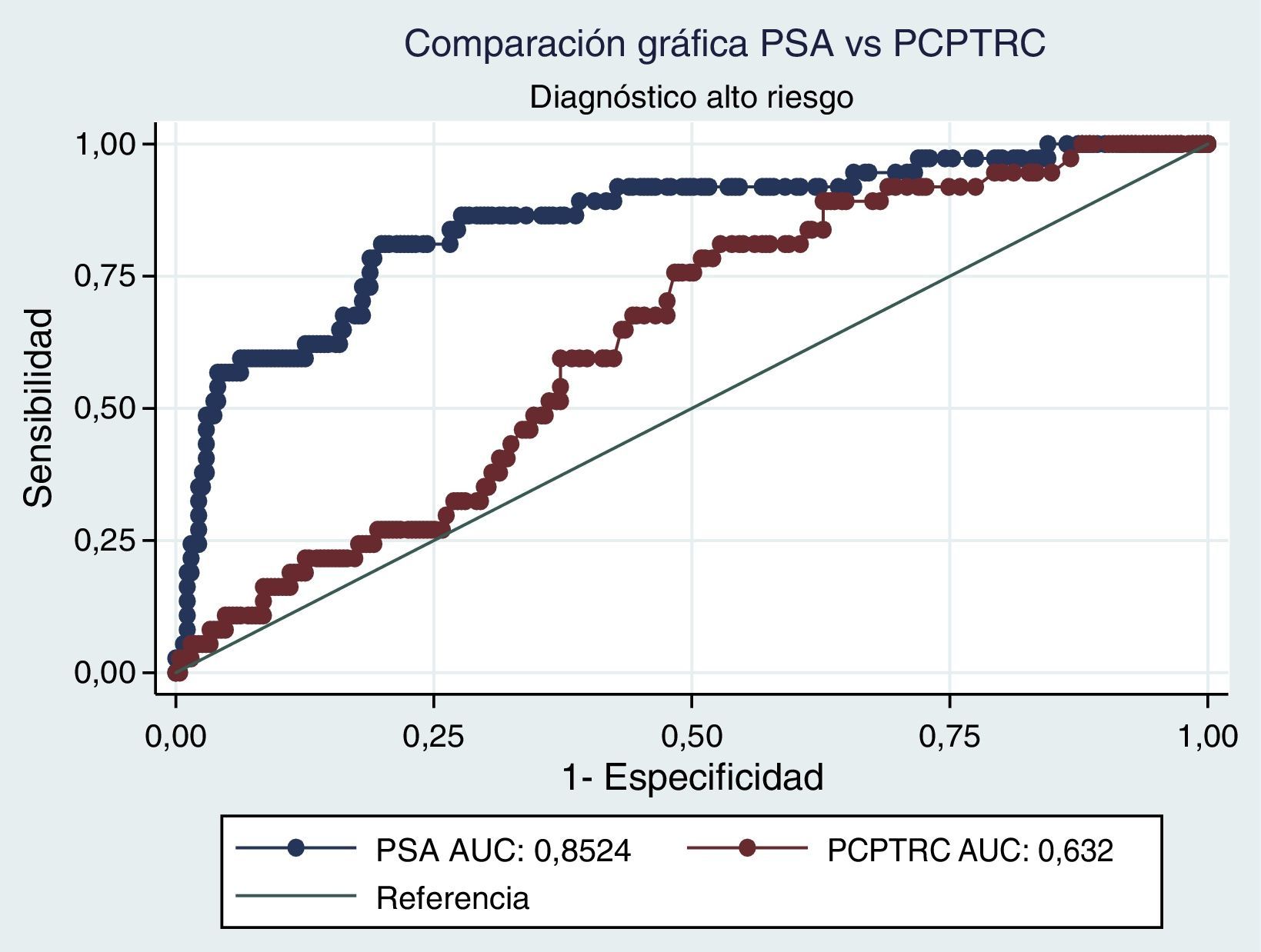
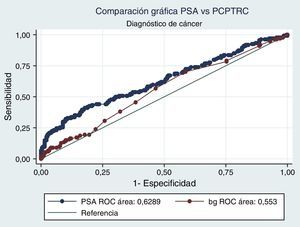
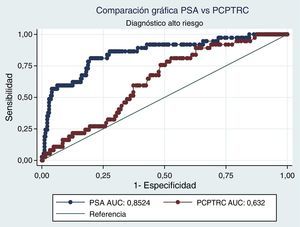
Al realizar el análisis AUC para PCPTRC se encontró un valor de 0,55 para diagnóstico de cáncer y de 0,63 para el grado. Al comparar con los análisis AUC para PSA, estos fueron de 0,62 y 0,85, respectivamente. Diferencias estadísticamente significativas en el alto grado, mas no en cáncer (figs. 1 y 2).
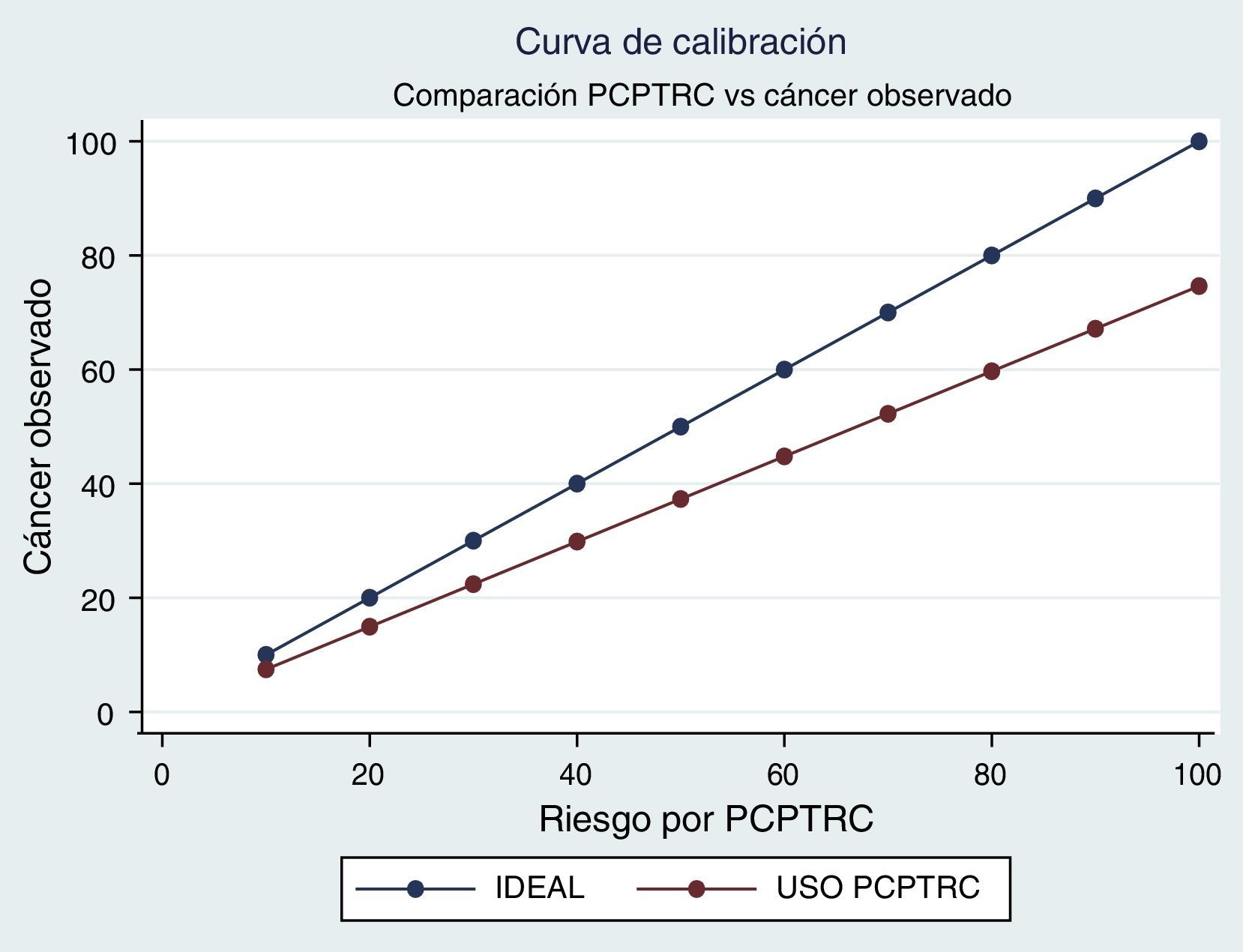
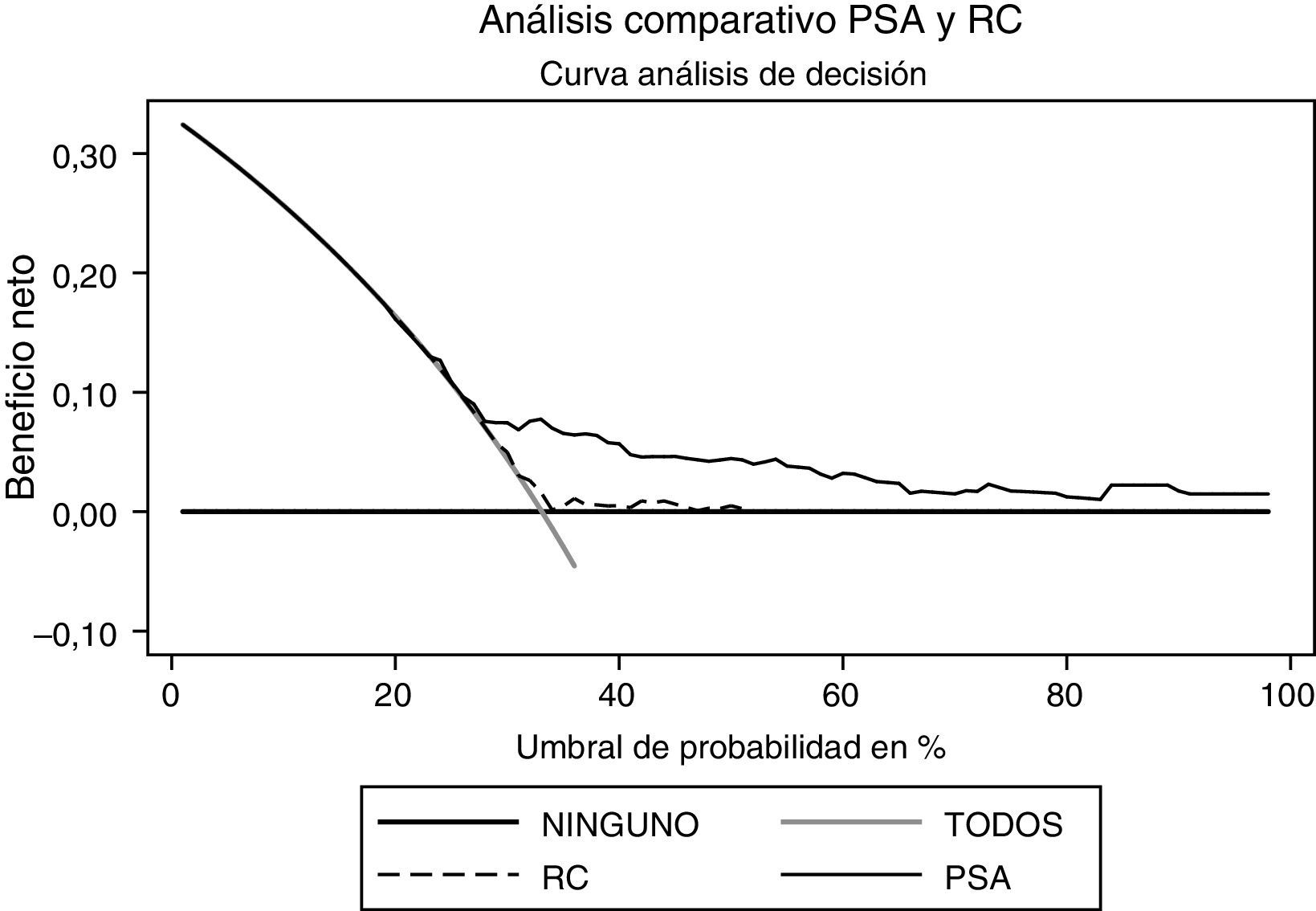
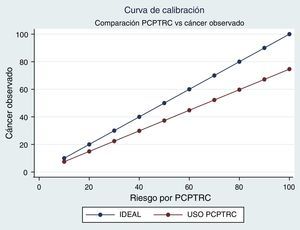
Teniendo como referencia el análisis de calibración del modelo, el PCPTRC muestra sobrevaloración general. De esta manera los valores obtenidos con el calculador siempre son superiores a los esperados en la población. En otras palabras, en esta muestra el uso del calculador sobrevaloró el riesgo diagnóstico y puede llevar a realizar biopsias que no serían necesarias (fig. 3).
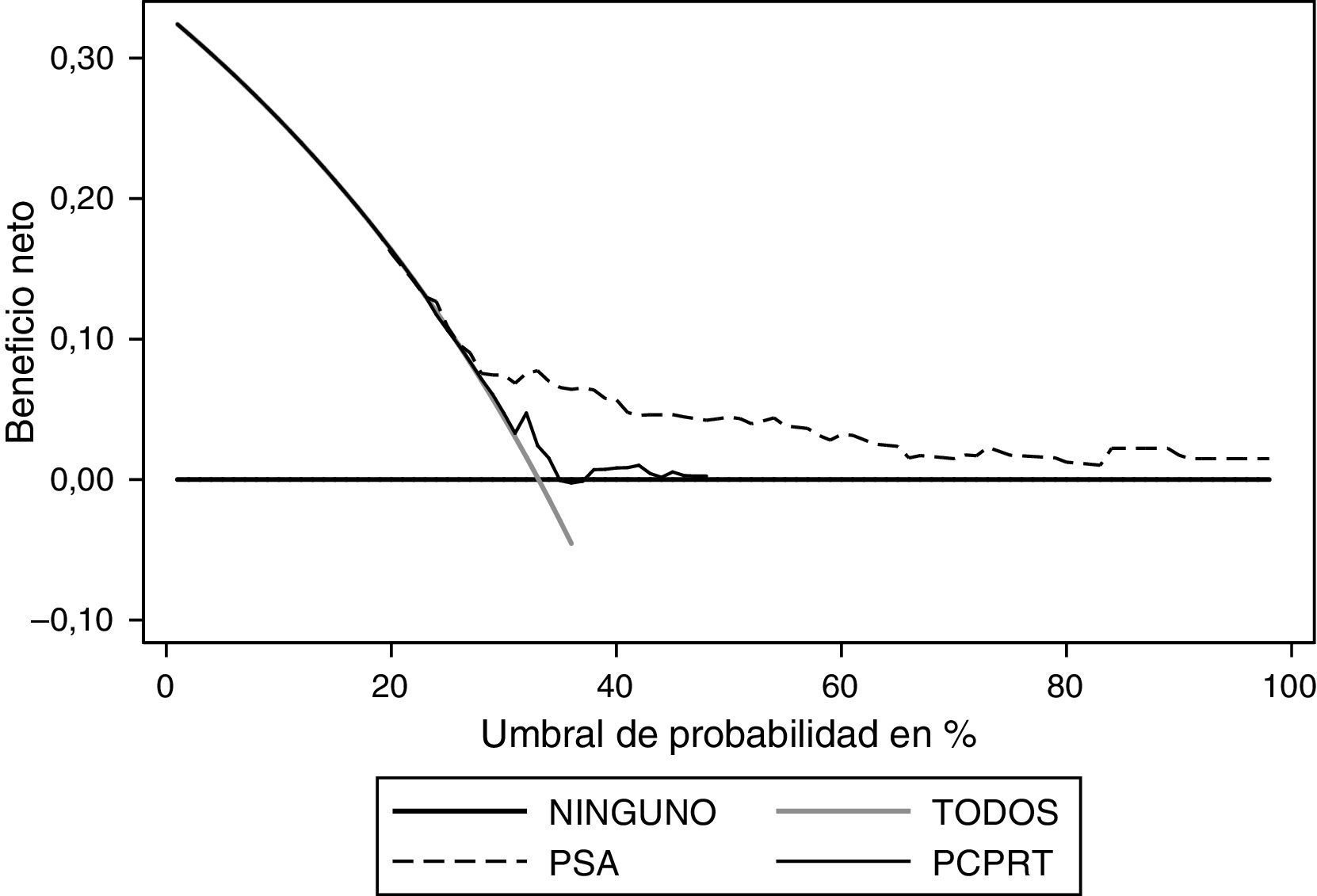
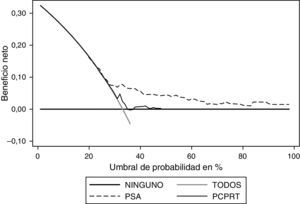
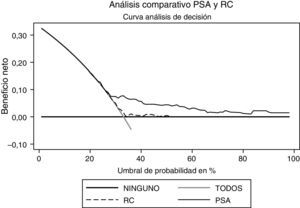
Al realizar el análisis de decisión se observa que el PSA ofrece un beneficio mayor al ser comparado con el modelo (fig. 4). Al realizar el análisis en el modelo con probabilidad entre el 30 y el 50% se observa el mayor beneficio del mismo; sin embargo, el PSA se mantiene como la variable con mayor beneficio. Respecto al grado, el PSA es la variable que ofrece mayor beneficio (fig. 5).
Se realizó una comparación entre el modelo y el PSA para la predicción de adenocarcinoma en el análisis multivariado, observando un mejor desempeño al tener en cuenta el PSA como única variable en nuestra población. Se realizaron pruebas de Hosmer Lemeshow para valorar el ajuste del modelo, con valores de p=0,19 en el caso del diagnóstico de adenocarcinoma, equívoca por la distribución de los cuartiles.
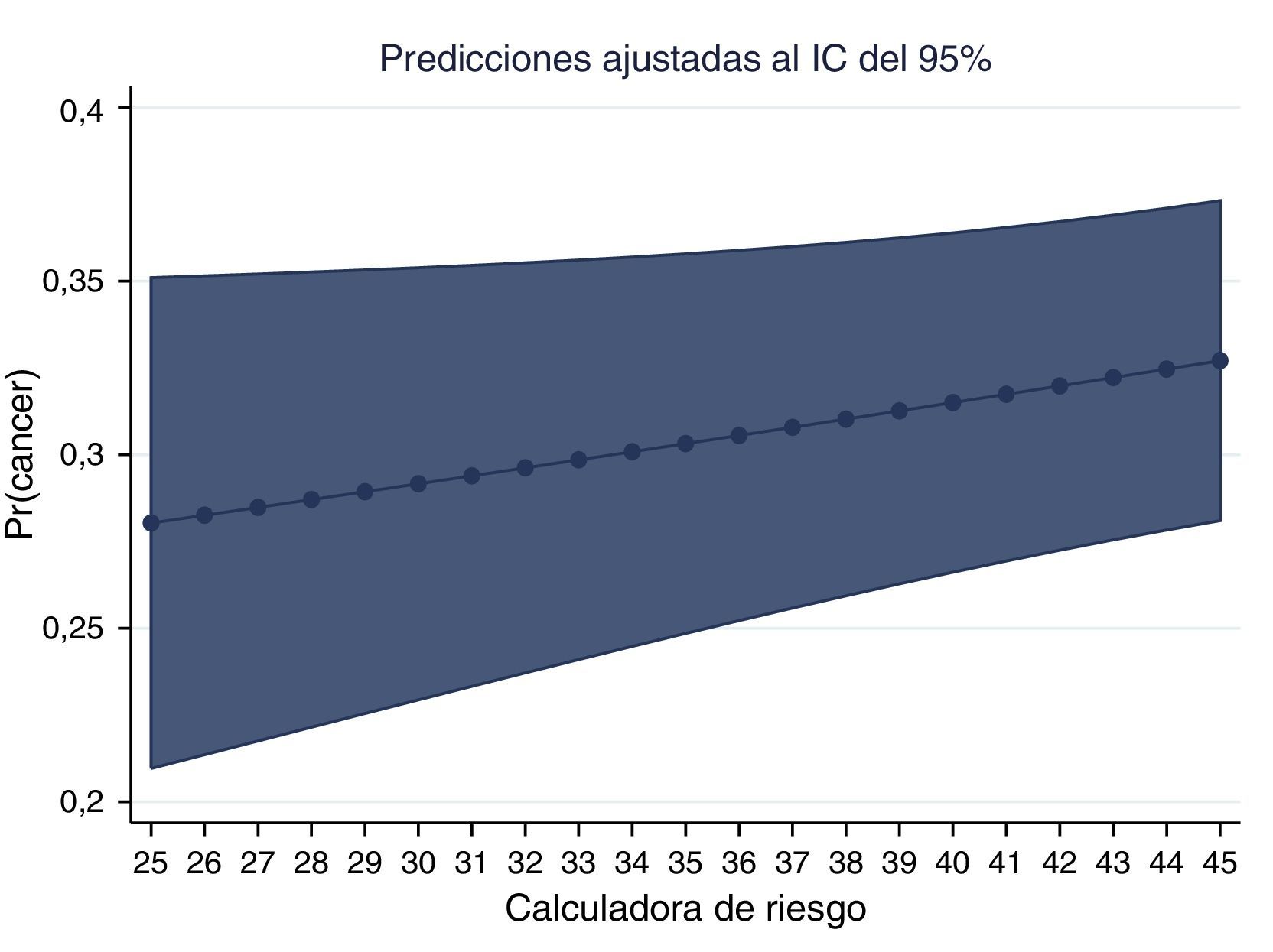
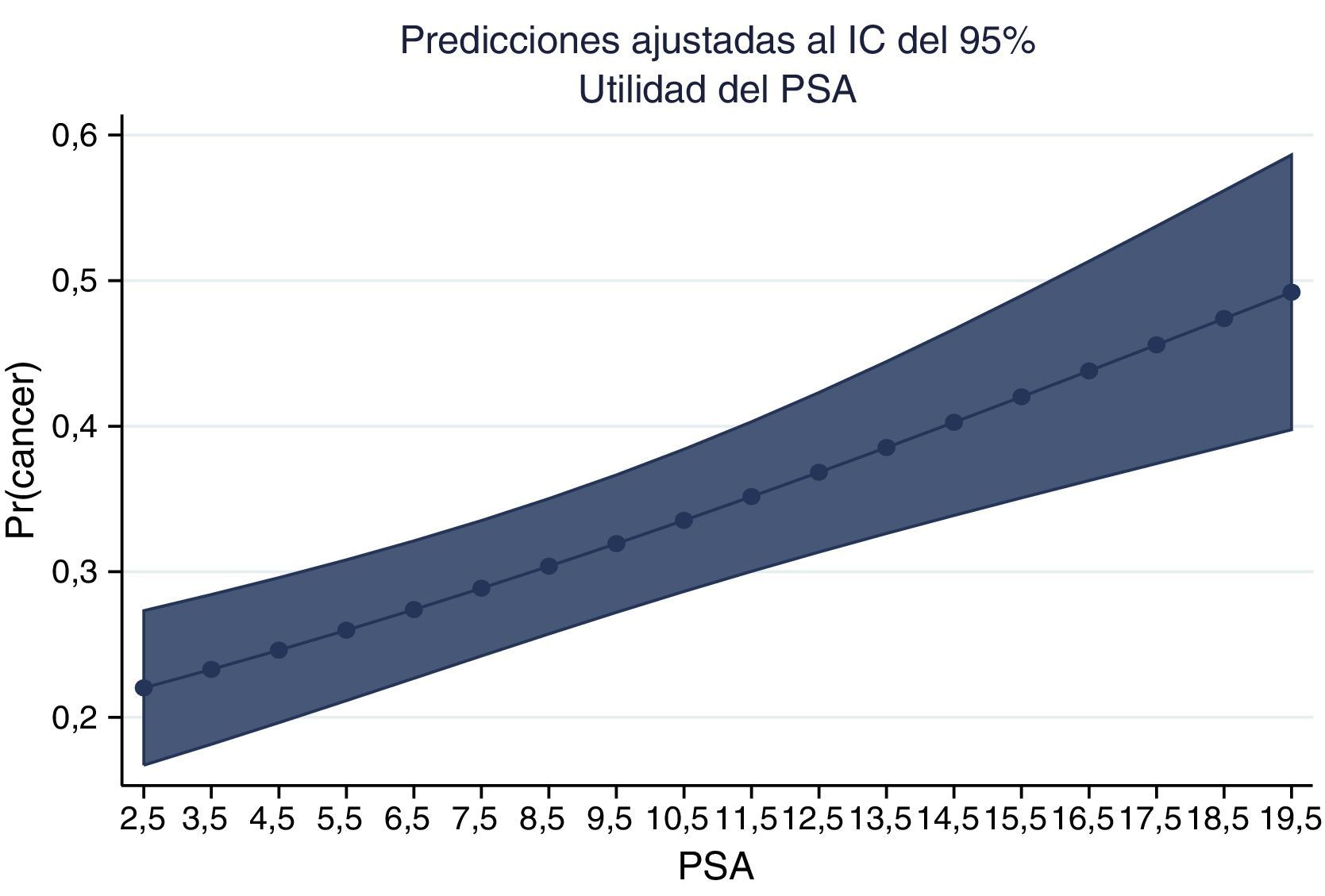
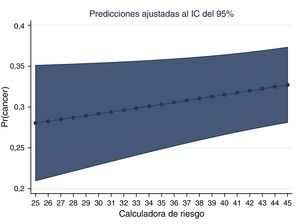
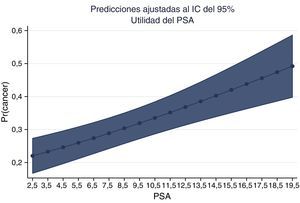
La gráfica del PSA y la probabilidad de adenocarcinoma muestran la probabilidad ajustada de encontrar cáncer en nuestros pacientes colombianos (figs. 6 y 7).
DiscusiónEl uso de modelos predictivos diagnósticos es una práctica frecuente en la urología moderna. Dicha herramienta constituye un recurso nuevo que permite objetivar las conductas médicas. Sin embargo, la validación externa de cada uno de estos modelos previa a su aplicación no se realiza en forma consecuente por diferentes circunstancias9.
Este estudio buscó la validación externa del PCPTRC en una cohorte colombiana, en el contexto de seleccionar los pacientes con un posible adenocarcinoma de próstata y que serían biopsiados por primera vez. Sin embargo, se encuentran características poblacionales que hacen especial esta cohorte.
Un valor de PSA promedio de 7ng/ml es alto si se compara con otras experiencias de la literatura. En el trabajo de Ankerst et al. las cohortes mostraron un intervalo de 3,4 a 5,2ng/ml, incluyendo también la serie que da origen al calculador de riesgo6. Todo esto puede deberse a falta de masificación del uso de esta prueba en la población, por lo que se genera un gran interrogante sobre la situación en la población general colombiana. Características como una raza única hispánica hacen que dicha variable pierda utilidad en la predicción. Igualmente, la poca frecuencia de antecedentes familiares entre los casos con adenocarcinoma de próstata y el uso de inhibidores de 5 alfa reductasa limitan su valor predictivo (tablas 2 y 3).
El PSA presentó una sensibilidad del 90%, la cual se alcanza definiendo un punto de corte en 4,5ng/ml. La especificidad para el mismo es del 17% y LH(+) de 1,1. Por lo menos para la población de estudio, el antiguo punto de corte en 4ng/ml sigue siendo útil en la práctica diaria2,10.
Cuando se realiza el análisis de las características operativas del modelo, a través del análisis AUC, para PCPTRC se encontró un valor de 0,55 para diagnóstico de cáncer y de 0,63 para el grado. Mediciones con una apropiada precisión, si se tienen en cuenta los intervalos de confianza. El problema surge al comparar con los análisis AUC para PSA: 0,62 y 0,85, respectivamente. Diferencias estadísticamente significativas y que muestran la superioridad del PSA al momento de seleccionar los pacientes que serán llevados a primera biopsia. En la validación practicada por Ankerst et al. se encuentran valores AUC desde 0,56 en la cohorte Goeteborg hasta 0,72, dependiendo de la imputación de datos6. Comparando nuestro dato con cohortes americanas, tenemos a Cleveland Clinic con una valor de 0,58 y a Durham con 0,71; en todos los casos nuestro valor es inferior6.
La curva de calibración evidencia una sobrestimación general del riesgo de tener adenocarcinoma de próstata. Este hallazgo es consistente con otras cohortes internacionales7, lo cual evidencia una capacidad predictiva limitada. En igual sentido se obtienen los resultados de valor del ajuste del modelo.
Si se compara el PCPTRC con el PSA, es evidente que con este último se logra un mayor beneficio neto, de acuerdo con los resultados encontrados en los análisis de decisión. En otras palabras, la población requeriría menos biopsias para encontrar una positiva si solo se tiene en cuenta el PSA.
Es evidente el tamaño muestral inferior de esta corte respecto a otras series; sin embargo, no se realizó imputación de datos. Esto es importante porque, como se ve en la serie Roeteborg, diferentes simulaciones generan una gran variabilidad en la precisión del calculador6,10. La temporalidad histórica del muestreo puede introducir sesgos, como en cualquier estudio similar; sin embargo, en este caso se documentaron características epidemiológicas particulares que consecuentemente limitan el uso de modelos no validados.
Es importante tener en cuenta que cada cohorte tiene unas características particulares y que se deben comparar los resultados preferiblemente dentro de la cohorte. Las comparaciones arbitrarias entre cohortes pueden llevar a sesgos.
ConclusionesLa capacidad predictiva del PCPTRC, documentada en el análisis, es baja comparada con los resultados de otras cohortes internacionales y mostró una valor predictivo inferior al uso exclusivo del PSA como herramienta diagnóstica.
La validación que se hace del PCPTRC no permite recomendar su uso en la práctica clínica con cohortes similares a la estudiada.
Nivel de evidenciaIII.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.