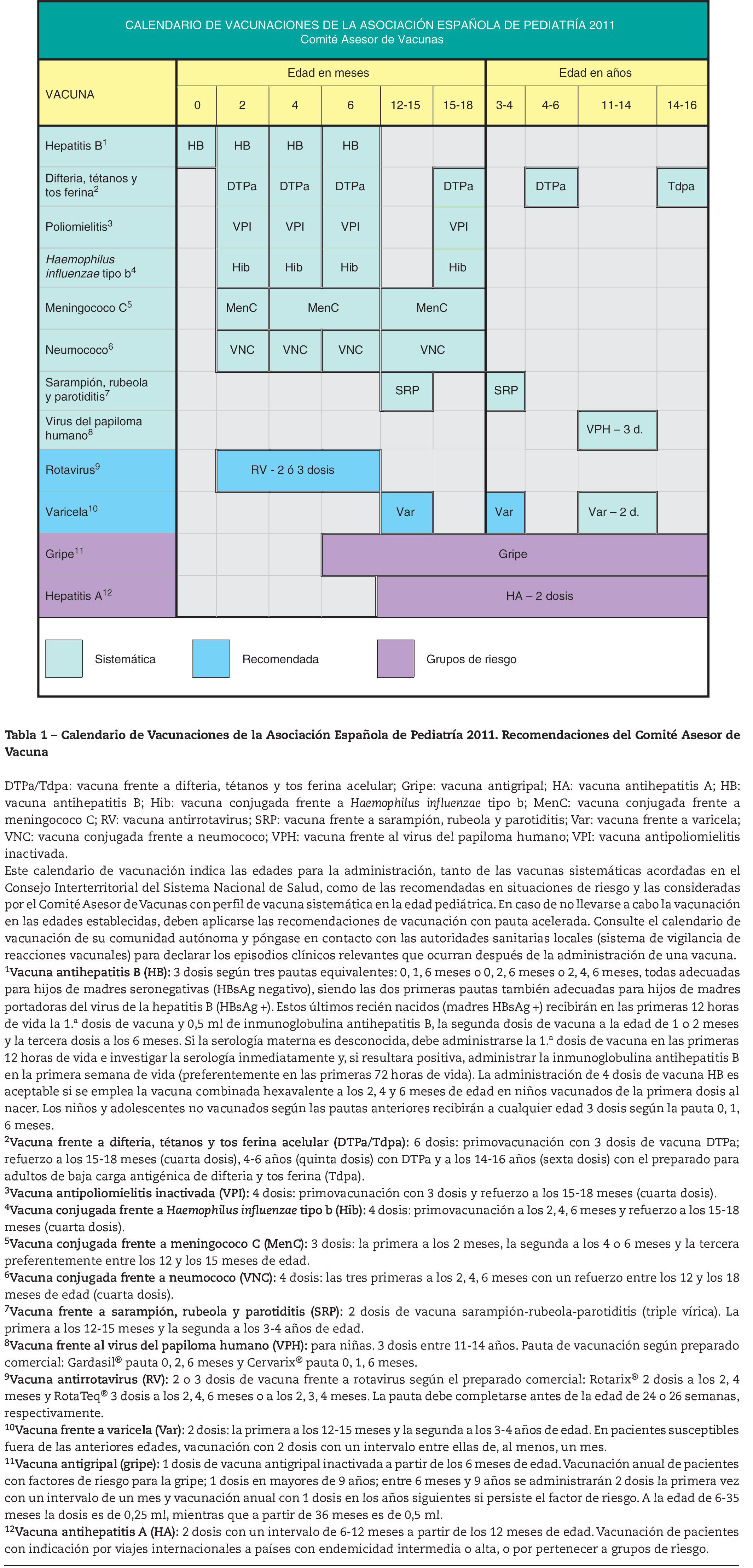
Tabla 1. - Calendario de Vacunaciones de la Asociación Española de Pediatría 2011. Recomendaciones del Comité Asesor de Vacuna. DTPa/Tdpa: vacuna frente a difteria, tétanos y tos ferina acelular; Gripe: vacuna antigripal; HA: vacuna antihepatitis A; HB: vacuna antihepatitis B; Hib: vacuna conjugada frente a Haemophilus influenzae tipo b; MenC: vacuna conjugada frente a meningococo C; RV: vacuna antirrotavirus; SRP: vacuna frente a sarampión, rubeola y parotiditis; Var: vacuna frente a varicela; VNC: vacuna conjugada frente a neumococo; VPH: vacuna frente al virus del papiloma humano; VPI: vacuna antipoliomielitis inactivada. Este calendario de vacunación indica las edades para la administración, tanto de las vacunas sistemáticas acordadas en el Consejo Interterritorial del Sistema Nacional de Salud, como de las recomendadas en situaciones de riesgo y las consideradas por el Comité Asesor de Vacunas con perfil de vacuna sistemática en la edad pediátrica. En caso de no llevarse a cabo la vacunación en las edades establecidas, deben aplicarse las recomendaciones de vacunación con pauta acelerada. Consulte el calendario de vacunación de su comunidad autónoma y póngase en contacto con las autoridades sanitarias locales (sistema de vigilancia de reacciones vacunales) para declarar los episodios clínicos relevantes que ocurran después de la administración de una vacuna. 1Vacuna antihepatitis B (HB): 3 dosis según tres pautas equivalentes: 0, 1, 6 meses o 0, 2, 6 meses o 2, 4, 6 meses, todas adecuadas para hijos de madres seronegativas (HBsAg negativo), siendo las dos primeras pautas también adecuadas para hijos de madres portadoras del virus de la hepatitis B (HBsAg +). Estos últimos recién nacidos (madres HBsAg +) recibirán en las primeras 12 horas de vida la 1.ª dosis de vacuna y 0,5 ml de inmunoglobulina antihepatitis B, la segunda dosis de vacuna a la edad de 1 o 2 meses y la tercera dosis a los 6 meses. Si la serología materna es desconocida, debe administrarse la 1.ª dosis de vacuna en las primeras 12 horas de vida e investigar la serología inmediatamente y, si resultara positiva, administrar la inmunoglobulina antihepatitis B en la primera semana de vida (preferentemente en las primeras 72 horas de vida). La administración de 4 dosis de vacuna HB es aceptable si se emplea la vacuna combinada hexavalente a los 2, 4 y 6 meses de edad en niños vacunados de la primera dosis al nacer. Los niños y adolescentes no vacunados según las pautas anteriores recibirán a cualquier edad 3 dosis según la pauta 0, 1, 6 meses. 2Vacuna frente a difteria, tétanos y tos ferina acelular (DTPa/Tdpa): 6 dosis: primovacunación con 3 dosis de vacuna DTPa; refuerzo a los 15-18 meses (cuarta dosis), 4-6 años (quinta dosis) con DTPa y a los 14-16 años (sexta dosis) con el preparado para adultos de baja carga antigénica de difteria y tos ferina (Tdpa). 3Vacuna antipoliomielitis inactivada (VPI): 4 dosis: primovacunación con 3 dosis y refuerzo a los 15-18 meses (cuarta dosis). 4Vacuna conjugada frente a Haemophilus influenzae tipo b (Hib): 4 dosis: primovacunación a los 2, 4, 6 meses y refuerzo a los 15-18 meses (cuarta dosis). 5Vacuna conjugada frente a meningococo C (MenC): 3 dosis: la primera a los 2 meses, la segunda a los 4 o 6 meses y la tercera preferentemente entre los 12 y los 15 meses de edad. 6Vacuna conjugada frente a neumococo (VNC): 4 dosis: las tres primeras a los 2, 4, 6 meses con un refuerzo entre los 12 y los 18 meses de edad (cuarta dosis). 7Vacuna frente a sarampión, rubeola y parotiditis (SRP): 2 dosis de vacuna sarampión-rubeola-parotiditis (triple vírica). La primera a los 12-15 meses y la segunda a los 3-4 años de edad. 8Vacuna frente al virus del papiloma humano (VPH): para niñas. 3 dosis entre 11-14 años. Pauta de vacunación según preparado comercial: Gardasil® pauta 0, 2, 6 meses y Cervarix® pauta 0, 1, 6 meses. 9Vacuna antirrotavirus (RV): 2 o 3 dosis de vacuna frente a rotavirus según el preparado comercial: Rotarix® 2 dosis a los 2, 4 meses y RotaTeq® 3 dosis a los 2, 4, 6 meses o a los 2, 3, 4 meses. La pauta debe completarse antes de la edad de 24 o 26 semanas, respectivamente. 10Vacuna frente a varicela (Var): 2 dosis: la primera a los 12-15 meses y la segunda a los 3-4 años de edad. En pacientes susceptibles fuera de las anteriores edades, vacunación con 2 dosis con un intervalo entre ellas de, al menos, un mes. 11Vacuna antigripal (gripe): 1 dosis de vacuna antigripal inactivada a partir de los 6 meses de edad. Vacunación anual de pacientes con factores de riesgo para la gripe; 1 dosis en mayores de 9 años; entre 6 meses y 9 años se administrarán 2 dosis la primera vez con un intervalo de un mes y vacunación anual con 1 dosis en los años siguientes si persiste el factor de riesgo. A la edad de 6-35 meses la dosis es de 0,25 ml, mientras que a partir de 36 meses es de 0,5 ml. 12Vacuna antihepatitis A (HA): 2 dosis con un intervalo de 6-12 meses a partir de los 12 meses de edad. Vacunación de pacientes con indicación por viajes internacionales a países con endemicidad intermedia o alta, o por pertenecer a grupos de riesgo.