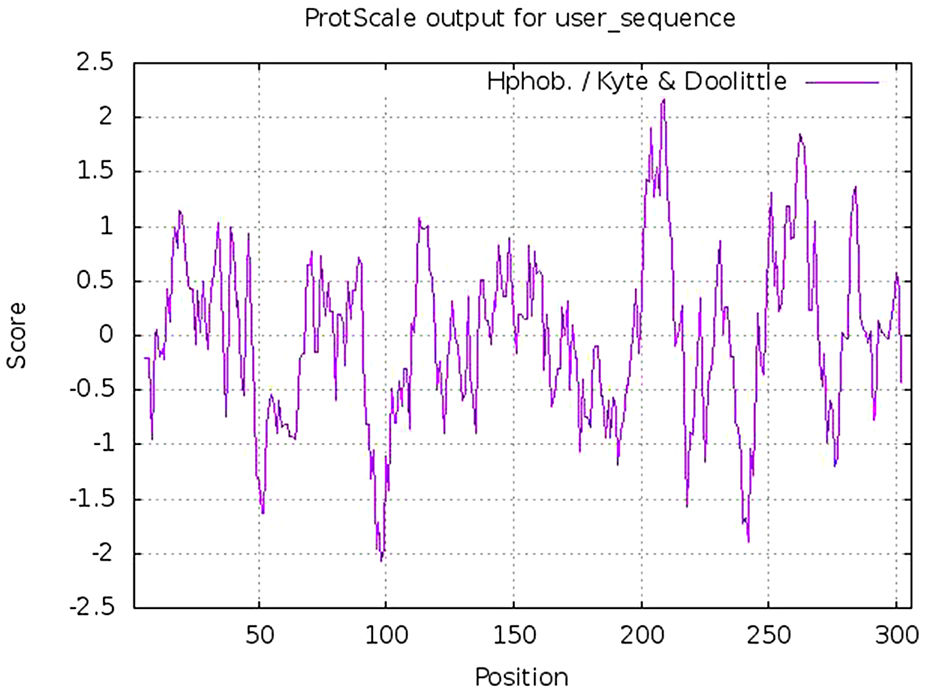
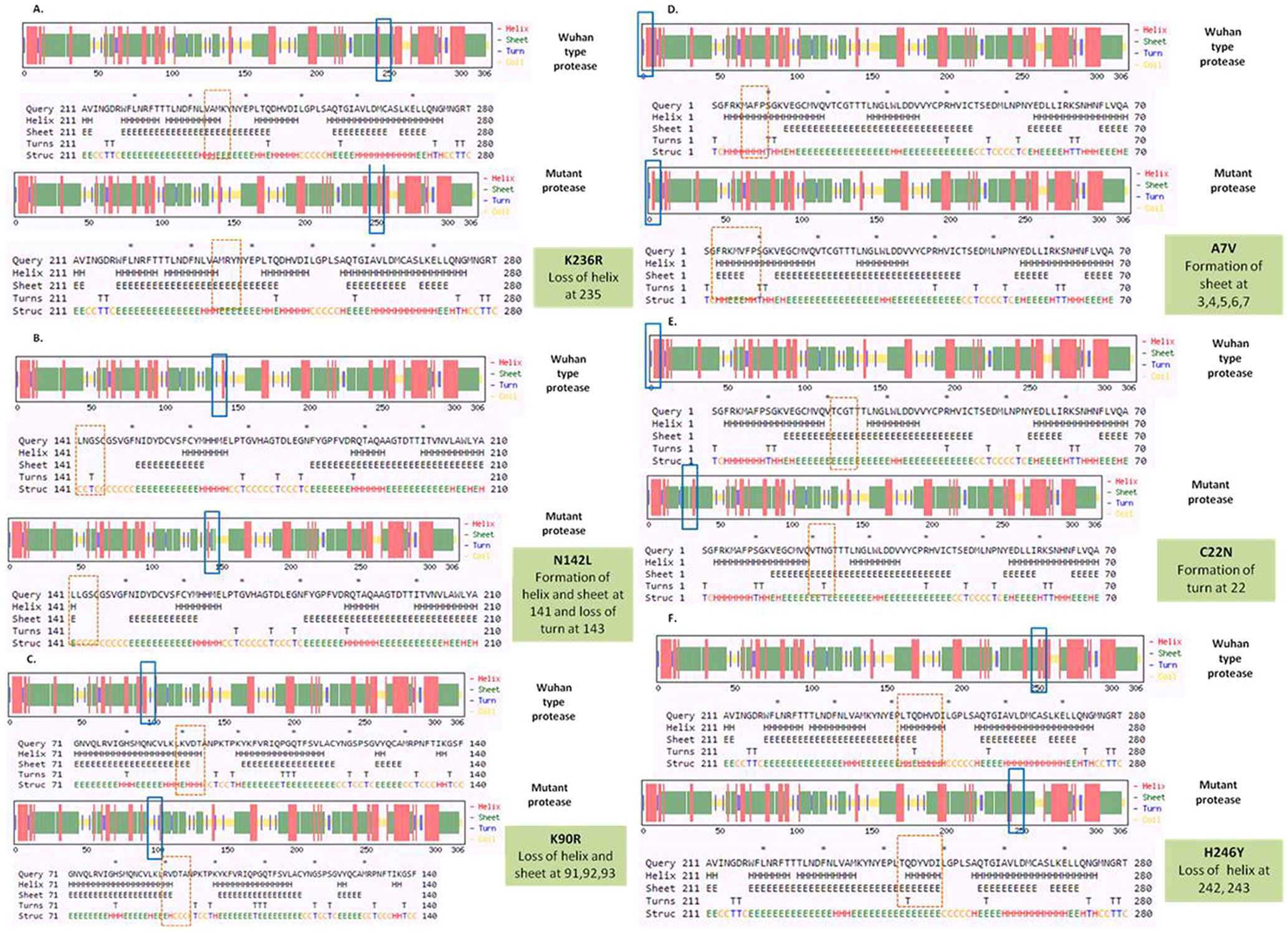
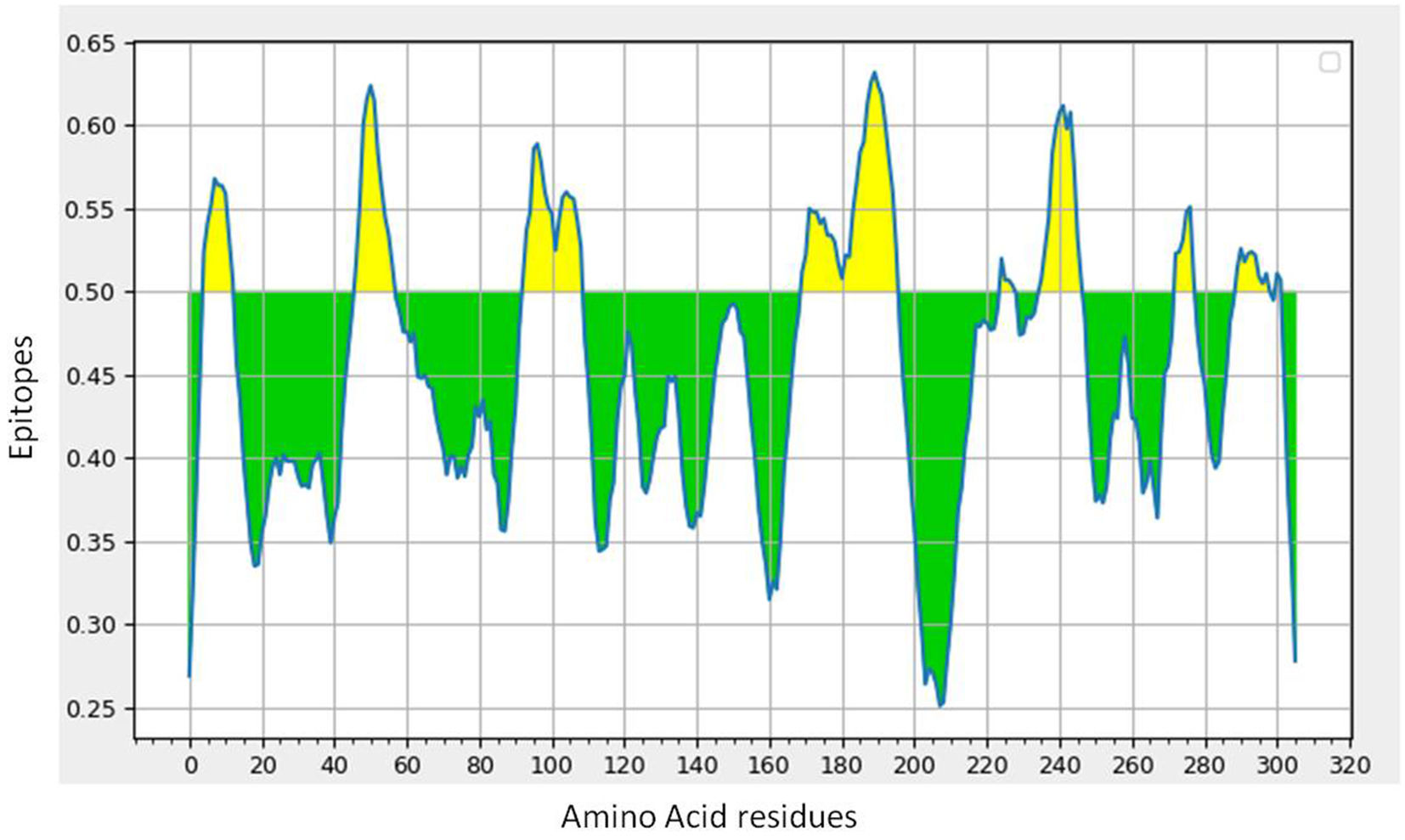
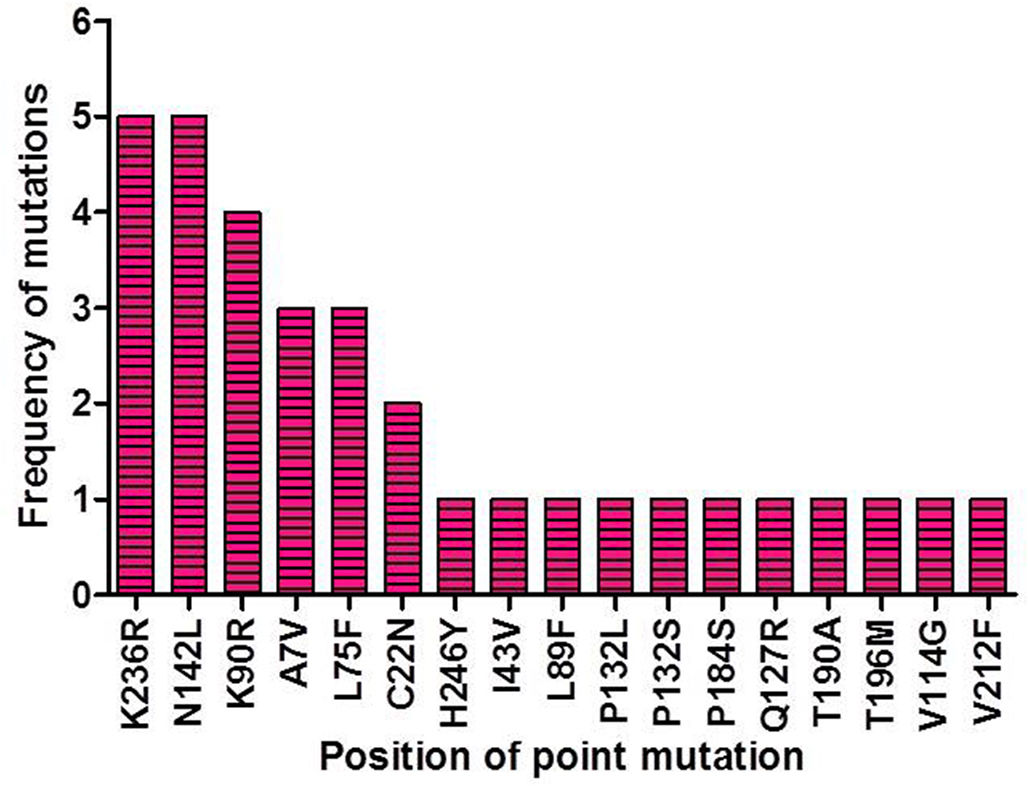
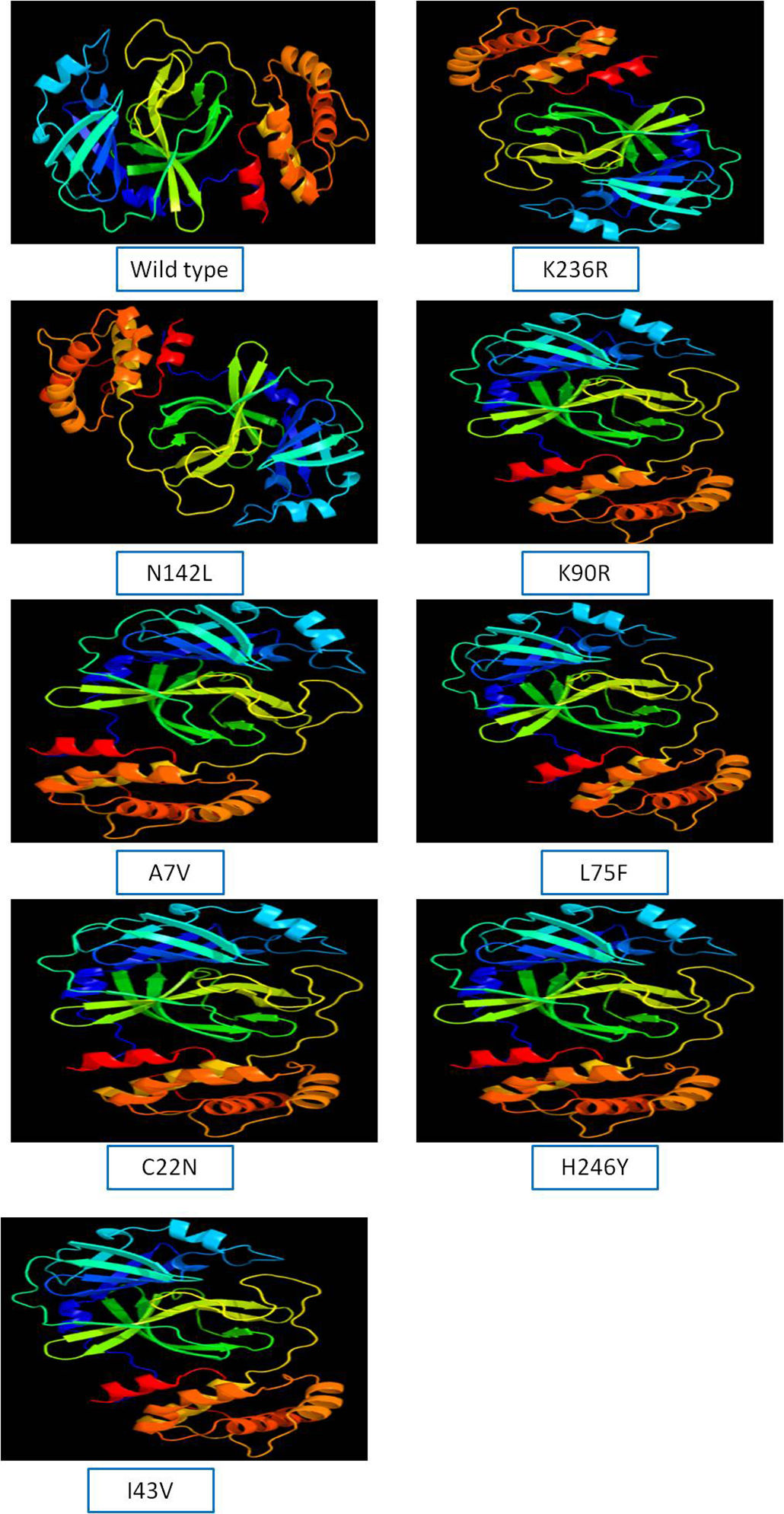
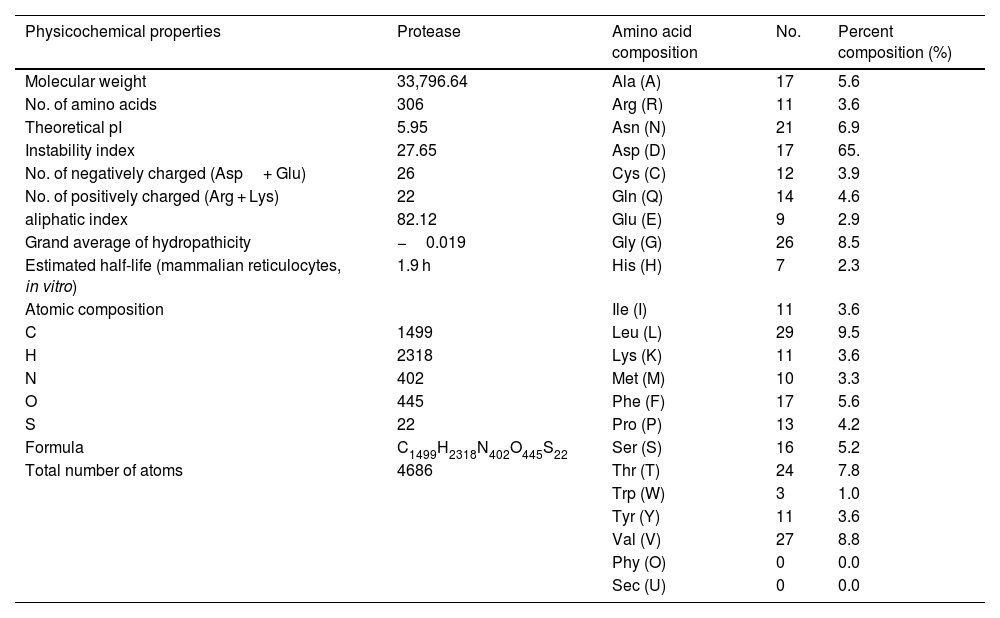
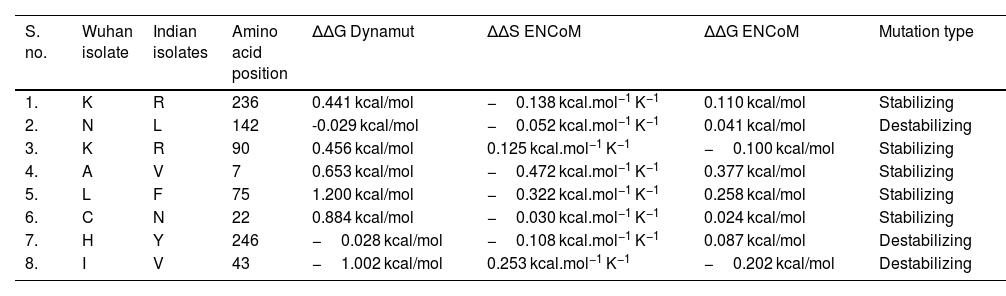
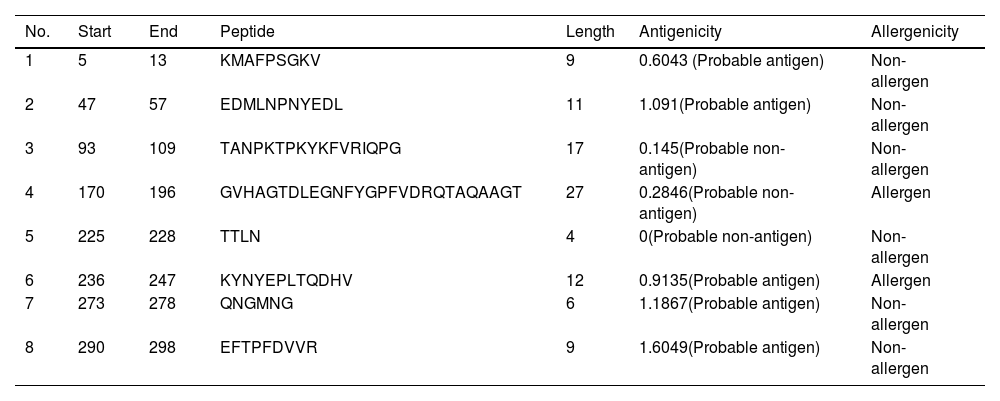
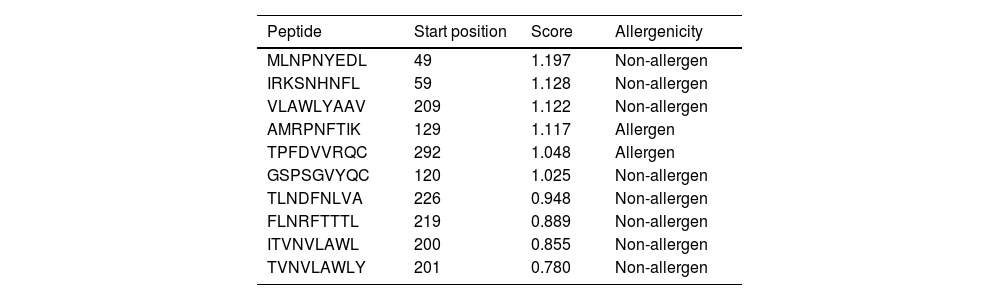
SARS-CoV-2 (Severe Acute Respiratory Syndrome), an etiolating agent of novel COVID-19 (coronavirus 2019) pandemic, rapidly spread worldwide, creating an unprecedented public health crisis globally. NSP5, the main viral protease, is a highly conserved protein, encoded by the genome of SARS-CoV-2 and plays an important role in the viral replication cycle. In the present study, we detected a total of 33 mutations from 675 sequences submitted from India in the month of March 2020 to April 2021. Out of 33 mutations, we selected 8 frequent mutations (K236R, N142L, K90R, A7V, L75F, C22N, H246Y and I43V) for further analysis. Subsequently, protein models were constructed, revealing significant alterations in the 3-D structure of NSP5 protein when compared to the wild type protein sequence which also altered the secondary structure of NSP5 protein. Further, we identified 9 B-cell, 10 T-cell and 6 MHC-I promising epitopes using predictive tools of immunoinformatics, out of these epitopes some were non-allergenic as well as highly immunogenic. Results of our study, however, revealed that 10 B-cell epitopes reside in the mutated region of NSP5. Additionally, hydrophobicity, physiochemical properties, toxicity and stability of NSP5 protein were estimated to demonstrate the specificity of the multiepitope candidates. Taken together, variations arising as a consequence of multiple mutations may cause alterations in the structure and function of NSP5 which generate crucial insights to better understand structural aspects of SARS-CoV-2. Our study also revealed, NSP5, a main protease, can be a potentially good target for the design and development of vaccine candidate against SARS-CoV-2.
El SARS-CoV-2 (Síndrome Respiratorio Agudo Severo), un agente etiológico de la nueva pandemia de COVID-19 (coronavirus 2019), se propagó rápidamente por todo el mundo y creó una crisis de salud pública sin precedentes a nivel mundial. El NSP5, la proteasa viral principal, es una proteína altamente conservada, codificada por el genoma del SARS-CoV-2 y juega un papel importante en el ciclo de replicación viral. En el presente estudio se detectaron un total de 33 mutaciones de 675 secuencias presentadas desde la India en el mes de marzo de 2020 a abril de 2021. De 33 mutaciones, se seleccionaron 8 mutaciones frecuentes (K236R, N142L, K90R, A7V, L75F, C22N, H246Y e I43V) para su posterior análisis. Posteriormente, se construyeron modelos proteicos que revelaron alteraciones significativas en la estructura 3D de las proteínas NSP5 en comparación con la secuencia de proteínas de tipo silvestre que también alteraron la estructura secundaria de la proteína NSP5. Además, se identificaron 9 epítopos prometedores de células B, 10 de células T y 6 de MHC-I, utilizando herramientas predictivas de inmunoinformática, algunos no alergénicos y altamente inmunogénicos. Los resultados de nuestro estudio, sin embargo, revelaron que 10 epítopos de células B residen en la región mutada de NSP5. Adicionalmente, se estimó la hidrofobicidad, propiedades fisicoquímicas, toxicidad y estabilidad de la proteína NSP5 para demostrar la especificidad de los candidatos multiepítopos. En conjunto, las variaciones que surgen como consecuencia de múltiples mutaciones pueden causar alteraciones en la estructura y función del NSP5 que generan conocimientos cruciales para entender mejor los aspectos estructurales del SARS-CoV-2. Nuestro estudio también reveló que el NSP5, una proteasa principal, puede ser un blanco potencialmente bueno para el diseño y desarrollo de la vacuna candidata contra el SARS-CoV-2.
Artículo
Comprando el artículo el PDF del mismo podrá ser descargado
Precio 19,34 €
Comprar ahora