DISTRIBUIÇÃO DE RECEPTORES OPIOIDES DELTA NO TEGMENTO PONTINO: IMPLICAÇÕES NO CICLO VIGILIA-SONO
RESUMO
Introdução: A região ventral do núcleo reticular oral da ponte (vRPO) é a zona do tegmento pontino implicada na geração e manutenção do sono REM. Experiências realizadas mediante microinjecção de opiáceos no tegmento pontino do gato demonstraram que a activação de receptores opioides nesta zona modula a aparição do sono REM. Material é métodos: No presente estudo utilizamos técnicas de marcação imunocitoquímica do receptor opioide do subtipo delta (DOR) a nível de microscopia óptica com a finalidade de determinar a sua localização no tegmento pontino do gato e ao nível de microscopia electrónica com o intuito de determinar a sua localização subcelular no vRPO. Resultados: DOR foi localizado fundamentalmente no citoplasma de dendritos (55%) de médio e grande tamanho que recebiam contactos sinápticos assimétricos (64%) e simétricos (36%) e, em menor medida, uma localização pré-sináptica nos terminais axónicos . Conclusões: Nossos resultados sugerem que a activação de DOR no vRPO regula a aparição do sono REM essencialmente através da modulação das respostas pós-sinápticas a aferências excitatórias e, em menor medida, também inibitórias ; a activação de DOR no vRPO teria, contudo, um papel menor na modulação directa da liberação de neurotransmissores.
Palaras-chave : Delta. Gato. Opioide. Receptor. REM.vRPO.
INTRODUCCIÓN
Estudios pioneros de transecciones del tronco del encéfalo pusieron de manifiesto la importancia del tegmento pontino en los mecanismos neurales del sueño REM y la organización de sus fenómenos bioeléctricos característicos 1, 2. El registro de unidades celulares demostró que las neuronas de la formación reticular del puente aumentan su frecuencia de descarga durante el sueño REM 3, 4. Posteriormente, mediante lesiones más selectivas en diferentes zonas del tegmento pontino se observó que aquellas localizadas en las áreas ventrales del núcleo reticular oral del puente (vRPO) produjeron como único efecto una disminución marcada del sueño REM 5, 6. El estudio de pacientes con lesiones del tegmento pontino ventral ha aportado información clínica relevante a estas observaciones experimentales, ya que pacientes con lesiones del vRPO presentan alteraciones del sueño REM 7, 8.
Como estructura clave en la generación del sueño REM 9, 10, el vRPO contiene gran cantidad de conexiones recíprocas con los subsistemas responsables de los fenómenos característicos de esta fase (atonía muscular, activación del EEG, movimientos oculares rápidos y ondas ponto-genículo-occipitales) 11, al igual que con las demás estructuras que participan en otras fases del ciclo vigilia-sueño (CVS) 10-15. La acetilcolina es uno de los neurotransmisores fundamentales implicados en la regulación del sueño REM en el vRPO, aunque también participan otras sustancias 16-21. La inyección de pequeños volúmenes (20 nl) del agonista colinérgico carbacol en el vRPO reproduce todas las características conductuales y bioeléctricas del sueño REM 12, 15, situación que no ocurre cuando estas microinyecciones se realizan en el tegmento pontino dorsal 12, 15, 22 o caudal 23. De manera similar, la inyección de dosis mínimas (0.04 μg) de carbacol en el vRPO también produce aumento del sueño REM 24, 25. Aunque otros autores han propuesto distintas regiones del tegmento pontino como posibles organizadores de la generación del sueño REM, es probable que esta discordancia se deba a la poca selectividad de muchas de las microinyecciones, algunas de las cuales superaron los 200 nl de volumen 26-28.
Los estudios de microscopía electrónica indican que en el vRPO abundan terminales axónicos que establecen contactos de morfología asimétrica 29, cuyo neurotransmisor podría ser glutamato y/o acetilcolina. Experimentos electrofisiológicos in vitro han demostrado que la mayoría de neuronas del vRPO son despolarizadas por acetilcolina (mediante la activación de receptores muscarínicos postsinápticos) 30, 31; el glutamato y la histamina producen fundamentalmente despolarización y descargas en espiga, mientras que la serotonina y el ácido γ-aminobutírico (GABA) producen hiperpolarización de estas células 21.
Se sabe que los agonistas opioides tienen efectos marcados sobre el CVS; la administración sistémica de opiáceos produce supresión de sueño lento (SL) y sueño REM, seguida de un rebote de ambas fases 32-35. En gatos con transecciones del tronco del encéfalo, la administración sistémica de morfina produce supresión del sueño REM en el animal descerebrado, por lo que se ha postulado que la supresión de esta fase producida por opiáceos en el animal intacto podría estar determinada en parte por la acción de éstos en la formación reticular del tronco del encéfalo 32, 36. Algunos autores han observado una disminución del sueño REM al inyectar morfina en la formación reticular medial del puente del gato 37, 38. Sin embargo, estudios realizados en nuestro laboratorio han demostrado que la inyección de dosis mínimas de morfina en el vRPO produce aumento del SL y SP 20.
La distribución de receptores opioides en el tronco del encéfalo ha sido estudiada utilizando métodos diversos: autorradiografía 39-41, hibridación in situ42-44 y últimamente, y de forma más fiable, mediante inmunohistoquímica para detectar los propios receptores 45-4. Estos estudios en general, y los inmunohistoquímicos en particular, se han centrado en el análisis de la distribución general de los receptores opioides a nivel de microscopía óptica en el sistema nervioso central de distintas especies, fundamentalmente en la rata.
A nivel de microscopía electrónica se ha estudiado la localización de receptores opioides en estructuras troncoencefálicas muy concretas, en especial aquellas que tienen una gran densidad de receptores, como es el caso del locus coeruleus 49, el núcleo del tracto solitario 50, la sustancia gris periacueductal 51 o el área tegmental ventral 52, 53. Sin embargo, hasta el momento se ha prestado muy poca atención a otras regiones del tronco, como el tegmento pontino que, pese a contener receptores opioides y a que su activación produce efectos considerables sobre las fases de sueño, no tienen una expresión tan llamativa. En el vRPO del gato sólo se ha estudiado hasta el momento la localización del receptor opioide mu 54, pero todavía no existe ningún estudio sobre la localización ultraestructural de receptores opioides tipo delta en el vRPO, pese a que la morfina también actúa sobre estos receptores. Por lo tanto, en el presente estudio nos hemos propuesto:
1. Determinar la distribución del receptor opioide delta (DOR) en distintos sectores del tegmento mesopontino del gato mediante técnicas inmunohistoquímicas de marcaje simple para DOR a nivel de microscopía óptica.
2. Determinar la localización subcelular de DOR y la ubicación de los sitios funcionales para su activación en el vRPO del gato meditante técnicas inmunohistoquímicas de marcaje simple para DOR a nivel de microscopía electrónica.
MATERIAL Y MÉTODOS
Sujetos experimentales y preparación del tejido
Se utilizaron 4 gatos anestesiados con pentobarbital sódico i.p. (Dolethal®) (35 mg/kg). Los cerebros fueron fijados mediante perfusión a través del arco aórtico de una solución con: 1) heparina (1000 U/ml) en solución salina isotónica; 2) 50 ml de acroleína (3.8%) en una solución de paraformaldehído (PFA) (2%) en tampón fosfato (TF) 0.1M; y 3) 1000 ml de PFA (2%) en TF 0.1M. Los cerebros fueron extraídos y post-fijados durante 30 minutos con PFA (2%). Se cortaron secciones del tegmento pontino de 40-50 μm en un vibratomo en TF 0.1M a 4°C. Las secciones fueron incubadas 30 minutos en una solución de borohidruro de sodio (1%) en TF 0.1M para retirar el exceso de aldehídos, y lavadas abundantemente en TF 0.1M. Para mejorar la penetración de los anticuerpos, las secciones fueron crioprotegidas 40 minutos en sacarosa (25%) y glicerol (3%) en TF 0.05M, congeladas en nitrógeno líquido y descongeladas rápidamente en TF 0.1M a temperatura ambiente. Después de ser lavadas en tampón Tris-salino (TTS) 0.1M (pH 7.6), las secciones fueron incubadas 2 horas en albúmina de suero bovino (0.5%) (BSA) o en suero de cabra (10%) en TTS 0.1M para minimizar el marcaje inespecífico.
Inmunohistoquímica
La detección inmunohistoquímica de DOR fue realizada utilizando dos métodos: 1) el método de la inmunoperoxidasa (ABC) y; 2) el método inmunogold (oro coloidal). En ambos casos, todas las incubaciones se realizaron a temperatura ambiente y en agitación continua, seguidas de varios lavados en TTS 0.1M, TF 0.1M y tampón fosfato salino (TFS) 0.01M, pH 7.6. Las secciones fueron incubadas durante 2 noches a 4°C en una solución de BSA (0.1%) que contenía el anticuerpo primario anti-DOR desarrollado en conejo (Diasorin) a las siguientes diluciones: 1) 1:2500 para la inmunoperoxidasa y; 2) 1:500 para el inmunogold, y Tritón X-100 (0.25% para microscopio óptico y 0.025% para microscopio electrónico). Posteriormente las secciones fueron lavadas con TTS 0.1M y procesadas mediante uno de estos dos protocolos: 1) Inmunoperoxidasa: Las secciones fueron incubadas con el anticuerpo secundario IgG cabra anticonejo biotinilado (1:400, Vector Laboratories) en BSA (0.1%) en TTS 0.1M e incubadas nuevamente durante 30 minutos en ABC (Vectastain Elite Kit, Vector Laboratories). La inmunorreactividad DOR fue visualizada con una incubación durante 6 minutos en 3,3'-diaminobenzidina (0.022%) y peróxido de hidrógeno (0.003%) en TTS 0.1M. 2) Inmunogold: Las secciones fueron lavadas con TTS 0.1M, transferidas a TFS 0.01M, bloqueadas durante 10 minutos con BSA (0.8%) y gelatina (0.1%) en TTS 0.01M e incubadas durante 2 horas en IgG cabra anti-conejo marcado con partículas de oro coloidal de 1 nm de diámetro (1:50; AutoProbeOne GAR, Amersham). Después fueron bloqueadas nuevamente en la solución de BSA y gelatina, lavadas en TFS, fijadas 10 minutos en glutaraldehído (2%) en TFS 0.01M y lavadas en TFS. El marcaje con oro coloidal se intensificó posteriormente con plata metálica (IntenSEM Kit, Amersham). Las secciones para microscopía óptica fueron lavadas en TF 0.03M y montadas en portaobjetos; después fueron deshidratadas, desengrasadas en xilol, cubiertas y examinadas en un microscopio óptico (Axioskop-Zeiss).
Microscopía electrónica
Las secciones procesadas para microscopía electrónica fueron postfijadas durante 1 hora en tetróxido de osmio (2%) en TF 0.1M, lavadas con TF 0.1M, deshidratadas mediante pases por alcoholes y óxido de propileno, e incubadas durante una noche en una mezcla 1:1 de óxido de propileno y resina Epon (EM Bed-812; Electron Microscopy Sciences). Después fueron transferidas a Epon durante 2 horas, incluidas en plano entre dos láminas de plástico e incubadas en estufa a 60°C durante 64 horas. De la superficie externa del tejido incluido se cortaron secciones ultrafinas (40-50 nm) del vRPO con una cuchilla de vidrio utilizando un ultramicrotomo (Reichert-Jung, Ultracut E/GA/S-83/05). Los cortes ultrafinos fueron recogidos en rejillas de cobre, teñidos con citrato de plomo y acetato de uranilo 55 y examinados con un microscopio electrónico Jeol JEM 1010.
Identificación de perfiles
La clasificación de los elementos celulares se basó en las descripciones de Peters et al. 56. Las dendritas fueron identificadas por su contenido homogéneo de microtúbulos, presencia de mitocondrias, retículo endoplásmico liso o rugoso, ribosomas, escasez de neurofilamentos y presencia de terminales axónicos haciendo contacto con ellas. Los terminales axónicos fueron identificados por tener múltiples vesículas sinápticas y un diámetro >0.2 μm. Los somas neuronales fueron identificados por la presencia del núcleo, complejo de Golgi, múltiples ribosomas y retículo endoplásmico rugoso. Los axones amielínicos se reconocieron por tener un diámetro entre 0.1 y 0.2 μm, estar generalmente agrupados y tener un contorno más regular que las dendritas. Las sinapsis asimétricas fueron identificadas por su mayor engrosamiento postsináptico y una hendidura sináptica aumentada; mientras que las simétricas tenían delgadas especializaciones pre- y postsinápticas y no presentaban aumento de su hendidura sináptica. Aquellas zonas donde las membranas celulares se encontraban en estrecha aposición, que no presentaban densidades sinápticas reconocibles y no se encontraban separadas por procesos gliales fueron definidas como contactos no sinápticos o aposiciones, y no fueron incluidas dentro de la cuantificación. Los perfiles considerados inmunorreactivos para inmunogold-DOR fueron aquellos con dos o más partículas de oro en los perfiles de gran tamaño (>0.2 μm), y una partícula en los más pequeños (<0.2 μm).
Análisis de datos
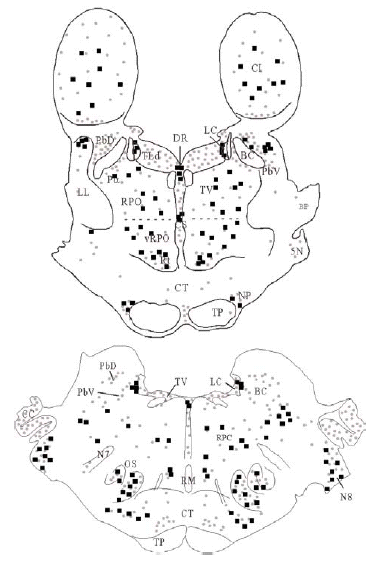
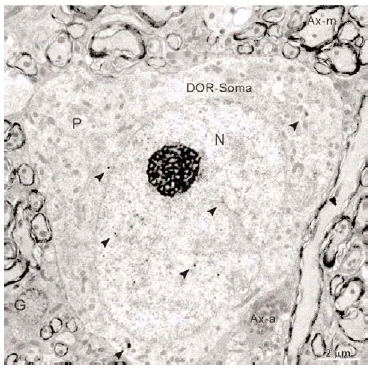
Se obtuvieron cortes de diferentes niveles del puente que fueron escaneados y exportados a un programa informático de dibujo (Canvas® 7.0.2; Deneba Systems). Las estructuras de referencia fácilmente apreciables en los cortes fueron dibujadas sobre una imagen superpuesta. Mediante un microscopio óptico binocular (Axioskop-Zeiss) fue observada la inmunorreactividad para DOR, y sobre las dos imágenes superpuestas se dibujó una tercera imagen donde se detalló la inmunorreactividad de somas neuronales (cuadrados negros) y neuropilo (puntos grises). Las regiones con neuropilo inmunorreactivo para DOR fueron asignadas siguiendo unos estándares internos basados en comparaciones entre las diferentes intensidades de la inmunorreactividad. Los somas neuronales marcados en los cortes correspondieron al número real de somas inmunorreactivos para DOR observados en ese corte concreto (ver Figura 1).
Figura 1
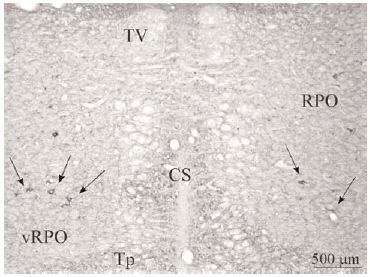
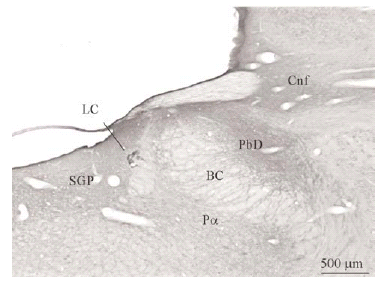
Con ayuda de una cámara digital (SPOT Insight Camera, Diagnostic Instruments) y un programa informático (Spot Insight, V3.2; Diagnostic Instruments) se tomaron fotos de algunas regiones del puente y de neuronas localizadas en el vRPO (ver Figura 2).
Figura 2a
Figura 2b
El análisis ultraestructural se realizó en 11 bloques de tejido que contenían el vRPO. Todos los perfiles inmunorreactivos fueron contados a partir de micrografías electrónicas a magnificaciones entre 6000-25,000X de un área total de 37,070 μm2. Las micrografías electrónicas se obtuvieron con una cámara Bioscan (Gatan Inc) acoplada a un ordenador Power Macintosh 8600 y a un programa Digital Micrograph 3.1 (Gatan Inc). En cada micrografía del material preparado con inmunogold se contó el número de perfiles inmunorreactivos para DOR. También se calculó el número total de partículas por unidad de área examinada, el número y tipo de sinapsis, tanto marcadas como no marcadas que recibían los perfiles inmunorreactivos, y la frecuencia de distribución de partículas de oro asociadas a la membrana plasmática o el citoplasma en relación con cada tipo de perfil. Se utilizaron análisis de varianza (ANOVA) para determinar si existían diferencias en la intensidad del marcaje (número de perfiles inmunorreactivos) entre los distintos bloques de tejido para cada uno de los compartimentos subcelulares (somas, dendritas, terminales, axones amielínicos, axones mielínicos y glía). Además se comparó, mediante una prueba t de Student, la densidad de partículas inmunorreactivas para DOR asociadas a la membrana plasmática con la densidad de aquellas asociadas al citoplasma, tanto en dendritas como en terminales.
RESULTADOS
Microscopía óptica
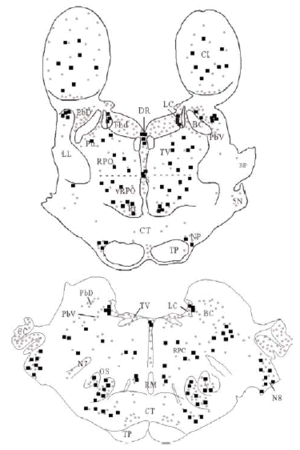
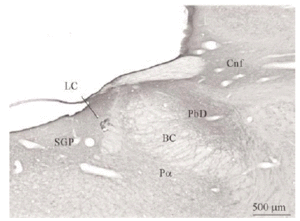
Mediante la técnica de la inmunoperoxidasa se observó inmunorreactividad para DOR en el neuropilo de extensas zonas del puente y porciones adyacentes del mesencéfalo y bulbo raquídeo. El marcaje del neuropilo fue en general moderado y mostró una distribución bastante homogénea, aunque hubo diferencias entre algunas estructuras concretas en la intensidad de la inmunorreactividad (ver Figura 3 y Tabla 1). Se observó inmunorreactividad más intensa en el complejo olivar superior, corteza cerebelosa, núcleos cocleares, núcleo reticular tegmental, núcleo central superior del rafe, núcleo parabraquial dorsal, núcleo tegmental laterodorsal y sustancia gris periacueductal; moderada en los núcleos del puente, núcleo rafe magnus, núcleos del lemnisco lateral, perilocus coeruleus alfa, núcleo parabraquial ventral, núcleo dorsal del rafe, locus coeruleus y colículo inferior; leve en el núcleo motor del trigémino, núcleo reticular caudal del puente (RPC) y núcleo reticular oral del puente (RPO); y ausente en el núcleo tegmental ventral, braquium pontis, núcleo rafe pontis, tracto piramidal y braquium conjunctivum.
Figura 3
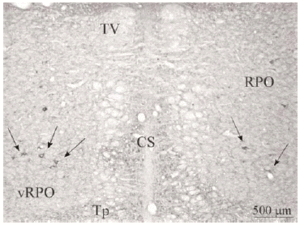
El tegmento pontino oral se caracterizó por contener somas inmunorreactivos para DOR a diferencia de la mayoría de otras estructuras. Estos somas mostraron una tendencia llamativa a concentrarse más en porciones ventrales que dorsolaterales del tegmento (ver Figura 2). Algunas otras estructuras donde se pudieron observar somas neuronales inmunorreactivos fueron: los núcleos del puente, el complejo olivar superior, el núcleo rafe magnus, núcleo reticular tegmental, núcleo dorsal del rafe, núcleo tegmental laterodorsal, núcleos cocleares, núcleos del lemnisco lateral, locus coeruleus, sustancia gris periacueductal y colículo inferior.
Microscopía electrónica
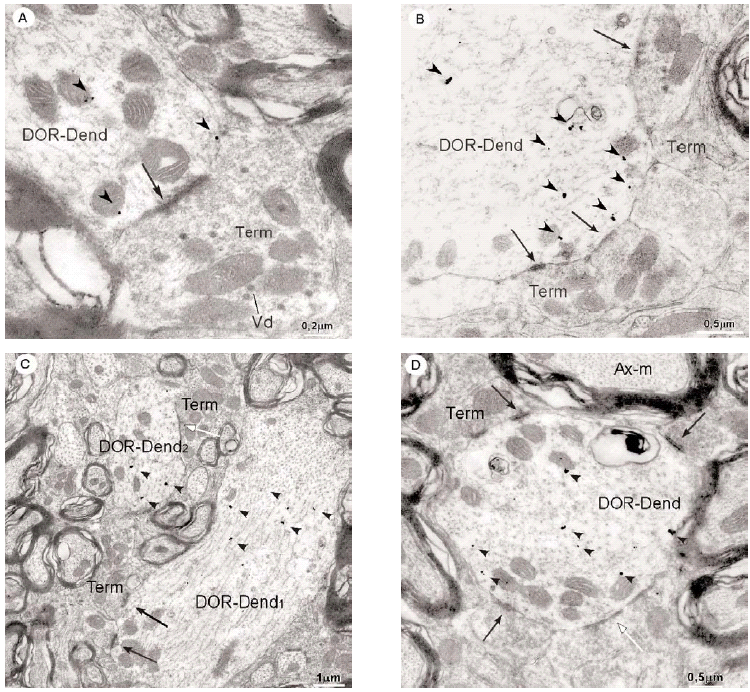
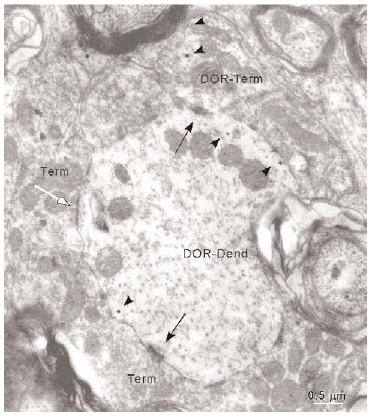
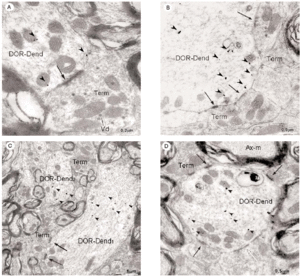
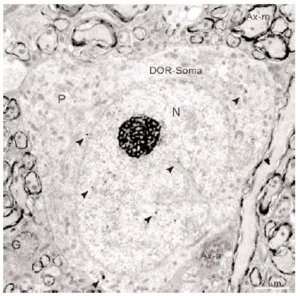
En el microscopio electrónico la inmunorreactividad para DOR en el vRPO mediante el método inmunogold se localizó principalmente en dendritas de tamaño intermedio grande (2 7 μm de diámetro) (n = 634; 55%) (Fig. 4). El resto del marcaje para DOR estuvo distribuido en terminales axónicos (n = 237; 21%), axones no terminales [mielínicos (n = 164; 14%) y amielínicos (n = 59; 5%)], somas neuronales (n = 30; 3%) (Fig. 5) y glía (n = 12; 1%). La mayor parte de las partículas de inmunogold estuvieron localizadas en el compartimiento intracitoplásmico, tanto en las dendritas como en los terminales (Fig. 4).
Figura 4
Figura 5
Los ANOVAs demostraron que la densidad de perfiles marcados para DOR por unidad de área (μm2) fue significativamente diferente entre los distintos bloques (F10,296 = 7,631; p = <0,0001 y F10,296 = 2,122; p = 0,0227 para dendritas y terminales, respectivamente), lo que posiblemente refleja diferencias en la fijación del tejido entre los distintos animales.
Inmunorreactividad DOR en dendritas
La mayoría (634/1136) de perfiles inmunorreactivos para DOR en el vRPO fueron dendritas (Fig. 4), cuyos diámetros oscilaron entre 0.5 y 7 μm. En estas dendritas, la inmunorreactividad para DOR estuvo localizada principalmente en el citoplasma (n = 2746; 87%), y en una menor proporción en la membrana plasmática (n = 424; 13%). La densidad de la inmunorreactividad DOR dendrítica fue significativamente mayor en el citoplasma (número de partículas en el citoplasma dendrítico/área de tejido examinada) que en la membrana plasmática (número de partículas en la membrana dendrítica/área de tejido examinada) (t306 = 15,621; p = <0,0001). Cuando se consideraron únicamente las dendritas inmunorreactivas para DOR, el marcaje asociado al compartimento intracitoplásmico (número de partículas en el citoplasma/número de dendritas inmunorreactivas) también fue significativamente mayor que el marcaje asociado a la membrana plasmática (número de partículas en la membrana plasmática/número de dendritas inmunorreactivas) (t292 = 14,143; p = <0,0001).
Los terminales inmunorreactivos para DOR representaron únicamente el 17% (191/1133) del número total de sinapsis recibidas por las dendritas inmunorreactivas para DOR en el vRPO, mientras que el resto de terminales aferentes (83%) no presentaron marcaje para DOR (942/1133). Del total de contactos sinápticos sobre las dendritas inmunorreactivas para DOR un 64% presentaron morfología asimétrica y un 36% simétrica.
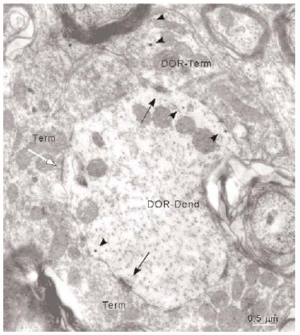
Inmunorreactividad DOR en terminales
De todos los perfiles inmunorreactivos para DOR en el vRPO, los terminales axónicos representaron el 21% (237/1136); su diámetro osciló entre 0.4 2.2 μm (Fig. 6). Estos terminales contuvieron en su mayoría pequeñas vesículas (40 60 nm) sinápticas de tipo claro; en pocas terminales se observaron vesículas grandes de centro denso (90 100 nm) (Fig. 4a). Las partículas de inmunogold se localizaron esencialmente en el citoplasma (88%). El resto de partículas se localizó en la membrana plasmática del terminal sin relación con las especializaciones sinápticas. La densidad de la inmunorreactividad DOR en terminales localizada en el citoplasma (número de partículas en el citoplasma del terminal/área de tejido examinada) fue significativamente mayor que la localizada asociada a la membrana plasmática (número de partículas en la membrana del terminal/área de tejido examinada) (t306 = 7,437; p = <0,0001). Cuando se consideraron únicamente los terminales inmunorreactivos para DOR, el marcaje asociado al compartimento intracitoplásmico (número de partículas en citoplasma/número de terminales inmunorreactivos) también fue significativamente mayor que el marcaje asociado a la membrana plasmática (número de partículas en membrana plasmática/número de terminales inmunorreactivos) (t143 = 15,692; p = <0,0001).
Figura 6
La mayoría de terminales inmunorreactivos para DOR establecieron sinapsis con dendritas marcadas que contenían DOR (93%; 191/206), cuya morfología fue principalmente de tipo asimétrico (64%; 123/191) (ver Figura 4).
DISCUSIÓN
Diversos estudios han demostrado que el vRPO es el organizador de la red neuronal responsable de generar los fenómenos bioeléctricos del sueño REM (9,10,11). Además, las múltiples conexiones que tiene el vRPO con las estructuras responsables de controlar otros estados del CVS, proporcionan una base anatómica para la alternancia entre las diferentes fases del CVS mediante la interacción recíproca de sus elementos 9, 12, 13. Esto implica que sobre el vRPO actúa una gran variedad de neurotransmisores y/o neuromoduladores como la serotonina, acetilcolina, glutamato, histamina, GABA y péptidos opioides 16-21, que producirán diferentes efectos fisiológicos según el tipo de neurotransmisor, el/los receptor/es que activen y la localización celular de éste/os. Nuestros resultados confirman los hallazgos de otros estudios realizados sobre la distribución de receptores opioides en el tronco del encéfalo de la rata que han utilizado técnicas de autorradiografía 39-41, hibridación in situ42-44 e inmunohistoquímica 45-48. Hasta donde sabemos, este es el primer estudio inmunohistoquímico sobre la localización de DOR en el puente y la localización ultraestructural en el vRPO del gato, una especie ampliamente utilizada en los estudios del CVS. En nuestro estudio demostramos la amplia distribución que tiene DOR en el tegmento pontino, así como en otras estructuras del tronco del encéfalo del gato. A nivel ultraestructural en el vRPO, DOR se localizó principalmente en perfiles postinápticos de mediano y gran tamaño, los cuales en general recibían sinapsis asimétricas (presumiblemente excitatorias) de terminales axónicos de diferentes tamaños. En conjunto, nuestros resultados sugieren que la activación de DOR en el vRPO principalmente modula respuestas postsinápticas a otros neurotransmisores.
Consideraciones metodológicas
Se utilizó un anticuerpo policlonal DOR desarrollado en conejo y dirigido contra la porción amino-terminal de DOR (AA 3-17). Este anticuerpo ha sido empleado con anterioridad en otros estudios realizados en tejido de rata y ratón 45, 51, 57. El presente estudio es el primero realizado con este anticuerpo en tejido de gato, y aunque la señal es específica de acuerdo a los controles efectuados, la inmunorreactividad es moderada en comparación con las especies anteriormente mencionadas.
Distribución inmunohistoquímica de DOR
en el puente
Los estudios realizados hasta el momento en rata describen la presencia de DOR en la formación reticular del puente sin hacer diferencias entre distintos sectores del tegmento 45, 47. Nuestros datos muestran que en el tegmento pontino del gato, el marcaje para DOR en el neuropilo es más intenso en zonas dorsolaterales y ventrales y los somas neuronales inmunorreactivos para DOR tienen una localización preferencial en zonas ventrales (vRPO) y centrales del tegmento pontino. Al igual que en otros estudios previos realizados en rata 45, 47, hemos observado en el puente inmunorreactividad para DOR en el tegmento, núcleos cocleares, complejo trigeminal, complejo olivar superior, núcleos central superior y dorsal del rafe, locus coeruleus, núcleo tegmental laterodorsal y núcleos parabraquiales.
Una observación novedosa de nuestro trabajo fue la presencia de inmunorreactividad DOR en estructuras pertenecientes al sistema auditivo, como los núcleos del lemnisco lateral y el nervio coclear. Aunque varios trabajos demuestran la presencia de encefalina, dinorfina y otros péptidos opioides en las vías auditivas 70, 61, 62 hasta el momento no había sido descrita la presencia de receptores opioides en estas estructuras.
La gran mayoría del marcaje para DOR en nuestro material se localizó en perfiles postsinápticos del compartimiento somatodendrítico. Este hallazgo estaría de acuerdo con resultados obtenidos en la rata en otras regiones del SNC, como la corteza insular 65, giro dentado 66, hipocampo 67 y núcleo dorsal del rafe 68. No obstante, estudios inmunohistoquímicos utilizando el mismo anticuerpo 45, 51, 57 u otros diferentes 69, 70, 67 han demostrado que DOR puede existir tanto pre como postinápticamente en otras regiones del SNC, lo que demuestra la gran variabilidad que existe en la localización subcelular de este receptor en distintas estructuras. Con relación al vRPO específicamente, resultados obtenidos en nuestro laboratorio demuestran que los receptores opioides delta comparten la misma localización postsináptica que los tipo mu 54. Debido a que la activación de receptores opioides produce una hiperpolarización celular 71, 72, nuestros resultados sugieren que la activación de DOR podría modificar la transmisión del estímulo mediante dos mecanismos: 1) interfiriendo con la respuesta post-sináptica a diferentes neurotransmisores liberados en el vRPO y/o, 2) disminuyendo la liberación de distintos neurotransmisores en el vRPO.
En el vRPO, el DOR presente en localización postsináptica muy probablemente está contenido en neuronas GABAérgicas; estas neuronas abundan en el vRPO y además el GABA colocaliza con receptores opioides en muchas otras estructuras del sistema nervioso central 73, 74, 75, 76. La activación de receptores opioides delta en neuronas gabaérgicas produciría una hiperpolarización celular, disminuyendo la neurotransmisión gabaérgica en el vRPO. En favor de esta hipótesis, experimentos con microinyecciones restringidas en el vRPO han demostrado que mientras la estimulación con agonistas gabaérgicos (muscimol) produce aumento de la vigilia 18, la estimulación con opioides (morfina) produce aumento de sueño 20. La mayoría de las dendritas inmunorreactivas para DOR establecían sinapsis de morfología asimétrica con terminales axónicos sin marcaje para DOR. Estas especializaciones sinápticas son típicamente excitatorias y muy posiblemente glutamatérgicas 56, ya que el glutamato es el neurotransmisor excitatorio más abundante del SNC.
Sin embargo, también encontramos en menor medida DOR a nivel presináptico en terminales axónicos, lo que nos sugiere que la activación de receptores opioides delta en el vRPO también podría regular la liberación de neurotransmisores como posible mecanismo de acción. Esta localización presináptica de DOR ha sido observada en roedores en otras regiones del SNC, como la sustancia gris periacueductal 51 y el área postrema 77. La presencia de DOR en terminales axónicos no pudo atribuirse a ninguno de los tipos morfológicos descritos en el vRPO por De la Roza y Reinoso-Suárez 29, aunque predominaron los terminales de tipos I, II y V.
El hecho de que en vRPO sólo una pequeña parte de los receptores opioides delta se encontrara asociada a la membrana plasmática dendrítica hace pensar que, bajo condiciones basales la mayoría de receptores DOR se encuentran dentro del citoplasma, y posiblemente se movilizan hacia la membrana plasmática ante determinadas circunstancias puntuales. Este fenómeno ha sido estudiado recientemente en neuronas corticales y asta posterior de la médula espinal en rata, observándose una movilización de receptores delta hacia la membrana plasmática tras la exposición a morfina 78.
CONCLUSIONES
1) En el tegmento del puente la inmunorreactividad DOR es discreta, pero las neuronas DOR positivas abundan en las porciones ventrales (vRPO) y centrales.
2) En el vRPO, DOR tiene una localización subcelular principalmente intracitoplasmática en perfiles dendríticos.
3) Las acciones de los agonistas de DOR en el ciclo vigilia-sueño mediadas por el vRPO se deberían fundamentalmente a la modulación de la excitabilidad neuronal a nivel postsináptico.
Este trabajo recibió el Premio Javier Espinar en la XII Reunión Anual de la AIPS, celebrada en Madrid, Junio de 2003.