Estudio vídeo-polissonográfico em doente com suspeita de insónia familiar fatal
RESUMO
Objectivo. Demonstrar as alterações neurofisiológicas e comportamentais do ciclo vigília-sono, características da Insónia Familiar Fatal (IFF), em doente com suspeita clínica e diagnóstico genético posterior.
Doente e Métodos. Doente do sexo masculino, 39 anos. História familiar compatível com IFF. Ao longo de 5 meses apresentou impotência, insónia progressiva e episódios diurnos de sono com apneias, mioclonias e automatismos gestuais. Ao ser internado havia diplopia, hipertensão arterial e hiperhidrose. Realizamos monitorização com Vídeo-Polissonnografia durante 24 horas. Cada segundo foi classificado de acordo com os critérios de Sforza (1995).
Resultados. Vigília: olhos fechados, actividade motora em membros inferiores, ritmo alfa posterior a 8-9 Hz, reactivo. Sono : breves episódios de sono "NREM" e "REM", com características atípicas, ausência de sono profundo e diminuição dos fusos, com mioclonias, gesticulação e apneias. Insónia inicial. Após administração de alprazolam (1 mg via oral e 0,5 mg sublingual) : padrão "NREM" durante 3 horas, sem actividade motora e sem apneias.
Discussão e Conclusões . Os achados polissonográficos foram caracterizados por grave alteração da organização cíclica do sono, diminuição do tempo total de sono e padrões atípicos de sono "NREM" e "REM". A administração de alprazolam permitiu aumentar o sono nocturno, com abolição das mioclonias e apneias.
Palavras-chave: Insónia familiar fatal. Enfermidade priónica hereditária. Alteração do ciclo vigília-sono. Vídeo-polissonografia.
INTRODUCCIÓN
Desde que Lugaresi et al1 describieran por primera vez, en 1986, las características clínicas y patológicas del insomnio familiar fatal, se han recogido en la literatura médica al menos un centenar de casos2-17. Dentro de las tradicionalmente llamadas encefalopatías espongiformes, actualmente conocidas como enfermedades priónicas18-21 provocadas por el depósito en el cerebro de una proteína anómala, el insomnio familiar fatal (IFF) es una enfermedad atípica, generalmente hereditaria22, con transmisión autosómica dominante y penetrancia incompleta, asociada a una mutación puntual (GAC-AAC) en el codón 178 (D178N) del gen de la proteína priónica (PRNP), localizado en el brazo corto del cromosoma 20, que provoca la sustitución del ácido aspártico por asparragina, con la expresión obligatoria de metionina en el codón 129 de los alelos mutados del mismo gen (genotipo D178N129M)23,24.
Patológicamente se caracteriza por atrofia casi selectiva de los núcleos talámicos anteroventral (AV) y dorsomedial (DM), que se encuentran gravemente afectados1,2,8,9,15. También puede encontrarse afectación consistente de estructuras límbicas corticales, así como de los núcleos olivares y en menor grado otros núcleos talámicos, ganglios de la base, córtex cerebral y cerebelar. La espongiosis cortical sólo aparece en casos de evolución prolongada. La enfermedad se produce por acumulación de una proteína prion resistente a proteasas en el citoplasma celular de estas estructuras; el depósito más temprano y estable es en el tálamo, donde se desarrollan las lesiones más graves25-29.
Clínicamente multisistémica y heterogénea en su edad de inicio (40-60 años), duración (7-37 meses) y síntomas predominantes2,16, cursa con una grave alteración del ciclo vigilia-sueño16,30 con imposibilidad para generar sueño fisiológico, apareciendo insomnio progresivo y generándose sólo breves episodios de sueño, asociados de forma típica a conductas motoras oníricas, llevando todo ello a un progresivo deterioro de la capacidad de atención y del estado de vigilia31; el desequilibrio en el control de los ritmos circadianos de secreción hormonal y autonómicos32,33 se manifiesta por diversos signos y síntomas, resultantes de la pérdida sus fluctuaciones circadianas debida a una hiperactividad simpática, tales como hipertensión arterial34, hiperpirexia, hiperhidrosis, taquicardia, respiración irregular, miosis, alteraciones urinarias, impotencia en varones, estreñimiento, amenorrea, pérdida de peso, hipercortisolemia y aumento de las catecolaminas; las manifestaciones neurológicas descritas incluyen diplopía, disfagia, disartria, hiperreflexia osteotendinosa, mioclonías, distonía, ataxia de la marcha y piramidalismo16.
En función de la duración del cuadro hasta su final fatal y su relación con el polimorfismo del alelo no mutante del codón 129, se han descrito 2 variantes de IFF: un grupo de curso breve inferior a 1 mes desde el inicio de los síntomas y homocigóticos para la metionina (M129M), en los que los estados oníricos y el insomnio son más manifiestos, y otro de evolución más prolongada y heterocigosis valina-metionina (V129M), en los que los síntomas neurológicos son más acentuados e iniciales35,36.
Los hallazgos neurofisiológicos que se desprenden de los estudios electroencefalográficos (EEG) y polisomnográficos realizados en estos pacientes se caracterizan por alteración tanto de la macro como de la microestructura de sueño1,4,5,16,22,30,36. El más común y temprano, una vez que comienza la clínica, afecta a los grafoelementos de sueño indicativos de los estados de transición entre vigilia y sueño y del sueño superficial que precede en sujetos normales tanto al sueño de ondas lentas como al sueño REM, tales como complejos K, ondas de vértex y fundamentalmente spindles de sueño, que aparecen pobremente definidos, disminuidos o ausentes. Se asocia a una marcada disminución de la actividad de ondas lentas y bruscas transiciones de sueño no REM y REM desde la vigilia, con descargas atípicas de ondas lentas, sueño REM con a sin atonía y disminución progresiva del tiempo total de sueño. En vigilia, el ritmo alfa posterior reactivo y simétrico muestra una progresiva disminución en amplitud y frecuencia con actividad theta intermitente, haciéndose menos reactivo y difundiendo a regiones anteriores. Se ha descrito actividad periódica o seudoperiódica, en forma de descargas agudas a 1-2 Hz sólo en las fases finales de los casos de curso prolongado5,9. Existe un marcado aumento de la actividad motora en el electromiograma asociado a la hiperactividad simpática, con pérdida de los patrones motores circadianos37,38.
PACIENTE Y MÉTODO
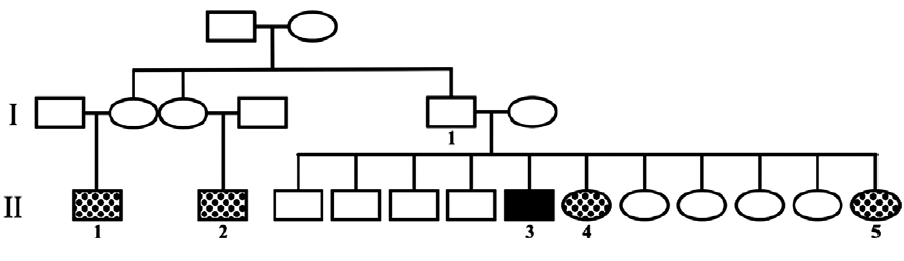
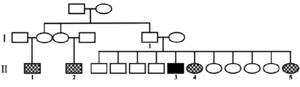
Se trata de un varón de 39 años de edad (75 kg de peso y 173 cm de altura), con antecedentes familiares de esta enfermedad; 2 primos paternos y 2 hermanas a los 28 y los 56 años, respectivamente, habían fallecido con síntomas de IFF, la última con diagnóstico genético compatible (fig. 1).
Figura 1. Familiares del paciente del caso. I.1: sin síntomas de insomnio familiar fatal (IFF), fallecido a los 70 años por otra causa; II1 y II 2: fallecidos con síntomas de IFF; II 3: paciente caso, mutación D178N M129M; II 4: fallecida a los 56 años con síntomas de IFF confirmado genéticamente; II 5: fallecida a los 28 años con síntomas de IFF.
No presentaba antecedentes personales de interés y tenía historia de sueño normal; durante los 5 meses previos al estudio el curso clínico del paciente fue el siguiente: inicialmente, durante aproximadamente 2 meses y coincidiendo con la época estival y con un cambio de trabajo y domicilio, comienza con dificultad para conciliar el sueño, junto con hipersudación profusa, disminución de la libido e impotencia. Sin embargo, en los 3 meses posteriores los problemas de sueño empeoran progresivamente, presentando insomnio de inicio y mantenimiento, llegando a dormir sólo 1 h escasa, aproximadamente a las 6 de la mañana, en las últimas semanas previas al registro (tiempo total de sueño previo de 7-8 h/día). Asociado al insomnio presenta gran inquietud en miembros inferiores, inicialmente durante la noche y después también durante el día. Mientras duerme los familiares describen episodios de apnea, no observados previamente, y gesticulaciones. Abandonó su trabajo por gran agotamiento, cansancio e hipersomnolencia durante el día, con tendencia al sueño en forma de breves y frecuentes episodios. Acudió a urgencias por presentar cefalea holocraneal de carácter continuo, que se resolvió en unas horas, y diplopía aguda horizontal a partir de 1,5 m de distancia, que permaneció con mejoría al tercer día. A la exploración, la diplopía aumentaba con la mirada a la izquierda y desaparecía con la oclusión monocular. Las pupilas eran isocóricas y lentamente reactivas, con fondo de ojo normal. Los reflejos osteotendinosos aparecían exaltados y se evidenciaba un temblor fino distal. La medición de la presión arterial se mostró elevada (180/100 mmHg) y durante el ingreso el paciente estaba irritable e inquieto, y presentó estreñimiento e hipersudación.
Los resultados del hemograma, la bioquímica, el estudio inmunológico, así como la tomografía computarizada (TC) y la resonancia magnética (RM) no mostraron hallazgos valorables. El estudio realizado en el líquido cefalorraquídeo también resultó negativo para la detección de la proteína 14-3-3. El registro EEG de vigilia presentó ritmo alfa posterior de características normales y sin actividades periódicas.
Realizamos un estudio videopolisomnográfico durante 24 h de forma ininterrumpida, mediante un equipo poligráfico digital (Profile). Se controló la actividad electroencefalográfica mediante electrodos de superficie dispuestos según el Sistema Internacional 10-20 de emplazamiento de electrodos y electrodos adicionales cigomáticos. Se registró la actividad electromiográfica en la zona submentoniana y en ambas regiones tibiales anteriores y los parámetros cardiorrespiratorios mediante electrocardiograma, sensor de flujo buconasal, banda abdominal y oximetría. Dada la difícil identificación de los estadios de sueño típicos y la corta duración de los ciclos de sueño, que impidieron el uso de los criterios de clasificación por épocas de Rechtschaffen y Kales (1968), cada segundo de registro fue visualmente clasificado de acuerdo con los criterios definidos por Sforza et al5, basándose en esta dificultad, en un estudio sobre las alteraciones del sueño y su relación con el curso clínico de 6 nuevos casos de IFF.
Posteriormente al registro, se conocieron los resultados del estudio genético para el gen de la PRNP; se encontró la mutación D178N (sustitución del ácido aspártico por asparragina en el codón 178 del gen de la PRNP) y un polimorfismo en el codón 129 homocigótico para el aminoácido metionina (M129M), que sugerían la existencia de un IFF.
RESULTADOS
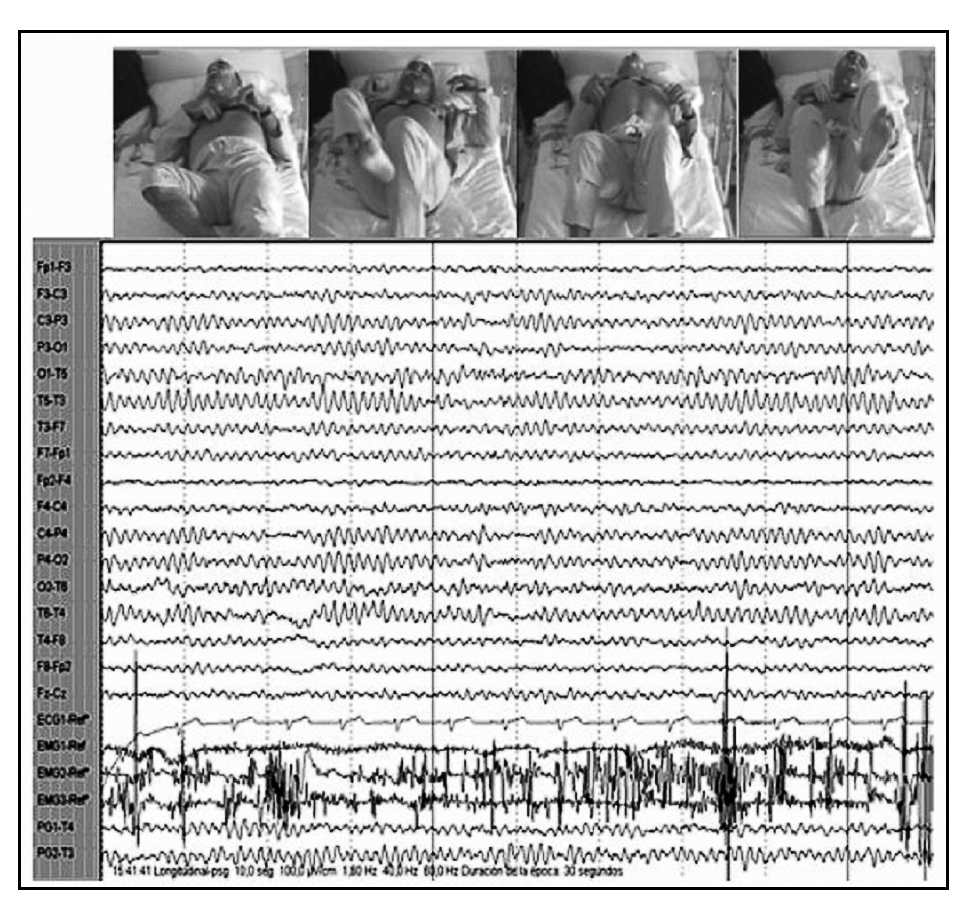
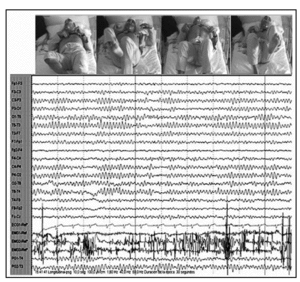
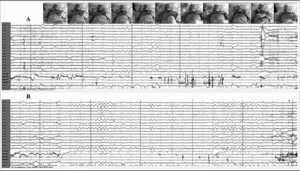
Durante la vigilia relajada, el paciente mostraba desinterés por su entorno e incapacidad para mantener la atención, permaneciendo con frecuencia con los ojos cerrados, aunque respondía rápidamente a cualquier estímulo, y presentando actividad motora casi continua en el tronco y los miembros inferiores. El registro electroencefalográfico mostraba un ritmo alfa posterior a 8-9 Hz, sincrónico, simétrico y reactivo a estímulos, con abundante actividad electromiográfica (fig. 2).
Figura 2. En vigilia, ojos cerrados y frecuente actividad motora. Ritmo alfa posterior reactivo a 8-9 Hz y abundante actividad electromiográfica.
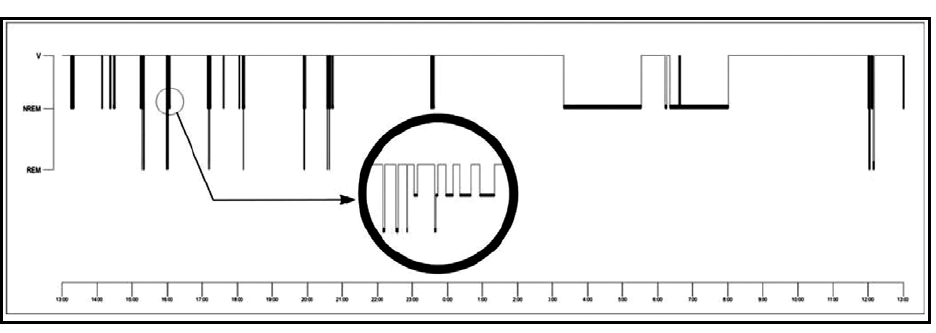
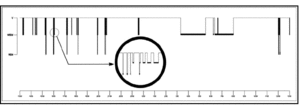
El patrón de sueño de este paciente, como se observa en el hipnograma de 24 h, se caracterizó por gran fragmentación del sueño durante el horario diurno, en forma de breves períodos de segundos de duración, todos inferiores a 1 min e incluso algunos de 5 s, que recurrían agrupadamente, alrededor de 8 a 12 períodos de sueño cada hora, en los que diferenciamos 2 tipos de actividad que remedaban de forma atípica al sueño no REM y REM. Ambas actividades aparecían de forma casi instantánea desde la vigilia relajada, aisladas o en asociación en un mismo período de sueño (fig. 3). El número total de estos episodios diurnos de sueño fue de 83, con 66 clasificados como sueño no REM (82,8%), que sumaban en total un tiempo de 27 min, y 17 clasificados como sueño REM (17,2%), con duración global de 5,6 min (tabla 1).
Figura 3. Hipnograma de 24 h. Obsérvese en detalle un grupo de breves episodios de sueño no REM y REM, aislados e incluso asociados en un mismo período de sueño.
El patrón de sueño REM se caracterizó por una actividad de frecuencias mixtas, desincronizada y de bajo voltaje, asociada a movimientos oculares rápidos en presencia o no de atonía muscular, y presentando con frecuencia gesticulaciones con los miembros superiores, señalando y contando con los dedos o realizando movimientos de escritura con la mano derecha, así como automatismos orofaciales y somniloquia.
El patrón de sueño no REM presentaba descargas atípicas de ondas delta de elevado voltaje directamente desde la vigilia, algunas puntas de vértex y complejos K, sobre un patrón de frecuencias mixtas de relativo bajo voltaje, sin que aparecieran ritmos típicos de sueño profundo (fig. 4).
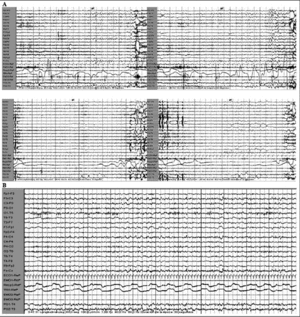
Figura 4. A. Episodio de sueño "REM" de 16 s, constituidos por una actividad desincronizada con movimientos oculares rápidos y aumento del tono muscular, asociado a gesticulaciones. B. Episodio de sueño "NREM" de 19 s, con descargas atípicas de ondas delta de elevado voltaje y algunas puntas de vértex. Observése la rápida transición de ambos episodios de sueño desde la vigilia.
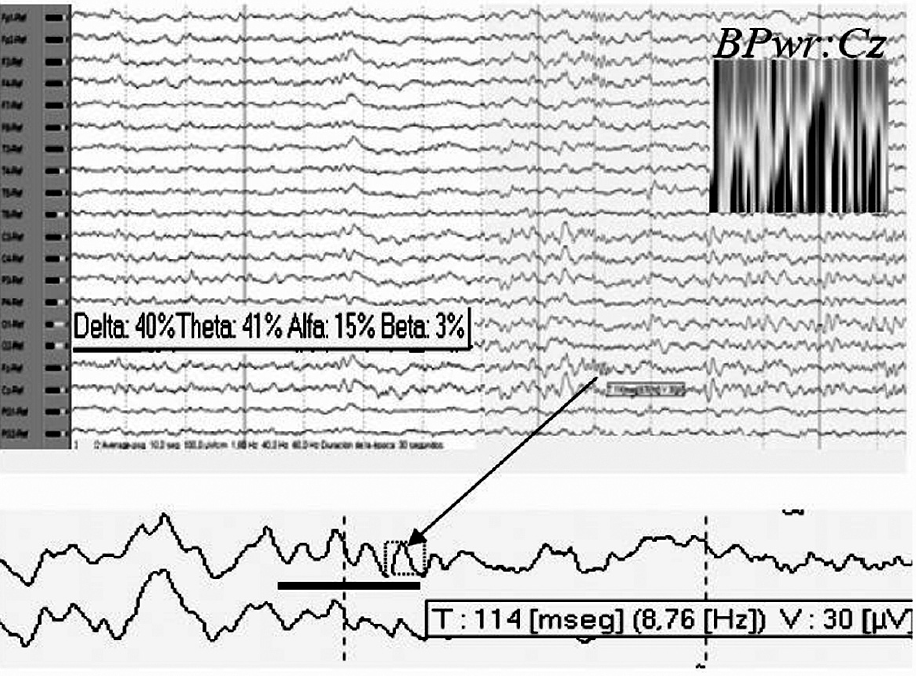
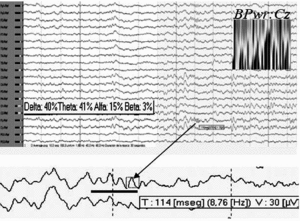
El análisis de la potencia de banda para el electrodo Cz durante todos los períodos no REM mostró predominio de frecuencias theta-delta, en menor grado alfa y beta prácticamente ausente. Por otra parte, y teniendo en cuenta las características de los trenes de sueño típicos de los adultos sanos registrados en superficie, observamos que los escasos complejos K que aparecían en esta fase de sueño, de forma muy ocasional asociaban ritmos que por su duración (≤ 0,5 s), morfología (menos aguda y monomorfa) y frecuencia (< 10 Hz) de sus ondas individuales, pudieran corresponder con la denominada por otros autores "actividad spindle residual o pobremente formada"5, sin que aparezca en la literatura médica representación iconográfica de ésta (fig. 5).
Figura 5. Análisis de la potencia de banda para Cz durante los períodos de sueño no REM. En detalle, ritmos que pudieran corresponder con actividad spindle residual.
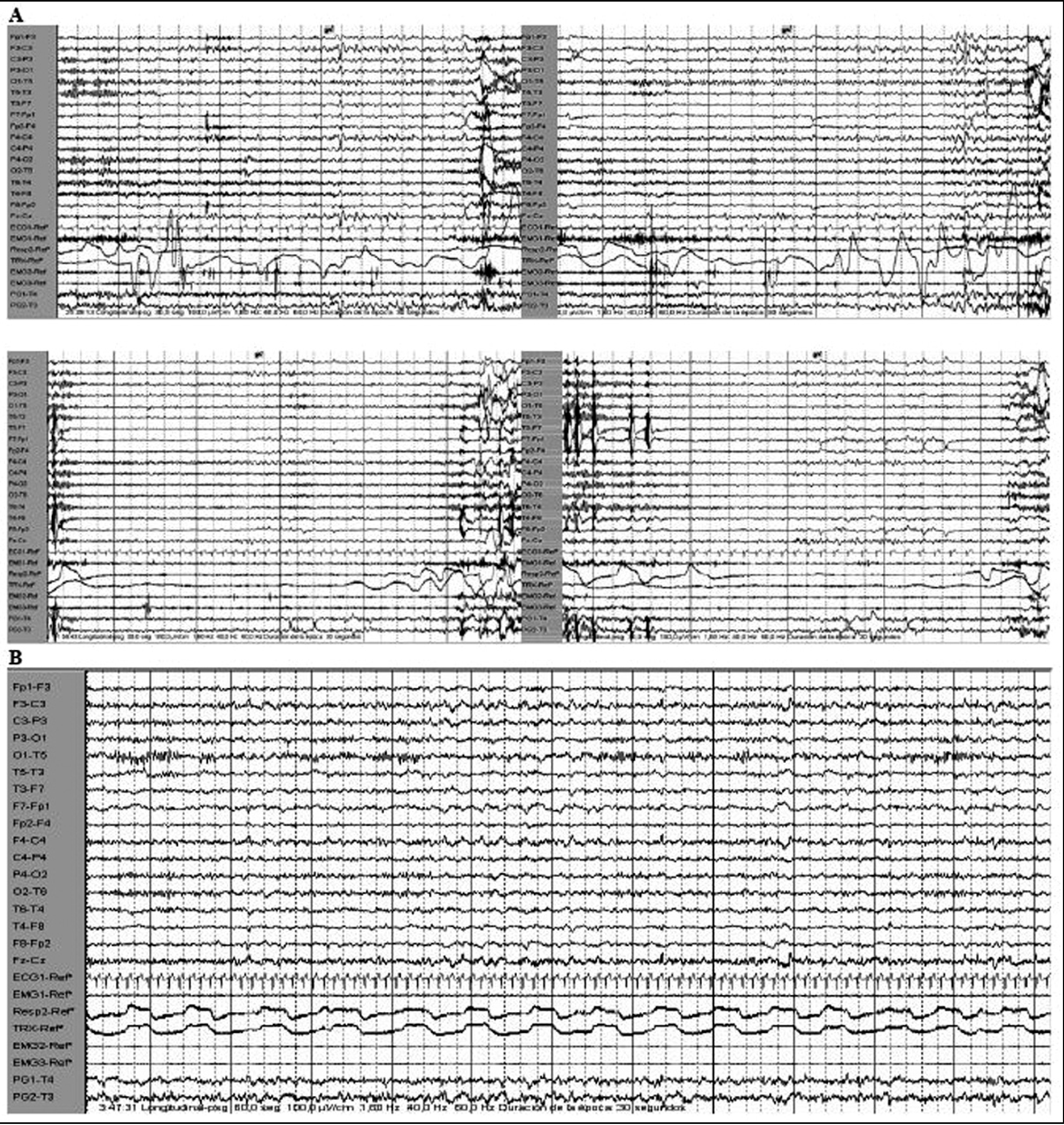
Los episodios de sueño se acompañaban de frecuentes mioclonías del tronco y los miembros inferiores, y de forma invariable aparecían episodios de apnea, fundamentalmente centrales y mixtas, que finalizaban con inspiración forzada, ronquido y despertar. Durante el horario de sueño nocturno, a partir de las 23:30 h, el paciente presentó imposibilidad para conciliar el sueño y gran inquietud motora, por lo que se le administró alprazolam (1 mg por vía oral y 0,5 mg sublingual), tras lo cual apareció un patrón de sueño no REM durante 3,5 h con algunos despertares espontáneos intrasueño, presentando escasos complejos K, actividad spindle disminuida y ausencia de fases profundas de sueño. Durante el sueño nocturno, el paciente quedó tranquilo; desaparecieron la actividad motora y los episodios de apnea y ronquido (fig. 6).
Figura 6. A: en cada período de sueño, episodios de apnea que finalizan con la inspiración forzada y despertar. Los registros superiores e inferior izquierdo muestran fases no REM y el inferior derecho fase REM. B: tras alprazolam (1 mg por vía oral y 0,5 mg sublingual), patrón no REM durante 3,5 h, sin actividad y sin apneas.
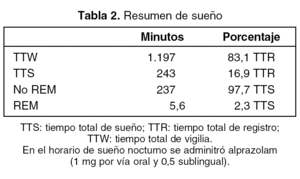
En resumen, durante las 24 h de registro, el tiempo total de vigilia fue de 20 h (1.197 min) y el tiempo total de sueño de 4 h (243 min), correspondiendo el 97,7% a sueño no REM y el 2,3% a sueño REM (tabla 2).
DISCUSIÓN Y CONCLUSIONES
De acuerdo con los hallazgos neurofisiológicos obtenidos por otros autores en pacientes con IFF, los resultados de nuestro estudio en este paciente con sospecha de la enfermedad demostraron una importante incapacidad para producir un patrón cíclico fisiológico de las actividades típicas del sueño REM y no REM. La casi completa desaparición de los husos de sueño, posiblemente presentados en este paciente únicamente como trenes de actividad que remedan a los spindles de sueño típicos, pero de frecuencia más baja, menos monomorfos y más recortados en su duración, junto con la marcada disminución o ausencia de la actividad típica del sueño de ondas lentas, también hallada en él, se han descrito como las alteraciones clave más tempranas del EEG de sueño36, confirmadas por análisis espectral5 y sólo evidentes a partir del inicio clínico de la enfermedad, que no se encontraron entre los pacientes asintomáticos portadores de la mutación asociada en el IFF; en éstos el daño talámico era el causante de las alteraciones clínicas y EEG39. Otros hallazgos polisomnográficos característicos de esta enfermedad, como las bruscas transiciones desde la vigilia a sueño no REM y REM, a veces con recurrencia cuasiperiódica, con descargas atípicas del sueño de ondas lentas y sueño REM con o sin atonía, junto con una importante reducción del tiempo total de sueño, también se constataron en este paciente, lo que confirma las características distintivas neurofisiológicas resultantes de la temprana disrrupción de la organización rítmica sueño-vigilia que acontece en el IFF desde su inicio clínico. Por tanto, resulta determinante el análisis neurofisiológico temprano de la estructura de sueño de estos pacientes; uno de los requisitos para el diagnóstico de IFF es la demostración de las alteraciones del sueño mediante polisomnografía40.
Durante el control neurofisiológico de los pacientes con IFF y en forma de ensayo terapéutico se administraron algunos fármacos inductores del sueño, en un intento de inducir actividad spindle y sueño de ondas lentas. El uso de benzodiacepinas y barbitúricos por vía intravenosa sólo causaron enlentecimiento o aplanamiento de la actividad EEG, e incluso coma, sin provocar las actividades típicas del sueño inducido por estos fármacos1,30. En un caso la administración de gammahidroxibutirato, inductor de sueño de ondas lentas, indujo este sueño durante unas 3 h, lo que sugiere que su práctica ausencia en el IFF pudiera responder no sólo a las lesiones neuropatológicas subyacentes sino también a una supresión funcional de éste al menos parcialmente reversible4. Por otra parte, es posible que se genere actividad delta en áreas del neocórtex41. Tras la administración de alprazolam (1 mg por vía oral y 0,5 mg sublingual) en nuestro paciente durante el seguimiento, aparecieron 3,5 h de sueño, que si bien no se acompañó de actividad sigma ni sueño de ondas lentas, permitió aumentar el tiempo total de sueño respecto de su duración en los días previos.
Debido a que tanto la presencia de grafoelementos de sueño implicados en su inicio y mantenimiento como el sueño de ondas lentas se han relacionado con el buen funcionamiento de los mecanismos de sincronización cortico-talámicos42, el decremento temprano de ambas actividades en el IFF, junto con la dificultad de su inducción farmacológica en estos pacientes, permite deducir que las lesiones neuropatológicas implicadas deben producir un bloqueo funcional parcial o total de la generación de actividades de sueño sincronizadas. Por tanto, la correlación de los hallazgos EEG y anatomopatológicos en el IFF indican que los núcleos talámicos AV y DM están probablemente implicados de forma directa o indirecta en la regulación del ciclo vigilia-sueño. De hecho se ha postulado que la desaparición temprana de los spindles de sueño en el IFF sea consecuencia de la atrofia del núcleo dorsomedial del tálamo, el cual mantiene conexiones con el núcleo reticular talámico considerado generador de los husos de sueño5,43.
El hallazgo de la presencia de episodios de apnea durante el sueño de este paciente, que no se habían observado previamente antes del inicio clínico de la enfermedad, no resulta sorprendente, teniendo en cuenta que, aunque no es una característica clínica usual del IFF, las complicaciones respiratorias se han descrito no en pocos pacientes con esta enfermedad (10 casos). Ya, en el caso inicial de Lugaresi1, se informa de la existencia de respiración ruidosa, taquipneica e irregular con frecuentes apneas. De forma similar, en otros pacientes aparecieron disturbios respiratorios varios que incluían respiración irregular12,15,17, episodios de apnea 4,12,17,35, taquipnea6,17, bradipnea4, estridor inspiratorio4,15, disnea15,17, distrés respiratorio44, movimientos paradójicos inspiratorios de las cuerdas vocales4 e incluso necesidad de ventilación mecánica17. Se ha especulado que las alteraciones respiratorias en el IFF podrían relacionarse con la afectación del núcleo reticular bulbar, a partir de los resultados del análisis anatomopatológico de un paciente, perteneciente a una familia española afectada17, que asociaba alteraciones respiratorias y presentaba pérdida neuronal en este núcleo, junto con los hallazgos neuropatológicos de una familia austríaca15, con importante afectación troncoencefálica y del núcleo reticular. Sin embargo, en el IFF el troncoencéfalo no suele afectarse salvo en la zona de la oliva inferior. Pudiera ocurrir que la afectación del núcleo bulbar no fuera tan consistente en el resto de los pacientes con trastornos respiratorios o bien que el examen anatomopatológico del troncoencéfalo hubiese sido menos exhaustivo.
Se ha especulado la posible influencia de las complicaciones respiratorias en el curso acortado en el grupo de pacientes homocigóticos para la metionina en el codón 12917. Cuando se realizó un estudio genético en los pacientes con alteraciones respiratorias, siempre presentaron este polimorfismo genético y tuvieron un curso clínico inferior a 11 meses hasta la muerte. Podemos incluir nuestro caso en este grupo, debido a su importante deterioro clínico en un corto período con final fatal a los 6 meses del estudio, junto con el resultado genotípico D178N-M129M, y probablemente por la presencia de complicaciones respiratorias asociadas. Aunque no tenemos una hipótesis definitiva para explicar el control de las apneas en nuestro paciente durante el sueño en horario nocturno, éste podría estar relacionado con una mayor preservación del control autonómico respiratorio que durante el sueño en horario diurno.
Debemos señalar como limitación de nuestro estudio, la imposibilidad de realizar controles posteriores debido a la negativa expresada por los familiares a causa del deterioro del paciente, que impidió describir la evolución del patrón de sueño y de los disturbios respiratorios, así como comprobar el efecto sobre el patrón de sueño de otros fármacos.
En resumen, podemos concluir que los hallazgos polisomnográficos durante 24 h en este paciente se caracterizaron por gran fragmentación y disminución del tiempo total de sueño, junto con ausencia de fases típicas de sueño profundo y descargas de ondas delta atípicas, sueño REM sin atonía y trenes de sueño o spindles poco formados o ausentes, todo ello concordante con los patrones de sueño descritos por otros autores en pacientes con IFF. La administración de alprazolam permitió en este caso aumentar la duración del sueño nocturno, con desaparición de las sacudidas motoras y apneas.
Por tanto, la posibilidad de un tratamiento eficaz capaz de aumentar en la mayor medida posible de forma continuada el tiempo total de sueño en estos pacientes, y mejorar así al menos su calidad de vida, depende de la realización de nuevos ensayos terapéuticos repetidos durante el seguimiento neurofisiológico, aunque limitados por la escasa prevalencia de la enfermedad y las dificultades en la realización del estudio en relación con el estado del paciente.
Aceptado tras revisión externa: 18-09-2006.
Correspondencia:
Dra. Y. Sánchez-González.
Servicio de Neurofisiología Clínica. Hospital Virgen de las Nieves.
Ctra. de Jaén, s/n. 18014 Granada. España.
Correo electrónico: ysancg@fundacionhvn.org