RECENT ISSUES IN THE DIAGNOSIS OF NARCOLEPSY
Luigi Ferini-Strambi, Cinzia Castronovo and Maria Livia Fantini
Sleep Disorder Center, San Raffaele Scientific Institute, Milan, Italy.
Narcolepsy is an uncommon but not rare sleep disorder, occurring in 0.05% of the population, and its diagnosis may be difficult. The typical patient is symptomatic for 10 years before the diagnosis is established. Multiple factors contribute to the challenge of diagnosing narcolepsy more quickly, particularly the extensive differential diagnosis of excessive daytime sleepiness, which comprise voluntary sleep restriction, obstructive sleep apnea, circadian rhythm disorders such as delayed sleep phase disorder, chemical dependency, and mood disorders.
Excessive daytime sleepiness (EDS) is considered the main complaint in narcolepsy. Multiple Sleep Latency Test (MSLT) is the most commonly used objective test to assess sleepiness and it measures an individual's ability to fall asleep. Sleep latency is assessed in 4 or 5 twenty-minute periods over 1 day, during which subjects lie in a dark and quiet room and try to fall asleep. Narcolepsy is diagnosed when the mean sleep latency is 5 minutes or less and 2 or more sleep-onset rapid eye movement (REM) periods (SOREMP) occur. Some authors consider a sleep latency of 8 minutes as the abnormality threshold. Indeed, this value would be the best cut-off in diagnosing narcolepsy, with approximately 90% of narcoleptic patients having a latency below this level. Sleep deprivation can lead to a false positive result on the multiple sleep latency test, since sleep debt increases REM pressure. Therefore MLST is considered valid only if at least six hours of polysomnographically-defined sleep have been recorded prior to daytime testing. It also recommended that adequate sleep be documented by sleep log or actigraphy for two weeks prior to the MSLT. Nonetheless, the validity of the MSLT in the diagnosis of narcolepsy has been recently questioned by several studies. Indeed, patients without sleep complaints may fulfil MSLT criteria for narcolepsy, while only 70% of patients with clear cataplexy do. Importantly, however, a significant portion of the general population may have a mean sleep latency equal to or less than eight minutes, especially if nocturnal sleep is not normalized prior to the MSLT. It should be noted that the new International Classification of Sleep Disorders-2 allows narcolepsy to be diagnosed by establishing a lack of hypocretin in the cerebrospinal fluid or by performing an MSLT. This new approach will remove the need to perform an MSLT in a number of cases, particularly in those with cataplexy.
A neglected but perhaps equally important complaint in narcolepsy is the impaired performance in the waking state, due to the inability to remain vigilant during the day. Recently, the Sustained Attention to Response Task (SART) test has been proposed as a tool to measure vigilance as an indicator of the severity of narcolepsy. One study compared SART to the MSLT, known to reflect the tendency to fall asleep. There was clear evidence that both tests measured different phenomena: indeed there was no correlation between MSLT and SART results. However, in their respective roles, both tests performed equally well, as shown by excellent ROC and high sensitivity and specificity.
The exact nature of the diurnal variation in vigilance in narcolepsy is unclear. It was hypothesized that the homeostatic sleep drive is increased in narcolepsy. Decreased levels of vigilance are associated with increased low frequency band power in the electroencephalogram (EEG). These frequencies are expected to be increased in narcoleptic patients as well as low frequency power should increase over the day. A recent study assessed quantitative EEG at 9:00, 11:00, 13:00, 15:00, and 17:00 hours, during rest and during reaction time tasks in narcoleptic patients. Alpha power at rest in narcoleptic patients was lower than healthy subject, at all times. Delta and theta power during rest and task performance increased steadily over the day in narcoleptic patients, as well as beta1 and beta2 power during rest increased at the end of the day. The effects in the lower frequency bands strongly suggest that vigilance is low at all times. The progressive increase in low frequency power indicates that the sleep drive is enhanced. It is not clear whether this pattern reflects an extreme state of low vigilance, or a pathological brain condition. The effects in the higher frequencies suggest that narcoleptic patients may make an effort to counteract their low vigilance level.
Another recent study by our group assessed the Cyclic Alternating Pattern (CAP) in patients with narcolepsy, showing that the occurrence of the A1 CAP subtypes is impaired during NREM sleep. Thus, narcolepsy seems to be accompanied not only by alterations of REM but also NREM sleep, as reflected by CAP and corresponding EEG spectral analysis. These findings might indicate that in narcolepsy very-slow oscillation processes less effective than normal might be present, with a subtly impaired capability of grouping the other sleep EEG activities; this aspect deserves further insight in order to obtain a better understanding of its functional meaning.
NEUROPÉPTIDOS E HIPERSOMNIA
Oscar Prospéro García y Corinne J. Montes Rodríguez
Grupo de Neurociencias. Departamento de Fisiología. Facultad de Medicina. Universidad Nacional Autónoma de México (UNAM). México D.F. México.
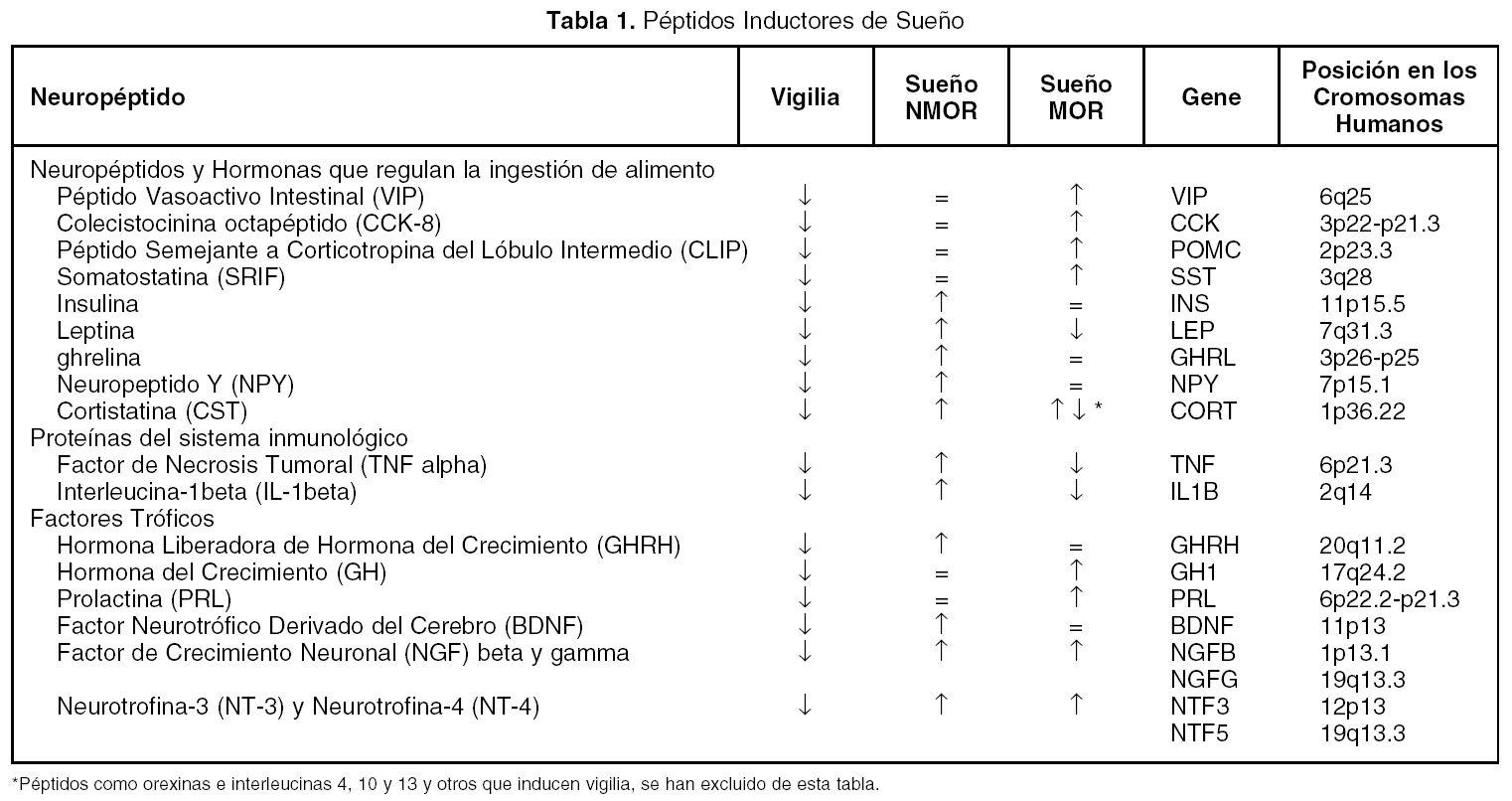
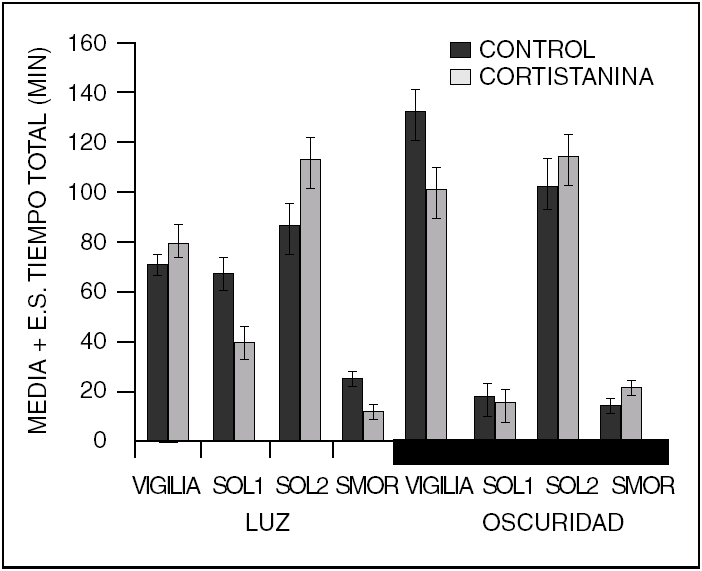
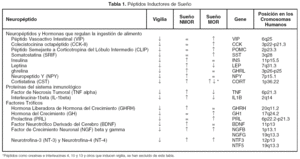
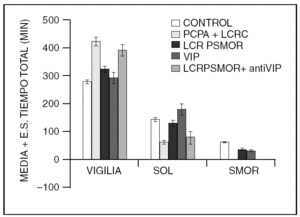
Además de los neurotransmisores que regulan el ciclo sueño vigilia, v. gr. vigilia: noradrenalina, serotonina, histamina, acetilcolina; sueño sin movimientos oculares rápidos (NMOR): GABA, prostaglandina D2, adenosina y sueño con movimientos oculares rápidos (MOR): acetilcolina, endocanabinoides, hay una serie de péptidos que modulan cada una de las fases del ciclo sueño-vigilia. Como puede observarse en la tabla 1, los péptidos promotores de sueño en realidad son miembros de familias de péptidos organizadas. Obsérvese que la gran mayoría de los péptidos que regulan la ingestión de alimento promueven el sueño. Asimismo, lo hacen los péptidos relacionados a la respuesta inmunológica y los que participan en los procesos de crecimiento y de reparación neuronal. Péptidos como el Vasoactivo Intestinal (VIP), parecen utilizar el líquido cefalorraquídeo (LCR) para ir de zonas rostrales a caudales en el cerebro y ejercer una acción inductora de sueño, revirtiendo incluso, el insomnio inducido por la inhibición de la síntesis de serotonina por paraclorofenilalanina (PCPA, inhibe a la triptofano hidroxilasa, (fig. 1)
Figura 1. Inducción de sueño en gatos insomnes por PCPA por LCR de gatos privados de sueño MOR (LCR PSMOR, técnica del florero invertido) y VIP. Bloqueo del efecto del LCR PSMOR por anticuerpos antiVIP. Los anticuerpos fueron agregados al LCR PSMOR 12 h antes de administrarlo a los gatos. LCRC = LCR de gatos sin privar de sueño.
El VIP ha mostrado ser un potente inductor de SOL y MOR en la rata y el gato . También se observó que era capaz de restituir el sueño en ratas y gatos mantenidos insomnes por PCPA (fig. 1). Adicionalmente se informó que los anticuerpos antiVIP aumentan la vigilia a expensas del sueño MOR dejando intacto el sueño lento en ratas y previene el efecto del LCR PSMOR en gatos (fig. 1). Otros investigadores han hecho infusiones continuas de VIP por varios días, encontrando un aumento del sueño lento y sueño MOR. Fármacos antagonistas de VIP reducen el sueño MOR en ratas. Además, el VIP se acumula en el LCR de gatos privados de sueño MOR y el pegado de VIP a sus receptores aumenta después de la privación selectiva de sueño MOR.
Adicionalmente, se ha informado que varios neurotransmisores involucrados en la generación del sueño estimulan la liberación de VIP, v. gr. la acetilcolina, la serotonina, la prostaglandina D2, y las interleucinas, las cuales indu-cen sueño MOR y NMOR. El grupo de Jouvet ha sugerido que el VIP esta relacionado con el control circadiano del sueño.
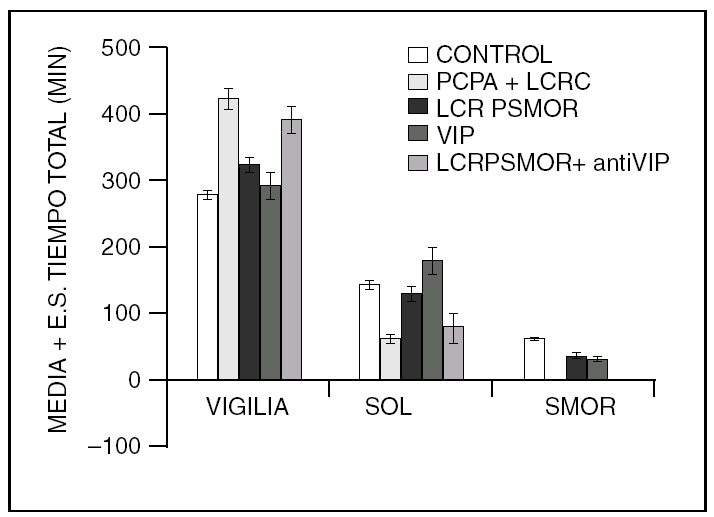
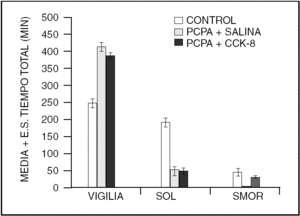
Por otra parte, la colecistocinina (CCK-8), es un péptido que aumenta el sueño en ratas normales y restituye el sueño MOR en gatos insomnes por PCPA (fig. 2).
Figura 2. La colecistocinina-8 (CCK-8), también restituye el sueño MOR en los gatos mantenidos insomnes con PCPA.
Cortistatina
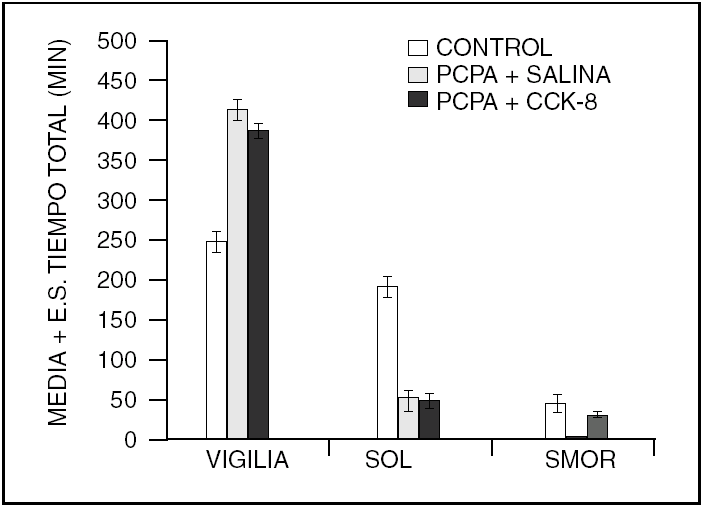
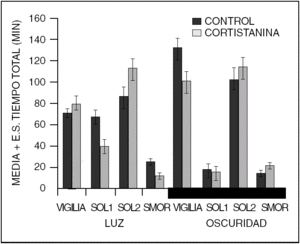
Este es un péptido que fue descrito en 1996. Induce sueño NMOR aparentemente por interferir con la actividad de la ACh. Sin embargo, a concentraciones diferentes (500 ng) a las que inducen sueño NMOR, es capaz de afectar al sueño MOR, aumentándolo o disminuyéndolo, dependiendo de la fase del ciclo luz-oscuridad en que se administre (fig. 3). Cortistatina parece modular la acción de la ACh a nivel cortical y del hipocampo. Su farmacología aún está en estudio, por lo que se sabe poco acerca de la manera específica como este péptido modifica los estados de vigilancia. A pesar de que se ha descrito un receptor a cortistatina, esta se une a los receptores de somatostatina. Así que, los efectos sobre el sueño observados pueden ser consecuencia de la activación de ambos tipos de receptores.
Figura 3. La cortistatina (500 ng) administrada intracerebroventricular aumenta el sueño lento, aunque no significativamente a esta dosis. Sin embargo, el sueño MOR es reducido durante la fase de luz mientras que es aumentado durante la fase de oscuridad, del ciclo luz-oscuridad.
Como podemos observar en la tabla 1, la cantidad de péptidos involucrados en la regulación del sueño son muchos, aun cuando descontamos varios de ellos y los que inducen vigilia. Ello significa que los genes involucrados en la regulación de nuestros estados de vigilancia también son muchos. Hemos puesto solo algunos de ellos también, pero nos dan una idea de cuales serían los genes que nos promueven el sueño. Obviamente faltan los que promueven la vigilia, los cuales no son menos importantes. No solo los péptidos de secreción y sus genes están involucrados, si no los genes que codifican para los diferentes receptores de los diferentes neurotransmisores.
El exceso de vigilia en términos cotidianos (desvelos) o el exceso de sueño, en los mismos términos (hipersomnolencia), se ha sugerido que reduce la esperanza de vida. Así que de un equilibrio resultante del diálogo concertado entre péptidos promotores de vigilia y péptidos promotores de sueño tenemos una vigilia robusta, llena de las destrezas de nuestros procesos mentales durante la fase de luz, del ciclo luz-oscuridad, y por el otro lado, tenemos también un sueño profundo y reparador, durante la fase de oscuridad, que nos llevará a la vigilia mencionada. Si este sistema de neuropéptidos se daña como en la ausencia de orexinas entonces el equilibrio se rompe y tenemos hipersomnolencia diurna, con intrusiones anómalas de sueño MOR.
BIBLIOGRAFÍA
De Lecea L, Criado J R, Prospéro-García O. Gautuikk KM, Schweitzer P, Danielson PE, Dunlop CLM, Siggins GR, Henriksen SJ, Sutcliffe JG. A cortical neuropeptide with neuronal depressant and sleep-modulating properties. Nature. 1996;381:242-5.
Gee Lee M, Hassani OK, Jones BE. Discharge of identified orexin/hypocretin neurons across the sleep-waking cycle. J. Neurosci. 2005;25:6716-20.
Jones BE. From waking to sleeping: neuronal and chemical substrates. TIPS. 2005;26:578-86.
Prospéro-García, O. y Drucker Colín, R. Control neural del ciclo sueño-vigilia. En: sueño y procesos cognitivos. Ramos Platón, M.J. (ed.). Editorial Síntesis, S.A. 1996. p. 131-60.
Prospéro-García O, Méndez-Díaz M. The role of neuropeptides in sleep modulation. Drug News Perspect. 2004;17:
Sapier CB, Scammel TE, Lu J. Hypothalamic regulation of sleep and circadian rhythms. Nature. 2005;437:1257-63.
Shemyakin A, Kapas L. L-364,718, a cholecystokinin-A receptor antagonist, suppresses feeding-induced sleep in rats. Am J Physiol Regul Integr Comp Physiol. 2001;280:R1420-6.