Comunicación elegida para ser presentada oralmente
EL EFECTO DE LA POSICIÓN DURANTE EL SUEÑO EN LA SEVERIDAD DEL SÍNDROME DE APNEA-HIPOAPNEA OBSTRUCTIVA DEL SUEÑO
T. Canet*, A. Santamaría, C. Oltra**, O. González***, M. Armero, J.B. Soler Cejudo, J.L. Ros Sánchez Cruzado*
*Facultativos Especialistas de Neurofisiología Clínica. **Técnicos de Neurofisiología Clínica y Unidad de Preventiva. Hospital Virgen de los Lirios. Alcoy. ***Facultativo Especialista de Neurofisiología Clínica del Hospital San Juan de Alicante.
INTRODUCCIÓN
El efecto agravante de la posición supina en las alteraciones respiratorias durante el sueño es un hecho conocido, aunque muy poco estudiado pese a las implicaciones terapéuticas, entre otras, que su valoración puede conllevar. El objetivo de éste estudio es valorar la influencia tanto de la posición supino como en las diferentes posiciones de decúbito lateral, aspecto no valorado hasta la actualidad en la literatura, en la severidad de SAHOS.
MATERIAL Y MÉTODOS
Valoramos los 50 pacientes estudiados para diagnóstico de SAHOS mediante polisomnografía durante una noche completa en el Servicio de Neurofisiología Clínica en los meses de Enero-Julio del 2001. Consideramos el criterio de A. Oksenberg y D. Silverberg para determinar SAHOS dependiente de posición supino y se aplicó el mismo criterio modificado a las diferentes posiciones de decúbito lateral. Establecimos 4 grupos de severidad del SAHOS según el IAR total (IARt): muy leve: 10 - < 20 (5 pacientes), leve: 20 - < 3 0 (6), moderado: 30 - < 40 (7) y severo: > 40 (29).
RESULTADOS
Para el estudio supino/no supino se incluyeron 47 pacientes. En 23 casos de ellos (49%) el IAR fue 2/3 mayor durante el tiempo que durmió en supino, encontrando una relación significativa inversa entre el grado de severidad y la postura supina (p < 0,05). El efecto de las diferentes posiciones decúbito lateral se pudo estudiar en 29 casos (58%) hallando una tendencia en los SAHOS grados leve a presentar una menor severidad significativa del IAH al dormir en decúbito lateral derecho frente al izquierdo aunque no se alcanzó significación estadística probablemente al escaso número de casos estudiados.
CONCLUSIÓN
Es conveniente en todo estudio PSG describir, no solamente el IAR total, sino también el IAR en cada posición ya que la severidad del SAHOS depende de ésta.
Comunicación breve
EL EFECTO DE LA POSICIÓN DURANTE EL SUEÑO EN LA SEVERIDAD DEL SÍNDROME DE APNEA-HIPOAPNEA OBSTRUCTIVA DEL SUEÑO
T. Canet*, A. Santamaría, C. Oltra**, O. González***, M. Armero, J.B. Soler Cejudo, J.L. Ros Sánchez Cruzado*
*Facultativos Especialistas de Neurofisiología Clínica. **Técnicos de Neurofisiología Clínica y Unidad de Preventiva. Hospital Virgen de los Lirios. Alcoy. ***F. Especialista de NFC del H. San Juan de Alicante.
Palabras clave: SAHOS posicional. Supino. PSG. IAR.
Correo electrónico: canet_ter@gva.es
INTRODUCCION
El SAHOS es una enfermedad caracterizada por realizar pausas respiratorias seguidas de ronquido mientras se duerme1. La posición corporal del supino tiene un papel relevante en las alteraciones respiratorias. Ya en los primeros artículos publicados sobre anomalías respiratorias durante el sueño por Gastaut y cols en 1966 se mencionaba que durante el supino se agravaban estas2 y parece ser tan evidente y conocido que incluso los acompañante de los pacientes roncadores lo refieren en las historias clínicas y fueron unos de los primeros en comunicarlos3. Sin embargo este efecto agravante no se tiene en cuenta en la mayoría de estudios respecto a las alteraciones respiratorias durante el sueño ya que no analizan éstas en cada posición. La severidad de un paciente es reflejada en estos estudios tan solo a través del índice total de alteraciones respiratorias (IAR) durante una noche pese a que en las recomendaciones de los "estardard de la práctica de la polisomnografía"4 se aconseja registrar la posición durante los registros y analizar las alteraciones respiratorias respecto a ellas.
La valoración del efecto de la posición en el SAHOS nos lleva a la consideración de que existen dos tipos de pacientes SAHOS, los pacientes posicionales (PP) y los no posicionales (NPP). Los pacientes posicionales tienen por lo menos el doble de alteraciones respiratorias en supino frente a las postural laterales5.
Conocer ante que tipo de paciente estamos puede optimizar la indicación y las opciones terapéuticas que podemos ofrecerle6, teniendo en consideración incluso que alguna de ellas como la UPP es invasiva. Hay terapias simples de poco coste, como la corrección postural, aconsejables para determinados pacientes PP aplicada como terapia individual o coadyuvante7 y también útiles en pacientes NPP que mejoran la adaptación y cumplimiento de otros tratamientos8. La no consideración de la contribución del efecto de la postura a la hora de valorar la efectividad de un tratamiento empleado para SAHOS puede ser causa tanto de falsos positivos como negativos9,10.
Por las razones expuestas nos planteamos como objetivos valorar en primer lugar cómo influye el supino en los pacientes estudiados en nuestro laboratorio y analizar las diferencias entre los pacientes posicionales y no posicionales y la influencia de la severidad del SAHOS expresada por el IAR, la edad y el sexo en estos dos tipos de pacientes. El otro aspecto a determinar es el comportamiento de los distintos decúbitos laterales, derecho e izquierdo, en ambos tipos de pacientes y su relación así mismo con la severidad del SAHOS, edad y sexo, aspectos no especificados hasta la actualidad en la literatura.
Figura 1.
MATERIAL Y METODO
Estudiamos en el Servicio de Neurofisiología Clínica a 50 pacientes a los que se realizó durante los meses de enero a junio de 2001 una polisomnografía durante una noche completa para diagnóstico de SAHOS y cuyo índice de alteraciones respiratorias total (IAR) obtenido fue mayor de 10.
El registro se realizó con el polisomnógrafo digital Cadwell de 32 canales. Se registraron cuatro canales para electroencefalograma: C4-A1, C3-A2, O2-A1 y O1-A2; dos canales de electrooculograma; y uno para electromiografía de mentón; movimientos de piernas, ronquido (sensor), flujo aéreo (termistor naso-bucal), esfuerzo respiratorio (bandas tórax y abdomen), ECG, saturación oxígeno y sensor posición. El registro fue monitorizado mediante cámara de video de infrarrojos y valorado toda la noche por personal de enfermería del servicio de neurofisiología clínica. Las fases de sueño y arousals se interpretaron de forma manual. En el resto de parámetros se realizó un análisis automático supervisado manualmente.
Para el estudio del efecto de la posición supino en el SAHOS y la determinación de pacientes posicionales (PP) o no posicionales (NPP) utilizamos la definición del SAHOS dependiente de posición supino empleado por Cartwright (1984): SAHOS dependiente de supino (PP) es aquel cuyo IAR en posición supino es dos veces superior al IAR en el decúbito lateral (IAR supino/IAR no supino > 2). Excluimos a los pacientes que habían dormido menos de 30 minutos en cualquiera de las dos posicines.
Estudiamos las diferencias entre ambos tipos de pacientes PP y NPP y la edad media, IAR total, en supino y no supino y sexo. Para analizar la influencia de la severidad del SAHOS según el IAR distribuimos a los pacientes en cuatro categorías: muy leve (IAR = 10 - < 20), leve (IAR = 20 - < 30), moderado (IAR = 30 - < 40) y severo (IAR > 40). Para el estudio de la influencia de la edad en el SAHOS posicional definimos tres grupos de edad: 1 (< 40 años), 2 (entre 40-60 años) y 3 (> 60 años).
Para el estudio de la influencia de las posiciones del decúbito lateral, derecha e izquierda en el SAHOS, distribuimos a los pacientes en tres grupos según cumpliesen los siguientes requisitos:
Grupo A o lateral derecho: cuando el IAR en posición derecha es dos veces superior al IAR en la izquierda.
Grupo B o lateral izquierdo: cuando el IAR en posición izquierda es dos veces superior al IAR en la derecha.
Grupo C o lateral indiferente: cuando el IAR en posición derecha o izquierda es similar y su cociente es inferior a dos.
Se incluyeron los casos en los que el tiempo de sueño sobre la derecha e izquierda fue superior a 30 minutos.
Analizamos las diferencias entre los tres subgrupos y el efecto de la severidad del SAHOS según el IAR, de la edad y del sexo en las distintas posiciones del decúbito lateral utilizando las mismas categorías empleadas en el estudio del efecto supino y no supino.
Análisis estadístico: las variables contínuas siguieron una distribución normal por ello para su estudio se aplicó el test ANOVA. Para variables cualitativas se aplicó el test de la chi-Cuadrado o el test de Fisher. Para el análisis entre variables cualitativas y cuantitativas se realizó la t de Student para muestras independientes entre dos grupos, el test Anova para el análisis de varios grupos y los test de Tukey y Bonferroni para comparaciones múltiples entre diferentes grupos entre sí. Se utilizó el paquete estadístico SPSS vs 9.0.
RESULTADOS
Incluimos 47 pacientes (94%), 39 hombres y 8 mujeres. La edad media fue de 53,6 ± 12. La media del índice de alteraciones respiratorias durante el sueño total (IAR total) fue 49,5 ± 23. La media del tiempo total de sueño (TTS) fue de 350,4 ± 72 minutos (tabla 1). Excluimos a dos de ellos por dormir todo el estudio en supino y otro en decúbito lateral durante toda la noche.
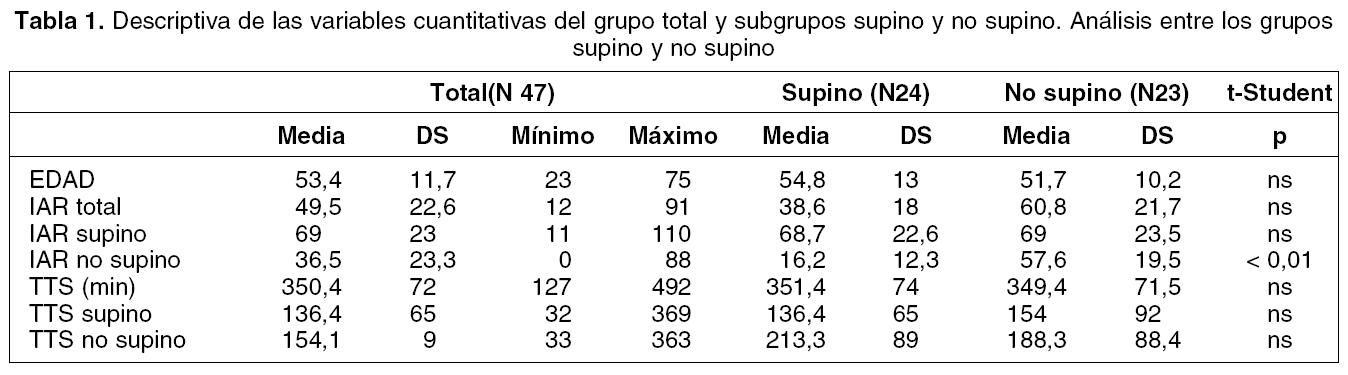
La frecuencia de los pacientes posicionales fue algo superior (24 casos) a los no posicionales (23 casos). Encontramos 20 hombres y 4 mujeres en el grupo de SAHOS posicional. Prácticamente ninguna de las variables estudiadas: edad media, IAR total, el IAR supino, el tiempo total de sueño ni el tiempo total de sueño en cada posición mostró diferencias significativas entre los pacientes PP y NPP. Sólo el índice de IAR en no supino fue menor en los PP 16,2 ± 12,3 frente a 57,6 ± 19,5 (p < 0,01) (tabla1).
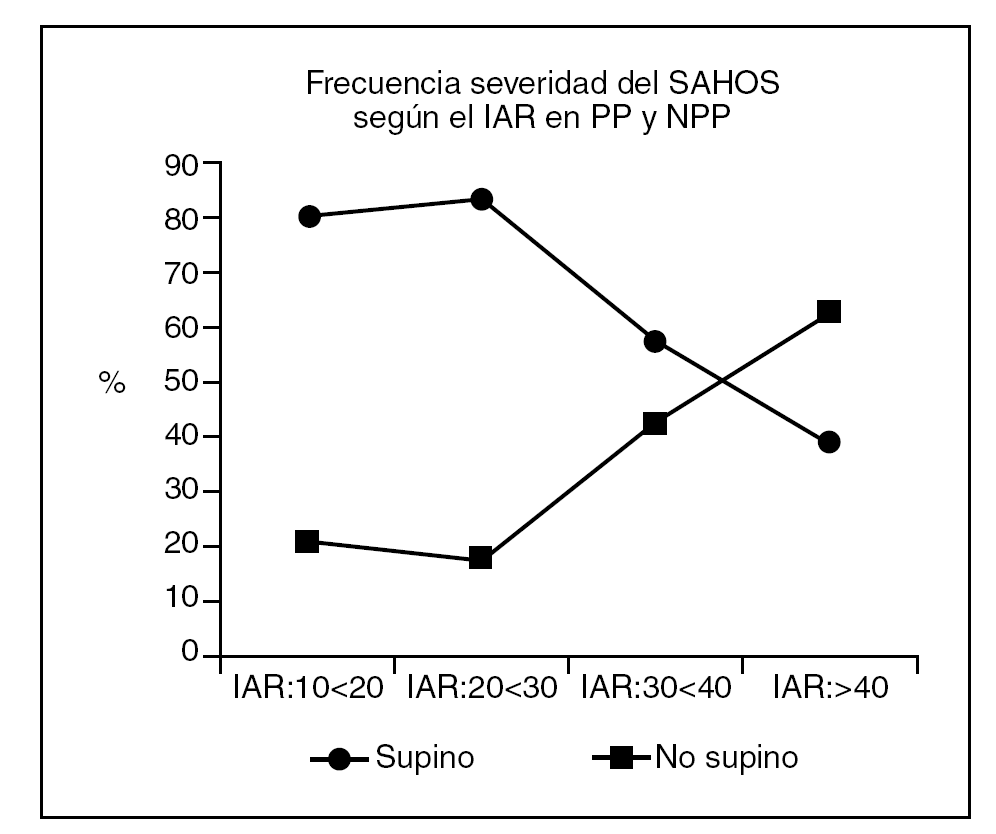
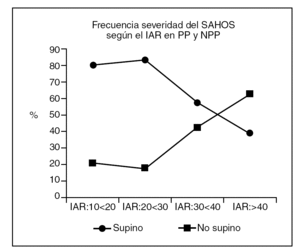
La distribución de los pacientes en las categorías de severidad del SAHOS según el IAR fue de 5 casos en el grado muy leve, 6 en el leve, 7 en el moderado y 29 en el severo. De ellos fueron pacientes PP en cada una de las categorías de forma correlativa: 4 (80%), 5 (83%), 4 (57%) y 1(38%). Estos datos muestran una tendencia a disminuir los casos dependientes de supino conforme aumenta la severidad pero no se alcanzar significación estadística (gráfica 1). Esta distribución podía estar influenciada por el tiempo de sueño en supino, ya que éste es un factor que se correlaciona fuertemente con el IAR, por ello se analizó en cada una de las categorías siendo de 147,6 ± 71 m en los muy leves, 124,7 ± 81 m en los leves, 158,6 ± 56 m en los moderados y de 145,6 ± 87 m en los severos y no mostró significación estadística en el test de la varianza ni en los multicomparativos. Tampoco se observó una diferencia estadísticamente significativa de la edad en los distintos grupos de severidad IAR (muy leves: 53 ± 9 años; leve: 48 ± 16 años; moderado: 58 ± 15 años y, severo: 53,6 ± 10 años).
El número de pacientes en las categorías de leves y moderados fue pequeño, por los que los distribuimos en dos grupos según el IAR fue menor o mayor de 40. Este análisis mostró que en el grupo de severos había menos casos dependientes de supino (38%) que en el de no severos (87%) (p < 0,0001).
El índice IAR no supino en los PP fue menor de 10 inexistente o en nueve casos, estuvo entre 11 y 19 en siete casos, entre 20 y 29 en cuatro, entre 30 y 39 en tres y mayor de 40 en un caso. Sin embargo en los NPP, no hubo ningún caso con el IAR menor de 10 ni entre 11 y 19, entre 11 y 29 hubieron dos casos, entre 30 y 39 cuatro casos y mayor de 40 en diecisiete casos (p < 0,0001).
Figura 2.
El análisis de la influencia de la edad en el SAHOS se hizo estableciendo tres grupos de edades encontrando en la muestra total 5 casos menores de 40 años, 28 en el grupo de 40 a 60 años y 14 en el de mayores de 60 años.
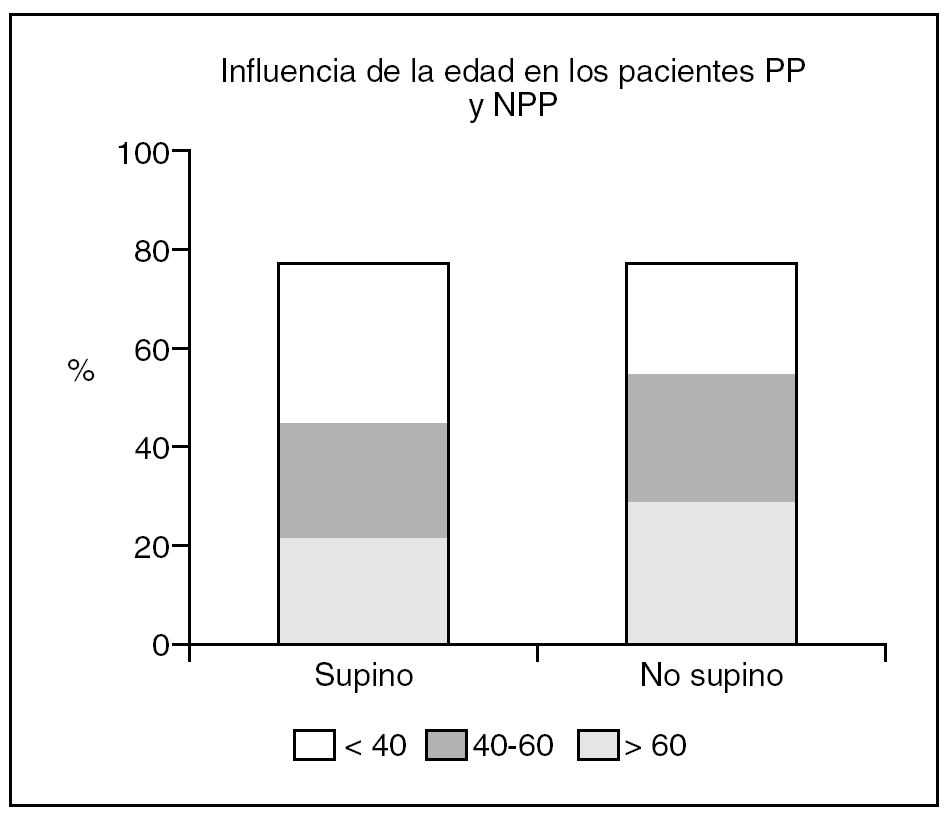
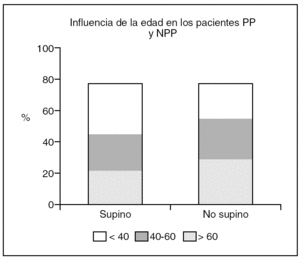
Observamos una tendencia no significativa a aumentar los casos SAHOS dependientes de supino conforme aumenta la edad, encontrando 2 (40%) casos que cumplían el criterio de dependiente de supino en el grupo de edad menor de 40 años, 13 (46%) en el grupo de 40 a 60 años y 9 (64%) en el de mayores de 60 años (gráfico 2).
El estudio del comportamiento de los distintos decúbitos laterales, derecho e izquierdo en el SAHOS pudo realizarse en 28 pacientes (56%). Todos fueron varones. La edad media fue de 52 ± 12 años. En 5 casos el IAR fue dos veces superior al dormir sobre la derecha que sobre la izquierda (PD), en 9 casos el IAR fue dos veces superior al dormir sobre la izquierda que sobre la derecha (PI) y en 14 casos el IAR en la derecha y la izquierda fue similar (PIN). El tiempo que durmieron en cada grupo sobre la derecha e izquierda no mostró significación estadística y puede verse en la tabla 2.
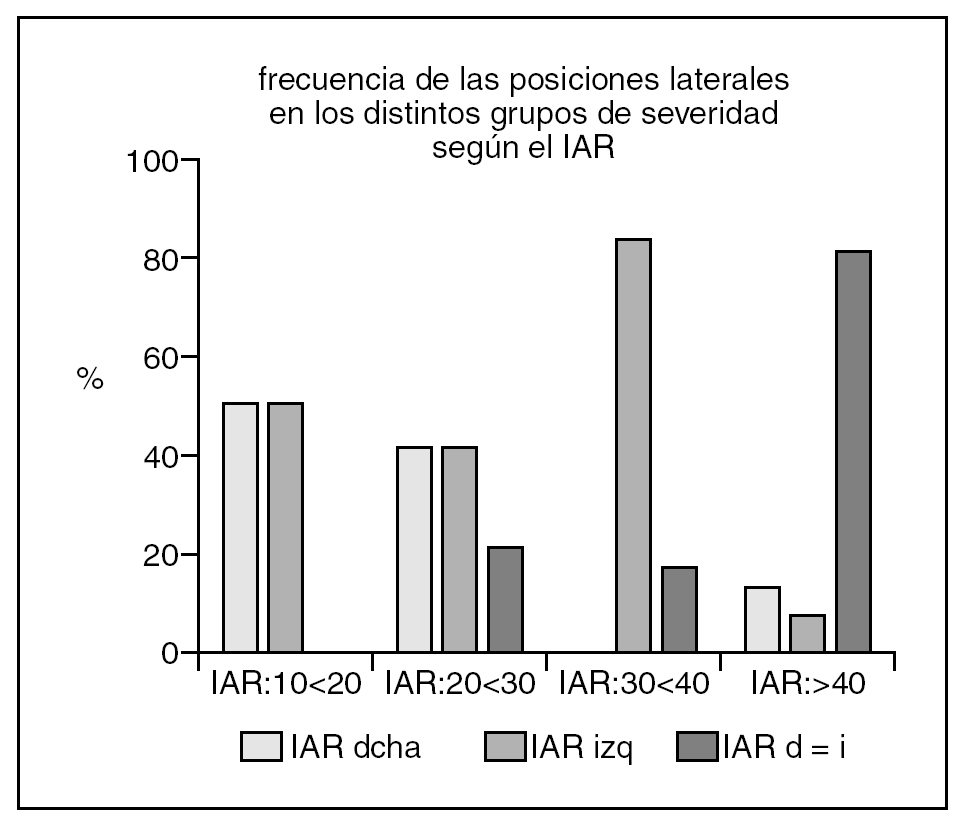
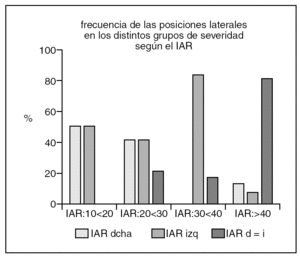
La mayoría de pacientes PD y PI fueron SAHOS posicionales (100% los PD y el 67% los PI) frente a los 3 casos encontrados en PIN (21%) (p < 0,001).
Figura 3.
Respecto a la distribución de PI y PD según la severidad observamos una disminución significativa de estos tipos de pacientes a partir del IAR de 40 (PI 89% vs PIN 17% (p < 0,005). En los PD (60%) no hubo significación estadística probablemente por el número total de casos incluidos (gráfico 3).
Encontramos un número similar de pacientes menores de 60 años (grupo de menos de 40 y grupo de 40 y 60 años) en los tres tipos de pacientes, en los PD fue del 60%, en los PI del 67% y en PIN del 71%. No hubo significación estadística.
El análisis comparativo entre los tres grupos y el IAR izquierda, mostró que aunque en los pacientes con ID este es menor que en los PI (11 frente a 26), la diferencia no fue estadísticamente significativa. Sin embargo, el IAR en la derecha si fue muy inferior y significativo en los pacientes PI que los PD (5,4 frente a 39 p < 0,0001) (tabla 2).
DISCUSION
El SAHOS posicional supone más de la mitad de los pacientes con clínica de SAHOS como se muestra en los resultados de nuestro estudio dónde su frecuencia es del 51%, y en otros trabajos como el de Cartwright et al5, publicado en 1984, primer trabajo que investigó el papel de la posición en la severidad de las apneas y fue del 58% o el de Oksenberg et al6 dónde fue del 56%. Estos trabajos al igual que el nuestro se realizaron en poblaciones grandes de pacientes con clínica de SAHOS no seleccionados (24, 574 y 50 pacientes respectivamente). En otros trabajos, dentro de los pocos existentes en la literatura que hacen referencia al tema de la posición en el SAHOS, ha oscilado entre un 9 y un 60% (11, 12 y 13) si bien el número de pacientes incluido fue pequeño y los tipos de SAHOS diferentes.
La diferencia principal entre ambos tipos de pacientes estriba en la severidad del IAR en el decúbito lateral ya que en los dos tipos de pacientes el IAR en supino es similar (68 ± 23 en los PP y 69 ± 23 en los NPP), sin embargo en los PP el IAR en el decúbito lateral es muy bajo (16 ± 12) mientras que en los NPP el IAR en decúbito lateral es similar al de supino (58 ± 19) (p < 0,05). El efecto agravante del supino en los casos posicionales parece estar reflejado por tanto, por un aumento del IAR en esta posición.
En los SAHOS no posicionales el IAR en supino y no supino es similar, lo cual puede presuponer que el supino no tiene el efecto agravante visto en los PP. Sin embargo, la gravedad de las alteraciones respiratorias no sólo es debida al número de ellas reflejado en el IAR. Otros parámetros como la longitud de las apneas/hipoapneas, la desaturación mínima de oxígeno, la desaturación en sueño delta, la duración y ocurrencia de los arousals, la intensidad del ronquido y la incidencia de bradi-taquicardia desempeñan un papel importante en la gravedad de las alteraciones respiratorias y todos estos parámetros empeoraban en el supino14. En los NPP no se ha estudiado la variación de estos parámetros y la escasa frecuencia de eventos respiratorios en posición lateral dificulta su estudio.
El IAR es de todos los factores que influyen en el SAHOS el que mayor efecto tiene en la posición. El análisis comparativo del IAR entre los PP y NPP mostró que aunque éste era menor en los casos PP no había diferencia significativa entre ambos grupos por eso estudiamos su influencia en los dos tipos de pacientes distribuyendo a estos en varias categorías de severidad. Observamos una tendencia a una relación inversa para encontrar PP conforme aumenta el grado de severidad IAR datos concordantes con los existentes en la bibliografía6. La frecuencia del SAHOS posicional fue elevado y más o menos constante en las categorías de severidad IAR muy leve y leve (80 y 83% respectivamente), mostrando una reducción conforme aumenta la severidad, encontrando 58% en los moderados (IAR30-40) y más marcada cuando el IAR es superior a 40 (38%). El índice de 40, parece ser el punto umbral para la distinción entre pacientes posicionales y no posicionales como ya concluyó Oksenberg et al15. Dicho índice debe interpretarse con cautela ya que el número de pacientes posicionales a partir de éste es menor que en índices IAR inferiores pero no despreciable (41,6%).
Otros de los factores relacionados con el SAHOS analizados en este estudio fueron el sexo y la edad. El efecto del sexo en el SAHOS posicional no ha sido investigado con anterioridad, en nuestro estudio el número total de mujeres fue escaso para valorar esta influencia adecuadamente si bien encontramos dos mujeres en cada uno de los grupos de pacientes PP y NPP.
La edad parece ser una de los factores que menos influyen en el SAHOS posicional. Nosotros encontramos una mayor frecuencia de PP en pacientes mayores de 60 años (64%) que en las otras categorías de edad establecidas: 40% en el grupo de menores de 40 años y 46% en el de 41-60 años, si bien el análisis estadístico no mostró significación estadística, al igual que al juntar los casos en dos categorías de jóvenes o menores de 60 y mayores de 60. Este comportamiento no coincide del referido6 dónde el PP fue mayor en los pacientes menores de 60 años (59%).
El otro objetivo de nuestro estudio fue el de analizar el comportamiento de las posiciones laterales en el SAHOS, aspecto no referido en la literatura. Encontramos que en un 50% de los 28 casos que durmieron suficiente tiempo en los dos decúbitos laterales el IAR se comporta de forma distinta en la izquierda o derecha, siendo superior la frecuencia de casos en el que el IAR es dos veces mayor al dormir sobre la izquierda (PI = 9 casos ) que sobre la derecha (PD = 5 casos). No encontramos al igual que en el análisis de la influencia del supino una relación con la edad para ninguna de las posiciones. Los PI son más frecuente en los pacientes posicionales (100% en los PD y el 67% en los PI) y también en los pacientes con índice de severidad IAR leves y moderados (89%) y apenas se observa significativamente en este rango de severidad en los pacientes cuyo IAR es similar en ambas posiciones (14%). El punto de corte para diferenciar el comportamiento distinto en las posiciones sea el IAR mayor de 40 al igual de lo que ha observado para el SAHOS posicional.
Es crucial tener en cuenta que en los pacientes posicionales su severidad viene determinada por el tiempo que pasa durmiendo en supino durante su registro y que este puede ser distinto al tiempo total de registro en esa posición en el cual se incluye también el tiempo de vigilia. Una noche en la que la mayoría del tiempo haya dormido en supino el IAR probablemente alcance el rango de moderado o severo, sin embargo si pasa poco tiempo en supino puede que no se observe ninguna anomalía, o que sólo ronque o esté en los niveles inferiores de severidad. También hay que favorecer durante el registro una libertad de movimientos, en caso contrario el resultado de la PSG podría dar una visión errónea de la severidad del paciente respecto a sus hábitos corporales en su domicilio16,17.
El análisis del tiempo dormido en supino y no supino entre los PP y NPP y subgrupos de estos para la edad y categorías de severidad según el IAR, ha mostrado ser similar, sin diferencias significativas entre ellos, lo cual indica que el tiempo en nuestro estudio no es un factor de confusión. Si bien, en ningún trabajo se ha determinado cual el tiempo necesario mínimo o punto de corte que diferencie a los pacientes. Como requisito se excluye a los que hayan dormido menos de 30 minutos en una de las dos posiciones5,14.
La identificación del tipo de paciente SAHOS ante el que estamos puede tener implaciones importantes, entre ellas terapéuticas, para él. Los paciente PP con un grado leve o moderado de severidad pueden elegir como primera opción de tratamiento el evitar la posición supino15,18. En nuestro estudio estos pacientes suponen el 54% de los PP y el 28% del total. La terapia posicional es un tratamiento simple y de poco coste que tiene como objetivo evitar que el paciente duerma en posición supino. Se ha utilizado simplemente el aprendizaje19-21 o varios objetos tales como una pelota de tenis aplicada en una camiseta o banda en la mitad de la espalda20,22, una alarma que se activa al estar en supino7,19,23 o una especie de cilindro24-26. El uso continuo de cualquiera de estos objetos es eficaz para erradicar prácticamente el tiempo que se duerme en supino (menos del 10% del total del sueño) en todos los pacientes19,22,25 mientras que si se interrumpe su uso a las semanas24,25 o pocos meses de llevarlo19,22 sigue siendo eficaz en dos tercios de los pacientes al igual que ocurre en los pacientes en los que no se ha utilizado ningún objeto y han evitado el supino con el aprendizaje21. La eficacia se mantiene por lo menos durante tres años20,21 a más largo plazo no ha sido investigada.
La aplicación de este tratamiento en pacientes PP con IAR lateral inferior a 10 o inexistente llevaría a estos pacientes al rango de la normalidad. En nuestro estudio estos casos suponen el 38% de los PP (9 casos). En el resto de casos con índice lateral superior a 10 esta terapia debe usarse como coadyuvante. La reducción de peso actúa en primer lugar reduciendo la severidad en la posición lateral6, al igual que la UPP9. Estudios comparativos entre el tratamiento CPAP y terapia posicional han encontrado una eficacia similar entre los dos tratamientos, en pacientes PP7, obesos leves27 y en pacientes con IAH de 17 ± 828.
La presión de un CPAP a pautar a un paciente también está influenciada por el supino. Pevernagie and Shepard et al11 encontraron que la presión que precisan los pacientes PP es inferior a la que precisan los NPP, si bien la diferencia de presión fue tan sólo de un cmH2O, lo cual puede deberse a que esta presión se determina en supino y la severidad de apneas en esta posición es similar en ambos tipos de pacientes. Si se evita la posición de supino puede usarse la presión necesaria en lateral que será menor, incluso de cuatro cmH2O8 y favorecer el cumplimiento y tolerancia. Dicha observación es aplicable tanto en los pacientes obesos y no obesos, jóvenes y mayores y en los diferentes grupos de severidad10 y pacientes no posicionales8.
La interpretación de unos resultados postUPP9 o de aplicaciones orales10 y su comparación con el diagnostico previo, sin tener en cuenta los resultados según posición pueden ser falsos positivos o negativos, lo cual nos conduciría a pensar en el primer caso que estamos ante un éxito y en el segundo ante un fracaso de la técnica empleada.
La frecuencia del SAHOS posicional en los laboratorios de sueño puede reflejar de forma indirecta una no selección clínica de los casos. Puesto que muchos de ellos son casos leves y moderados puede que un ensayo por un periodo de tiempo de correción de la postura con un control clínico de la variación de la sintomatología fuera útil como filtro para indicar un estudio polisomnográfico y rentabilizar los medios diagnósticos.
Todas estas observaciones realzan la necesidad de reflejar en los datos de las PSG el tiempo que se duerme en cada posición así como los resultados del análisis de las alteraciones respiratorias en cada posición ya que ello nos dará una visión más completa del paciente y podría ser asesorado respecto a un tratamiento personalizado.
Como conclusiones podemos extraer que el SAHOS posicional es muy frecuente y ocurre tanto en hombres como en mujeres sin claras diferencias en cuanto a la edad. El principal factor para sospecharlo es el índice IAR superior a 40, si bien en casos con índices superiores a 40 la frecuencia no es desestimable (40%).
En un 50% de SAHOS el IAR en decúbito lateral es diferente al dormir sobre la derecha o izquierda, de ellos parece haber una mayor frecuencia de personas en las que el índice de alteraciones respiratorias es mayor al dormir en el lado izquierdo (64%). Si bien se necesitan estudios con mayor casuística que corroboren nuestros hallazgos.
Sólo se puede saber y hacer uso de la información de si un paciente es un SAHOS posicional e incluso dentro del decúbito lateral cual puede ser su lado normal o de menor gravedad y hacer uso de estos conocimientos si se constata y se estudia la posición en los registros polisomnográficos.
BIBLIOGRAFIA
1.Sanders MH. Sleep Breathing Disorders. En: Kryger M, Principles and Practice of Sleep Medicine. ed, Saunders Company; 2000:797-813.
2.Gastaut H, Tassinari CA, Duron B. Polygraphic study of the episodio diurnal and nocturnal (hypnic and respiratory) manifestations of the Pickwickian syndrome. Brain Res. 1966;2:167-86.
3.Editor's note. Patient's wife cures his snoring. Chest. 1984;84:582.
4.Martin RJ, Chairman, Block AJ, Cohn MA, et al. Committee members: indications and standards for cardiopulmonary sleep studies. Sleep. 1985;8:371-9.
5.Cartwright RD. Effect of sleep position on sleep apnea severity. Sleep. 1984;7:110-4.
6.Oksenberg A, Silverberg DS, Arons E, et al. Positional vs nonpositional obstructive sleep apnea patients. Anthropomorphic, nocturnal polysomnographic and multiple sleep latency test data. Chest. 1997;112:629-39.
7.Cartwright RD, Ristanovik R, Díaz F, et al. A comparative study of treatments for positional sleep apnea. Sleep 1991;14:546-52.
8.Neill AM, Angus SM, Sajkov D, et al. Effects of sleep posture on upper airway stability in patiens with obstructive sleep apnea. Am J Respir Crit Care Med. 1997; 155:199-204.
9.Katsantonis GP, Miyashaki S, Walsh JK. Effects of uvulopalatopharyngoplasty on sleep architecture and patterns of obstructed breathing. Laryngoscope. 1990;100: 1068-72.
10.Cartwright RD. Predicting response to the tongue retaining device for sleep apnea syndrome. Arch Otolaryngol. 1985;111:385-8.
11.Pevernagie DA, Shepard JW. Relations between sleep stage, posture and effective nasal CPAP levels in OSA. Sleep. 1992;15:162-7.
12.Lloyd SE, Cartwright RD. Physiologic basis of therapy for sleep apnea (letter). Am Rev Resp Dis. 1987;136: 525-6.
13.Braver HM, Block J. Effect of nasal spray, positional therapy and the combination thereof in the asymptomatic snorer. Sleep. 1994;17:516-21.
14.Oksenberg A, Khamaysi I, Silverberg DS, et al. Association of body position with severity of apneic events in patients with severe nonpositional obstructive sleep apnea. Chest. 2000;118:1018-24.
15.Oksenberg A, Silverberg DS. Review Article. The effect of body posture on sleep-related breathing disorders facts and therapeutic implications. Sleep Medicine Reviews. 1998;2 (3):139-62.
16.Metersky ML, Castriotta RJ. The effect polysomnography on sleep position: Possible implications on the diagnosis of positional obstructive sleep apnea. Respiration. 1996;63:283-7.
17.Hartse KM, Logan MB, Branham GH, et al. Unattended home monitoring in the evaluation of sleep apnea: Is it equal to formal polysomnography? Sleep Res. 1996;25:251.
18.Jackson EI, Schmidt HS. Modification of sleeping position in the treatment of obstructive sleep apnea. Sleep Res. 1982;11:149.
19.Cartwright RD, Lloyd S, Lilie J, et al. Sleep position training as treatment for sleep apnea syndrome: a preliminary study. Sleep. 1985;8:87-94.
20.Kavey NB, Gidro-Frank, Sewitch DE. The importance of sleeping position and a simple treatment technique. Sleep Res. 1982;11:152.
21.Chaudhary BA, Chaudhary TK, Kolbeck RC, et al. Therapeutic effect of posture in sleep apnea. Southern Med J. 1986;79:1061-3.
22.Kavey NB, Blitzer A, Gidro-Frank S, Korstanje K. Sleeping position and sleep apnea syndrome. Am J Otolaryngol. 1985;6:373-7.
23.Cartwright R. Home modification of sleep position for sleep apnea control. En: Miles L, Broughton R, eds, Clinical evaluation and physiological monitoring in the home and work environment. Palo Alto: Raven Press; 1990:123-9.
24.Freebeck P, Stewart D. Positional training while you sleep. Sleep Res. 1995;24:235.
25.Freebeck P, Stewart D. Compliance and effective therapy for positional apnea. Sleep Res. 1995;24:236.
26.Mauret JT, Stuck BA, Hein G, Verse T, Hormann K. Treatment of obstructive sleep apnea with a new vest preventing the supine position. Dtsh Med Wochenschr. 2003;128 (3):71-5.
27.Klimaszewsky A, Jokic R, Crossley M, et al. Behavioral treatment versus CPAP in positional OSA. Sleep Res. 1997;26:392.
28.Jokic R, Klimaszewski A, Crossley M, Sridhar G, Fitzpatrick MF. Positional treatment vs continuous positive airway pressure in patients with positional obstructive sleep apnea syndrome. Chest. 1999;115 (3):771-81.
DESCRIPCIÓN DE ALTERACIÓN EN SPECT CEREBRAL HALLADOS EN PACIENTES DIAGNOSTICADOS DE NARCOLEPSIA
R. Chilet Chilet, M. Rueda Soriano, P. Giner i Bayarri, F. Giménez Vázquez, J. Moliner Ibañez, M. Escudero Torrella y G. Zalve Plaza.
S. Neurofisiología Clínica. H.U. Dr. Peset. Valencia. España.
Correspondencia: Av. Gaspar Aguilar, 90. 46017 Valencia. España.
Correo electrónico: letletro@yahoo.es
OBJETIVOS
La narcolepsia es un trastorno neurológico incluido dentro de las hipersomnias intrínseca. A mediados del siglo xx se describe la tétrada clásica: hipersomnia, cataplejía, parálisis de sueño y alucinaciones hipnagógicas. El objetivo: aportar un estudio descriptivo de paciente diagnosticados de narcolepsia que presentan diferentes alteraciones en el SPECT cerebral.
MÉTODOS
Se realiza una selección de los pacientes diagnosticados de narcolepsia, tras la realización de historia clínica, escala de somnolencia de Epworth, estudios neurofisiológicos (estudio poligráfico de sueño y test de latencias múltiples), estudios inmunogenéticos (estudio serológico de los antígenos del sistema HLA de clase I y II). Tras ello se les realiza un SPECT cerebral de perfusión.
RESULTADO
Según nuestro estudio se ha visto en paciente narcolépticos un asociación con alteraciones de perfusión cerebral, con disminución de la misma sobre todo en regiones izquierdas.
CONCLUSION
Existe un porcentaje importante de pacientes que presentan alteración en SPECT cerebral, aunque se desconoce las causa con certeza; se describe en otros estudios alteraciones en la densidad de receptores D2, así como variaciones del flujo sanguíneo en sueño REM.
PALABRAS CLAVES
Narcolepsia. SPECT. Perfusión.
Comunicación breve
DESCRIPCIÓN DE HALLAZGOS DE SPECT CEREBRAL EN PACIENTES DIAGNOSTICADOS DE NARCOLEPSIA
R. Chilet Chilet R, M. Rueda Soriano, E. Caballero Calabuig*, P. Giner i Bayarri, F. Giménez Vázquez, M.D. Reyes Ojeda*, J. Moliner Ibáñez, M. Escudero Torrella y G. Zalve Plaza
*S. Neurofisiología Clínica. S. Medicina Nuclear. H.U. Dr. Peset. Valencia. España.
RESUMEN
El objetivo del presente estudio es comparar los resultados del SPECT cerebral de 18 pacientes diagnosticados de narcolepsia; reseñar la presencia de una alteración en la perfusión en el SPECT cerebral en este grupo. Un alto porcentaje de los pacientes estudiados (casi un 78%), presenten diferentes alteraciones de perfusión; sin poder concluir el porque de estas alteraciones en la prueba de imagen cerebral.
Palabras clave: Narcolepsia. SPECT. Perfusión.
INTRODUCCIÓN
La narcolepsia es un transtorno neurológico idiopático, incluida dentro de los trastornos intrínsecos del sueño. Clásicamente se define como una enfermedad de etiología desconocida, caracterizada por somnolencia excesiva y ataques de sueño, generalmente en asociación con episodios de cataplejía, parálisis del sueño, alucinaciones hipnagógicas y otros fenómenos ligados al sueño REM, como la1.
Se describe la enfermedad a finales del siglo xix, por E. Gèlineau, que propuso dar el nombre de narcolepsia "a una neurosis rara, caracterizada por la necesidad imperiosa de dormir ..."1. En 1926, Adie cataloga ya la narcolepsia como una enfermedad específica de probable origen neurológico, independiente de la neurosis, de la encefalitis y de la epilepsia. Sin embargo no es hasta mediados del siglo xx cuando Yoss y Daly describieron detalladamente la tétrada clásica: hipersomnia, cataplejía, parálisis del sueño y alucinaciones hipnagógicas y/o hipnopómpicas2. En años 60, Vogel describe como peculiaridad de los pacientes narcolépticos, el comienzo del sueño en REM, ésto hizo que la neurofisiología se constituyera en apoyo diagnóstico de la narcolepsia3.
La enfermedad tiene una prevalencia que se estima entre 0,03% y 0,16%, sin existen diferencias entre hombre-mujer, aunque ciertos autores describen un discreto predominio en el varón4; la aparición es máxima a los 14 años, casi siempre antes de los 25 años; aunque se han descrito casos de comienzo antes de los 10 años y después de los cincuenta5. El riesgo de narcolepsia es de 60-200 veces mayor en los familiares de un individuo afecto en comparación con la población general; esto sugiere una transmisión genética. Hay que tener en cuenta que fue ya en el siglo xix cuando se intuye el carácter familiar de la enfermedad. En 1983, Honda et al, comunicaron la asociación de esa enfermedad con el sistema de histocompatibiliadad HLA. Posteriormente, se demuestra una estrecha asociación de la narcolepsia con el haplotipo DR2, DQ1 y concretamente, HLA DQB1*06026. La verdadera causa de la enfermedad sigue sin conocerse, y se piensa que deben existir otros factores genéticos en su base fisiopatología, así como factores ambientales que determinen sus variantes fenotípicas. Actualmente se ha comenzado a nombrar como posible clave la deficiencia de la función de la hipocretina, aunque no encontramos estudios concluyentes7.
La narcolepsia es conocida por su tétrada clásica, ya nombrada anteriormente, somnolencia, cataplejía, alucinaciones hipnagógicas y parálisis del sueño. La somnolencia diurna se manifiesta por accesos irresistibles de sueño que se suceden durante el día. Estos accesos súbitos de sueño de varios minutos a horas de duración pueden producirse en plena actividad. Estas crisis pueden asociarse a una somnolencia de fondo y alteraciones de memoria. Las crisis de sueño involuntario y las siestas, en general, restauran la vigilancia durante varias horas. La cataplejía consiste en una súbita relajación del tono muscular sin alteración de la conciencia; las alucinaciones hipnagógicas (en el inicio del sueño) e hipnopómpicas (al despertar) pueden ser auditivas, visuales y en ocasiones somestésicas. La parálisis de sueño se produce esencialmente en el momento del despertar matutino o al término de una siesta; corresponde a una atonía muscular completa que a menudo se experimenta de manera angustiosa. En estudios recientes, se habla del concepto de péntada, añadiendo a la tétrada clásica: sueño nocturno interrumpido y conductas automáticas3, en las que el paciente sigue realizando su actividad durante unos 10 seg, pese haberse dormido, y despierta sin recordar nada de lo ocurrido.
El diagnóstico se realiza según los Criterios Diagnósticos de la Narcolepsia-1990 ICSD2.
a) Somnolencia excesiva o debilidad muscular súbita.
b) Siestas recurrentes durante el día o ataques de sueño que ocurren casi diariamente durante un mínimo de tres meses.
c) Pérdida bilateral súbita del tono muscular en asociación con emoción intensa (cataplejía).
d) Entre las características asociadas se encuentran:
a. Parálisis de sueño.
b. Alucinaciones Hipnagógicas.
c. Conductas automáticas.
d. Disrupciones de sueño nocturno.
e) La polisomnografía muestra una o más de las siguientes características:
a. Latencia de sueño menor de 10 minutos.
b. Latencia de sueño REM menor de 20 minutos.
c. Un Test de múltiples latencias se sueño (MSLT) que demuestre una latencia media de sueño de menos de 5 minutos.
d. Dos o más entradas al sueño en fase REM.
f) HLA DQB10602 positivo.
g) Ausencia de trastorno médico o psiquiátrico que pueda justificar los síntomas.
h) Otros trastornos de sueño pueden estar presentes, pero no son la causa fundamental de los síntomas; por ejemplo movimientos periódicos de las extremidades o síndrome de apneas del sueño.
Los criterios mínimos para el diagnóstico son B más C, o bien A más E más F más G.
El tratamiento actualmente, consiste en las siestas programadas en función de las necesidades del propio paciente (de unos 20 minutos de duración), adecuado sueño nocturno y terapia farmacológica. Los más eficaces hoy en día son estimulantes del sistema nervioso central como el metilfenidato, los antidepresivos tricíclicos, se utilizan para controlar los ataques de cataplejía. No obstante, cabe reseñar que el tratamiento de estos pacientes es individualizado.
MATERIAL Y MÉTODOS
Se presenta un estudio retrospectivo, en el cual se pretende comparar los resultados del SPECT cerebral de perfusión de 18 pacientes diagnosticados de narcolepsia en el S. de Neurofisiología siguiendo los criterios de la Internacional Clasificación of Sleep Disorders (ICSD).
Para el diagnóstico, a todos y cada uno de estos pacientes se les realizó:
1. Historia clínica completa, para poder detectar toda la clínica del paciente, en la que no puede faltar la hipersomnia y los ataques de sueño, pues éstos son considerados como síntomas primarios, el resto de las características clínicas de la narcolepsia son consideradas como síntomas auxiliares.
2. Polisomnografía (PSG) y del TLMS, con video-EEG de 15 canales. Para realizar la PSG, el paciente debe ser sometido a una evaluación multidisciplinaria efectuada en un laboratorio del sueño equipado para la realización de la misma. Los parámetros fisiológicos de registro son los siguientes:
Electroencefalograma
Electrooculograma.
Electromiografía submentoniana y tibial.
Electrocardiograma.
Monitor de vídeo.
Esfuerzo ventilatorio a través de monitorización de movimientos torácicos.
El test de latencias múltiples de sueño (TLMS), consiste en un registro poligráfico, que se realiza durante el día y después de una noche de sueño habitual. Se practica 4 ó 5 tomas de 30 minutos, dándole al paciente en cada una de ellas la posibilidad de dormir una siesta. Se evalúa si aparece o no sueño, cual es la latencia promedio con la que se inicia en las distintas siestas y que fases contiene, en especial si aparece o no sueño REM. Un individuo normal o no dormirá o tendrá una latencia en promedio superior a 10 minutos, cifra a la que se ha llegado en estudios de población normales. Las hipersomnias severas se asocian a latencias inferiores a 5 minutos; las leves y moderadas entre 5 y 10 minutos. No se registra sueño REM normalmente en estas siestas, sin embargo, si aparece en más de una siesta se documenta la existencia de narcolepsia. La presencia de REM en sólo una siesta es menos específica y puede verse en la privación de sueño o de fármacos que disminuyen el REM (p. ej., tricíclicos).
3. Tipaje de HLA de clase I y II. Actualmente, es importante para un completo diagnóstico el tipaje de HLA; ya que, se ha demostrado que el alelo DQB1*0602 es un marcador más sensible de narcolepsia, y parece que se asocia a la presencia y gravedad de cataplejía, pero no a la intensidad de hiprsomnia8.
4. Pruebas de imagen (RM y/o TAC cerebral).
5. SPECT cerebral. Creemos importante realizar en este punto, una breve descripción de SPECT cerebral de perfusión 99mTc-HMPAO. El d,1-hexametilprooilenoamino oximao exametazima es un compuesto lipofílico con una eficacia de extracción en primer paso del 70-80%. Atraviesa la BHE por difusión pasiva con un pico máximo de actividad (1-2 min. post-inyección) que corresponde a una captación del 4-7% de la dosis, y es seguido de una difusión retrógrada rápida en los siguientes minutos (10-15% de la fijación máxima inicial). La fijación tisular se produce por oxidación intracelular a un compuesto hidrofílico, mediada por glutation. No redistribuye posteriormente y aprox. El 86% permanece en cerebro a las 24 h (post inyección). La distribución del trazador es proporcional al flujo sanguíneo cerebral9.
6. Otras pruebas complementarias (hemograma y fórmula, bioquímica, hemostasia, h. tiroideas, electrocardiograma y radiografía de tórax). (Resultados en el esquema del póster).
RESULTADOS
Tal como se observa en los datos del póster, un alto porcentaje de nuestros pacientes, casi un 78%, presentan diferentes alteraciones de perfusión en el SPECT cerebral; dichas alteraciones no están presentes en el grupo control (25 sanos), con el que se han comparado los resultados.
El 50% de las alteraciones del SPECT, son hipoperfusiones globales y el otro 50% presentan hipoperfusión de predominio izquierdo. Además, el 50% de los pacientes presentan hipoperfusión de predominio temporal, el 14,28% de predominio parietal y el mismo porcentaje de predominio global o heterogéneo y por último, el 35,71% presenta un disminución de perfusión en regiones frontales.
Si bien es cierto que el tamaño muestral es relativamente bajo, aunque cabe recordar que la narcolepsia tiene una prevalencia en nuestro medio baja, como se comento anteriormente.
De lo datos de nuestro estudio, se ha realizado un estudio descriptivo; agrupando a los pacientes en dos grupos, según el resultado del SPECT sea normal o patológico, considerando como patológico la presencia de alguna alteración en la perfusión cerebral y teniendo en cuenta variable como edad, sexo, resultado de HLA, TLMS, PSG, etc. (ver resultado en póster).
CONCLUSIÓN
1. En nuestro estudio se detecta alteración del flujo cerebral en casi el 78% de los pacientes diagnosticados de narcolepsia, en concreto presentan hipoperfusiones de diferentes regiones del sistema nervioso central.
2. Se desconoce la causa por la cual determinados pacientes presentan estas alteraciones mostradas en el SPECT; las cuales no se asemejan a ninguna otra alteración de las diferentes patologías que afectan al sistema nervioso central.
3. No se observa un patrón de alteración en el SPECT cerebral homogénea en los pacientes estudiados, sin que se asocie ninguna causa neurológica a esta variabilidad en las imágenes obtenidas.
El por qué de estas alteraciones de perfusión en pacientes diagnosticados de narcolepsia, es todavía una pregunta sin respuesta. Tal vez, porque no se conoce todavía la etiología de esta enfermedad, aunque hay que tener en cuenta que, actualmente existen dos frentes abiertos, uno es la teoría de la autoinmunidad, que sigue sin concretarse completamente, aunque parece estar clara su relación con el complejo de HLA; y la otra posible clave está en la deficiencia de la función de las hipocretinas.
BIBLIOGRAFÍA
1.International classification of sleep disorders. American Sleep disorders Association. 1990.
2.Culebras A. La medicina del sueño. 1994;54:77-84.
3.Espinar-Sierra J. Introducción. El síndrome de Narcolepsia-Cataplejía, hoy. Unidad de Sueño. Hospital Clínico San Carlos, Madrid. Vol.10-Numero 1(Sup.)/Septiembre 1998.
4.Diccionario de la Medicina del sueño. 2001;132-6.
5.Domínguez Ortega L. Narcolepsia. Revisión. Actualizaciones en Neurología. 2003;1(6):346-51.
6.Mingot E, Kimura A, Latterman A, Lin X, Yasunaga S, Mueller-Eckhardt G, et al. Extensive Hla class II studies in 58 non-DRB1*15(DR2) narcoleptic patients with cataplexy. Tissue Antigens. 1997;49:329-41.
7.Dauvilliers Y, Baumann C, Carlander B, Bischof M, Blatter T, Lecendreux M,et al. CSF hypocretin-1 levels in narcolepsy, Kleine-Levine syndrome and other hypersomnias and neurological conditions. J Neurol Neurosurg Pschiatry. 2003;74(12):1667-3.
8.Ezpeleta D, Peraita-Andrados R. Genética de la Narcolepsia. Vigilia-Suño. ;10(Suppl.):S21-8.
9.GrupoHispano-Luso de SPECT Cerebral. Atlas de radiofármacos de perfusión.
FIABILIDAD ENTRE EXPERTOS EN LA APLICACIÓN DE LOS CRITERIOS DE RECHTSCHAFFEN & KALES EN REGISTROS DE SUJETOS JÓVENES SANOS TRAS TRATAMIENTO FARMACOLÓGICO
S. Clos, S. Giménez, A. Morte, S. Romero, J.L. Lorenzo y M.J. Barbanoj
Centre d'Investigació de Medicaments. Institut de Recerca de l'HSCSP. Departament de Farmacologia i Terapèutica. UAB. Barcelona. España.
Correspondencia: Institut de Recerca de l'Institut de Recerca de l'HSCSP. St. Antoni M.ª Claret, 149. Barcelona. España.
Correo electrónico: sclos@hsp.santpau.es
INTRODUCCION
El manual de Rechtschaffen & Kales (R&K) fue creado en 1968 como herramienta para proporcionar reglas para el estadiaje de sueño y mejorar la concordancia entre todos los laboratorios. Se definió en registros de sujetos jóvenes sanos sin tratamiento farmacológico. No obstante, debido a que estas normas están sujetas a interpretación individual, a veces pueden resultar guías confusas, ocasionando una variabilidad significativa en la evaluación clínica, epidemiológica e investigadora (científica) de los trastornos de sueño.
OBJETIVO
Evaluar el grado de concordancia en el estadiaje de las diferentes fases de sueño en sujetos sanos bajo tratamiento farmacológico entre expertos de dos laboratorios de sueño: Barcelona y Viena.
SUJETOS Y MÉTODOS
Diez voluntarios jóvenes participaron en un estudio clínico aleatorizado, cruzado, doble ciego y balanceado, recibiendo 20 mg de d-anfetamina y placebo a las 12 horas del mediodía de cada uno de los días experimentales. Cada sesión incluía un registro polisomnográfico pre y post tratamiento. En el estudio se utilizaron los registros postratamiento. En total se evaluaron 18928 épocas de 30 segundos (20 registros polisomnográficos) siguiendo las reglas de Rechtschaffen y Kales (1968) por 2 expertos evaluadores, uno de nuestro laboratorio de Barcelona y otro del laboratorio de sueño del departamento de Psiquiatría de la Universidad de Viena. El grado de concordancia entre los dos expertos se evaluó mediante el coeficiente kappa de Cohen. Se calculó el valor del coeficiente kappa global, para cada tratamiento, para cada voluntario y para cada fase del sueño.
RESULTADOS
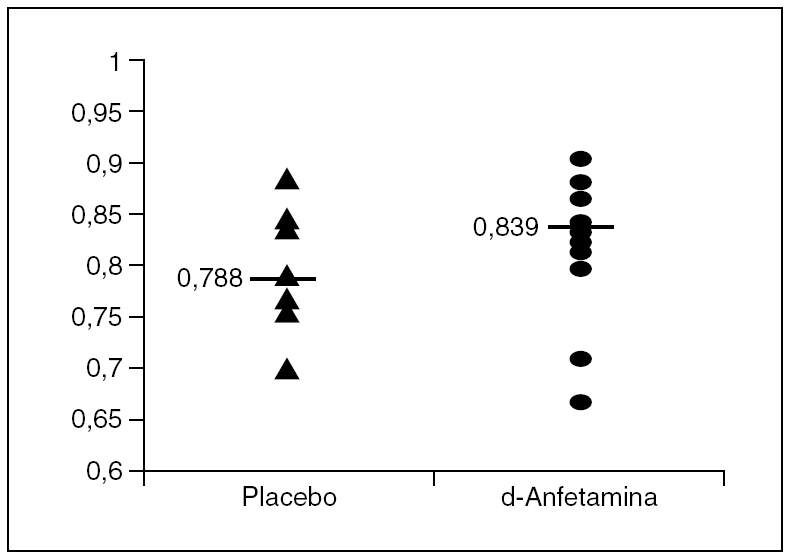
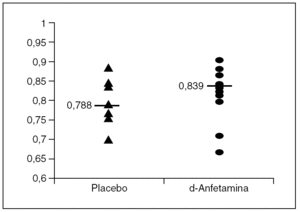
Los valores del coeficiente kappa por voluntarios oscilaron entre 0,696 y 0,884 con Placebo, y entre 0,712 y 0,906 con d-anfetamina.
CONCLUSIONES
Aunque el bajo índice de concordancia entre diferentes evaluadores de registros polisomnográficos siguiendo las normas de R&K en ancianos y en trastornos de sueño está bien documentado, no disponemos de información que sugiera que se haya analizado el grado de concordancia tras la administración de un fármaco. El elevado coeficiente kappa observado tras administración de anfetamina, podría explicarse por los efectos que esta produce sobre el sueño (aumento de la latencia de sueño y del porcentaje de fase 2), disminuyendo así los posibles cambios entre fases.
Evaluaciones similares tras la administración de otros fármacos con distintos efectos sobre el sueño serían, sin duda, de interés.
PALABRAS CLAVE
d-anfetamina, Índice de concordancia. R&K.
AGRADECIMIENTOS
Laboratorio de sueño del departamento de Psiquiatría de la Universidad de Viena.
The Siesta Group.
Comunicación breve
FIABILIDAD ENTRE EXPERTOS EN LA APLICACIÓN DE LOS CRITERIOS DE RECHTSCHAFFEN & KALES EN REGISTROS DE SUJETOS JÓVENES SANOS TRAS TRATAMIENTO FARMACOLÓGICO
S. Clos, S. Giménez, A. Morte, S. Romero, J.L. Lorenzo y M.J. Barbanoj
Centre d'Investigació de Medicaments. Institut de Recerca de l'HSCSP. Departament de Farmacologia i Terapèutica. UAB. Barcelona. España.
INTRODUCCIÓN
El manual de Rechtschaffen & Kales fue creado en 1968 como herramienta para proporcionar reglas en el estadiaje de sueño y mejorar la concordancia entre todos los laboratorios. Sin embargo, debido a que estas normas están sujetas a interpretación individual, a veces pueden resultar guías confusas, ocasionando una variabilidad significativa en la evaluación clínica, epidemiológica e investigadora (científica) de los trastornos de sueño. Algunas de estas limitaciones derivan de la especificación arbitraria de algunos criterios, como la amplitud, la frecuencia y la prevalencia de las ondas delta del EEG en cada época, con variaciones fisiológicas (como las variaciones en la amplitud de EEG debidas a variables interindividuales o a la edad) que pueden afectar la distribución de los estadios de sueño. A parte de estas limitaciones, los efectos farmacológicos sobre el sueño no pueden ser evaluados correctamente utilizando la codificación tradicional ya que las reglas fueron definidas en registros de sujetos jóvenes sanos, sin tratamiento farmacológico. Además, los fármacos que alteran estos parámetros electroencefalográficos críticos para la codificación del sueño (p. ej., la amplitud de las ondas delta) provocan canvios en la arquitectura del sueño, mientras que otro fármaco que altere otra variable del sueño (p.ej., aumento de la actividad beta) no afecta la distribución de los estadios de sueño. En estos casos, el criterio de codificación puede conducir a resultados erróneos.
Aunque éste es un problema reconocido, no existe mucha literatura que estudie y cuantifique el grado de concordancia entre codificadores y, además, la mayoría de estudios se desarrollan para la evaluación y validación de sistemas de codificación de sueño automáticos (Hoelster TJ, 1989; Schaltenbran N, 1996).
OBJETIVO
Evaluar el grado de concordancia en el estadiaje de las diferentes fases de sueño en sujetos sanos bajo tratamiento farmacológico entre expertos de dos laboratorios de sueño: Barcelona y Viena.
SUJETOS Y MÉTODOS
Diez voluntarios jóvenes sanos participaron en un estudio clínico aleatorizado, cruzado, doble ciego y balanceado, recibiendo 20 mg de d-anfetamina y placebo a las 12 horas del mediodía de cada uno de los días experimentales. Cada sesión incluía un registro polisomnográfico pre y post tratamiento. En el estudio se utilizaron los datos de los registros postratamiento.
Todos los registros polisomnográficos fueron realizados siguiendo el procedimiento habitual: 6 canales de EEG (Fp 1, Fp2, C3, C4, O1, O2) referenciados a la media de los mastoides, según el sistema internacional 10/20; 2 canales EOG; dos canales EMG: submentoniano y tibial; y un canal de ECG. La función respiratoria fue evaluada mediante el flujo naso-bucal, respiración torácico-abdominal y saturación de oxígeno.
En total se evaluaron 18928 épocas de 30 segundos (20 registros polisomnográficos) siguiendo las reglas de Rechtschaffen y Kales (1968) por 2 expertos evaluadores, uno de nuestro laboratorio de Barcelona y otro del laboratorio de sueño del departamento de Psiquiatría de la Universidad de Viena. Ninguno de los expertos tuvo información sobre los otros expertos, voluntarios o tratamiento durante la codificación de los registros. El grado de concordancia entre los dos expertos se evaluó mediante el coeficiente kappa de Cohen. Este índice evalúa el grado de concordancia de dos medias y que no es debida al azar. Se calculó el valor del coeficiente kappa global, para cada tratamiento, para cada voluntario y para cada fase del sueño. Se siguieron los criterios de Fleiss para valorar el grado de concordancia: > 0,75 excelente, 0,4-0,75 aceptable y < 0,4 pobre.
El estudio fue aprovado por el Comité Ético del Hospital de la Santa Creu i Sant Pau y se desarrolló siguiendo las recomendaciones éticas de la asamblea de Helsinky i los procedimientos de Buenas Prácticas Clínicas. Todos los sujetos firmaron un consentimiento informado y fueron recompensados económicamente por su participación.
RESULTADOS
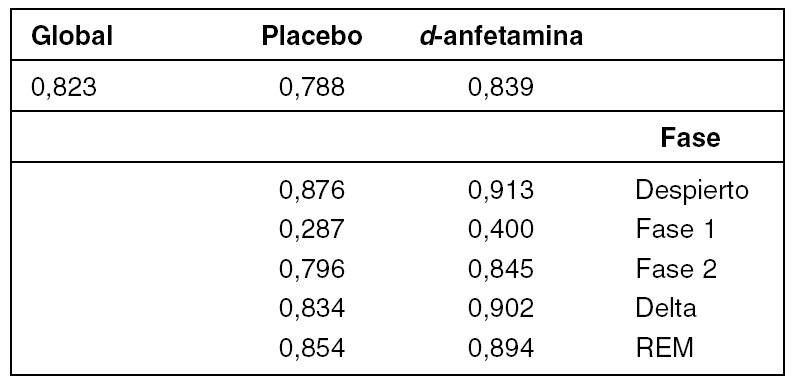
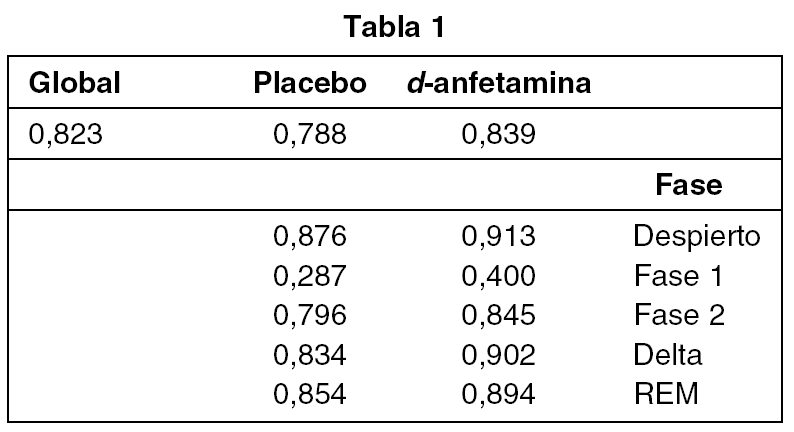
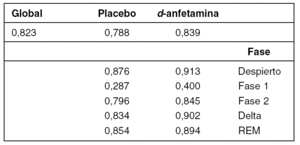
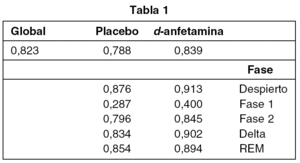
El valor global (tabla1) del coeficiente kappa obtenido fue de 0,823 (excelente). Analizando los tratamientos por separado (tabla1), el valor global fue menor para placebo (0.788) que para d-anfetamina (0,839).
Los valores del coeficiente kappa por voluntarios (fig. 1) oscilaron entre 0,696 y 0,884 con Placebo; y entre 0,712 y 0,906 con d-anfetamina.
Figura 1.
En relación a las fases de sueño (tabla 1), el mayor grado de concordancia se observó en la fase "despierto" (placebo 0,876, d-anfetamina 0,913) y el menor, en la fase 1 (placebo 0,287, d-anfetamina 0,400).
DISCUSIÓN
Los resultados obtenidos en nuestro estudio se asemejan a la literatura previa (Kim Y, 1993; Norman R-G, 2000), donde el mayor acuerdo se observa para las fases despierto y REM, seguidas de fase 2 y sueño delta (fases 3 y 4), tanto para placebo como para d-anfetamina, aunque los valores Kappa fueron mayores tras la administración de anfetamina en todas las fases de sueño.
Este hecho podría explicarse por los efectos que esta droga produce sobre el sueño: aumento de la latencia de sueño y del porcentaje de fase 2 . De esta manera disminuyen los posibles cambios entre fases, haciendo más fàcil su estadiaje y aumentando la concordancia.
CONCLUSIÓN
Siguiendo los criterios de Fleiss, el grado de concordancia global obtenido entre expertos de Barcelona y Viena fue excelente y aún mejor tras la administración de d-anfetamina en todas las fases del sueño. Evaluaciones similares tras la administración de otros fármacos con distintos efectos sobre el sueño serían, sin duda, de interés.
AGRADECIMIENTOS
Laboratorio de sueño del departamento de Psiquiatría de la Universidad de Viena.
The Siesta Group.
BIBLIOGRAFIA
Rechtschaffen, A & Kales A. A manual of standardized terminology, techniques and scoring system for sleep stages of human subjects. Brain Information Service/Brain Research Institute. UCLA. Los angeles, 1968.
Hoelscher TJ, Mc Call WV, Powell J, Marsh GR, Erwin CW. Two methods of scoring sleep with the Oxford Medilog 9000: comparison to conventional paper scoring. Sleep. 1989;12:133-9.
Schaltenbrand N, Lengelle R, Toussaint M, Luthringer R, Carelli G, Jacqmin A, et al. Sleep stage scoring using the neural network model comparison between visual and automatic analysis in normal subjects and patients. Sleep. 1996;19:26-35.
Danker-Hopfe H & Herrmann W.M. Interrater reliability of sleep stage scoring according to Rechtschaffen and Kales rules (RKR): a review and methodological considerations. Klin. Neurophysiol. 2001;32:89-99.
Kim Y, Kurachi M, Horita M, Matsura K, Kamikawa Y. Agreement of visual scoring sleep stages among many laboratories in Japan: effect of a supplementary definition of slow wave on scoring of slow wave sleep. Jpn J Psychiatry Neurol. 1993;47:91-7.
Norman RG, Pal I, Stewart C, Walsleben JA, Rapoport DM. Iterobserver agreement among sleep scorers from different center in a large dataset. Sleep. 2000;23:7.
Correspondencia: Institut de Recerca de l'Institut de Recerca de l'HSCSP. St. Antoni M.ª Claret, 149. Barcelona. España. Correo electrónico: sclos@hsp.santpau.es1
NIVEL DE ESTUDIOS ACADEMICOS EN UN GRUPO DE HIPERSOMNIAS
E. Gómez, S. Parra, M. Tárrega, E. Gónzalez, P. Rubio y A. Benetó
Unidad de Sueño H.U. La Fe. Valencia. España.
OBJETIVO
Describir las características demográficas y clínicas de los pacientes remitidos a nuestro servicio para estudio de hipersomnia diurna (HD) y valorar su nivel de estudios académicos alcanzados.
MATERIAL Y MÉTODOS
De los 212 pacientes remitidos con clínica de HD, fueron incluídos aquellos que cumplimentaron correctamente un Cuestionario General de Trastornos de Sueño (155). A todos ellos se les realizó PSG y MSLT. Posteriormente fueron clasificados según la causa objetivada de HD.
RESULTADOS
Las características demográficas de nuestro grupo de pacientes fueron:
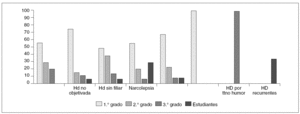
La mayor parte de ellos (66%) referían haber alcanzado estudios de 1.º grado, 24% de 2.º grado y 9,5% de 3.º; obteniendo en conjunto un nivel significativamente más bajo con respecto al nivel alcanzado en la Provincia de Valencia (a partir del censo de población y viviendas de 2001). No se objetivaron diferencias estadísticamente significativas según la causa de la hipersomnia ni su momento de inicio.
CONCLUSIONES
El nivel de estudios alcanzados por nuestros pacientes con HD es más bajo que en la población general de Valencia. Convendría valorar factores socioculturales en posteriores estudios.
Comunicación breve
NIVEL DE ESTUDIOS ACADÉMICOS EN UN GRUPO DE HIPERSOMNIAS
S. Parra, E. Gómez, M. Tárrega, E. González, P. Rubio y A. Benetó
Unidad de Sueño. Servicio de Neurofisiología Clínica. Hospital Universitario La Fe. Valencia. España.
INTRODUCCIÓN
Diversos estudios han relacionado la hipersomnia diurna (HD) con alteraciones cognitivas, objetivándose un déficit de atención en pacientes con narcolepsia. Por otra parte, la excesiva somnolencia en sujetos normales se asocia a peores resultados escolares; sin embargo, no hemos encontrado estudios previos que evalúen el nivel de estudios académicos alcanzados en pacientes diagnosticados de HD, y por tanto las consecuencias académicas de esta excesiva somnolencia diurna. Nuestro objetivo fue describir las características demográficas y clínicas de los pacientes remitidos a nuestro servicio para estudio de HD, valorando el nivel de estudios académicos alcanzados por éstos.
MÉTODOS
Se estudiaron de forma retrospectiva todos los pacientes remitidos a nuestra unidad (en funcionamiento desde el año 1991) cuya clínica principal fuera una HD no sugestiva de SAOS. De 212 pacientes, fueron incluidos 155 que cumplimentaron correctamente un Cuestionario General de Trastornos de Sueño, en el que se cuestionan tanto aspectos demográficos y clínicos, como socioculturales, incluyendo el nivel de estudios alcanzados y la puntuación en la escala de Epworth1. A todos ellos se les realizó polisomnografia nocturna (PSGN) que incluyó registro de actividad cerebral (C3-A2, C3-C4, C4-A1), electrooculograma, electromiograma submetoniano y en ambos músculos tibiales anteriores, estudio de parámetros respiratorios mediante termistor naso-bucal, movimientos torácico y abdominal mediante sensores piezoelectricos, medida de la saturación de oxígeno con pulsioxímetria transcutánea, registro de posición corporal y ronquido. El análisis de los parámetros de sueño se realizó según las normas de Rechfschaffen y Kales2, considerando patológico un índice de apnea/hipopnea (IAH) mayor de 10 eventos por hora de sueño, y un índice de movimientos periódicos de piernas (IMP) > 5 por hora de sueño. A todos se les realizó test de múltiples latencias de sueño (MSLT) a la mañana siguiente del PSGN, mediante 4 ó 5 siestas de 20 minutos de duración separadas por intervalos de 2 horas. Previamente se les instruyó a cumplimentar un horario regular de sueño durante los 15 días anteriores a la realización del estudio.
Los pacientes fueron agrupados según la causa subyacente de hipersomnia diurna, mediante los criterios ICSD-903. Se valoró el nivel de estudios académicos alcanzados por éstos de forma global, en estudios de primer grado (primarios, bachiller), estudios de segundo grado (medios, diplomaturas) y estudios de tercer grado (licenciaturas); y se compararon mediante test de Chi-cuadrado con el nivel alcanzado en la población general de Valencia, a partir del censo de población y viviendas de 2001. Posteriormente comparamos los niveles de estudios alcanzados por los pacientes entre los distintos grupos diagnósticos, y entre los pacientes que referían más o menos de 10 años de evolución, con la intención de evaluar la influencia de la causa y del retraso en el diagnóstico,
RESULTADOS
De los 155 pacientes, un 56% fueron varones, con una edad media de 34,5 años. El 63,8% de los pacientes presentaron un tiempo de evolución de la sintomatología en el momento de la realización del PSGN, y por tanto un retraso en el diagnóstico, menor de 10 años.
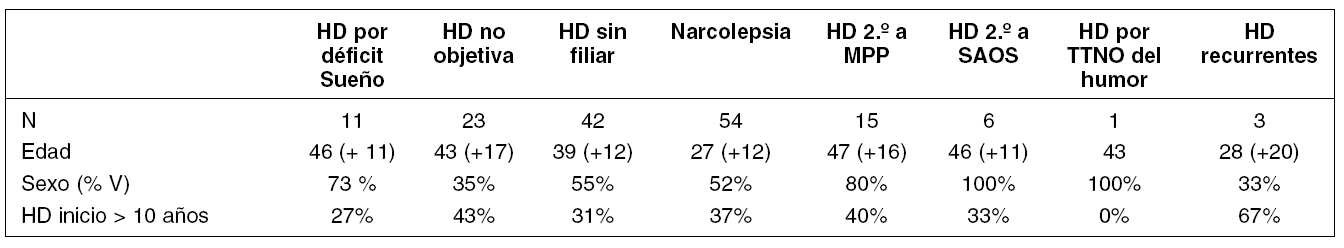
Cincuenta y cuatro pacientes (34,8%) refirieron clínica de narcolepsia con una corta latencia de inicio al sueño en el MSLT y presencia de SOREMs; otros 3 pacientes (1,9%) refirieron clínica de hipersomnia recurrente, 11 (7%) presentaban sueño nocturno insuficiente, y en uno de ellos se objetivó un trastorno del humor subyacente. En 15 (10%) se objetivó un índice de MPP > 5 por hora de sueño y fueron clasificados como HD secundaria a MPP, y en 6 (3,9%) se evidenció un IAH > 10 eventos por hora de sueño, por lo que fueron considerados como HD secundaria a SAOS. Se clasificaron 42 pacientes (27%) como HD sin filiar porque no se halló una causa subyacente objetivable de su sintomatología, y 23 pacientes (14,8%) como HD no objetivada dado que la latencia media de inicio al sueño en el MSLT fue mayor de 10 minutos.
De las características demográficas y los hallazgos en el MSLT según causa subyacente de HD (tabla 1) cabe destacar que los grupos de edad media menor en el momento del diagnóstico y con menor latencia de inicio en el MSLT, fueron el grupo de narcolepsia y de HD recurrente, siendo estos últimos el grupo con mayor retraso en el diagnóstico (más de 10 años).
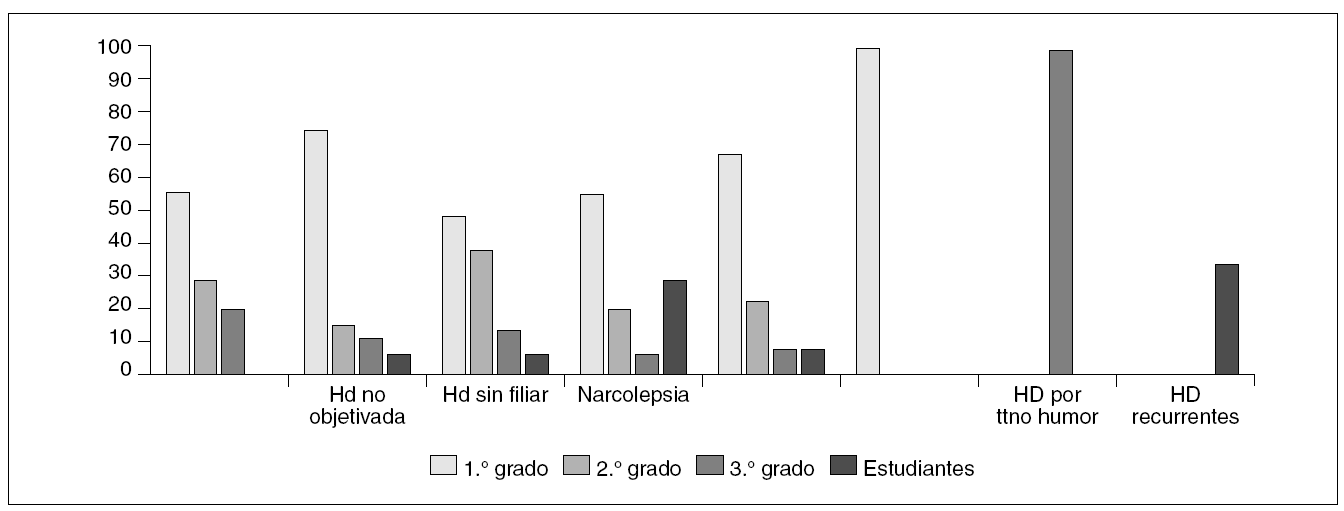
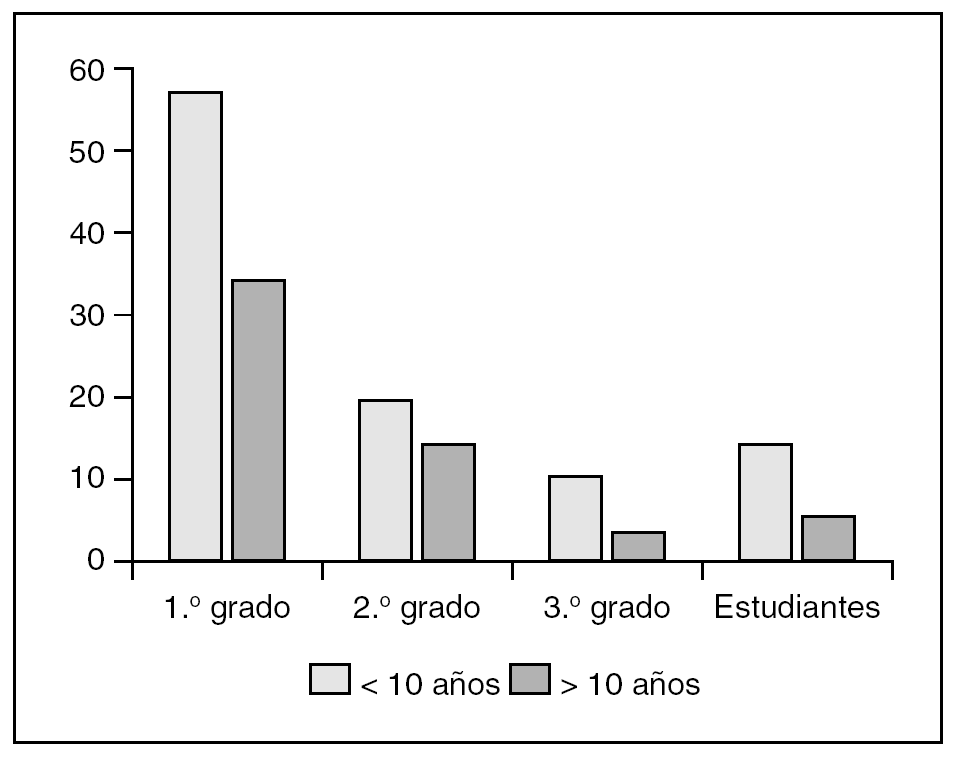
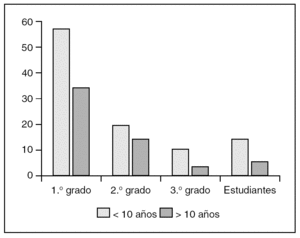
Analizando el nivel de estudios académicos, observamos que un 66% alcanzaron estudios de 1.º grado, un 24% de segundo grado, y tan sólo un 9% de tercer grado; encontrándose una diferencia estadísticamente significativa (p < 0,05) entre la proporción de pacientes que alcanzaron estudios de 1.º y 2.º grado y la proporción de la población general de Valencia, en los que un 26% había alcanzado estudios de 1.º grado, un 40% de 2.º grado, y un 11% de tercer grado. No se objetivaron diferencias estadísticamente significativas en el nivel de estudios alcanzados por los pacientes agrupados según la causa subyacente ni según el retraso en el diagnóstico (fis. 1 y 2).
Figura 1. Nivel de estudios alcanzados según el grupo diagnóstico.
Figura 2. Nivel de estudios alcanzados según el tiempo de evolución hasta el diagnóstico.
DISCUSIÓN
Es por todos conocido, que la HD tiene un importante impacto en la salud general y en el estado funcional de los pacientes, especialmente en la autopercepción que tienen sobre la energía y la fatiga4. Concretamente en estudios que evalúan la calidad de vida en pacientes con narcolepsia mediante el cuestionario SF-365, se objetivaron peores puntuaciones en todos los dominios que en controles sanos.
Uno de los aspectos en los que influye la HD es en la capacidad cognitiva de los pacientes que la padecen. Concretamente en pacientes con narcolepsia, se ha observado un rendimiento normal en tareas cortas pero disminuido en tareas que implican atención sostenida o mantenimiento de la vigilancia, y dificultad para concentrarse6-9, atribuyéndose a los efectos de la somnolencia diurna10. En pacientes con SAOS11,12, se han objetivado alteraciones de atención y déficits en la memoria, que mejoran significativamente tras la supresión de apneas mediante CPAP. Por otra parte, en la población sana, también se han descrito alteraciones similares tras la privación de sueño13; en un estudio sobre médicos residentes y estudiantes de medicina14, la privación de sueño (4 horas o menos de sueño ininterrumpido) ocasionaba un aumento de la fatiga y disminución de la motivación, aunque obtenían puntuaciones similares en los test que medían retención a corto y largo plazo de material nuevo aprendido.
Todas estas alteraciones cognitivas que se asocian a excesiva somnolencia diurna, pueden afectar al rendimiento académico. En la población sana, se objetivaron peores resultados académicos en pacientes con somnolencia15,16; y en pacientes diagnosticados de narcolepsia, diversos estudios hacen referencia también al efecto negativo en la capacidad de aprendizaje que pueden presentar, especialmente en etapas avanzadas con complejidades mayores. En un amplio estudio llevado a cabo en EE.UU., Europa, y Asia, en una muestra de 180 pacientes con narcolepsia señalaron que el 51% de ellos atribuía a los síntomas de su enfermedad sus escasos logros académicos, el 34% sus problemas de relación con los profesores, y que a un 32% sus síntomas les resultaban embarazosos6. El síntoma que parece ser más incapacitante para estos pacientes y con mayor repercusión en sus actividades diarias, es el tipo de HD crónica e inexorable que padecen. En otro estudio5, un 57% de los pacientes diagnosticados de narcolepsia referían en un 9% dificultades en concentrarse durante las clases y absentismo escolar frecuente y en un 55% menor éxito de lo que eran capaces. Asimismo, se ha objetivado que estos efectos podían ser reducidos al tratarse con Modafinil et al17, de forma que el grupo de pacientes tratados tenía menor dificultad en realizar las actividades sociales, mayor energía, atención y autoestima que los sujetos tratados con placebo.
Hay que tener en cuenta que alteraciones que cursan con HD como la narcolepsia, suele manifestarse al comienzo de la adolescencia, etapa de intenso aprendizaje escolar y de establecimiento de relaciones sociales, y que puede perjudicar la concentración, la capacidad de aprendizaje, el rendimiento académico y la adaptación psicosocial de este grupo de pacientes. Además es frecuente que los pacientes sean diagnosticados muchos años después del comienzo de los síntomas18, quizá debido al desconocimiento de éstos por parte no sólo de los familiares sino también de los profesionales de la enseñanza y de la salud. Los adolescentes pueden entonces ser considerados como perezosos, sin interés por los estudios, o ser etiquetados de dificultades en el aprendizaje, favoreciendo todo ello el abandono de los estudios.
En nuestro estudio hemos objetivado que el nivel de estudios académicos alcanzados por los pacientes con clínica de HD de forma global es más bajo que en la población general de Valencia, por lo que consideramos que en el estudio de pacientes con hipersomnia diurna se debería valorar el rendimiento escolar, para poder realizar una detección precoz del problema, y desarrollar así una intervención eficaz que ayude a prevenir o manejar las dificultades de aprendizaje. Del mismo modo, ante un estudiante con bajo rendimiento escolar, también podría tener interés indagar sobre hábitos o alteraciones de sueño que provoquen somnolencia, entre otros muchos aspectos, que pudieran estar influyendo sobre su rendimiento. Este hallazgo podría ser debido, como previamente se ha descrito, tanto a las dificultades en la atención como a la falta de motivación que presentan estos pacientes. Sin embargo, dado que no parece existir en nuestros pacientes relación con la causa subyacente de la hipersomnia ni con el retraso en el diagnóstico, convendría tener en cuenta otros factores en posteriores estudios que pudieran estar contribuyendo. Por un lado, las alteraciones del humor se han relacionado con peores resultados escolares, y del mismo modo habría que tener en cuenta factores socioculturales, como son los bajos recursos económicos, el absentismo escolar, y las preferencias vocacionales. Sería de interés incidir en el inicio de los síntomas, para evaluar su contribución al fracaso escolar, aunque en muchas ocasiones estos son vagos, pueden pasar desapercibidos, o no atribuirse a una enfermedad.
BIBLIOGRAFÍA
1.Johns MW. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale. Sleep. 1991;14: 540-5.
2.Rechtschaffen A, Kales A. A Manual of Standardised Terminology, Techniques and Scoring System for Sleep stages in Human Subjects. Los Ángeles: BIS/BRI, UCLA. 1968.
3.ICSD International Classification of Sleep Disorders: Diagnostic and Coding Manual. Diagnostic Classification Steering Committee, Thorpy MJ, Chairman. Rochester, MN, American Sleep Disorders Association, 1990.
4.Briones B, Adams N, Strauss M, Rosenberg C, Whalen C, Carskadon M, et al. Sleepiness and health. Relationship between sleepiness and general health status. Sleep 1996;19(7):583-8.
5.Daniels E, King MA, Smith IE, Shneerson JM. Health-related quality of life in narcolepsy. Jornal of Sleep Research. 2001;10(1);7.5-81
6.Ramos MJ. Procesos cognitivos y adaptación psicosocial en la narcolepsia. Vigilia y sueño. 1998;10(1).
7.Goswami M. The influence of clinical symptoms on quality of life in patients with narcolepsy. Neurology. 1998;50 Suppl 1:31-6.
8.Douglas NJ. The psychosocial aspectos of narcolepsy. Neurology. 1998;50 Suppl 1:27-30.
9.Wise M. Childhood narcolepsy. Neurology. 1998;50 Suppl 1:37-42.
10.Hood B, Bruck D. Sleepiness and performance in narcolepsy. J Sleep Res. 1996;5:128-34.
11.Naegele B, Pepin JL, Levy P, Bonnet C, Pellat J, Feuerstein C. Cognitive executive dysfunction in patients with obstructive sleep apnea syndrome (SAOS) after CPAP treatment. Sleep. 1998;21(4):392-7.
12.Naegele B, Thouvard V, Pepin JL, Levy P, Bonnet C, Perret JE, et al. Deficits of cognitive executive functions in patients with sleep apena syndrome. Sleep. 1995; 18(1):43-52.
13.McCarthy M end Waters W. Decreased attentional responsivity during sleep deprivation: orienting response latency, amplitude, and habituation. Sleep. 1997;20(2): 115-23.
14.Browne BJ, Van Susteren T, Onsager DR, Simpson D, Salaymed B, Condon RE. Influence of sleep deprivation on learning among surgical house staff and medical students. Surgery. 1994;115(5):604-10.
15.Drake C, Nickel C, Burduvali E, Roth T, Jefferson C, Badia P. The pediatric daytime sleepiness scale (PDSS): sleep habits an school outcomes in middle-school children. Sleep. 2003;26(4):455-8.
16.Rodrígues RN, Viegas AA, Abreu A, Tavares P. Daytime sleepiness and academic performance in medical students. Arq Neuro-Psiquiatr. 2002;60(1):6-11.
17.Beusterien KM, et al. Health-related quiality of life effects of Modafinil for treatment of narcolepsy. Sleep. 1999;22(6):757-65.
18.Benetó A, Rubio P, Gómez E, Puertas FJ, Domínguez F, Valvidieso R, Entrambasaguas M. Dificultades diagnósticas en el síndrome narcolepsia-cataplejía: a propósito de nuestra casuística. Rev Neurol. 1997;25(138): 208-11.
DISMORFIA SEPTAL Y SAHS
M.J. Jurado*, O. Romero*, J. Lorente**, T. Sagalés*, N. Moreno***, G. Sampol**** y L. Miguel*****
*Servicio de Neurofisiología Clínica. Hospital Vall d´Hebrón. Barcelona. España. **Servicio de Otorrinolaringología. Hospital Vall d´Hebrón. Barcelona. España. ***Servicio de Estadística. Hospital Vall d´Hebrón. Barcelona. España. ****Servicio de Neumología. Hospital Vall d´Hebrón. Barcelona. España. *****Unidad de Enfermería del Servicio de Neurofisiología Clínica. Hospital Vall d´Hebrón. Barcelona. España.
Correspondencia: Servicio de Neurofisiología Clínica. Hospital Vall d´Hebrón. Paseo Vall d´Hebrón, 119-129. 08035. Barcelona. España. Correo electrónico: 38256mjl@comb.es
La dismorfia septal se comporta de forma asintomática la mayoría de veces. Cuando es severa, altera la dinámica del flujo de aire a través de las fosas nasales, produciendo un incremento de los gradientes de presión de las vías respiratorias altas, y desencadenando un colapso faríngeo: mecanismo vinculado con la fisiopatología del Síndrome de apnea-hipopnea del sueño (SAHS).
OBJETIVO
Evaluar la eficacia de la cirugía nasal (septoplastia funcional) en un grupo de pacientes con SAHS.
MATERIAL Y MÉTODOS
Se estudiaron 34 pacientes varones, de edades comprendidas entre 32-62 años, con insuficiencia respiratoria nasal y roncopatía crónica, realizándose PSG nocturna previa a la cirugía y a los 3-6 meses de la misma.
RESULTADOS
En todo el grupo, disminuyó de forma significativa el IAH tras la cirugía, pasando de 45,7 a 31,8 (p < 0,001). Se eliminaron aquellos factores que por sí solos podrían hacer variar el IAH, como la posición y el peso. Se evaluó la influencia de los siguientes signos: hipertrofia úvulo-palatina, hipertrofia amigdalar, flaccidez úvulo-palatina, macroglosia y/o retrognatia (alteraciones anatómicas que favorecen o producen por sí solas un SAHS), objetivando que los pacientes que presentaban hipertrofia y/o flaccidez úvulo-palatina, además de su patología nasal, mejoraron significativamente su IAH tras la cirugía.
CONCLUSIONES
La septoplastia funcional es un tratamiento efectivo en pacientes con SAHS y dismorfia septal, ya sea aislada, o bien co-existiendo con una hipertrofia y/o flaccidez úvulo-palatina.
PALABRAS CLAVE
Insuficiencia respiratoria nasal. Dismorfia septal. SAHS.
Comunicación breve
DISMORFIA SEPTAL Y SAHS
M.J. Jurado*, O. Romero*, T. Sagalés*, J. Lorente**, N. Moreno*** y A. Milà *
*S. Neurofisiología Clínica. **S. ORL. ***S. Preventiva. Hospital Vall d'Hebrón. Barcelona. España.
INTRODUCCIÓN
Se considera que la desviación del tabique nasal (dismorfia septal) puede ser un factor etiológico en el SAHS.
Cuando la dismorfia septal es severa, altera la dinámica del flujo de aire a través de las fosas nasales produciendo un incremento de los gradientes de presión de las vías respiratorias altas, y desencadenando un colapso faríngeo: mecanismo vinculado con la fisiopatología del SAHS.
OBJETIVO
Evaluar la eficacia de la cirugía nasal (septoplastia funcional) en un grupo de pacientes con SAHS, mediante PSG nocturna previa y posterior a la cirugía.
MATERIAL y MÉTODOS
Se estudiaron 34 pacientes con insuficiencia respiratoria nasal y sintomatología de roncopatía crónica, remitidos a nuestro laboratorio de sueño para descartar SAHS, durante el período de 1997 al 2003.
Se incluyeron aquellos con diagnóstico de SAHS (IAH > 10/h), confirmados por PSG, y con dismorfia septal, confirmada por exploración ORL.
Ningún paciente refirió síntomas de rinitis alérgica ni se objetivaron signos de ésta en la exploración.
Se realizaron estudios PSG nocturnos 3-6 meses antes (basal) y 6 meses después de la cirugía nasal (visita postquirúrgica).
RESULTADOS
Los 34 pacientes fueron diagnosticados de SAHS.
En todo el grupo, disminuyó de forma significativa el IAH tras la septoplastia funcional, pasando de 45,7 a 31,8 (p < 0,001).
Se valoraron posibles factores que pudieran modificar los resultados:
El factor peso, evaluado como índice de masa corporal (IMC), no cambió significativamente después de la cirugía nasal (28 ± 2,6 frente a 27,9 ± 2,5).
Se estudió el IAH durante la posición de decúbito supino y de decúbito lateral para objetivar el factor posición. Un 63% de los pacientes mejoraron notablemente en la posición de decúbito lateral disminuyendo el IAH postquirúrgicamente de 30 a 19. Un 34% de los pacientes también mejoraron en la posición de decúbito supino, pasando de un IAH 65,9 antes de la cirugía a 44,7 después. En 4 pacientes (11,7%) no fue posible registrar la posición y 5 pacientes (16,6%) habían dormido toda la noche en decúbito supino.
Finalmente, se evaluó la influencia de la coéxistencia de uno o más de los siguientes signos: hipertrofia úvulo-palatina,hipertrofia amigdalar, flacidez úvulo-palatina, macroglosia y/o retrognatia (alteraciones anatómicas que producen o favorecen por sí solas un SHAS), objetivando que los pacientes que presentaban hipertrofia y/o flacidez úvulo-palatina, además de su patología nasal, mejoraron significativamente su IAH postquirúrgico.
CONCLUSIÓN
1. Concluímos que la septoplastia funcional es un tratamiento eficaz en pacientes con SAHS y dismorfia septal, ya sea aislada, o bien coexistiendo con una hipertrofia y/o flacidez úvulo-palatina.
Esta mejoría puede estar enmascarada por la posición de decúbito supino durante el sueño, como se observó en nuestros pacientes, siendo imprescindible valorar el IAH en la posición de decúbito supino y lateral.
2. Es importante tener presente que en la etiología del SAHS puede estar implicada la dismorfia septal y que el realizar una anamnesis detallada y una exploración ORL será muy útil para detectarla.
BIBLIOGRAFÍA
Series F, St Pierre S, Carrier G. Effects of surgical correction of nasal obstruction in treatment of obstructive sleep apnea. Am Rev Respir Dis. 1992;146:1261-5.
Penel T, Moller M, Becker HF. Effects of sleep position and sleep stage on the collapsibility of the upper airways in patients with sleep apnea. Sleep. 2001;1:24 (1):90-5.
Henner D, Scharf S, Lieberman A, Lavie P. Sleep apnea syndrome treated by repair of deviated nasal septum. Chest. 1983;84:184-5.
Rappai M, Collop N, Kemp S, De Shazo R. The nose and sleep-disordered breathing. Chest. 2003;124:2309-23.
Verse T, Maurer J, Pirsig W. Effect of nasal surgery on sleep-related breathing disorders. Laryngoscope. 2002;112: 64-8.
Friedman M, Tanyeri H, Lim J. Effect of improved nasal breathing on obstructive sleep apnea. Otolaryngol Head Neck Surg. 2000;122:71-5.
Lofaso F, Coste A, Ortho MP. Nasal obstruction as a risk factor for sleep apnea syndrome. Eur Respir 2000;16: 639-43.
RITMIAS DEL SUEÑO: TRATAMIENTO
M. Morell, M. Cubel, R. Genis, P. Aguas y G. Pin
Unidad Valenciana del Sueño. Valencia. España.
OBJETIVO
Valorar la eficacia de un tratamiento no farmacológico de las ritmias del sueño
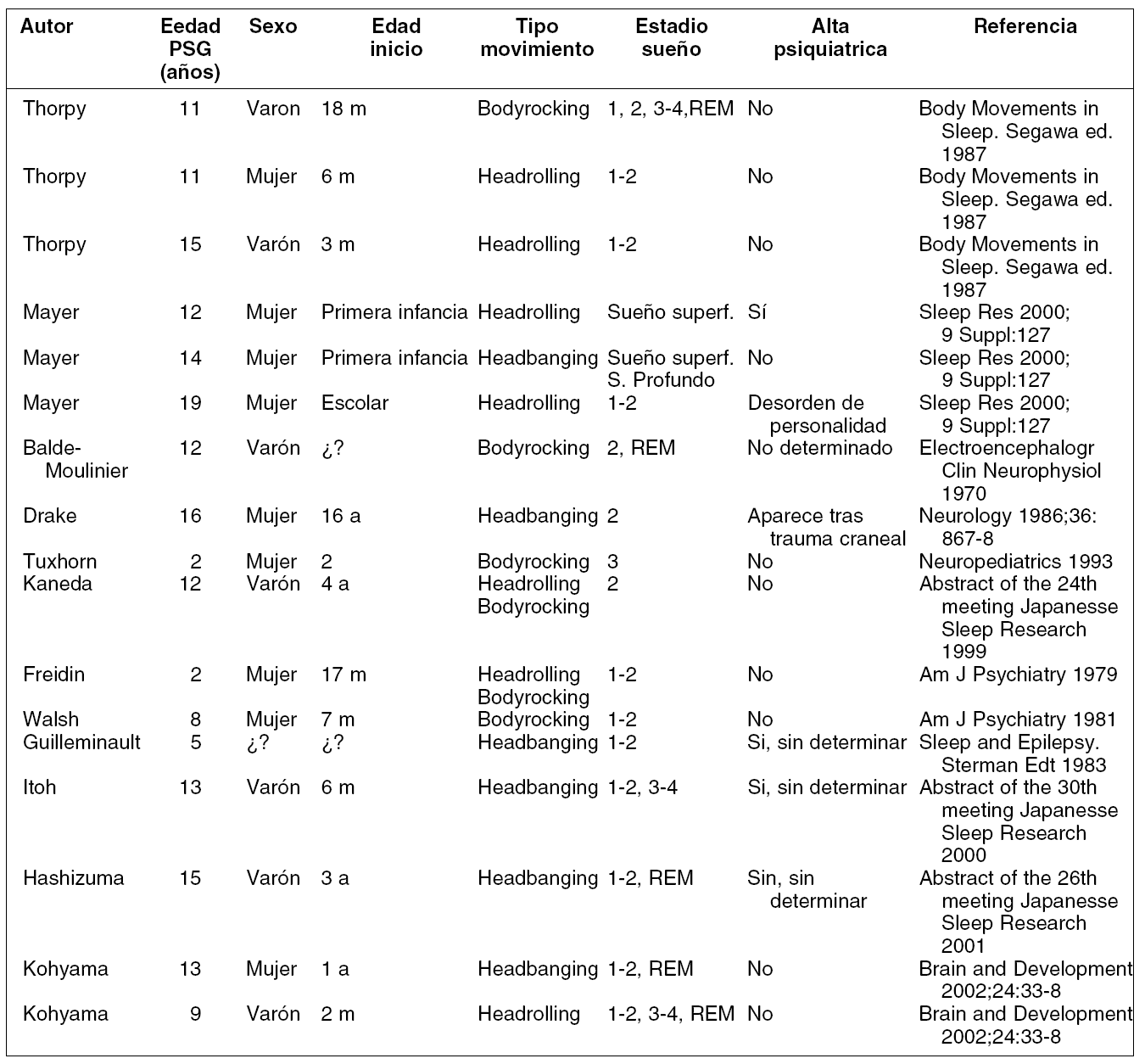
De una serie de 6 casos presentamos uno de ellos como muestra significativa.
CONCEPTO DE RITMIA DE SUEÑO
Parasomnias caracterizados por movimientos repetitivos de la cabeza, tronco o extremidades durante la transición vigilia-sueño o durante el sueño nocturno.
DESCRIPCIÓN CLÍNICA DEL CASO
Mujer de 12 años que consulta por movimiento de golpeteo en decúbito prono.
A las 2 ó 3 horas de sueño "cabezazos rítmicos contra el almohadón" varias veces a lo largo de la noche y todas las noches.
Antecedente: movimientos similares desde bebé para iniciar el sueño y durante el mismo.
Hermano de 9 años clínica similar.
No otros antecedentes de interés.
RMN y EEG con deprivación de sueño, normales. Exploración neurológica, otorrinolaringológica y neumológica sin anomalías.
TRATAMIENTO
Objetivo: Interrumpir el movimiento y mejorar calidad de sueño.
Utilizamos un estímulo de naturaleza aversiva (despertar) desencadenado tras el aviso de movimiento proporcionado por un sonido (cascabeles) para establecer un condicionamiento (sonido-despertar), que desarrolle respuestas condicionadas de evitación.
Al inicio del tratamiento se introdujo un movimiento rítmico exterior (mecedora) asociado a un sonido externo (tic-tac de reloj) con el objetivo de convertir la conducta automática de la paciente en una conducta consciente y voluntaria.
Esta asociación se realizaba unos minutos antes de irse a la cama
En una segunda fase se asocia maniobra incompatible con posición decúbito prono que facilitaba la ritmia.
CONCLUSION
Se observa disminución de la rítmia sin efectos secundarios.
Eficacia del tratamiento basada en:
Colaboración familiar.
Conciencia de la ritmicidad.
Asociación de conducta aversiva.
Impedir las posturas favorecedoras.
Comunicación breve
RITMIAS DEL SUEÑO
G. Pin, M. Morell, M. Cubel, P. Aguas y I. Cubel
Unidad Valenciana del Sueño. Hospital Quirón Valencia. Valencia. España.
DEFINICIÓN
Son movimientos automáticos de mecimiento que algunos niños realizan para conciliar el sueño o durante el mismo, fueron descritos de manera independiente por Zappert y Crochet en 1905. Consisten en movimientos estereotipados, rítmicos ,que realizan con la cabeza o con todo el cuerpo. En ocasiones pueden acompañarse de sonidos guturales y tienen un ritmo regular de alrededor de un golpe por segundo. Típicamente su frecuencia es de 0,5-2 Hz.
Suelen iniciarse hacia los 9 meses (excepcionalmente se desarrolla a partir de los 18 meses) y raramente persisten más allá de los dos años. Lo presentan el 66% de los niños a los 9 meses, en los que se observa una buena calidad de sueño. Persisten en el 6% de los niños de 5 años1.
CLÍNICA
Clínicamente se presentan como movimientos anteroposteriores de la cabeza (head-banging), movimientos circulares de la cabeza (head-rolling) o movimiento de balanceo de todo el cuerpo (body-rocking).
Pueden observarse durante los alertamientos de cualquier fase del sueño y también en las transiciones del sueño a la vigilia y viceversa.
Hay un predominio en el sexo masculino respecto al sexo femenino (de 3 a 1).
Generalmente afecta a niños por otra parte sanos. Sin embargo, se pueden asociar a ciertas alteraciones del desarrollo tales como retraso mental o autismo. Los niños mayores de 6 años con ritmias del sueño presentan con mayor frecuencia síntomas neurológicos sutiles como desintegración sensoriomotora, confusión izquierda-derecha, aumento de sensibilidad a ciertos estímulos y disminución frente a otros, disminución del sentido de riesgo y aumento de la ansiedad en situaciones normales. Los test vestibulares muestran que, si bien las zonas periféricas del sistema vestibular están intactas, los circuitos centrales están menos desarrollados en los individuos que tienen rocking y banging3. Se ha identificado altas puntuaciones de ansiedad en niños con body rocking4.
Normalmente desaparecen espontáneamente antes de la adolescencia. Los que persisten más allá de los 6 años deberían ser estudiados.
ETIOLOGÍA
Existe una predisposición familiar a padecer el trastorno y se han barajado diferentes hipótesis etiológicas. Así se ha sugerido que son una forma de autoestimulación vestibular2 o parte de una conducta aprendida en la que el niño reproduciría los movimientos de mecimiento que realizan los padres al acunarlo.
Al parecer, en su génesis están envueltas las estructuras subcorticales.
DIAGNÓSTICO
El diagnóstico es eminentemente clínico:
Historia clínica y antecedentes familiares (predisposición familiar).
Cintas de vídeo aportadas por la familia.
Escalas de conducta infantil (Child Behaviour Checklist, Cuestionario de Cualidades y Dificultades).
Escala de Somnolencia Diurna Pediátrica.
Polisomnografía: especialmente si la clínica no permite un diagnóstico de certeza. En ella, los episodios se ven durante la vigilia, el adormecimiento o el sueño y pueden ocurrir con o sin evidencia de arousal desde el sueño. Se caracterizan por ondas de gran amplitud lo cual representa un artefacto asociado al movimiento más que una alteración subyacente de la actividad cerebral. La forma de las ondas es sincrónica con el movimiento repetitivo visto en el video y típicamente ocurren a una velocidad de 0,5-2 ciclos/segundo (fig. 1). También se observa un incremento del tono muscular. Generalmente arrancan del sueño NREM y muy raramente del REM5,6.
Figura 1.
En la tabla, tomada de Hohyama, se resumen los hallazgos de los diferentes estudios realizados referidos en la literatura hasta el año 2002:
Debe hacerse el diagnostico diferencial con:
Autismo: presencia de movimientos de mecimiento durante la vigilia.
Hipsarrítmia: a pesar de que las epilepsias nocturnas incluyan movimientos rítmicos de las extremidades, la semiología de estos movimientos es muy distinta: la asociación de un carácter tónico/clónico, asociado a desviación de la mirada, incontinencia o laceraciones de la lengua son muy sospechosas de epilepsia.
Espasmo mutans
Síndrome de la muñeca oscilante.
Síndrome de movimiento periódico de las piernas.
Tics
Autoagresión.
TRATAMIENTO
Generalmente no precisan tratamiento específico. Informar y calmar a los padres es primordial. En los niños pequeños se deben tomar medidas de precaución para disminuir el ruido y evitar que el niño se dañe físicamente. En todos los casos es importante Instaurar unos buenos hábitos de sueño y evitar el déficit de sueño.
En algunas ocasiones, sin embargo, debido a su frecuencia, intensidad y consecuencias diurnas es necesario iniciar un tratamiento. No obstante es quizás la parasomnia mas difícil de erradicar y excepcionalmente puede persistir hasta la edad adulta. El tratamiento puede ser farmacológico, conductual o mixto:
a) Tratamiento farmacológico: Benzodiacepinas (Clonazepam 1 mg nocturno) o antidepresivos tricíclicos.
Indicado especialmente cuando se asocia a SDAH o el trastorno persiste en la adolescencia o en la edad adulta y ,ocasionalmente, en determinadas circunstancias en las que este puede resultar embarazoso (dormir en presencia de extraños o fuera del domicilio habitual) o cuando la eficacia del sueño disminuye provocando sintomatología diurna (alteraciones de conducta, excesiva somnolencia diurna, afectación de la escolaridad).
b) Tratamiento Conductual (7,8). El método utilizado por nosotros consta de varias facetas.
Sobrecorrección utilizando un estímulo de naturaleza aversiva: los niños son despertados y obligados a caminar tras el aviso de movimiento que proporciona un sonido de cascabeles previamente colocados en la parte del cuerpo implicada en los movimientos. De esta manera, cada vez que el niño inicia el movimiento, el sonido avisa a los padres y el procedimiento de sobrecorrección se desencadena desarrollando respuestas condicionadas de evitación.
Práctica positiva: al inicio del tratamiento y antes de acostarse se introduce un movimiento rítmico (mecedora) asociado a un sonido externo (tic-tac de reloj) con el objetivo de convertir la conducta automática del niño en una conducta consciente y voluntaria.
Refuerzos positivos: la disminución de las ritmias nocturnas (observadas mediante el uso de autorregistros) conlleva la obtención por parte del niño de uno de los premios previamente pactados con los padres.
Seguimiento: se realiza un seguimiento de tres meses al terminar el procedimiento. Los rebrotes de la rítmia observados en este período responden rápidamente a la reinstauración dl tratamiento (3 casos de los 11 tratados)
c) Mixto: en 4 casos hemos utilizado durante la primera semana clonacepam nocturno debido a las importantes alteraciones de conducta y aprovechamiento escolar presentes. La retirada del fármaco supuso un rebrote de las ritmias durante la semana subsiguiente.
Nuestra experiencia con el tratamiento conductual abarca 11 casos con edades comprendidas entre 6 y 14 años. En 9 ocasiones la evolución ha sido satisfactoria con desaparición o marcada reducción de los movimientos y, especialmente, con mejoría clara de la somnolencia diurna y actividad escolar. La evolución de la disminución fue semejante en todos los casos a la observada en el caso presentado en el póster con un repunte de movimientos al inicio de tratamiento. La duración media del tratamiento es de 4 a 6 semanas.
Un paciente no experimentó mejoría con tratamiento conductual ni con tratamiento mixto, sin que encontráramos la causa después de investigaciones complementarias y se perdió la evolución. El último paciente incluido, una niña de 6 años, está pendiente del control evolutivo final aunque su evolución clínica durante la parte intensiva del tratamiento conductual ha sido positiva. El evidente inconveniente de esta técnica es la necesaria estricta colaboración por parte de los familiares.
BIBLIOGRAFIA
1.Klackenberg G. Rhythmic movements in infancy and early childhood. Acta Paediatr Scand. 1971;224 Suppl: 74-83.
2.Sallustro F, Atwell CW. Body rocking, head banging, and head rolling in normal children. J Pediatr. 1978; 93:704-8.
3.Golbin A. Periodic and rhythmic parasomnias. En: Sleep psychiatry, ed. A Goldin, H. Kravitz, L. Keith. 2004. p. 147-60.
4.Laberge L, Tremblay RE, Vitaro F, et al. Development of parasomnias from childhood to early adolescente. Pediatrics. 2000;106(1 pt 1):67-74.
5.Hoban TF. Rhytmic Movement Disorder in Children. CNS Spectrums. 2003;8(2):135-8.
6.Hohyama J, Matsukura F, Kimura K, Tachibana N. Rhythmic movement disorder: polysomnograhic study and summary of reported cases. Brain & Development. 2002;24:33-8.
7.Golding K. Nocturnal headbanging as a settling habit: the behavioural treatment of a 4 years old boy. Clinical Child Psychology and Psychiatry. 1998;31:1045-359.
8.Cyd C, Strauss A, Rubinoff B, Atkeson M. Elimination of nocturnal headbanging in a normal seven- year-old girl using overcorrection plus reguards. J Behav Ther & Exp Psychiat. 1983;14 (3):269-73.