La reciente incorporación de adalimumab (HUMIRA®) para su uso en la enfermedad de Crohn (EC) nos ha hecho pensar que para el clínico práctico sería interesante disponer de una breve guía de actuación, a modo de check list, con objeto de facilitar la labor diaria. Deliberadamente, no llevamos a cabo una revisión extensa, sino que adoptamos una actitud esquemática, señalando los puntos que a nosotros nos parecen útiles en el día a día. Hemos dividido el documento en tres partes, tratando de seguir la secuencia que seguimos en la consulta:
- 1.
Evaluación pretratamiento.
- 2.
Administración de la primera dosis de tratamiento.
- 3.
Administración y registro durante el tratamiento/seguimiento.
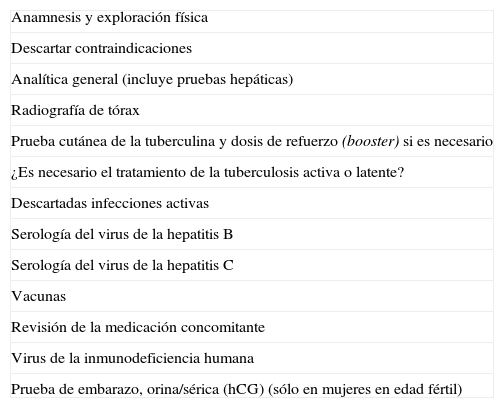
Adalimumab ha demostrado, en condiciones de ensayo clínico, su eficacia para el tratamiento de la EC activa moderada-grave, por lo que la ficha técnica del producto lo indica en pacientes que no hayan respondido a una terapia, completa y adecuada, con corticoides y/o inmunosupresores, o que son intolerantes o tienen contraindicaciones médicas para este tipo de tratamientos1. Por supuesto, es fundamental explicar al paciente en qué consiste el tratamiento, por qué esta indicado y sus riesgos potenciales, así como la necesidad de realizar estudios analíticos y radiológicos antes del iniciarlo (tabla I).
Lista de comprobación previa al tratamiento
| Anamnesis y exploración física |
| Descartar contraindicaciones |
| Analítica general (incluye pruebas hepáticas) |
| Radiografía de tórax |
| Prueba cutánea de la tuberculina y dosis de refuerzo (booster) si es necesario |
| ¿Es necesario el tratamiento de la tuberculosis activa o latente? |
| Descartadas infecciones activas |
| Serología del virus de la hepatitis B |
| Serología del virus de la hepatitis C |
| Vacunas |
| Revisión de la medicación concomitante |
| Virus de la inmunodeficiencia humana |
| Prueba de embarazo, orina/sérica (hCG) (sólo en mujeres en edad fértil) |
Se deben descartar específicamente las siguientes afecciones: insuficiencia cardíaca congestiva, enfermedades desmielinizantes, lupus eritematoso sistémico, gestación o síntomas y/o signos de infección activa. Hay que verificar igualmente en los antecedentes clínicos la ausencia de enfermedad neoplásica o neurológica que pudiera afectar al uso del fármaco. En el interrogatorio se debe recabar información sobre contactos con pacientes con tuberculosis (TBC) y/o trabajo en áreas de riesgo (véase más adelante).
Contraindicaciones absolutas1De acuerdo con la ficha técnica, hay sólo tres contraindicaciones absolutas:
- –
Hipersensibilidad al principio activo o a alguno de los excipientes.
- –
TBC activa u otras infecciones graves tales como sepsis e infecciones oportunistas.
- –
Insuficiencia cardíaca moderada-grave (NYHA clases III/IV).
Es recomendable realizar un hemograma y bioquímica que incluya analítica hepática (GOT, GPT, GGT, fosfatasa alcalina y bilirrubina), proteína C reactiva y velocidad de sedimentación globular (VSG).
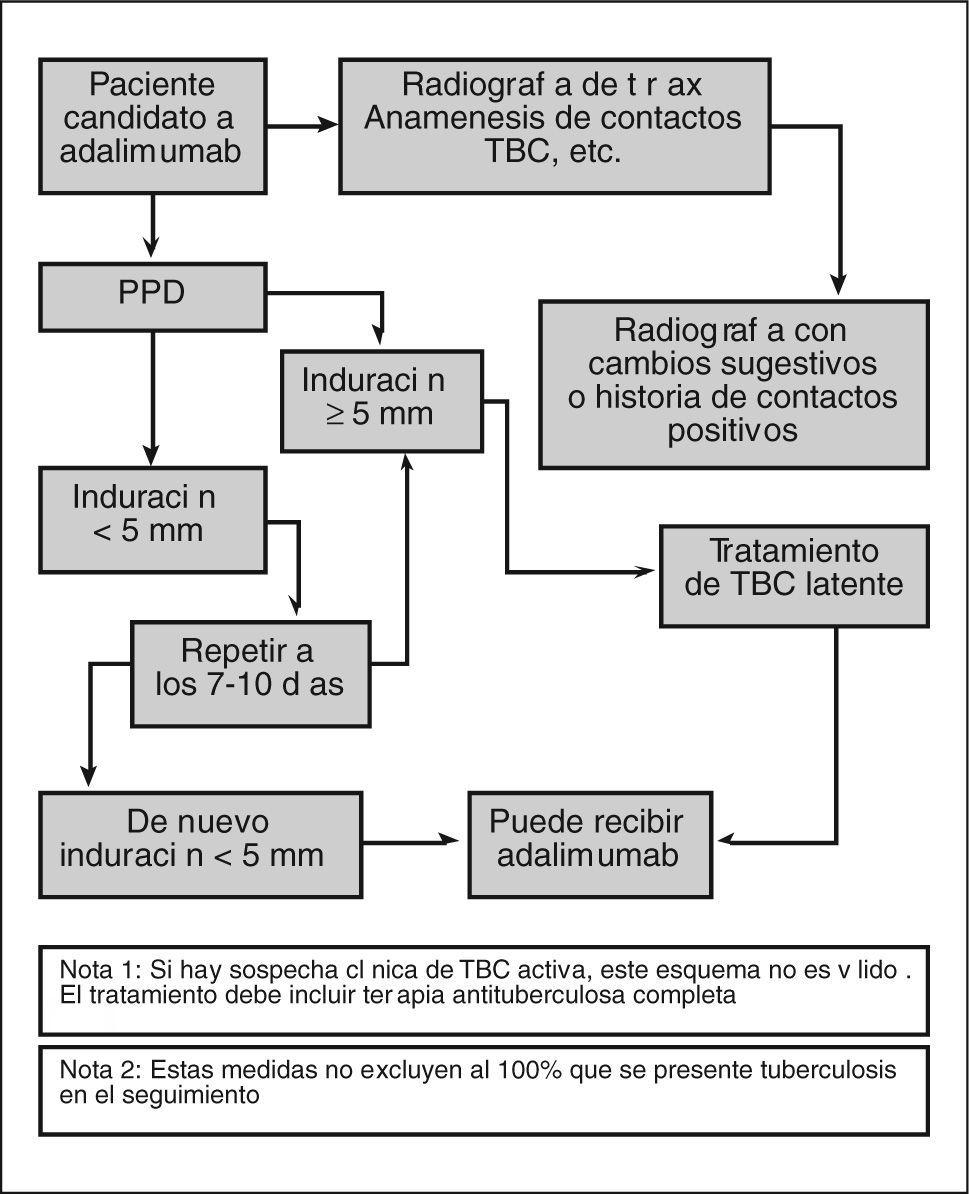
Análisis específicosTuberculosis2–8Antes de iniciar el tratamiento se debe evaluar en todos los pacientes la existencia de TBC activa o inactiva (latente) (fig. 1). Es muy importante realizar una anamnesis dirigida, interrogando acerca de la posibilidad de contactos recientes o remotos con pacientes afectados de TBC, antecedentes de vacunación BCG o el antecedente en la infancia de una neumonía no tratada.
Es imprescindible solicitar una radiografía de tórax y valorar cualquier cambio que indique la presencia de datos morfológicos sugestivos de infección activa o pasada de TBC.
Además, hay que realizar el test cutáneo de la tuberculina (PPD, prueba de Mantoux) en todos los pacientes (aplicando las recomendaciones locales). Se debe realizar siempre mediante una inyección intradérmica en el antebrazo y leerla a las 72 h, midiendo la induración en el eje transversal. Una induración de 5 mm tiene un significado positivo en pacientes con contactos recientes, infectados por el virus de la inmunodeficiencia humana (VIH), inmunodeprimidos, trasplantados de órgano sólido, portadores de una radiografía de tórax patológica o en tratamiento con inmunosupresores (incluida una dosis de prednisona ≥ 15 mg al día durante al menos 30 días). Estas situaciones, en realidad, incluyen prácticamente a todos los pacientes con EC activa en los que se considera el tratamiento con agentes anti-TNF, por lo que cualquier induración ≥ 5 mm debemos considerarla como un test positivo.
Dosis de refuerzo (booster)Todo paciente con un primer PPD negativo, especialmente si está inmunodeprimido, debería recibir una segunda dosis de refuerzo (booster), una semana después, en el antebrazo contrario, y se seguirán las mismas normas de lectura que en el test inicial.
Si como resultado de las exploraciones se diagnostica TBC activa, no debe iniciarse el tratamiento y, por supuesto, tratar la TBC convenientemente.
Tratamiento de la tuberculosis latenteSe realizará una profilaxis de TBC en todos los pacientes con contactos recientes, con un PPD positivo o con ambos, de acuerdo con las recomendaciones locales.
En el tratamiento de la infección tuberculosa latente, se han propuesto diferentes pautas y fármacos. La más habitual es isoniazida 300 mg/día durante 6-9 meses, con los controles habituales para detectar hepatotoxicidad. En caso de toxicidad o intolerancia al fármaco, la alternativa es rifampicina 600 mg/día durante 6 meses. En casos individuales, por condicionantes personales o locales, y previa consulta con médicos expertos, pueden utilizarse otras pautas.
Se desconoce el intervalo mínimo necesario entre el inicio de tratamiento de la infección TBC y los anti-TNF. Aunque se ha recomendado iniciar tratamiento anti-TBC un mes antes de comenzar tratamiento con biológicos, probablemente sea aplicable en caso de urgencia un intervalo menor, sólo de días, o incluso iniciar ambos tratamientos de forma simultánea.
Es importante informar a los pacientes de la posibilidad de presentar TBC durante o después del tratamiento y buscar activamente datos de sospecha de TBC (p. ej., tos persistente, debilidad/pérdida de peso, febrícula) hasta un año después de haber finalizado el tratamiento. En caso de diagnosticar TBC durante el seguimiento, se debe interrumpir la medicación e informar a las autoridades sanitarias.
Infecciones activas9–12El tratamiento con adalimumab no debe iniciarse en pacientes con infecciones activas, incluidas las crónicas o localizadas, hasta que éstas estén controladas. A los pacientes que desarrollen una nueva infección mientras estén bajo tratamiento se les debe realizar un seguimiento estrecho; la administración del fármaco deberá interrumpirse si un paciente desarrolla una infección grave, hasta que ésta esté curada.
Infección por el virus de la hepatitis B10,13,14Se recomienda conocer el estado inmunológico frente a una posible infección por el virus de la hepatitis B (VHB) mediante la determinación de marcadores virales (HBsAg, HBsAc y HBcAc). En pacientes con HBsAg positivo resulta prudente, de acuerdo con las evidencias indirectas (pacientes en quimioterapia) y directas disponibles, realizar profilaxis con un tratamiento antiviral antes de iniciar el tratamiento con adalimumab. En caso de presentar una reactivación del VHB durante el tratamiento, se debe interrumpir la administración del fármaco e iniciar una terapia antiviral efectiva con el tratamiento de soporte apropiado.
Infección por el virus de la hepatitis C10,14En pacientes tratados con anti-TNF no se han descrito reactivación de la infección por el virus de la hepatitis C (VHC) ni empeoramiento de la función hepática.
Infección por el virus de la inmunodeficiencia humana10,14Se debe evaluar la posibilidad de una infección por el VIH y el estado de ésta. La situación inmunológica individual y la evolución de la EC determinarán las decisiones clínicas concretas.
Autoinmunidad ANASalvo que el paciente presente sintomatología, no se considera necesario medir los ANA y anti-ADN. Si hay sintomatología que sugiera la posibilidad de fenómenos de autoinmunidad, se llevarán a cabo los tests individuales aconsejables en cada caso.
Test de embarazo15–17Es necesario preguntar por la posibilidad de embarazo en el momento de iniciar el tratamiento, puesto que no hay experiencia suficiente para asegurar la seguridad de la administración de adalimumab durante el embarazo. Por ello, a las mujeres en edad fértil se les debe recomendar utilizar un método anticonceptivo adecuado, y continuar su uso durante al menos 5 meses tras el último tratamiento con el fármaco. Si a pesar de lo anterior se produce un embarazo mientras la paciente está en tratamiento, se tomarán las decisiones con carácter individual, y con la participación de la paciente y sus allegados, previa información exhaustiva. No obstante, la experiencia con los agentes anti-TNF en el embarazo, aunque escasa, sugiere fuertemente que su uso es razonablemente seguro, mientras que una EC activa y grave compromete seriamente la salud de la madre y del nasciturus.
Exploraciones opcionales si fueran necesarias- –
En caso de fiebre, hay que realizar un coprocultivo, un hemocultivo y un urocultivo, así como las serologías que se consideren precisas según las circunstancias clínicas.
- –
En caso de enfermedad perianal, hay que hacer una evaluación clínica que incluya endoscopia rectal, y al menos dos de las tres exploraciones habituales: exploración bajo anestesia, resonancia magnética (RM) pélvica o ecografía endorrectal. La elección de las pruebas depende de cada caso y de la disponibilidad local. Es conveniente, para poder valorar posteriormente la evolución clínica de forma objetiva, determinar un índice de actividad, como el de Present o el PDAI.
- –
En caso de sospecha de absceso, se debe realizar una ecografía y/o una tomografía computarizada abdominal.
Es importante valorar y llevar un calendario de vacunaciones en el momento del diagnóstico, antes de administrar inmunosupresores que pudieran contraindicar algunas vacunas (p. ej., varicela). Se pueden administrar con total seguridad vacunas de gérmenes muertos, proteínas desnaturalizadas, hidratos de carbono o virus inactivos, aunque no hay evidencia suficiente para conocer cuál es la eficacia de las diferentes estrategias de vacunación en estos pacientes. No deben administrarse vacunas con microorganismos vivos en pacientes que reciben tratamiento inmunosupresor.
Se recomienda vacunar a todos los pacientes con el virus de la gripe con una periodicidad anual y con la vacuna an- tineumocócica cada 5 años. En este último caso se aconseja que se haga 2 semanas antes de comenzar el tratamiento inmunosupresor con el fin de aumentar su eficacia.
ADMINISTRACIÓN DE LA PRIMERA DOSIS DE TRATAMIENTO1,20–23El adalimumab (HUMIRA®) se presenta en pluma/ jeringa precargada (0,8 ml de solución inyectable mediante administración subcutánea, que contiene 40 mg). En España, se suele obtener en la farmacia hospitalaria, y el paciente debe conservar más adelante el fármaco en la nevera (a 2-8 oC) sin congelarlo. Se debe explicar al paciente el método de inyección, conservación, etc., y evaluar si está capacitado para seguir con el programa en su domicilio o si precisará inyectarse en el hospital, el centro de salud, por un allegado o por sí mismo. En caso de estar capacitados para la autoadministración, tras un adecuado aprendizaje de la técnica de inyección, los pacientes pueden autoinyectarse. De acuerdo con la ficha técnica que ha aprobado la Agencia Europea del Medicamento (EMEA), pueden utilizarse dos esquemas de dosis para la inducción de la respuesta: 160 mg el primer día (esta dosis puede administrarse mediante 4 inyecciones en un día o con 2 inyecciones por día durante 2 días consecutivos), 80 mg el día 14 y 40 mg el día 28; o bien 80 mg el primer día, 40 mg el día 14 y 40 mg el día 28. La elección de una u otra pauta debe individualizarse en función de la situación personal de cada paciente, aunque en opinión de los autores hay pocas razones para no utilizar como dosis estándar 160/80 (días 0 y 14) en la gran mayoría de los casos. Después de iniciar el tratamiento, la dosis inicial recomendada de mantenimiento, con carácter general, es de 40 mg administrados en semanas alternas.
ADMINISTRACIÓN Y REGISTRO DURANTE EL TRATAMIENTO/SEGUIMIENTOValoración clínicaEl objetivo de esta evaluación es no sólo valorar la eficacia del tratamiento sino detectar de forma precoz la aparición de efectos secundarios debidos a la medicación. Es conveniente realizar una anamnesis dirigida a la detección de infecciones (efecto adverso más frecuente) interrogando acerca de la presencia de fiebre, tos y/u otros síntomas respiratorios, síndrome miccional, pérdida de peso, presencia de adenopatías palpables y/o masa abdominal.
Valoración analíticaTambién es importante realizar una analítica de control con el fin de detectar posibles alteraciones hematológicas (pancitopenia, anemia, etc.), así como valorar los parámetros hepáticos periódicamente (la frecuencia dependerá del paciente y de la medicación concomitante) y, por supuesto, controlar los parámetros inflamatorios.
Eficacia clínica21,24–30Para algunos pacientes que no han respondido al tratamiento en la semana 4, puede ser beneficioso continuar con una terapia de mantenimiento hasta la semana 12. La terapia continuada debe ser cuidadosamente reconsiderada en pacientes que no hayan respondido dentro de este período. En algunos pacientes que han experimentado una disminución de su respuesta, puede ser beneficioso un aumento de la dosis a 40 mg semanales.
Durante el tratamiento deben optimizarse otras terapias concomitantes (p. ej., corticoides y/o agentes inmunomoduladores). De hecho, un signo de eficacia del tratamiento es poder reducir la dosis de corticoides, y el objetivo es retirarlos.
Consideraciones específicas complementariasA los pacientes se les puede entregar una tarjeta de alerta especial, aunque un buen informe clínico es siempre preferible; además, lo más importante en la clínica diaria es que tanto ellos como sus médicos de familia dispongan de una buena comunicación con el gastroenterólogo responsable. Se debe educar a los pacientes para que consulten con su médico si aparecen signos/ síntomas que sugieran tuberculosis (p. ej., tos persistente, debilidad/pérdida de peso, febrícula) durante o después del tratamiento. Parece recomendable evaluar al paciente 2-4 semanas después de la primera dosis e indagar, entre otros aspectos, los beneficios obtenidos, los efectos secundarios, los problemas con la inyección, etc. Según la práctica habitual de cada centro, se debe citar periódicamente al paciente en la consulta (cada 3 meses habitualmente) para efectuar una anamnesis, una exploración física y estudios complementarios si se precisan (analítica incluida). No obstante, para el paciente son mucho más importantes las visitas urgentes o semiurgentes que las visitas programadas: el equipo responsable debe intentar conseguir que el acceso del paciente a la consulta sea fluido.
Enfermedad perianal21,31–34El control de pacientes con enfermedad fistulizante se realiza en la visita basal, a las 4 semanas tras la inducción y posteriormente cada 3-4 meses. La exploración física se realizará evaluando el estado de los sedales (si los lleva), el número de orificios fistulosos y la existencia o no de drenaje a la compresión (evaluando el contenido de salida de los orificios externos). Se recomienda el control evolutivo de la enfermedad con un índice de actividad específico, realizando estudios de imagen si se considera oportuno (endoscopia, RM, ecografía anal, etc.).
La reunión fue financiada por Laboratorios Abbott. Los firmantes han recibido, en diverso grado, ayudas para asistencia a reuniones y congresos por parte de Abbott y de otras empresas de la industria farmacéutica relacionadas (Schering-Plough y UCB en concreto). No obstante, la elaboración del manuscrito final ha sido totalmente independiente.
Queremos expresar nuestro agradecimiento a Javier Rodríguez, del Departamento Médico de Abbott, por su ayuda en la coordinación del esfuerzo del grupo.
Las recomendaciones aquí expresadas reflejan el consenso entre los autores, de acuerdo con su práctica clínica habitual, y se han elaborado con la intención de facilitar una sinopsis de la información disponible, sin ninguna pretensión normativa.
Este documento se ha elaborado conjuntamente por todos los firmantes, tras una reunión física en la que se elaboró un documento preliminar, cuyos sucesivos borradores han sido revisados mediante comunicación por correo electrónico. Todos los autores han participado por igual, y por eso están listados por orden alfabético.