El cáncer de pulmón es la primera causa de muerte por cáncer en el mundo. En Chile es la segunda causa de muerte por cáncer después del cáncer gástrico, con una sobrevida a cinco años de un 15%. Esta realidad se debe principalmente a que su diagnóstico se hace en etapas avanzadas de la enfermedad. De ahí la importancia de los esfuerzos para lograr su detección precoz en poblaciones de alto riesgo.
Los exámenes imaginológicos que en la actualidad se utilizan en el diagnóstico del cáncer pulmonar son la radiografía simple de tórax, la tomografía computada, la resonancia magnética y el PET-CT. En este artículo se analizará el rendimiento de estos exámenes en el diagnóstico y etapificación del cáncer pulmonar, así como la influencia de éstos en el tratamiento, pronóstico y evolución de esta enfermedad.
Lung cancer is the first cause of cancer related death worldwide. In Chile lung cancer is the second cause of death by cancer after stomach cancer with a five year survival rate of 15%. This reality is mainly due to diagnosis in late stages of the disease. Thus the importance of the efforts to get an early detection in high risk populations.
Imaging tests actually used in lung cancer diagnosis include plain x ray, computed tomography, magnetic resonance and PET-CT. The aim of this article is to analize the accuracy of this methods in diagnosis and lung cancer staging as well as their incidence in treatment, prognosis and evolution of this disease.
El principal factor causal del cáncer pulmonar es el tabaquismo. Otros factores de riesgo son la exposición a agentes cancerígenos como asbesto, arsénico, radón, pesticidas y otros. La enfermedad pulmonar obstructiva crónica per se es otro factor de riesgo. También lo es la fibrosis pulmonar difusa, especialmente idiopática (FPI). Existen además factores genéticos que predisponen al desarrollo de un cáncer pulmonar.
Clasificación del cáncer pulmonarEl cáncer pulmonar se clasifica en cáncer de células no pequeñas (CCNP) y cáncer de células pequeñas (CCP). Aproximadamente el 85% de los casos corresponde a CCNP y el 15% a CCP (1, 2).
Histológicamente los principales tipos de CCNP son el adenocarcinoma (+/- 35%) y el carcinoma de células escamosas (+/- 30%). Cánceres que no presentan características definitivas de adenocarcinoma o de carcinoma escamoso se consideran desde el punto de vista histopatológico como cánceres de células no pequeñas no especificados (not otherwise specified carcinomas) y constituyen aproximadamente un 10% de los tumores malignos pulmonares. El cuarto tipo de CCNP es del carcinoma de células grandes (+/-10%).
AdenocarcinomaLocalización preferentemente periférica y en lóbulos superiores. Suele dar metástasis precozmente.
No presenta necesariamente asociación con tabaquismo.
Actualmente el adenocarcinoma se clasifica en:
1)Lesiones preinvasivas- a)
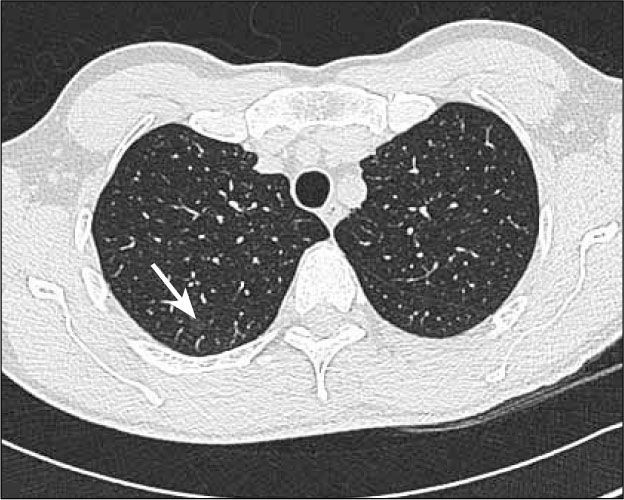
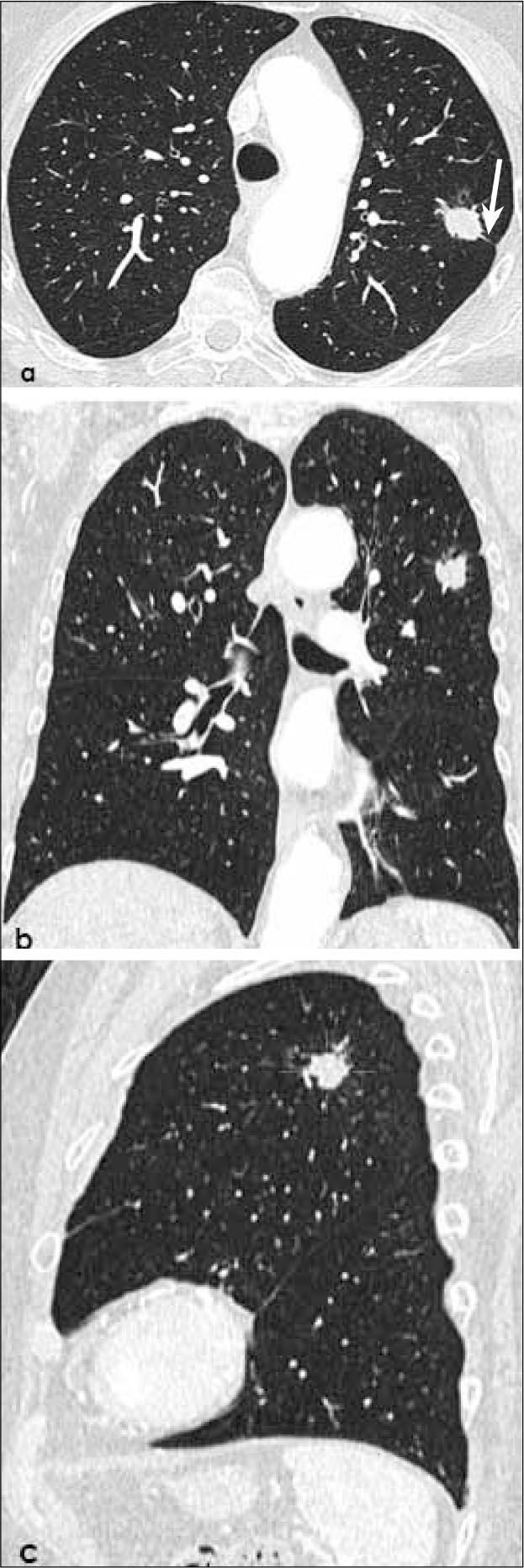
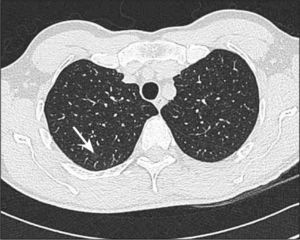
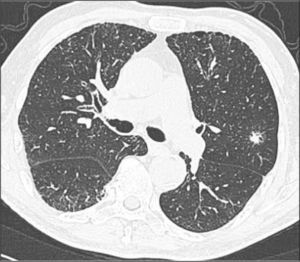
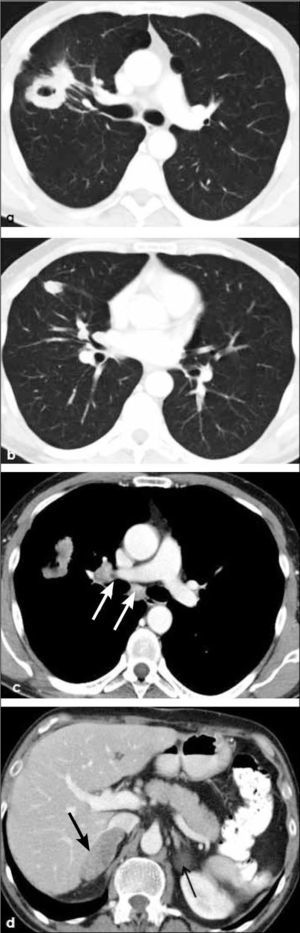
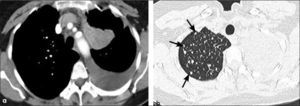
Hiperplasia adenomatosa atípica (HAA). Lesión de opacidad en vidrio esmerilado habitualmente no mayor de 5.0mm de diámetro (Figura 1).
- b)
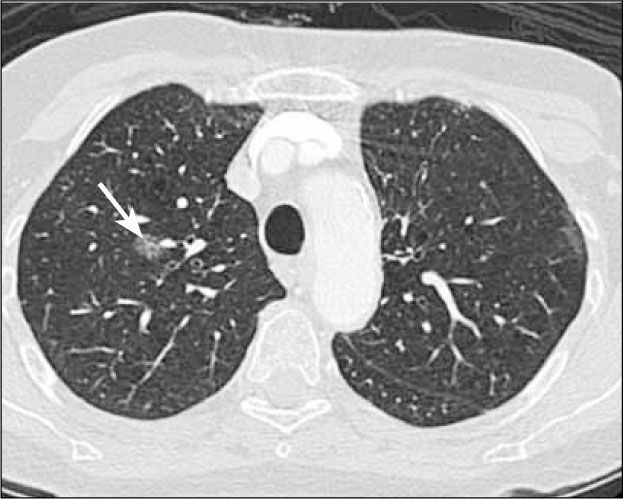
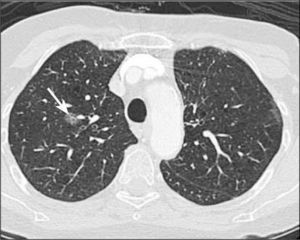
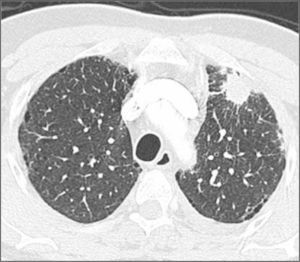
Adenocarcinoma in situ (AIS). Lesión preferentemente de opacidad en vidrio esmerilado con un diámetro de hasta 3.0 cm (Figura 2). Corresponde al antes denominado carcinoma bronquioloalveolar, término que la Clasificación Internacional Multidisciplinaria del Adenocarcinoma Pulmonar sugiere eliminar. La opacidad en vidrio esmerilado se debe al crecimiento lepídico de estas lesiones, lo que significa que las células neoplásicas se adosan o recubren las paredes alveolares, sin invadir el estroma pulmonar miofibroblástico (3).
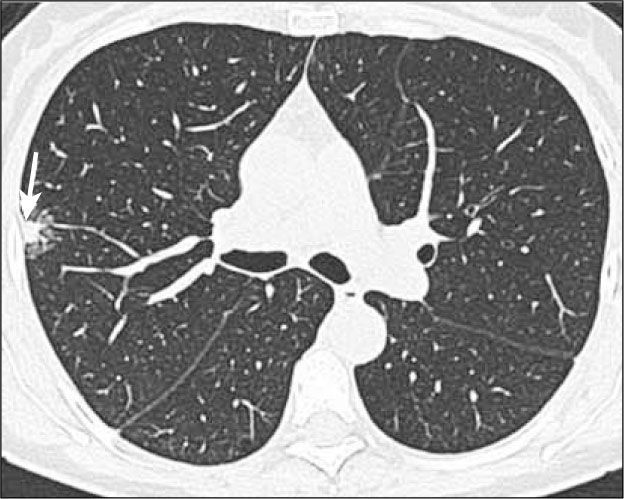
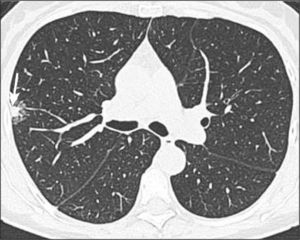
Lesión de hasta 3.0 cm de diámetro, habitualmente de opacidad en vidrio esmerilado y con un componente invasivo sólido con un diámetro de hasta 5.0mm (Figura 3). La invasión sólo afecta al estroma pulmonar, sin comprometer vasos sanguíneos, linfáticos ni pleura; de haberla, el tumor pasa a ser invasivo (3). Con frecuencia se observa un solapado (overlap) entre HAA, AIS y AMI.
3)Adenocarcinoma predominantemente lepídico (APL)Se sugiere esta denominación para lesiones mayores de 3.0 cm de diámetro y que no obstante pueden corresponder a AIS o a AMI (3).
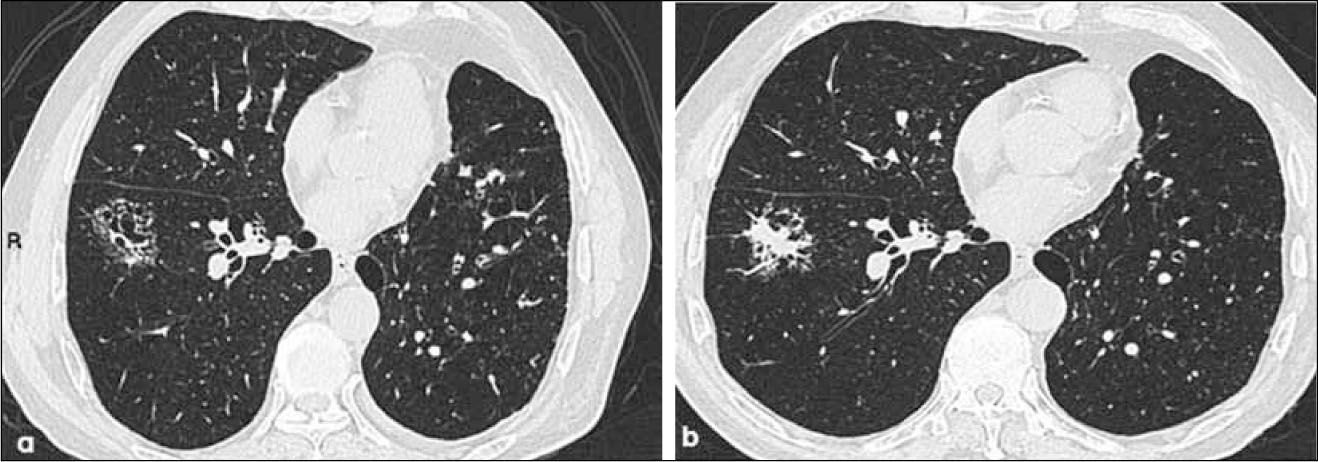
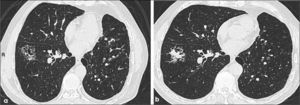
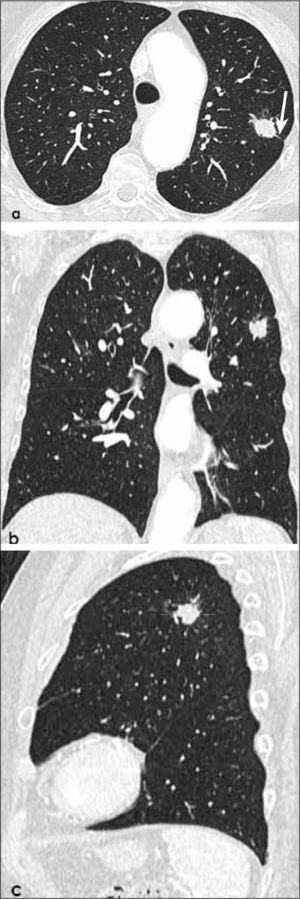
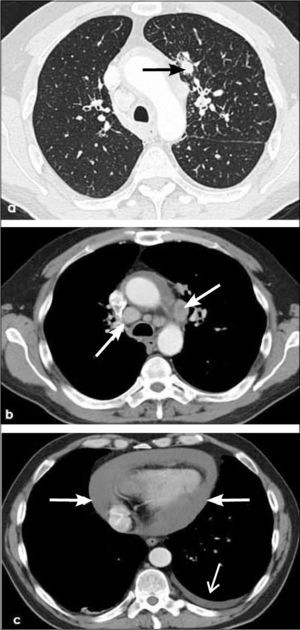
4)Adenocarcinoma invasivoa, b, c: Opacidad nodular sólida de 2.5 cm de diámetro en lóbulo superior izquierdo en corte axial y reconstrucciones coronal y sagital. Contornos espiculados y al menos una línea con contacto pleural, habitualmente fibrótica (flecha en a). Compatible con adenocarcinoma invasivo.
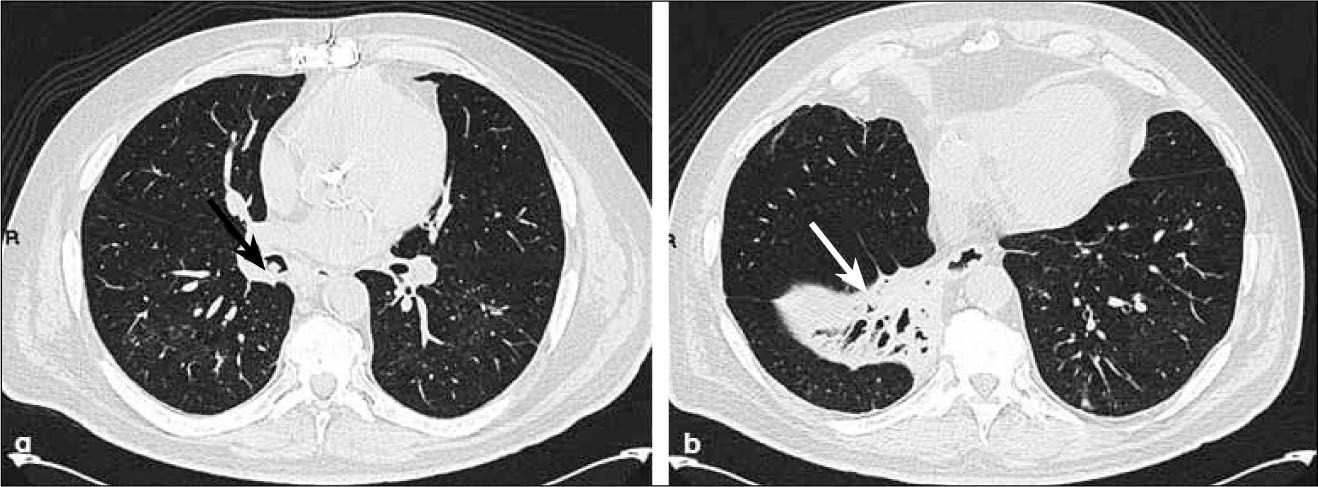
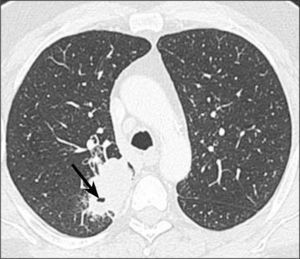
Las lesiones premalignas son la displasia escamosa y el carcinoma escamoso in situ. De localización preferentemente central, originándose en bronquios principales, lobares o segmentarios. Suele manifestarse como lesión endobronquial, obstrucción bronquial, infiltración de pared bronquial e invasión local. Da metástasis más tardías. Frecuentemente provoca atelectasia o bien neumonía obstructiva (Figura 6). Además se cavita con frecuencia (Figura 7). Tiene estrecha relación con tabaquismo.
Existe un grupo de cánceres pulmonares de células no pequeñas que presentan características histológicas mixtas que no permiten ser clasificados como adenocarcinoma ni carcinoma escamoso. Estas neoplasias, con diferente agresividad de acuerdo al tipo celular y grado de diferenciación, son actualmente denominadas carcinomas no especificados. Tienen relación variable con el hábito tabáquico.
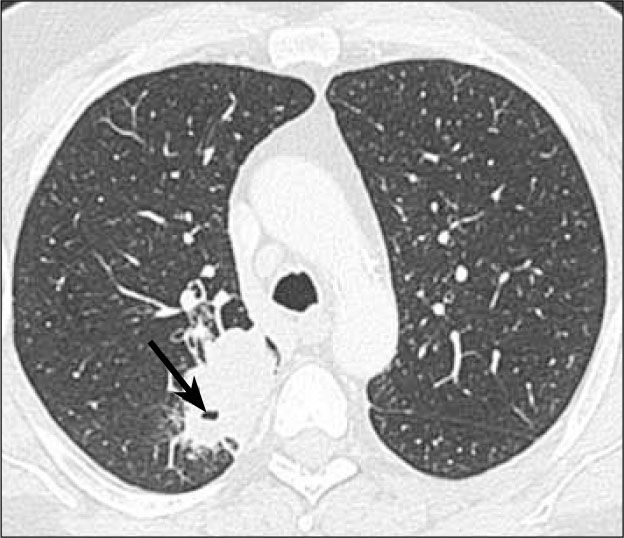
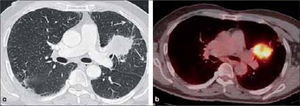
Carcinoma de células grandesDe gran tamaño y habitualmente periférico. Presenta características imaginológicas similares con el adenocarcinoma, exceptuando por su tamaño, generalmente mayor de 4.0 cm (Figura 8). Da metástasis tempranas. Se asocia con tabaquismo. Metastatiza precozmente y es de mal pronóstico. Tiene relación con tabaquismo.
Un subtipo a considerar es el carcinoma de células grandes neuroendocrino, también de mal pronóstico aunque menos agresivo que el cáncer de células pequeñas.
Cáncer de celulas pequeñasCorresponde a aproximadamente al 15% de los tumores malignos del pulmón.
Es de origen neuroendocrino. Habitualmente ya diseminado al momento del diagnóstico. Se localiza generalmente en bronquios principales o lobares.
Invade bronquios y provoca masas hiliares y/o perihiliares de tamaño significativo. Se asocia con extenso compromiso ganglionar metastásico hiliar y mediastínico (Figura 9). Da además metástasis a distancia precoces. Muy mal pronóstico. Asociado con tabaquismo.
a, b: Cáncer de células pequeñas. El tumor se origina en un bronquio central provocando una gran masa compuesta por tumor y adenopatías mediastínicas bilaterales, comprimiendo e invadiendo vía aérea principal (flecha negra en a), ramas arteriales pulmonares y probablemente esófago y aorta descendente (flechas blancas en b). Se advierte además pequeño derrame pleural izquierdo.
Constituye el 1-2% de los cánceres pulmonares. Se origina en células neuroendocrinas de las paredes bronquiales. Es histológicamente diferente de otros tumores neuroendocrinos como el carcinoma neuroendocrino de células grandes y el carcinoma de células pequeñas. Suele provocar varios síndromes clínicos pues potencialmente puede producir y liberar péptidos neuroendocrinos activos. Existen dos tipos de tumor carcinoide:
- 1)
Carcinoide típico (70-90%). Es de baja malignidad y localmente invasivo (Figura 10). Las metástasis son poco frecuentes (1). No se asocia con tabaquismo.
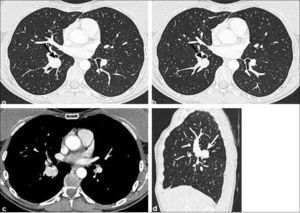
Figura 10.a, b, c, d: Tumor carcinoide típico. Masa de contornos netos de 4.0 cm de diámetro en lóbulo inferior derecho que se insinúa en el bronquio lobar (flecha en a) y estenosa bronquio segmentario apical (flecha en b). Calcificaciones en su espesor. Hiperdenso con uso de contraste endovenoso ya que es hipervascularizado (flecha en c). d) Reconstrucción sagital (flecha).
(0.24MB). - 2)
Carcinoide atípico (10-25%). Es más agresivo y localmente invasivo. Da metástasis con mayor frecuencia. Se asocia con tabaquismo (1).
La radiografía simple frontal y lateral es habitualmente el examen ini-cial que se efectúa en un paciente con sospecha de cáncer pulmonar. Sin embargo, lesiones nodulares pequeñas menores de 2.0 cm de diámetro, opacidades focales de baja densidad o procesos parenquimatosos en determinadas localizaciones anatómicas pasan con frecuencia desapercibidas. En ocasiones la presencia de atelectasia sugiere una lesión neoplásica que obstruye la vía aérea.
La tomografía computada de tórax, ocasionalmente la resonancia magnética y más recientemente el PET-CT (examen que combina la tomografía por emisión de positrones con la tomografía computada) son los métodos imaginológicos de elección utilizados actualmente en el diagnóstico, etapificación, pronóstico y evaluación de los resultados terapéuticos en cáncer pulmonar. Esto se debe a la gran capacidad de resolución espacial y/o de contraste que estos métodos poseen (además de la posibilidad de obtener imágenes multiplanares y/o tridimensionales indirectas o directas). El PET-CT utiliza como radiofármaco la 18F-fuoro-2-deoxi-D-glucosa (FDG), análogo de la glucosa, considerando el alto metabolismo glucídico que habitualmente presentan las lesiones cancerosas.
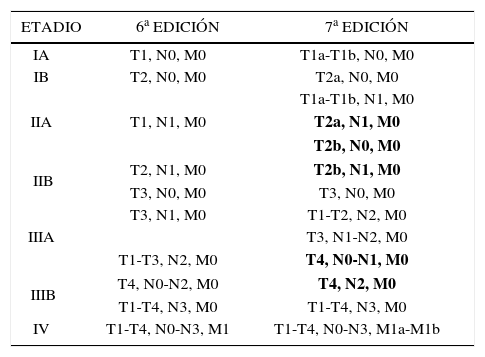
El sistema TNM de etapificación del cáncer pulmonar en su séptima edición (5, 6) tiene una importancia indiscutida en la evaluación pronóstica de esta enfermedad y en la elección de la terapia más adecuada para cada caso. El descriptor o etapificador T se refiere a las características del tumor primario, el N al compromiso ganglionar regional y el M a las metástasis intra y extratorácicas. La séptima edición, al igual que la sexta, considera la etapificación del CCNP pero aconseja además incluir el tumor carcinoide y el CCP pues se ha demostrado que este sistema también se correlaciona adecuadamente con el pronóstico de estos tumores y permite adoptar las medidas terapéuticas más adecuadas. Textos y artículos publicados hasta el año 2010 y utilizados como medios de estudio y consulta contienen el sistema de etapificación TNM en su sexta edición (4). Es conveniente por lo tanto estar al tanto de las diferencias entre ambos (Tabla 1).
Comparación del sistema sexta y séptima edición de etapificación tnm los cambios más relevantes se destacan con letras remarcadas
| ETADIO | 6a EDICIÓN | 7a EDICIÓN |
|---|---|---|
| IA | T1, N0, M0 | T1a-T1b, N0, M0 |
| IB | T2, N0, M0 | T2a, N0, M0 |
| T1a-T1b, N1, M0 | ||
| IIA | T1, N1, M0 | T2a, N1, M0 |
| T2b, N0, M0 | ||
| IIB | T2, N1, M0 | T2b, N1, M0 |
| T3, N0, M0 | T3, N0, M0 | |
| T3, N1, M0 | T1-T2, N2, M0 | |
| IIIA | T3, N1-N2, M0 | |
| T1-T3, N2, M0 | T4, N0-N1, M0 | |
| IIIB | T4, N0-N2, M0 | T4, N2, M0 |
| T1-T4, N3, M0 | T1-T4, N3, M0 | |
| IV | T1-T4, N0-N3, M1 | T1-T4, N0-N3, M1a-M1b |
Nota: los cambios importantes están con letras remarcadas (5).
El sistema de etapaficación actual clasifica al tumor primario (T) de acuerdo a su tamaño en las siguientes etapas:
-T1a: tumor de hasta 2.0 cm de diámetro máximo en el plano axial.
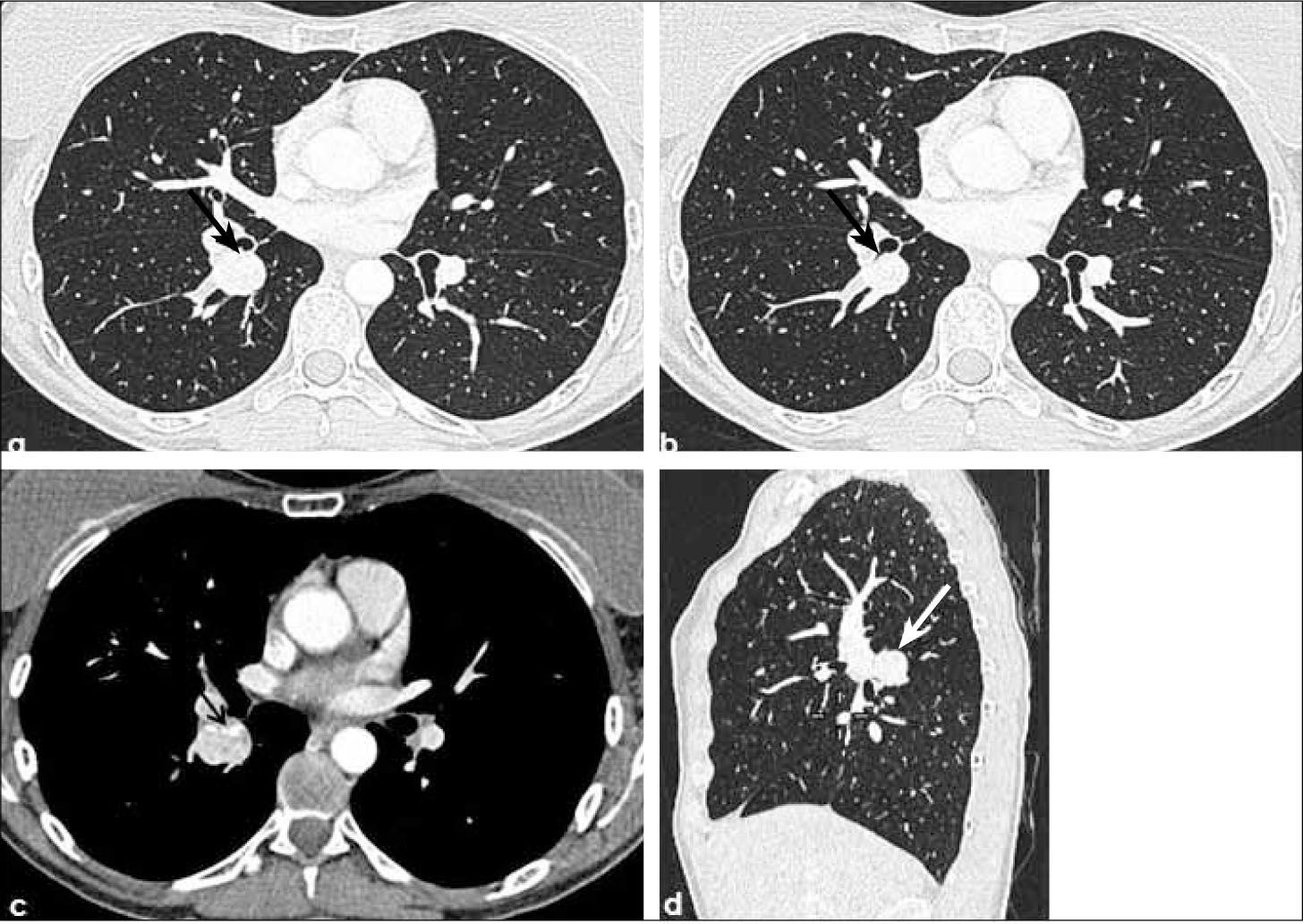
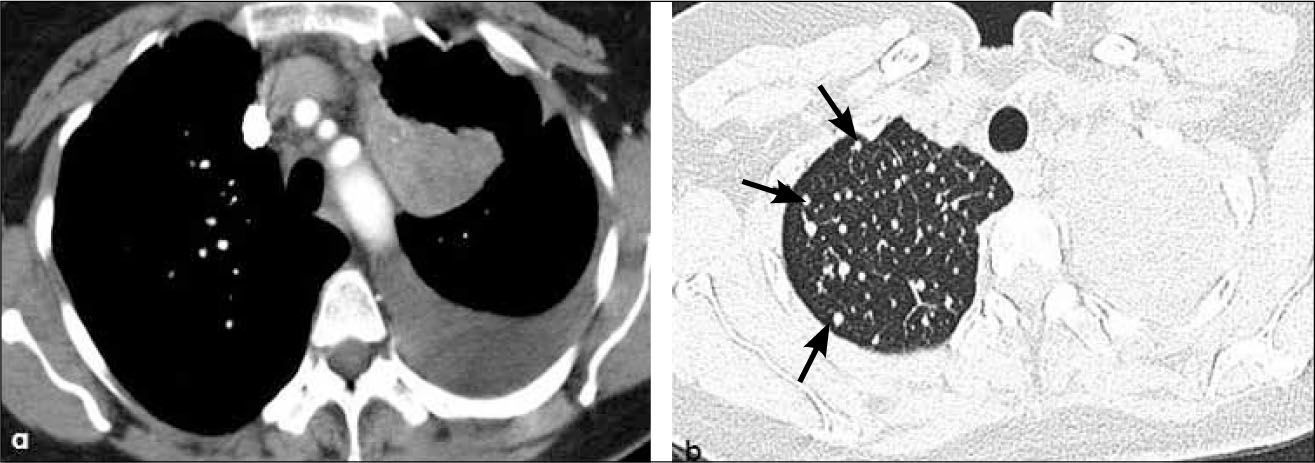
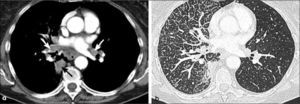
-T1b: mayor de 2.0 cm hasta 3.0 cm de diámetro. Tanto los tumores T1a como T1b se encuentran rodeados por parénquima pulmonar y/o pleura visceral y, de tener un componente endobronquial, éste no compromete bronquios lobares (Figuras 11 y 5).
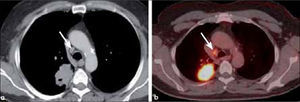
-T2a: tumor mayor de 3.0 cm hasta 5.0 cm de diámetro (Figura 12).
-T2b: mayor de 5.0 cm hasta 7.0 cm de diámetro (Figura 13).
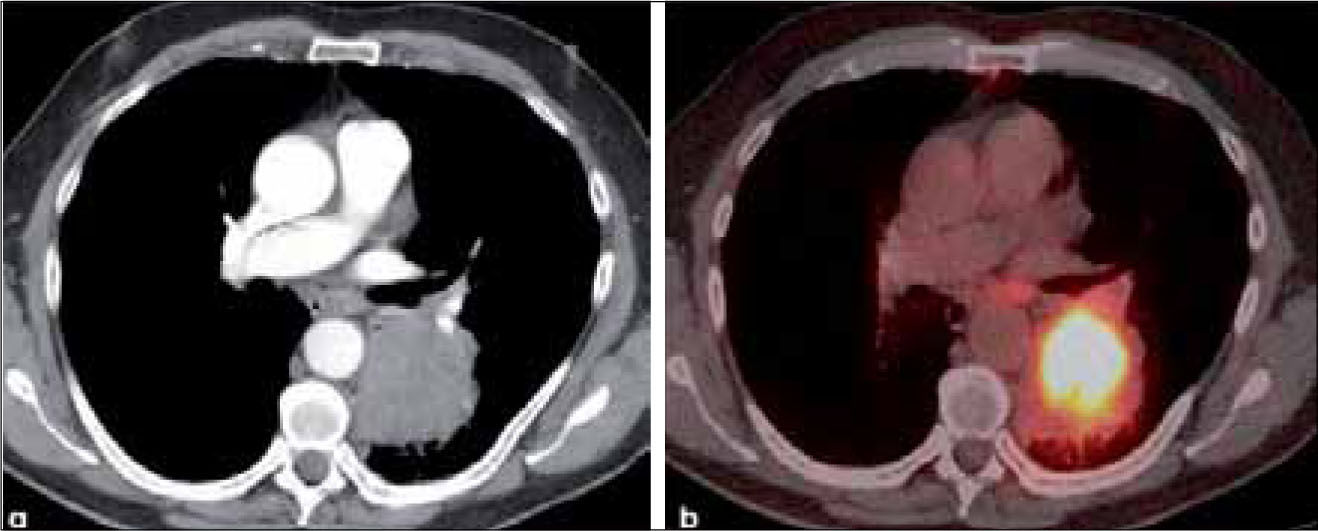
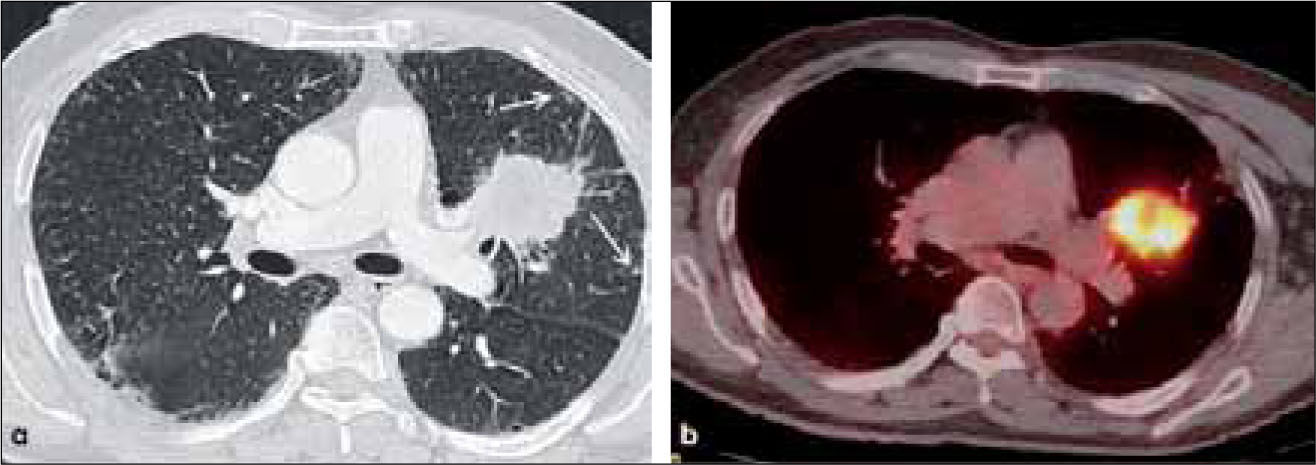
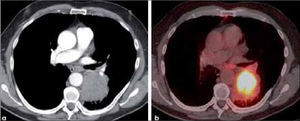
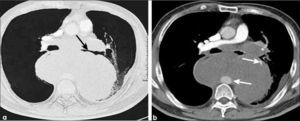
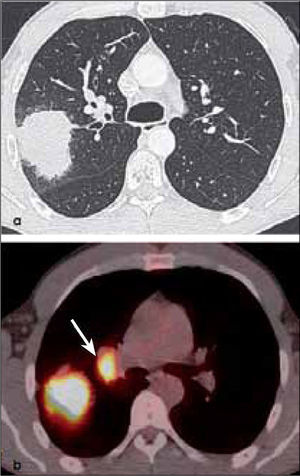
a, b: Adenocarcinoma de 7.0 cm de diámetro de contornos finamente espiculados en lóbulo superior derecho (a). En (b) el PET-CT muestra intensa captación del radiofármaco por el tumor primario y presencia de adenopatías hiliares ipsilaterales también hipermetabólicas (flecha). T2b-N1.
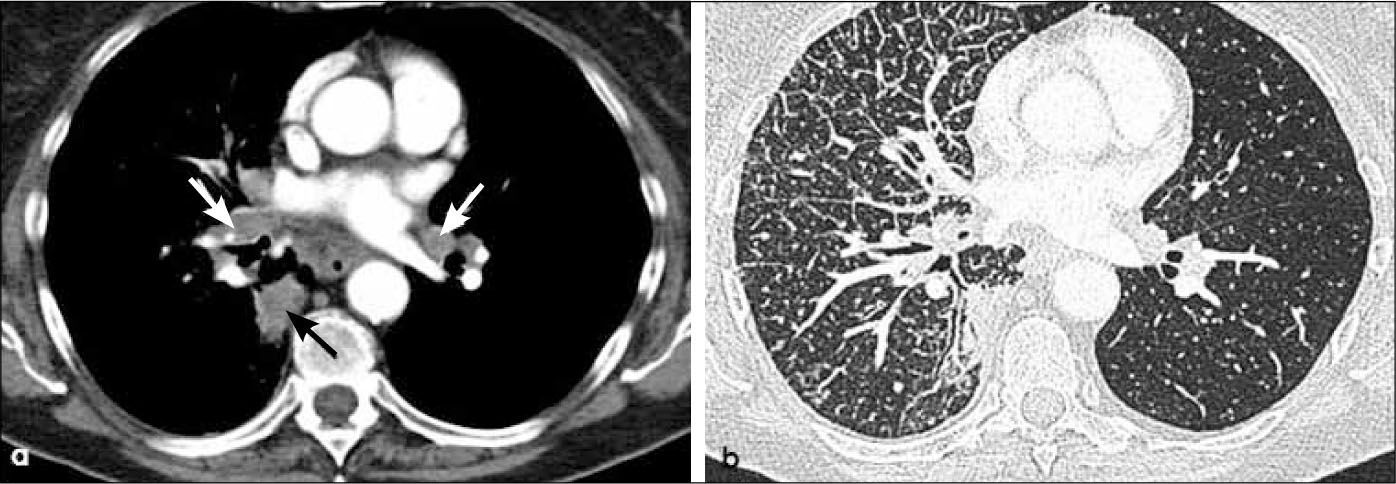
También se considera etapa T2 un tumor que invade sólo en forma local la pleura visceral y un tumor en región hilar que provoca atelectasia y/o neumonía obstructiva que no involucre todo el pulmón (Figura 14). Se considera además en esta etapa un tumor endobronquial a más de 2.0 cm de la carina (Figura 14).
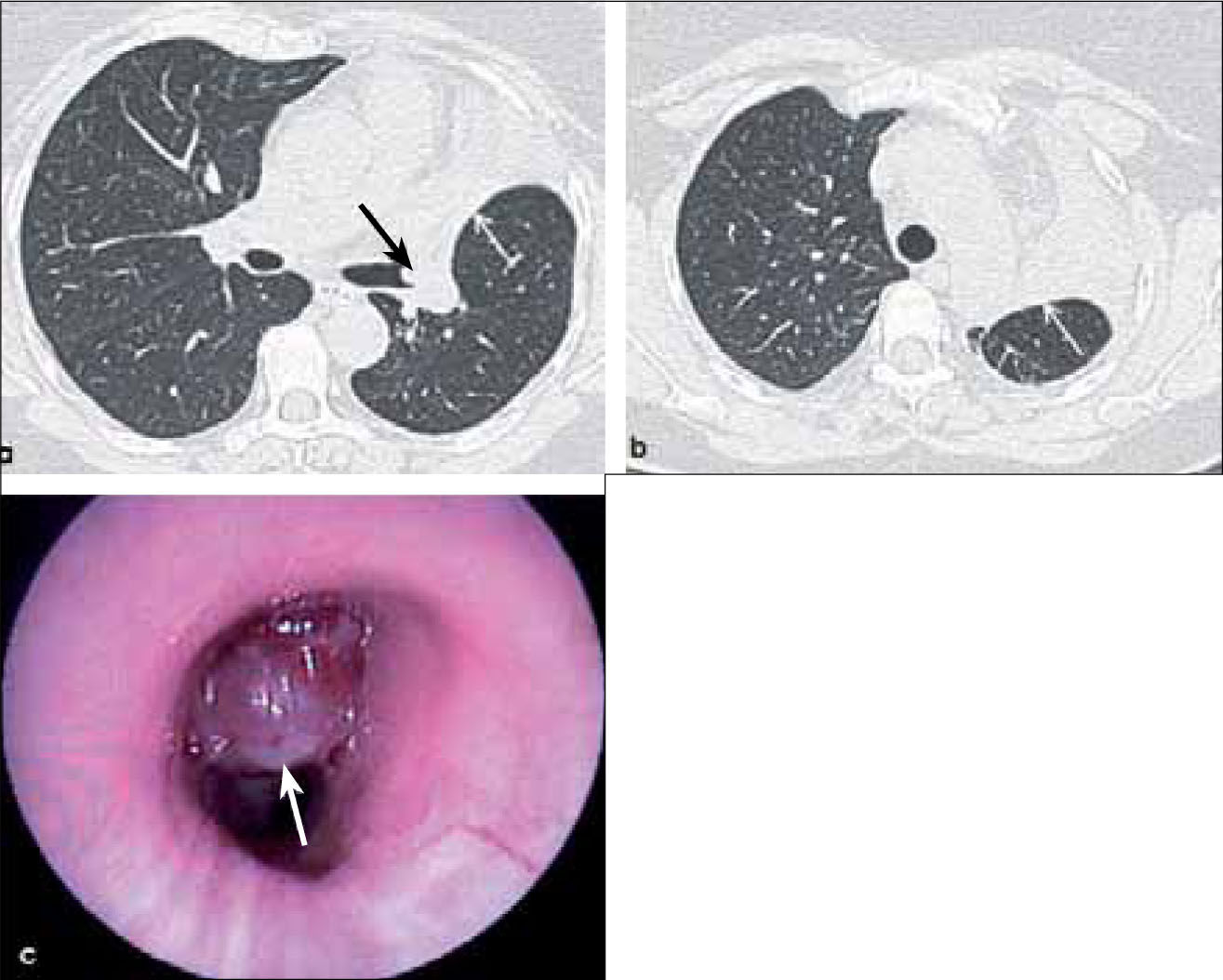
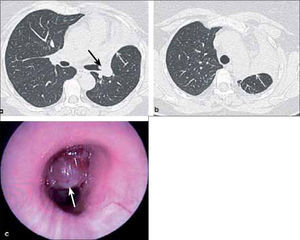
a, b, c: Tumor carcinoide atípico en lumen del bronquio lobar superior izquierdo (flecha negra en a) asociado con atelectasia obstructiva del lóbulo superior (flecha blanca en a y b). T2. La broncoscopía muestra la lesión en origen del bronquio lobar superior (flecha blanca en c). T2.
-T3: tumor mayor de 7.0 cm de diámetro (Figura 8). Independientemente de su tamaño, un tumor asociado con nódulos tumorales localizados en un mismo lóbulo (Figura 15) y una lesión neoplásica endobronquial a menos de 2.0 cm de la carina corresponden asimismo a esta etapa. También corresponde a T3 un tumor que invade localmente el diafragma, la pleura mediastínica, el pericardio parietal o la pared torácica, sin considerar su tamaño. Es además un tumor en etapa T3 el que provoca atelectasia completa del pulmón y también un tumor del vértice o sulcus pulmonar superior (Figura 16).
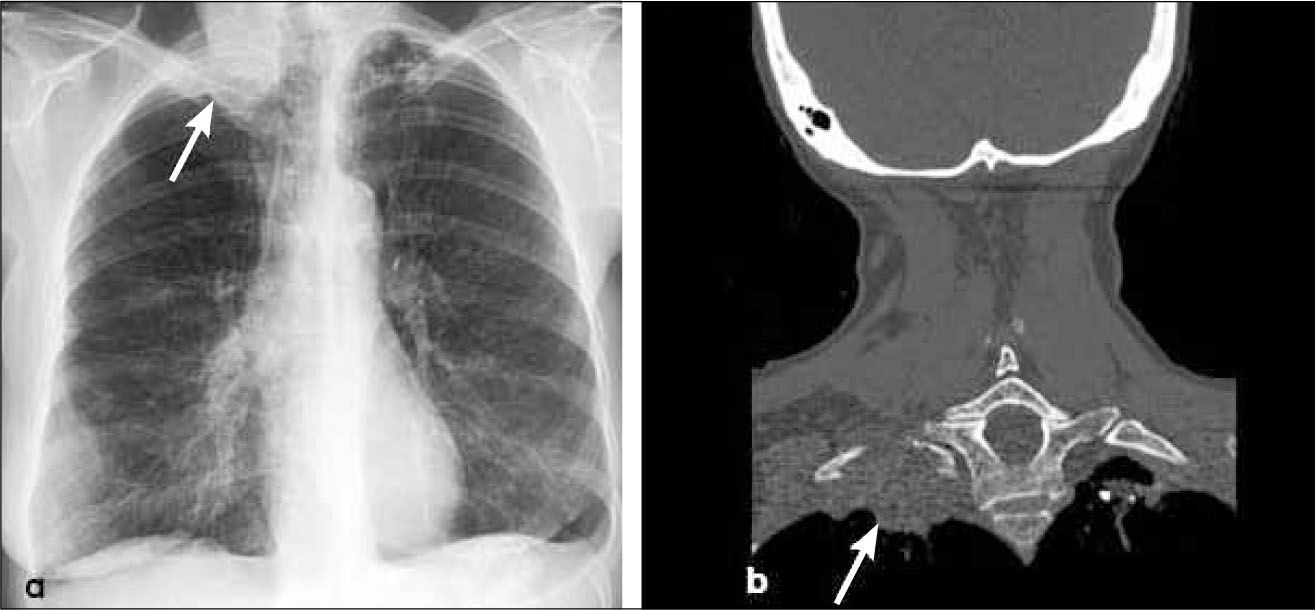
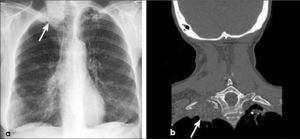
a, b: Tumor del vértice pulmonar. La radiografía frontal (a) muestra una asimetría de ambos vértices pulmonares con opacidad apical derecha sospechosa de neoplasia (flecha). Una TC con reconstrucción coronal confirma la lesión que se asocia con osteolisis de la primera costilla (flecha), hallazgo tomográfico específico de invasión de pared torácica. T3.
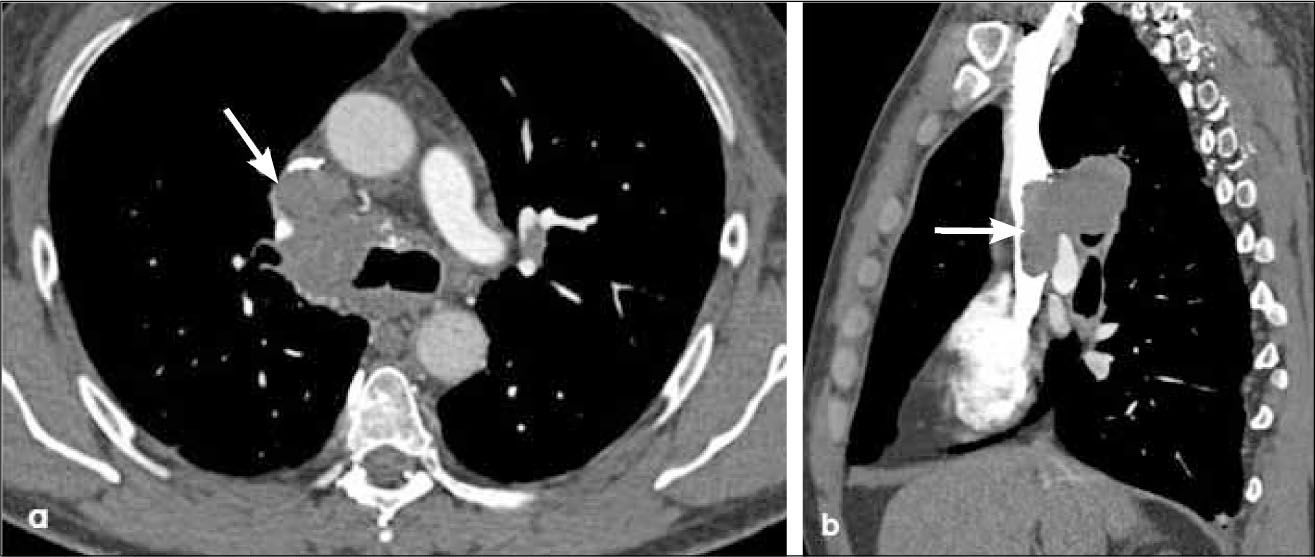
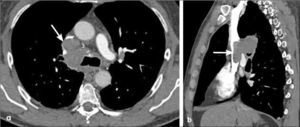
-T4: corresponde a esta etapa un tumor que invade el mediastino, la vía aérea, esófago, corazón, grandes vasos y/o vértebra, independientemente de su tamaño (Figura 17). Se incluye en etapa T4 un tumor con uno o más nódulos tumorales, localizados en el mismo pulmón pero en distinto lóbulo que la lesión primaria (Figura 18).
En cáncer pulmonar la evaluación de adenopatías se realiza con TC y/o PET-CT. Se consideran sospechosos de compromiso metastásico linfonodos con diámetros mayores de 10.0mm en el eje menor, considerado mejor predictor de patología que el eje mayor. La sensibilidad y especificidad de la TC en la evaluación de adenopatías es de aproximadamente 70 y 80% respectivamente. Ganglios menores de 10.0mm pueden tener componente tumoral y ganglios mayores de ese tamaño pueden corresponder a compromiso reactivo-inflamatorio. El PET-CT tiene una sensibilidad y especificidad de aproximadamente 80 y 90% y presenta, aunque con menor frecuencia, limitaciones en linfonodos metastásicos subcentimétricos; también ganglios inflamatorios menores o mayores de 10.0mm pueden presentar actividad metabólica, provocando dificultades en la interpretación diagnóstica.
-N0: Esta etapa indica ausencia de adenopatías regionales tumorales.
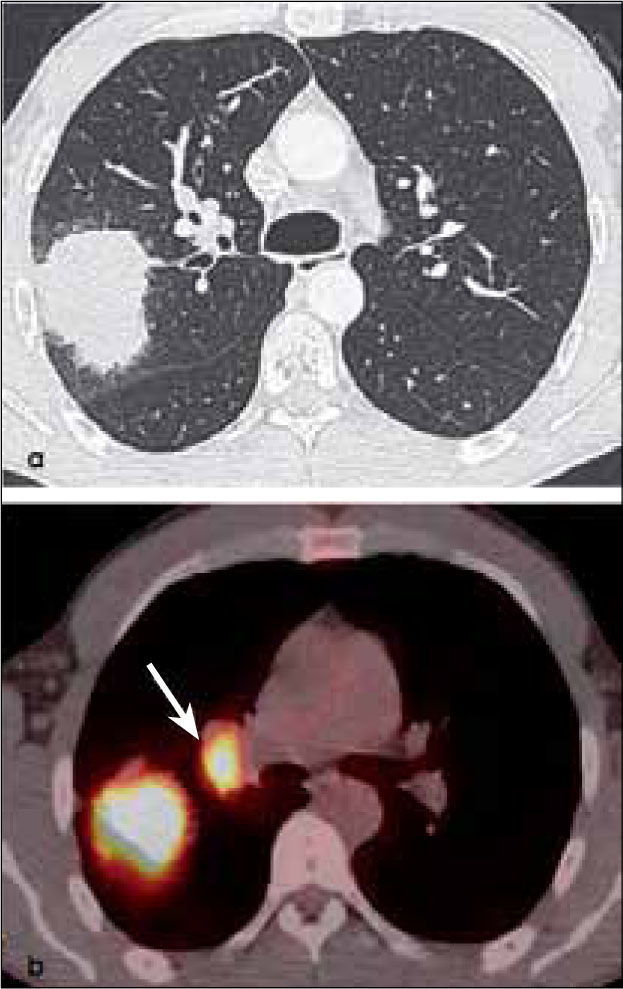
-N1: Adenopatías metastásicas ipsilaterales al tumor, adyacentes a bronquios subsegmentarios, segmentarios, lobares, interlobares e hiliares (Figura 13 y 18).
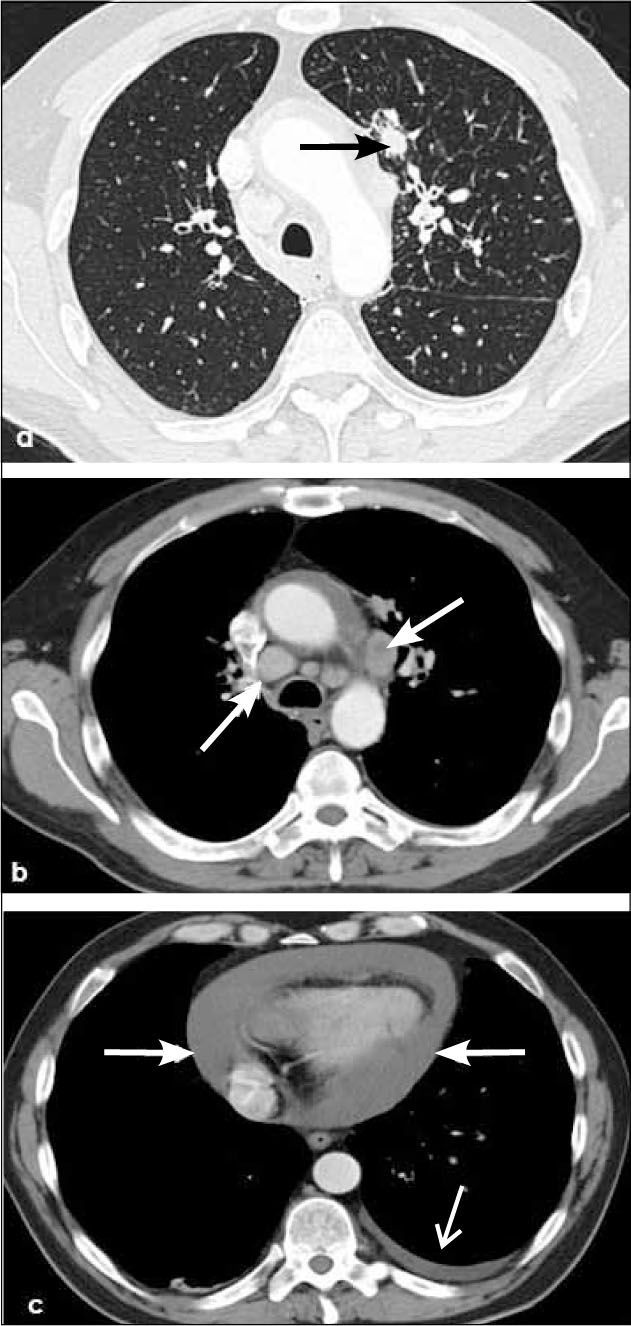
-N2: adenopatías mediastínicas ipsilaterales al tumor (Figura 19).
-N3: adenopatías en mediastino y/o hilio contralateral al tumor (Figura 20 y 21). También se consideran N3 los ganglios comprometidos en región supraclavicular o escalena ipsi y/o contralateral.
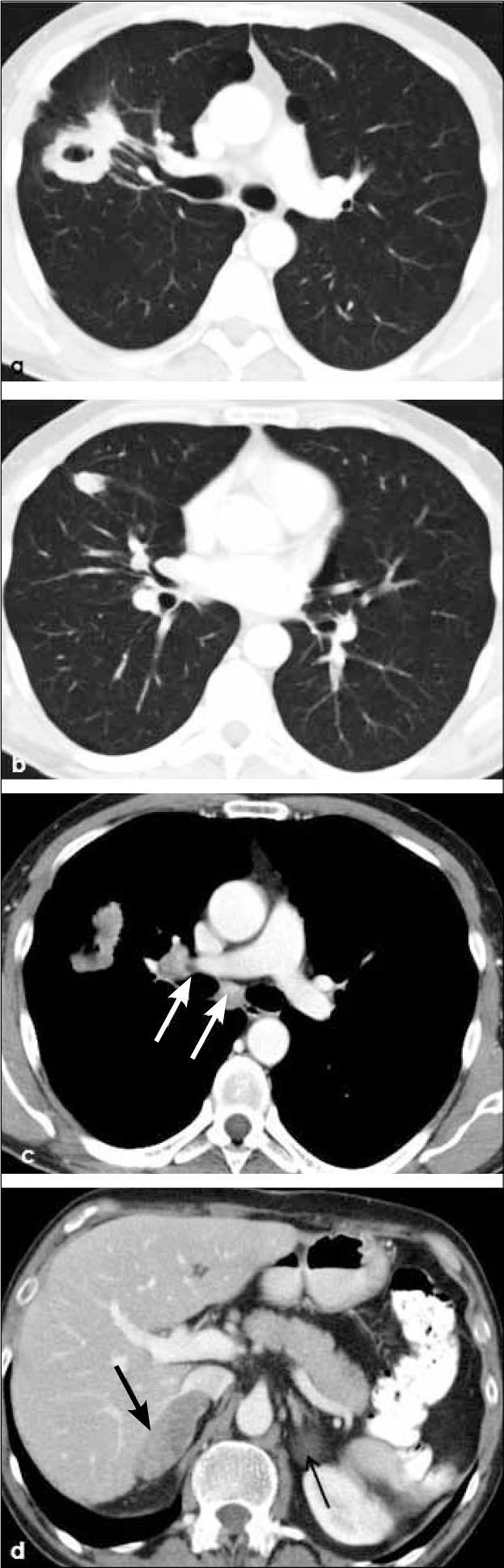
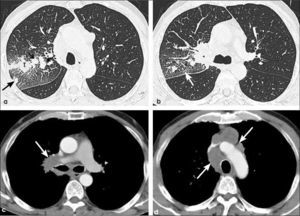
a, b, c, d: Cáncer de célula pequeñas en lóbulo superior derecho (T) menor de 3.0 cm de diámetro con nódulos tumorales satélites (flechas en a), adenopatías en hilio ipsilateral (flecha en c) y en mediastino ipsi y contralateral (flechas en d). T3-N3. Linfangitis peritumoral con engrosamiento intersticial axial y septal (flechas cortas en b).
La séptima edición de la clasificación etapificadora TNM considera el compromiso metastásico según su localización intra o extratorácico.
-M0: sin evidencias de metástasis.
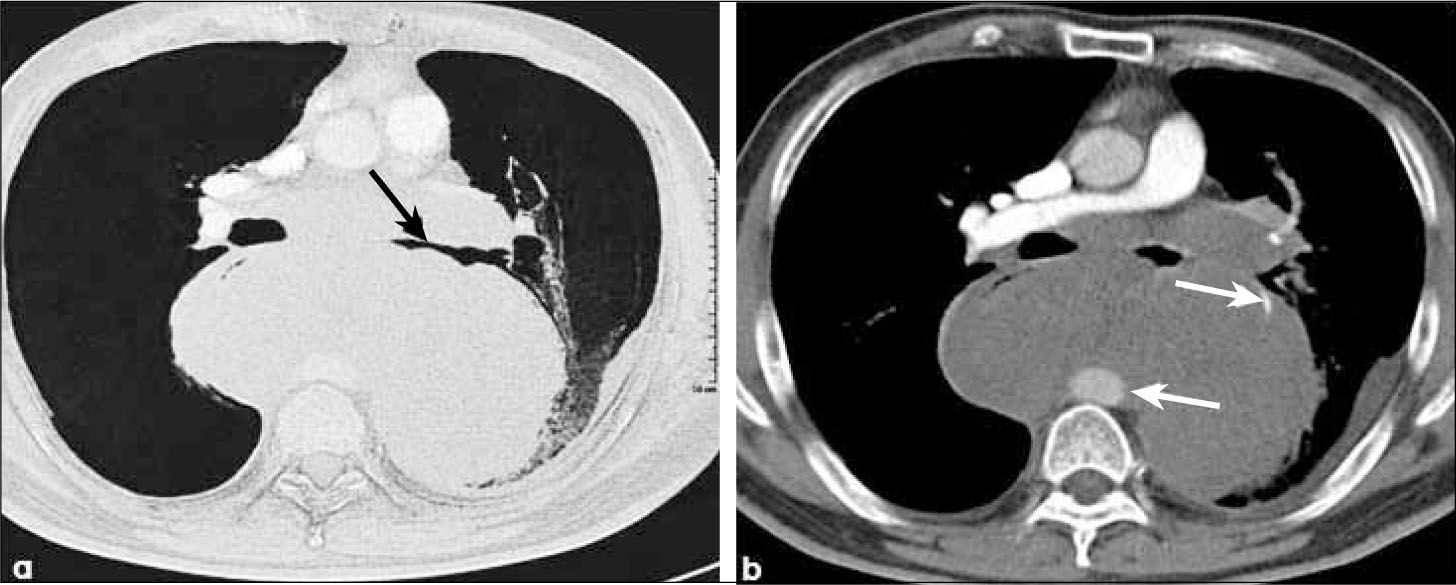
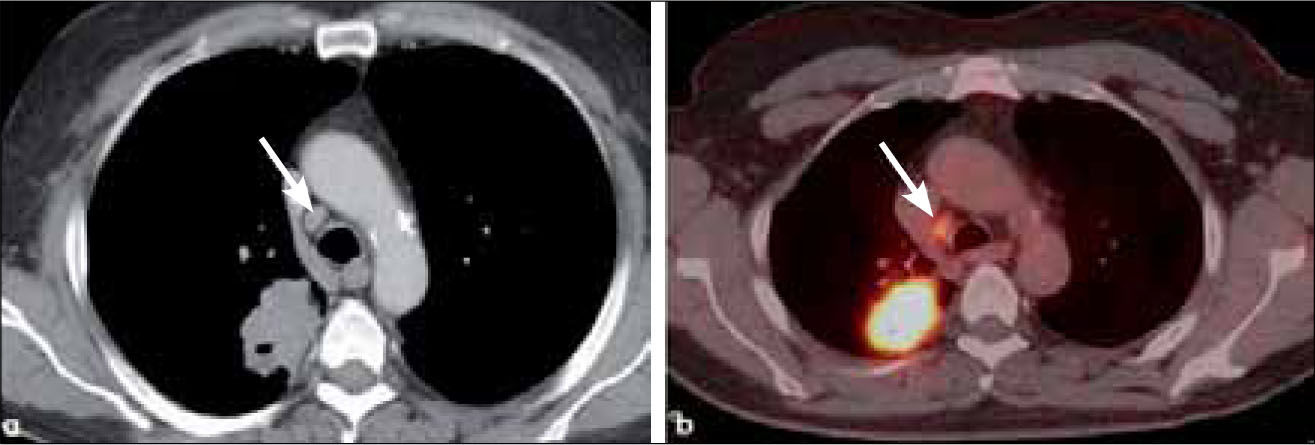
-M1a: metástasis en el pulmón contralateral al tumor primario, derrame pleural neoplásico y/o modularidad pleural y derrame perícárdico maligno y/o pericardio nodular. La certeza de malignidad de un derrame pleural o pericárdico se obtiene con la presencia de células neoplásicas obtenidas con punción aspirativa. (Figura 21 y 22).
-M1b: metástasis extratoracicas, localizadas en cerebro, glándulas suprarrenales, hígado, esqueleto, etc. (Figura 18).
Las distintas posibilidades de combinaciones TNM que se pueden presentar en la etapificación del cáncer pulmonar se resumen en cuatro estadíos de la enfermedad, desde el I al IV y sus subgrupos. En forma resumida los estadíos entre IA y IIIA son considerados potencialmente resecables quirúrgicamente y los estadíos IIIB (N3) y I V, salvo excepciones, se consideran habitualmente irresecables (Tabla 1). Una excepción puede ser un CCNP con metástasis única en cerebro o glándula suprarrenal, previa confirmación histopatológica.
Linfangitis carcinomatosa en cáncer pulmonarEl compromiso linfangítico en cáncer pulmonar es una complicación que habitualmente significa mal pronóstico. Generalmente se produce por diseminación retrógrada de células neoplásicas desde adenopatías hiliares y/o mediastínicas (Figura 23). La diseminación por vía hematógena es menos frecuente. Se estima que la posibilidad de resección quirúrgica del tumor puede plantearse cuando la linfangitis está limitada al mismo lóbulo de la lesión primaria.
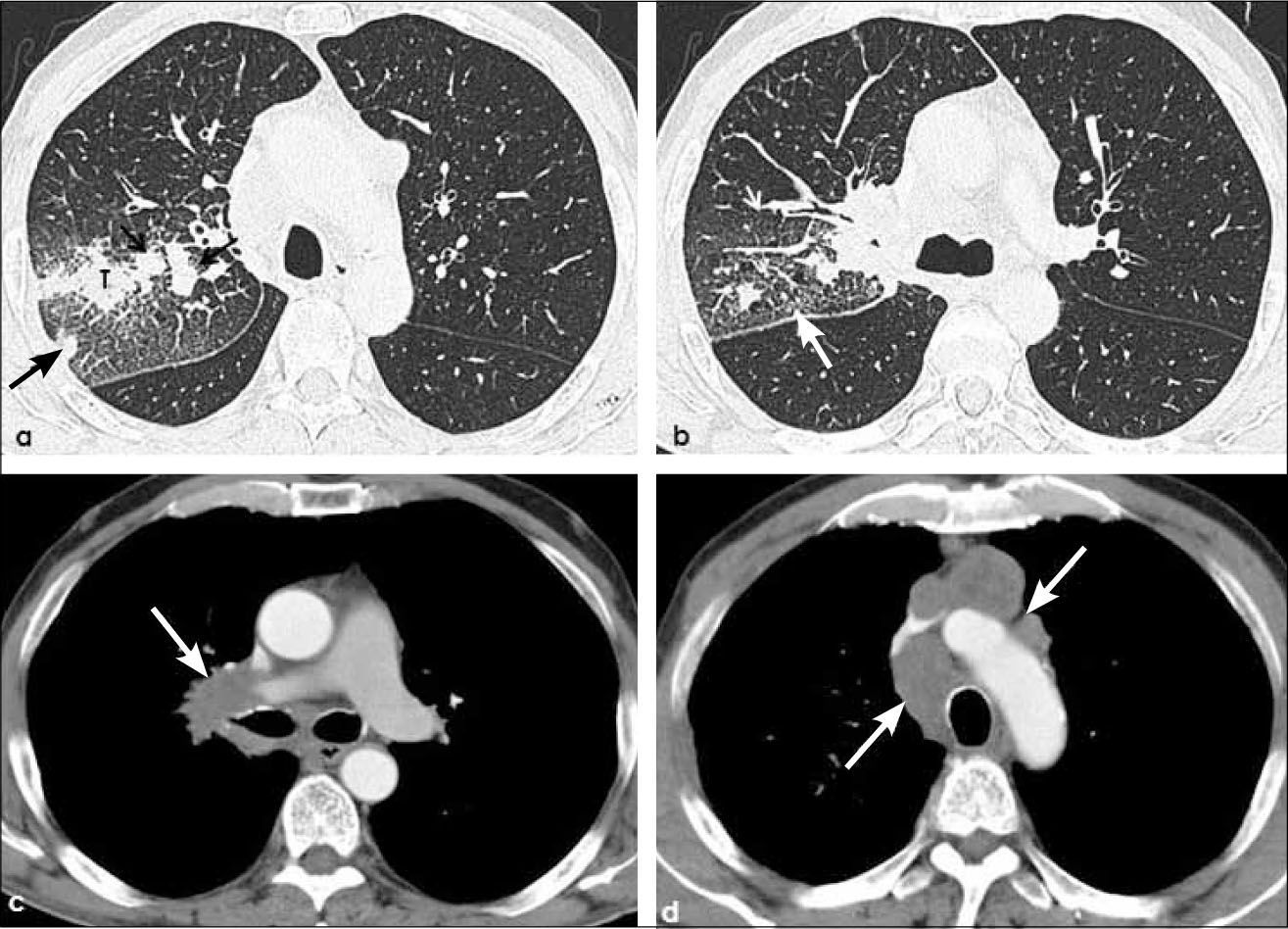
a, b: Adenocarcinoma de 3.5 cm de diámetro en lóbulo inferior derecho (flecha negra) con adenopatías hiliares y mediastínicas ipsilaterales e hiliares contralaterales (flechas blancas en a). T2a-N3. Extensa linfangitis carcinomatosa con engrosamiento nodular del intersticio axial y de septos interlobulillares tanto en lóbulo inferior derecho como en lóbulo medio (b).
La Tomografía Computada (TC) es el examen más ampliamente utilizado en la actualidad en el diagnóstico de los tumores pulmonares. Es indispensable el uso de la técnica multicorte que permite efectuar un volumen de adquisición con cortes de un espesor de 2.5mm o menos y así poder caracterizar pequeños nódulos sólidos y nódulos subsólidos, sean estos puramente de opacidad en vidrio esmerilado o con un componente sólido (7). La muy buena resolución espacial y de contraste de la TC permiten hacer una adecuada evaluación de la lesión primaria y su relación con estructuras vecinas, del compromiso ganglionar regional, de la presencia de metastásis intratorácicas y eventualmente de localizaciones secundarias extratorácicas como glándulas suprarrenales e hígado.
El tumor primario en ocasiones plantea diagnóstico diferencial con lesiones no neoplásicas (ej: TBC, COP, actinomicosis, neumonía lipoídea exógena y otras). El antecedente clínico y el estudio histopatológico son fundamentales para el diagnóstico definitivo.
La biopsia del tumor primario una vez detectado por TC, sea endoscópica, por punción transtorácica, por videotoracoscopía o abierta debe siempre ser efectuada pues el diagnóstico histológico incide directamente en la conducta terapéutica.
La TC también permite una adecuada evaluación del compromiso ganglionar hiliar, perihiliar, mediastínico y supraclavicular, aunque su sensibilidad y especificidad tienen limitaciones (aproximadamente 60 y 80% respectivamente). Ganglios mayores de 10.0mm en el eje menor se consideran sospechosos de patología. La limitación es la presencia de ganglios de tamaño normal con compromiso tumoral y de linfonodos de tamaño aumentado y que corresponden a hiperplasia o a ganglios de carácter inflamatorio-infeccioso. Es en estos casos donde el PET-CT puede ser aclaratorio; más adelante en este artículo me referiré en específico a este tópico.
La presencia de metástasis en el pulmón contralateral y de derrame pleural y/o pericárdico se detecta fácilmente con TC. No obstante el diagnóstico de certeza de malignidad lo da la presencia de células neoplásicas en muestra obtenida por punción del derrame.
Una TC de tórax debe siempre extenderse caudalmente hasta el área suprarrenal, localización frecuente de metástasis de cáncer pulmonar. Permite además eventualmente detectar localizaciones secundarias en la porción de hígado visualizado.
El PET-CT ha demostrado ser un método de alto rendimiento en el diagnóstico y principalmente en la etapificación del cáncer pulmonar (8, 9). La captación de glucosa marcada de una lesión se mide en SUV (Standard Uptake Value). En general, un nódulo o masa pulmonar con un valor de SUV bajo 2.5 tiene una posibilidad de ser maligna de aproximadamente un 18%. Una lesión con SUV sobre 2.5 tiene una posibilidad de malignidad aproximada de un 50%. Lesiones con SUV sobre 5.0 son malignas en un 90% o más de los casos. Un valor de corte de SUV adecuado para plantear lesión posiblemente benigna o maligna es 2.5. En general los CCNP de mayor captación, con valores de SUV habitualmente sobre 5.0 SUV, son los carcinomas escamosos y los de menor captación son los adenocarcinomas (10).
Si bien el PET-CT no presenta grandes ventajas sobre la TC en la evaluación del tumor primario, puede mostrar actividad metabólica glucídica en nódulos pulmonares mayores de 7.0mm de diámetro, sean satélites de la lesión neoplásica o en otro lóbulo ipsilateral o en el pulmón contralateral; también puede evidenciar captación del radiofármaco en lesiones pleurales adyacentes al tumor, hallazgos que pueden incidir en la conducta terapéutica definitiva. Permite además diferenciar una neoplasia central hipermetabólica de atelectasia y/o neumonía obstructiva asociada. Falsos negativos se observan en adenocarcinomas de crecimiento lepídico o predominatemente lepídico (sin o con escasa invasión estromal) y en tumores carcinoides. En estos casos predomina la evaluación morfológica y de densidad de la lesión que aporta la TC.
El rendimiento del PET-CT en la evaluación de adenopatías regionales supera a la TC sola. Linfonodos subcentimétricos en el eje menor, no patológicos según criterio TC, pueden presentar captación de glucosa marcada. Sin embargo, linfonodos no tumorales mayores de 10.0mm en el eje menor y que son reactivos, inflamatorios o infecciosos, pueden presentar actividad metabólica glucídica aunque habitualmente con va-lores de SUV bajo 2.5 (5). La sensibilidad y especificidad del PET-CT en la evaluación de adenopatías mediastínicas en cáncer pulmonar es de aproximadamente 80 y 90% respectivamente. La mediastinoscopía, método invasivo, sigue siendo el “gold standard” en la detección de ganglios con compromiso tumoral con una sensibilidad y especificidad aproximadas de 80 y 100% respectivamente (5).
Una ventaja manifiesta del PET-CT sobre los otros métodos de diagnóstico por imágenes está en la detección de metástasis a distancia. Dado su sistema de adquisición permite evidenciar lesiones secundarias que pueden obligar a modificar el tratamiento. Puede detectar además un segundo tumor primario de localización extratorácica no sospechado clínicamente (9). Una limitación del PET-CT está en la evaluación del compromiso metastásico cerebral dado que el alto metabolismo de glucosa de las células cerebrales normales puede ocultar la presencia de una lesión neoplásica secundaria. Es necesario complementar el estudio de etapificación idealmente con resonancia magnética con uso de contraste endovenoso paramagnético.
ConclusionesLa TC y el PET-CT son los estudios de imágenes de elección utilizados actualmente en el diagnóstico y etapificación del cáncer pulmonar. De ambos, el PET-CT ha demostrado ser el método de mayor rendimiento en la etapificación de esta enfermedad; debería ser utilizado en todo paciente potencialmente quirúrgico, evitando así la realización de toracotomías innecesarias (5).
La aplicación del sistema de etapificación TNM (séptima edición) es fundamental en el pronóstico y elección del tratamiento adecuado del cáncer pulmonar.
El autor declara no tener conflictos de interés, con relación a este artículo.