El incremento de las micosis invasoras es una constante médica, principalmente en receptores de trasplantes de órganos, pacientes de sida y otros pacientes inmunodeficientes, recién nacidos de peso bajo y pacientes críticos, posquirúrgicos o con neoplasias. La mayoría son pacientes sometidos a múltiples acciones diagnósticas y terapéuticas, están tratados con fármacos antibacterianos de amplio espectro o con antivirales, o son portadores de catéteres u otros dispositivos intravasculares. La morbilidad y la mortalidad de estas micosis son elevadas, hecho que las convierte en un problema médico importante, ya que se estima que el 5% de los pacientes hospitalizados va a desarrollar una infección, y que entre el 3 y el 6% de estas infecciones será una candidiasis invasora24,33. Con menos frecuencia, se describen micosis respiratorias o diseminadas producidas por Aspergillus u otros hongos filamentosos (Scedosporium, Fusarium, Pneumocystis o los zigomicetos), así como meningitis por Cryptococcus21,33.
Los antifúngicos disponibles para el tratamiento de estas enfermedades no son suficientes, a pesar de que en los últimos años se han comercializado 2 formulaciones lipídicas de anfotericina B (anfotericina B liposómica y anfotericina B complejo lipídico), 2 triazoles con un espectro antifúngico extendido (voriconazol y posaconazol) y 3 equinocandinas (anidulafungina, caspofungina y micafungina)2,21. Estas últimas tienen como diana el β-1,3-D-glucano de la pared fúngica76 y provocan alteraciones estructurales importantes en la célula fúngica que pueden conducir a su lisis62,63,76.
En este artículo revisamos las fortalezas y las limitaciones observadas en la actividad antifúngica in vitro de la micafungina. Hemos realizado una búsqueda bibliográfica con los términos "micafungin", "activity", "Candida", "Aspergillus", "fungi", "mycos*", "susceptibility", en la base de datos PubMed/Medline de la National Library of Medicine de Estados Unidos desde enero de 2006 hasta enero de 2009. Se han incluido todos los estudios que aportaban datos de actividad in vitro de micafungina obtenidos con métodos estandarizados, como M27-A18,19 y M38-A17 del Clinical and Laboratory Standards Institute (CLSI, [Estados Unidos]), el método de microdilución del European Committee on Antimicrobial Susceptibility Testing20 o métodos comercializados, como Sensititre YeastOne, con una correlación adecuada con los estándares anteriores72,80. Los estudios de sensibilidad in vitro realizados en años anteriores se pueden consultar en otras revisiones detalladas25,41.
La micafungina es un lipopéptido desarrollado a partir de un producto natural aislado del cultivo en caldo del hongo Coleophoma empetri41, con un amplio espectro de acción contra Candida y Aspergillus2,11,25,34,44,70. La micafungina bloquea la síntesis de β-1,3-D-glucano de la pared celular fúngica mediante la inhibición no competitiva de la β-1,3-D-glucano sintetasa (codificada por los genes FKS1y FKS2). Es fungicida (dependiente de la dosis) para Candida, mientras que ejerce una acción fungistática contra Aspergillus. Esta acción es selectiva contra la pared fúngica que se ve alterada estructuralmente, y provoca una inestabilidad osmótica que puede causar la muerte del hongo1,11,62,63. La micafungina ejerce una acción fungicida contra las células de Candida en crecimiento a concentraciones ≥ 1 μg/ml. Las células gradualmente aumentan de tamaño y/o comienzan a deformarse. Mediante microscopía electrónica, se pueden observar diferentes alteraciones en la morfología de la pared celular, con deformación del contorno, formación de septos anómalos y una disminución prominente de la capa intermedia de la pared. Además, se observan alteraciones de la membrana y de diferentes organelas celulares63. Los efectos en las células de Aspergillusson también llamativos, aunque no inducen la muerte de todas las células. Concentraciones de micafungina entre 0,001 y 0,1 μg/ml provocan cambios en la morfología de las hifas. Estos cambios incluyen la formación de ramificaciones laterales, alteración de los ápices de las hifas y deformaciones, aplastamientos y colapsos de éstas62. La selectividad de acción de la micafungina en la pared del hongo, con componentes muy diferentes de los de las células eucariotas de los mamíferos, hace que tenga una toxicidad mínima para los pacientes3,41.
La micafungina es una indicación terapéutica de primera línea para el tratamiento de las candidemias y las candidiasis invasoras en adultos y niños (incluidos los neonatos). La European Medicines Agency Evaluation of Medicines for Human Use y la Agencia Española del Medicamento y Productos Sanitarios han autorizado su empleo en el tratamiento de las candidiasis invasoras y las esofagitis candidiásicas. También ha aprobado su uso en la profilaxis de las infecciones por Candida en pacientes receptores de trasplante de células precursoras hematopoyéticas o que puedan presentar períodos de neutropenia prolongados. Es importante destacar que micafungina puede utilizarse tanto en el tratamiento, como en la prevención de la candidiasis en neonatos, niños, adolescentes, adultos o ancianos. Este hecho la convierte en una herramienta de gran valor en grupos de pacientes donde no está aprobado el uso de otros fármacos antifúngicos.
La eficacia in vitro de la micafungina es excelente contra aislamientos de Candida y Aspergillus resistentes a anfotericina B34,97, a diferentes azoles16,45,64,81,82,97 y otras equinocandinas16, lo que la convierte en una herramienta terapéutica eficaz para el tratamiento de las aspergilosis y candidiasis invasoras. También su eficacia es elevada contra las fases quísticas de Pneumocystis jiroveci y varios hongos dematiáceos41. Sin embargo, su actividad, como la del resto de las equinocandinas, es escasa para Trichosporon57, Cryptococcus neoformans59,94 y los zigomicetos4,57,87,88. La pared de C. neoformans contiene tanto β-1,3-D-glucano como β-1,6-D-glucano, y es probable que la falta de actividad de las equinocandinas se relacione con una alteración de la diana enzimática o con el bloqueo del acceso a la diana por la presencia de melanina26,78.
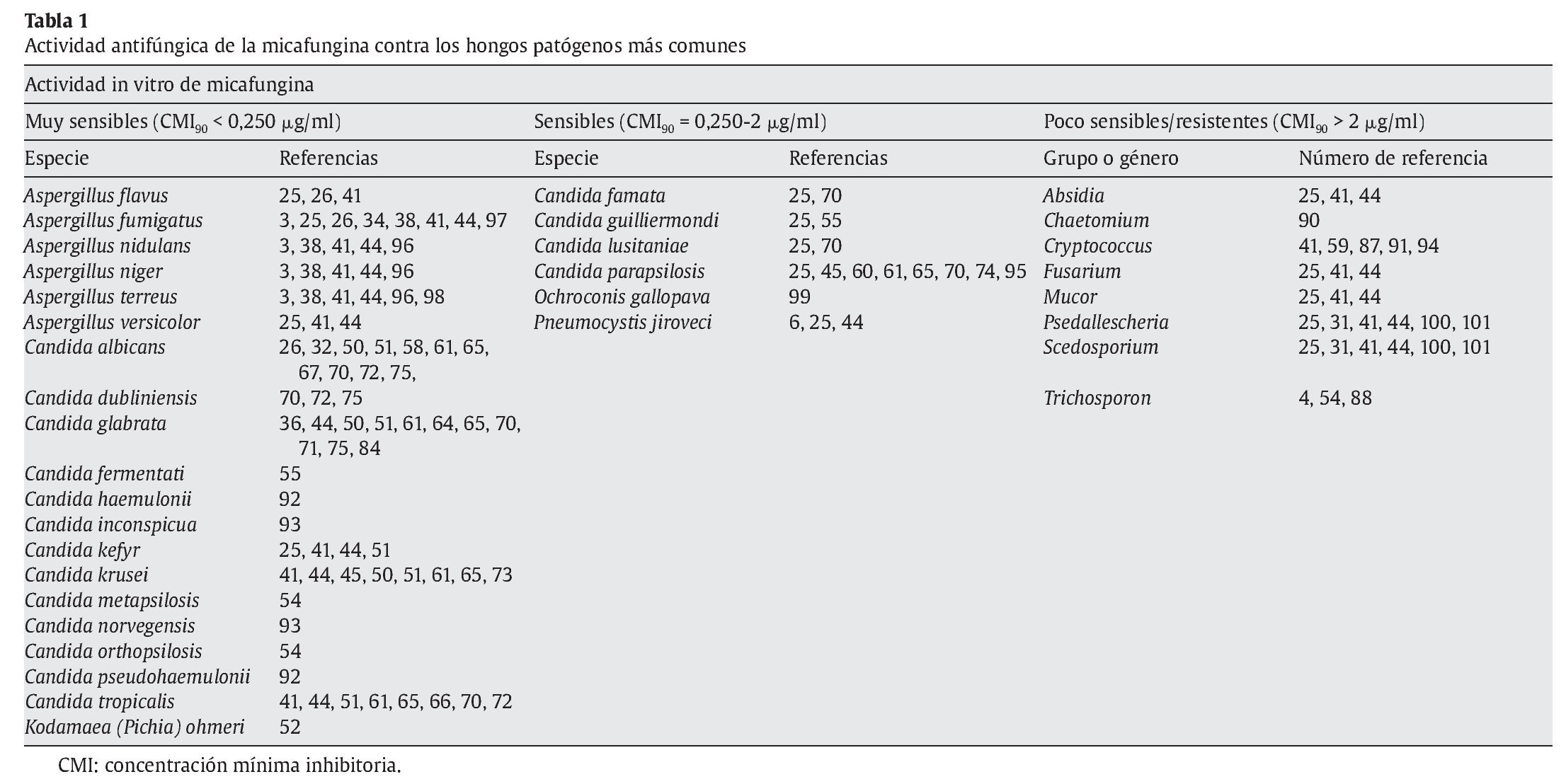
Recientemente, el CLSI ha propuesto los puntos de corte para las equinocandinas18,19. Se considerarían sensibles todos los aislamientos inhibidos por concentraciones ≤ 2 μg/ml de anidulafungina, caspofungina o micafungina, y no sensibles los inhibidos por concentraciones > 2 μg/ml. Con estos puntos de corte como referencia, entre el 95 y el 99% de los aislamientos clínicos del género Candidason sensibles a micafungina70,71,73,75. No hay una definición clara sobre los puntos de corte en el caso de los hongos filamentosos, pero los empleados para las levaduras podrían considerarse orientadores96.
Actividad in vitro en Candida
La candidiasis invasora representa la cuarta causa de infección nosocomial en Europa y Estados Unidos. Candida albicans continúa siendo la especie predominante, aunque se está produciendo un importante cambio etiológico, y otras especies como Candida parapsilosis, Candida glabrata, Candida tropicalis o Candida krusei representan entre el 35 y el 55% de los aislamientos clínicos24. El problema que plantea esta deriva etiológica es principalmente terapéutico, ya que estas especies suelen ser menos sensibles o incluso resistentes a los antifúngicos clásicos33,51,58.
La mayoría de las candidiasis invasoras (> 90%) son producidas por 5 especies (C. albicans, C. parapsilosis, C. glabrata, C. tropicalis y C. krusei2,24,77,78), pero hay importantes variaciones en la prevalencia según la localización geográfica, con el aislamiento frecuente en hemocultivos de C. glabrata y C. tropicalis en América y de C. glabrata y C. parapsilosis en Europa33,95. La descripción de resistencias microbiológicas a los antifúngicos, especialmente a fluconazol e itraconazol, en especies como C. krusei, C. glabrata, Candida dubliniensis o Candida lusitaniae, hace necesaria la identificación correcta de la especie implicada que permita la instauración lo más rápidamente posible del tratamiento antifúngico adecuado. Se ha observado que la micafungina es activa en los aislamientos resistentes a fluconazol e itraconazol70 de casi todas las especies aisladas, con la excepción de C. parapsilosis8,64,82,84,95.
Ostrosky-Zeichner et al65 estudiaron la actividad in vitro de micafungina contra 2.000 aislamientos de Candida de hemocultivo procedentes de 2 estudios clínicos realizados en Estados Unidos entre 1995 y 1999 por el grupo de estudio de las micosis del National Institute of Allergy and Infectious Diseases Mycoses Study Group. Observaron que la micafungina tiene una actividad antifúngica excelente que se extiende a los aislamientos, principalmente de las especies C. krusei y C. glabrata, resistentes a otros antifúngicos, como fluconazol (6% de aislamientos resistentes) e itraconazol (18% de aislamientos resistentes). Las especies más sensibles a la micafungina fueron C. albicans y C. dubliniensis (concentración mínima inhibitoria [CMI]90 = 0,03 μg/ml), seguidas de C. glabrata y C. tropicalis (CMI90 = 0,006 μg/ml), y C. krusei y C. lusitaniae (CMI90 = 0,25 μg/ml). Los 20 aislamientos de C. lusitaniae y los 391 de C. parapsilosis resistentes a los azoles tuvieron una CMI90 ≤ 2 μg/ml. Anidulafungina mostraba CMI similares a las de micafungina, pero las CMI de caspofungina eran 2 o más diluciones más altas.
Pfaller et al70 evaluaron 5.346 aislamientos de sangre y otras muestras clínicas estériles, recogidos durante 6 años (enero de 2001-diciembre de 2006) en 90 centros médicos de diferentes países del mundo. Observaron que más del 99% de los aislamientos se inhibían con ≤ 2 μg/ml de micafungina. La eficacia in vitro de micafungina y caspofungina era similar, aunque se encontraban variaciones de una o 2 diluciones entre las 3 equinocandinas estudiadas según la especie de Candida evaluada. El 94% de los aislamientos pertenecían a 4 especies, C. albicans (54%), C. glabrata (14%), C. parapsilosis (14%) y C. tropicalis (12%). Los autores no encontraron diferencias significativas en la actividad de micafungina durante los 6 años del estudio, ni tampoco variaciones relacionadas con el origen geográfico de los aislamientos. Sin embargo, en 6 aislamientos (0,1%) se observaron CMI > 4 μg/ml de anidulafungina o caspofungina, de estos aislamientos 3 eran C. guilliermondii (CMI de caspofungina ≥ 8 μg/ml), uno C. glabrata (CMI de caspofungina ≥ 8 μg/ml), otro Candida rugosa (CMI de anidulafungina ≥ 8 μg/ml) y, finalmente, otro pertenecía a la especie C. tropicalis (CMI de caspofungina ≥ 8 μg/ml). En cambio, las CMI de micafungina eran ≤ 2 μg/ml para los anteriores aislamientos clínicos. Además, cuando Pfaller et al74 estudiaron la sensibilidad in vitro de los aislamientos de C. parapsilosis obtenidos de candidiasis invasoras incluidos en el programa ARTEMIS, observaron que todos (539 aislamientos) se inhibían con ≤ 2 μg/ml de micafungina, mientras que con las mismas concentraciones de anidulafungina y caspofungina se inhibían el 92% (621) y el 99% (1.447) de los aislamientos, respectivamente. Los datos sobre aislamientos de Candida obtenidos de niños con candidiasis invasora son más limitados. Sin embargo, varios autores han observado que la micafungina tiene muy buena actividad contra estos aislamientos. Ikeda et al39 han observado que la actividad de micafungina tiene muy buena actividad en C. albicans, C. tropicalis y C. glabrata (rango de la CMI entre 0,002 y 0,015 μg/ml) y ésta es algo menor frente a C. parapsilosis (CMI entre 0,125 y 2 μg/ml).
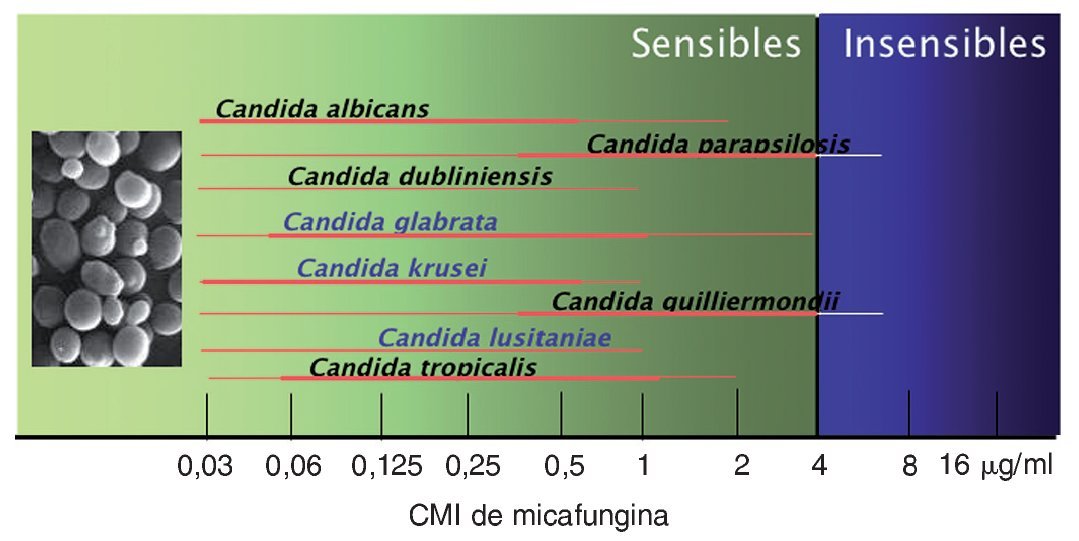
Pfaller et al70,71 dividen las especies de Candida en 2 grandes grupos, en función de su sensibilidad in vitro a las equinocandinas (tabla 1 y fig. 1). El primer grupo estaría formado por las especies que son extremadamente sensibles a las equinocandinas, con CMI90 entre 0,015 y 0,25 μg/ml, como C. albicans, C. dubliniensis, C. glabrata, C. tropicalis, C. krusei y C. kefyr. El segundo grupo lo formarían las especies C. parapsilosis, C. guilliermondii, C. lusitaniae y C. famata con CMI90 entre 0,25 y 2 μg/ml.
Figura 1. Distribución de las especies de Candida según su sensibilidad in vitro a la micafungina. En letra azul figuran las especies de Candida que albergan aislamientos clínicos resistentes a otros antifúngicos. CMI: concentración mínima inhibitoria.
Se han descrito infecciones invasoras producidas por aislamientos de C. parapsilosis con sensibilidad reducida a anidulafungina, caspofungina y micafungina, y se están estudiando los mecanismos moleculares implicados26,29,30. Moudgal et al60 describen el caso de un paciente con endocarditis candidiásica de válvula aórtica por C. parapsilosis que se había tratado inicialmente con anfotericina B y 5-fluorocitosina (sin reemplazarle la válvula), y posteriormente con caspofungina y fluconazol. Después de una curación inicial, se le dio de alta, manteniéndose el tratamiento con fluconazol, y volvió a ingresar 3 meses después con un cuadro de candidiasis invasora por C. parapsilosis que no respondió al tratamiento con caspofungina. La variabilidad en la sensibilidad a la micafungina en C. parapsilosis podría relacionarse con el hecho de que está compuesta por varias especies diferentes, además de C. parapsilosis sensu stricto, como las nuevas especies Candida metapsilosis y Candida orthopsilosis95 que son más sensibles in vitro a micafungina y otros antifúngicos54. El porcentaje de aislamientos de C. parapsilosis que eran realmente Candida metapsilosis y Candida orthopsilosis en el estudio ARTEMIS (2001-2006) variaban desde el 0,7% en África hasta el 10,9% en América54.
Hakki et al35 describieron un fracaso terapéutico con caspofungina de una candidemia por C. krusei con posterior endoftalmitis en una paciente con leucemia mieloblástica aguda. Un segundo aislamiento de sangre mostró un aumento de 8 veces la CMI de la del primer aislamiento clínico (CMI de 2 a 0,25 μg/ml), obtenido antes comenzar el tratamiento con caspofungina. Dos aislamientos orales obtenidos de la misma paciente mostraron también este incremento de las CMI de caspofungina (CMI = 1 y 8 μg/ml, respectivamente). Esta sensibilidad reducida a caspofungina se asoció a mutaciones en el gen FKS142. Sin embargo, para estos mismos aislamientos, la CMI de anidulafungina (0,25 μg/ml) y micafungina (0,5 μg/ml) fueron menores. También Pelletier et al69 y Kahn et al42 describieron casos de candidiasis por C. krusei en pacientes tratados con caspofungina. Krogh-Madsen et al47 obtuvieron también aislamientos seriados de C. glabrata con resistencia a anfotericina B y caspofungina en hemocultivos de un receptor de un trasplante hepático ingresado en la unidad de cuidados intensivos. Por último, C. guilliermondii, que incluye aislamientos clínicos con sensibilidad reducida in vitro a diferentes antifúngicos, como fluconazol y caspofungina, es sensible a anidulafungina y micafungina70.
Diferentes autores han descrito un efecto paradójico de las equinocandinas en su actividad in vitro frente a los aislamientos de Candida con crecimiento celular a concentraciones superiores a la CMI. Este efecto es más frecuente en caspofungina y menor en anidulafungina y micafungina. Además, se ha observado una variación importante que depende de la especie de Candida estudiada, siendo más frecuente en C. albicans, mucho menor en C. dubliniensis y otras especies13,27,40, y prácticamente ausente en C. glabrata13. También se han descrito aislamientos clínicos inhibidos con CMI ≥ 2 μg/ml de equinocandinas, principalmente en candidiasis orofarígeas y otras infecciones superficiales5,81. Esta menor sensibilidad no ha influido en la evolución de los pacientes con candidiasis invasoras tratados con equinocandinas22,23,37,45,49. Sin embargo, en las candidiasis oculares o neurológicas debe considerarse, antes de instaurar el tratamiento, que las concentraciones alcanzadas por las equinocandinas en estas localizaciones anatómicas son más bajas10,41,44.
Actividad in vitro contra Aspergillusy otros hongos de interés médico
La frecuencia clínica de aspergilosis invasoras ha aumentado de forma considerable33 y se ha convertido en un problema médico muy importante por su difícil diagnóstico y tratamiento y una mortalidad extremadamente alta (40-100%). Sin embargo, su incidencia es muy variable en función del tipo de paciente, y es mayor en receptores de trasplante alogénico de médula ósea (7-12%) y menor en los de trasplante de riñón e hígado (0,5-2%). La mayoría de las aspergilosis son principalmente pulmonares o cerebrales y suelen estar causadas (> 80%) por Aspergillusfumigatus, Aspergillus niger y Aspergillus flavus33. La micafungina muestra una potente actividad in vitro contra Aspergillus(tabla 1), ya que la mayoría de los aislamientos clínicos evaluados se inhiben por ≤ 2 μg/ml34. Este antifúngico es muy activo frente a A. fumigatus, A. flavus, A. terreus (especie a menudo resistente a anfotericina B) y otras especies de Aspergillus de importancia médica34. Ikeda et al39 han observado que la actividad de micafungina es elevada contra los aislamientos de Aspergillus (rango de la CMI entre 0,004 y 0,015 μg/ml) procedentes de pacientes pediátricos con aspergilosis invasoras. Esta alta actividad antifúngica de la micafungina y otras equinocandinas, junto con la eficacia clínica demostrada46, ha hecho que se recomienden en el tratamiento de las aspergilosis invasoras en las guías de práctica clínica de 2008 de la Infectious Diseases Society of America96.
La actividad de la micafungina y las demás equinocandinas contra otros hongos filamentosos está menos estudiada, pero se ha descrito actividad in vitro variable contra varias especies (tabla 1). Sin embargo, los zigomicetos y otros hongos con un contenido reducido de β-1,3-D-glucano en sus paredes son resistentes a las equinocandinas78.
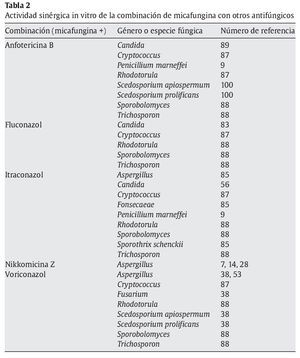
Combinación in vitro de micafungina con otros fármacos con acción antifúngica
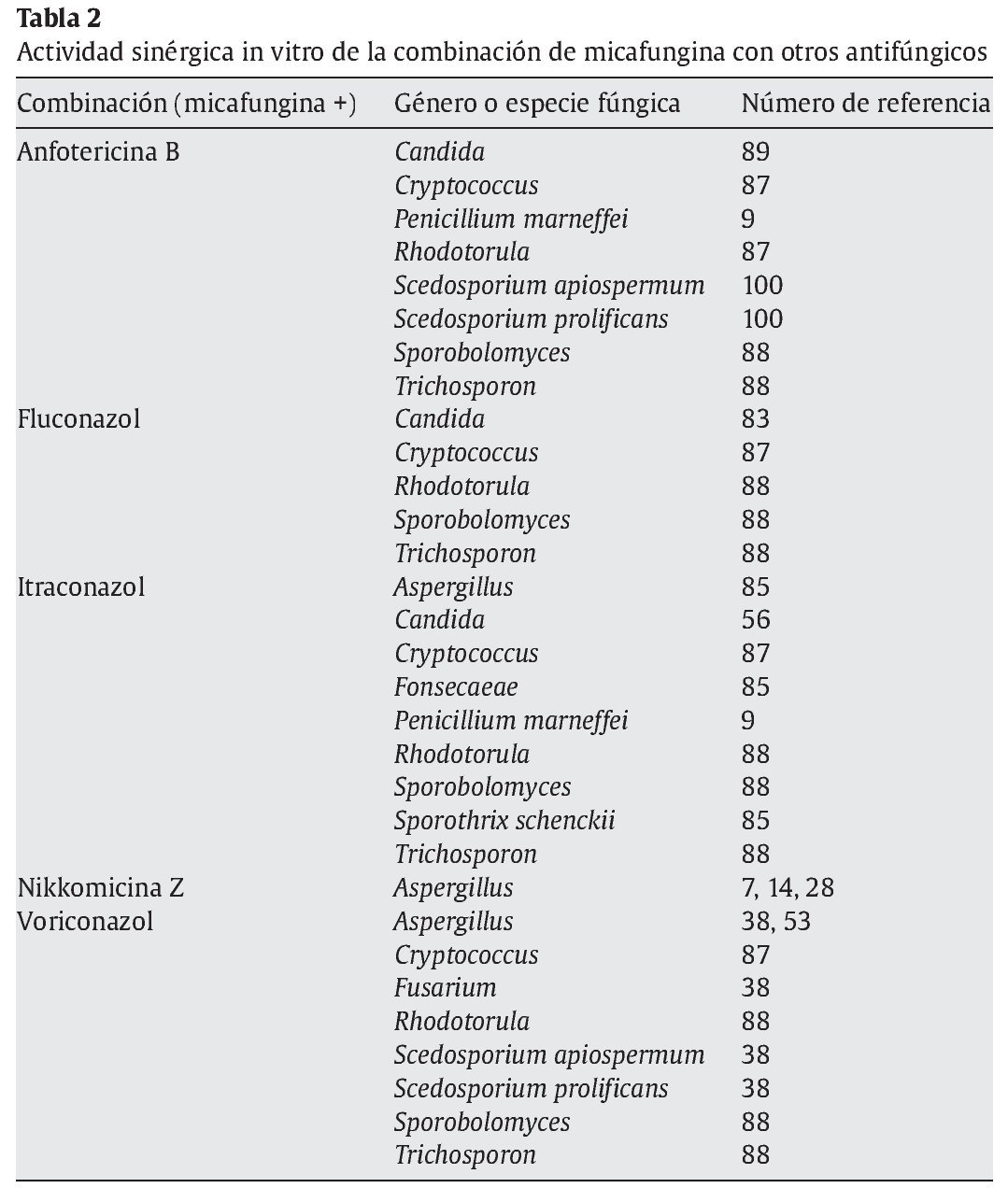
La combinación de equinocandinas con otros fármacos con actividad antifúngica es una opción que está adquiriendo importancia como alternativa terapéutica en las micosis producidas por hongos poco sensibles a la monoterapia antifúngica habitual o en determinadas infecciones asociadas a biopelículas12,15,43,48,66,67,79,86,100. Varios estudios in vitro han mostrado una actividad sinérgica, en los que se combina micafungina con anfotericina B, fluconazol, itraconazol, nikkomicina Z o voriconazol contra aislamientos de diferentes especies de Aspergillus, Candida, Scedosporium, Fusarium o zigomicetos (tabla 2). La mayoría de estas actividades in vitro se han comprobado en modelos experimentales en diversas especies animales68 y se han publicado descripciones puntuales del tratamiento con éxito de pacientes con micosis humanas invasoras46.
Conclusión
La micafungina es un antifúngico con una excelente actividad antifúngica contra Candida y Aspergillus, sobre todo contra las especies menos sensibles a la acción de los antifúngicos triazólicos clásicos, como fluconazol e itraconazol. Además, la combinación in vitro de micafungina con otros antifúngicos ha mostrado sinergia contra muchos hongos resistentes o poco sensibles a los antifúngicos convencionales, como S. prolificans o los zigomicetos.
Agradecimientos
Los autores han recibido financiación de los proyectos PI061895 del Fondo de Investigación Sanitaria y GIC07/123-IT-222-07 del Gobierno Vasco-Eusko Jaurlaritza.
Declaraciones de los autores
Los autores no tienen nada que declarar
*Autor para correspondencia.
Correo electrónico:guillermo.quindos@ehu.es (G. Quindós).
Recibido el 2 de febrero de 2009
Aceptado el 9 de febrero de 2009