El herpes zóster (HZ) y su principal complicación, la neuralgia postherpética (NPH), representan un importante problema de salud. En los pacientes de edad avanzada y en aquellos con enfermedades crónicas, esta enfermedad puede tener graves consecuencias para su salud. Además, el tratamiento sintomático de la enfermedad es, cuando menos, insuficiente en muchos casos. Es por ello que la prevención del HZ y de la NPH constituye una prioridad, especialmente en las poblaciones más vulnerables.
Aproximadamente, 1 de cada 4 personas desarrollará un HZ a lo largo de su vida. Después de la infección primaria por el virus varicela-zóster (VVZ), el virus permanece latente durante años en los ganglios sensoriales paravertebrales y/o en los nervios craneales. La inmunosenescencia asociada al envejecimiento, así como cualquier circunstancia que provoque una depresión del sistema inmune, puede llevar a una reactivación del virus. Cuando esto ocurre, aparece primero una erupción vesicular con distribución unilateral y localizada en la zona del dermatomo afectado, que es lo que se conoce como HZ. La NPH es un cuadro de dolor de intensidad variable, persistente o de nueva aparición, 3 meses después de la curación de las lesiones cutáneas. En algunos casos, este dolor de la NPH puede persistir meses o años.
En las personas con diabetes de más de 65 años, el riesgo de sufrir HZ/NPH es 3 veces superior al de la población general. La presencia de otras patologías concomitantes, como la insuficiencia cardíaca o la enfermedad pulmonar obstructiva crónica (EPOC), aumenta este riesgo de forma adicional hasta más de 4 veces. Todo ello lleva en estos pacientes a un riesgo aumentado de hospitalizaciones por HZ/NPH o por alteración de la patología de base. En Italia, un país de nuestro entorno, los costes anuales de HZ/NPH fueron de 41,2 millones de €, siendo costes directos un 70% de los asociados al tratamiento del HZ/NPH o de sus complicaciones colaterales, y el resto costes indirectos por pérdida de productividad1.
Por otra parte, desde 2006 existe una vacuna aprobada de virus vivos atenuados frente al HZ/NPH para mayores de 60 años y desde 2011, además, para adultos de más de 50 años. Muchos países desarrollados han evaluado la introducción de esta vacuna en sus respectivos programas de vacunación con el objeto de reducir los costes asociados a HZ/NPH. Así, en Estados Unidos y Canadá se ha incluido la vacunación frente al HZ en ≥ 60 años desde los años 2006 y 2010, respectivamente. En Europa, la vacunación se recomienda en determinados países en función de la edad de los pacientes (Alemania, Reino Unido, Suecia, Francia, etc.). De igual forma, un estudio de coste-efectividad realizado en España demostró que un programa de vacunación en adultos de más de 50 años, con una cobertura de al menos un 30%, podría ser coste-efectivo, aumentando el beneficio del programa en adultos de más de 65 años2. En España, la Comunidad de Castilla y León, en marzo de 2015, fue pionera en la introducción de la vacuna del HZ/NPH en un grupo de pacientes con EPOC de entre 60 y 64 años, y en tratamiento con corticoides inhalados. Posteriormente, 9 meses más tarde, en enero de 2016 se ha incluido también la cobertura a personas con diabetes de entre 60 y 69 años, y se ha ampliado a pacientes con EPOC también de entre 60 y 69 años. Sin embargo, a pesar de todo lo comentado, la actual dispersión y la poca homogeneidad de nuestro sistema sanitario han hecho que esta iniciativa no se haya trasladado al resto de comunidades autónomas de nuestro país.
Con todas estas consideraciones preliminares, pensamos que era necesario resumir y categorizar las evidencias disponibles acerca de la enfermedad del HZ/NPH y de su prevención y, en particular, de la efectividad de estas medidas en las personas con diabetes. Este documento ha sido elaborado por un grupo multidisciplinar de expertos de Atención Primaria y Endocrinología y Nutrición, y ha contado con el apoyo de Sanofi Pasteur MSD. Sin embargo, el resumen de la evidencia y las recomendaciones de expertos se alcanzaron mediante el acuerdo de los expertos implicados, sin que Sanofi Pasteur MSD haya influido en modo alguno en la elaboración de estas.
ObjetivosEl objetivo de este documento fue elaborar de forma resumida y comprensible unas recomendaciones para el uso de la vacuna frente al HZ/NPH en personas con diabetes, como medida adicional dentro del manejo integral de estos pacientes, junto a las recomendaciones nutricionales, incremento de la actividad física, etc.
Para ello se identificaron de forma sistemática todas las evidencias disponibles en la población general y, más específicamente, en las personas con diabetes. Todas las conclusiones obtenidas se agruparon en secciones, según la temática a discutir. Finalmente, las evidencias resultantes fueron categorizadas según la calidad de los estudios que las soportaban y, posteriormente, se elaboraron recomendaciones específicas, acompañadas del grado de recomendación.
MetodologíaUn comité científico multidisciplinar de expertos compuesto por profesionales de Atención Primaria y Endocrinología y Nutrición fue el encargado de buscar, analizar y categorizar la evidencia científica disponible. Para ello, en primer lugar, y con el apoyo metodológico de Luzán 5, se realizó una búsqueda sistemática en diversas bases de datos (ver abajo) con los términos herpes zoster, herpes zoster vaccine y diabetes mellitus, sin límite temporal ni de idioma de búsqueda.
Las búsquedas se llevaron a cabo en:
- -
MEDLINE.
- -
EMBASE.
- -
The Cochrane Library.
- -
U.S. National Guidelines Clearinghouse.
- -
Tripdatabase.
- -
Biblioteca de Guías de Práctica Clínica del Sistema Nacional de Salud —SNS— (Guía-Salud).
- -
Fisterra.
Los artículos fueron clasificados según su nivel de evidencia utilizando la clasificación del Centre for Evidence-Based Medicine de Oxford, Reino Unido (CEBM)3 (tabla 1). La evidencia obtenida y agrupada en secciones, según la naturaleza de su contenido, se evaluó y discutió de forma multidisciplinar en 2 reuniones presenciales del comité científico. Toda esta documentación resumida y estructurada fue la que se utilizó como base para la elaboración de recomendaciones clínicas que fueron consensuadas por unanimidad.
Evaluación del nivel de evidencia y grado de recomendación según el Centre for Evidence-Based Medicine de Oxford (CEBM)
| Grado de recomendación | Nivel de evidencia | Tratamiento, prevención, etiología y daño | Pronóstico e historia natural |
|---|---|---|---|
| A | 1a | RS con homogeneidad de EC con asignación aleatoria | RS de estudios de cohortes con homogeneidad (que incluya estudios con resultados comparables, en la misma dirección y validados en diferentes poblaciones) |
| 1b | EC individual con IC estrecho | Estudios de cohortes individuales, con un seguimiento mayor del 80% de las cohortes y validadas en una sola población | |
| 1c | Todos o ninguno | Series de casos (todos o ninguno) | |
| B | 2a | RS de estudios de cohortes con homogeneidad | RS de estudios de cohortes históricas o de grupos controles no tratados en EC con homogeneidad |
| 2b | Estudios de cohortes individuales con seguimiento inferior a 80%. EC de baja calidad | Estudio individual de cohortes históricas o seguimiento de controles no tratados en una EC o guía de práctica clínica no validada | |
| 2c | Estudios ecológicos o de resultados en salud | Investigación de resultados en salud | |
| Diagnóstico | Diagnóstico y prevalencia | Estudios económicos y de análisis de decisión | |
| RS de estudios de diagnóstico de alta calidad con homogeneidad (que incluya estudios con resultados comparables, en la misma dirección y en diferentes centros clínicos) | RS con homogeneidad de estudios de cohortes prospectivas | RS con homogeneidad de estudios económicos de alta calidad | |
| Estudios de cohortes que validen la calidad de una prueba específica, con estándar de referencia adecuado o a partir de algoritmos de estimación del pronóstico o de categorización del diagnóstico o probado en un centro clínico | Estudios de cohortes prospectivas con buen seguimiento | Análisis basado en costes o alternativas clínicamente sensibles; RS de la evidencia. Incluye análisis de sensibilidad | |
| Pruebas diagnósticas con especificidad tan alta que un resultado positivo confirma el diagnóstico y con sensibilidad tan alta que un resultado negativo descarta el diagnóstico | Series de casos (todos o ninguno) | Análisis en términos absolutos de riesgos y beneficios clínicos: claramente tan buenas o mejores, pero más baratas, claramente tan malas o peores, pero más caras | |
| RS de estudios de diagnósticos de nivel 2 con homogeneidad | RS con homogeneidad de estudios 2b o mejores | RS con homogeneidad de estudios económicos con nivel mayor a 2 | |
| Estudios exploratorios que a través de una regresión logística determinan factores significativos y validados con estándar de referencia adecuado (independiente de la prueba diagnóstica) | Estudio individual de cohortes históricas o de seguimiento insuficiente | Análisis basado en costes o alternativas clínicamente sensibles; limitado a revisión de la evidencia. Incluye análisis de sensibilidad | |
| Estudios ecológicos | Auditorías o estudios de resultados en salud | ||
| 3a | RS de estudios de casos y controles individuales | ||
| 3b | Estudios de casos y controles individuales | ||
| C | 4 | Series de casos, estudios de cohortes y de casos y controles de baja calidad | Series de casos y estudios de cohortes de pronóstico de baja calidad |
| D | 5 | Opinión de expertos sin evaluación crítica explícita, ni basada en fisiología, ni en trabajo de investigación juicioso, ni en “principios fundamentales” | Opinión de expertos sin evaluación crítica explícita, ni basada en fisiología, ni en trabajo de investigación juicioso, ni en “principios fundamentales” |
| Diagnóstico | Diagnóstico diferencial y prevalencia | Estudios económicos y de análisis de decisión | |
| RS de estudios con homogeneidad de estudios 3b y mejor calidad | RS de estudios con homogeneidad de estudios 3b y mejor calidad | RS de estudios con homogeneidad de estudios 3b y mejor calidad | |
| Comparación enmascarada y objetiva de un espectro de pacientes que podría ser examinado para un determinado trastorno, pero el estándar de referencia no se aplica a todos los pacientes del estudio. Estudios no consecutivos o sin aplicación de un estándar de referencia | Estudio no consecutivo de cohorte, o análisis muy limitado de la población basado en pocas alternativas o costes, datos de mala calidad, pero con análisis de sensibilidad que incorporan variaciones clínicamente sensibles | ||
| Estudios de casos y controles con escasos o sin estándares de referencia independientes | Series de casos o estándares de referencia obsoletos | Análisis sin análisis de sensibilidad | |
| Opinión de expertos sin evaluación crítica explícita, ni basada en fisiología, ni en trabajo de investigación juicioso, ni en “principios fundamentales” | Opinión de expertos sin evaluación crítica explícita, ni basada en fisiología, ni en trabajo de investigación juicioso, ni en “principios fundamentales” | Opinión de expertos sin evaluación crítica explícita, ni basada en fisiología, ni en trabajo de investigación juicioso, ni en “principios fundamentales” | |
EC: ensayo clínico; IC: intervalo de confianza; RS: revisión sistemática.
Para clasificar la consistencia de estas recomendaciones, se utilizó nuevamente la clasificación del CEBM de Oxford, Reino Unido3.
1Herpes zóster: epidemiología, clínica, diagnóstico y tratamientoEl HZ es una enfermedad causada por la reactivación del VVZ a partir de una infección latente en los ganglios sensoriales.
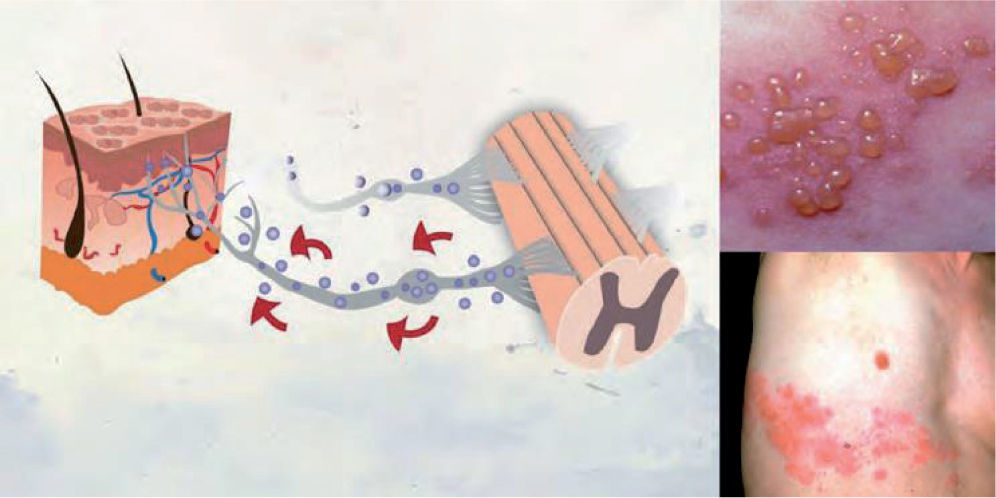
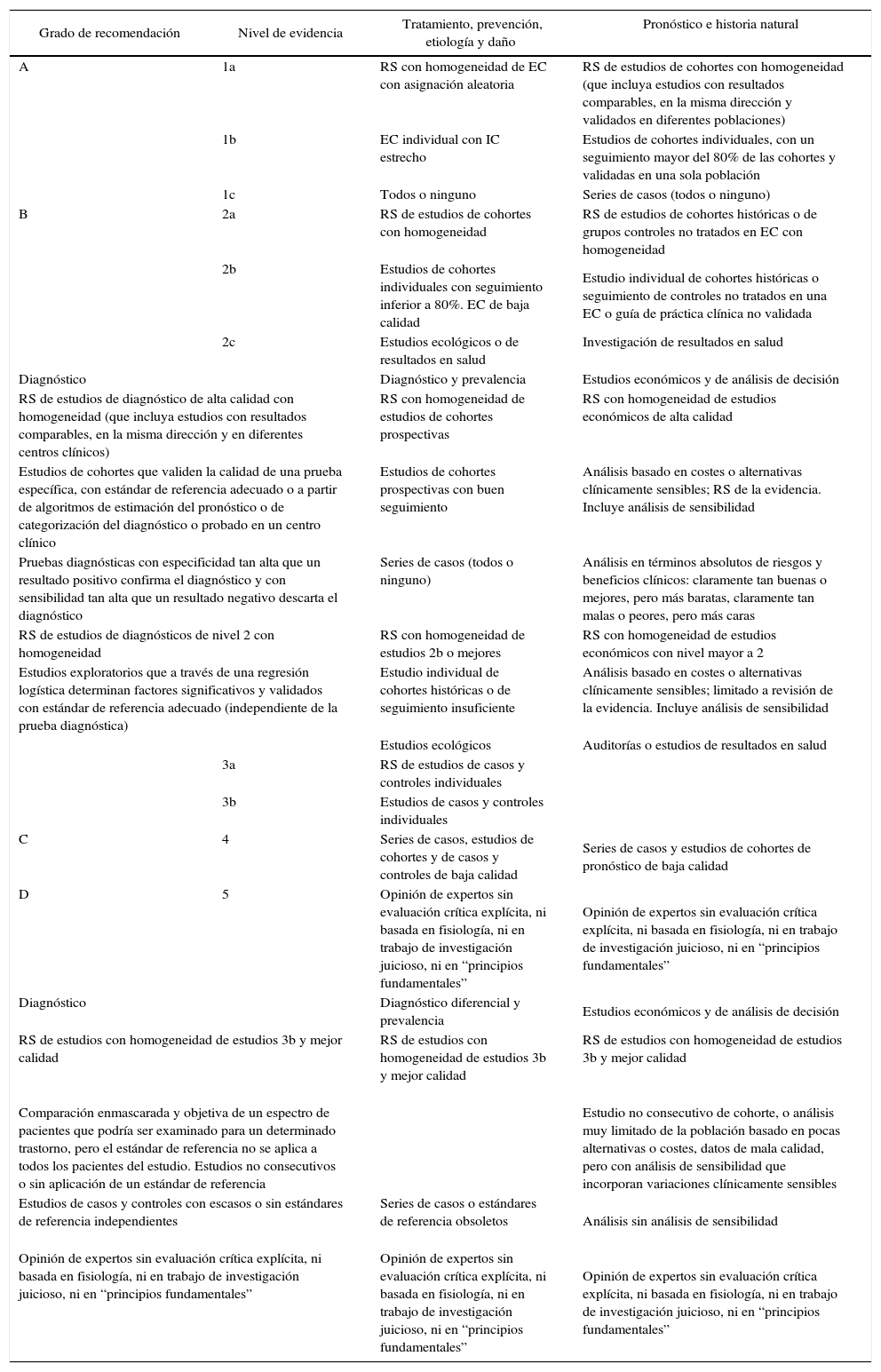
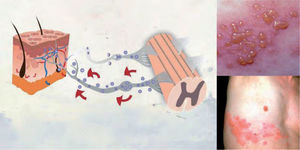
DefiniciónEl HZ es una enfermedad producida por una reactivación del virus latente varicela zóster. Se caracteriza por una erupción cutánea vesicular localizada en la región sensorial afectada de los ganglios, que está a menudo precedida o acompañada de dolor agudo o picazón4. Si el virus se aloja en nervios craneales, puede llegar a afectar a los párpados y poner en peligro la visión al producir una queratitis, que puede complicarse con la aparición de glaucoma o iridociclitis (fig. 1).
Patogenia del herpes zóster. La infección por el virus varicela zóster se caracteriza por una erupción cutánea vesicular localizada en la región sensorial afectada de los ganglios, que está a menudo precedida o acompañada de dolor agudo o picazón4
Aproximadamente, 1 de cada 4 personas desarrollará un HZ a lo largo de su vida, aunque en mayores de 85 años este riesgo aumenta a 1 de cada 25–10. Las personas que han padecido un HZ presentan un mayor riesgo de accidente cerebrovascular a partir de los 3 meses de la enfermedad, en comparación con aquellas sin ese antecedente (odds ratio [OR]: 1,53; intervalo de confianza [IC] del 95%, 1,10-2,33; p=0,04)11.
ClínicaEl HZ suele comenzar con una fase prodrómica que aparece de 1 a 7 días antes de la aparición de las vesículas. Estos pródromos varían desde un prurito leve hasta sensación de hormigueo, ardor o dolor lancinante, constante o intermitente. Posteriormente surge un exantema maculopapuloso eritematovioláceo, en donde rápidamente afloran vesículas. En 24-72 h, las vesículas se vuelven purulentas y a los 7-10 días aparecen costras pardoamarillentas, que pueden persistir durante 2-3 semanas dejando eritema, pigmentación y a veces cicatrices deprimidas12.
La complicación más común y debilitante del HZ es la NPH. Se define como la persistencia de dolor en el área afectada por el HZ. Suele ser de evolución prolongada, con dolor y molestias de gran intensidad que provocan una grave alteración de la calidad de vida y que causan importantes repercusiones a nivel personal, familiar y social. Aparece en aproximadamente el 10-20% de las personas que padecen un HZ y hasta en el 50% de las mayores de 85 años13–15. Mientras el HZ es una enfermedad aguda, que generalmente se resuelve en un plazo aproximado de 1 mes en la mayoría de los pacientes, la NPH persiste durante al menos 6 meses, con casos de personas que sufren dolor durante años16–18.
Diversos estudios sugieren que la presencia de diabetes se asocia con un incremento del riesgo de desarrollar HZ, siendo más alto este riesgo en personas de 65 o más años19,20, que presentan un riesgo 3 veces mayor de desarrollarlo21. Si además se suma la presencia de insuficiencia cardíaca y EPOC, el riesgo de sufrirlo es superior 4 veces al de las personas no diabéticas con estas patologías19. En cuanto a la persistencia del dolor postherpético, la incidencia cruda es un 50% más alta en personas con diabetes frente a personas no diabéticas (5,97 frente a 3,93 casos/1.000; p < 0,01)21.
Según los resultados de un reciente estudio que ha incluido 119.413 sujetos con HZ, la incidencia de NPH en personas con diabetes tipo 2 (7.744 personas incluidas en el estudio, un 6,5% del total) fue de un 9,6%, frente a un 5,6% en la población no diabética. La incidencia de NPH en personas con diabetes tipo 1 (282 personas incluidas, un 0,2% del total) fue del 3,5%. Dentro de los sujetos inmunocompetentes incluidos en este estudio, los procesos crónicos que presentan las personas con una mayor probabilidad de desarrollar NPH son, por este orden: EPOC y enfermedad hepática crónica, seguido de diabetes mellitus tipo 2 (DM2)22.
DiagnósticoLa infección por el VVZ se diagnostica mayoritariamente por la historia clínica, la exploración y la clínica resultante. La aparición, la distribución y el aspecto característico de las lesiones suelen ser suficientes para un diagnóstico clínico. Solo en muy raras ocasiones puede ser necesario realizar un diagnóstico virológico, que trate de diferenciar si las lesiones son producidas por el virus del herpes simple o si, en caso de vacunados, el exantema es producido por un virus salvaje o vacunal. Existen diversos procedimientos disponibles para realizar el diagnóstico virológico: aislamiento del virus, diagnóstico rápido y diagnóstico serológico23.
El diagnóstico de la NPH puede ser fácil de realizar, ya que suele presentarse en los pacientes que hayan tenido una erupción cutánea en forma de vesículas, habitualmente unilateral, y que haya dejado una cicatriz residual o hipopigmentación, acompañada de disestesia, anestesia o hiperestesias en la antigua distribución vesicular. El diagnóstico se complica en pacientes que no han presentado manifestaciones cutáneas, obligando al diagnóstico diferencial con glaucoma, infarto de miocardio, pleuritis, colecistitis, etc. Las personas con NPH no suelen tener antecedentes de traumatismos, ni manifestaciones radiológicas o hematológicas24.
TratamientoRespecto al abordaje del HZ, la administración de fármacos antivirales por vía sistémica puede reducir la inflamación, disminuir la sintomatología y contribuir a una más pronta recuperación25.
En relación con el abordaje de la NPH, el inicio del tratamiento ha de realizarse con terapias sintomáticas habituales y, en el caso de no ser efectivas, se pasará a instaurar tratamientos más específicos en función de la intensidad del dolor, edad del paciente y patología asociada. Los antidepresivos tricíclicos, antiepilépticos, capsaicina y fármacos opiáceos han sido utilizados para disminuir el dolor de la neuralgia. Si pese al uso de los fármacos anteriormente descritos no se obtuviera una respuesta satisfactoria, se debe enviar al paciente a una unidad del dolor26.
En la actualidad puede prevenirse la aparición del HZ y la NPH mediante la vacunación. La vacuna frente al HZ se ha asociado con una reducción en la incidencia de la enfermedad y en la frecuencia de aparición de la NPH27,28.
Resumen de la evidencia- •
Aproximadamente, 1 de cada 4 personas sufrirá un HZ a lo largo de su vida. Aunque en personas mayores de 85 años, este riesgo aumenta a 1 de cada 26–11(nivel de evidencia: 4).
- •
Las personas con diabetes tipo 2 mayores de 65 años presentan un riesgo 3 veces mayor de desarrollar un HZ que las personas sin diabetes19(nivel de evidencia: 2b).
- •
La incidencia cruda de NPH es al menos un 50% más alta en personas con diabetes que en las personas sin diabetes (5,97 frente a 3,93 casos/1.000; p < 0,01)21(nivel de evidencia: 2b).
- •
La vacunación frente al HZ/NPH se ha asociado con una disminución en la incidencia de la enfermedad y una reducción en la aparición de la NPH27,28(nivel de evidencia: 1b).
La vacuna frente al HZ/NPH es una vacuna de virus vivos atenuados, compuesta por la misma cepa que la vacuna de la varicela.
Desarrollo clínico y autorizaciónLa cepa utilizada para ello es la Oka/Merck, aunque con una carga viral de no menos de 19.400 unidades formadoras de placas (UFP), frente a las 1.350 UFP de la vacuna de la varicela29.
El mecanismo de acción de la vacuna es mediante refuerzo de la respuesta inmunitaria específica, en especial de los linfocitos T, frente al VVZ, con lo que se evita su reactivación. El objetivo de la vacuna es la prevención del HZ y de sus complicaciones asociadas, principalmente la NPH29.
La vacuna fue aprobada por la Food and Drug Administraron (FDA) y por la European Medicines Agency (EMA) en 200629. En España, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) autorizó la vacuna en junio de 2006, y se comercializó en octubre de 2014 con el nombre comercial de Zostavax®.
La vacuna está indicada para prevenir el HZ y la NPH en personas de 50 años de edad o mayores29.
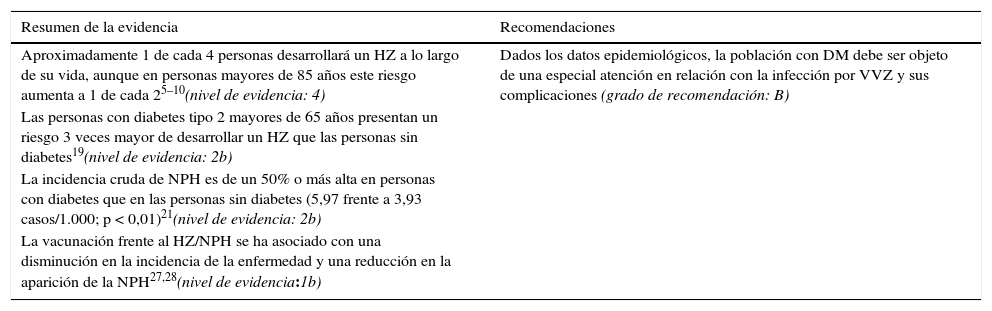
EficaciaLa eficacia y seguridad de la vacuna se ha demostrado frente a placebo en 2 ensayos clínicos aleatorizados, doble ciego, en los que se incluyeron más de 80.000 pacientes: el Ensayo para la Prevención del Herpes Zóster (Shingles Prevention Study [SPS])30 y el Estudio de Eficacia y Seguridad en el Herpes Zóster (Zostavax Efficacy and Safety Trial [ZEST])31. Estos estudios demuestran una eficacia para la reducción del HZ del 69% en personas de 50 a 59 años y del 51% en personas de 60 años o más. Por lo tanto, la eficacia de la vacuna es más alta entre las personas de 50-59 años, y esta se reduce según aumenta la edad. Además, los ensayos han demostrado la eficacia de la vacuna en otros aspectos como la reducción de la incidencia de NPH y de la carga de enfermedad, es decir, de la gravedad y la duración del dolor y otras molestias asociadas al HZ. Las características y resultados de estos estudios se resumen en la tabla 2.
Características de los ensayos clínicos de la vacuna del herpes zóster
| Estudio | Estudio de Eficacia y Seguridad de Zostavax (ZEST) | Estudio de Prevención del Herpes Zóster (SPS) | ||||
|---|---|---|---|---|---|---|
| n | 22.439 (11.211 vacunados, 11.228 controles) | 38.546 (19.270 vacunados, 19.276 controles) | ||||
| Diseño | Doble ciego controlado con placebo | Doble ciego controlado con placebo | ||||
| Tipo de pacientes | 50-59 años, inmunocompetentes | ≥ 60 años, inmunocompetentes | ||||
| Seguimiento medio | 1,3 años | 3,13 años | ||||
| Eficacia vacunal según la edad | ||||||
| 50-59 años | ≥ 60 años | 60-69 años | ≥ 70 años | 70-79 años | ≥ 80 años | |
| Disminución de la incidencia de HZ (IC del 95%) | 70% (54-81%) | 51% (44-58%) | 64% (56-71%) | 38% (25-48%) | 41% (28-52%) | 18% (< 0-48%) |
| Disminución de la incidencia de NPH (IC del 95%) | No disponible | 67% (48-79%) | 66% (20-87%) | 67% (43-81%) | 74% (49-87%) | 40% (< 0-67%) |
| Disminución de CdE (IC del 95%) | 73% (53-85%) | 61% (51-69%) | 66% (52-76%) | 55% (40-67%) | 59% (43-71%) | 38% (< 0-67%) |
CdE: carga de enfermedad; HZ: herpes zóster; IC: intervalo de confianza; NPH: neuralgia postherpética.
La efectividad de la vacuna frente al HZ/NPH también se ha investigado y confirmado en condiciones reales de uso32. En una cohorte retrospectiva de más de 75.000 personas mayores de 60 años se encontró una tasa de HZ de 6,4 por cada 1.000 personas/año, muy inferior a la tasa de HZ en una cohorte de más de 200.000 personas no vacunadas (13,0 por cada 1.000 personas/año)27. En este estudio, la incidencia de aparición de HZ se redujo en un 55%, el riesgo de padecer HZ oftálmico disminuyó en un 63% y el número de hospitalizaciones por HZ descendió en un 65% en personas vacunadas.
Duración de la protecciónLa persistencia de la protección tras la vacunación no se conoce con exactitud. En el estudio Short Term Persistence Study (STPS), realizado con un subgrupo de pacientes del estudio SPS, y en el seguimiento a largo plazo de pacientes del estudio SPS, se ha demostrado que la eficacia vacunal persiste al menos durante 7 años, con una efectividad del 48,7, del 64,9 y del 58,6% en la reducción del HZ, del NPH y de la carga de enfermedad, respectivamente33. Sin embargo, en un estudio realizado en 176.078 vacunados mayores de 60 años en el grupo Kaiser Permanent North California (KPNC) se puso de manifiesto una reducción de la eficacia vacunal, desde el 68,7% en el primer año hasta el 4,2% en el octavo año34. Otros autores señalan que la eficacia de la vacuna para disminuir la incidencia de episodios de HZ podría persistir solo hasta el octavo año, aunque la eficacia de la vacuna en la reducción de la carga de enfermedad podría persistir al menos hasta el décimo año tras la administración de la vacuna35.
La disminución de la eficacia de la vacuna frente al HZ/NPH que evidencia estos estudios sugiere la posibilidad de que sea necesaria una estrategia de revacunación, aunque de momento en la ficha técnica no se indica ni se recomienda su necesidad. En el caso de que en algún momento se recomiende la revacunación, existen datos que indican que una dosis de refuerzo, administrada 10 años después de la primera dosis, podría resultar tan inmunógena como la primera dosis a la misma edad36.
SeguridadLa seguridad de la vacuna se ha puesto de manifiesto en las bases de datos de seguridad32 y en la experiencia observada en la vida real, tras más de 32 millones de dosis de vacuna frente al HZ/NPH administradas en todo el mundo, desde su autorización en 2006.
La vacuna frente al HZ/NPH es en general bien tolerada y los acontecimientos adversos más comunes informados (observados en más de 1 de cada 10 pacientes) son reacciones en el lugar de la inyección (eritema, dolor/sensibilidad, inflamación y prurito) y dolor de cabeza29.
También se ha demostrado la seguridad e inmunogenicidad en sujetos de diferentes edades37, con diferentes condiciones médicas subyacentes (DM, EPOC)38, en personas con antecedente de HZ39, en personas seronegativas para el VVZ40, en pacientes con tratamiento crónico con corticosteroides41, así como en estudios para valorar la administración concomitante de la vacuna frente a HZ/NPH con la vacuna inactivada frente a la gripe42 y la vacuna frente al neumococo 23-valente43.
Características: posología, precauciones, contraindicaciones e interaccionesPosología- -
Una dosis única (0,65ml) vía subcutánea (s.c.) o intramuscular (i.m.), preferiblemente en la región deltoidea.
- -
En el momento actual, la ficha técnica de la vacuna indica que se desconoce la necesidad de una dosis de refuerzo29.
- -
La vacuna se debe administrar por vía s.c. en pacientes con trastornos de la coagulación.
- -
No hay datos con respecto al uso de la vacuna en mujeres embarazadas, y se desconoce si el VVZ se excreta en la leche materna.
- -
La inmunización se debe posponer en sujetos que sufran enfermedad febril aguda de moderada a grave o infección.
- -
No se ha notificado la transmisión del virus vacunal en los ensayos clínicos. Sin embargo, estudios poscomercialización con vacunas de varicela señalan que puede ocurrir la transmisión viral-vacunal, de forma muy infrecuente, entre los vacunados que desarrollan un exantema variceli-forme y sus contactos susceptibles29.
- -
Al tratarse de una vacuna de virus vivos atenuados, su administración puede dar lugar a una enfermedad diseminada en individuos inmunodeprimidos, por lo que estos pacientes deben ser evaluados cuidadosamente antes de recibir la vacuna. Asimismo, no se ha establecido su seguridad y eficacia en pacientes infectados por el virus de la inmunodeficiencia humana (VIH), con o sin evidencia de inmunodepresión. Sin embargo, hay estudios en pacientes con infección por VIH y una cifra de linfocitos T CD4+ ≥ 200 células/μl, que señalan que la vacuna puede ser segura e inmunogénica en estos pacientes44.
La vacuna está contraindicada:
- -
En personas con antecedentes de hipersensibilidad al principio activo o a alguno de los excipientes.
- -
En estados de inmunodeficiencia primaria o adquirida.
- -
En casos de tratamientos inmunosupresores, incluyendo altas dosis de corticosteroides. Sin embargo, no está contraindicada en sujetos que estén recibiendo corticosteroides tópicos o inhalados, dosis bajas de corticosteroides sistémicos o en pacientes que estén recibiendo corticoides como terapia de sustitución, por ejemplo para la insuficiencia adrenal.
- -
En tuberculosis activa no tratada.
- -
En el embarazo. Además, se debe evitar el embarazo durante al menos 1 mes después de la vacunación29.
- -
La respuesta inmunitaria humoral frente al VVZ no se reduce con la administración concomitante de las vacunas frente a HZ/NPH y antigripal inactivada42, lo que permite su uso simultáneo en caso necesario.
- -
No se aconseja el uso simultáneo de la vacuna frente a HZ/NPH y la vacuna frente al neumococo polisacárido 23v, porque puede verse disminuida la respuesta inmunógena frente al VVZ43.
- -
No se dispone de datos relativos al uso concomitante con otras vacunas y no se ha evaluado la administración concurrente con medicaciones antivirales frente al VVZ29.
La inversión de la pirámide demográfica en España está produciendo un incremento de los casos de HZ y NPH, y representa un reto para mantener la sostenibilidad del sistema sanitario. Cebrián et al45 estiman los costes directos del HZ y la NPH en 60 millones de € anuales para el SNS español. En consecuencia, la prevención mediante vacunación del HZ y la NPH es una alternativa eficiente para el Sistema Sanitario Nacional y permite un incremento de los años de vida saludables de la población adulta mayor de 50 años.
Los estudios que han evaluado la eficiencia de los programas de vacunación de HZ/NPH en Estados Unidos, Canadá y Europa (Inglaterra y Gales) no son extrapolables a nuestro país. Aunque la carga de la enfermedad no varía mucho entre unos países y otros, sí que lo hacen los costes directos e indirectos, por lo que se necesitaría llevar a cabo estudios de evaluación económica en nuestro país6,46–49.
López Belmonte et al, recientemente han publicado un estudio nacional de coste-efectividad50, y concluyen que un programa de vacunación frente al HZ con una cobertura de un 30% de los sujetos por encima de 50 años en España podría considerarse coste-efectivo, con el mayor beneficio en los sujetos de 65 a 74 años.
Resumen de la evidencia- •
La vacuna frente al HZ y la NPH es una vacuna de virus vivos atenuados. En España está comercializada para mayores de 50 años. La pauta de vacunación es una única dosis vía s.c. o i.m.29(nivel de evidencia: 1b).
- •
La vacuna refuerza la inmunidad celular específica frente al VVZ latente en el organismo, y persigue evitar la reactivación y sus complicaciones29(nivel de evidencia: 1b).
- •
La vacuna frente al HZ es eficaz en la prevención del HZ y de la NPH, así como en la reducción de la carga de enfermedad asociada al HZ30,31(nivel de evidencia: 1b).
- •
La eficacia de la vacuna frente al HZ es más alta entre las personas de 50-59 años y se reduce según aumenta la edad30,31(nivel de evidencia: 1b). Sin embargo, la eficacia permanece elevada en el grupo de mayor edad para prevenir la NPH y reducir la carga de enfermedad33(nivel de evidencia: 1b).
- •
Existen datos de un descenso de la eficacia vacunal para prevenir el HZ y la NPH más allá del octavo año posvacunal34,35(nivel de evidencia: 1b). La ficha técnica de la vacuna no establece, por el momento, la necesidad de dosis de recuerdo29.
- •
La seguridad vacunal está firmemente establecida basándose en estudios pre y poscomercialización30–32(nivel de evidencia: 1b), sin efectos adversos graves notificados. Los acontecimientos adversos más comunes informados son reacciones locales y dolor de cabeza29(nivel de evidencia: 1b).
- •
Se ha demostrado la seguridad e inmunogenicidad de la vacuna del HZ/NPH en personas de diferentes edades37(nivel de evidencia: 1b) y con diferentes condiciones médicas subyacentes crónicas como DM o EPOC38(nivel de evidencia: 1b).
- •
Un programa de vacunación frente a HZ con una cobertura de un 30% de las personas por encima de 50 años en España podría considerarse coste-efectivo, con el mayor beneficio en las personas de 65 a 74 años50(nivel de evidencia: 1b).
- •
Al ser una vacuna de virus vivos atenuados, debe seguir las recomendaciones generales de utilización de este tipo de vacunas29(nivel de evidencia: 1b).
- •
Se puede administrar concomitantemente con la vacuna antigripal42 (nivel de evidencia: 1b).
- •
Se recomienda la vacunación frente al HZ/NPH en personas con DM mayores de 50 años, de forma similar al resto de la población general (grado de recomendación: A).
- •
Se recomienda especialmente la vacunación frente al HZ/NPH en personas con DM entre 65 y 75 años basándose en su coste-beneficio, de forma similar al resto de la población general (grado de recomendación: A).
Aunque la infección por VVZ es frecuente en el paciente inmunocomprometido, es un hallazgo clínico poco habitual en el paciente inmunocompetente.
IntroducciónDe este modo, la reactivación del VVZ se produce por la disminución de la inmunidad mediada por células VVZ-específico. La DM puede comprometer la competencia inmune del paciente frente a la infección por VVZ y aumentar el riesgo y la gravedad de las infecciones.
Reactivación del herpes zóster y de la diabetesEl HZ ocurre con más frecuencia en personas con diversas enfermedades crónicas, y entre ellas la DM. Los mecanismos biológicos implicados de esta asociación con el HZ son desconocidos. Esta circunstancia cuestiona que la vacuna del HZ esté actualmente indicada en adultos de avanzada edad, y no en pacientes más jóvenes con comorbilidades como la diabetes con riesgo aumentado de HZ, en los que se podría valorar su uso dado el impacto observado de la infección por el HZ y de la NPH en personas con diabetes más jóvenes.
La asociación entre la DM y el HZ está apoyada por diversos defectos específicos in vitro51 en la inmunidad innata y adaptativa, lo que puede facilitar la reactivación del VVZ que permanece acantonado. La DM se acompaña de una alteración de la inmunidad celular52, lo que aumenta el riesgo de HZ y de enfermedad herpética ocular, haciendo que estos sean más graves y generalizados53. Asimismo se ha sugerido que el mayor estrés neuronal en la DM debido a la enfermedad microvascular diabética puede contribuir a la reactivación viral y a un mayor riesgo de HZ53.
Independiente de la edad y el sexo, la diabetes es un predictor importante de riesgo de desarrollar HZ20.
Reactivación del herpes zóster y mal control metabólicoPor tanto, dado que los resultados entre la potencial relación del grado de control metabólico y la infección o reactivación por infección HZ son de muy baja calidad metodológica19,54, no es posible extraer conclusiones con adecuado grado de certeza.
Mayor riesgo de herpes zóster en la diabetesEn el estudio de cohorte retrospectivo de Guignard et al19 se observó que la magnitud de riesgo de HZ asociado a la DM2 estaba condicionada por la edad de los individuos y la presencia de comorbilidades, como la enfermedad cardíaca y la enfermedad pulmonar crónica. Las personas con DM2 con una edad ≥ 65 años tuvieron un riesgo 3 veces mayor de desarrollar HZ en comparación con los no diabéticos. Sin embargo, entre las personas con diabetes con una edad comprendida entre 40 y 64 años, el incremento de riesgo fue solo del 50% comparado con los no diabéticos de la misma edad.
En un estudio retrospectivo realizado en Israel, que comparó 22.294 casos de HZ con 88.895 controles, se encontró un incremento de riesgo de HZ del 53% en las personas con diabetes (OR: 1,53; IC del 95%, 1,44-1,62)54.
En el estudio de Aldaz et al20, realizado en España, se observó un riesgo relativo ajustado de desarrollar HZ en las personas con diabetes de 2,1 (IC del 95%, 1,9-2,4) comparado con los no diabéticos. Este exceso de riesgo fue más pronunciado en jóvenes, donde la inmunidad suele estar conservada. A partir de los 45 años, el exceso de riesgo asociado a la diabetes disminuyó, lo cual puede deberse a la presencia de otras enfermedades concurrentes que contribuirían a reducir las diferencias entre la respuesta inmune de las personas con o sin diabetes.
En otro estudio retrospectivo de cohortes de base poblacional, realizado en una organización de cuidado de la salud con más de una cuarta parte de la población de Israel, también se encontró un aumento del 17% en el riesgo de HZ en la diabetes (hazard ratio [HR]: 1,53; p < 0,05), después de ajustar por sexo, edad, nivel socioeconómico, antecedentes de cáncer, tratamiento del VIH y el uso de inhibidores del factor de necrosis tumoral α (anti-TNFα)55.
Igualmente, 2 estudios de cohortes estadounidenses analizaron como objetivos secundarios la asociación de la diabetes y del HZ en una población con una edad ≥ 60 años, y observaron una asociación positiva de la diabetes con la incidencia de HZ, aunque de menor magnitud (HR: 1,06 y 1,05, respectivamente; ambos, p < 0,05)27,28.
Por otra parte, otros estudios no han demostrado ningún vínculo entre el HZ y la diabetes. Sin embargo, hay que destacar que estos estudios no tenían un diseño específico para abordar esta cuestión o fueron realizados en poblaciones con otras comorbilidades específicas27,56. En un estudio prospectivo de casos-controles realizado por Lasserre et al57 se encontró una asociación entre diabetes y HZ en el análisis univariante, pero esta no fue significativa en el análisis multivariante. El no tener en cuenta una interacción entre la edad y la DM2 pudo subestimar el efecto de la DM2 en los pacientes de edad avanzada.
Asimismo, en el estudio de Díez et al, que utilizó datos de la base del alta hospitalaria regional de Valencia en el período de 2007 a 2014, se observó que las recurrencias de hospitalizaciones por HZ fueron más comunes entre los varones, entre los mayores de 70 años y en pacientes con comorbilidad como la diabetes58.
Neuralgia postherpética en las personas con diabetesEl estudio de la relación entre la diabetes y la gravedad y duración de la NPH es complejo debido a:
- -
Las diferencias entre las poblaciones estudiadas, así como los diferentes criterios de inclusión y exclusión del diagnóstico de HZ.
- -
Las diferencias en los algoritmos de codificación, así como en la precisión de la codificación.
- -
Las diferentes fuentes de datos y la sincronización.
- -
La naturaleza de los diferentes mecanismos de seguimiento (es decir, ensayos clínicos o estudios de observación).
Las tasas de NPH en la diabetes, en estudios prospectivos, han oscilado entre el 3 y el 34%, aumentando la frecuencia y duración con la edad avanzada28,30,59. Sin embargo, en el estudio de Suaya et al se encontraron tasas de persistencia de NPH de entre el 5,97 y el 3,93% en individuos con o sin diabetes, respectivamente. Probablemente, la identificación de los marcadores de persistencia de la NPH, utilizando el sistema de diagnóstico CIE-9-CM de las reclamaciones médicas en lugar de la revisión de los registros médicos, pudo subestimar la frecuencia real60. En este estudio se observó que las tasas de persistencia de la NPH fueron mayores en el paciente inmunocomprometido que en el inmuno-competente, sin tener en cuenta el estado de la diabetes. Sin embargo, las diferencias entre las personas inmunocom-prometidas e inmunocompetentes fueron menores en los pacientes con diabetes (el 7,46% [IC del 95%, 6,63-8,38] frente al 5,84% [IC del 95%, 5,62-6,08]) que en los pacientes sin diabetes (el 6,25% [IC del 95%, 5,89-6,62] frente al 3,77% [IC del 95%, 3,70-3,85])60.
Complicaciones crónicas de la diabetes y el herpes zósterEn el estudio de Ke et al61 se investigó la asociación entre el riesgo de HZ y las comorbilidades macrovasculares y micro-vasculares relacionadas con la diabetes. Este estudio retrospectivo incluyó a 25.345 pacientes con HZ recientemente identificados y controles de la misma edad y sexo, obtenidos de la base de datos nacional de investigación de seguros de salud de Taiwán, durante el período 2005-2011. Se utilizaron análisis de regresión logística multivariante para calcular las OR y para evaluar los factores de riesgo de HZ en personas diabéticas con complicaciones crónicas. El riesgo de HZ aumentó significativamente en los casos de DM frente a los controles sin DM (el 20,2 frente al 17,0%; OR: 1,24; p < 0,001). Tras el ajuste por edad y sexo se observó un riesgo significativamente mayor de HZ en personas con DM con enfermedad arterial coronaria (OR ajustada [ORa]: 1,21; p < 0,001) y trastornos microvasculares (ORa: 1,32; p < 0,001) comparado con personas con DM con otras comor- bilidades pero sin trastornos microvasculares.
Igualmente, el estudio de Joesoef et al62 demostró que el riesgo de HZ se incrementa si en los pacientes coexisten trastornos crónicos prevalentes, como enfermedad cardiovascular, DM, hiperlipidemia o hipertensión, aunque no pudo identificarse una condición predisponente en la mayoría de los casos de HZ.
Modalidad de tratamiento de la diabetes y el herpes zósterEn el estudio de Ke et al61, los pacientes tratados con tiazo- lidinedionas, inhibidores de la alfaglucosidasa e insulina tuvieron un riesgo más alto de HZ que los que recibieron metformina o sulfonilureas en monoterapia (ORa: 1,11, 1,14 y 1,18, respectivamente; p < 0,001). Los pacientes en tratamiento solo con insulina o en combinación con otros agentes antidiabéticos tuvieron un riesgo significativamente mayor de HZ (ORa: 1,25; p < 0,001) que los que recibieron monoterapia con agentes orales. La principal limitación de este estudio es que la base de datos de investigación nacional del seguro de salud de Taiwán no proporciona los valores de HbA1c o las dosis de los fármacos antidiabéticos.
Igualmente, en el estudio de Heymann et al54 se observó una asociación positiva entre la DM y el HZ entre los pacientes con una edad menor de 45 años que usaban insulina, aunque esta asociación no alcanzó significación estadística. Este dato podría sugerir un mayor riesgo de HZ en las personas con DM en tratamiento con insulina frente a los no insulinizados.
Resumen de la evidencia- •
La DM puede afectar a la inmunidad celular por diferentes mecanismos y puede facilitar la reactivación del VVZ, con independencia de la edad y del sexo, potenciando el riesgo de HZ20,51–53(nivel de evidencia: 2b).
En los estudios retrospectivos y de casos-controles, la magnitud de riesgo de HZ asociado a la DM2 está condicionada por la edad de los individuos y la presencia de comorbilidades19. Se ha detectado un mayor incremento de riesgo en los pacientes con diabetes más jóvenes, con una edad comprendida entre 40 y 64 años19(nivel de evidencia: 2b).
- •
Las tasas de NPH en el paciente con DM oscilan entre el 3 y el 34%, y son similares a las de la población general28,59(nivel de evidencia: 1b).
- •
El riesgo de HZ en la diabetes se incrementa significativamente en los pacientes con comorbilidades macro- vasculares y microvasculares61(nivel de evidencia: 3b).
- •
Las personas con DM tratadas en monoterapia con metformina o sulfonilureas tienen menor riesgo de desarrollar HZ que las que reciben tiazolidinedionas, inhibidores de la alfaglucosidasa o insulina61(nivel de evidencia: 3b).
- •
Por la disminución de la inmunidad celular y por el mayor riesgo de infección por VVZ en las personas con DM se aconseja la vacunación frente al HZ/NPH (grado de recomendación: B).
- •
Debido al aumento de riesgo de infección por VVZ en presencia de comorbilidades (EPOC, insuficiencia cardíaca) en las personas con DM se aconseja la vacunación frente al HZ/NPH en estas circunstancias (grado de recomendación: B).
- •
En las personas con diabetes más jóvenes (entre 40 y 64 años) y con peor control metabólico, debido a un posible mayor riesgo de reactivación del VVZ se sugiere también la vacunación (grado de recomendación: D).
Existen 2 ensayos clínicos aleatorizados, controlados con placebo, a doble ciego, que estudiaron la eficacia, seguridad y tolerabilidad de la vacuna del HZ en la prevención de la aparición de HZ y NPH30,31.
Ensayos clínicos aleatorizados: eficacia y seguridad de la vacuna del herpes zósterEl primero de los ensayos clínicos de estas características se realizó en 38.456 sujetos mayores de 60 años de edad, con una mediana de seguimiento de 3,12 años y un total de 957 casos confirmados de HZ y 107 de NPH30. La vacuna fue eficaz en la prevención de la infección por HZ, reduciendo la incidencia de 11,12/1.000 personas-año en los no tratados a 5,42/1.000 personas-año en los vacunados (reducción del 51,3%; IC del 95%, 44,2-57,6). La reducción de la incidencia de NPH fue del 66,5% (IC del 95%, 47,5-79,2), desde 1,38/ personas-año en los no vacunados a 0,46/personas-año en los vacunados. La reducción de la incidencia del impacto global de la enfermedad debida a HZ fue del 61,1% (IC del 95%, 51,1-69,1). En cuanto a la aparición de eventos adversos, existió una incidencia mayor de eventos adversos en el punto de inyección en el grupo de personas vacunadas, siendo por lo demás bien tolerada, sin efectos adversos graves.
El otro ensayo clínico se realizó con un diseño muy similar en sujetos de edad entre 50 y 59 años31. Se aleatorizaron un total de 22.439 sujetos, con un seguimiento medio de 1,3 años. En general, los resultados fueron consistentes con los del primer ensayo, y mostraron una reducción del 69,8% (IC del 95%, 54,1-80,6) de prevención de HZ (30 casos, 1,99/1.000 personas-año, en vacunados frente a 99 casos, 6,57/1.000 personas-año, en no vacunados). La tolerancia fue igualmente buena y se produjo mayor número de eventos adversos en el grupo de vacunados, a expensas de problemas en el lugar de inyección y cefaleas.
En relación con estos datos en personas con diabetes, en las publicaciones de los 2 ensayos clínicos anteriores, no hay datos específicos sobre la proporción y características de los pacientes con esta comorbilidad (diabetes mellitus), ni tampoco datos de subanálisis de la eficacia específica en esta población.
Efectividad de la vacuna del herpes zósterEn lo que concierne a la efectividad de la vacuna, hay 2 estudios disponibles sobre su efectividad en condiciones de práctica real utilizando las bases de datos de 2 organizaciones diferentes.
El primer estudio se realizó con un diseño retrospectivo de cohortes utilizando la base de datos de la organización de KPSC27. Se estudió la población mayor de 60 años de dicha organización durante un período de 3 años, tras la introducción de la vacuna en el sistema de salud de Estados Unidos. Se identificaron los pacientes que habían recibido la vacuna (75.761 participantes), y se asignó a cada uno de ellos un control no vacunado de igual fecha de nacimiento (total de 227.283 personas). Se estudió la incidencia de episodios de HZ durante el tiempo de observación, que demostró una menor incidencia en los pacientes que habían recibido la vacuna, con una reducción del riesgo tras ajustar por las variables potencialmente confusoras (HR: 0,45; IC del 95%, 0,42-0,48). Estos resultados fueron similares para diferentes condiciones. Entre los participantes se contaron 14.720 personas con diabetes que habían recibido la vacuna y 50.212 que no la habían recibido. Los resultados de la reducción de riesgo en personas con diabetes era muy similar a los de la cohorte general (HR: 0,49; IC del 95%, 0,42-0,57).
En el segundo estudio de Langan et al28, con diseño retrospectivo de cohortes sobre la base de datos de Medicare en Estados Unidos, en población mayor de 65 años, se comprobó que la incidencia de nuevos episodios de HZ y NPH era menor en las personas que habían sido vacunadas, demostrando una efectividad importante frente a las nuevas infecciones (HR: 0,48; IC del 95%, 0,39-0,56). Cabe destacar que el riesgo de nuevos episodios de HZ fue superior en personas con diabetes (HR ajustado: 1,02; IC del 95%, 1,02-1,08). Todos los resultados se ajustaron por los factores disponibles, incluyendo la comorbilidad como la diabetes. Sin embargo, no se realizó un subanálisis para las personas con DM. Concretamente, del total de personas incluidas en el estudio, 300.016 presentaban una diabetes, de los cuales 8.812 habían sido vacunados (del total de 29.785 vacunados en total). Por tanto, podemos asumir que este estudio confirma la efectividad de la vacuna en una amplia población de edad avanzada (> 65 años), en la que se incluyó una proporción importante de personas con DM.
Como conclusión podemos afirmar que los datos de efectividad en la vida real de la vacuna en personas con DM son equivalentes a los demostrados en personas sin esta condición, aunque carecemos de análisis de grupos detallados, ni de estudios prospectivos, ni controlados.
Resumen de la evidencia- •
En la actualidad no se dispone de datos específicos procedentes de ensayos clínicos amplios sobre la eficacia de la vacuna en personas con diabetes30,31(nivel de evidencia: 1b).
- •
La inclusión de las personas con DM en estudios disponibles avalan la eficacia y seguridad de la vacuna de HZ en esta población27,28(nivel de evidencia: 1b).
Existe un estudio que investigó los costes de la principal complicación de la infección por HZ, esto es, la NPH63.
Reducción de costes de la neuralgia postherpética con la vacunación (datos en España)En un área sanitaria, que comprendía un hospital comarcal y su área de atención primaria de referencia, se estudiaron retrospectivamente los casos registrados de HZ (total, 1.506). Entre ellos se efectuó el estudio comparativo de los que desarrollaron en la evolución, con al menos 1 año de seguimiento, una NPH (n=228) con el resto de pacientes que no desarrollaron dicha complicación (incidencia del 15,1% de esta complicación). Entre los pacientes, había un 14,7% con diabetes (proporción de diabetes del 13,7 y el 20,7% en los sin y con NPH, respectivamente). Hubo un exceso de costes en todos los componentes, tanto directos como indirectos, evaluados de manera consistente en los pacientes con NPH. Los costes totales fueron de 1.827,1 y de 457,5 € en los pacientes con y sin NPH, respectivamente. Este exceso de coste fue de 739,9 € en costes sanitarios (tanto en gasto en atención primaria como en especializada) y de 629,8 € en los no sanitarios. No se realizó un subanálisis de la población con diabetes.
Coste-efectividad de la vacunación basado en modelosEl estudio de López-Belmonte et al investigó el coste-efectividad de la vacunación de la población mayor de 50 años en España, tanto desde la perspectiva del sistema de salud (third party payer) como desde la perspectiva de la sociedad2. Para ello se utilizó un modelo económico validado, incluyendo en él datos específicos de aplicación a nuestro sistema de salud, siguiendo las recomendaciones de López- Bastida et al para nuestro sistema de salud64, y con validación de las estimaciones utilizando datos provenientes de la Red de Médicos Centinelas de Madrid y de la Comunidad Valenciana (base de datos Abucasis)65,66. Las estimaciones del modelo revelan que la vacunación del 30% de la población española de más de 50 años implicaría la reducción de 244.046 casos de HZ y de 88.359 casos de NPH, con una ganancia de 29.819 años de vida ajustados por calidad (AVAC). La correspondiente cifra de incremento de la ratio coste-efectividad fue de 16.577 €/AVAC ganados desde la perspectiva del sistema de salud, y 24.189 €/AVAC desde el punto de vista de la sociedad. Ambos costes están claramente por debajo del límite arbitrario de coste-efectividad de 30.000 € que se usa habitualmente. El coste por caso evitado de HZ fue de 2.025 y de 2.955 € desde el punto de vista del sistema y de la sociedad, respectivamente. Las cifras equivalentes para 1 caso evitado de NPH fueron de 5.594 y 8.163 €, respectivamente. El número necesario a tratar para evitar 1 caso de HZ fue, según el modelo, de 20, y para la NPH de 56. Cabe destacar que para introducirse en el modelo se usaron datos con una perspectiva conservadora, lo que puede producir en todo caso una sobrestimación de coste.
Por tanto, en relación con los aspectos farmacoeconómicos, no se han encontrado datos específicos para población con DM. Sin embargo podemos deducir de los estudios disponibles de esta índole que, como mínimo, en las personas con diabetes el coste-efectividad de la vacunación es tan favorable como en las personas sin esta condición. Y aún más teniendo en cuenta que la aparición de HZ y su complicación pueden influir aún más desfavorablemente desde el punto de vista clínico en personas con diabetes. Esta consideración se fundamenta en la posibilidad de generar descompensaciones hiperglucémicas tras un episodio de HZ, en la mayor frecuencia de NPH en población con diabetes y en la presencia de mayores comorbilidades asociadas a la diabetes.
Resumen de la evidencia- •
La vacunación frente al HZ/NPH en la población española mayor de 50 años podría ser una medida coste- efectiva64(nivel de evidencia: 1b).
- •
En relación con los aspectos farmacoeconómicos, no se han encontrado datos específicos para población con DM. Sin embargo se estima que en las personas con diabetes el coste-efectividad de la vacunación es tan favorable como en las personas sin esta condición63–66(nivel de evidencia: 5).
Las recomendaciones de los distintos organismos oficiales en España y otros países respecto a la vacunación del HZ son dispares, así como los programas de prevención implementados.
Europa- -
Reino Unido. El Joint Committee on Vaccination and Immunisation del Department of Health recomienda la vacuna para personas de entre 70 y 79 años, con un catch-up a los 78 años. Está financiada públicamente desde 201067. La aceptabilidad es excelente. Más del 90% de los pacientes susceptibles de vacunación HZ muestran una alta satisfacción. Buena cobertura de vacunación, en torno al 52-56% en todo el territorio. Reducción del número de consultas: se registró una disminución de consultas del 22% en las 2 cohortes vacunadas (2014-2015).
- -
Francia. El Haut Conseil de la Santé Publique recomienda la vacuna desde 2013, y la financia desde 2014, para personas entre 65 y 74 años, con un catch-up para mayores de 74 a 79 años de edad durante el primer año de implantación del programa de vacunación68. La vacuna frente al HZ y la NPH está reconocida con el nivel IV (excelente calificación).
- -
Alemania. En el Comité de Vacunación de Sajonia (Empfehlungen der SächsischenImpfkommission), 4 regiones recomiendan la vacuna desde 2010 para mayores de 50 años. Sin financiación pública69.
- -
Austria. El Impfausschuss des Obersten Sanitätsrates (Consejo de la Salud) recomienda la vacuna desde 2007 para mayores de 50 años. Sin financiación pública.
- -
Suecia. La Agencia de los Beneficios Dentales y Farmacéuticos la recomienda desde 2011 para mayores de 50 años. Con financiación pública desde 2012.
- -
Grecia. La Comisión Nacional de Vacunación recomienda la vacuna desde diciembre de 2011 en mayores de 60 años, pero se considera necesaria solo para grupos de alto riesgo y no tendrá financiación pública, salvo para estos grupos.
- -
Italia. Se recomienda en 5 regiones desde 2014 para pacientes de riesgo y con financiación pública.
- -
Estados Unidos. Primer país en reconocer el valor de la vacuna y recomendarla desde octubre de 2006 bajo pauta mixta (financiación pública y privada) en mayores de 60 años de edad. Buen perfil de seguridad y tolerabilidad: tras 10 años de uso no se ha registrado ningún caso grave de farmacovigilancia.
- -
Australia. El National Center for Inmunization Research Surveillance la recomienda y la financia para mayores de 70 años de edad y con catch-up en personas de 71-79 años, a implementar a partir del 1 de noviembre de 2016.
- -
Israel. El Ministry of Health la recomienda desde octubre de 2012, sin financiación pública, para mayores de 60 años.
- -
Corea del Sur. Los Korea Centers for Disease Control and Prevention la recomiendan, desde diciembre de 2012, sin financiación pública a partir de los 60 años.
- -
Castilla y León. Esta comunidad autónoma puso en marcha el primer programa financiado en marzo de 2015 destinado a pacientes de entre 60 y 64 años con EPOC, en tratamiento con corticoides inhalados. En enero de 2016 se amplió el programa de prevención frente al HZ al paciente diabético de entre 60-69 años, y la extensión de la cohorte de edad del grupo con EPOC de 60 a 69 años70.
- -
La Rioja. Esta comunidad autónoma ha anunciado que durante 2016 pondrá en marcha un programa financiado dirigido a diabéticos (tipos 1 y 2) de 65 años. Dicho programa estará incorporado en el calendario del adulto y dirigido a grupos prioritarios.
- -
Baleares. Vacuna recomendada y no financiada incluida en el calendario del adulto de enero de 2016.
- -
Murcia. Vacuna incluida en el Protocolo de Vacunación en Trasplantes de Órgano Sólido del Servicio de Prevención y Protección de la Salud desde febrero de 201671.
La vacuna frente al HZ y la NPH, actualmente no está financiada por el SNS.
Resumen de la evidencia- •
La vacuna frente al HZ/NPH está incluida en el calendario vacunal de numerosos países de nuestro entorno. Se recomienda en mayores de 50 años, con diferentes rangos de edad dependiendo de los países67–69(nivel de evidencia: 5).
- •
Dados los datos epidemiológicos, la población con DM debe ser objeto de una especial atención en relación con la infección por VVZ y sus complicaciones (grado de recomendación: B).
- •
Se recomienda la vacunación frente al HZ/NPH en personas con DM mayores de 50 años, de forma similar al resto de la población general (grado de recomendación: A).
- •
Se recomienda la vacunación frente al HZ/NPH en personas con DM entre 65 y 75 años basándose en su coste- beneficio, de forma similar al resto de la población general (grado de recomendación: A).
- •
Por la disminución de la inmunidad celular y el mayor riesgo de infección por VVZ en las personas con DM se aconseja la vacunación frente al HZ/NPH (grado de recomendación: B).
- •
Debido al aumento de riesgo de infección por VVZ en presencia de comorbilidades (EPOC, insuficiencia cardíaca) en las personas con DM se aconseja la vacunación frente al HZ/NPH en estas circunstancias (grado de recomendación: B).
- •
En las personas con diabetes más jóvenes (entre 40 y 64 años, aunque solo está autorizada en mayores de 50 años), y con peor control metabólico, debido a un posible mayor riesgo de reactivación del VVZ, se sugiere también la vacunación de acuerdo a lo establecido en ficha técnica (grado de recomendación: D).
- •
El impacto clínico y el consumo de recursos del HZ y la NPH en las personas con DM sugieren un posible beneficio de la vacunación frente al HZ/NPH en esta población (grado de recomendación: D).
- •
Dado el mayor riesgo de HZ y de NPH en personas con DM se sugiere desarrollar en nuestro país una estrategia específica de vacunación, impulsada centralmente desde el SNS, para esta población de pacientes (grado de recomendación: D).
El HZ y su principal complicación, la NPH, representan un importante problema de salud. En los pacientes de edad avanzada y en aquellos con enfermedades crónicas pueden tener graves consecuencias para la salud de los pacientes. En consecuencia, la prevención del HZ y de la NPH constituye una prioridad, especialmente en las poblaciones más vulnerables. Desde 2006 existe una vacuna de virus vivos atenuados frente al HZ/NPH, que está aprobada por la EMA para adultos mayores de 60 años, y desde 2011 ampliada para su utilización en adultos de más de 50 años. Esta vacuna está disponible en España desde 2014.
La vacuna frente al HZ/NPH refuerza la inmunidad celular específica frente al VVZ, latente en el organismo, evitando su reactivación y, por tanto, el desarrollo de las complicaciones asociadas. La vacuna frente al HZ/NPH es eficaz en la prevención del HZ y de la NPH, así como en la reducción de la carga de enfermedad asociada al HZ. Se ha demostrado que la vacuna frente al HZ/NPH es más eficaz en personas de entre 50 y 59 años y que su efectividad disminuye con el aumento de la edad. La eficacia de la vacuna se extiende durante 8 años, aunque no se ha establecido por el momento la necesidad de una dosis de recuerdo más allá de ese momento. La vacuna frente al HZ/NPH es segura, siendo los efectos adversos comunicados poco frecuentes y leves, como reacciones locales o cefaleas. Debe administrarse por vía s.c. o i.m. Además puede administrarse de forma concomitante con la vacuna antigripal.
Las personas con diabetes constituyen un grupo especialmente vulnerable frente al VVZ. No es infrecuente que las personas con diabetes tengan una afectación de la inmunidad celular, lo cual podría facilitar la reactivación del VVZ. Además de los sujetos de más edad, las personas más jóvenes (entre 40 y 64 años) con diabetes y con peor control metabólico podrían tener también un mayor riesgo de reactivación del VVZ. Asimismo, la presencia de determinadas complicaciones crónicas, como la enfermedad coronaria o complicaciones microvasculares, y otras comorbilidades como la EPOC o la insuficiencia cardíaca, podrían aumentar este riesgo. Finalmente, la aparición de HZ/NPH en una persona con diabetes puede asociarse con un peor control metabólico y otras complicaciones clínicas desfavorables.
Aunque en la actualidad no se dispone de estudios específicos sobre la efectividad de la vacuna frente al HZ/NPH en personas con diabetes, la inclusión de este tipo de pacientes en los estudios de intervención, y la no comunicación de problemas de la vacuna en este colectivo, nos hace pensar que esta vacuna tiene una eficacia comparable tanto en las personas con diabetes como en la población general. Tampoco existen datos farmacoeconómicos específicos en población con diabetes con respecto al impacto de la vacuna, aunque de igual forma consideramos que esta vacuna es tan coste- eficaz en personas con diabetes como en la población general.
En las personas con diabetes de más de 65 años, el riesgo de sufrir HZ/NPH es 3 veces superior al de la población general. La presencia de otras patologías concomitantes como la insuficiencia cardíaca o la EPOC aumenta este riesgo de forma adicional más de 4 veces. Muchos países desarrollados han evaluado la introducción de esta vacuna en sus respectivos programas de vacunación, teniendo en cuenta esas consideraciones previas, con el objeto de reducir los costes asociados a HZ/NPH. Así, en Estados Unidos y Canadá se ha incluido la vacunación frente al HZ en ≥ 60 años desde los años 2006 y 2010, respectivamente. En Europa, la vacunación se recomienda en determinados países, también en función de la edad de los pacientes (Alemania, Reino Unido, Suecia, Francia, etc.). Más específicamente, en España un estudio de coste-efectividad demostró que un programa de vacunación en adultos de más de 50 años, con una cobertura de al menos un 30%, podría ser coste-efectivo, aumentando el beneficio del programa en adultos de más de 65 años2. En España, la Comunidad de Castilla y León, en marzo de 2015, fue pionera en la introducción de una estrategia de vacunación frente al HZ en un subgrupo de pacientes con EPOC de entre 60 y 64 años, y en tratamiento con corticoides inhalados. Posteriormente, 9 meses más tarde, en enero de 2016, se ha incluido como novedad la cobertura a personas con diabetes de entre 60 y 69 años, y se ha ampliado a EPOC en sujetos de entre 60 y 69 años. Sin embargo, la actual dispersión y la poca homogeneidad de nuestro sistema sanitario han hecho que esta iniciativa no se haya trasladado al resto de comunidades autónomas de nuestro país.
En este documento, elaborado por un grupo multidisciplinar de expertos de Atención Primaria y Endocrinología y Nutrición, se ha pretendido elaborar de forma resumida y comprensible unas recomendaciones para el uso de la vacuna frente al HZ/NPH en personas con diabetes. Consideramos que las personas con diabetes constituyen un grupo prioritario para la vacunación frente al HZ/NPH. En particular, este comité de expertos recomienda la vacunación en personas con diabetes de entre 60 y 69 años, con el mismo grado de recomendación y evidencia respecto a su eficacia, efectividad y seguridad que para la población general. La presencia de insuficiencia renal avanzada o necesidad de diálisis no contraindica la administración de la vacuna frente al HZ/ NPH. También, en estos pacientes aconsejamos su administración conjunta con la vacuna de la gripe. Futuros estudios determinarán si esta vacuna debe recomendarse también en personas más jóvenes con diabetes, de entre 40 y 64 años, con diabetes tipo 1 o diabetes tipo 2.
Resumen de la evidencia y recomendacionesHerpes zóster: epidemiología, clínica, diagnóstico y tratamiento
| Resumen de la evidencia | Recomendaciones |
|---|---|
| Aproximadamente 1 de cada 4 personas desarrollará un HZ a lo largo de su vida, aunque en personas mayores de 85 años este riesgo aumenta a 1 de cada 25–10(nivel de evidencia: 4) | Dados los datos epidemiológicos, la población con DM debe ser objeto de una especial atención en relación con la infección por VVZ y sus complicaciones (grado de recomendación: B) |
| Las personas con diabetes tipo 2 mayores de 65 años presentan un riesgo 3 veces mayor de desarrollar un HZ que las personas sin diabetes19(nivel de evidencia: 2b) | |
| La incidencia cruda de NPH es de un 50% o más alta en personas con diabetes que en las personas sin diabetes (5,97 frente a 3,93 casos/1.000; p < 0,01)21(nivel de evidencia: 2b) | |
| La vacunación frente al HZ/NPH se ha asociado con una disminución en la incidencia de la enfermedad y una reducción en la aparición de la NPH27,28(nivel de evidencia:1b) |
La vacuna frente al herpes zóster y la neuralgia postherpética
| Resumen de la evidencia | Recomendaciones |
|---|---|
| La vacuna frente al HZ y la NPH es una vacuna de virus vivos atenuados. En España está comercializada para mayores de 50 años. La pauta de vacunación es una única dosis vía s.c. o i.m.29(nivel de evidencia: 1b). La vacuna refuerza la inmunidad celular específica frente al VVZ latente en el organismo, y persigue evitar la reactivación y sus complicaciones29(nivel de evidencia: 1b) | Se recomienda la vacunación frente al HZ/NPH en personas con DM mayores de 50 años, de forma similar al resto de la población general (grado de recomendación: A) |
| La vacuna frente al HZ es eficaz en la prevención del HZ y de la NPH, así como en la reducción de la carga de enfermedad asociada al HZ30,31(nivel de evidencia: 1b) | |
| La eficacia de la vacuna frente al HZ es más alta entre las personas de 50-59 años y se reduce según aumenta la edad30,31(nivel de evidencia: 1b). Sin embargo, la eficacia permanece elevada en el grupo de mayor edad para prevenir la NPH y reducir la carga de enfermedad33(nivel de evidencia: 1b) | |
| Existen datos de un descenso de la eficacia vacunal para prevenir HZ y NPH más allá del octavo año posvacunal34,35(nivel de evidencia: 1b). La ficha técnica de la vacuna no establece, por el momento, la necesidad de dosis de recuerdo29 | |
| La seguridad vacunal está firmemente establecida basándose en estudios pre y poscomercialización30–32(nivel de evidencia: 1b), sin efectos adversos graves notificados | |
| Los acontecimientos adversos más comunes informados son reacciones locales y dolor de cabeza29(nivel de evidencia: 1b) | |
| Se ha demostrado la seguridad e inmunogenicidad de la vacuna del HZ/NPH en sujetos de diferentes edades37(nivel de evidencia: 1b) y con diferentes condiciones médicas subyacentes crónicas como DM o EPOC38(nivel de evidencia: 1b) | |
| Un programa de vacunación frente al HZ con una cobertura de un 30% de los sujetos por encima de 50 años en España podría considerarse coste-efectivo, con el mayor beneficio en los sujetos de 65 a 74 años50(nivel de evidencia: 1b) | Se recomienda la vacunación frente a HZ/NPH en personas con DM entre 65 y 75 años basándose en su coste-beneficio, de forma similar al resto de la población general (grado de recomendación: A) |
| Al ser una vacuna de virus vivos atenuados debe seguir las recomendaciones generales de utilización de este tipo de vacunas29(nivel de evidencia: 1b) | |
| Se puede administrar concomitantemente con la vacuna antigripal42(nivel de evidencia: 1b) |
Consecuencias del herpes zóster en personas con diabetes mellitus
| Resumen de la evidencia | Recomendaciones |
|---|---|
| La DM puede afectar a la inmunidad celular por diferentes mecanismos y puede facilitar la reactivación del VVZ con independencia de la edad y del sexo, potenciando el riesgo de HZ20,51–53(nivel de evidencia: 2b) | Por la disminución de la inmunidad celular y el mayor riesgo de infección por VVZ en las personas con DM, se aconseja la vacunación frente al HZ/NPH (grado de recomendación: B) |
| En estudios retrospectivos y de casos-controles, la magnitud del riesgo de HZ asociado a la DM2 está condicionada por la edad de los individuos y la presencia de comorbilidades19. Se ha detectado un mayor incremento de riesgo en los pacientes diabéticos más jóvenes, con una edad comprendida entre 40 y 64 años19(nivel de evidencia: 2b) | Debido al aumento del riesgo de infección por VVZ en presencia de comorbilidades (EPOC, insuficiencia cardíaca) en las personas con DM, se aconseja la vacunación frente al HZ/NPH en estas circunstancias (grado de recomendación: B) |
| En las personas con diabetes más jóvenes (entre 40 y 64 años) y con peor control metabólico, debido a un posible mayor riesgo de reactivación del VVZ, se sugiere también la vacunación (grado de recomendación: D) | |
| Las tasas de NPH en el paciente con DM oscilan entre el 3 y el 34%, siendo similares a las de la población general28,59(nivel de evidencia: 1b) | |
| El riesgo de HZ en la diabetes se incrementa significativamente en los pacientes con comorbilidades macrovasculares y microvasculares61(nivel de evidencia: 3b) | |
| Las personas con DM tratadas en monoterapia con metformina o sulfonilureas tienen menor riesgo de desarrollar HZ que las que reciben tiazolidinedionas, inhibidores de la alfaglucosidasa o insulina61(nivel de evidencia: 3b) |
Eficacia, efectividad y seguridad de la vacuna frente al herpes zóster en personas con diabetes mellitus
| Resumen de la evidencia | Recomendaciones |
|---|---|
| En la actualidad no se dispone de datos específicos procedentes de ensayos clínicos amplios sobre la eficacia de la vacuna en personas con diabetes30,31(nivel de evidencia: 1b) | |
| La inclusión de las personas con DM en estudios disponibles avala la eficacia y seguridad de la vacuna de HZ en esta población27,28(nivel de evidencia: 1b) |
Datos farmacoeconómicos aplicables a España de la vacunación de herpes zóster en personas con diabetes mellitus
| Resumen de la evidencia | Recomendaciones |
|---|---|
| La vacunación frente al HZ/NPH en la población española mayor de 50 años podría ser una medida coste-efectiva64(nivel de evidencia: 1b) | El impacto clínico y el consumo de recursos del HZ y de la NPH en las personas con diabetes sugieren un posible beneficio de la vacunación frente al HZ/NPH en esta población (grado de recomendación: D) |
| En relación con los aspectos farmacoeconómicos, no se han encontrado datos específicos para población con DM. Sin embargo, se estima que en las personas con diabetes el coste- efectividad de la vacunación es tan favorable como en las personas sin esta condición63–66(nivel de evidencia: 5) |
Programas de vacunación internacionales y autonómicos
| Resumen de la evidencia | Recomendaciones |
|---|---|
| La vacuna frente al HZ/NPH está incluida en el calendario vacunal de numerosos países de nuestro entorno. Se recomienda en mayores de 50 años, con diferentes rangos de edad dependiendo de los países67–69(nivel de evidencia: 5) | Dado el mayor riesgo de HZ y NPH en personas con DM se sugiere desarrollar en nuestro país una estrategia específica de vacunación, impulsada centralmente desde el Sistema Nacional de Salud, para esta población de pacientes (grado de recomendación: D) |
ERM ha recibido becas de investigación y honorarios como consultora/asesora y/o ponente, así como ayudas para asistir a conferencias o cursos de las siguientes empresas: GlaxoSmithKline, Sanofi Pasteur MSD, Merck, Sanofi Pasteur, Pfizer y Novartis.
DM ha recibido honorarios por ponencias o consultoría de las siguientes empresas: AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Eli Lilly, Ferrer, Janssen, MSD, Novartis, Novonordisk, Praxi Pharmaceutical y Sanofi.
JJMB ha participado en conferencias de difusión de contenido científico en relación con la vacuna del herpes zóster.
ASG declara no tener ningún conflicto de intereses.
EDA ha recibido honorarios por ponencias o consultoría de las siguientes empresas: Abbott, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Ferrer, Janssen, MSD, Novartis, Novonordisk, Sanofi y Sanofi Pasteur MSD.
FJAB y EJG han realizado tareas de asesoramiento y han contribuido al desarrollo y difusión del contenido científico en relación con la vacuna del VVZ/NPH.