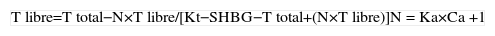Uno de los aspectos más importantes de la vida del varón es su capacidad para desarrollar una actividad sexual normal; su pérdida siempre ha sido considerada como un acontecimiento de especial trascendencia. La relación entre la actividad sexual y otras características masculinas con los testículos es un hecho conocido desde los más remotos tiempos y se ha relacionado con el descenso lento de la secreción de testosterona que se produce con la edad avanzada. Este hipogonadismo del varón es una de las más frecuentes e infradiagnosticadas endocrinopatías. Para denominar las situaciones clínicas motivadas por el declinar de la función gonadal en el varón en relación con la edad, se han propuesto diversos términos, y el que parece más universalmente aceptado hoy en día es hipogonadismo de inicio tardío (HIT). Se trata de un síndrome clínico y bioquímico asociado a la edad avanzada (del varón), caracterizado por síntomas típicos y disminución de las concentraciones de testosterona sérica, que puede afectar a múltiples órganos y sistemas y puede deteriorar la calidad de vida. Este síndrome puede ser tratado y se pueden recuperar las alteraciones producidas por él. Para ello es necesario un protocolo diagnóstico que aborde multitud de aspectos relacionados con los riesgos y beneficios del tratamiento.
One of the most important elements in men’s live is the ability to engage in normal sexual activity; loss of this activity has always been considered especially important. The relationship between sexual activity, as well as other masculine characteristics, and the testicles has been well known since ancient times and has been related to the slow decrease in testosterone secretion with advanced age. Male hypogonadism is one of the most frequent and under-diagnosed endocrine diseases. Several terms have been proposed to refer to clinical situations caused by the age-related decline in male gonadal function; currently, the most widely accepted term is late-onset hypogonadism (LOH). LOH consists of a clinical and biochemical syndrome associated with advanced age (in men), characterized by typical symptoms and reduced serum testosterone concentrations, which can affect multiple organs and systems and reduce quality of life. This syndrome can be treated and the alterations produced can be reversed. To achieve this, a diagnostic protocol that approaches the multiple factors related to the risks and benefits of treatment is required.
Uno de los aspectos más importantes de la vida del varón es su capacidad para desarrollar una actividad sexual normal; su pérdida siempre ha sido considerada como un acontecimiento de especial trascendencia. La relación entre la actividad sexual y otras características masculinas con los testículos es un hecho conocido desde los más remotos tiempos; los pueblos primitivos practicaban la castración en animales domésticos para hacerlos más dóciles (caballo, toro, etc.) o facilitar su cebamiento (cerdo), y en el hombre se practicaba a sacerdotes de ciertas religiones, los guardianes del harén y, hasta los siglos xvii y xviii, los niños del coro, para preservarlos del cambio de la voz. También se sabe desde la Antigüedad que la capacidad para la actividad sexual del varón declina a medida que avanza su edad; las primeras referencias médicas al respecto proceden de médicos árabes de los siglos IX y X, que señalaban la edad de comienzo de estas manifestaciones hacia los 63 años.
La andrología científica surgió a mediados del siglo XIX con los descubrimientos de las células intersticiales, por Franz Leydig, y de su actividad secretora, por el fisiólogo francés Arnold Adolph Berthold. En 1889, Brown-Séquard, a sus 72 años, comunicó a la Sociedad de Biología de París el ensayo realizado sobre sí mismo con la inyección subcutánea de extractos de testículo de cobaya, dando a conocer la recuperación de su fuerza física e incremento de su capacidad intelectual y creando el precedente de la terapia hormonal sustitutiva. En las primeras décadas del siglo xx, diversos clínicos e investigadores (Mendel, Vaerting, Marañón, Séller y Myers, Werner, etc.)1 estudiaron las manifestaciones de la disminución funcional de las gónadas debida a la edad. Podemos conocer las ideas dominantes a mediados del siglo xx a través de algunas afirmaciones emitidas por Marañón2,3: "el climaterio masculino es mucho menos importante que el femenino"; "la inmensa mayoría de los hombres no lo manifiestan"; "la aparición es más tardía que en la mujer, a partir de los 60 años". En 1957, el prestigioso clínico suizo Alexis Labhart4 exponía que "el diagnóstico del climaterio en el hombre solamente está justificado en casos raros".
En la actualidad, los estudios epidemiológicos realizados en las últimas décadas han cambiado la consideración y actitud clínico-terapéutica de la medicina ante este problema, aunque todavía, como afirma Nieschlag5, el hipogonadismo en el varón es una de las más frecuentes e infradiagnosticadas endocrinopatías. Para denominar las situaciones clínicas motivadas por el declinar de la función gonadal en el varón en relación con el aumento de la edad, se han propuesto diversos términos con distintos fundamentos y en general con una precisión parcial: climaterio masculino, andropausia, andropenia, síndrome de ADAM, síndrome de PADAM, síndrome de LOH o síndrome de SLOH. Climaterio es un término procedente del griego klimater, que significa escalón o descenso y hace alusión al declive de la capacidad para la actividad sexual. La denominación de climaterio masculino se utilizó en las primeras décadas del siglo xx y sigue utilizándose en la actualidad aunque, como en el caso del climaterio femenino, con un sentido amplio, que incluye no sólo la actividad sexual o las alteraciones hormonales, sino también las posibles repercusiones generales del organismo, tanto físicas como psíquicas. El término andropausia, etimológicamente "cese de la actividad androgénica", surgió por similitud con el de menopausia en la mujer; en el caso del varón, este término resulta poco acertado, ya que en general (salvo caso excepcional de orquiectomía bilateral), no hay una supresión de la secreción de testosterona, como ocurre en la mujer menopáusica con la secreción de estradiol, sino que se trata de una lenta disminución de la secreción de testosterona. No obstante este término también está admitido en los textos médicos, tanto latinos como anglosajones (andropause). Más preciso sería el término andropenia, utilizado en ocasiones para designar la disminución de secreción de testosterona, pero no es un término muy generalizado. En 1999, Morley et al6 propusieron la denominación de "síndrome de ADAM" para referirse a esta situación clínica, por corresponder las letras de ADAM a las iniciales de Androgen Deficiency Aging Male; también se ha empleado la denominación "síndrome de PADAM" haciendo referencia a la Partial Androgen Deficiency Aging Male, que estaría más ajustada a la realidad. En los últimos años, se viene utilizando las denominaciones "síndrome de LOH" (late-onset hypogonadism in male) y SLOH (symptomatic late-onset hypogonadism), convertido al castellano en síndrome de HIT (hipogonadismo de inicio tardío). Estos términos son los consensuados en el año 2004 en el IV Congreso celebrado en Praga y publicados7 en 2005 por la ISA (International Society of Andrology), la ISSAM (International Society for the Study of the Aging Male) y la EAU (European Association of Urology), por lo que son los términos utilizados en lo sucesivo. Las sociedades mencionadas consensuaron en 2004 la definición del HIT7 como "un síndrome clínico y bioquímico asociado a la edad avanzada (del hombre), caracterizado por síntomas típicos y disminución de las concentraciones de testosterona sérica, que puede afectar a múltiples órganos y sistemas y deteriorar la calidad de vida".
Antes de abordar con profundidad el protocolo de estudio y tratamiento del síndrome de HIT, creemos conveniente hacer algunas consideraciones básicas en relación con determinados aspectos que lo caracterizan:
En el aspecto fisiopatológico cabe resaltar que se trata de un síndrome plurihormonal, en el que se ven afectadas diversas hormonas en relación con la edad (deshidroepiandrosterona, somatotropina, tiroxina, melatonina, etc.) o de forma secundaria a la hipofunción testicular (lutropina, folitropina, etc.), aunque la importancia terapéutica fundamental resida en el déficit de testosterona.
– En el aspecto clínico hay que destacar que tienen tanta importancia, o aún más, la afección metabólica (ósea, muscular, del tejido adiposo, resistencia a la insulina, etc.) o neuropsíquica (déficit mental) que la puramente genitosexual, por más que ésta sea la más llamativa para el paciente y a veces para el médico. Por otro lado, es un hecho comprobado que puede mantenerse una actividad sexual normal con distintas concentraciones de testosterona séricas8, incluso infranormales, o que puede estar muy deteriorada aun con concentraciones normales. De igual forma, la actividad sexual del varón puede mantenerse en algunos hasta edades muy avanzadas, mientras que en otros puede verse afectada a edades tempranas, aunque en general es máxima alrededor de los 17 años y va disminuyendo paulatinamente con la edad9. Todas estas aparentes incongruencias se explican por el hecho de que en la sexualidad del varón, además de las hormonas y la edad, intervienen otros muchos factores (estado de salud física y psíquica, medicaciones, estilo de vida, nutrición, educación y cultura, circunstancias personales y familiares, socioeconómicas y laborales, etc.) que habrá que tener en cuenta al valorar la capacidad de la actividad sexual del varón.
En el aspecto terapéutico, la terapia de restitución con testosterona (TRT) es la medida fundamental, aunque no la única, y debe atenerse estrictamente a sus indicaciones, contraindicaciones y medidas de monitorización para evitar efectos adversos, valorando en cada paciente la razón beneficios/riesgos. Todavía se mantienen reservas en cuanto al beneficio terapéutico a largo plazo, ya que se requiere de más estudios para dilucidar esta cuestión10.
La importancia sociosanitaria de esta entidad clínica radica en la extensa población que puede verse afectada, dada la supervivencia del varón occidental, el mantenimiento de un buen estado general hasta edades avanzadas y la demanda de una mayor calidad de vida que incluya la posibilidad de prolongar la actividad sexual durante más años. Otro factor a tener en cuenta es que la aparición de nuevas formas de administración de andrógenos ha facilitado el tratamiento de restitución; de hecho, el consumo de preparados de testosterona ha aumentado sustancialmente en estos últimos años7. Si el siglo XX fue el siglo de la menopausia, el siglo XXI puede ser el del síndrome de HIT.
DATOS EPIDEMIOLÓGICOSEn el tema que nos ocupa, hay que distinguir entre los datos epidemiológicos referidos a las bajas concentraciones de testosterona, ya sea total, libre o biodisponible, y los relacionados con la prevalencia del síndrome clínico de HIT que incluye, además de las bajas concentraciones de testosterona, los síntomas típicos del HIT. Por otra parte, muchos de los estudios están referidos a la población general, pero otros se han llevado a cabo en grupos más reducidos que por sus características pueden ser considerados como en riesgo de síndrome de HIT.
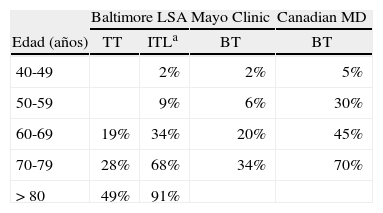
Datos epidemiológicos referidos a las concentraciones séricas de testosteronaLas cifras de prevalencia aportadas por los diversos estudios y autores a veces difieren de forma importante; esto se debe, entre otras razones, a que las técnicas empleadas y los criterios de normalidad aplicados en las concentraciones hormonales no son coincidentes en todos los estudios realizados. En el Baltimore Longitudinal Study of Aging, realizado sobre 890 varones, las concentraciones séricas de testosterona total (TT), con independencia de otros factores, se encontraban disminuidas hasta cifras de hipogonadismo (< 325ng/dl [11,3nmol/l]) en proporciones del 20, el 30 y el 50% a las edades de 60, 70 y 80 años respectivamente, con una tasa de descenso anual de la testosterona total de 3,2ng/dl11. Sin embargo, Vermeulen12, considerando concentraciones bajas de testosterona total las inferiores al límite menor de la normalidad en adultos jóvenes (< 350ng/dl), sólo observó cifras bajas en el 25% de los varones mayores de 75 años. La prevalencia subía al 30% si aplicaba como criterio de testosterona total baja las concentraciones<2–2,5 desviaciones estándar de los concentraciones medias de adultos jóvenes; la proporción era similar al considerar la testosterona libre (FT) con cifras por debajo del percentil 1 de los valores correspondientes a adultos jóvenes13. Por otra parte, Ternover14, utilizando como criterio las concentraciones séricas subnormales de testosterona biodisponible (BT), señala una prevalencia del 50% de los varones de edad>55 años. En relación con los parámetros utilizados para determinar las concentraciones hipogonadales de testosterona, como se puede observar en la tabla 1, la prevalencia suele ser más baja si se emplea la TT y más alta si la medición es de la FT o de la BT15.
Prevalencia de concentraciones hipogonadales de testosterona según el parámetro bioquímico estudiado
| Edad (años) | Baltimore LSA | Mayo Clinic | Canadian MD | |
| TT | ITLa | BT | BT | |
| 40-49 | 2% | 2% | 5% | |
| 50-59 | 9% | 6% | 30% | |
| 60-69 | 19% | 34% | 20% | 45% |
| 70-79 | 28% | 68% | 34% | 70% |
| > 80 | 49% | 91% | ||
BT: testosterona biodisponible; ITL: índice de testosterona libre; SHBG: globulina transportadora de hormonas sexuales; TT: testosterona total.
Adaptado de Morley JE et al15.
ITL=TT/SHBG.
Los datos obtenidos por el estudio de las concentraciones séricas de testosterona no se corresponden exactamente con la prevalencia del síndrome de HIT; en muchos casos, los síntomas y signos hipogonadales asociados a las concentraciones bajas de testosterona podrían estar ausentes, y por tanto son un verdadero síndrome de HIT. Las concentraciones bajas de testosterona son el factor básico para el síndrome de HIT. En el Massachusetts Male Aging Study, realizado con 1.709 varones de edades comprendidas entre los 39 y los 70 años, y seguidos durante 8,8 (intervalo, 7–10,4) años, se comprobó una prevalencia del síndrome de HIT del 6% al inicio del estudio y del 12,3% al final16. Sobre la base de los resultados de ese estudio, se ha calculado que en Estados Unidos el síndrome de HIT afectaría a 2,4 millones de varones entre 40 y 69 años, con una incidencia de 481.000 nuevos casos por año17. De los estudios de Vermeulen12,13,18 se puede concluir que, en Estados Unidos, 1/10 varones mayores de 50 años y 1/5 varones mayores de 60 años tendrían concentraciones de testosterona en el límite de hipogonadismo y podrían padecer el síndrome de HIT; en Europa, un 25-30% de los varones de más de 70 años se encontraría en las mismas circunstancias. En España no disponemos de estudios sobre prevalencia de síndrome de HIT, pero extrapolando las tasas europeas o americanas a nuestra población de varones mayores de 65 años (2.723.000 en el censo de 1999, INE), se podría admitir que de medio millón a un millón de individuos puedan estar afectados. En el estudio multicéntrico europeo EMAS19, realizado con 800 varones de 8 países (100 de ellos de España), con media de edad de 60 años, se encontró que un 11,5% de éstos daban concentraciones hipogonadales de testosterona, aplicando criterios hormonales de TT<8nmol/l o de FT<0,2nmol/l si la TT estaba entre 8 y 12nmol/l; en esta población, la prevalencia del síndrome de HIT variaba del 1 al 7,8% según el criterio clínico empleado (número y tipo de síntomas hipogonadales, al menos 3 de los 12 estudiados y relacionados con al menos 3 áreas clínicas de las 6 consideradas). Con estos criterios restrictivos, el número de posibles afectados en nuestro país sería inferior al anteriormente citado (alrededor de 300.000), pero aun así sería considerable (tabla 1).
Prevalencia en grupos de mayor riesgoLa prevalencia del síndrome de HIT es más elevada en determinados grupos de pacientes; además de los pacientes ambulatorios en general, los obesos, diabéticos y afectados de disfunción eréctil manifiestan el HIT en mayor proporción que la población general. En pacientes ambulatorios, según el Hypogonadism in Male Study, realizado en 2.162 varones de edad≥45 años que acudieron a centros de atención sanitaria primaria, el 38% presenta concentraciones bajas de TT (< 300ng/dl) y síntomas hipogonadales; entre los más jóvenes (entre 45 y 64 años), la proporción era menor que en edades superiores (el 37 frente al 42%), pero los síntomas hipogonadales eran más acusados20. En obesos21,22, también es más frecuente el síndrome de HIT y en mayor proporción cuanto mayor es el índice de masa corporal (IMC), pero puede remitir con la pérdida de peso. En los diabéticos tipo 2, se han dado tasas de prevalencia del 3323, el 5024 y hasta el 70%25, dependiendo de la edad, el grado de obesidad, el tiempo de evolución y el grado de control de la diabetes mellitus. Para la disfunción eréctil se han publicado cifras muy variables en relación con la prevalencia del síndrome de HIT, desde el 18,726, el 22,3 o el 34%; si además eran diabéticos27, hasta el 37%28; incluso se admite que en los resistentes al tratamiento con inhibidores de la 5-difosfoesterasa (5-DPE) hasta el 50% padecerían el síndrome de HIT y podrían responder al tratamiento con la TRT.
PARÁMETROS SÉRICOS DE LA ACTIVIDAD FUNCIONAL DEL TESTÍCULOLas dos funciones fundamentales del testículo son la función productora de espermatozoides y la secretora de testosterona; ambas funciones están interrelacionadas; el déficit de espermatogénesis planteará problemas de infertilidad y el déficit de secreción de testosterona será el determinante de hipogonadismo. Para el estudio del síndrome de HIT es preciso determinar las concentraciones de testosterona, valorándolas respecto a límites de normalidad y teniendo en cuenta sus variaciones por la edad u otros factores.
Parámetros séricos de normalidad de testosteronaEn el varón adulto sano, el 90% de la testosterona circulante es segregada por las células de Leydig del testículo y el 5-10% restante, por las glándulas suprarrenales29. Una proporción importante, del 44 al 60%, va ligada firmemente a la globulina transportadora de hormonas sexuales (SHBG), mientras que otra, estimada en un 38-54%, lo hace unida laxamente a la albúmina, y sólo el 1-2% circula como FT29,30. Se considera BT la suma de la FT más la unida a la albúmina31 y sería la fracción que origina la mayor acción hormonal. Los concentraciones de normalidad están referidas a las encontradas en varones sanos, de edades comprendidas entre los 20 y los 40 años31, y en muestras de sangre extraídas entre las 7.00 y las 11.00 de la mañana. La secreción de testosterona se ajusta a un ciclo circadiano, con mínimos a últimas horas de la tarde y máximos al final de la madrugada y primeras horas de la mañana32; las variaciones pueden llegar a tener una amplitud del 36%33. Se ha propuesto34 como concentraciones normales de TT las de 12–30nmol/l (350–850ng/dl) y para la FT, 174–900 pmol/l (60–312pg/ml). No obstante hay que tener en cuenta las concentraciones de referencia de cada laboratorio en función de la técnica empleada. Basándose en datos de grandes grupos de varones sanos, no obesos, el límite más bajo del rango normal se estableció alrededor de los 315ng/dl (11nmol/l) para la TT y alrededor de 6,5ng/dl (0,225nmol/l) para la FT, correspondiendo a una BT de 140ng/dl (5nmol/l). La mayoría de los autores utilizan estos valores o similares. Menos del 1% de los varones sanos, entre 20 y 40 años, presentan concentraciones de TT<3,2ng/ml, pero aparecen en más del 20% de los mayores de 60 años, y la proporción es aún mayor si se considera la FT30.
Variaciones con la edadLas concentraciones séricas de testosterona disminuyen gradual y progresivamente con la edad. Hartman et al11, en una muestra de 890 varones, comprobaron un descenso longitudinal de los concentraciones de TT, con una tasa de 0,035ng/ml/año. También en el Massachusetts Male Aging Study16 se observó una continua disminución de la testosterona con la edad, tanto en la FT (1,2%/año) como en la testosterona unida a la albúmina (1%/año); no obstante, la mayoría de los varones de edad avanzada continúan teniendo una testosterona sérica similar a la de los jóvenes8. En varones mayores de 75 años, Vermeulen12 observó que el 20% tenía concentraciones del cuartil superior obtenido en los jóvenes.
Consideraciones sobre el valor de los parámetrosPara valorar correctamente las concentraciones de testosterona en varones adultos de edad avanzada, deberíamos aclarar algunos interrogantes. Por una parte, no conocemos si las necesidades de andrógenos a esas edades son las mismas que en los varones jóvenes; hay indicios de que en la edad avanzada se produce mayor sensibilidad de algunos tejidos a los andrógenos y mayor respuesta a la supresión de la secreción de lutropina por los andrógenos (feedback negativo)34-36. Hallazgos en roedores y humanos indican que la diferente sensibilidad a los andrógenos de algunos tejidos está relacionada con las concentraciones de los receptores androgénicos37-39 y que cada tejido tiene unas necesidades diferentes de testosterona. Por otro lado, la testosterona es el andrógeno circulante más importante, pero en los tejidos su forma activa es la dihidrotestosterona (DHT) que se produce por la acción de la enzima 5α-reductasa; desconocemos cómo evolucionan con la edad los contenidos enzimáticos de los órganos diana y los mecanismos intracelulares. Algunos autores40-42 proponen establecer unos intervalos de normalidad específicos para cada edad. Por último, quedan por explicar las grandes variaciones interindividuales de las concentraciones séricas de testosterona, incluso dentro de un mismo individuo; con la edad, la testosterona podría reducirse de forma importante, aunque manteniéndose en límites normales, lo que podría plantear si ese descenso debería considerarse una deficiencia androgénica.
Otros factores modificadores de las concentraciones séricas de testosteronaCon independencia de la edad, las concentraciones séricas de testosterona también se pueden modificar por otros factores, como los factores de riesgo cardiovascular y dietas pobres en grasas42, consumo de tabaco (fumar más de 10 cigarrillos al día)43, consumo de alcohol44, obesidad16,21,22, enfermedades crónicas (aterosclerosis, insuficiencia cardíaca, infarto de miocardio, hipertensión arterial, diabetes mellitus, insuficiencia renal crónica, cirrosis hepática y hepatopatías crónicas, úlcera gástrica, agudizaciones de la artritis reumatoide, cáncer)16,30 o diferentes fármacos (glucocorticoides, neurolépticos)29,44. En general, cualquier situación que afecte a la salud del individuo puede favorecer una disminución más precoz e intensa de la secreción de testosterona, lo que confirma la tradición de considerar la función sexual como "de lujo". Especial interés tienen el sobrepeso y la obesidad por su prevalencia actual y su frecuente asociación con una situación de hipogonadismo hipogonadotrópico que, como se comprueba clínicamente, se supera generalmente con la pérdida de peso. En estos hipogonadismos asociados a otras enfermedades, se podría plantear la duda diagnóstica de si nos encontramos ante un hipogonadismo secundario o un síndrome de HIT favorecido o agravado por la enfermedad concomitante. Cuando son secundarios, las concentraciones séricas de testosterona pueden retornar a la normalidad una vez superado el proceso agudo30.
ALTERACIONES HORMONALES EN EL SÍNDROME DE HIPOGONADISMO DE INICIO TARDÍOEn el síndrome de HIT hay otras alteraciones hormonales asociadas al descenso de testosterona; el síndrome de HIT es un síndrome plurihormonal. De las hormonas afectadas, algunas corresponden al eje hipotalamohipofisogonadal (gonadoliberina [Gn-RH], folitropina [FSH], lutropina [LH], prolactina) y otras están en relación con la edad o el proceso de envejecimiento (somatotropina [GH], melatonina, hormonas tiroideas, deshidroepiandrosterona). Estas últimas pueden participar en los síntomas relacionados con el síndrome de HIT en los individuos de más edad45. Las concentraciones séricas de lutropina y folitropina se encuentran elevadas; en el Massachusetts Male Aging Study16 se hallaron incrementos de las concentraciones de FSH y de LH en una proporción del 1,9 y el 1,3% por año, junto a un descenso de la prolactina del 0,4% anual. Los incrementos de FSH y LH serían escasos en relación con los descensos de testosterona. Para Vaninnetti et al46, la LH y la FSH se incrementarían en los varones desde los 75 a los 85 años, para descender después gradualmente; las concentraciones hipogonadales de testosterona podrían acompañarse de concentraciones relativamente elevadas de LH y FSH, lo que indicaría un hipogonadismo primario, o concentraciones bajas de LH y FSH, como en los hipogonadismos centrales o secundarios. También se ha comprobado una menor frecuencia de los pulsos de secreción de Gn-RH y menor sensibilidad de las células gonadotropas hipotalamohipofisarias ante la disminución de testosterona47. Los descensos motivados por la edad, tanto en las concentraciones de GH e IGFI48 como las de deshidroepiandrosterona49 y tiroxina50, pueden potenciar las alteraciones de composición corporal atribuidas al síndrome de HIT (disminución de masa magra y aumento de masa grasa). Por otro lado, se ha descrito51 en hipotiroidismos, incluso subclínicos, concentraciones bajas de testosterona que se revierten con la administración de tiroxina. La disminución de la secreción nocturna de melatonina52 puede determinar o contribuir a la alteración del sueño y el descanso nocturno, síntoma que también suele acompañar al síndrome de HIT. Pese a todo lo expuesto, y según las recomendaciones para el estudio, tratamiento y monitorización del síndrome de HIT consensuadas por la ISA, ISSAM y EAU7,53, las determinaciones de hormonas tiroideas, cortisol, DHEA y DHEA-S, melatonina, GH e IGF-I no están indicadas en la evaluación no complicada del síndrome de HIT, salvo si se sospecha de otras alteraciones endocrinas.
CLÍNICA DEL SÍNDROME DE HIPOGONADISMO DE INICIO TARDÍONo es fácil configurar el síndrome clínico de HIT debido a que los síntomas son inespecíficos, pueden ser muy variables de unos individuos a otros, no siempre guardan relación con las concentraciones séricas de testosterona y muchos de ellos pueden ser considerados síntomas de un cuadro general de envejecimiento o de otras enfermedades asociadas. No obstante, la similitud con el hipogonadismo en varones jóvenes, la correlación entre determinados síntomas con los valores séricos de testosterona y la evolución favorable con la TRT pueden ayudar a definir el cuadro clínico del síndrome de HIT. Entre los síntomas del síndrome de HIT, podemos distinguir un primer grupo referido al área genitosexual y un segundo grupo integrado por alteraciones metabólicas con repercusión en otras áreas del organismo (tejidos muscular y adiposo y composición corporal; tejido óseo; resistencia insulínica, metabolismo hidrocarbonado y lipídico; alteraciones hemáticas, en piel y faneras, en sistema nervioso y de comportamiento). Como ya se ha comentado anteriormente, aunque la testosterona se relaciona clásicamente con las funciones genitosexuales, las repercusiones metabólicas generales tienen tanta o más importancia para la salud y la calidad de vida del individuo que las estrictamente relacionadas con la sexualidad (tabla 2).
Síntomas que pueden manifestarse en el síndrome de hipogonadismo de inicio tardío
| Síntomas genitosexuales | Síntomas no genitosexuales |
| Disminución de la actividad sexual | Disminución de la masa y la fuerza muscular |
| Disminución de la libido | Aumento de la masa grasa (sobrepeso-obesidad) |
| Disfunción eréctil | Fatigabilidad y menos energía vital |
| Disminución del líquido Seminal | Osteopenia-osteoporosis (con/sin fracturas) |
| Disminución de la calidad Seminal | Síndrome metabólico |
| Reducción de la fertilidad | Disminución de memoria y capacidad cognitiva |
| Disminución del orgasmo | Disforia y posibles depresiones. Insomnio |
La afección genitosexual fue inicialmente la más llamativa y sigue siéndolo socialmente; de hecho, es la principal preocupación de los pacientes afectados por este síndrome y el principal motivo por el que consultan al médico. Según se ha señalado, las alteraciones que podrían estar en relación con bajas concentraciones de testosterona son: la disminución de la actividad sexual, la disminución de la libido, la disfunción eréctil, el menor volumen y la peor calidad del líquido seminal eyaculado y la disminución o desaparición del orgasmo o sensación placentera. La actividad sexual, valorada por la frecuencia de coitos, disminuye con la edad, desde unas 4 veces por semana a edades entre los 20 y los 25 años hasta 2 veces al mes entre los 70 y los 80 años54; solamente un 15% de los varones mayores de 60 años niegan cualquier actividad sexual55. Se ha postulado56 que para que se produzca una actividad sexual normal se requiere un nivel crítico de 300ng/dl de TT. La importancia de las concentraciones de testosterona para mantener una actividad sexual normal se manifiesta también por la disminución de las erecciones espontáneas nocturnas en ausencia de andrógenos56. En relación con la libido, las opiniones son contradictorias: mientras Vermeulen12 opina que no parece haber correlación entre libido y concentraciones de testosterona, otros autores admiten que sí la habría57,58 y algunos señalan la recuperación de la libido con TRT59,60. Un reciente metaanálisis de trabajos aleatorizados y controlados con placebo confirma una moderada mejoría de la libido en pacientes tratados con TRT61. En animales se ha demostrado una clara relación entre las concentraciones de testosterona y la función eréctil62 y los andrógenos parecen ser esenciales para el varón para una erección peneana normal, tanto por su acción central como por la periférica63,64. Sin embargo, en el Massachusetts Male Aging Study16,65, así como en otros estudios66,67, no se ha encontrado correlación entre disfunción eréctil y concentraciones séricas de testosterona. Incluso hay referencias sobre el mantenimiento de la función eréctil en varones con hipogonadismo grave68. Algunos estudios26,28 señalan que en una proporción variable de pacientes con disfunción eréctil, del 20 al 37%, hay concentraciones de testosterona indicio de hipogonadismo, pero otros autores69,70 consideran que la deficiencia de testosterona es infrecuente como principal causa de impotencia, admitiendo que pueda influir como factor secundario en un 6-45% de los casos69. Mikhail70, después de revisar la literatura más relevante desde 1939 a 2005, concluye que el hipogonadismo no es un hallazgo habitual en la disfunción eréctil, pues se encuentra tan sólo en alrededor del 5% de los casos. No obstante, en algunos trabajos sí se ha encontrado relación entre disfunción eréctil y las concentraciones séricas de BT71 y FT72. Además, también se ha observado efectos favorables de la TRT en pacientes con disfunción eréctil e hipogonadismo en los que la terapia con sildenafilo no lograba resultados positivos73-75. El volumen de líquido seminal eyaculado se reduce en los varones de edad avanzada y se acompaña de disminución del número y la motilidad de los espermatozoides y un aumento del porcentaje de formas anormales, aunque la mayoría de los varones a esas edades pueden mantener los parámetros de fertilidad similares a los de los jóvenes76. La disminución de la sensación del orgasmo en las relaciones sexuales se ha puesto en relación con las bajas concentraciones séricas de testosterona y se ha comprobado su mejoría, junto con la de la disfunción eréctil, con la TRT75.
Síntomas de áreas no genitosexualesSíntomas y alteraciones de la composición corporalEn varones sanos, la edad avanzada se acompaña de modificaciones de la composición corporal; la masa grasa aumenta desde el 22% de los jóvenes hasta el 30%, mientras que la masa libre de grasa disminuye un 30%77. Variaciones similares se han observado en varones con hipogonadismo comparándolos con grupos eugonadales de la misma edad y con el mismo IMC78, lo que indica que estos cambios puedan estar relacionados con las concentraciones de andrógenos78. Numerosos trabajos79-86 parecen probar una relación entre las bajas concentraciones de testosterona y la disminución de masa muscular (sarcopenia), la fuerza de contracción muscular, la resistencia y la capacidad física del individuo, así como el aumento de la masa grasa, especialmente de la grasa visceral o intraabdominal, con alteración, en definitiva, de la composición corporal; la acumulación de grasa favorecería el sobrepeso y la obesidad. Por el contrario, la TRT revierte estas alteraciones87-92 y consigue una reducción del 6% de la masa grasa y un incremento de un 3-4% de la masa magra y la densidad mineral ósea, según se deduce del metaanálisis de Isidori et al92.
Síntomas y alteraciones óseasLas bajas concentraciones de testosterona se asocian a disminución de la densidad mineral ósea, por mayor reabsorción ósea, y a mayor riesgo de caídas y fracturas86,93-96. La TRT mejora la densidad mineral ósea 89,92,97-105.
Síntomas y alteraciones metabólicasYa se ha mencionado la mayor frecuencia de hipogonadismo entre los pacientes diabéticos23-25. Las concentraciones bajas de testosterona y SHBG se encuentran no sólo en diabéticos tipo 2, sino también en prediabéticos, de forma que constituyen un factor predictor independiente para el síndrome metabólico y para la diabetes mellitus tipo 2 en varones de mediana edad106,107. Otros autores108-110 insisten en la relación de las bajas concentraciones de testosterona con el aumento de resistencia a la insulina y la alteración de tolerancia a la glucosa, motivados por la disminución de la masa muscular, el aumento de grasa en depósitos intraabdominales (obesidad superior) y aumento de la producción y el metabolismo de los glucocorticoides. En el mismo sentido, algunos trabajos controlados y aleatorizados han mostrado una mejoría en la sensibilidad a la insulina por acción de la TRT111,112, aunque esto no ha sucedido en todos los casos113. Las concentraciones séricas de testosterona se correlacionan negativamente con las de triglicéridos y con la dislipemia114,115, mientras que la TRT disminuye el colesterol de las lipoproteínas de baja densidad (cLDL) y aumenta el de las lipoproteínas de alta densidad (cHDL)116,117.
Síntomas y alteraciones de la hemoglobinaLa testosterona favorece la eritropoyesis y estimula directamente la producción de eritropoyetina en los riñones118. Por eso es frecuente una discreta anemia en los varones de edad avanzada con disminución de concentraciones séricas de testosterona y pueden beneficiarse de la TRT119. Por la misma razón, el exceso de testosterona puede conducir a eritrocitosis120, y por ello en las recomendaciones de ISA, ISSAM y EAU7,53 se establecen medidas de determinación de la hemoglobina, previa al tratamiento y durante la monitorización.
Síntomas y alteraciones de piel y fanerasEl síndrome de HIT se acompaña de alteraciones en piel y en vello corporal121,122. En un estudio llevado a cabo en varones mayores de 50 años y con bajas concentraciones séricas de testosterona, se encontró una disminución del vello púbico en el 70% y del vello axilar en el 55%123. El vello facial disminuye, con pelos más finos y necesidad de afeitado en plazos más dilatados.
Síntomas y alteraciones del sistema nervioso y del comportamientoLa testosterona parece influir de forma importante en el estado de ánimo y en las funciones cognitivas del individuo124. Síntomas de nerviosismo, irritabilidad, ansiedad, tristeza, cansancio e insomnio se han relacionado con bajas concentraciones de testosterona en varones de edad avanzada7 y en algunos estudios se ha comprobado su mejoría con la TRT125. También se ha asociado el déficit de testosterona con una mayor frecuencia de síndromes depresivos126,127 y la TRT se ha mostrado favorable en los cuadros de comienzo tardío128 y en depresiones rebeldes al tratamiento con inhibidores selectivos de la recaptación de serotonina (ISRS), pacientes en los que se daba una alta tasa de hipogonadismo129,130. De la misma manera, ciertas alteraciones de la memoria, la capacidad mental y la actividad intelectual se han puesto en relación con el descenso en los valores de testosterona sérica7,124,131,132. En estos casos el papel de la TRT no está bien dilucidado, pues según algunos estudios133,134, la TRT no alivia estas alteraciones, pero según otros sí mejora significativamente la cognición espacial135, la memoria espacial y verbal136 y el rendimiento en trabajos de memoria137. Por otra parte, las bajas concentraciones séricas de testosterona parecen facilitar la enfermedad de Alzheimer138,139 (tabla 2).
Formas clínicas de presentación del síndrome de hipogonadismo de inicio tardíoEste síndrome puede presentarse en el individuo en distintas circunstancias que darán lugar a distintas formas clínicas, y éstas, a su vez, condicionarán distintas actitudes terapéuticas. Puede presentarse en forma primitiva o primaria, en un varón adulto previamente sano o sin enfermedad conocida; sería la forma de aparición más temprana (antes de los 65 años), con síntomas más acusados, de mayor interés diagnóstico y de mejor pronóstico terapéutico. En forma secundaria, puede manifestarse con motivo de cualquier enfermedad aguda grave o enfermedad crónica aparecida en mediana o avanzada edad (diabetes mellitus, enfermedad cardiovascular, hipertensión arterial), abuso de sustancias (tabaco, alcohol), factores nutricionales (desde desnutrición a obesidad) y por las medicaciones empleadas140. En estos casos, la naturaleza secundaria del síndrome quedará confirmada por su desaparición con la superación o mejoría del proceso causante, aunque en algunos casos permanezca ya como entidad clínica propia; el proceso inicial actuó en estos últimos casos como desencadenante. Puede también presentarse como forma asociada a alguna de las enfermedades propias de mediana o avanzada edad de las ya citadas y con mutuas influencias de interés pronóstico y terapéutico. Por último, puede aparecer conjuntamente con un proceso general de envejecimiento, por lo común a edades muy avanzadas; estas formas requieren una consideración clínica y terapéutica particular y no se suele recurrir a medidas especiales como la TRT.
DIAGNÓSTICO DEL SÍNDROME DE HIPOGONADISMO DE INICIO TARDÍOEl diagnóstico del síndrome de HIT se fundamenta en la consideración de cuatro aspectos básicos: datos clínicos, datos bioquímicos, edad avanzada y ausencia de otra enfermedad como causa de hipogonadismo.
Valoración clínicaLa constatación de los síntomas y signos de hipogonadismo puede realizarse siguiendo las pautas generales de estudio de los pacientes, insistiendo en la existencia de los síntomas clásicos ya expuestos. En la exploración ofrece especial interés apreciar el volumen testicular. En varones sanos mayores de 70 años, el volumen testicular disminuye un 20%; utilizando como punto de corte un volumen de 14,3ml, se podría predecir concentraciones de BT con una sensibilidad del 46% y una especificidad del 79%141. Para la valoración clínica se ha propuesto como herramientas útiles diversos cuestionarios sobre síntomas relacionados con la deficiencia androgénica; los más utilizados como métodos de cribado del síndrome de HIT son el cuestionario ADAM (Androgen Deficiency in Aging Male) o de la Universidad de Sant Louis (Missouri, Estados Unidos) y el cuestionario AMSS (Aging Male Symptoms Scale).
Cuestionario ADAMFue desarrollado por Morley y Perry142 y se trata de un cuestionario autoaplicable muy simple que consta de 10 preguntas a las que se debe responder "sí" o "no". Las cuestiones hacen referencia a la percepción "presente o ausente" de la pérdida de libido (1.a), falta de energía vital (2.a), disminución de fuerza muscular (3.a), pérdida de estatura (4.a), disminución de ganas de vivir (5.a), sensación de tristeza y/o malhumor (6.a), disminución/pérdida de erecciones (7.a), disminución en la capacidad para los deportes (8.a), somnolencia tras la cena (9.a) y disminución de la capacidad de trabajo (10.a). Se considera positivo este test si se contesta afirmativamente a las preguntas 1.a y 7.a o al menos 3 de las restantes preguntas. Se adjunta a este documento un modelo de este cuestionario, como anexo 1. En un grupo de 316 médicos voluntarios canadienses, con edad media de tan sólo 52 (intervalo, 40–80) años, el cuestionario mostró una sensibilidad del 88% y una especificidad del 60% para identificar a los sujetos con bajas concentraciones de BT, definidas en este estudio por concentraciones<70ng/dl; con estas cifras resultó un 25% del grupo142. Legros et al143, utilizando una versión francesa de este cuestionario en 754 varones con una media de edad de 59,5 (50–70) años que estaban tomando parte en un cribado de cáncer de próstata y aceptaron voluntariamente una evaluación adicional para el síndrome de HIT, observaron una sensibilidad del 80% pero con una especificidad de tan sólo el 32% para identificar a individuos con FT por debajo del límite normal de los jóvenes (< 7ng/dl). Su baja especificidad incrementa los casos de falsos positivos, lo que se relaciona con síntomas depresivos144.
Cuestionario ADAM142
|
Propuesto por Heinemann et al145 y basado en la evaluación subjetiva de los síntomas, pretende cuantificar el síndrome de HIT; aunque no validado frente a las concentraciones séricas de andrógenos, ha demostrado ser una herramienta útil para el cribado de la deficiencia androgénica146. Consiste en 17 preguntas sobre síntomas relacionados con la deficiencia androgénica y, en caso de haberlos, valora la intensidad con una puntuación de 2 a 5 (1 punto en caso de que no los haya). Por encima de 37 puntos se estima que hay síntomas de hipogonadismo moderado y por encima de 50 se lo considera grave (se adjunta como anexo 2 un modelo de este cuestionario). Utilizando este test, T'Sjoen et al147 encontraron cierta correlación con las concentraciones séricas de FT y BT en 161 varones sanos de edades entre 74 y 89 años.
Otros cuestionariosSmith et al148 han propuesto otra escala de 8 ítems basada no sólo en valoración subjetiva de síntomas, sino además de la edad, el IMC y posible comorbilidad (diabetes mellitus, asma, cefalea, etc.). Tiene también una baja especificidad, de sólo un 49%, para una sensibilidad del 75% (valor predictivo positivo entre el 28 y el 52%).
Consideración general de los cuestionariosAunque puedan ser herramientas útiles para el cribado de posibles pacientes con síndrome de HIT, hay que tener en cuenta que los síntomas climatéricos masculinos no son predictores de las concentraciones de andrógenos149,150 y por sí solos y sin estudio clínico completo y determinaciones bioquímicas no son suficientes para el diagnóstico del síndrome de HIT. Más valor tienen, en caso de ser negativos, para eximir a estos individuos de ulteriores estudios.
VALORACIÓN BIOQUÍMICALas determinaciones bioquímicas relacionadas con la actividad andrógenica son obligadas para el diagnóstico del síndrome de HIT. En ausencia de un marcador específico de la actividad androgénica tisular y celular, habitualmente se utilizan como parámetros bioquímicos las concentraciones séricas de TT y/o FT; para la determinación de esta última se utiliza el método de diálisis o calculándola por las concentraciones de TT, SHBG y albúmina, según la fórmula de Vermeulen (anexo 3). También se puede determinar, aunque se realice en menos ocasiones, el índice androgénico o de andrógeno libre o de testosterona libre44 resultante de dividir el valor de TT por el de la SHBG (TT / SHBG) o la BT que es la suma de la FT más la testosterona unida a la albúmina y realizada por precipitación por sulfato amónico7. La determinación bioquímica básica e inicial es la del valor sérico de la TT7,52 que se debe confirmar por otra ulterior determinación. En situaciones de disparidad entre las concentraciones de las dos determinaciones de TT o situaciones dudosas, se recurrirá a la valoración de la FT. La guía de práctica clínica de la Sociedad de Endocrinología Americana151 recomienda igualmente empezar por la determinación de las concentraciones séricas de TT, repetida en otra mañana para confirmar el diagnóstico, y en algunos casos que pudieran quedar dudosos, recurrir a las determinaciones de la FT o de la BT. Las muestras de sangre deben ser extraídas entre las siete y las once de la mañana, teniendo en cuenta el ritmo circadiano de la secreción de testosterona.
Cálculo de testosterona libre (fórmula de Vermeulen et al13)
| T libre=T total−N×T libre/[Kt−SHBG−T total+(N×T libre)]N = Ka×Ca +1 |
Ca: concentración de albúmina; Ka: constante de asociación testosterona-albúmina; Kt: constante de asociación testosterona-SHBG; SHBG: globulina transportadora de hormonas sexuales; T libre: testosterona libre; T total: testosterona total.
También está disponible para cálculo automático en: www.issam.ch/freetesto.htm
De acuerdo con las recomendaciones ISA, ISSAM y EAU de 2007,53, se considerará:
- 1.
Concentraciones diagnósticas de hipogonadismo:
- –
Las de TT<8nmol/l (231ng/dl).
- –
Las de FT<180 pmol/l (52pg/ml).
- –
- 2.
Concentraciones normales:
- –
Las de TT>12nmol/l (346ng/dl).
- –
Las de FT>250 pmol/l (72pg/ml).
- –
- 3.
Concentraciones dudosas:
- –
Entre 8 y 12nmol/l (231–346ng/dl) de TT.
- –
Entre 180 y 250 pmol/l (52–72pg/ml) de FT.
- –
En casos de resultados dudosos, se puede complementar el estudio con determinaciones de LH y prolactina que ayudarán a confirmar el diagnóstico o descartar otros tipos de hipogonadismos. Los hallazgos de concentraciones elevadas de LH junto a cifras bajas de TT o de FT deberían ser considerados como evidencia adicional para el diagnóstico de la deficiencia androgénica; sin embargo, dadas las posibles alteraciones en la secreción de LH relacionadas con la edad, una LH elevada no es una condición para el diagnóstico de hipogonadismo en el varón de edad avanzada152. Contrariamente, una elevación aislada de LH sin bajas concentraciones séricas de testosterona no tiene significación de insuficiencia androgénica. La respuesta secretora de LH al estímulo de Gn-RH podría ayudar a excluir un hipogonadismo secundario a estas edades153. En las recomendaciones ya citadas7,53, la determinación de otras hormonas (tiroideas, cortisol, DHEA y DHEAS, melatonina, GH, IGF-I), que podrían estar disminuidas en los varones de avanzada edad, no se recomiendan en forma sistemática y sólo individualmente si se sospecha alteraciones endocrinas de alguna de ellas. Según la guía clínica basada en la evidencia propuesta en 2006 por la Sociedad Americana de Endocrinología151, las concentraciones mínimas normales en varones jóvenes y sanos serían 300ng/dl (10,4nmol/l) para la TT y 50pg/ml (0,17nmol/l) para la FT; concentraciones inferiores tendrían validez diagnóstica de hipogonadismo. En la misma guía se recomienda la determinación de FSH y LH para diferenciar mejor el hipogonadismo primario (testicular) del secundario (hipofisohipotalámico). Actualmente no hay evidencia de que las determinaciones de la concentración sérica de otros andrógenos como la DHT, la androstendiona o la DHEAS puedan contribuir al diagnóstico. Siempre se tendrá en cuenta los límites de normalidad de cada laboratorio y según técnicas utilizadas, así como los controles de calidad.
Edad avanzadaEn la definición del síndrome de HIT va implícito que su comienzo se produce en adultos de edad avanzada. Establecer una edad de aparición concreta es cuestionable, al igual que sucede con la edad de la menopausia en la mujer, con la dificultad añadida en el varón de que la disminución de la secreción de testosterona ocurre de forma más lenta y gradual, además de más tardíamente. Por otra parte, lo que realmente importa es la edad "biológica", es decir, el estado general de salud y no la edad cronológica. De todas formas, a título orientativo, se ha señalado la edad de 60 años7,53 como la de mayor riesgo de aparición del síndrome, aunque en algunos estudios como el HIMS (Hypogonadism in Male Study)20, aparece a edades más tempranas; en el HIMS concretamente, el 37% de los varones entre 45 y 64 años presentaban síntomas hipogonadales con concentraciones bajas de TT, FT y BT frente al 42% del grupo que tenía 65 años o más, que además tenían síntomas menos acusados que los más jóvenes. Jockenhovel154 también señala que un 15-25% de los varones mayores de 50 años tienen concentraciones de testosterona inferiores a las consideradas normales para los 20–40 años. Por todo lo expuesto, aunque cabe esperar que el HIT se manifieste fundamentalmente en varones de edad avanzada, no podemos descartar que aparezca en cualquier momento a partir de los 50 años, e incluso antes; lo realmente importante es que su presentación acontece después de finalizado el desarrollo genitosexual normal.
Ausencia de enfermedad o alteración causante de hipogonadismoSe considera que el HIT es un síndrome primario y motivado por la edad avanzada; por lo tanto, ante la aparición de un hipogonadismo en el varón adulto mayor, se debe descartar otras causas (prolactinoma u otros).
TRATAMIENTO DEL SÍNDROME DE HIPOGONADISMO DE INICIO TARDÍOEn este apartado se aborda el fundamento y los objetivos del tratamiento, las posibles medidas terapéuticas y fundamentalmente la TRT, con sus beneficios, riesgos, indicaciones y contraindicaciones y la monitorización del tratamiento.
Fundamento y objetivos del tratamientoActualmente está fuera de toda duda el beneficio del tratamiento del síndrome de HIT correctamente diagnosticado y tratado según las recomendaciones y guías clínicas existentes7,53,151. Igualmente, se admite como objetivos del tratamiento155: la restitución de las concentraciones séricas fisiológicas de testosterona, la mejoría o desaparición de los síntomas, la prevención de alteraciones a largo plazo, la mejoría de la calidad de vida y un posible retraso de la mortalidad156. En relación con las concentraciones de testosterona, se considera como objetivo terapéutico conseguir los concentraciones más bajas de la normalidad para varones jóvenes7, sin que haya evidencia de la necesidad de mantener el ritmo circadiano fisiológico de la testosterona.
Medidas terapéuticasAunque la principal medida terapéutica es la TRT, no deben obviarse otras medidas útiles en la prevención y el tratamiento del síndrome de HIT, que pueden disminuir o retrasar la sintomatología y las alteraciones; entre éstas merecen cita las medidas nutricionales, la actividad física y medidas psicoterápicas. Las medidas nutricionales que eviten la obesidad, especialmente de tipo superior, pueden ser de interés; ya se mencionó anteriormente la frecuencia asociativa de obesidad e hipogonadismo. La actividad física podría evitar o disminuir la afectación muscular (sarcopenia) y ósea (osteopenia) del hipogonadismo. La psicoterapia se haría conveniente o necesaria, ante depresiones o cambios de humor que pueden estar favorecidos por las circunstancias laborales, familiares y socioeconómicas propias de los varones en edad de riesgo de síndrome de HIT. En definitiva, debe considerarse este síndrome dentro de una perspectiva global del individuo; se debe tratar al paciente, no sólo el síndrome de HIT.
Terapia de restitución con testosteronaLa TRT es una opción terapéutica para el varón "en condiciones asociadas a la deficiencia o ausencia de la testosterona endógena"157 considerada por la OMS (Guía para la utilización de andrógenos en hombres, 1992), y otros organismos oficiales (NIH y FDA de Estados Unidos). Diversas sociedades científicas nacionales e internacionales (Sociedad Endocrina de Australia, 2000; Segunda Reunión Anual de Consenso en Andropausia, 2001; AACE, American Association of Clinical Endocrinologists; Sexual Medicine Society of North America, 2002; diversas sociedades alemanas, 2001; Endocrine Society; ISA [International Society of Andrology]; ISSAM [International Society of Study of Aging Male]; EAU [European Association of Urology])7,53,151,158 consideran la TRT como medida terapéutica específica del síndrome de HIT, por los probados beneficios que puede conseguir en estos pacientes, aun admitiendo posibles riesgos y, por esto, recomendando determinados controles. También es cierto que todas las instituciones citadas y alguna otra ya mencionada10, así como la mayoría de los autores que se dedican al problema, opinan que son necesarios más estudios aleatorizados y controlados a largo plazo para obtener mayores evidencias de que el balance beneficios/riesgos resulta favorable. La TRT es un tema de actual y creciente interés: el número de publicaciones de los últimos 30 años se ha multiplicado por 10 y el consumo de preparados de testosterona ha aumentado significativamente158,159; en Estados Unidos se hicieron 2,3 millones de prescripciones en 2005, lo que supone un incremento del 50% respecto a 2001 y un 210% respecto a 1999. Revisaremos seguidamente los beneficios que cabe esperar de la TRT, así como sus riesgos, indicaciones y contraindicaciones y los cuidados de monitorización que requiere.
Beneficios de la terapia de restitución con testosteronaBeneficios clínicos (consideración general)Nieschlag et al158 señalan que restaurando las concentraciones séricas de testosterona hasta el nivel de normalidad de los adultos jóvenes se puede mejorar muchos de los síntomas del hipogonadismo, especialmente las alteraciones del estado de ánimo y el nivel de energía vital y, por ello, de la sensación de bienestar, las alteraciones de la función sexual (especialmente la libido, pero también la función eréctil si su alteración está relacionada con el hipogonadismo), las alteraciones en la masa magra corporal, las de la eritropoyesis (mejorando la anemia si la hubiera y se debiera al hipogonadismo) y las alteraciones de la densidad mineral ósea.
Beneficios en el huesoLos grupos de Behre et al160 y Zitzmann et al161 han demostrado con toda claridad los efectos beneficiosos de la TRT en la densidad mineral ósea de los varones con hipogonadismo, que se mantienen a lo largo de varios años. La eficacia de la TRT en la densidad mineral ósea es tan evidente que su mejoría ha sido considerada como marcador de eficacia de la TRT. El efecto en la densidad mineral ósea puede observarse pasados los primeros 6 meses y continúa durante 2 o 3 años162, incluyendo la posibilidad de mejorar la arquitectura estructural del hueso163. La testosterona actúa sobre el hueso tanto por acción sobre los osteoblastos como sobre los osteoclastos y tanto a través de los receptores androgénicos como de los receptores estrogénicos, previa transformación en estrógenos por la aromatasa. Tanto andrógenos como estrógenos influyen en el remodelado óseo por medio de citocinas del microambiente óseo (acción autocrina y paracrina)164. Para algunos autores165 los estrógenos tendrían importancia en el mantenimiento de la formación ósea, aunque para otros los efectos beneficiosos de la testosterona serían independientes de la acción estrogénica166.
Beneficios en la composición corporal y la fuerza muscularLos efectos de la TRT en la composición corporal (masa grasa y masa magra) y la fuerza muscular en varones de edad avanzada con hipogonadismo han sido ampliamente estudiados. En todos los casos, en mayor o menor medida, se ha comprobado una tendencia a la disminución de la masa grasa y al aumento de la masa magra o masa libre de grasa. Isidori et al167 han realizado un metaanálisis con 29 trabajos controlados y aleatorizados que incluyeron a 1.083 individuos con una media de edad de 64,5 (49,9-77,6) años; se trató a 625 con testosterona y a 427 con placebo y 31 constituyeron un grupo control. La TRT logró una reducción de 1,6kg (intervalo de confianza [IC], 2,50,6) de la grasa corporal total (el 6,2% [IC, 9,2-3,3] de la masa grasa total inicial) y un aumento de 1,6kg (IC, 0,6-2,6) de la masa libre de grasa o masa magra (el 2,7% [IC, 1,1-4,4] del peso inicial de masa magra), sin que se apreciaran cambios en el peso total corporal. Los resultados de los efectos de la testosterona sobre la fuerza muscular fueron más heterogéneos, con tendencia a la mejoría y aumento solamente en la fuerza de extensión de rodillas y de contracción de la mano del brazo dominante.
Beneficios en la función sexualLos beneficios de la TRT en la disfunción sexual de los varones hipogonadales de edad avanzada han sido controvertidos; mientras algunos autores admitían efectos beneficiosos, otros no los encontraban. Dos metaanálisis recientes nos ayudan a concretar mejor estos efectos. El primero, de Isidori et al168, en 2005, engloba 17 trabajos aleatorizados y controlados con placebo, realizados sobre 656 individuos, de los que 284 seguían tratamiento con testosterona, 284 con placebo y 88 con tratamiento cruzado; la duración media de los estudios era de 3 (1–36) meses. Los varones con concentraciones de testosterona<12nmol/l mejoraron moderadamente en cuanto al número de erecciones nocturnas, pensamientos sexuales y motivación, número y éxito de encuentros, mejor función eréctil y mayor satisfacción sexual general, mientras que la testosterona no fue eficaz en los varones con disfunción eréctil eugonadal. La función eréctil, pero no la libido, estaba inversamente relacionada con las concentraciones basales de testosterona. El segundo metaanálisis, de Boloña et al61 en 2007, incluye también 17 trabajos aleatorizados y controlados con placebo, sobre 862 participantes. Concluye que la utilización de testosterona mejora en pequeña medida la satisfacción de la función eréctil y de forma moderada la libido; este último efecto era más acusado en los varones con concentraciones iniciales de testosterona más bajas. Los efectos en la satisfacción sexual general no fueron significativos. De todas formas, para valorar con más seguridad los efectos beneficiosos de la TRT en la función sexual, no debemos olvidar que el hipogonadismo no es un hallazgo común en la disfunción eréctil; ocurre sólo en torno al 5%61 o al 18,7%28 de los casos, y no se ha encontrado relación entre las concentraciones de testosterona normal o biodisponible o de las concentraciones de la SHBG con la disfunción eréctil169,170. Lo que sí parece evidente es lac mejoría de la disfunción eréctil con la TRT en varones con hipogonadismo, incrementándose la respuesta a los inhibidores de la 5-DPE74,75,170.
Beneficios en la función cognitiva y el estado de ánimoLos estudios sobre la relación entre las concentraciones séricas de andrógenos y la capacidad cognitiva en el varón no son concluyentes171. En la mayoría de los casos parece demostrarse tal relación7,53,124,131-134, pero en otros no se comprueba172-174. A pesar de esta polémica, Kaufman et al171 sostienen que las bajas concentraciones séricas de FT y BT contribuyen al deterioro de la capacidad mental del varón de edad avanzada. En concreto, parece probado que la testosterona sí mejoraría significativamente la cognición espacial135, la memoria espacial y verbal136 y el rendimiento en trabajos de memoria137. Por otra parte, la falta de testosterona parece facilitar la enfermedad de Alzheimer138,139. También se ha relacionado las concentraciones séricas bajas de testosterona con una mayor frecuencia de síndromes depresivos126,127, aunque Kaufman et al171 consideran que la disminución de testosterona relacionada con la edad no constituye un factor de riesgo clínicamente significativo de depresión, sin poder excluir que tenga su importancia en el estado de ánimo depresivo. La TRT se ha mostrado beneficiosa en los síndromes depresivos de comienzo tardío128, así como en depresiones rebeldes al tratamiento con ISRS, pacientes en los que se encuentra una alta tasa de hipogonadismo129,130.
Beneficios en los factores de riesgo cardiovascularNumerosos trabajos han contrastado las concentraciones bajas de testosterona y el TRT con factores de riesgo cardiovascular, aterosclerosis y alteraciones cardiovasculares (cardiopatía isquémica, insuficiencia cardíaca crónica). Como referencia de interés, exponemos los resultados del metaanálisis de Haddad et al175, publicados este mismo año, que incluye 30 trabajos que engloban a 1.642 varones, de los que 808 estaban con TRT; tras estudiar glucemia, presión arterial, perfil lipídico y eventos cardiovasculares, la conclusión fue que no hay evidencia de que la TRT se asocie a efectos cardiovasculares importantes. Isidori et al140 admiten que la TRT es relativamente segura en relación con la salud cardiovascular y Malkin et al176 parecen demostrar efectos positivos en numerosos parámetros metabólicos (sensibilidad insulínica, control de glucemia, adiposidad visceral, hiperlipemia) en pacientes con diabetes mellitus tipo 2 o con insuficiencia cardíaca crónica. Nieschlag et al158, respecto a este problema, concluyeron que no hay evidencia de efectos adversos de la TRT en la cardiopatía isquémica o la insuficiencia cardíaca crónica, y que incluso puede ser importante la TRT en las enfermedades cardiovasculares del varón. En apoyo de esto estaría el efecto vasodilatador arterial de la testosterona, que a concentraciones fisiológicas ha demostrado tener una importante acción inhibitoria de los canales del calcio tipo L en los vasos177. Otros trabajos, en consonancia con lo expuesto, demuestran un importante beneficio en varones hipogonadales con angina e isquemia de inicio con testosterona intramuscular176 o con parches transdérmicos de testosterona178. También se ha observado mejoría de la capacidad funcional cardíaca y disminución de la resistencia vascular periférica en pacientes con insuficiencia cardíaca crónica sometidos a TRT con testosterona oral179 o intramuscular180. En relación con los efectos de la TRT en las concentraciones de las distintas fracciones de lípidos en sangre, muchos trabajos encontraron descensos del colesterol total y del cLDL117,118 y concentraciones de triglicéridos en correlación negativa con las concentraciones séricas de testosterona7,53; incluso se ha propuesto que la testosterona sería el factor hormonal más importante para estimular el aumento del cHDL115. Sin embargo, el metaanálisis de Haddad et al175 no ha confirmado estos resultados. Finalmente, algún trabajo ha señalado que la TRT induce mejoría en la homeostasis de la glucosa en diabéticos con moderado hipogonadismo181; este hecho está en concordancia con la idea defendida por otros autores de que las concentraciones bajas de testosterona pueden ser predictoras de síndrome metabólico y diabetes mellitus tipo 2107.
Calidad de vidaEs evidente que la calidad de vida disminuye con la edad, tanto por factores endógenos (limitaciones físicas, comorbilidad) como exógenos (familiares, sociales, laborales, económicos). Hasta el presente, no se ha podido comprobar una relación directa entre las concentraciones séricas de FT o BT y la calidad de vida170 ni se ha podido demostrar utilizando cuestionarios del tipo de SF-36147.
Riesgos de la terapia de restitución con tetosteronaLa TRT puede acompañarse de riesgos para la salud por la estimulación de los tejidos sensibles a los andrógenos; estos riesgos incluyen el carcinoma prostático, la hipertrofia benigna de próstata, la policitemia, la apnea del sueño, la ginecomastia y el cáncer de mama, retención de líquidos e hipertensión arterial119,182.
Alteración de la próstataDe todos los efectos adversos, el que causa mayor preocupación es el posible estímulo del crecimiento del cáncer de próstata. Hasta ahora, no hay evidencia de que la testosterona inicie el desarrollo del cáncer de próstata183,184. En una revisión de 461 varones tratados con TRT durante 3–36 meses, la tasa de aparición de cáncer de próstata fue la misma (5 casos, 1,1%) que en los no tratados185. Tampoco hay evidencia de que la testosterona estimule la progresión del cáncer de próstata; en varones diagnosticados de neoplasia intraepitelial prostática (PIN), la TRT, durante 1 año, no aumentó el riesgo de progresión del cáncer significativamente (1,3%) respecto al grupo control186. Las siguientes observaciones y hallazgos disminuirán la preocupación sobre el riesgo de la TRT para el cáncer de próstata:
- –
Los cánceres de próstata empiezan a aparecer a edades en las que suele ir descendiendo la concentración sérica de testosterona.
- –
No hay correlación entre concentraciones séricas de testosterona y concentraciones de PSA, que es el marcador tumoral del cáncer de próstata187.
- –
Bajas concentraciones de testosterona previas al diagnóstico de cáncer de próstata, predicen mal pronóstico y mayor agresividad188.
- –
Contrariamente, los pacientes con concentraciones más altas de testosterona sérica previas al diagnóstico gozan de mayor supervivencia189.
En una reciente revisión, Morgentaler190 concluye que no hay, ni nunca ha habido, base científica para creer que la testosterona estimula el crecimiento del cáncer de próstata. No obstante, las recomendaciones actuales7,53 incluyen descartar la posibilidad de un cáncer de próstata para el inicio de la TRT mediante la realización de un tacto rectal y una determinación de PSA a los varones mayores de 45 años. Si la PSA fuese>4ng/ml o el tacto rectal fuera sospechoso, se recomienda realizar una biopsia transrectal guiada por ultrasonidos (ecografía), para verificar el posible diagnóstico. También se recomienda seguir con controles de seguridad durante el tratamiento con TRT, como se expondrá más adelante. La preocupación por el cáncer de próstata es comprensible, dado que es el cáncer más frecuente en varones; hasta un 50% de los varones mayores de 50 años tienen un cáncer de prostata oculto191, aunque sólo en una minoría, y en función de factores endógenos, genéticos y exógenos, se desarrollará. La TRT incluso podría realizarse en pacientes hipogonadales después de la resolución quirúrgica192,193 o por braquiterapia194 del cáncer de próstata, siguiendo los controles clínicos y bioquímicos (PSA) precisos. En relación con la hiperplasia benigna de próstata (HBP), hallazgo muy prevalente en varones de edad avanzada, se admite195 que no hay evidencia de que la TRT ocasione HBP en varones hipogonadales; Morales196 señala que, aunque puedan producirse discretos aumentos del tamaño de la próstata y del PSA durante la TRT, éstos se mantienen siempre dentro de la normalidad. No obstante, se considera contraindicaciones de la TRT la HBP con obstrucción grave de la emisión de orina y la HBP asociada a síntomas del tracto urinario bajo, aunque en este caso la contraindicación sea parcial o temporal7,53,196.
PolicitemiaComo ya se expuso al revisar la clínica del síndrome de HIT, la testosterona estimula la eritropoyesis incrementando la síntesis de eritropoyetina renal117, por lo que no es infrecuente encontrar discretas anemias en los afectados por este síndrome que mejoran con la TRT118,157. Pero a dosis suprafisiológicas la testosterona puede producir policitemias7,53; en un 6-25% de los pacientes tratados con TRT desarrollan eritrocitosis con incrementos del hematocrito superiores al 50%171. El riesgo podría estar en función de la vía de administración de la testosterona, un 3-15% para las aplicaciones transdérmicas y el 44% para la testosterona por vía intramuscular185. La determinación del hematocrito o de la concentración sanguínea de hemoglobina es uno de los cuidados incluidos en la monitorización de la TRT. En caso de presentarse, se deben tomar medidas adecuadas (interrupción temporal del tratamiento, reajuste de dosis, flebotomía) para evitar riesgos cardiovasculares7,53.
Apnea del sueñoAlgunos trabajos195-198 han señalado que la TRT podría inducir o exacerbar la apnea del sueño, especialmente en sujetos obesos, con enfermedad pulmonar obstructiva crónica y fumadores. También Liu et al199 han observado un incremento de hipoxemia con la administración a corto plazo de dosis altas de testosterona en varones ancianos sanos, aunque estas alteraciones no han sido confirmadas por otros autores162.
Otros efectos adversosAdemás de los efectos adversos ya mencionados, ocasionalmente pueden aparecer otros que no podemos dejar de mencionar aunque sean menos comunes185. Rara vez puede observarse una retención clínicamente significativa de líquidos con dosis moderadas de testosterona, pero esto debe tenerse en cuenta en pacientes con insuficiencia cardíaca congestiva o insuficiencia renal. La ginecomastia es una complicación benigna que puede ocurrir ocasionalmente durante el tratamiento con testosterona, como consecuencia de la aromatización periférica de la testosterona y su conversión en estrógenos en el tejido adiposo. Suele estar incrementada en varones de edad avanzada. Su diagnóstico al inicio o durante el tratamiento obliga a modificarlo aunque el carcinoma de mama sea raro en varones. La afección hepática por preparados de testosterona se circunscribe exclusivamente al uso oral de los derivados alquilados; por lo tanto no aparece cuando se utiliza la vía cutánea o la intramuscular. Las alteraciones locales, intramuscular en casos de inyectables o dérmica en preparados para vía cutánea, no son infrecuentes, pero en general de escasa importancia; las cutáneas son más frecuentes con las preparaciones en parches que con las de tipo gel.
INDICACIONES DE LA TERAPIA DE RESTITUCIÓN CON TESTOSTERONASegún las recomendaciones de consenso de ISA, ISSAM y EAU de 20057,53, sería apropiado el tratamiento de TRT ante el diagnóstico de síndrome de HIT con concentraciones séricas de TT<8nmol/l (231ng/dl o 2,31ng/ml) o de FT<180 pmol/l (52pg/ml). Con anterioridad a este consenso, se estimaba otras concentraciones mínimas de testosterona como indicativas para iniciar tratamiento de TRT, que variaban discretamente unas de otras en cada país157, por lo que estimamos como mejor opción la propuesta consensuada ya expuesta. La Guía Clínica de la Sociedad Americana de Endocrinología151 del 2006 recomienda, aunque con baja valoración de evidencia, iniciar el tratamiento de TRT "en pacientes sintomáticos con deficiencia androgénica y bajas concentraciones de testosterona para inducir y mantener los caracteres sexuales secundarios, mejorar su función sexual, su sensación general de bienestar, la masa y la fuerza musculares y su densidad mineral ósea". Condición necesaria para establecer la TRT es valorar en cada paciente el balance beneficios/riesgos, y se instaura únicamente cuando los beneficios esperados puedan superar a los riesgos. Consideración especial ha de tenerse en los síndromes de HIT asociados a otras enfermedades (obesidad, diabetes mellitus, enfermedad cardiovascular, disfunción eréctil). En algunas, como en la obesidad, el tratamiento de ésta puede mejorar el síndrome de HIT y hacer innecesario la TRT; en otras, como en disfunción eréctil, está claramente admitida como necesaria para su resolución. En otros casos (enfermedad cardioisquémica, insuficiencia cardíaca), como ya se expuso, se especula sobre su beneficio.
Contraindicaciones de la terapia de restitución con testosteronaEn las recomendaciones del consenso ISA, ISSAM y EAU de 20057,53, se establecen como contraindicaciones absolutas para instaurar la TRT las siguientes enfermedades: varón con sospecha o afecto de carcinoma de próstata o mama, policitemias significativas, insuficiencia cardíaca grave, síntomas importantes de obstrucción evidente del tracto urinario inferior (con alta valoración en la International Prostate Symptom Score [IPSS]) o hallazgos clínicos de obstrucción de flujo vesical (aumento de volumen residual posmiccional, disminución del máximo flujo urinario, estudios de presión de flujo patológicos) por agrandamiento producido por hiperplasia benigna de próstata, en cuyo caso se debería evitar el tratamiento con testosterona. La obstrucción moderada representa una contraindicación parcial; superada con éxito por el tratamiento, la contraindicación desaparece. Las mismas contraindicaciones figuran en la Guía Clínica de la Sociedad Americana de Endocrinología151, puntualizando la contraindicación ante nódulo palpable o induración en próstata o un PSA>3ng/ml, sin evaluación urológica más amplia (evidencia de muy escasa valoración); también puntualiza la contraindicación en eritrocitosis cuando el hematocrito sea>50% o cuando la valoración IPSS en la hipertrofia benigna de próstata sea>19, pero con evidencia de muy escasa valoración, igual que en el caso de la insuficiencia cardíaca grave. La contraindicación más firme sigue siendo el cáncer de próstata, y aun así con calidad de evidencia baja. Respecto a la edad del paciente, en principio no debe ser un determinante absoluto, y por sí sola no es una contraindicación en ausencia de otras contraindicaciones definitivas7,53, aunque se admite que los mejores resultados se logran en pacientes de edad<65 años200, que también son los que presentan síntomas más acusados20. Al margen de las contraindicaciones señaladas en estas recomendaciones, parece lógico contraindicar la TRT ante cualquier situación patológica grave y de mal pronóstico a corto plazo y en edades extremas con síndrome involutivo senil generalizado.
Monitorización en terapia de restitución con testosteronaDado el posible riesgo de efectos adversos con la TRT, es lógico que se propongan determinados controles de seguridad, tanto al inicio del tratamiento como durante el tiempo que dure. Las recomendaciones de la ISA, ISSAM y EAU de 20057,53, en cuanto a cuidados de monitorización son:
- –
Al inicio: exploración prostática por tacto rectal y determinación de PSA (antígeno específico prostático) en varones de edad>45 años; determinación del hematocrito; exploración de densidad mineral ósea, aconsejable.
- –
Cada 3 meses, durante el primer año: revisión prostática por tacto rectal y determinación de PSA; ante la aparición de anormalidades, se recomienda biopsia prostática guiada por ultrasonidos; revisión del hematocrito; ajuste de dosis si es preciso; revisión clínica; ante alteraciones del comportamiento, modificar dosis o suspender el tratamiento.
- –
Cada año: revisión prostática y del hematocrito.
- –
Cada 2 años: revisión de la densidad mineral ósea.
Las recomendaciones de la Guía de la Sociedad Americana de Endocrinología151 incluyen las siguientes medidas de monitorización:
- –
Control clínico a los 3 meses de inicio del tratamiento, para comprobar mejoría de los síntomas o aparición de efectos adversos.
- –
Control de la concentración sérica de testosterona, a los 3 meses del inicio del tratamiento, teniendo en cuenta los siguientes puntos:
- 1.
Se debe conseguir que estén en los valores medios de la normalidad.
- 2.
Si la administración de la testosterona es por inyección, la medición de la testosterona se hará a mitad de tiempo entre 2 inyecciones.
- 3.
Si la administración es por parches, la determinación de la testosterona se hará a las 3–12h de su aplicación.
- 4.
Si la administración se realiza por tabletas bucales, la determinación se hará inmediatamente antes.
- 5.
Si la administración es por gel, la determinación de la testosterona sérica se hará transcurridas 1–2 semanas.
- 6.
Si las concentraciones séricas de testosterona de los controles son>700ng/dl (24,5nmol/l) o<350ng/dl (12,3nmol/l), se reajustará la dosis o la frecuencia.
- 1.
- –
Control de la próstata al inicio del tratamiento y a los 3 meses, mediante tacto rectal y medición de PSA, continuando con los controles recomendados en las guías basadas en la evidencia para el cribado del cáncer de próstata, según edad y raza del paciente.
- –
Control del hematocrito al inicio del tratamiento, a los 3 meses y al año. Si el hematocrito supera el 54%, se interrumpirá el tratamiento hasta que descienda a concentraciones saludables, valorando posible hipoxia o apnea del sueño y reiniciando el tratamiento a dosis reducida.
- –
Control de la densidad mineral ósea, al inicio y a los 2 años, mediante medición en la columna lumbar, el cuello femoral y la cadera en varones hipogonadales con osteoporosis o baja incidencia de fractura traumática.
Además recomiendan:
- –
Consultar con urólogos ante: concentraciones séricas de PSA>4ng/ml; incrementos de PSA en suero o plasma>1,4ng/ml en el curso de un período de tratamiento de 12 meses; velocidad de crecimiento de PSA>0,4ng/ml después de 6 meses de tratamiento con TRT, si se posee datos anteriores de más de 2 años; detección de anormalidad prostática al tacto rectal; una valoración de síntomas prostáticos>19, según la Asociación Urológica Americana (IPSS).
- –
Evaluar síntomas y signos de acontecimientos adversos específicos de cada formulación y vía de administración en cada visita de control:
- 1.
Con tabletas bucales, alteraciones del gusto o de las mucosas de la cavidad bucal.
- 2.
Con inyectables, fluctuaciones del estado de ánimo, la libido o el hematocrito, especialmente en varones de edad avanzada.
- 3.
Con parches, posibles síntomas o signos de irritación cutánea.
- 4.
Con gel, se debe advertir a los pacientes de que se cubran la piel tratada con el gel o limpiarla antes de un posible contacto cutáneo con una mujer o un niño, a los que podría transferir los andrógenos.
- 1.
La testosterona es el andrógeno más importante de los testículos. Cada día se sintetizan en ellos 5–7mg de testosterona. Por ello, el tratamiento con andrógenos significa la administración de testosterona. El objetivo del tratamiento es conseguir una concentración fisiológica de testosterona en suero que sea apropiada para corregir la deficiencia androgénica, anular sus síntomas y prevenir las secuelas a largo plazo34. Hay gran número de preparaciones y formulaciones disponibles, de las que se puede seleccionar el producto que sea más apropiado en función de diferentes características clínicas y farmacocinéticas que se debe tener en cuenta. El hígado muestra una alta capacidad para metabolizar la testosterona circulante. La vida media de la testosterona libre en suero es de aproximadamente 10min. Por ello, la testosterona oral que se absorbe en el duodeno produce sólo un breve incremento de testosterona en suero, que es ineficaz clínicamente. Sólo dosis que superen los 200mg de testosterona exceden la capacidad metabólica del hígado y alcanzan los órganos diana por la circulación sistémica201. Todas las vías de administración de testosterona han sido estudiadas, pero sólo en algunas se ha demostrado eficacia, y las vías transdérmica, intramuscular y oral son las más ampliamente utilizadas. En algunos países también se usan formulaciones subcutáneas, sublinguales y bucales.
Por otra parte, el desarrollo de diferentes formulaciones ha llevado consigo también modificaciones de la estructura química de la molécula de testosterona para conseguir mayor eficacia clínica. Así, la alquilación en la posición 17α impide el metabolismo hepático rápido, pero produce hepatotoxicidad, y por ello estas preparaciones no son recomendables. La esterificación del grupo 17β-hidroxilo, que también impide el metabolismo prematuro, no tiene este efecto adverso. La esterificación con grupos carboxilos en la posición 17β incrementa la lipofilia y hace posible la administración intramuscular en solución oleosa que se libera lentamente desde la inyección depot. Los ésteres que entran en la circulación tienen una vida media tan corta como la de la propia testosterona, por lo que el efecto prolongado se produce exclusivamente por la liberación retrasada desde la inyección depot. La alquilación en la posición 1 también protege del primer paso hepático. La eliminación del grupo C19 (19-nortestosterona) altera el metabolismo e incrementa la duración del efecto. También ha habido intentos de separar el efecto virilizante de los andrógenos del efecto anabólico cambiando la estructura de la molécula de testosterona. El efecto anabólico proteínico podría ser útil en mujeres y niños y en el tratamiento de la osteoporosis, la anemia aplásica y la caquexia. Gran número de los llamados esteroides anabólicos (anabolizantes) han sido sintetizados para estimular la eritropoyesis y aumentar la masa muscular y la masa ósea34.
Por todo ello, los andrógenos pueden ser clasificados en función de la vía de administración y de su estructura química (tabla 3).
Clasificación de los preparados androgénicos
| Según la vía de administraciónOralMesterolonaUndecanoato de testosteronaAcetato de metenolonaMetiltestosteronaFluoximesteronaIntramuscularPropionato de testosteronaEnantato de testosteronaCipionato de testosteronaUndecanoato de testosteronaBuciclato de testosteronaDecanoato de 19-nortestosteronaSubcutáneaImplantes de testosteronaTransdérmicaGel de testosteronaParches de testosteronaSegún la estructura químicaTestosterona nativaGel de testosteronaParches de testosteronaImplantes de testosteronaEster 17α-hidroxilosPropionato de testosteronaEnantato de testosteronaCipionato de testosteronaUndecanoato de testosteronaBuciclato de testosteronaDecanoato de 19-nortestosteronaAndrógenos 1-alquiladosMesterolonaAcetato de metenolonaAndrógenos 17α-alquiladosMetiltestosteronaFluoximesterona |
Modificado de Jockenhovel34.
Es un derivado de la DHT (1α-metil-5α-dihidrotestosterona) y ocupa un lugar especial entre las preparaciones de andrógenos. Tras su administración oral, la mesterolona es bien absorbida y protegida del metabolismo hepático por el grupo metilo. Una simple toma de 30mg produce unas concentraciones séricas de mesterolona equivalentes a la fisiológica de testosterona. Su máxima acción se consigue a las 3h y tiene una vida media de unas 7h. Hay que administrar hasta 150mg al día divididos en 3–4 dosis. No se convierte a estradiol o testosterona por el cuerpo, por lo que no puede desarrollar completamente las acciones biológicas de los andrógenos. Puede tener indicación en ciertos hipogonadismos leves.
Undecanoato de testosterona oralEstá disponible en muchos países en cápsulas de 40mg. Tiene más de dos décadas de experiencia sin efectos secundarios, obtiene buena virilización y restaura la potencia y la libido de los varones hipogonadales. Es un compuesto lipofílico, éster de testosterona con ácido graso, que se absorbe en el intestino por vía linfática, con lo que se evita el primer paso hepático. Produce concentraciones de testosterona en el límite normal-bajo e incrementa moderadamente la DHT. Tiene una vida media corta, alcanza la máxima concentración sérica de testosterona en unas 5h y necesita la administración de 160–240mg diarios divididos en 3–4 dosis diarias, lo que lo restringe a pacientes que no toleran las vías transdérmica e intramuscular. Además tiene el inconveniente de su baja biodisponibilidad y la gran variabilidad de absorción individual e interindividual.
Acetato de metenolona (Striant®)Ha sido aprobado recientemente por la FDA. Se presenta como una pequeña tableta que contiene 30mg de testosterona y se adhiere a la mucosa bucal (en la parte superior de las encías bajo las fosas nasales) cada 12h. La tableta se va disolviendo y liberando testosterona, que se absorbe a través de la mucosa. Evita el primer paso hepático. Tras la segunda aplicación se consigue concentraciones estables de testosterona en sangre, dentro del límite normal. Las concentraciones de DHT y estradiol corren en paralelo con las de testosterona. Sólo la tercera parte de los pacientes que la han utilizado la encuentran inaceptable, pero no hay datos de eficacia clínica34.
Andrógenos 17α-alquiladosHasta los años setenta, estos compuestos eran utilizados en tratamiento sustitutivo para el hipogonadismo masculino por su administración oral y por evitar el primer paso hepático del metabolismo. Sin embargo, son necesarias dosis relativamente altas (159mg/ día) de metiltestosterona para obtener el efecto clínico. La fluoximesterona es igualmente efectiva y con dosis más bajas (20mg/día). Pero todos los andrógenos 17α-alquilados son hepatotóxicos, además de los efectos adversos en el perfil lipídico y el riesgo cardiovascular, y en muchos países ya no se comercializan.
Andrógenos por vía intramuscularPropionato de testosteronaEs un 17β-éster que se libera muy rápidamente desde la inyección depot, debido a su cadena lateral muy corta, y produce una alta concentración sérica de testosterona muy rápidamente. La administración intramuscular de 50mg produce una concentración máxima de testosterona suprafisiológica a la mitad del día, pero que cae a concentraciones por debajo del límite normal a los 2–3 días. Su vida media es de sólo 19h. Para el tratamiento sustitutivo a largo plazo precisa de 2 inyecciones semanales; por ello este preparado está en desuso.
Enantato y cipionato de testosterona (Testoviron Depot®, Testex Elmu Prolongatum®)Como la duración del efecto de los ésteres de testosterona depende de la longitud de la cadena lateral alifática esterificada en la posición 17β, el enantato de testosterona tiene vida media y duración del efecto mucho mayores que los del propionato de testosterona. Son las preparaciones de testosterona más utilizadas. Se tiene experiencia de más de 50 años y la función androgénica se restaura completamente.
En dosis de 200–250mg cada 2–3 semanas por vía intramuscular, produce adecuada sustitución a largo plazo, aunque 24–48h después de la inyección las concentraciones séricas de testosterona se hacen suprafisiológicas, lo que se sigue de un descenso exponencial a concentraciones infranormales antes de la siguiente inyección. Estas fluctuaciones en las concentraciones séricas de testosterona pueden producir cambios clínicos no deseados, por lo que, en individuos que se quejan de fluctuaciones en la respuesta, la dosis puede modificarse a 100mg cada 7–10 días202.
Undecanoato de testosterona (Reandron® o Nebido®)De reciente introducción en el mercado, se prepara en una formulación con base oleosa que proporciona una liberación de testosterona más estable y duradera a la circulación. Este preparado es de vida media más larga y mucho mayor duración del efecto que el enantato. La vida media después de la inyección intramuscular es de 50–60 días. Estudios farmacocinéticos34 han demostrado una acumulación significativa a intervalos de 6 semanas entre inyecciones, lo que indica que las concentraciones medias de testosterona aumentan significativamente en la primera semana después de una inyección intramuscular de 1.000mg. Después las concentraciones de testosterona disminuyen progresivamente y mantienen un nivel normalbajo durante unas 12 semanas, sin aparentes efectos secundarios. Así, sólo son necesarias 4 inyecciones intramusculares de undecanoato de testosterona por año para la sustitución a largo plazo34.
Andrógenos por vía subcutáneaImplantes de testosterona (pellets)Hasta el desarrollo de las preparaciones inyectables de testosterona, el procedimiento normal de sustitución era el implante subcutáneo de testosterona (pellets). De uso muy popular en Reino Unido y Australia, actualmente están en desuso en el resto del mundo. Los implantes subcutáneos de testosterona (100 o 200mg) son preparaciones cristalinas de testosterona que, con anestesia local e incisión de la piel, se colocan en el tejido adiposo subcutáneo del abdomen. Sólo un 3-5% de los pacientes experimentan efectos adversos locales. Tienen la más larga duración del efecto de todas las preparaciones de testosterona utilizadas. Proporciona concentraciones de testosterona constantes y dentro del límite normal. El implante dura alrededor de 6 meses, por lo que la mayoría de los pacientes necesita dos implantes anuales. Inmediatamente después de la implantación se producen concentraciones suprafisiológicas de testosterona durante 1–2 días, pero no mayores que la máxima producida por el enantato. Los valores en el límite alto de la normalidad permanecen durante 2 meses y luego retornan a concentraciones infranormales al sexto mes. Tiene el inconveniente de necesitarse un procedimiento quirúrgico menor, para su implante, el riesgo de infecciones (menos del 1%), la extrusión del implante (sobre el 8%) y la necesidad de quitarlo si surgen problemas con el tratamiento sustitutivo203.
19-nortestosterona y sus ésteresLa 19-nortestosterona, también conocida como nandrolona, se produce por el reemplazo de un grupo metilo del 10C por un átomo de hidrógeno. Este esteroide posee mayor efecto anabolizante y menor efecto androgénico. La 19-nortestosterona se une más fuertemente que la testosterona al receptor androgénico, pero esta unión es menos fuerte para la 19-nordihidrotestosterona que para la DHT natural. Por ello, los tejidos en que la testosterona tiene efecto directo (muscular y óseo) presentan mayor estimulación, mientras que los tejidos dependientes de la DHT (piel y próstata) no se estimulan tanto. Se ha estudiado estas diferentes propiedades del efecto selectivo de los distintos órganos usando el potente andrógeno sintético 7α-metil-19-nortestosterona (MENT)204. La MENT es 10 veces más potente que la testosterona en cuanto a efectos anabólicos (mantener la función muscular, renal y hepática, entre otras), antiandrógenos (supresión de LH/FSH) y de comportamiento (libido, etc.), pero sólo la mitad de efectiva en la próstata que la testosterona. La MENT es resistente a la enzima 5α-reductasa. Esto hace que no pueda ser reducida a dihidro-19- nortestosterona y el efecto selectivo de tejido sea más potente que el de la testosterona. Y además tiene poca potencia en bioanálisis en que la testosterona amplifica la actividad de 5α-reductasa, como la estimulación del tamaño de la próstata en animales castrados. Esto puede tener ventajas en el tratamiento a largo plazo. Pero, por el contrario, la MENT puede aromatizarse fácilmente a estradiol y podría por ello mantener la masa ósea, pero esto tiene que ser demostrado todavía. La MENT no se une a la proteína transportadora SHBG y por ello se elimina rápidamente de la circulación. Para su administración se usa el acetato de MENT; sus características de difusión son más convenientes para uso en implantes y dan posibilidades a una terapia a largo plazo. Pero también podría desarrollarse una preparación de MENT en gel. A la dosis empleada (2 implantes, cada uno con 115mg de acetato de MENT insertado subcutáneo en el brazo y retirado a las 6 semanas) no tiene efectos tóxicos. Los resultados de un ensayo experimental en humanos demuestran que la MENT tiene efectos similares en las esferas sexual y psicológica que la testosterona en los varones hipogonadales. La MENT podría llegar a ser el primer modulador selectivo del receptor androgénico (SARM). Así, las MENT tendrían un efecto androgénico beneficioso en la musculatura, el hueso, la psique (libido) y otros tejidos diana que dependen de la testosterona, mientras que evitarían los potenciales efectos adversos en la próstata (crecimiento, proliferación celular) y la piel (acné). Todo esto hace que la evaluación de las MENT para uso en la inhibición de la fertilidad masculina (anticoncepción) y en el HIT sea particularmente interesante. Además, la existencia de 2 tipos de receptores androgénicos (AR-A y AR-B), con diferente distribución en los tejidos, podría contribuir al desarrollo de los SARM.
Andrógenos por vía transdérmicaTestosterona en parches (Testoderm®, Androderm®, Testoderm TTS®)El desarrollo de preparados transdérmicos de testosterona se produce a finales de los años ochenta y supuso un importante avance en la terapia androgénica. El primer parche del mercado (Testoderm®) se aplicaba en la región escrotal para permitir una adecuada absorción. A las 4–8h de su aplicación consigue alcanzar en suero concentraciones de testosterona en la zona media del límite normal y las mantiene durante 24h. Estas concentraciones fisiológicas se mantienen bastante estables y son mejores que las fluctuaciones no fisiológicas de los ésteres inyectables. La respuesta clínica es buena, pero tiene el inconveniente de que el lugar de aplicación es inaceptable para muchos varones, y en algunos con hipogonadismo prepuberal, el área escrotal es pequeña para la dimensión del parche. La piel escrotal posee altas concentraciones de 5α-reductasa, y se producen concentraciones elevadas de DHT. Su aplicación es diaria y el preparado es caro.
Posteriormente han aparecido parches de aplicación no escrotal, en los que la liberación transdérmica de testosterona se produce por un sistema de reservorio que contiene la testosterona en una base de alcohol (Androderm®). Cada parche contiene 12,2mg de testosterona en una preparación alcohólica; con un área de liberación de 7,5cm2, que libera 2,5mg de testosterona al día. Existe otra preparación de 5mg. Tiene la ventaja de producir concentraciones de testosterona, testosterona biodisponible, DHT y estradiol dentro de concentraciones fisiológicas y con patrón circadiano, en varones hipogonadales de cualquier edad. Los sitios preferentes de aplicación de mayor a menor absorción son: espalda, muslos, brazo y abdomen. Pero tiene el inconveniente de que produce irritación de la piel en un 10-30% de los pacientes. La previa aplicación de cremas de corticoides mejora el prurito y el eritema, pero obliga al 10% de los sujetos a dejar el tratamiento.
Existen otras formulaciones transdérmicas (Testoderm TTS®), con una superficie de aplicación amplia pero sin reservorio, que producen menos irritación de la piel. La liberación de testosterona y su acción androgénica son buenas, tanto en jóvenes hipogonadales como en mayores con hipogonadismo relativo. Pero estos parches no siempre se adhieren bien a la piel, sobre todo con el ejercicio intenso, tienen poca flexibilidad en cuanto a la dosificación y son caros.
Testosterona en gel (Androgel®, Testogel®, Testim®)Es un sistema abierto de aplicación dérmica de testosterona. Se aplica a la piel en una solución de gel hidroalcohólico. El gel se seca rápidamente y el esteroide se absorbe en el estrato córneo, que sirve de reservorio; de ahí se libera a la circulación lentamente en varias horas manteniendo concentraciones constantes. A los 30min de la aplicación aumenta la concentración de testosterona en suero y se obtiene concentraciones constantes a las 18–24h. La biodisponibilidad es de un 9-14% de la dosis aplicada. La aplicación de 100mg/día en un solo sitio o en cuatro sitios separados de la piel produce concentraciones de testosterona en el límite alto de la normalidad, con un 23% más cuando se aplica en cuatro zonas distintas. La farmacocinética muestra un aumento de estradiol. Las concentraciones de DHT están aumentadas, pero la relación DHT/T aumenta muy poco. Estudios con aplicación de testosterona en gel durante 2 años han demostrado que mejora la función sexual y psicológica, aumenta la masa magra y la fuerza muscular y disminuye la masa grasa de los varones hipogonadales de cualquier edad205. El gel se tolera mejor y produce menos irritación de la piel, con lo que se producen menos abandonos del tratamiento. Tiene mayor flexibilidad en la dosificación. Como inconvenientes, muestra un aumento discreto del hematocrito, dependiente de la dosis, y aumento de los concentraciones de PSA, pero siempre dentro de límites normales. No se han observado cambios en el perfil lipídico. Es caro.
Dihidrotestosterona en gelLa DHT en gel está disponible en 25 y 50mg DHT/g, se emplea a la dosis de 125–250mg/día y produce concentraciones de DHT dentro del límite fisiológico. En varones mayores sanos, se producen concentraciones fisiológicas con dosis menores (32- 64mg/día). La DHT no se aromatiza a estradiol. Esto supone efectos beneficiosos en las mamas, al no producirse ginecomastia, y en la próstata, donde los estrógenos estimulan la proliferación de la estroma. Por el contrario, probablemente sea inactiva en los huesos.
Miembros del grupo de trabajo de la SEEN Endocrinología de la Sexualidad: Julián José Alcañiz Ferrando, Rafael Barril Vicente, Benito Blanco Samper, José Enrique Campillo Álvarez, Aniceto Charro Salgado, Enrique Costilla Martín, Daniel Antonio de Luis Román, José Ángel Díaz Pérez, Marcelino Gómez Balaguer, Federico Hawkins Carranza, Cecilia Liñán Pagés, Inmaculada Moraga Guerrero, Jesús Pérez Luis, Gonzalo Piédrola Maroto, Osvaldo Rajmil i Marqueson, Adela Rovira Loscos, Concepción Sanabria Pérez, Daniel Sola López, M. Elena Torres Vela, Francisco Javier Tébar Massó y Fernando Villamil Fernández.