La angiografía es la técnica de referencia para el diagnóstico de la enfermedad arterial coronaria. Sin embargo, la mayoría de los síndromes coronarios agudos involucran lesiones angiográficamente no significativas. Es también la técnica de elección para guiar la implantación de prótesis endovasculares y su seguimiento. La tomografía de coherencia óptica es una técnica de imagen interferométrica que penetra en los tejidos alrededor de 2-3mm y ofrece una alta resolución axial. Es capaz de distinguir diferentes tipos de tejido, como fibroso, lipídico, necrótico o calcificado, reconoce características de las placas de ateroma que se han asociado con progresión rápida de la lesión y eventos clínicos adversos, como la delgada capa de fibroateroma, el espesor de la capa fibrosa, la infiltración de macrófagos y la formación de trombos. En la actualidad, existe un creciente interés en el valor de la tomografía de coherencia óptica en el área de intervención coronaria, donde la técnica ofrece ventajas significativas sobre las técnicas intravasculares de diagnóstico convencionales, como la ecografía intravascular. Su alta resolución permite reconocer las complicaciones periprocedimiento, como microdisección, malaposición e hiperplasia neointimal, haciendo de esta herramienta una de las técnicas más prometedoras en el diagnóstico intravascular.
Coronary angiography is the reference technique for the diagnosis of coronary disease. However, the majority of acute coronary syndromes involve angiographically non-significant lesions. It is also the technique of choice for guiding the implantation of endovascular prostheses and their later monitoring. Optical coherence tomography is an interferometric imaging technique that penetrates tissue approximately 2-3mm and provides axial and lateral resolution. It is able to distinguish different tissue types, such as fibrous, lipid-rich, necrotic, or calcified tissue. Optical coherence tomography is able to recognize a variety of features of atherosclerotic plaques that have been associated with rapid lesion progression and clinical events, such as thin cap fibroatheroma, fibrous cap thickness, dense macrophage infiltration, and thrombus formation. Currently, there is growing interest in the value of optical coherence tomography in the area of coronary intervention, where the technique offers significant advantages over more widespread intravascular diagnostic techniques such as intravascular ultrasound. Its higher resolution permits to recognize periprocedural complications, such as microdissection of the coronary artery, stent malapposition, and neointimal hiperplasia, making this tool one of the most promising techniques in the intravascular diagnosis.
La tomografía de coherencia óptica (TCO) es una técnica de imagen cardiovascular invasiva novedosa que utiliza luz para la realización de imágenes de secciones transversales del vaso. Esta técnica ofrece mayor resolución que cualquier otro procedimiento de imagen intravascular, hasta la fecha. El desarrollo de esta tecnología permitió en un principio el estudio de la placa aterosclerótica intracoronaria con una resolución mucho mayor que la que proporciona el ultrasonido intravascular (UIV), logrando identificar las características y contenido de la placa, y su alta concentración de lípidos, macrófagos o calcio.
Durante los últimos años, se ha mostrado su utilidad en otros aspectos de la enfermedad aterosclerótica y el intervencionismo coronario, como la medición precisa del diámetro del vaso, la caracterización del trombo, la ruptura de la placa, las disecciones coronarias, las mediciones de la neoíntima y la hiperplasia intimal dentro de los stents, así como servir de guía en el intervencionismo para la adecuada implantación de los stents.
El objetivo de este trabajo es realizar una revisión acerca de los aspectos técnicos para la formación de imágenes mediante TCO, su utilización en la caracterización de la placa intracoronaria y las diferentes aplicaciones en el intervencionismo coronario.
Principios técnicos y métodos de adquisiciónEl principio básico y fundamental de la TCO es la reflectometría de coherencia baja que utiliza un interferómetro y una fuente de luz de banda ancha con un espectro cercano al de la luz infrarroja. Esto es debido a que la velocidad de la luz (3×108m/s) es mucho más rápida que la del sonido, por lo que requiere de la utilización de técnicas de interferometría, que divide la señal en 2 brazos, el de referencia y otro brazo de muestra, para posteriormente acoplar ambos brazos en un detector (interferómetro). La longitud de onda de la luz tiene un rango de 1.250 a 1.350nm para minimizar la absorción de la luz por parte de los tejidos. La TCO tiene una resolución espacial de 10-18μm, lo que es equivalente a 10 veces la resolución que ofrece el UIV (150-200μm) a expensas de una menor penetración en el tejido (1.5-2mm para TCO frente a 4-8mm para UIV).
La imagen es formada por una reflexión retrodispersa de la luz emitida por un hilo de fibra óptica que tiene un grosor de 0,014 pulgadas, que viaja al tejido y produce un eco de la luz hacia la sonda, que es medible como intensidad de señal o magnitud. La fuente de luz es una guía de fibra óptica que gira de forma rotacional obteniendo múltiples cortes axiales (líneas A) para crear un imagen completa de una sección transversal del vaso.
Esta reflexión retrodispersa puede ser más fácilmente comprendida como la radiación que es emitida o reflejada del tejido analizado hacia la sonda, que es interpretada en la imagen como el brillo característico de los diferentes componentes del tejido. Por otra parte, se debe entender por atenuación la capacidad de penetración de la radiación de luz en los diferentes componentes del tejido. De esta manera, las lesiones coronarias caracterizadas por fibrosis, lípidos, calcio y macrófagos tendrán una diferente atenuación y reflexión retrodispersa.
Los primeros equipos de TCO se basaban en time domain-optical coherence tomography (TD-OCT, «tomografía de dominio de tiempo»), que consiste en un espejo que se mueve a distancias calibradas produciendo retrasos en el eco conocido, imagen que se acopla al eco proveniente del tejido en la fibra óptica. Ahora, las nuevas generaciones de TCO intravascular tienen una mayor velocidad para la adquisición de las imágenes gracias a que utilizan un espejo fijo con una fuente de luz de longitud de onda variable; este método se conoce como frequency o Fourier domain-optical coherence tomography (FD-OCT, «TCO de dominio de frecuencia»). La sangre no es un medio transparente y refleja la luz, por tanto, para obtener imágenes intracoronarias con TCO es necesario eliminar temporalmente la sangre de dentro del vaso. Con los primeros equipos TD-OCT, la velocidad del pullback era de 1-3mm/s y, por tanto, para eliminar la sangre durante el tiempo necesario para la adquisición de las imágenes se requería la oclusión proximal del vaso con un balón junto a la inyección de suero salino a nivel distal. Con los nuevos equipos de FD-OCT, la velocidad del pullback se ha incrementado hasta los 20mm/s. Esto permite adquirir las imágenes de TCO de forma rápida durante inyecciones cortas de contraste a través del catéter guía, similares a las que se realizan para obtener las imágenes angiográficas. Con esta velocidad de adquisición se logra la revisión de segmentos de 4 a 6cm de longitud de arterias epicárdicas en menos de 5s1–4.
Para la adquisición de las imágenes es necesario el adecuado posicionamiento en la arteria coronaria mediante catéter guía, el equipo de segunda generación FD-OCT disponible actualmente para uso clínico (LightLab® C7-XR, LightLab Imaging Inc., Westford, MA, EE. UU.), y el catéter de intercambio rápido (LightLab® C7 DragonFly™, Westford, MA, EE. UU.) que puede ser introducido en la arteria coronaria mediante guías coronarias convencionales de 0,014 pulgadas. Las arterias epicárdicas que sean estudiadas preferentemente deben tener un diámetro entre 2.0 y 3.75mm, no tener tortuosidad importante ni curvas mayores de 90 grados. La TCO es un estudio seguro y confiable. Con los sistemas iniciales de pullback lento era frecuente que los pacientes presentaran dolor torácico y ocasionalmente cambios en el segmento ST. Sin embargo, esto prácticamente ha desaparecido con los nuevos sistemas que permiten realizar la adquisición en pocos segundos5.
Aplicaciones clínicasTomografía de coherencia óptica y aterosclerosis intracoronariaAntiguamente, el estudio de la aterosclerosis coronaria se lograba mediante estudios angiográficos, que como bien se sabe, tienen serias limitaciones por la resolución de las imágenes, y una alta variabilidad interobservador e intraobservador. Sin embargo, técnicas invasivas han logrado el estudio de estadios tempranos de la aterosclerosis coronaria. Tal es el caso del UIV. No obstante, esta técnica también tiene limitaciones para distinguir los diferentes componentes de la placa y no permite visualizar aquellas posteriores a lesiones con alto contenido de calcio.
Caracterización de la placa y placa de alto riesgoCon la aparición de la TCO es posible la medición directa in vivo de la capa intimal y su engrosamiento, que es considerado como una etapa temprana de la aterosclerosis coronaria y disfunción endotelial6.
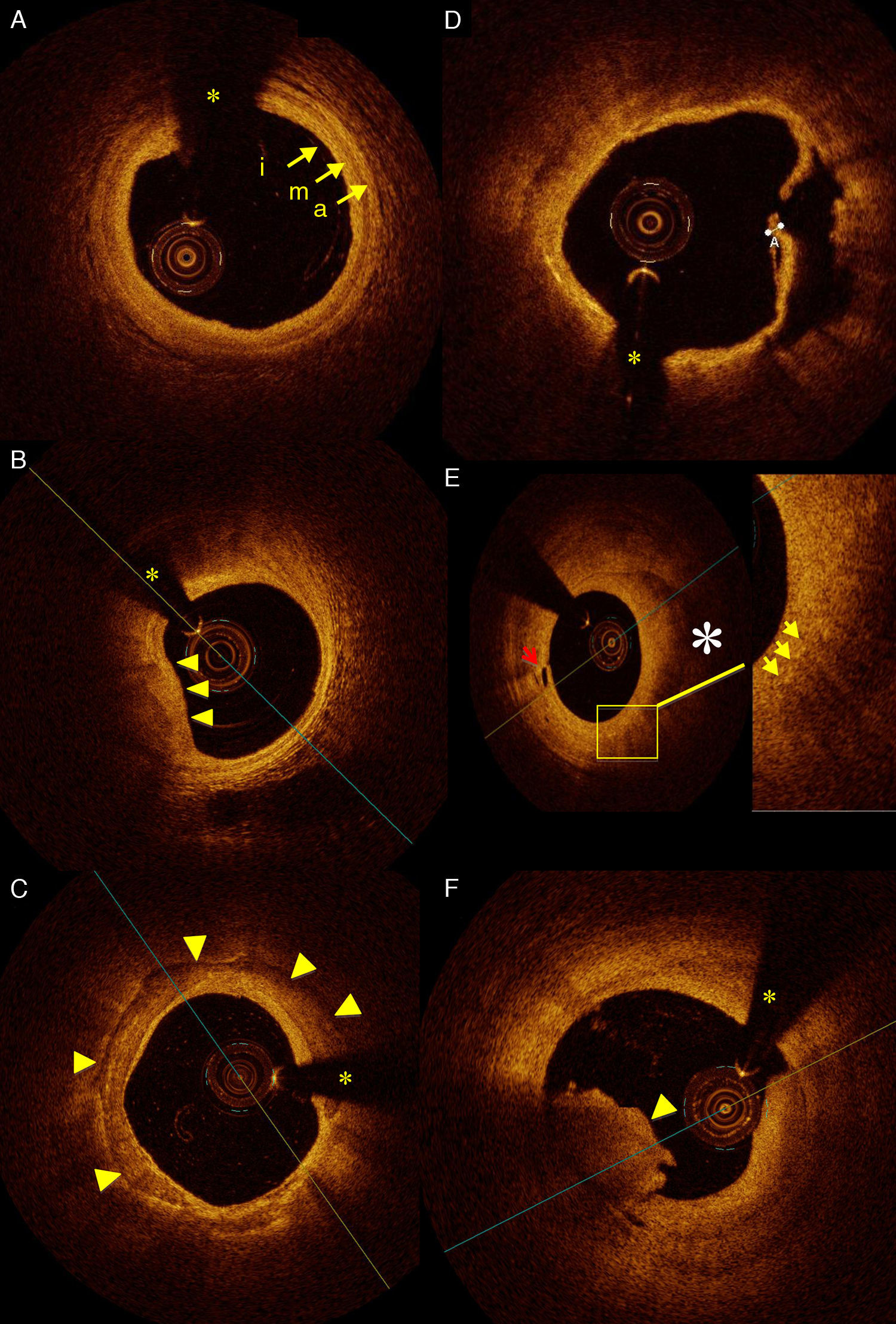
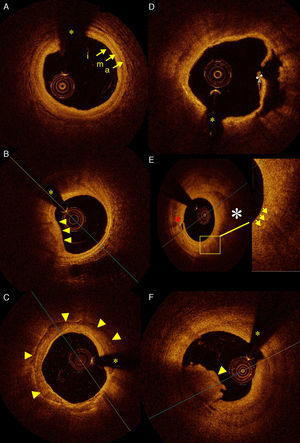
En diferentes estudios se ha logrado determinar la composición de la placa de ateroma mediante TCO, clasificándolas en lesiones fibrosas, fibrosas calcificadas y ricas en contenido lipídico. Las placas fibrosas muestran imágenes que son placas homogéneas y de alta intensidad. Las fibrosas calcificadas son lesiones con bordes nítidos y de baja intensidad. Y, finalmente, las lesiones con alto contenido de lípidos muestran imágenes con bordes difusos y con baja intensidad de señal (fig. 1 A-C). La determinación mediante TCO de este tipo de lesiones comparada con histología y UIV tiene una alta sensibilidad y especificidad7–9. Como toda técnica de imagen en la que se involucra un observador, existe cierta variabilidad en el momento de distinguir entre lesiones fibrosas con calcio y lesiones que son ricas en lípidos. Para eliminar esa variabilidad dependiente del observador, hay en marcha estudios orientados a realizar un análisis cuantitativo del tipo de tejido de la placa utilizando distintos parámetros como, por ejemplo, el coeficiente de atenuación. Un estudio reciente ha demostrado que las lesiones con núcleo necrótico e infiltración de macrófagos tienen una fuerte atenuación (μt>10mm−1), mientras las lesiones fibrosas y calcificadas tienen una atenuación ligera (μt 2-5mm−1)10,11. La determinación de la composición de las lesiones mediante la TCO tiene relevancia clínica ya que el dilucidar el material de la placa (alto contenido de calcio con poca distensibilidad o lesiones con alto contenido necrótico con tendencia a la ruptura) puede guiar al cardiólogo intervencionista en la toma de decisiones en el momento de tratar dichas lesiones.
A) Imagen de TCO intracoronaria que muestra un segmento de arteria coronaria donde se pueden determinar con claridad las 3 capas vasculares: intima (i), media (m) y adventicia (a). B) Placa lipídica (flechas) con bordes difusos y mal definidos. C) Arteria coronaria derecha con gran placa de calcio (flechas) con bordes nítidos. (*) Sombra de la guía intracoronaria. D) Placa rota en un paciente con síndrome coronario agudo con elevación del segmento ST; se observa la placa rota (grosor de 13μm) y la úlcera después de vaciar su contenido lipídico. E) Placa lipídica (*) que se aprecia con bordes mal definidos. La flecha roja muestra los vasos vasorum. La placa lipídica muestra pequeños puntos (flechas amarillas) con ausencia de señal posterior, que dejan sombra y que pueden corresponder al alto contenido de células inflamatorias (macrófagos) en la placa lipídica. F) Estructura de bordes irregulares que protruye en la luz y con sombra posterior correspondiente a trombo intracoronario (flecha).
El estudio de la placa vulnerable y los factores que predisponen a su ruptura y subsiguiente trombogénesis es esencial para la evaluación de los síndromes coronarios, ya que cerca del 80% de ellos se producen por la ruptura de la placa que se ha considerado de mayor riesgo, el fibroateroma de cápsula fibrosa fina. Este tipo de placas se caracteriza por presentar un núcleo necrótico-lipídico que está recubierto por una fina capa fibrótica, caracterizada por infiltración de macrófagos (fig. 1 E). La TCO es un método prometedor para la detección de este tipo de placas porque gracias a su alta resolución permite medir el grosor de la cápsula fibrosa, que es uno de los principales factores implicados en la tendencia de la placa a romperse (fig. 1 D). Como ejemplo de la aplicación de la TCO en este aspecto, en un reciente estudio de Tanaka et al.12 se demostró que el grosor de la cápsula fibrosa en la zona de la ruptura de la placa era mayor en los infartos agudos de miocardio producidos en situación de esfuerzo que en los que se produjeron en reposo.
Además, algunos datos indican que la TCO sería también capaz de detectar la presencia de acúmulos de macrófagos, otro aspecto implicado en la vulnerabilidad de la placa.
Además de las características y composición de la placa, la TCO puede ser de gran utilidad en pacientes con síndrome coronario agudo, ya que permite detectar con gran precisión la presencia de placas rotas y de trombo intracoronario. Kubo et al.13 compararon 3 modalidades de estudios invasivos de imagen cardiovascular, la TCO, el UIV y la angioscopia, para el estudio de la lesión culpable en paciente con infarto agudo de miocardio, y reportaron una incidencia de ruptura de placa del 73, 40 y 47%, respectivamente, demostrando la superioridad de la TCO sobre otras técnicas invasivas para la detección de este tipo de lesión. Respecto al trombo, en TCO se observa como una imagen hiperintensa, irregular, que protruye la luz vascular, de bordes nítidos y que produce distinta atenuación dependiendo de su composición. El trombo blanco, es decir, aquel rico en plaquetas, presenta una menor atenuación y no se observa sombra posterior, ya que permite el paso de luz, lo que deja ver con claridad la pared vascular. Por otra parte, el trombo rojo, rico en hematíes, tiene una mayor atenuación y no permite el paso de luz, con lo que se produce una sombra posterior al trombo que imposibilita la visualización de la pared vascular14,15 (fig. 1 F). La TCO es una técnica muy sensible para la detección de trombo. En el trabajo de Kubo et al. en pacientes con infarto agudo de miocardio mencionado previamente, la TCO fue capaz de detectar trombo en el 100% de los pacientes, mientras que con UIV solo se detectó en el 33%. Una vez determinada la presencia de trombo, la TCO también podría ser útil guiando el intervencionismo en los síndromes coronarios agudos para la adecuada aspiración de trombo previa a la implantación del stent.
Tomografía de coherencia óptica en el intervencionismo coronarioEn el intervencionismo coronario, la TCO tiene un papel cada vez más importante, ofreciendo información acerca del adecuado posicionamiento del stent tras la implantación y para el estudio de la restenosis o trombosis del mismo. La alta resolución de imagen de la TCO ha aportado también información en el seguimiento de pacientes posterior a un intervencionismo, ya que es capaz de detectar finas capas de tejido de recubrimiento en los stents.
Optimización en la implantación de stentLa TCO puede ser utilizada tras la implantación del stent para evaluar su adecuada aposición a la pared y para obtener información acerca del daño vascular causado por el implante.
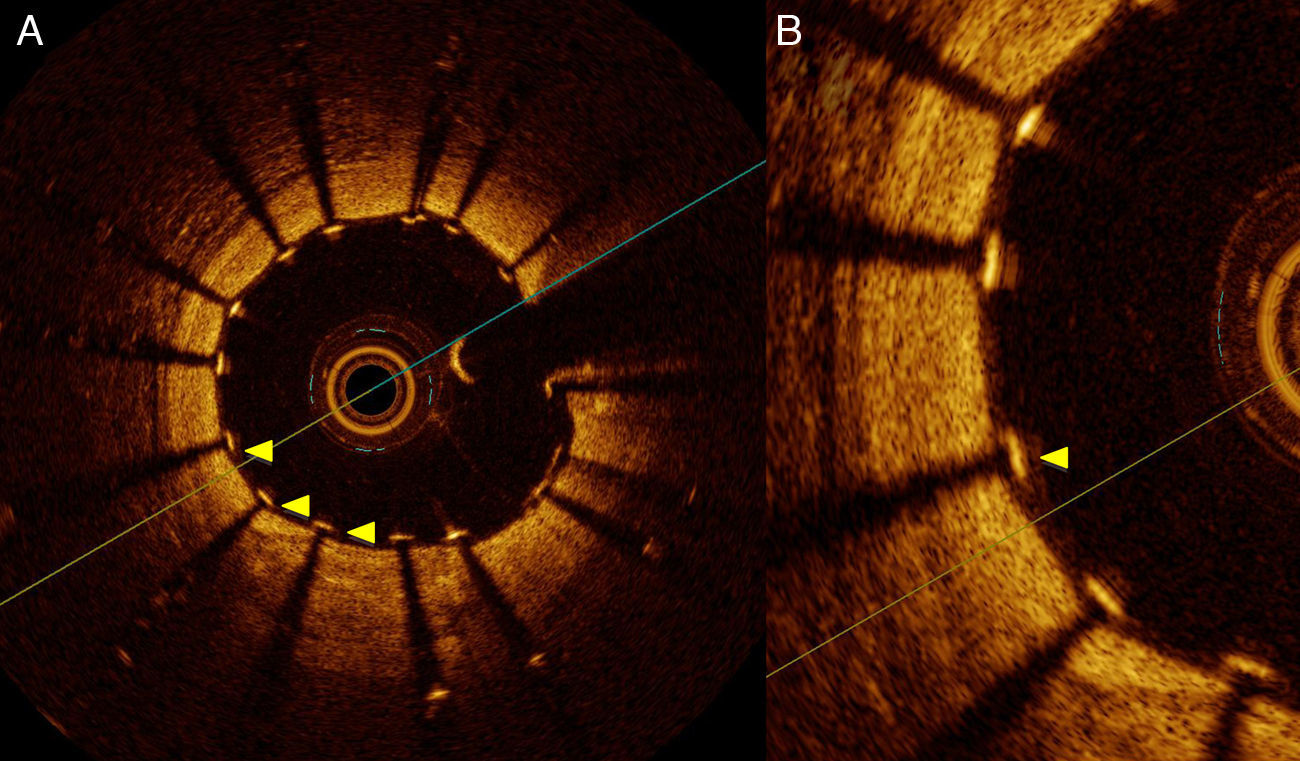
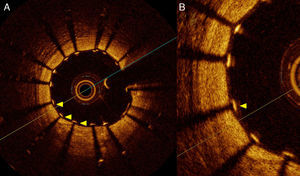
La gran resolución axial de la TCO permite evaluar la aposición del stent a la pared del vaso con gran detalle. Los soportes (struts) del stent se identifican en la TCO como estructuras de alta reflectividad con sombra posterior (fig. 2). La TCO muestra solo la superficie endoluminal del strut debido a la limitada penetración de la luz a través del metal. En los stents farmacoactivos tanto el strut como el polímero deben tenerse en cuenta para evaluar la aposición en cada tipo de stent. Se considera que existe malaposición solo si la distancia desde la superficie endoluminal del strut hasta la pared del vaso es mayor que la suma del metal y el polímero para cada tipo específico de stent. La gran sensibilidad de esta técnica hace que sea posible detectar pequeños grados de malaposición que, de hecho, son muy frecuentes después de la implantación del stent, y cuyo significado clínico no está actualmente establecido (fig. 3).
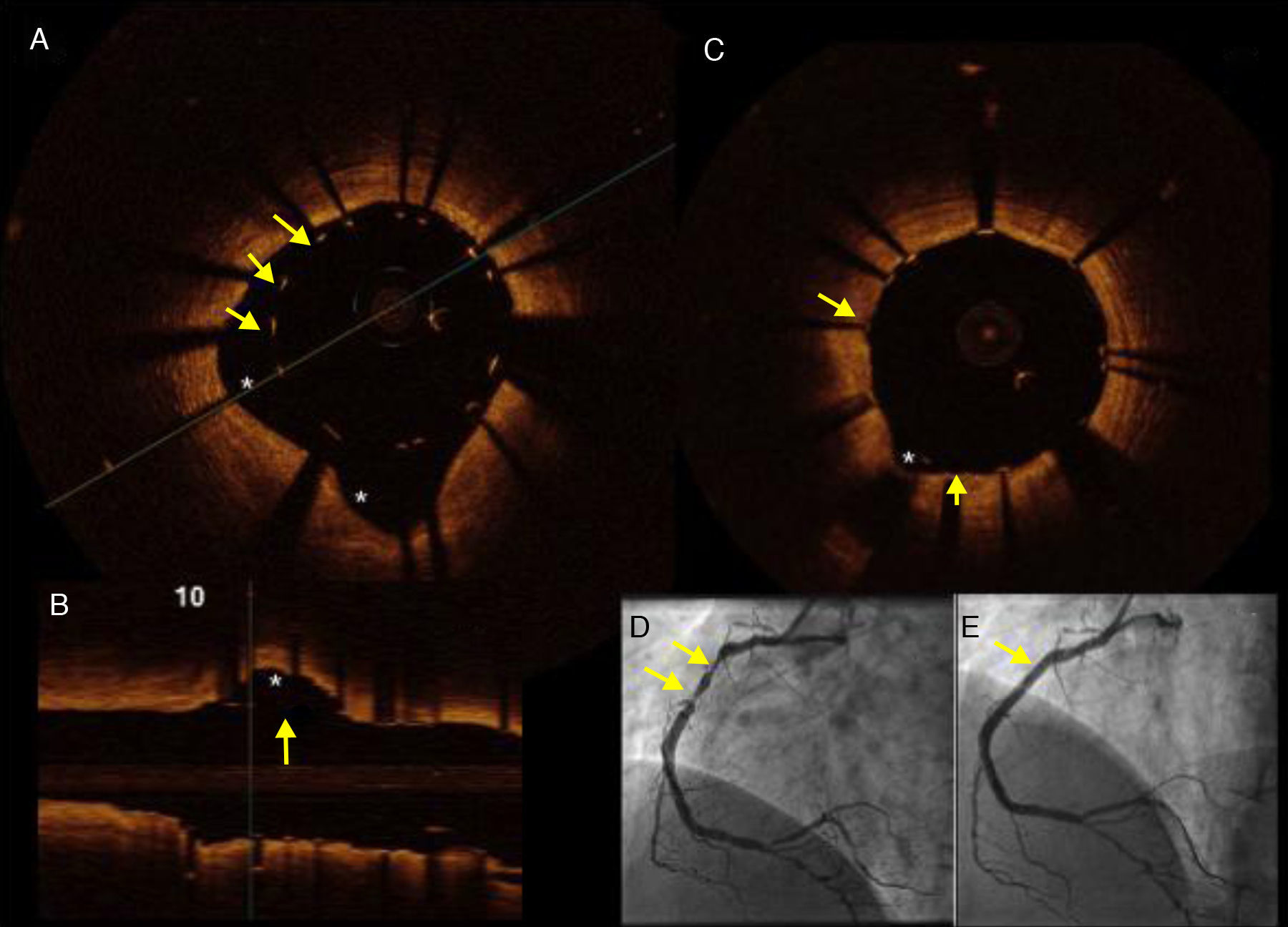
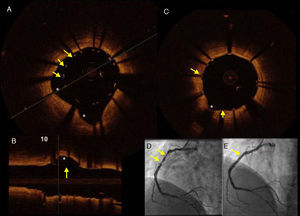
Hombre de 45 años, dislipidémico y fumador, con un infarto de miocardio con elevación del segmento ST de localización inferior. A) Imagen de TCO en la que se muestran los soportes (struts) del stent implantado (flechas) con una clara zona de malaposición debido a ectasia de la coronaria derecha (*). B) Imagen de TCO, en un eje longitudinal, que muestra la zona de malaposición (flecha) y la zona aneurismática (*). C) Imagen de TCO que muestra el resultado final posterior a posdilatación con balón del stent en la CD. D) Imagen angiográfica en donde se muestran (flechas) las zonas de ectasia y estenosis severa, responsables del síndrome coronario agudo. E) Resultado angiográfico final.
Respecto al daño vascular, la implantación del stent siempre produce efectos en la pared que se pueden clasificar en: i) prolapso de tejido: la protrusión de tejido entre soportes (struts) adyacentes sin ruptura de la superficie luminal; ii) disección intra-stent: se define como la ruptura o discontinuidad de la superficie luminal en el segmento intra-stent; iii) disección del borde: se define como la ruptura o discontinuidad de la superficie luminal en los bordes del stent16–18.
Diversos estudios han demostrado que la TCO es más sensible que el UIV para la detección de estos fenómenos19. Debido a la alta resolución de la técnica, la incidencia de estos efectos tras la implantación de stents es muy alta, pero su significado clínico o pronóstico no está establecido. En estudios en animales el daño vascular se ha relacionado con la probabilidad de restenosis, pero este aspecto no ha sido estudiado todavía en humanos con TCO.
Trombosis y restenosis del stentTrombosisLa trombosis del stent es una de las complicaciones más graves que pueden ocurrir después de la implantación del mismo. Como se ha estudiado con anterioridad, existen múltiples factores que predisponen a la trombosis. Sin ser objetivo de este trabajo, simplemente mencionaremos que dentro de esas múltiples causas se encuentran la malaposición del stent y la falta de recubrimiento del mismo por tejido endotelial. Si bien existen algunos métodos como el UIV, que puede, con mayor precisión que la angiografía, detectar sitios de malaposición, la TCO ofrece una resolución absolutamente mayor para definir la posición precisa de los soportes (struts) del stent y puede detectar grados de malaposición no visibles con otras técnicas. Por otro lado, la TCO permite visualizar tejido de recubrimiento en el stent incluso cuando este consiste en capas muy finas, como ocurre habitualmente con los stents farmacoactivos. Es importante, sin embargo, tener en cuenta que la TCO no es capaz de detectar una capa única de células endoteliales y que no puede distinguir si el tejido que recubre el stent es endotelio funcionante. En todo caso, en este momento es la mejor técnica de la que disponemos para el estudio in vivo del recubrimiento del stent. La TCO es también útil para detectar infraexpansión del stent, otro de los aspectos que se han implicado en las trombosis del mismo, especialmente las subagudas. Por tanto, es una técnica que puede proporcionar información relevante sobre las causas que llevaron a la trombosis. Esto puede tener además influencia en el tratamiento, por ejemplo en la decisión sobre el mantenimiento prolongado de la doble terapia antiplaquetaria20–22.
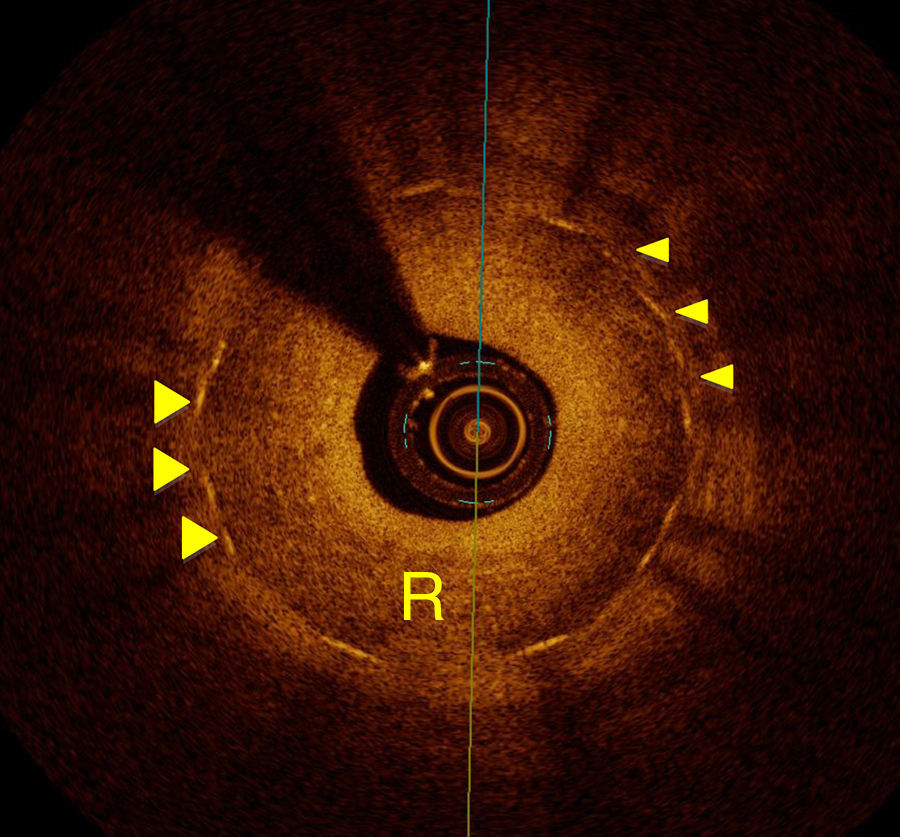
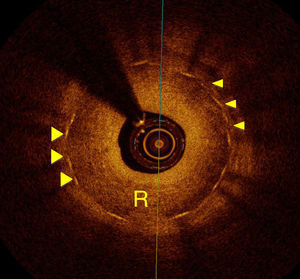
RestenosisLa restenosis ha sido el talón de Aquiles del intervencionismo coronario desde la aparición de los stent metálicos hasta los farmacoactivos. Aunque con el advenimiento de estos últimos las tasas de restenosis han sido tan bajas como del 10%22, continúa siendo el principal motivo de la reaparición de síntomas después de la implantación de los stents. Nuevamente, el ultrasonido intracoronario ha tratado de establecer las bases en el reconocimiento de las causas y fisiopatología de la restenosis intra-stent. La TCO ha aportado nueva información en este campo, ya que las imágenes de alta resolución no solo permiten la medición exacta del tejido restenótico, sino que han revelado nuevos aspectos respecto a sus características morfológicas. Gonzalo et al.17 estudiaron a 24 pacientes (25 vasos) que presentaban datos angiográficos de restenosis intra-stent mediante análisis cuantitativo de TCO, midiendo la luz y área del stent calculando así el área de tejido restenótico. En este estudio se pudieron identificar distintos patrones de tejido restenótico (en capas, homogéneo y heterogéneo). Se logró también la visualización de microvasos de neoformación en el 12% de los casos y se pudo relacionar la forma de presentación clínica con la forma del lumen (regular o irregular) y con la presencia de material intraluminal. Además del estudio del tejido restenótico, la TCO puede proporcionar datos sobre la causa de la restenosis (por ejemplo, infraexpansión del stent, fracturas, gaps, etcétera), aspectos que pueden ser importantes para determinar la estrategia de tratamiento (fig. 4).
Evaluación de la severidad de la lesiónLa reserva fraccional de flujo (FFR) es el estándar actualmente para valorar la severidad de una estenosis coronaria, pero hay ocasiones en las que no se puede aplicar (por ejemplo, contraindicación para el uso de adenosina). Por tanto, en ocasiones puede ser necesario utilizar una técnica de imagen intracoronaria para decidir sobre la necesidad de tratamiento de una estenosis. Diversos estudios han evaluado la utilidad del UIV para determinar la severidad de la estenosis utilizando la FFR como estándar de referencia, y basados en sus datos, durante mucho tiempo se ha utilizado el punto de corte de<4mm2 para considerar que una estenosis era severa. La TCO permite visualizar de forma muy nítida el límite entre la pared del vaso y el lumen y, por tanto, permite medir el área luminal de forma muy precisa y reproducible23. Es importante tener en cuenta que no se pueden aplicar de forma directa los puntos de corte utilizados habitualmente en UIV a la TCO porque diversos estudios han puesto de relevancia que existen diferencias entre las mediciones del lumen realizadas con una y otra técnica. En un trabajo realizado por nuestro grupo, la TCO demostró una eficiencia diagnóstica moderada para detectar estenosis significativas por la FFR, con un punto de corte óptimo muy por debajo del establecido hasta ahora para UIV24,25. Estos puntos de corte, sin embargo, deberían ser adaptados según el tamaño del vaso y la masa de miocardio viable distal a la estenosis, por lo que la investigación sigue en marcha en este aspecto.
La TCO proporciona mediciones muy precisas del lumen y esto se puede utilizar para orientar al intervencionista acerca de la elección del stent, ya que diámetros más grandes del tamaño del lumen pueden complicar el procedimiento, produciendo mayor riesgo de disección del borde, al igual que diámetros menores están relacionados con malaposición de los soportes (struts).
ConclusionesLa TCO es una técnica de imagen intravascular invasiva novedosa cuya utilización se está extendiendo cada vez a más laboratorios de hemodinámica alrededor del mundo. La introducción de los nuevos sistemas capaces de realizar pullbacks a alta velocidad ha simplificado mucho el uso de la técnica, haciéndola aplicable en la práctica diaria. La TCO proporciona un estudio detallado de la aterosclerosis coronaria, permitiendo identificar placas con características de alto riesgo. Durante el intervencionismo, esta técnica aporta información cuantitativa sobre las características de la estenosis y permite evaluar el resultado de la implantación del stent de forma inmediata y a largo plazo. Asimismo, puede ayudar a esclarecer las complicaciones más importantes de la revascularización percutánea con stent, como son la restenosis y la trombosis.
Sin duda aún hacen falta estudios que ayuden a explotar todo el potencial de esta técnica y a determinar su valor clínico. Sin embargo, su futuro parece prometedor para ayudar al cardiólogo intervencionista en la toma de decisiones sobre la necesidad de revascularización y la estrategia y resultados de la misma.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.