Los mixomas son los tumores cardiacos primarios más frecuentes, con una incidencia estimada de 0,5-1 por 106 individuos por año. Estos tumores han generado interés debido a su peculiar localización (el lado izquierdo del septum auricular cerca de la fossa ovalis), su presentación clínica variable y su histogénesis que aun no ha sido definida. La mayoría de los mixomas cardiacos son esporádicos mientras que aproximadamente el 10% de los casos forman parte del complejo de Carney. Esta neoplasia es de histogénesis incierta, sin embargo, se ha propuesto diferenciación endotelial, neurogénica, fibroblástica, muscular lisa, muscular cardiaca y raramente puede presentar diferenciación glandular. Recientemente, por la expresión de algunos factores específicos cardiomiogénicos, se ha propuesto un origen en células progenitoras mesenquimatosas cardiomiocíticas. Histológicamente los mixomas cardiacos están compuestos por células estelares fusiformes y poligonales inmersas en una matriz mixoide amorfa. Por inmunohistoquímica algunos marcadores endoteliales están presentes como el CD31, CD34 y FVIIIAg. Ha sido también informada positividad a la proteína S-100, calretinina, vimentina, desmina, miosina de músculo liso, CD56, α1-antitripsina, y α1-antiquimiotripsina. La resección quirúrgica es actualmente el único tratamiento. Presentamos en este artículo una revisión histopatológica e inmunohistoquímica de los mixomas cardiacos.
Mixomas are the most common primary cardiac tumors with an estimate incidence of 0,5-1 per 106 individuals per year. These tumors have generated interest due to their unique location (left side of the atrial septum near the fossa ovalis), variable clinical presentation and undefined histogenesis. Most cardiac myxomas occur sporadically while approximately 10% of diagnosed cases develop as part of Carney complex. This neoplasm is of uncertain histogenesis, however, endothelial, neurogenic, fibroblastic, and cardiac and smooth muscle cells differentiation has been proposed, and rarely glandular differentiation has been observed. Recently, due to the expression of certain cardiomyocyte-specific factors, an origin of mesenchymal cardiomyocytes progenitor cells has been suggested. Histologically cardiac myxomas are mainly composed of stellated, fusiform and polygonal cells, immersed in an amorphous myxoid matrix. Immunohistochemically some endothelial markers, such as CD31, CD34, FVIIIAg, are present. Positive staining has also been reported for S-100 protein, calretinin, vimentin, desmin, smooth muscle myosin, CD56, α1 antitrypsin and α 1antichymotrypsin. Surgical resection is currently the only treatment of choice. We present in this article a histopathological and immunohistochemical review of cardiac myxomas.
De todos los tumores humanos los cardiacos representan el 0.2% y pueden ser primarios o metastásicos (secundarios), siendo estos últimos 20 a 40 veces más comunes que los primarios. De los tumores primarios, el 75% son benignos y aproximadamente un 50-85% de estos corresponden a mixomas, con una incidencia de 0.5-1 por 106 individuos por año1–3.
Los mixomas cardiacos (MC) se desarrollan en cualquiera de las cavidades cardiacas, pero hasta el 90% de ellos están localizados en la aurícula izquierda, adheridos principalmente al tabique interauricular cerca de la fossa ovalis3. Raramente han sido descritos en la aorta, la arteria y la vena pulmonar, o la vena cava inferior1,3. En una serie de 114 pacientes con MC informada por Burke et al., 73 casos (73%) estuvieron localizados en la aurícula izquierda, 22 (19%) en la aurícula derecha, 3 (4%) en los ventrículos y 3 casos (3%) presentaron afección múltiple tanto en aurículas como en ventrículos4.
Los MC son diagnosticados entre la cuarta y sexta década de la vida, pero pueden presentarse en cualquier grupo etario; en 1956 se informó sobre un mixoma congénito y se han encontrado estos tumores en personas mayores de 90 años5,6. Clínicamente hay 2 formas: 1) los tumores esporádicos (90%), que se presentan más frecuentemente en mujeres (3:1), se encuentran localizados en la aurícula izquierda (86%) y son generalmente únicos2; 2) aquellos tumores familiares (10%), que predominan un poco más en hombres, pueden aparecer a edad más temprana, se presentan con menos frecuencia en la aurícula izquierda (62%) y pueden estar asociados a anormalidades extracardiacas, las cuales pueden formar parte del complejo informado por J. Aidan Carney en 1985. El síndrome de Carney es una alteración autosómica dominante y genéticamente heterogénea. Han sido identificados 2 locus; uno en la región CNC1 17q22-24 y el otro en la región CNC2 2p16. Del segundo (CNC2) se desconoce su función, pero el primero, el gen CNC1, ha sido identificado como subunidad reguladora (R1A) de la proteína cinasa A (PRKAR1A), dependiente de AMP cíclico, que está relacionado con la génesis del MC7. En el síndrome de Carney, además de MC, puede haber mixomas en otras localizaciones como fibroadenomas mixoides mamarios (múltiples y bilaterales), lesiones pigmentadas (lentígines) en piel y mucosas (labios conjuntiva y genitales), nevus azules, hiperactividad endocrina, tumores de tiroides, schwannoma melanocítico psammomatoso, tumor de células de Sertoli calcificante y algunas otras neoplasias7. Los pacientes con este complejo desarrollan más frecuentemente recurrencia de los MC a pesar de una resección quirúrgica adecuada. Histológicamente los MC familiares son indistinguibles de los esporádicos8.
Los pacientes con MC pueden no presentar síntoma alguno, mostrar datos clínicos inespecíficos (de donde ha surgido el denominar al MC como el «gran imitador clínico»), o mostrar datos de desequilibro hemodinámico por obstrucción intracardiaca, signos de embolización sistémica o pulmonar, y algunos síntomas generales (que algunos autores han llamado la tríada clásica del MC)3,5,6. Las manifestaciones clínicas pueden ser variadas y dependen del sitio de origen, el tamaño y movilidad del MC. Puede haber datos de estenosis o insuficiencia mitral, disnea, pérdida brusca de la conciencia (síncope) y distensión de venas del cuello (en los tumores que afectan cavidades derechas). Las manifestaciones embólicas se pueden observar en el 30 al 50% de los casos y son causadas por fragmentación y desprendimiento de la superficie del mixoma. Dependiendo de la localización del mixoma, estas embolias pueden ser hacia la circulación pulmonar o sistémica, dando como consecuencia infartos miocárdicos, pulmonares o cerebrales, o raramente presentarse como embolias cutáneas9. Los émbolos hacia las extremidades inferiores pueden hacer pensar en diagnóstico de vasculitis periférica secundarias a problemas reumatológicos; esto último hace énfasis en la importancia del estudio histopatológico de especímenes de embolectomías10.
Los síntomas generales son inespecíficos e incluyen debilidad, fatiga, anorexia, pérdida de peso y fiebre de bajo grado, además de anemia, y elevación de la sedimentación globular que se presentan hasta en el 90% de los pacientes1,3,4. Estos síntomas pueden estar acompañados de anormalidades en los estudios de laboratorio como anemia, leucocitosis, trombocitopenia y elevación del volumen de sedimentación globular. Lo anterior es causado, al menos en parte, por la producción autocrina de citocinas como IL-6 e IL-811.
Aunque es poco frecuente, puede también en ocasiones presentarse cardiomegalia evidenciada en la radiografía simple de tórax o signos electrocardiográficos de hipertrofia ventricular izquierda12. El método más sencillo para el diagnóstico es la ecocardiografía, pero como las alteraciones estructurales cardiacas en la radiografía simple de tórax y en el electrocardiograma no son frecuentes, el ecocardiograma no se realiza si la enfermedad no es sospechada y frecuentemente el paciente puede presentar datos de embolismo antes de que se tenga el diagnóstico de MC12.
La escisión quirúrgica es el único tratamiento para estos tumores, y es usualmente curativa1. Se ha observado recurrencia del 1 al 4% de los mixomas esporádicos y del 12 a 22% de los casos familiares1,13. Aunque los MC son considerados benignos, en los casos que recurren puede haber mayor proliferación e histología atípica, y hay informes de transformación maligna en casos aislados, que presentaron características histológicas similares al histiocitoma fibroso maligno, mixofibrosarcoma, o condrosarcoma14.
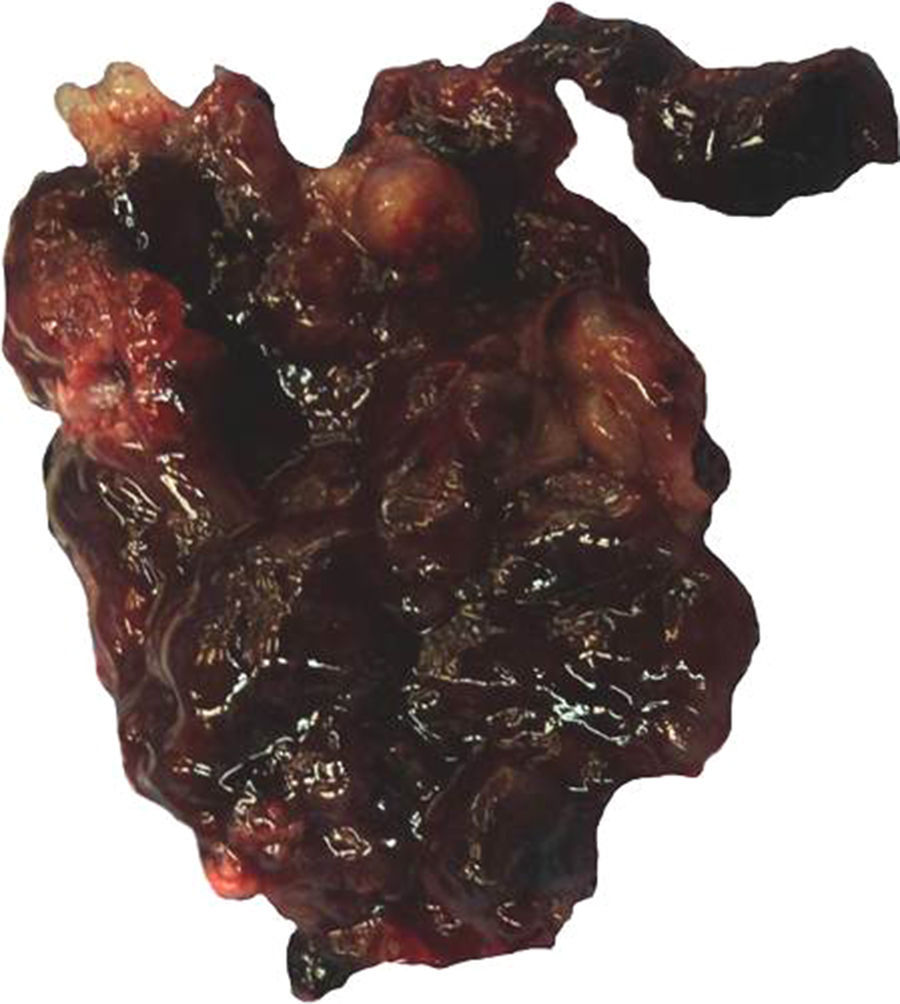
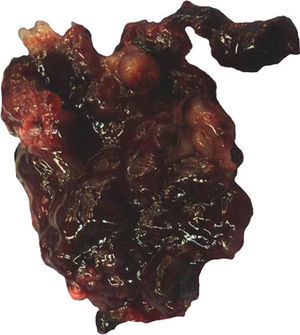
Características macroscópicasMacroscópicamente los mixomas tienen características heterogéneas. La mayoría son polipoides, y raramente sésiles. Por lo general la superficie externa es multilobulada, gris-blanquecina, amarilla o café, y de consistencia gelatinosa/mixoide, frecuentemente mezclada con áreas hemorrágicas. Pueden presentarse microcalcificaciones, que son más frecuentes en los mixomas de la aurícula derecha y en ocasiones todo el tumor está calcificado (mixomas petrificados). Su tamaño varía de unos cuantos milímetros hasta 18cm de eje mayor, con un promedio de 5 a 6cm15 (fig. 1). El espécimen extirpado suele presentarse adherido a fragmentos de músculo cardiaco, que corresponden al sitio de su implantación. En ocasiones estos tumores pueden tener configuración papilar con extensiones digitiformes, lo que los hace más propensos a fragmentarse y a generar émbolos1,9. Los MC con superficie de aspecto papilar muestran síntesis aumentada de algunas metaloproteinasas de matriz extracelular (MMP-MT1, MMP-2 y MMP-9), que se correlaciona con la acentuación de la producción del estroma mixoide, y a esto es a lo que se ha atribuido el aumento de riesgo de eventos embólicos en los MC10.
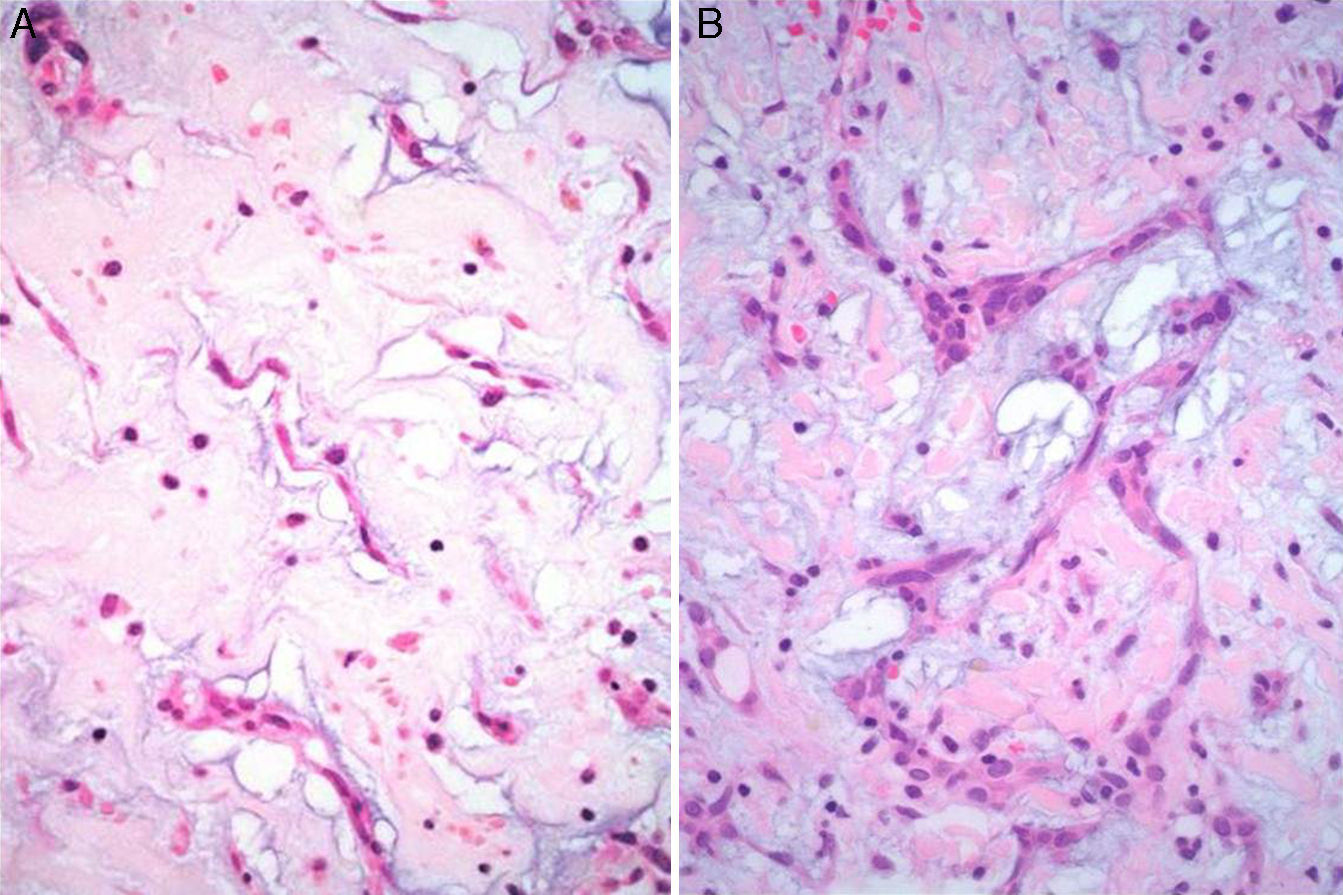
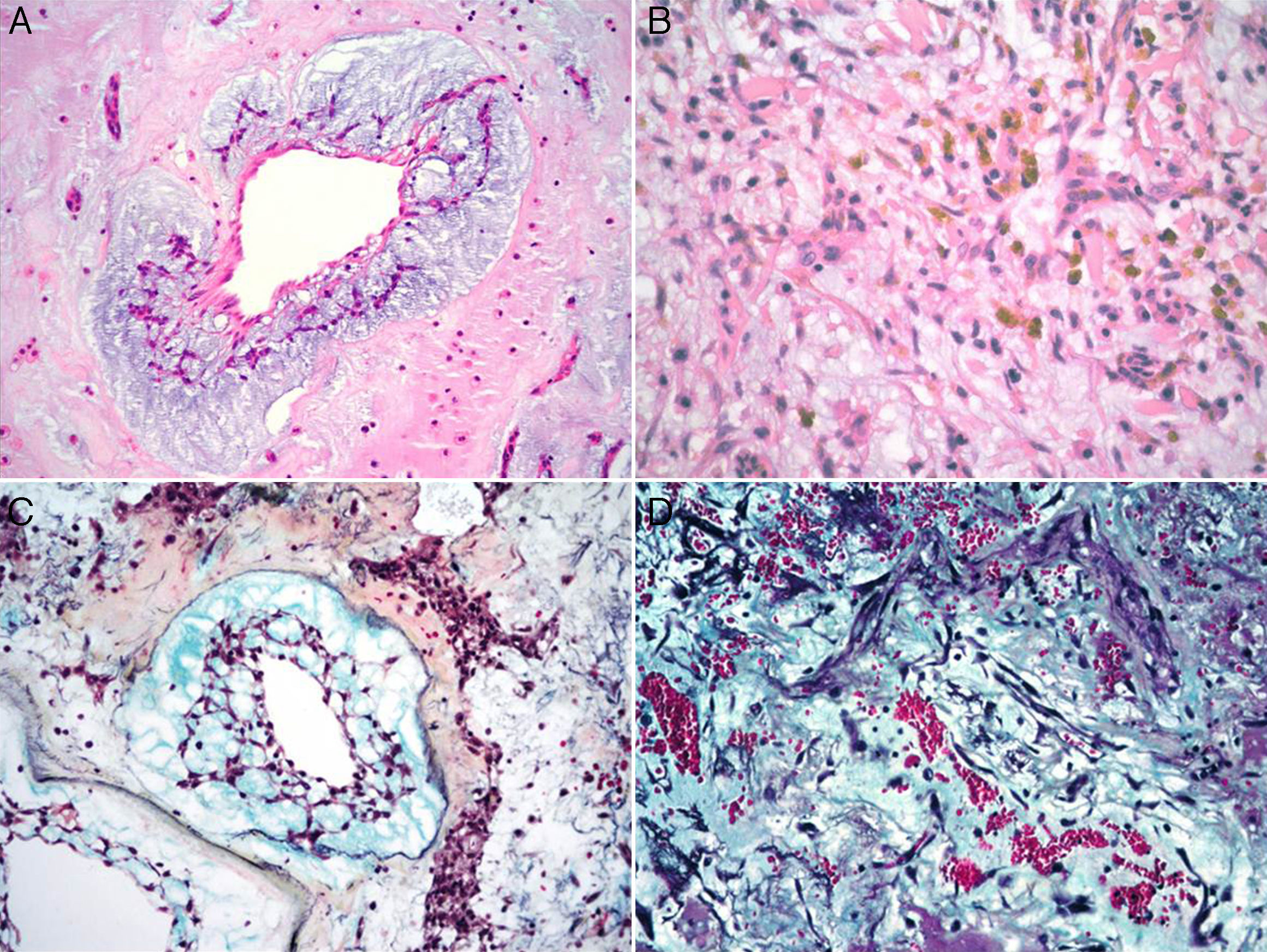
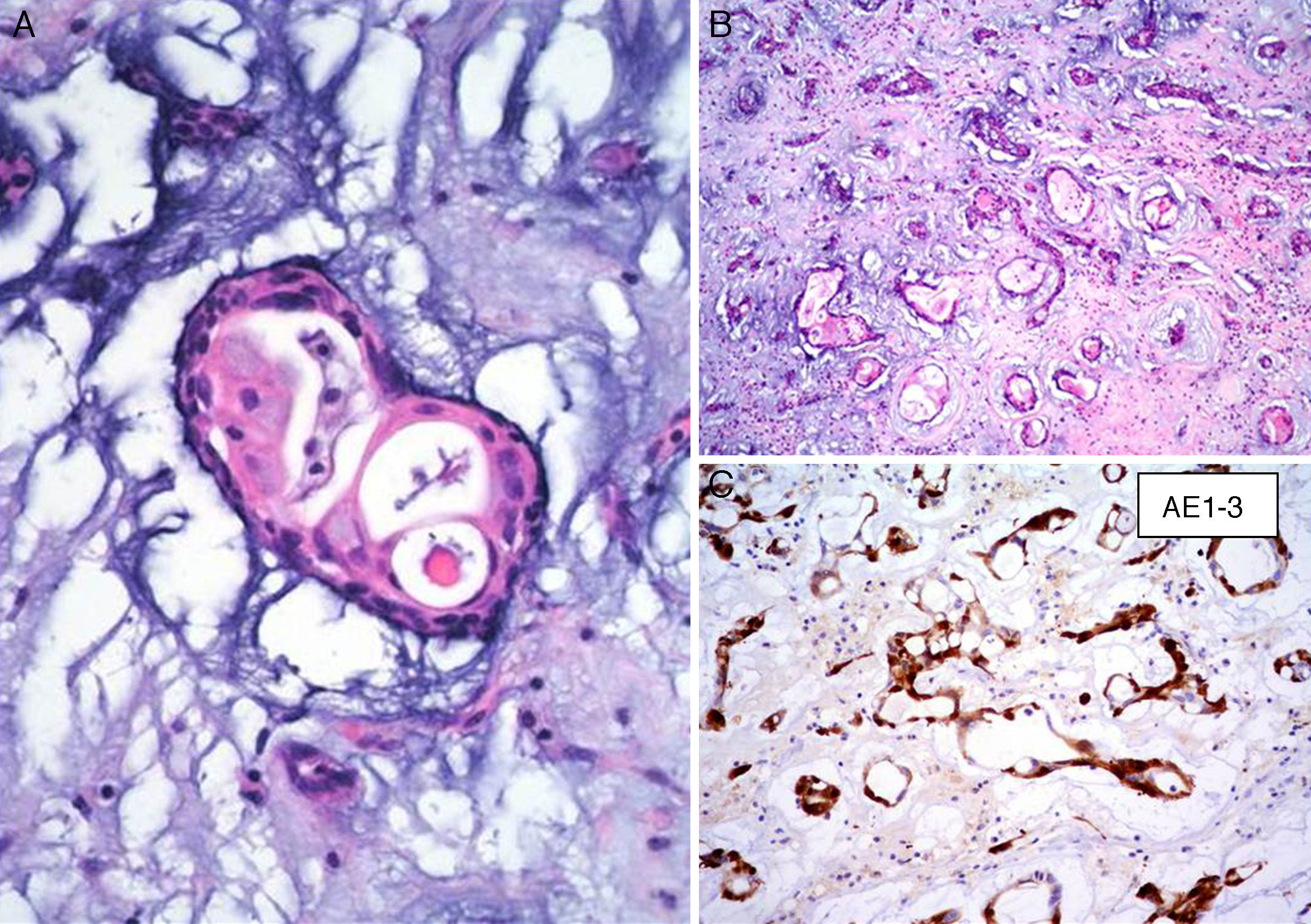
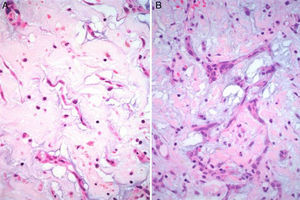
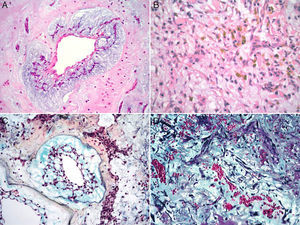
Características microscópicasLa celularidad de los MC es muy variable, no solo entre especímenes, sino también en partes diversas del mismo tumor. En unas áreas el tumor puede tener escasas células tumorales inmersas en abundante matriz mixoide, y en otras, las células pueden agruparse de tal manera que semejan un tumor epitelial13. Histológicamente los MC están compuestos por 2 tipos principales de células; las células estelares y las poliédricas, y ambas se encuentran incorporadas en una extensa matriz mixoide amorfa con zonas de hemorragia (fig. 2). Las células estelares son alargadas con núcleos redondos u ovales y citoplasma eosinófilo. Las células poliédricas (también llamadas células lepídicas) tienen igualmente un núcleo redondo u oval y variable cantidad de citoplasma eosinófilo y se encuentran en forma aislada, o formando cordones celulares o agregados circulares concéntricos alrededor de espacios pequeños simulando estructuras glandulares16. Estas células también pueden agregarse alrededor de vasos formando «manguillos perivasculares» infiltrados frecuentemente por linfocitos (fig. 3A y B). Ocasionalmente se pueden encontrar algunas células tumorales gigantes multinucleadas8. Estos tumores presentan muy escaso pleomorfismo y las mitosis son raras al igual que la necrosis. En el entorno celular se pueden identificar un número variable de linfocitos, eritrocitos, macrófagos, células cebadas, células dendríticas, células plasmáticas, fibroblastos y células de músculo liso aisladas17,18. Es constante la presencia de hemosiderina dentro de macrófagos depositada en forma dispersa que se hace más evidente mediante la tinción de Perls o azul de Prusia (fig. 3C). Otros hallazgos histológicos que pueden estar presentes son fibrosis variable, cuerpos de Gamna-Gandy, hematopoyesis extramedular, calcificaciones, cartílago hialino, formación de hueso metaplásico y restos tímicos (ha sido informado desarrollo de timomas posiblemente originados de estos restos tímicos)19. Los infiltrados linfoides son frecuentes (raramente con formación de centros germinales) con distribución difusa y principalmente alrededor de las estructuras seudovasculares.
La matriz mixoide, que da el nombre a estos tumores, muestra un leve tinte basófilo con hematoxilina y eosina, dada por la presencia de abundantes proteoglicanos unidos a cadenas de glucosaminoglicanos, como condroitina sulfato y ácido hialurónico, que son positivas con la tinción de hierro coloidal de Halle, y con azul alciano a pH 2.5, y es positivo débil a la tinción de ácido peryódico Schiff13,20. Además, la matriz contiene cantidades variables de elastina, fibrinógeno, fibrina y colágena4,21. Ocasionalmente (1-5% de los casos), se puede identificar un componente glandular dentro del estroma mixoide (mixomas glandulares) (fig. 4). Estas glándulas son heterogéneas en su composición, y pueden ser desde glándulas con contornos ovalados y delineadas por células cilíndricas con núcleos de mediano tamaño y membranas nucleares regulares, hasta glándulas con contornos angulados y arquitectura cribiforme con presencia de células caliciformes positivas a la tinción de ácido peryódico Schiff4,17. Algunos informes refieren la presencia de atipia regenerativa de estas estructuras glandulares e incluso datos citológicos de malignidad, con la presencia de mitosis, atipia acentuada y expresión nuclear de p5317. Siempre que estas estructuras glandulares son halladas en un MC, es indispensable descartar la posibilidad de un adenocarcinoma metastásico a corazón. El comportamiento clínico de los mixomas con estructuras glandulares no difiere de los mixomas no glandulares18.
El diagnóstico diferencial más importante de los MC se debe hacer con trombos intracardiacos con cambios mixoides y proliferación de células fusiformes; en ocasiones la inmunomarcación puede servir para hacer esta diferencia (vide infra)21.
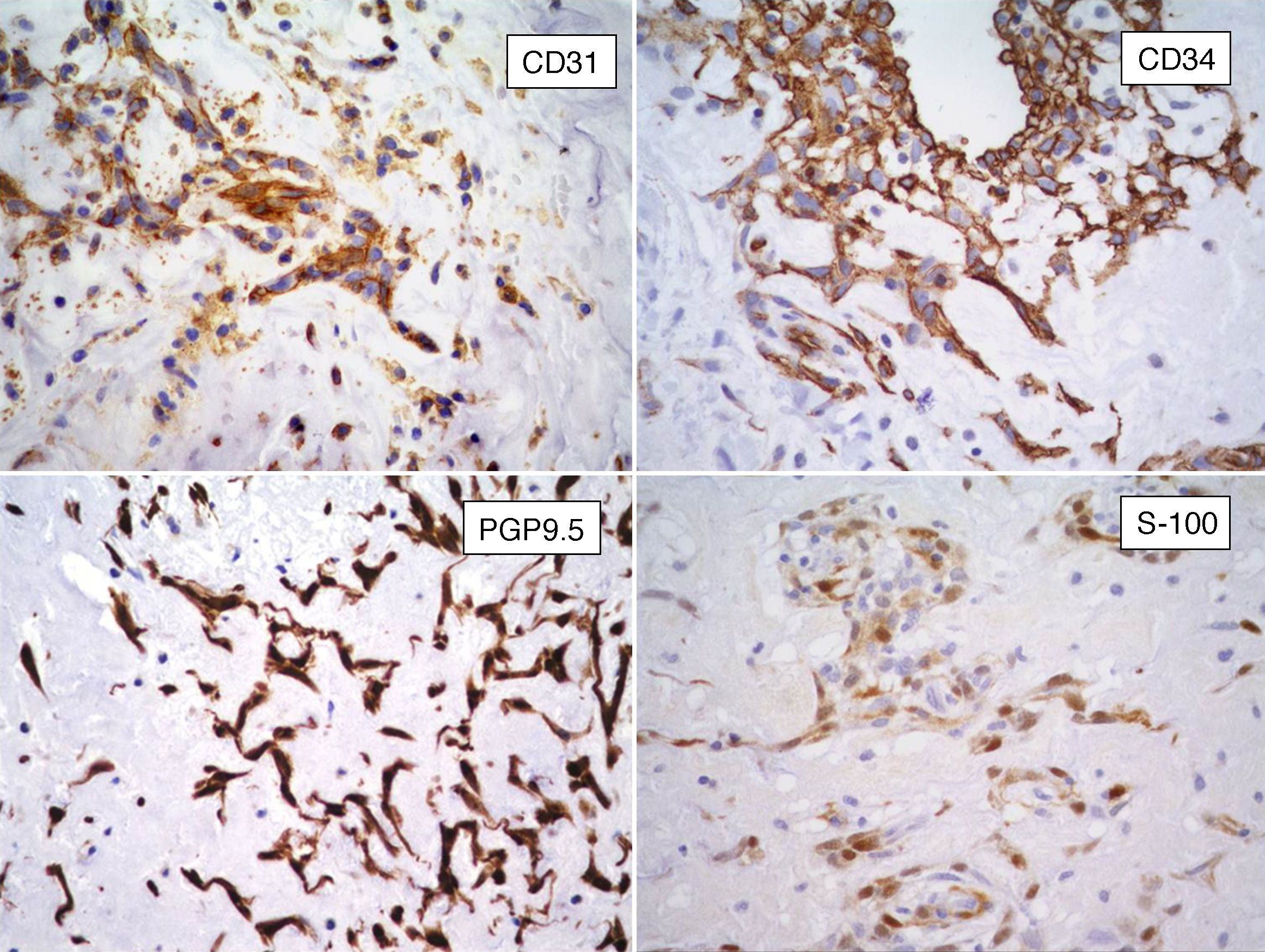
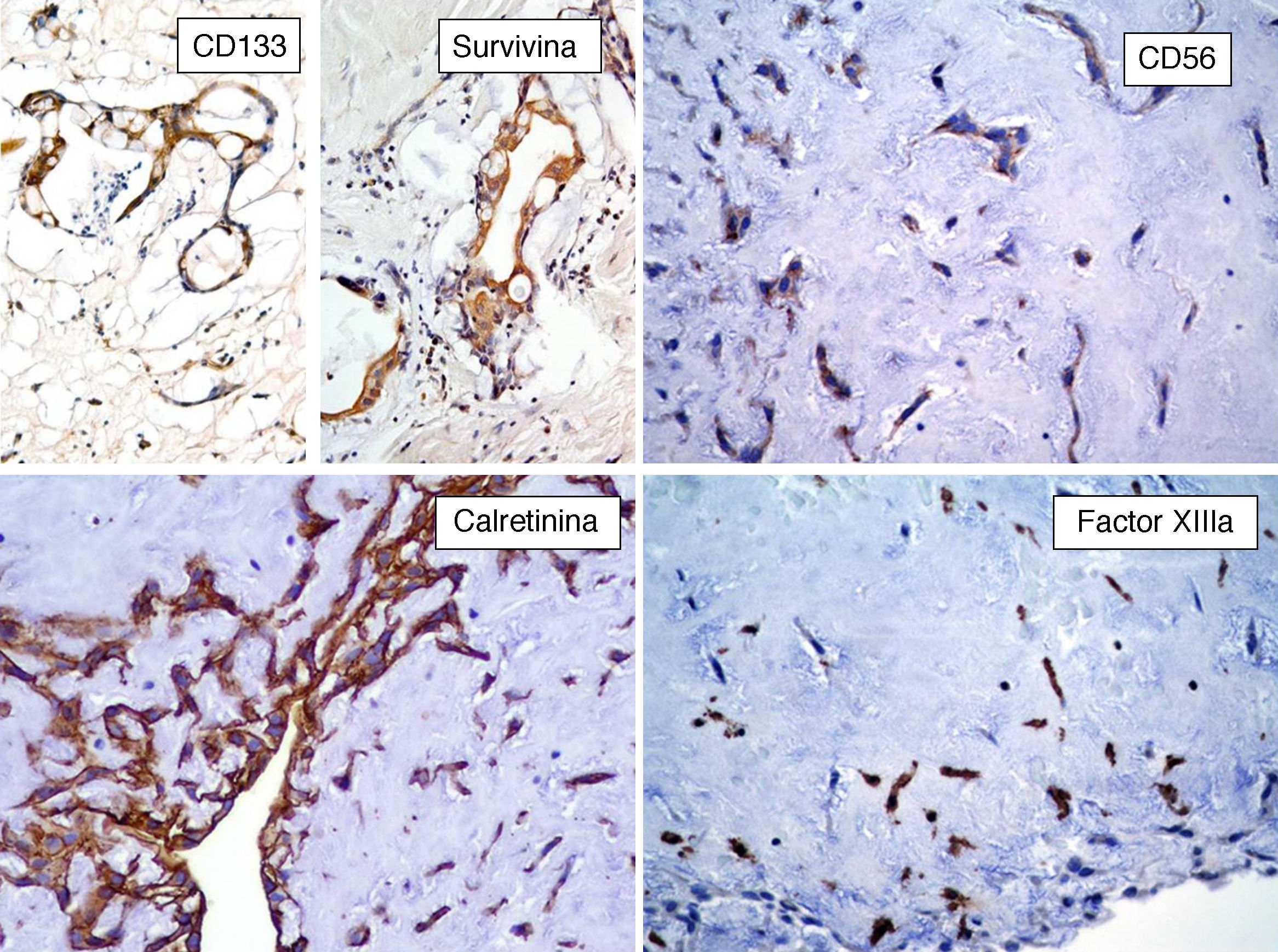
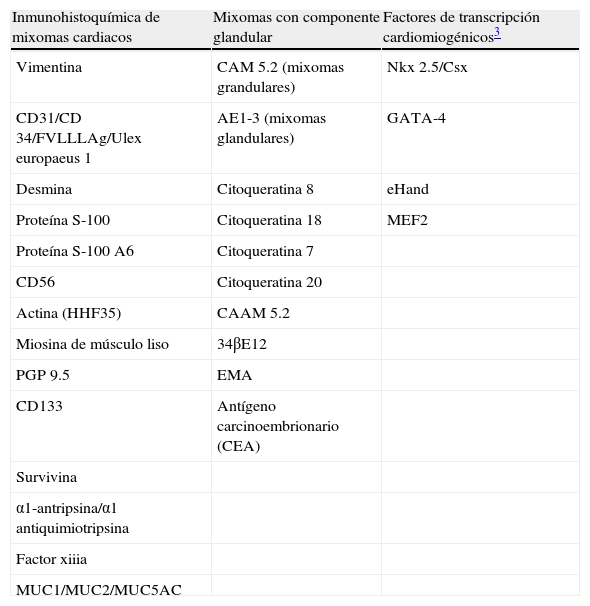
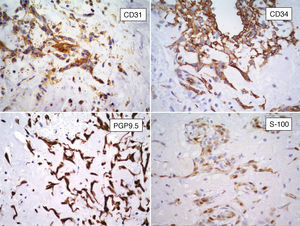
InmunohistoquímicaLos resultados inmunohistoquímicos se resumen en la tabla 1. Las células del MC expresan diversos inmunomarcadores endoteliales como CD31, CD34, antígeno relacionado con el factor viii (FVIII RA), trombomodulina y la lectina Ulex europaeus 1 (fig. 5)3,16,22. También se encuentran presentes en un alto porcentaje de los casos marcadores neurales, como calretinina, proteína S-100, PGP 9.5, enolasa neuronal específica, CD56 y S-100 A621. Pucci et al. estudiaron 53 casos de MC y encontraron que el 94% de estos son positivos al PGP 9.5, seguido de proteína S-100 (89%), lo que sugiere la posible diferenciación neuroendocrina de estos tumores y el origen en tejido endocárdico nervioso sensorial20,22,23 (fig. 5). Por otro lado, los marcadores miogénicos y cardiomiogénicos, como desmina, actina de músculo liso y caldesmona, estudiados en los MC, han dado resultados variables16,22. Kodama et al. demostraron la expresión inmunohistquímica de los factores de transcripción específicos de cardiomiocitos Nkx 2.5/Csx, GATA-4, y eHAND en los MC, lo que sugiere diferenciación cardiogénica (vide infra)24. Por otro lado, las células del mixoma son positivas a algunos marcadores histiocíticos (inespecíficos) como α1-antitripsina y α1-antiquimiotripsina, pero son negativas a los marcadores específicos de diferenciación histiocítica como el CD68 y el CD16320,22,23.
Inmunomarcación en mixomas cardiacos
| Inmunohistoquímica de mixomas cardiacos | Mixomas con componente glandular | Factores de transcripción cardiomiogénicos3 |
| Vimentina | CAM 5.2 (mixomas grandulares) | Nkx 2.5/Csx |
| CD31/CD 34/FVLLLAg/Ulex europaeus 1 | AE1-3 (mixomas glandulares) | GATA-4 |
| Desmina | Citoqueratina 8 | eHand |
| Proteína S-100 | Citoqueratina 18 | MEF2 |
| Proteína S-100 A6 | Citoqueratina 7 | |
| CD56 | Citoqueratina 20 | |
| Actina (HHF35) | CAAM 5.2 | |
| Miosina de músculo liso | 34βE12 | |
| PGP 9.5 | EMA | |
| CD133 | Antígeno carcinoembrionario (CEA) | |
| Survivina | ||
| α1-antripsina/α1 antiquimiotripsina | ||
| Factor xiiia | ||
| MUC1/MUC2/MUC5AC |
Es de interés el informe de que en algunos casos de MC los agregados celulares complejos que forman estructuras «seudovasculares» son positivos al CD34 y negativos a actina de músculo liso en las capas celulares internas, mientras que con inmunomarcación opuesta se observó en las células de las capas más externas; esto sugiere diferenciación endotelial y pericítica respectivamente16.
La vimentina es positiva difusa intensa en las células neoplásicas, mientras que las citoqueratinas son negativas en las células tumorales del estroma. Sin embrago, las estructuras glandulares de los MC suelen ser positivas para diversas citoqueratinas, como CK8, CK18, CK7 y CK2017. También presentan expresión de antígeno epitelial de membrana, antígeno carcinoembrionario (CEA), proteína S-100 y focalmente marcadores endocrinos18. Hay informes de inmunorreactividad para IL-6 con positividad citoplásmica granular22.
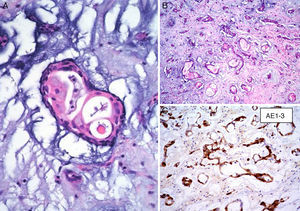
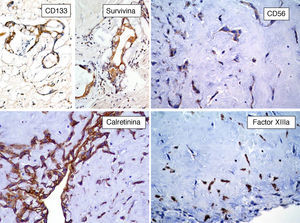
Por otro lado, se ha especulado que la ausencia de inmunorreactividad a CD117 (c-Kit) va en contra de la hipótesis de la naturaleza embrionaria de estos tumores23. Sin embargo, nosotros hemos inmunomarcado 6 casos de MC con CD133 y todos estos resultaron positivos (resultados aun no publicados), lo que puede indicar que algunas células del MC son células progenitoras (fig. 6). El CD133 (prominina-1) es una glucoproteína transmembrana que se encuentra expresada en células progenitoras CD34+ de sangre periférica, médula ósea e hígado fetal25. Las células CD133+ posiblemente sean más primitivas que las células CD34+. Resulta interesante el estudio realizado por Bonanno et al. quienes han demostrado que las células CD133+ pueden ser inducidas in-vitro a diferenciación endotelial o cardiomiocítica26. Con lo anterior se podría especular que son estas células CD133+/CD34+ las que dan origen al MC, puesto que estos tumores presentan diferenciación hacia células endoteliales y/o cardiomiocíticas24,26.
Parte de la definición histológica del MC es la presencia de material mixoide/mucoide en el estroma. Las mucinas son glucoproteínas de alto peso molecular que contienen oligosacáridos adheridos a residuos de serina o treonina mediante unión O-glucosídica y pertenecen a una familia que contiene 18 productos génicos. Chu et al. han demostrado que el material mucoide extracelular en los MC es positivo al MUC1, MUC2 y MUC5C, y son producidos por las células mesenquimatosas multipotenciales27.
Berrutti y Silverman demostraron la presencia de abundantes células positivas al factor xiiia (FXIIIa)28. El FXIIIa es una transglutaminasa que se expresa en plaquetas, monocitos, macrófagos y en los llamados dendrocitos dérmicos o dendrófagos28. Es interesante hacer notar que diversos tumores con matriz mixoide, como el tumor del estroma gastrointestinal mixoide y el histiocitoma fibroso maligno mixoide, presentan numerosos dendrocitos positivos al FXIIIa y células positivas al CD34. Esta combinación de células FXIIIa+/CD34+ en el MC, como afirman Berrutti y Silverman, podría inducir la formación de la proliferación mixoide angioformativa capaz de crecimiento autónomo28. El grado de proliferación en los MC es variable. Suvarna y Royds informaron un promedio de proliferación del 12-6%; utilizando PCNA y del 3.2% con el Ki-67 (MIB1)29. Nosotros inmunomarcamos 6 casos de MC con Ki-67 y el promedio fue del 1% (resultados aun no publicados).
Microscopia electrónicaLos estudios que han descrito la ultraestructura de los MC han demostrado la presencia de células de aspecto mesenquimatoso primitivo. Las células de mixoma muestran protrusiones citoplásmicas alargadas con presencia de filamentos intermedios en número variable, diversos organelos citoplásmicos y uniones celulares sin desmosomas4. Con estos hallazgos, aunque inespecíficos, se ha sugerido que las células del MC corresponden a células embrionarias pluripotenciales que ocasionalmente presentan datos morfológicos de miofibroblastos4. La matriz mixoide semeja a la observada en la matriz del cartílago. En algunas ocasiones las células mostraron una apariencia parecida al endotelio en continuidad con estructuras capilares endoteliales23,25. En los casos de mixomas con estructuras glandulares, se encuentran desmosomas y vellosidades en la zona apical celular.
Estudios moleculares y citogenéticosPocos estudios moleculares se han efectuado para evaluar actividad proliferativa y potencial metastásico, o para establecer un patrón de expresión de polimorfismo de protooncogenes y genes de supresión tumoral en los MC29,30. De acuerdo a estos estudios, los MC presentan proliferación celular baja, con bajo potencial metastásico y no muestran, o muestran poca expresión, de p53, y Rb1 y Bcl-229,30. Hay un informe interesante de expresión aumentada de inhibidor de activador de melanoma (MIA [melanoma inhibitor activity]/) en MC31. El MIA es una proteína codificada por el gen MIA en el cromosoma 19, de 11kD constituida por 131 aminoácidos, secretada por condrocitos normales y células de melanoma y algunas células de tumores de ovario, páncreas y glándula mamaria. El incremento de MIA en células de MC podría estar en relación con la progresión hacia metástasis sistémica y mal pronóstico31. Se han encontrado factores en estos tumores, que sin conocerse su función exacta, parecen participar de manera importante en la patogénesis. Estos son factores angiogénicos como el VEGF y PDGF y sus receptores (VEGF/Flt-1, VEGF2/KDR/Fly1 y PDGF α/β) que tienen función autocrina. Se presume su participación porque histológicamente estos tumores se presentan en un microambiente rico en vasos capilares sanguíneos dispersos a lo largo de la neoplasia, posiblemente secundarios a la liberación de factores angiogénicos por las células neoplásicas, lo que es apoyado por el hallazgo inmunohistoquímico de su positividad al VEGF32.
Es posible, como sucede en otras neoplasias, que diferentes alteraciones cromosómicas sean las responsables del desarrollo de los MC. Sin embargo, hasta hoy no han sido detectadas anormalidades estructurales características en estos tumores. Algunos estudios han indicado que los MC muestran un patrón de ADN aneuploide/tetraploide y cariotipos heterogéneos, incluso dentro de diferentes áreas en un mismo tumor3. La mayor parte de los datos citogenéticos informados hasta hoy son de casos con patrón de herencia familiar, con anormalidades cromosómicas que involucran principalmente los cromosomas 2, 12 y 171,3,4. A diferencia de los casos afectados con el complejo de Carney, no se han encontrado mutaciones específicas responsables de los casos esporádicos.
HistogénesisHay evidencia clínica y experimental de que los MC son neoplasias y no trombos exuberantes como originalmente se había postulado. Lo anterior tiene como soporte la evidencia de que ocasionalmente ha sido informado un comportamiento agresivo de mixomas que invaden todo el corazón hasta la pared torácica con metástasis a distancia. Además, histológicamente pueden presentar datos de transformación maligna como pleomorfismo y mitosis, y algunos casos han sido informados con aneuploidía y alteraciones cromosómicas inespecíficas3,4,14,31. Sin embargo, la gran mayoría de los MC tienen un comportamiento benigno.
La histogénesis de estos tumores sigue siendo incierta y esto deriva de la naturaleza conflictiva en cuanto a los hallazgos ultraestructurales, histológicos e inmunohistoquímicos. El origen de estos tumores ha sido investigado principalmente a través de la inmunohistoquímica. El problema con este método es que la identificación del origen tumoral por expresión selectiva de antígenos puede ser errónea, debido al hecho de que la expresión fenotípica de la neoplasia puede ser variable y no necesariamente reflejar su origen. Sea como fuere, la heterogeneidad en la expresión de proteínas de diversas líneas celulares llevó a la hipótesis de que los MC se originan de células mesenquimatosas primitivas pluripotenciales capaces de diferenciarse por diversas líneas celulares (endotelial, epitelial, fibroblástico, hematopoyética o muscular)16. Estas células podrían residir en la fossa ovalis y en el endocardio cercano, y ser células de reserva subendoteliales o células primitivas de restos embrionarios, que podrían surgir de remanentes embrionarios retenidos anormalmente durante eventos de migración durante el desarrollo temprano del corazón16,33. Se han informado similitudes morfológicas entre las células de los mixomas y las células endocárdicas del desarrollo embrionario. También se ha sugerido que las estructuras endocárdicas constituidas por capilares con células endoteliales prominentes descritas por R. W. Prichard en 1951, localizadas en la fossa ovalis, podrían estar relacionadas con los MC. Sin embargo, estas diminutas «estructuras de Prichard» del endocardio muestran mportantes diferencias iinmunofenotípicas con los mixomas, pues expresan marcadores endoteliales y son negativas a la actina, S-100 y calretinina, y parecen no corresponder a las hipotéticas células subendoteliales pluripotenciales de reserva de donde posiblemente los mixomas se pudieran originar33.
Recientemente se ha sugerido que los MC puedan surgir a partir de una célula progenitora de cardiomiocitos, debido a que las células de mixoma expresaron diversos factores de trascripción específicos que apuntan hacia un fenotipo primitivo cardiomiocítico25. Los resultados de Kodama et al. sugieren que las células de los MC se encuentran comprometidas en el espectro de diferenciación en el punto de multipotencialidad, correspondiente a la etapa que precede a la diferenciación de las almohadillas endocárdicas en el desarrollo embrionario, es decir, la transformación endotelial-mesenquimal25. Lo anterior es avalado por los hallazgos de factores de transcripción propios de cardiomiocitos primitivos, como Nkx 2.5/Csx, eHAND, GAT4 y MEF2 y por la expresión de α-actina, propia de cardiomiocitos durante el desarrollo temprano embrionario24. Otros autores encontraron un grupo de genes específicos del cartílago (SOX9, MIA y SPP1), y en su opinión esto apoya indirectamente que los MC surgen de células pluripotenciales mesenquimatosas, es decir, que pueden diferenciarse hacia varias líneas celulares31.
Estudios sobre la epigenética ofrecen nuevas posibilidades sobre el origen de los MC3. Se ha sugerido un posible papel de fenómenos de reactivación de los genes tempranos embrionarios del corazón, que pudiesen contribuir al desarrollo de los MC en la vida adulta3. Barah y Parida han identificado un grupo común de genes involucrados en el proceso del desarrollo cardiaco que incluyen Nkx 2.5/CSX, GATA4, HOX HAND, MYOD, SOC4-6, S-100 y TGFβ, que están presentes en algunos casos de MC. Esta activación de genes podría ser secundaria a algún fenómeno epigenético como metilación de ADN (en residuos de citosina/islas CpG), modificación de histonas o al remplazo por isoformas alternativas y/o ARN no codificante, que desempeña un papel importante en el control postranscripcional de genes regulatorios34.
Se podría especular que la histogénesis de los componentes glandulares estuviera relacionada con un proceso teratomatoso o de malformación celular o a eventos de diferenciación divergentes de las células tumorales12,13. También se ha sugerido que los componentes glandulares de los mixomas podrían corresponder a remanentes embrionarios del intestino anterior, epitelio bronquial, alveolar o mesotelial, pero ninguno de estos se ha identificado definitivamente como el origen del componente glandular17,18.
Posible origen viralRecientemente Li et al. postularon que el origen de los MC está en relación con la infección por el virus herpes simple 1 (VHS1)35. En un estudio de 17 casos de MC detectaron la presencia de antígenos de VHS1 en 12 casos (70.5%), sugiriendo una posible asociación etiológica y que la neoplasia pudiera resultar de una lesión crónica inflamatoria del endocardio. Un estudio subsecuente con una población mayor de pacientes no encontró esta asociación en ninguno de sus casos36. Nosotros estudiamos 6 casos de MC utilizando el anticuerpo de VHS1 Bio SB (BsB24) y resultaron todos ellos negativos (resultados aun no publicados).
Apoptosis y survivinaHay evidencias de que la apoptosis es un mecanismo de muerte celular presente en los MC, sin embargo la patogénesis detallada y su significado permanecen sin esclarecerse. Estudios inmunohistoquímicos han mostrado apoptosis en los MC a través de la vía dependiente de caspasas y que estas pueden ser inhibidas por la survivina37.
La survivina (también conocida como BRIC 5−baculoviral inhibitor of apoptosis repeat-containing 5) es una proteína de 16.5kDa, codificada por el gen BRIC5 localizado en el cromosoma 17q25, miembro de la familia de las proteínas inhibidoras de la apoptosis que está expresada en diversos tumores, pero ausente en tejidos maduros diferenciados38. El efecto antiapoptótico de la survivina está mediado por la inhibición directa tanto de la caspasa 3 como de la caspasa 7. Además de la inhibición de esta vía de muerte celular, la survivina promueve la proliferación celular, estimula la angiogénesis y la invasión tumoral y está asociada a resistencia a diversos agentes quimioterapia y a mal pronóstico38,39. Lin et al. han demostrado la expresión citoplásmica de survivina por inmunohistoquímica en MC40. Nosotros hemos inmunomarcado 6 casos de MC con antisurvivina y todos los casos resultaron positivos (fig. 6) (resultados aun no publicados.) Debido a que la survivina estimula la angiogénesis, esta podría ser en parte responsable del número elevado de vasos sanguíneos presentes en el MC. Sin embargo, la expresión de survivina se ha correlacionado con malignidad, y la mayoría de los MC muestra un comportamiento benigno. Es necesario realizar más estudios para determinar el significado puntual de la survivina en la angiogénesis de los MC.
ConclusionesAunque las características generales de los MC son las de un tumor benigno, las ocasionales recurrencias y metástasis, y los raros informes de transformación maligna, hacen que se le considere un tumor con bajo potencial maligno. Las investigaciones actuales intentan identificar cambios histopatológicos que se correlacionen con las diferentes presentaciones clínicas, así como aclarar el origen de estos tumores. Los estudios de inmunohistoquímica realizados en los MC no muestran diferenciación exclusiva hacia una línea celular, puesto que se han encontrado marcadores de tipo endotelial, cardiogénico o neuroendocrino. Estos se pueden expresar en varios tipos de células, incluyendo las pluri o multipotenciales, o incluso reexpresarse en tejido adulto debido a fenómenos epigenéticos de desregulación. Sin embargo, la evidencia actual es que el MC representa un tumor de posible origen en células de reserva primitivas que residen en la fossa ovalis y el endocardio circundante. Quizá el actual abordaje de técnicas avanzadas moleculares sea útil, por un lado, para lograr identificar las células de origen y las vías oncogénicas específicas, y por otro, para llevar al desarrollo de terapias dirigidas para el tratamiento de estos tumores.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Agradecemos al Dr. Luis del Valle, Profesor Asociado de Patología de la Escuela de Medicina de la Universidad de Luisiana, EE. UU., la inmunomarcación de 6 casos de mixomas cardiacos con CD133 y survivina.