Los lípidos juegan un importante papel durante la gestación, y en este periodo tienen lugar cambios importantes en el metabolismo lipoproteico. Durante el tercer trimestre del embarazo los niveles plasmáticos de colesterol y triglicéridos se ven sustancialmente incrementados, volviendo a niveles normales tras el parto. Se han descrito asociaciones entre el aumento de la morbilidad durante el embarazo e incrementos excesivos de la concentración plasmática del colesterol y triglicéridos. Por dicho motivo hemos revisado la relación entre las alteraciones lipídicas, la preeclampsia, la diabetes gestacional y el parto pretérmino. El control metabólico global de la embarazada mejoraría los resultados obstétricos, y la detección de alteraciones suprafisiológicas del perfil lipídico debería clasificar el embarazo en un nivel de riesgo superior, lo que comportaría un control más estricto.
Lipids play an important role during pregnancy, and in this period major changes occur in lipoprotein metabolism. During the third trimester plasma cholesterol and triglyceride levels are substantially increased, returning to normal after delivery. Described associations between increased morbidity during pregnancy and excessive increases in plasma cholesterol and triglycerides. For this reason we have reviewed the relationship between lipid alterations, preeclampsia, gestational diabetes and preterm birth. The overall metabolic control can improve pregnancy outcomes, and the assessment of supraphysiological changes in lipid profile will classify pregnancy risk at a higher level, which would entail a stricter control.
Los lípidos juegan un papel importante en la gestación, y durante este periodo ocurren cambios complejos en el metabolismo lipoproteico. En la primera mitad del embarazo prevalece el metabolismo anabólico, incrementándose los depósitos de grasa, y en la fase final predomina el metabolismo catabólico, aumentando la resistencia a la insulina1. En la etapa anabólica la acumulación de grasa está mediada por la hiperfagia, que facilita el aporte exógeno, y por un incremento de la actividad lipoproteinlipasa, con el consiguiente aumento de los depósitos grasos2,3.
Aunque la gestación se caracteriza por una insulinorresistencia fisiológica, esta es mayor durante el tercer trimestre, por lo que en este periodo aumenta la lipólisis y disminuye la acumulación grasa. A pesar de la hiperinsulinemia, hay un incremento de la producción hepática de glucosa, prueba de la resistencia a la insulina característica de este estado. La glucemia basal va disminuyendo durante el transcurso de la gestación debido a varios factores, como el efecto dilucional, por el incremento del volumen plasmático; el paradójico balance insulina-glucosa de producción hepática-glucemia durante la gestación y, sobre todo en el tercer trimestre, al paso transplacentario y utilización fetoplacentaria1. En una gestante sana la sensibilidad a la insulina está reducida en un 10%, mientras que en la diabetes gestacional se encuentra reducida hasta en un 40%. Esta resistencia esta mediada por el lactógeno placentario, estrógenos, progesterona, prolactina, cortisol y factor de necrosis tumoral alfa1-3.
El colesterol es imprescindible para la formación de membranas, síntesis de esteroides y diferenciación celular, y es necesario para el desarrollo embrionario y fetal2-4. Aunque el feto es capaz de sintetizar su propio colesterol, existe también un aporte exógeno de colesterol de la circulación materna a través de la placenta. El colesterol materno juega un papel transcendental en su desarrollo, habiéndose relacionado la hipocolesterolemia materna durante el segundo trimestre de la gestación con fetos microcéfalos5, y la hiperlipidemia materna en el embarazo a un incremento de lesiones precursoras de arteriosclerosis en los fetos6.
La hiperlipidemia durante el embarazo es variable. En general, los niveles de los lípidos plasmáticos durante el primer y segundo trimestre son similares a los de la mujer no gestante7,8. Sin embargo, durante el tercer trimestre existen incrementos del 65% en colesterol total y fosfolípidos, los triglicéridos pueden triplicarse, el colesterol de las lipoproteínas de baja densidad (cLDL) duplicarse y la concentración de colesterol de las lipoproteínas de alta densidad (cHDL) se incrementa en menor medida7,9,10. Estos cambios son independientes de la edad, la dieta y la ganancia ponderal. Las alteraciones del perfil lipídico se restablecen después del parto en un tiempo variable, y el descenso hacia la normalización se ve acelerado si la lactancia es materna10, y enlentecido en los casos de dislipidemia familiar11. Se han referido aumentos suprafisiológicos y extremos en algunas gestantes, sobre todo en aquellas con niveles más altos de triglicéridos de los esperados al inicio de la gestación, asociados también a descenso hasta la basal más lento tras la gestación y a niveles más bajos de HDL previos a la gestación. Las concentraciones lipídicas extremas se han relacionado con la existencia de dislipidemias familiares4.
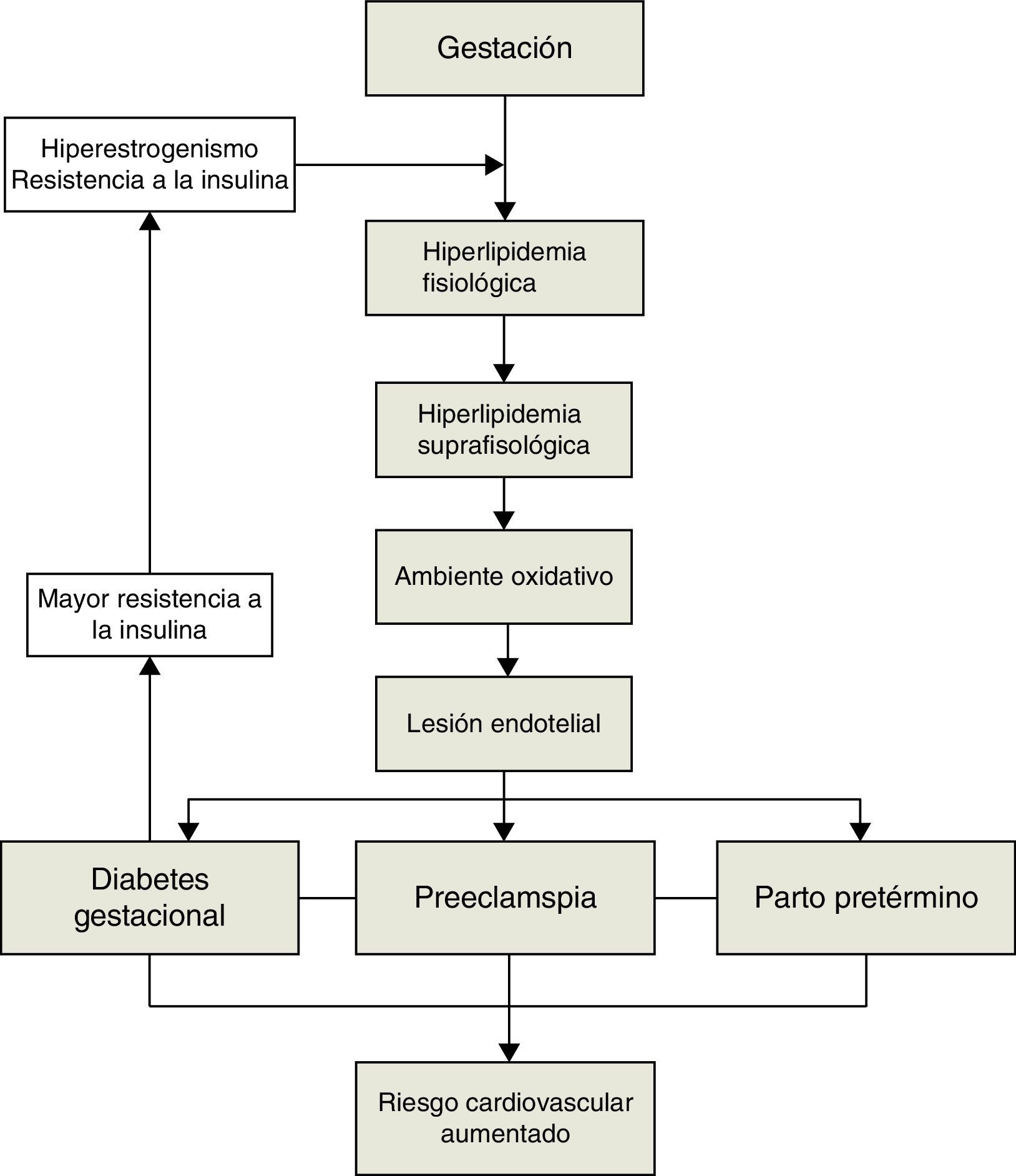
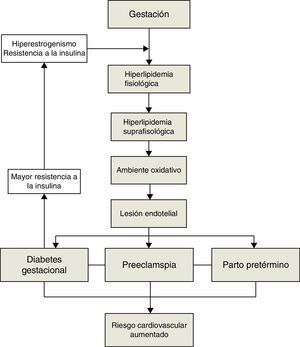
Existe una clara relación entre la diabetes gestacional, los estados hipertensivos de la gestación y el metabolismo lipídico. Del mismo modo se ha observado también relación con otra de las complicaciones con más relevancia clínica durante la gestación: el parto pretérmino (fig. 1). Por todo ello hemos considerado de interés revisar la relación entre las alteraciones lipídicas, la preeclampsia, la diabetes gestacional y el parto pretérmino.
Lípidos y preeclampsiaLa preeclampsia es una complicación médica del embarazo que ocurre en el 3 al 5% de las gestaciones. Se caracteriza por hipertensión arterial asociada a proteinuria >300mg/24h a partir de las 20semanas de gestación y se suele resolver a las 6semanas del parto. Se acompaña de una considerable morbimortalidad maternofetal y constituye en la actualidad la tercera causa de muerte materna, después de la hemorragia y la sepsis12. Puede progresar hacia la disfunción hepática, daño renal e incluso muerte materna, y alteraciones fetales como crecimiento intrauterino restringido, parto pretérmino y sus consecuencias en términos de prematuridad, como mayor probabilidad de muerte fetal anteparto y neonatal13.
En la tabla 1 se exponen los principales estudios sobre las alteraciones del metabolismo lipoproteico y/o riesgo cardiovascular en la preeclampsia. Se ha descrito un incremento del riesgo cardiovascular en aquellas mujeres con antecedente de preeclampsia comparadas con el resto de la población14-16. Esta asociación sugiere que la enfermedad cardiovascular y la preeclampsia compartirían mecanismos fisiopatológicos comunes como la disfunción endotelial, alteración también atribuida a otros factores de riesgo de la preeclampsia como la hipertensión arterial, la enfermedad renal y la diabetes mellitus17,18.
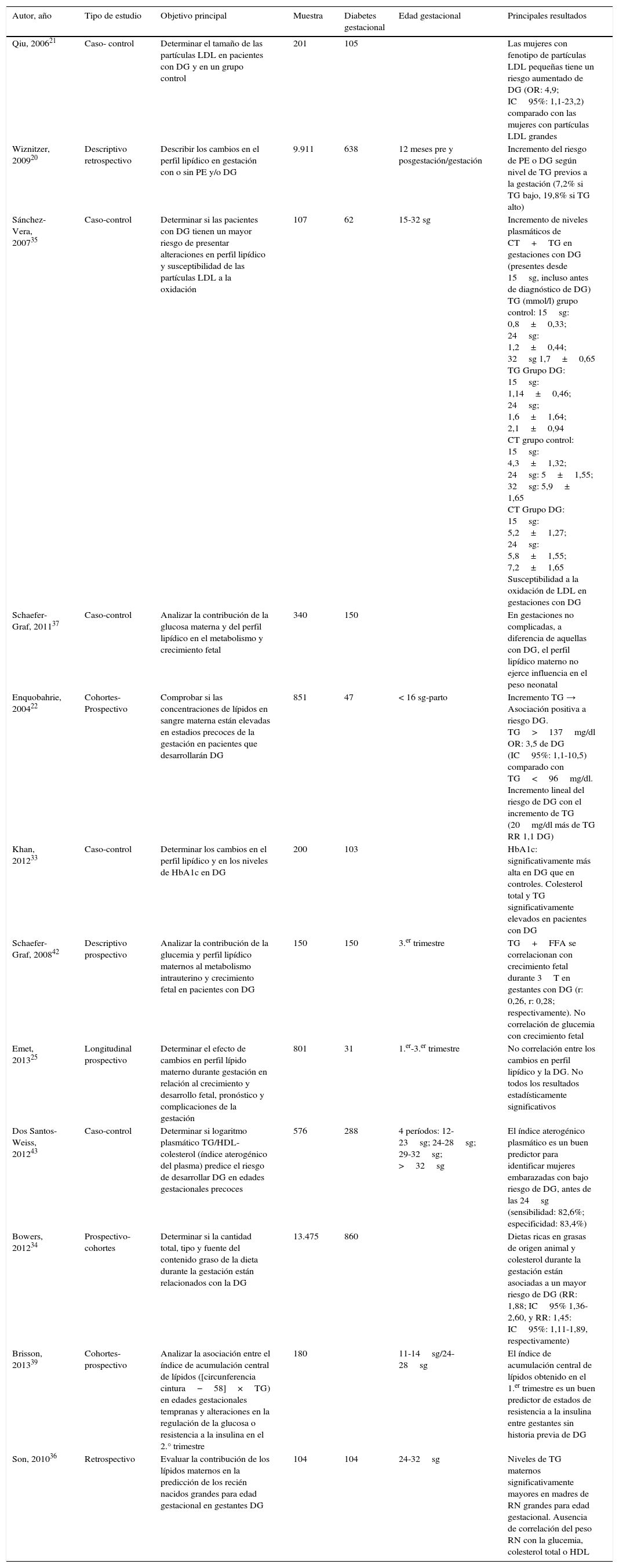
Resumen de artículos revisados: asociación entre niveles lipídicos y diabetes gestacional
| Autor, año | Tipo de estudio | Objetivo principal | Muestra | Diabetes gestacional | Edad gestacional | Principales resultados |
|---|---|---|---|---|---|---|
| Qiu, 200621 | Caso- control | Determinar el tamaño de las partículas LDL en pacientes con DG y en un grupo control | 201 | 105 | Las mujeres con fenotipo de partículas LDL pequeñas tiene un riesgo aumentado de DG (OR: 4,9; IC95%: 1,1-23,2) comparado con las mujeres con partículas LDL grandes | |
| Wiznitzer, 200920 | Descriptivo retrospectivo | Describir los cambios en el perfil lipídico en gestación con o sin PE y/o DG | 9.911 | 638 | 12 meses pre y posgestación/gestación | Incremento del riesgo de PE o DG según nivel de TG previos a la gestación (7,2% si TG bajo, 19,8% si TG alto) |
| Sánchez-Vera, 200735 | Caso-control | Determinar si las pacientes con DG tienen un mayor riesgo de presentar alteraciones en perfil lipídico y susceptibilidad de las partículas LDL a la oxidación | 107 | 62 | 15-32 sg | Incremento de niveles plasmáticos de CT+TG en gestaciones con DG (presentes desde 15sg, incluso antes de diagnóstico de DG) TG (mmol/l) grupo control: 15sg: 0,8±0,33; 24sg: 1,2±0,44; 32sg 1,7±0,65 TG Grupo DG: 15sg: 1,14±0,46; 24sg; 1,6±1,64; 2,1±0,94 CT grupo control: 15sg: 4,3±1,32; 24sg: 5±1,55; 32sg: 5,9± 1,65 CT Grupo DG: 15sg: 5,2±1,27; 24sg: 5,8±1,55; 7,2±1,65 Susceptibilidad a la oxidación de LDL en gestaciones con DG |
| Schaefer-Graf, 201137 | Caso-control | Analizar la contribución de la glucosa materna y del perfil lipídico en el metabolismo y crecimiento fetal | 340 | 150 | En gestaciones no complicadas, a diferencia de aquellas con DG, el perfil lipídico materno no ejerce influencia en el peso neonatal | |
| Enquobahrie, 200422 | Cohortes-Prospectivo | Comprobar si las concentraciones de lípidos en sangre materna están elevadas en estadios precoces de la gestación en pacientes que desarrollarán DG | 851 | 47 | < 16 sg-parto | Incremento TG → Asociación positiva a riesgo DG. TG>137mg/dl OR: 3,5 de DG (IC95%: 1,1-10,5) comparado con TG<96mg/dl. Incremento lineal del riesgo de DG con el incremento de TG (20mg/dl más de TG RR 1,1 DG) |
| Khan, 201233 | Caso-control | Determinar los cambios en el perfil lipídico y en los niveles de HbA1c en DG | 200 | 103 | HbA1c: significativamente más alta en DG que en controles. Colesterol total y TG significativamente elevados en pacientes con DG | |
| Schaefer-Graf, 200842 | Descriptivo prospectivo | Analizar la contribución de la glucemia y perfil lipídico maternos al metabolismo intrauterino y crecimiento fetal en pacientes con DG | 150 | 150 | 3.er trimestre | TG+FFA se correlacionan con crecimiento fetal durante 3T en gestantes con DG (r: 0,26, r: 0,28; respectivamente). No correlación de glucemia con crecimiento fetal |
| Emet, 201325 | Longitudinal prospectivo | Determinar el efecto de cambios en perfil lípido materno durante gestación en relación al crecimiento y desarrollo fetal, pronóstico y complicaciones de la gestación | 801 | 31 | 1.er-3.er trimestre | No correlación entre los cambios en perfil lipídico y la DG. No todos los resultados estadísticamente significativos |
| Dos Santos-Weiss, 201243 | Caso-control | Determinar si logaritmo plasmático TG/HDL-colesterol (índice aterogénico del plasma) predice el riesgo de desarrollar DG en edades gestacionales precoces | 576 | 288 | 4 períodos: 12-23sg; 24-28sg; 29-32sg; >32sg | El índice aterogénico plasmático es un buen predictor para identificar mujeres embarazadas con bajo riesgo de DG, antes de las 24sg (sensibilidad: 82,6%; especificidad: 83,4%) |
| Bowers, 201234 | Prospectivo-cohortes | Determinar si la cantidad total, tipo y fuente del contenido graso de la dieta durante la gestación están relacionados con la DG | 13.475 | 860 | Dietas ricas en grasas de origen animal y colesterol durante la gestación están asociadas a un mayor riesgo de DG (RR: 1,88; IC95% 1,36-2,60, y RR: 1,45: IC95%: 1,11-1,89, respectivamente) | |
| Brisson, 201339 | Cohortes-prospectivo | Analizar la asociación entre el índice de acumulación central de lípidos ([circunferencia cintura−58]×TG) en edades gestacionales tempranas y alteraciones en la regulación de la glucosa o resistencia a la insulina en el 2.° trimestre | 180 | 11-14sg/24-28sg | El índice de acumulación central de lípidos obtenido en el 1.er trimestre es un buen predictor de estados de resistencia a la insulina entre gestantes sin historia previa de DG | |
| Son, 201036 | Retrospectivo | Evaluar la contribución de los lípidos maternos en la predicción de los recién nacidos grandes para edad gestacional en gestantes DG | 104 | 104 | 24-32sg | Niveles de TG maternos significativamente mayores en madres de RN grandes para edad gestacional. Ausencia de correlación del peso RN con la glucemia, colesterol total o HDL |
CT: colesterol total; DG: diabetes gestacional; FFA: ácidos grasos libres; Hb1ac: hemoglobina glucosilada; IC: intervalo de confianza; OR: odds ratio; PE: preeclamspia; sg: semanas de gestación; RN: recién nacido; R: riesgo; RR: riesgo relativo; T: trimestre; TG: triglicéridos; VLDL, LDL, HDL: lipoproteínas de muy baja densidad, de baja densidad y de alta densidad.
No solo se ha descrito la dislipidemia como nexo entre la preeclampsia y la enfermedad cardiovascular18, sino que diversos estudios plantean también la asociación entre otros componentes del síndrome metabólico y el riesgo de preeclampsia, como la hipertensión arterial y el incremento de grasa visceral15,16,19.
De la dislipidemia observada en el embarazo, la hipertrigliceridemia se ha descrito como parte de la etiopatogenia y como predictor del riesgo de preeclampsia13,15,20-23. En este sentido, aunque los triglicéridos pueden estar elevados en las gestaciones normales, un incremento excesivo puede conducir a un entorno oxidativo con lesión endotelial y desarrollo consiguiente de preeclampsia18. Diversos estudios caso-control y de cohortes han hallado concentraciones de triglicéridos significativamente más elevadas en las gestantes preeclámpticas con respecto a las sanas16. Asimismo, se ha documentado que el número de casos de preeclampsia se incrementa de forma significativa a medida que aumenta la trigliceridemia18, cifrándose en estas condiciones un incremento del riesgo de 1,6 a 4,15 veces20,23. Es de destacar que la asociación de triglicéridos elevados (>181mg/dl) y concentraciones elevadas de LDL oxidado aumentaban el riesgo de preeclampsia en casi 9 veces (OR: 8,9; IC95%: 3,1-26,2)21. Si bien en la mayoría de estos estudios las muestras sanguíneas se obtuvieron en el tercer trimestre del embarazo, también se han encontrado concentraciones de triglicéridos superiores en la preeclampsia, cuando estas se determinan antes de las 20 semanas de gestación18,23,24.
En contraposición a estos datos, un reciente estudio prospectivo25 no mostró cambios significativos en los triglicéridos de 25 pacientes que desarrollaron preeclampsia (muestras recogidas <14 y >28 semanas de gestación a 801 embarazadas).
La mayoría de los estudios no encuentran incremento de la incidencia de preeclampsia en relación con las concentraciones de colesterol total y cLDL. Tan solo un estudio en el que se analizaron 350 gestantes a las 16semanas de gestación halló concentraciones plasmáticas de colesterol total superiores en preeclampsia (220,46±51,06mg/dl vs 201,35±42,89mg/dl, p=0,023)23, y otro demostró un aumento de riesgo de preeclampsia 3,6 veces superior para concentraciones séricas de colesterol total >205mg/dl (OR: 3,60; IC95%: 1,23-10,51)22. De forma paralela, se han descrito en estudios aislados concentraciones más elevadas de cLDL en las gestantes con preeclampsia14,26,27, e incremento del riesgo de preeclampsia de entre 2 y 3 veces para concentraciones elevadas de cLDL17,23.
Especial relevancia patogénica ha recibido la modificación oxidativa de las partículas LDL21, habiéndose descrito un aumento del riesgo de preeclampsia de casi 3 veces cuando los niveles de LDL oxidada eran superiores a 50U/l. Este riesgo era todavía mayor si se conjugaban triglicéridos y LDL oxidada elevados OR: 8,9; IC95%: 3,1-26,2, o si lo hacían niveles altos de LDL oxidada con niveles disminuidos de vitaminaC (OR: 9,8; IC95%: 3,0-32,2).
En referencia al cHDL, la mayor parte de los estudios señalan una tendencia a presentar niveles bajos en la eclampsia14,26-30, alcanzando significación estadística en solo uno de ellos16. En un estudio con gestantes colombianas se describió una odds ratio de 2,42 para el riesgo de preeclampsia en aquellas gestantes con cHDL <1,24mmol/l previo al parto (IC95%: 1,53-3,84)19.
Aunque la determinación de las lipoproteínas de muy baja densidad (VLDL) no se ha realizado en la mayoría de estudios clínicos, las gestaciones complicadas con preeclampsia presentan niveles aumentados de VLDL, y estos se correlacionaron positivamente con la proteinuria26,29,31.
Diabetes gestacionalLa diabetes gestacional es un estado hiperglucémico o de intolerancia a los hidratos de carbono que aparece por primera vez durante la gestación32. Es una de las complicaciones más comúnmente asociadas a la gestación, con una incidencia del 1 al 14%33,34. Implica un incremento del riesgo para desarrollar complicaciones obstétricas como la preeclampsia, el retraso de crecimiento intrauterino, la muerte fetal, la macrosomía y sus complicaciones, como la distocia de hombros, las hipoglucemias neonatales, el distrés respiratorio35. Además, las mujeres con historia previa de diabetes gestacional están más predispuestas a desarrollar diabetes mellitus tipo2 y episodios cardiovasculares.
El incremento de la producción hepática de VLDL por el hiperestrogenismo, junto con el estado de insulinorresistencia característico del embarazo, son los principales mecanismos responsables de la hipertrigliceridemia durante la gestación. Esta situación fisiológica se ve a su vez exacerbada en casos de diabetes gestacional21,36-38. En la tabla 2 se detallan los principales estudios que determinan las alteraciones del metabolismo lipídico en la diabetes gestacional y su posible impacto pronóstico.
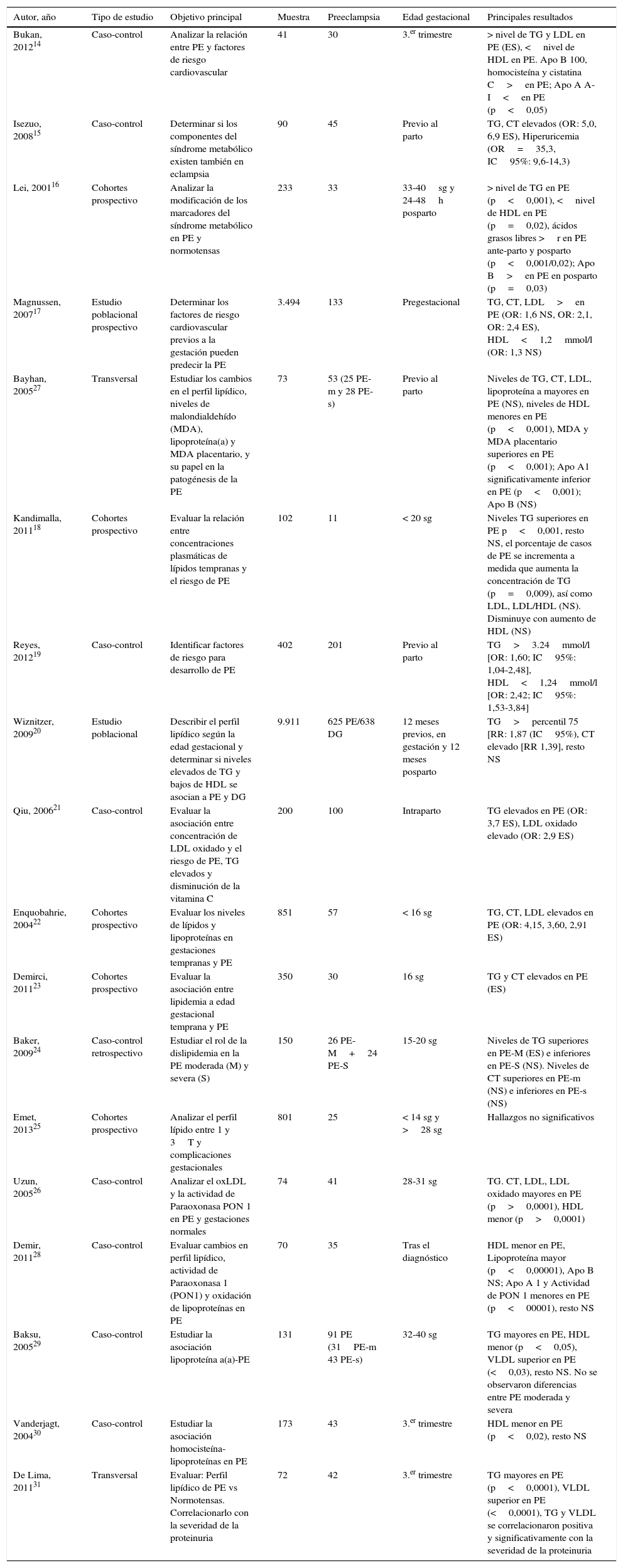
Resumen de artículos revisados: asociación entre niveles lipídicos y preeclampsia
| Autor, año | Tipo de estudio | Objetivo principal | Muestra | Preeclampsia | Edad gestacional | Principales resultados |
|---|---|---|---|---|---|---|
| Bukan, 201214 | Caso-control | Analizar la relación entre PE y factores de riesgo cardiovascular | 41 | 30 | 3.er trimestre | > nivel de TG y LDL en PE (ES), <nivel de HDL en PE. Apo B 100, homocisteína y cistatina C>en PE; Apo A A-I<en PE (p<0,05) |
| Isezuo, 200815 | Caso-control | Determinar si los componentes del síndrome metabólico existen también en eclampsia | 90 | 45 | Previo al parto | TG, CT elevados (OR: 5,0, 6,9 ES), Hiperuricemia (OR=35,3, IC95%: 9,6-14,3) |
| Lei, 200116 | Cohortes prospectivo | Analizar la modificación de los marcadores del síndrome metabólico en PE y normotensas | 233 | 33 | 33-40sg y 24-48h posparto | > nivel de TG en PE (p<0,001), <nivel de HDL en PE (p=0,02), ácidos grasos libres >r en PE ante-parto y posparto (p<0,001/0,02); Apo B>en PE en posparto (p=0,03) |
| Magnussen, 200717 | Estudio poblacional prospectivo | Determinar los factores de riesgo cardiovascular previos a la gestación pueden predecir la PE | 3.494 | 133 | Pregestacional | TG, CT, LDL>en PE (OR: 1,6 NS, OR: 2,1, OR: 2,4 ES), HDL<1,2mmol/l (OR: 1,3 NS) |
| Bayhan, 200527 | Transversal | Estudiar los cambios en el perfil lipídico, niveles de malondialdehído (MDA), lipoproteína(a) y MDA placentario, y su papel en la patogénesis de la PE | 73 | 53 (25 PE-m y 28 PE-s) | Previo al parto | Niveles de TG, CT, LDL, lipoproteína a mayores en PE (NS), niveles de HDL menores en PE (p<0,001), MDA y MDA placentario superiores en PE (p<0,001); Apo A1 significativamente inferior en PE (p<0,001); Apo B (NS) |
| Kandimalla, 201118 | Cohortes prospectivo | Evaluar la relación entre concentraciones plasmáticas de lípidos tempranas y el riesgo de PE | 102 | 11 | < 20 sg | Niveles TG superiores en PE p<0,001, resto NS, el porcentaje de casos de PE se incrementa a medida que aumenta la concentración de TG (p=0,009), así como LDL, LDL/HDL (NS). Disminuye con aumento de HDL (NS) |
| Reyes, 201219 | Caso-control | Identificar factores de riesgo para desarrollo de PE | 402 | 201 | Previo al parto | TG>3.24mmol/l [OR: 1,60; IC95%: 1,04-2,48], HDL<1,24mmol/l [OR: 2,42; IC95%: 1,53-3,84] |
| Wiznitzer, 200920 | Estudio poblacional | Describir el perfil lipídico según la edad gestacional y determinar si niveles elevados de TG y bajos de HDL se asocian a PE y DG | 9.911 | 625 PE/638 DG | 12 meses previos, en gestación y 12 meses posparto | TG>percentil 75 [RR: 1,87 (IC95%), CT elevado [RR 1,39], resto NS |
| Qiu, 200621 | Caso-control | Evaluar la asociación entre concentración de LDL oxidado y el riesgo de PE, TG elevados y disminución de la vitamina C | 200 | 100 | Intraparto | TG elevados en PE (OR: 3,7 ES), LDL oxidado elevado (OR: 2,9 ES) |
| Enquobahrie, 200422 | Cohortes prospectivo | Evaluar los niveles de lípidos y lipoproteínas en gestaciones tempranas y PE | 851 | 57 | < 16 sg | TG, CT, LDL elevados en PE (OR: 4,15, 3,60, 2,91 ES) |
| Demirci, 201123 | Cohortes prospectivo | Evaluar la asociación entre lipidemia a edad gestacional temprana y PE | 350 | 30 | 16 sg | TG y CT elevados en PE (ES) |
| Baker, 200924 | Caso-control retrospectivo | Estudiar el rol de la dislipidemia en la PE moderada (M) y severa (S) | 150 | 26 PE-M+24 PE-S | 15-20 sg | Niveles de TG superiores en PE-M (ES) e inferiores en PE-S (NS). Niveles de CT superiores en PE-m (NS) e inferiores en PE-s (NS) |
| Emet, 201325 | Cohortes prospectivo | Analizar el perfil lípido entre 1 y 3T y complicaciones gestacionales | 801 | 25 | < 14 sg y >28 sg | Hallazgos no significativos |
| Uzun, 200526 | Caso-control | Analizar el oxLDL y la actividad de Paraoxonasa PON 1 en PE y gestaciones normales | 74 | 41 | 28-31 sg | TG. CT, LDL, LDL oxidado mayores en PE (p>0,0001), HDL menor (p>0,0001) |
| Demir, 201128 | Caso-control | Evaluar cambios en perfil lipídico, actividad de Paraoxonasa 1 (PON1) y oxidación de lipoproteínas en PE | 70 | 35 | Tras el diagnóstico | HDL menor en PE, Lipoproteína mayor (p<0,00001), Apo B NS; Apo A 1 y Actividad de PON 1 menores en PE (p<00001), resto NS |
| Baksu, 200529 | Caso-control | Estudiar la asociación lipoproteína a(a)-PE | 131 | 91 PE (31PE-m 43 PE-s) | 32-40 sg | TG mayores en PE, HDL menor (p<0,05), VLDL superior en PE (<0,03), resto NS. No se observaron diferencias entre PE moderada y severa |
| Vanderjagt, 200430 | Caso-control | Estudiar la asociación homocisteína- lipoproteínas en PE | 173 | 43 | 3.er trimestre | HDL menor en PE (p<0,02), resto NS |
| De Lima, 201131 | Transversal | Evaluar: Perfil lipídico de PE vs Normotensas. Correlacionarlo con la severidad de la proteinuria | 72 | 42 | 3.er trimestre | TG mayores en PE (p<0,0001), VLDL superior en PE (<0,0001), TG y VLDL se correlacionaron positiva y significativamente con la severidad de la proteinuria |
Apo: apolipoproteína; CT: colesterol total; DG: diabetes gestacional; ES: estadísticamente significativo; IC: intervalo de confianza; m: meses; NS: no significación estadística; OR: odds ratio; PE: preeclamspia; PE-M: preeclampsia moderada; PE-S: preeclampsia severa; R: riesgo; RR riesgo relativo; sg: semanas de gestación; T: trimestre; TG: triglicéridos; VLDL, LDL, HDL: lipoproteínas de muy baja densidad, de baja densidad y de alta densidad.
Respecto al colesterol total, cHDL y cLDL, los resultados de los diferentes estudios realizados durante la gestación complicada con diabetes gestacional son dispares38 y no permiten extraer conclusiones. Se ha observado una mayor asociación entre diabetes gestacional e incremento de partículas LDL pequeñas y densas21,39, siendo el riesgo de diabetes hasta 5 veces superior con niveles elevados de esta partícula21,38.
Determinados factores dietéticos y el estilo de vida pregestacional se han relacionado con la diabetes gestacional. Así, se ha observado una asociación entre la diabetes gestacional y una dieta rica en grasas animales34, y una correlación positiva entre ingestas excesivas de alimentos ricos en colesterol y el diagnóstico de diabetes gestacional (incremento de 50mg de colesterol/1.000kcal asociado a un aumento del 88% de diabetes gestacional)40.
Las mujeres con diabetes gestacional tienen niveles plasmáticos incrementados de glucosa y triglicéridos; ello conlleva un incremento del aporte nutricional al feto, que puede implicar su crecimiento excesivo (macrosomía: feto con peso al nacimiento superior a 4.000g). La diabetes gestacional se asocia también al retraso de crecimiento intrauterino. En este sentido, las mujeres con diabetes gestacional que siguen un estricto control glucémico podrían mostrar tendencia a tener fetos pequeños o retraso de crecimiento intrauterino más que con macrosomía35.
La diabetes gestacional tiene tendencia a incrementar la susceptibilidad a la oxidación de las partículas LDL, lo que podría ocasionar mayores daños placentarios y alteraciones en los flujos, afectando negativamente al crecimiento fetal41.
La hipertrigliceridemia es un factor de riesgo independiente para tener neonatos grandes para la edad gestacional a término20,36. Las concentraciones elevadas de triglicéridos previas al parto serían predictores de fetos grandes para la edad gestacional en madres con diabetes gestacional con un correcto control metabólico42.
Más allá, el éxito de la insulinización con el objetivo de disminuir la macrosomía en pacientes con correcto control metabólico podría venir dado por la acción antilipolítica de la insulina y su capacidad para reducir la trigliceridemia, reduciendo así su potencial efecto sobre la masa grasa fetal.
En la mayoría de estudios los lípidos plasmáticos se han determinado en sangre materna una vez establecido el diagnóstico de diabetes gestacional, lo que dificulta establecer una relación de causalidad. Sin embargo, algunos hallazgos sugieren que la hipertrigliceridemia asociada a la diabetes gestacional podría estar ya presente en fases tempranas de la gestación. En un estudio en el que el perfil lipídico se determinó en muestras recogidas antes de la semana 13 de gestación, se observó que las mujeres con triglicéridos >137mg/dl tenían un riesgo 3,5 veces mayor de desarrollar diabetes gestacional comparado con aquellas con concentraciones <96mg/dl. Además, también evidenciaron una tendencia lineal en que por cada aumento de triglicéridos en 20mg/dl, el riesgo de diabetes gestacional se incrementaba un 10%22.
Recientemente se han apuntado 2 nuevos predictores de diabetes gestacional: el logaritmo del cociente TG/cHDL o índice aterogénico del plasma, y el índice de acumulación central de lípidos. El primero tiene una sensibilidad del 82,6%, especificidad del 83,4% y valor predictivo negativo del 97,8%, en gestaciones tempranas (12-24semanas) para discriminar entre pacientes sanas de aquellas con riesgo de desarrollar diabetes gestacional43. El segundo combina la circunferencia abdominal con los triglicéridos39, y medido en el primer trimestre de la gestación está asociado con un incremento de la resistencia a la insulina al final del segundo trimestre38, por lo que podría utilizarse como un marcador precoz de mujeres con riesgo de desarrollar diabetes gestacional.
Parto pretérminoEl parto pretérmino es la principal causa de morbimortalidad neonatal, especialmente en los países desarrollados44, en los que afecta al 12% de los nacimientos, y aunque las tasas se han mantenido estables, ha aumentado alrededor de un 20% en los últimos 20años45. Parto pretérmino se define como aquel que acontece antes de las 37semanas completas de la gestación y se clasifica tradicionalmente en parto anterior a las 34semanas completas de gestación (prematuridad de riesgo alto y moderado) y aquel que sucede entre la 34+0 semana y las 36+6 semana (prematuridad de bajo riesgo). Hay que distinguir entre el parto pretérmino iatrogénico por indicación médica a consecuencia de complicaciones relacionadas con la gestación, que representaría el 35% de los partos pretérmino46, y el parto pretérmino espontáneo o de origen desconocido.
Se han relacionado múltiples factores con el riesgo de parto pretérmino, como el antecedente de un parto pretérmino en gestaciones anteriores, la longitud cervical corta o los antecedentes familiares de parto pretérmino, además de los aspectos raciales y socioculturales. Todos ellos pueden ser fácilmente identificables en la entrevista clínica y los controles habituales de la gestante, e incluso alguno pueden ser objeto de tratamiento, como la longitud cervical corta.
Una mala placentación es la causa responsable del 30% de los partos pretérmino, sugiriendo que una deficiente adecuación vascular durante la gestación podría conllevar un riesgo aumentado de parto pretérmino y un exceso de riesgo de enfermedad cardiaca coronaria a largo plazo47.
Diferentes estudios han analizado la posible relación entre los cambios en el perfil lipídico durante la gestación y el riesgo de parto pretérmino espontáneo (tabla 3). Se ha descrito un aumento del riesgo de parto pretérmino en más de 3 veces si las gestantes presentan niveles elevados de ácidos grasos libres en el tercer trimestre de gestación48, y tasas de parto pretérmino elevadas (riesgo ajustado de 2,8 [parto <34semanas] y de 2,0 [>34 y <37semanas]) en pacientes que presentaban dislipidemia mixta durante el primer trimestre de gestación47. Se ha observado una asociación entre la existencia de hipertrigliceridemia posgestación y el antecedente de haber presentado un parto pretérmino, relacionando estos hallazgos con un aumento del riesgo cardiovascular a largo plazo49. Por otra parte, la hipertrigliceridemia preconcepcional puede aumentar hasta en un 60% el riesgo de parto pretérmino50, así como la detectada en el primero51 o en el segundo trimestre de la gestación, aumentando el riesgos hasta 5 veces51,52. Asimismo, se ha señalado que una baja tasa de cambio de triglicéridos durante el embarazo puede ser un marcador de riesgo de parto prematuro53,54. Frente a todas estas evidencias, 2 estudios no han demostrado asociación entre la hipertrigliceridemia y el parto pretérmino55,56. Por otra parte, algún estudio ha relacionado niveles bajos de triglicéridos y riesgo de parto pretérmino, aunque esta asociación únicamente se establece con el parto pretérmino iatrógeno y no con el parto pretérmino espontáneo (este último se relaciona con triglicéridos elevados)46.
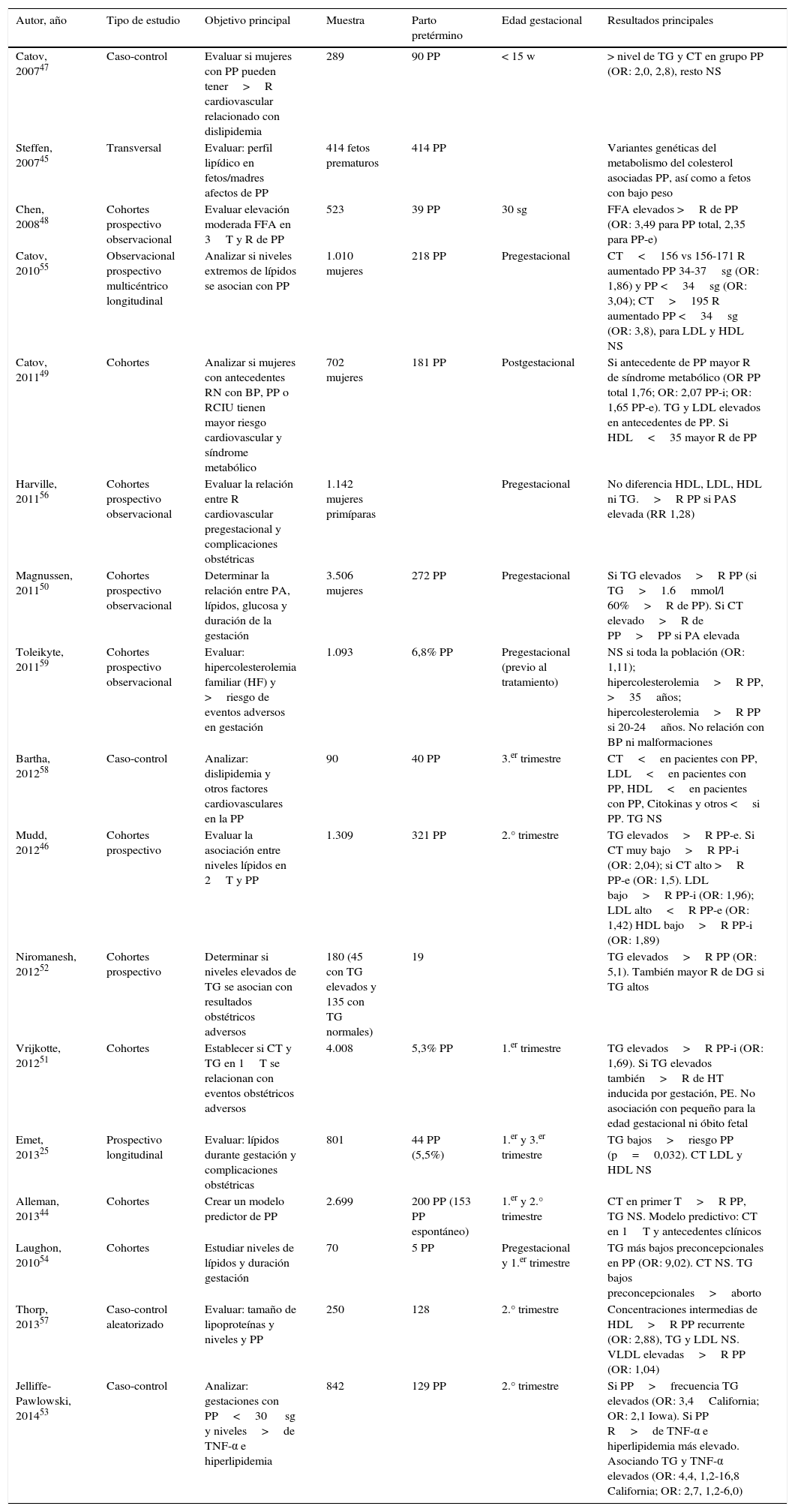
Resumen de artículos revisados: asociación entre niveles lipídicos y gestación pretérmino
| Autor, año | Tipo de estudio | Objetivo principal | Muestra | Parto pretérmino | Edad gestacional | Resultados principales |
|---|---|---|---|---|---|---|
| Catov, 200747 | Caso-control | Evaluar si mujeres con PP pueden tener>R cardiovascular relacionado con dislipidemia | 289 | 90 PP | < 15 w | > nivel de TG y CT en grupo PP (OR: 2,0, 2,8), resto NS |
| Steffen, 200745 | Transversal | Evaluar: perfil lipídico en fetos/madres afectos de PP | 414 fetos prematuros | 414 PP | Variantes genéticas del metabolismo del colesterol asociadas PP, así como a fetos con bajo peso | |
| Chen, 200848 | Cohortes prospectivo observacional | Evaluar elevación moderada FFA en 3T y R de PP | 523 | 39 PP | 30 sg | FFA elevados >R de PP (OR: 3,49 para PP total, 2,35 para PP-e) |
| Catov, 201055 | Observacional prospectivo multicéntrico longitudinal | Analizar si niveles extremos de lípidos se asocian con PP | 1.010 mujeres | 218 PP | Pregestacional | CT<156 vs 156-171 R aumentado PP 34-37sg (OR: 1,86) y PP <34sg (OR: 3,04); CT>195 R aumentado PP <34sg (OR: 3,8), para LDL y HDL NS |
| Catov, 201149 | Cohortes | Analizar si mujeres con antecedentes RN con BP, PP o RCIU tienen mayor riesgo cardiovascular y síndrome metabólico | 702 mujeres | 181 PP | Postgestacional | Si antecedente de PP mayor R de síndrome metabólico (OR PP total 1,76; OR: 2,07 PP-i; OR: 1,65 PP-e). TG y LDL elevados en antecedentes de PP. Si HDL<35 mayor R de PP |
| Harville, 201156 | Cohortes prospectivo observacional | Evaluar la relación entre R cardiovascular pregestacional y complicaciones obstétricas | 1.142 mujeres primíparas | Pregestacional | No diferencia HDL, LDL, HDL ni TG.>R PP si PAS elevada (RR 1,28) | |
| Magnussen, 201150 | Cohortes prospectivo observacional | Determinar la relación entre PA, lípidos, glucosa y duración de la gestación | 3.506 mujeres | 272 PP | Pregestacional | Si TG elevados>R PP (si TG>1.6mmol/l 60%>R de PP). Si CT elevado>R de PP>PP si PA elevada |
| Toleikyte, 201159 | Cohortes prospectivo observacional | Evaluar: hipercolesterolemia familiar (HF) y >riesgo de eventos adversos en gestación | 1.093 | 6,8% PP | Pregestacional (previo al tratamiento) | NS si toda la población (OR: 1,11); hipercolesterolemia>R PP, >35años; hipercolesterolemia>R PP si 20-24años. No relación con BP ni malformaciones |
| Bartha, 201258 | Caso-control | Analizar: dislipidemia y otros factores cardiovasculares en la PP | 90 | 40 PP | 3.er trimestre | CT<en pacientes con PP, LDL<en pacientes con PP, HDL<en pacientes con PP, Citokinas y otros <si PP. TG NS |
| Mudd, 201246 | Cohortes prospectivo | Evaluar la asociación entre niveles lípidos en 2T y PP | 1.309 | 321 PP | 2.° trimestre | TG elevados>R PP-e. Si CT muy bajo>R PP-i (OR: 2,04); si CT alto >R PP-e (OR: 1,5). LDL bajo>R PP-i (OR: 1,96); LDL alto<R PP-e (OR: 1,42) HDL bajo>R PP-i (OR: 1,89) |
| Niromanesh, 201252 | Cohortes prospectivo | Determinar si niveles elevados de TG se asocian con resultados obstétricos adversos | 180 (45 con TG elevados y 135 con TG normales) | 19 | TG elevados>R PP (OR: 5,1). También mayor R de DG si TG altos | |
| Vrijkotte, 201251 | Cohortes | Establecer si CT y TG en 1T se relacionan con eventos obstétricos adversos | 4.008 | 5,3% PP | 1.er trimestre | TG elevados>R PP-i (OR: 1,69). Si TG elevados también>R de HT inducida por gestación, PE. No asociación con pequeño para la edad gestacional ni óbito fetal |
| Emet, 201325 | Prospectivo longitudinal | Evaluar: lípidos durante gestación y complicaciones obstétricas | 801 | 44 PP (5,5%) | 1.er y 3.er trimestre | TG bajos>riesgo PP (p=0,032). CT LDL y HDL NS |
| Alleman, 201344 | Cohortes | Crear un modelo predictor de PP | 2.699 | 200 PP (153 PP espontáneo) | 1.er y 2.° trimestre | CT en primer T>R PP, TG NS. Modelo predictivo: CT en 1T y antecedentes clínicos |
| Laughon, 201054 | Cohortes | Estudiar niveles de lípidos y duración gestación | 70 | 5 PP | Pregestacional y 1.er trimestre | TG más bajos preconcepcionales en PP (OR: 9,02). CT NS. TG bajos preconcepcionales>aborto |
| Thorp, 201357 | Caso-control aleatorizado | Evaluar: tamaño de lipoproteínas y niveles y PP | 250 | 128 | 2.° trimestre | Concentraciones intermedias de HDL>R PP recurrente (OR: 2,88), TG y LDL NS. VLDL elevadas>R PP (OR: 1,04) |
| Jelliffe-Pawlowski, 201453 | Caso-control | Analizar: gestaciones con PP<30 sg y niveles>de TNF-α e hiperlipidemia | 842 | 129 PP | 2.° trimestre | Si PP>frecuencia TG elevados (OR: 3,4California; OR: 2,1 Iowa). Si PP R>de TNF-α e hiperlipidemia más elevado. Asociando TG y TNF-α elevados (OR: 4,4, 1,2-16,8 California; OR: 2,7, 1,2-6,0) |
BP: bajo peso; CT: colesterol total; DG: diabetes gestacional; FFA: ácidos grasos libres; HT: hipertensión; OR: odds ratio; PA: presión arterial; PAS: presión arterial sistólica; PE: preeclampsia; PP: parto pretérmino (PP-i, PE-e, PP espontáneo, iatrógeno); R: riesgo; RCIU: retraso de crecimiento intrauterino; RR; riesgo relativo; sg: semanas de gestación; T: trimestre; TG: triglicéridos; VLDL, LDL, HDL: lipoproteínas de muy baja densidad, de baja densidad y de alta densidad.
En un estudio de intervención con suplementos de ácidos grasos omega-3 en mujeres con antecedentes de partos pretérmino, solo se demostró una relación entre parto pretérmino recurrente y el tamaño de partículas VLDL medido mediante resonancia nuclear magnética57.
La mayoría de estudios que evalúan la relación entre la colesterolemia y el riesgo de parto pretérmino apoyan la teoría de que los niveles tanto elevados como bajos de colesterol serían un indicador de riesgo para parto pretérmino5,46,47,49,50,53-55. De los diferentes modelos desarrollados, el que mejor detecta las gestantes con predisposición al parto pretérmino contiene como variables el colesterol total en el primer trimestre y el incremento de colesterol entre trimestres, además de otros parámetros como la alfa-fetoproteína, la inhibina y las características de la paciente44. La combinación de índice de masa corporal materno bajo, concentraciones bajas de colesterol, con un cociente colesterol total/cHDL elevado, suele estar presente en las mujeres con parto pretérmino y se relaciona con la inflamación58. Es de destacar que las pacientes con hipercolesterolemia familiar heterocigota, y por tanto con concentraciones muy elevadas de colesterol total y cLDL, no presentan un riesgo incrementado de parto pretérmino59.
ConclusiónHa quedado patente que existe una íntima relación entre las 3 entidades patogénicas revisadas —preeclampsia, diabetes gestacional y parto pretérmino— con el metabolismo lipídico. En este sentido, la detección de alteraciones del perfil lipídico durante la gestación podría ser de utilidad para la predicción de acontecimientos adversos. Aunque la dislipidemia del embarazo no va a requerir tratamiento farmacológico, una estrategia terapéutica dirigida a un control metabólico global de la embarazada mejoraría los resultados obstétricos, así como la salud futura de madre e hijo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.