La hipercolesterolemia familiar (HF) es el trastorno genético autosómico dominante más frecuentemente asociado a enfermedad cardiovascular (ECV) prematura.
Material y métodosEstudio observacional, retrospectivo, para determinar las características clínicas, los parámetros analíticos y los factores de riesgo cardiovascular de 133 pacientes con diagnóstico genético confirmado de HF en seguimiento en la Unidad de Lípidos de Álava.
ResultadosEl 8,30% de los pacientes ha presentado ECV (en el 100% de los casos cardiopatía isquémica [CI]). El 40,60% alcanza el objetivo de cLDL: el 45,50% en prevención primaria y el 27,30% en prevención secundaria. El 81,80% de los pacientes con CI son varones. El odds ratio (OR) de presentar CI en los varones frente a las mujeres es 4,97 (1,03-23,93; p = 0,03). El OR de presentar CI en los pacientes con historia familiar de ECV prematura es 6,86 (1,32-35,67; p = 0,02). Encontramos una asociación estadísticamente significativa entre fumar y el riesgo de ECV (p=0,005) y también entre tener diabetes y el riesgo de ECV (p=0,0001). Si el tratamiento con estatinas se inicia antes de los 40 años, el OR de presentar CI es 6,40 (1,53-26,50; p=0,009). El tiempo medio desde el diagnóstico hasta el evento en el grupo de exfumadores es 10,80±5,80 años y en el grupo de no fumadores es 17,50±2,50 años (p=0,01).
ConclusionesEn nuestra población de referencia con HF, encontramos un mayor riesgo de presentar un evento cardiovascular en los pacientes varones, con antecedentes familiares de ECV prematura, diabéticos y en los que se ha iniciado el tratamiento hipolipidemiante después de los 40 años de edad.
Familial hypercholesterolaemia (FH) is the autosomal dominant genetic disorder most frequently associated with premature cardiovascular disease (CVD).
Material and methodsA retrospective, observational study was conducted to determine the clinical characteristics, analytical parameters and cardiovascular risk factors of 133 patients with a genetically confirmed diagnosis of FH on follow-up in the Lipid Clinic of Alava.
ResultsCVD was observed in 8.30% of the patients (ischaemic heart disease in 100% of the cases). The LDL concentration goal was achieved in 40.6% (45.50% in primary prevention and 27.30% in secondary prevention). The large majority (81.80%) of patients with coronary heart disease (CHD) were male. The odds ratio (OR) of males having CHD compared to females is 4.97 (1.03-23.93, P=.03). The OR of developing CHD in patients with a family history of premature CVD is 6.86 (1.32-35.67, P=.02). A statistically significant association was found between smoking and the risk of CVD (P=.005), and also between having diabetes and the risk of CVD (P=0.0001). If the treatment with statins begins at older than 40 years, the OR of suffering CHD is 6.40 (1.53-26.5) (P=.009). The mean time from diagnosis to the cardiovascular event in the group of ex-smokers is 10.80±5.80 years, and in the non-smoking group it is 17.50±2.50 years (P=.011).
ConclusionsIn our reference population with FH, it was found that there was an increased risk of suffering a cardiovascular event in male patients, with a family history of premature CVD, diabetics, and in those in whom lipid lowering treatment was started after 40 years of age.
La hipercolesterolemia familiar (HF) es el trastorno genético autosómico dominante más frecuentemente asociado a enfermedad cardiovascular (ECV) prematura, debido a concentraciones de colesterol LDL (cLDL) elevadas desde el nacimiento. Generalmente se ha estimado que la frecuencia de HF heterocigota en población caucásica es 1/500 y que 1/1.000.000 son homocigotos1. Sin embargo, en el Copenhagen General Population Study, se observó que la prevalencia de HF confirmada o probable, definida como una puntuación según los criterios de la Red de Clínicas de Lípidos Holandesas (DLCN), >5 puntos era de 1/2002. En España la prevalencia estimada estandarizada por edad y sexo del fenotipo de HF heterocigota es de 1/192 individuos y de homocigota es de 1/425.774 individuos3.
En los pacientes heterocigotos el gen mutado es el receptor de LDL (RLDL) en más del 90% de los casos, el gen de APOB en aproximadamente el 5% y mutaciones en el gen de proproteinconvertasasubtilisina/kexina tipo 9 (PCSK9) en aproximadamente el 1%4. Los pacientes con HF tienen entre 3 y 13 veces más riesgo de ECV prematura que los individuos sin HF2,5. En pacientes con HF heterocigota que no reciben tratamiento hipolipidemiante, típicamente se desarrolla enfermedad coronaria antes de los 55 años (varones) y 60 años (mujeres), mientras que los pacientes homocigotos desarrollarán enfermedad coronaria antes de los 20 años si no reciben tratamiento5.
En el estudio de cohortes Safeheart, se ha estimado que la prevalencia de diabetes entre los pacientes con HF es del 3,20%, del 14,40% con hipertensión arterial (HTA) y del 26,40% entre los pacientes que son fumadores activos. Así mismo, el 9,40% de estos pacientes han presentado ECV prematura6.
Los objetivos del presente estudio son conocer las características clínicas de los pacientes con HF, determinar el grado de control lipídico y analizar los factores de riesgo cardiovascular (FRCV) principales entre los pacientes en seguimiento en la Unidad de Lípidos del Hospital Universitario Araba.
Material y métodosTipo de diseño y población de estudioSe trata de un estudio observacional retrospectivo de 133 pacientes, con diagnóstico genético confirmado de HF, en seguimiento en la Unidad de Lípidos del Hospital Universitario Araba. La inclusión de pacientes se ha realizado desde el 2001 (año en el que se acredita la Unidad de Lípidos por la Sociedad Española de Arterioesclerosis) hasta junio de 2017, cuando se incluyeron los últimos pacientes con HF. Se han recogido tanto casos índices como casos familiares. Todos los pacientes eran mayores de 18 años, a excepción de 2casos familiares recientemente diagnosticados (de 11 y 13 años, respectivamente).
Variables de estudioSe han recogido datos demográficos (edad, sexo, edad al diagnóstico de HF, edad de inicio del tratamiento hipolipidemiante…), así como datos de la exploración física (peso, talla, presencia de arco corneal y xantomas tendinosos, entre otros) y datos analíticos (colesterol total [CT], cLDL, cHDL, TG, Lp[a]…). En el análisis estadístico de los datos de perfil lipídico, se ha excluido a los 2pacientes con edad inferior a 18 años y al paciente con diagnóstico de HF homocigota, para evitar que valores extremos alteraran la media del resto de los datos.
Además se han analizado FRCV como la diabetes, la HTA, el tabaquismo, los antecedentes familiares de ECV prematura, etc. Se ha considerado el diagnóstico de glucemia basal alterada si la glucemia en ayunas era ≥100mg/dl, diabetes si la glucemia basal era ≥126mg/dl o la HbA1c ≥6,5% y prediabetes si la HbA1c se encontraba entre 5,7 y 6,4%.
Finalmente, se ha valorado el tipo de tratamiento hipolipidemiante utilizado, así como la adherencia (en función del número de retirada de envases de cada fármaco en los últimos 6meses, según los datos recogidos de la prescripción electrónica) y las posibles reacciones adversas asociadas. En cuanto a la potencia de las estatinas utilizadas se han clasificado en de alta potencia (descenso del cLDL ≥ 50%), moderada potencia (descenso del cLDL entre 30 y<50%) y baja potencia (descenso de cLDL<30%). Los objetivos de control de cLDL se han definido según el documento de consenso de diagnóstico y tratamiento de la HF en España, teniendo en cuenta la edad, los FRCV asociados y si el paciente estaba en prevención primaria o secundaria7.
Para la determinación de los niveles de CT, TG, cLDL y cHDL se han utilizado métodos enzimáticos. Los niveles de cLDL se calcularon usando la fórmula de Friedewald. Los niveles de lipoproteína a (Lp[a]) se midieron con un método turbidimétrico (QuantiaLp(a), Abbott). El diagnóstico clínico de HF se ha realizado con base en los criterios DLCN; habitualmente se solicita el estudio genético cuando la puntuación DLCN es igual o mayor a 6 puntos. El diagnóstico genético se ha realizado en muestras de sangre (LIPOchip, Progenika®), con el consentimiento informado previo pertinente. Para la realización del Doppler de troncos supraaórticos (TSA) se ha empleado un ecógrafo GE Logiq (GE Healthcare®), con una sonda lineal de alta frecuencia (7,5-15MHz). La placa se definió como una estructura focal que protruye en la luz arterial más de 0,5mm o más del 50% del grosor íntima media de una zona contigua o cualquier grosor íntima media ≥ 1,5mm. Para la medición del índice tobillo-brazo (ITB) se ha empleado un tensiómeto digital dual Microlife Watch BP Office Abi®; se ha considerado patológico un valor<0,9.
Análisis estadísticoPara el estudio de las variables cuantitativas, se analizó si estos parámetros seguían una distribución normal (prueba de normalidad de Kolmogorov-Smirnov). Si la distribución era normal, los valores se presentan como media±desviación estándar (mínimo-máximo) y si no seguía una distribución normal se expresa como mediana (p25-p75). Se ha utilizado la prueba t de Student para muestras emparejadas en los casos en los que la distribución era normal y el test de Wilcoxon cuando no se cumplía este requisito.
En el caso de variables categóricas, se expresan como porcentaje, comparando las proporciones entre grupos mediante χ cuadrado (χ2) o la prueba exacta de Fisher (si los tamaños muestrales eran reducidos). Para estimar la posible asociación entre un FRCV y la ECV se ha empleado el odds ratio (OR). El nivel de significación estadística se ha fijado en p<0,05. El tiempo desde el diagnóstico hasta el evento cardiovascular se ha comparado mediante el análisis de supervivencia de Kaplan-Meier.
Para la gestión y el análisis estadístico de los datos, se han utilizado el programa estadístico IBM SPSS Statistics 22® y el Epidat 3.1®.
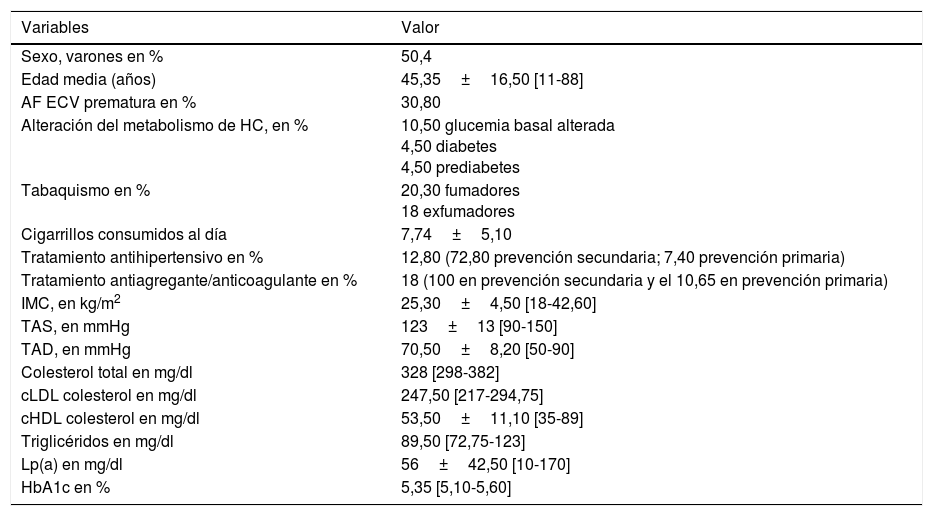
ResultadosLa muestra está constituida por 133 pacientes con diagnóstico genético confirmado de HF. Se presentan las características demográficas (sexo, edad, edad media al diagnóstico, edad media de inicio del tratamiento), clínicas (diabetes, tabaquismo, tensión arterial, IMC, tratamiento antiagregante) y los valores lipídicos iniciales en la tabla 1.
Características demográficas, clínicas y valores lipídicos iniciales
| Variables | Valor |
|---|---|
| Sexo, varones en % | 50,4 |
| Edad media (años) | 45,35±16,50 [11-88] |
| AF ECV prematura en % | 30,80 |
| Alteración del metabolismo de HC, en % | 10,50 glucemia basal alterada 4,50 diabetes 4,50 prediabetes |
| Tabaquismo en % | 20,30 fumadores 18 exfumadores |
| Cigarrillos consumidos al día | 7,74±5,10 |
| Tratamiento antihipertensivo en % | 12,80 (72,80 prevención secundaria; 7,40 prevención primaria) |
| Tratamiento antiagregante/anticoagulante en % | 18 (100 en prevención secundaria y el 10,65 en prevención primaria) |
| IMC, en kg/m2 | 25,30±4,50 [18-42,60] |
| TAS, en mmHg | 123±13 [90-150] |
| TAD, en mmHg | 70,50±8,20 [50-90] |
| Colesterol total en mg/dl | 328 [298-382] |
| cLDL colesterol en mg/dl | 247,50 [217-294,75] |
| cHDL colesterol en mg/dl | 53,50±11,10 [35-89] |
| Triglicéridos en mg/dl | 89,50 [72,75-123] |
| Lp(a) en mg/dl | 56±42,50 [10-170] |
| HbA1c en % | 5,35 [5,10-5,60] |
AF: antecedentes familiares: ECV: enfermedad cardiovascular; HC: hidratos de carbono; IMC: índice de masa corporal; TAS: tensión arterial sistólica; TAD: tensión arterial diastólica.
En cuanto al tipo de mutación genética, el 78,50% son heterocigotos simples, el 20,80% presentan una mutación doble y un paciente (0,80%) es homocigoto. En el 95,40% de los casos el gen mutado se encuentra en RLDL. En el 3,10% de los pacientes la mutación se localiza en el gen de APOB y en el 1,50% en el gen de APOE. En nuestra muestra, la puntuación media según los criterios DLCN es 11,70±3,80 (5-21) y el 10,50% de nuestros pacientes presentan una mutación tipo alelo nulo. Las mutaciones más frecuentes en nuestra muestra son c.313+1G>C en combinación con c.274C>G (cambio de aminoácido más splicing, 17 pacientes); c.313+2dupT (splicing, 9 pacientes) y la deleción del exón 5 (8 pacientes).
El CT al diagnóstico sin tratamiento hipolipidemiante (328 [298-382] mg/dl) es significativamente mayor que el CT en el último año (180 [160-200] mg/dl; p=0,000). El cLDL al diagnóstico (247,50 [217-294,75] mg/dl) es significativamente mayor que el cLDL medio en el último año (115 [99-129,5] mg/dl; p=0,000). No encontramos diferencias estadísticamente significativas en los niveles de Lp(a) antes y después del inicio del tratamiento hipolipidemiante (p=0,31). En el 14,30% de nuestros pacientes la Lp(a) resultó ser indetectable. Tampoco encontramos diferencias estadísticamente significativas en los niveles de HbA1c antes o después del inicio del tratamiento hipolipidemiante (p=0,08).
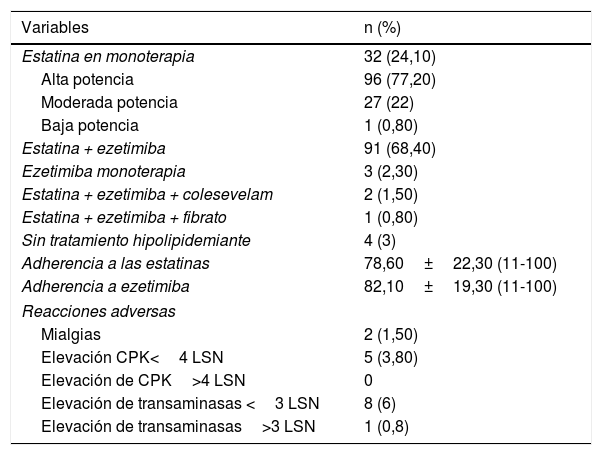
Las características del tratamiento hipolipidemiante se describen en la tabla 2. Cabe destacar que no encontramos diferencias estadísticamente significativas en la adherencia a estatinas (p=0,80) o en la adherencia a ezetimiba (p=0,58) en función del sexo.
Tratamiento hipolipidemiante
| Variables | n (%) |
|---|---|
| Estatina en monoterapia | 32 (24,10) |
| Alta potencia | 96 (77,20) |
| Moderada potencia | 27 (22) |
| Baja potencia | 1 (0,80) |
| Estatina + ezetimiba | 91 (68,40) |
| Ezetimiba monoterapia | 3 (2,30) |
| Estatina + ezetimiba + colesevelam | 2 (1,50) |
| Estatina + ezetimiba + fibrato | 1 (0,80) |
| Sin tratamiento hipolipidemiante | 4 (3) |
| Adherencia a las estatinas | 78,60±22,30 (11-100) |
| Adherencia a ezetimiba | 82,10±19,30 (11-100) |
| Reacciones adversas | |
| Mialgias | 2 (1,50) |
| Elevación CPK<4 LSN | 5 (3,80) |
| Elevación de CPK>4 LSN | 0 |
| Elevación de transaminasas <3 LSN | 8 (6) |
| Elevación de transaminasas>3 LSN | 1 (0,8) |
CPK: creatininfosfocinasa; LSN: límite superior de la normalidad.
El 91,70% de los pacientes no ha presentado ningún evento cardiovascular (prevención primaria) y el 8,30% se encuentra en prevención secundaria (en el 100% de los casos por cardiopatía isquémica [CI]). El 40,60% alcanza el objetivo de cLDL: el 45,50% en prevención primaria y el 27,30% en prevención secundaria. El 81,80% de los pacientes con CI son varones. El OR de presentar CI en los varones frente a las mujeres es 4,97 (1,03-23,93; p=0,03). El OR de presentar CI en los pacientes con historia familiar de ECV prematura es 6,86 (1,32-35,67; p=0,02).
Sin embargo, no se encuentra una asociación estadísticamente significativa entre presentar ECV y tener un ITB patológico (p=0,08) o tener placas en el Doppler TSA (p=0,59). Entre los pacientes con CI, solo el 33,30% presenta un ITB<0,9. Entre los pacientes con CI, el 44,40% presentaban placas de ateroma sin repercusión hemodinámica en el Doppler TSA y ningún paciente presentó estenosis vascular. El único paciente que presentaba estenosis<50% se encontraba en el grupo sin ECV y ninguno de nuestros pacientes presentó estenosis vascular>50%.
Encontramos una asociación estadísticamente significativa entre fumar y el riesgo de ECV (p=0,005). En los exfumadores (54% de los pacientes con CI) el OR era 6,50 (1,66-25,5) y en los fumadores el OR era 0,75 (0,08-7,02). Por lo que no existe una relación lineal entre la exposición al tabaco y el mayor riesgo cardiovascular (p=0,55).
Existe una asociación estadísticamente significativa entre tener diabetes y el riesgo de ECV (p=0,0001). El OR en pacientes con diabetes es 25,75 (3,90-169,80) y en pacientes con prediabetes de 12,90 (1,8-92,3). Existe una relación lineal entre el grado de alteración del metabolismo de los hidratos de carbono y el riesgo de ECV (p=0,001). Sin embargo, en nuestra muestra, no existe asociación entre el riesgo de desarrollar diabetes y la potencia de la estatina utilizada (p=0,99).
Existe una asociación estadísticamente significativa entre el diagnóstico de HF previo a las generalización del uso de estatinas (utilizando como punto de corte el año 1995) y el riesgo de CI (p=0,01). De hecho, el riesgo de presentar un evento cardiovascular es 5,80 (1,42-23,97) veces mayor si el diagnóstico de HF se realizó antes de la generalización del uso de las estatinas. No hay diferencias estadísticamente significativas entre haber comenzado el tratamiento con estatinas antes o después de los 18 años de edad y el riesgo de presentar CI (p=0,213). Sin embargo, si el tratamiento con estatinas se inicia después de los 40 años, el OR de presentar CI es 6,40 (1,53-26,50; p=0,01).
Se encuentran diferencias estadísticamente significativas en el tiempo desde el diagnóstico de HF hasta el evento cardiovascular en función de la exposición al tabaco (p=0,01). El tiempo medio desde el diagnóstico hasta el evento en el grupo de exfumadores es 10,80±5,80 años y en el grupo de no fumadores es de 17,50±2,50 años. Sin embargo, no encontramos diferencias estadísticamente significativas en el tiempo hasta el evento cardiovascular en función de la diabetes (p=0,51), el sexo (p=0,40), la historia familiar de ECV prematura (p=0,13) o la potencia de la estatina utilizada (p=0,42).
En los 6pacientes en tratamiento con inhibidores de PCSK9 (evolocumab), el CT medio es 154±46 mg/dl (100-210) y el cLDL medio es 77,30±32 mg/dl (30-110). El descenso medio del CT en pacientes en tratamiento con evolocumab es 40,50±14,60% y de cLDL es 56,30±17,20%.
DiscusiónLa media de pacientes diagnosticados de HF en España se estima aproximadamente en el 6%, tomando una frecuencia de HF 1/5005. Teniendo en cuenta que nuestra población de referencia, según datos del Instituto Nacional de Estadística (2016), es de 324.126 habitantes, supondría que el 20,50% de los pacientes con HF de la provincia de Álava están diagnosticados. De modo que el porcentaje de pacientes diagnosticados es superior a la media de nuestro país. No obstante, si consideramos que la frecuencia real de HF es más cercana a 1/200, tan solo tendríamos diagnosticados al 8,20% de estos pacientes2.
El 50,40% de nuestros pacientes son varones, la edad media es de 45,35 años y el 30,80% de los pacientes tienen antecedentes familiares de ECV prematura. Los datos son similares a los obtenidos en el registro Safeheart, con un 45,2% de varones, una edad media de 45,50 años y con antecedentes de ECV prematura en familiares en el 41,20% de los casos8. En nuestra muestra el 12,80% de los pacientes recibe tratamiento antihipertensivo, el 4,50% presenta diabetes y el 20,30% son fumadores. Datos concordantes se obtienen en la cohorte Safeheart, que presenta un 14,20% de pacientes hipertensos, un 4,30% de diabéticos de tipo 2 y un 25,60% de fumadores activos8. Los niveles de CT y de cLDL basales de los pacientes con diagnóstico clínico definitivo de HF en el registro de la Sociedad Española de Arterioesclerosis son 340mg/dl y 260mg/dl, respectivamente, que son similares a los valores encontrados en el presente estudio (CT: 342,50mg/dl y cLDL: 262,10mg/dl)9.
En nuestro estudio el 95,40% de los pacientes presenta una mutación del gen del RLDL, el 3,10% en el gen de APOB y el 1,50% en el gen de APOE. Los datos son compatibles con estudios previos que estiman que la mutación causante de HF es el RLDL en más del 90% de los casos y el gen de APOB en aproximadamente el 5%4. En nuestra muestra una familia presenta una mutación en el gen de APOE. Los estudios de secuenciación de nueva generación han demostrado que muy ocasionalmente la HF se debe a mutaciones dominantes en el gen de APOE, que codifica la apolipoproteína E, o en el gen STAP110.
En nuestro estudio el 8,30% de los pacientes ha presentado CI, valores similares al 11,80% de los pacientes que habían presentado enfermedad ateroesclerótica de las arterias coronarias en el registro Safeheart6. El 27,30% de nuestros pacientes en prevención secundaria consiguen un cLDL<70mg/dl, datos similares a los obtenidos en el Euroaspire IV, con un 80,50% de los pacientes con cLDL>70mg/dl11. Sin embargo, estos datos de consecución de objetivos lipídicos de nuestra muestra de pacientes en prevención secundaria son mejores que los resultados obtenidos en el registro Safeheart, en el que tan solo un 4,70% de los pacientes lograba un cLDL<70mg/dl durante el seguimiento12.
En el presente estudio, el riesgo de presentar CI es casi 5 veces superior en los varones que en las mujeres. Estos datos son discordantes con los obtenidos en el estudio realizado por Zamora et al., en el que no se encontraba una asociación estadísticamente significativa entre el sexo y el riesgo de CI en una población con fenotipo de HF3. Sin embargo, esta asociación entre sexo masculino y mayor riesgo de CI ya se había establecido por Hopkins et al., que en su estudio de 266 pacientes con HF heterocigota encontraron un riesgo de enfermedad coronaria 5,64 veces mayor en los varones13.
A diferencia del registro Safeheart, en el que no se encontró una asociación entre el antecedente familiar de ECV prematura y presentar un mayor riesgo cardiovascular, en nuestro estudio los pacientes con historia familiar de ECV prematura tienen casi 7 veces más riesgo de presentar un evento6. Este riesgo es mayor al observado en el estudio de deGoma et al., en el que se encontró una OR ajustada por el resto de FRCV de 1,84 en los pacientes con antecedentes familiares de ECV prematura14.
La asociación entre diabetes y ECV es muy importante en nuestro estudio: el riesgo de padecer enfermedad coronaria es 25 veces mayor en los pacientes diabéticos. Estos datos superan los observados en el estudio Safeheart, en el que se ha encontrado un OR para diabetes de 1,586. Sin embargo, nuestros resultados se aproximan a los obtenidos por De Sauvage Nolting et al., que demostraron un riesgo de ECV 17,61 veces superior en los pacientes diabéticos15.
La principal limitación de este trabajo es que se trata de un estudio observacional retrospectivo y, por tanto, la fiabilidad de las conclusiones extraídas no es comparable a la de un ensayo clínico aleatorizado. No obstante, nos ha permitido realizar un análisis descriptivo de los pacientes con HF en nuestra población de referencia y estimar qué factores de riesgo pueden estar asociados de manera más directa con la ECV. Por otro lado, el tamaño muestral no es comparable al del estudio Safeheart y, por tanto, las asociaciones encontradas con los diferentes FRCV puede que sean exclusivas de nuestra población de referencia y no sean completamente extrapolables al resto de la población española con HF.
ConclusionesEn nuestra población de referencia con HF, encontramos un mayor riesgo de presentar un evento cardiovascular en los pacientes varones, con antecedentes familiares de ECV prematura, diabéticos y en los que se ha iniciado el tratamiento hipolipidemiante más allá de los 40 años de edad.
A Luis Irigoyen, del Hospital Clínico Universitario Lozano Blesa de Zaragoza, responsable de la Unidad de Lípidos de Álava hasta 2014.