La ecocardiografía transesfofágica es una técnica semiinvasiva que permite una evaluación de la morfología y función cardiaca a tiempo real y que constituye, a día de hoy, un estándar de calidad en las intervenciones de cirugía cardiovascular. Se ha convertido en una herramienta fundamental tanto de monitorización como de diagnóstico en el perioperatorio que permite la correcta planificación quirúrgica y manejo farmacológico dirigido.
El objetivo de este documento es dar respuesta de forma consensuada y avalada por la evidencia científica de cuándo y cómo debe hacerse la ecocardiografía transesfofágica intraoperatoria en cirugía cardiovascular, qué aplicaciones tiene en el intraoperatorio, quién debe realizarla y cómo debe transmitirse la información obtenida durante el estudio. Los autores han hecho una revisión sistemática de las guías internacionales, artículos de revisión y ensayos clínicos para dar respuesta a estas preguntas.
Transesophageal echocardiography is a semi-invasive technique that allows an evaluation of cardiac morphology and function in real time and it is a quality standard in cardiovascular surgery. It has become a fundamental tool for both monitoring and diagnosis in the intraoperative period that allows decide the correct surgical planning and pharmacological management.
The goal of this document is to answer the questions of when and how the perioperative TEE should be performed in cardiovascular surgery, what are their applications in the intraoperative, who should perform it and how the information should be transmitted. The authors made a systematic review of international guidelines, review articles and clinical trials to answer by consensus to these questions.
El primer uso de ultrasonidos transesofágicos se remonta a 1971 con la medida de flujos en el arco aórtico. Posteriormente, se introduce en 1976 el modo M y en 1977 el modo bidimensional (2D). La época moderna de la ecocardiografía transesofágica (ETE) comienza en 1982 con la introducción de sondas flexibles que permiten la orientación en distintos planos y la obtención de imágenes bidimensionales (2D) y tridimensionales (3D). La ETE es una técnica semiinvasiva que permite una evaluación de la morfología y función cardiaca a tiempo real y que constituye, a día de hoy, un estándar de calidad en las intervenciones de cirugía cardiovascular y que ha demostrado influir favorablemente en el pronóstico postoperatorio de los pacientes intervenidos1,2. Constituye una herramienta fundamental tanto de monitorización como de diagnóstico en el perioperatorio que permite la correcta planificación quirúrgica y valoración de la respuesta del sistema cardiovascular a las intervenciones quirúrgicas y farmacológicas3.
La difusión de la ETE en los procedimientos quirúrgicos cardiovasculares ha hecho que algunas series comuniquen nuevos hallazgos en la exploración ecográfica precirculación extracorpórea (pre-CEC) en un 6-7,7% de los pacientes, requiriendo modificación del plan quirúrgico hasta en un 43,8% de los mismos4–7. Estos hallazgos pueden explicarse por la mejor calidad de imagen de la ETE frente a la ecografía transtorácica (ETT) y/o el tiempo transcurrido entre la ETT preoperatoria y la fecha de la cirugía. Estos mismos estudios arrojan en torno a un 6% de hallazgos no esperados poscirculación extracorpórea (post-CEC) requiriendo en la mitad de estos pacientes la reentrada en CEC5,8,9. Por otra parte, su utilidad e indicación se está extendiendo a distintos contextos perioperatorios y a otro tipo de intervenciones como cirugía torácica, vascular o hepática10,11.
Ante esta situación surge la necesidad por parte de la Sociedad Española de Anestesiología y Reanimación (SEDAR) y Sociedad Española de Cirugía Cardiovascular y Endovascular (SECCE) de crear un documento de consenso basado en las guías internacionales y práctica habitual para dar respuesta a los siguientes interrogantes12: ¿Quién debe realizar la ETE durante la cirugía cardiaca?, ¿Está siempre indicado?, ¿Qué contraindicaciones tiene?, ¿Cómo debe hacerse, debe seguirse una sistemática de estudio de ETE en las intervenciones de cirugía cardiaca?, ¿Qué información debe aportar en cada procedimiento?.
El objetivo de este documento es dar respuesta de forma consensuada y avalada por la evidencia científica de cuándo y cómo debe hacerse la ETE perioperatoria, qué aplicaciones tiene en el intraoperatorio, quién debe realizarla y cómo debe transmitirse la información obtenida durante el estudio. Los autores han hecho una revisión sistemática de las guías internacionales, artículos de revisión y ensayos clínicos para el contenido de este trabajo.
¿Quién debe realizar la ETE intraoperatoria en cirugía cardiovascular? Formación y acreditaciónLos continuos y rápidos avances en el diagnóstico y tratamiento de los pacientes con enfermedades cardiovasculares justifican la necesidad de adquirir una formación específica en ETE y su continua actualización de los médicos especialistas en anestesiología y reanimación y otros especialistas implicados en el perioperatorio. Un sólido entrenamiento en el manejo de la ecocardiografía es actualmente de vital importancia en la formación integral del especialista en patología quirúrgica cardiovascular, por lo que se ha de adquirir una amplia formación y experiencia en su utilización, iniciándose durante el periodo de formación de la especialidad.
La acreditación formal en ETE es un estándar para cualquier anestesiólogo cardiaco que trabaje en Canadá, Inglaterra, Australia y EE. UU. En Europa, la Sociedad Europea de Anestesia Cardio-Torácica (EACTA) ha puesto en marcha diferentes programas de acreditación societaria, entre los que se encuentra el de competencias profesionales, que plantea un modelo de certificación basado en la práctica real del profesional, que reconoce los logros obtenidos a lo largo de su trayectoria y que favorece su desarrollo profesional. Recientemente se ha publicado un documento de consenso definiendo las competencias a adquirir para la realización de un programa de formación o fellowship en anestesia cardiovascular por parte de la EACTA. Este programa incluye la adquisición de la acreditación en ETE de la Asociación Europea de Imagen Cardiovascular junto con la Sociedad Europea de Anestesia Cardio-Torácica (EACVI/EACTA). Dichas sociedades han identificado las competencias que debe de tener un profesional y las buenas prácticas que ha de realizar en su puesto de trabajo, así como las evidencias y pruebas que permitirán reconocerlas. Y recomiendan la obtención de la acreditación oficial en ETE (EACVI/EACTA) para la práctica independiente como anestesiólogo cardiaco en Europa. En el documento se expone: «La interpretación y comunicación de hallazgos patológicos mediante la ETE es parte integral de la anestesia cardiaca. Por tanto, la Sociedad Europea de Anestesia Cardio-Torácica (EACTA) y los directores de los programas de fellowship consideran la adquisición de conocimiento y práctica avanzada en ETE un requisito obligatorio para los fellows en anestesia cardiaca»13,14.
En España la SEDAR y su Sección de Anestesiología Cardiovascular, como institución que representa a los anestesiólogos cardiovasculares en España, suscribe las mismas recomendaciones que la EACTA para aumentar la seguridad y calidad de la atención de los pacientes sometidos a cirugía cardiaca. Además de la acreditación, la formación en ETE debe tener continuidad y ser constantemente actualizada. Con este objetivo es importante estar en contacto con las unidades de imagen cardiaca de los servicios de cardiología. La comunicación de forma presencial o remota con los servicios de cardiología hospitalaria es primordial como apoyo y para resolver posibles dudas en la toma de decisiones. La toma de decisiones erróneas basada en una incorrecta interpretación de los hallazgos ecocardiográficos puede ser perjudicial para el paciente, así como implicar un riesgo añadido desde el punto de vista legal para el profesional.
En España, por el momento, la capacitación específica mediante programas de formación o fellowship en ecocardiografía y/o anestesia cardiaca no está extendida, aunque cada vez existen más cursos presenciales, online y rotaciones específicas en esta área de conocimiento organizados tanto por anestesiólogos como por cardiólogos especialistas en técnicas de imagen.
En conclusión, consideramos que la realización de la ETE en el ámbito perioperatorio de la patología quirúrgica cardiaca corresponde al anestesiólogo responsable con formación específica en anestesia cardiovascular y ETE para el ámbito perioperatorio. No obstante, en función de su nivel de competencia, formación y experiencia pudiera ser necesaria la colaboración de cardiología.
Indicaciones y principales aplicaciones clínicasLas últimas guías publicadas en 2013 y 2014 por la Sociedad Americana de Ecocardiografía (ASE)1 y la Sociedad Americana de Anestesiólogos Cardiovasculares (SCA) 3 y la Asociación Europea de Imagen Cardiovascular (EACVI)14,15 establecen que la ETE intraoperatoria se debe realizar en:
- -
Todos los procedimientos de cirugía cardiaca abierta y cirugía de aorta torácica
- -
Algunas cirugías de revascularización coronaria
- -
Los procedimientos transcatéter intracardiaco: Implante transcatéter de válvula aórtica (TAVI), clip mitral, cierre de orejuela, cierre de comunicación auricular, implante de asistencia ventricular y de oxigenación por membrana extracorpórea (ECMO)16.
De modo general se recomienda en la actualidad la monitorización con ETE durante la cirugía cardiovascular en todo paciente sometido a una intervención cardiaca salvo que exista contraindicación.
Aplicaciones generales en cirugía cardiaca convencionalValoración en las distintas etapas de la cirugía cardiaca.
Pre-CECAntes de entrar en CEC deben ser valorados los siguientes aspectos:
- -
Contractilidad global y segmentaria de ambos ventrículos.
- -
Volemia/precarga/gasto cardiaco, presiones arteriales pulmonares y de llenado del ventrículo (VI).
- -
Valoración anatómica y funcional valvular, y descartar alteraciones valvulares asociadas y no diagnosticadas previamente.
- -
Evaluación de la presencia de cortocircuitos izquierda-derecha (foramen oval permeable, comunicación interauricular (CIA), comunicación interventricular.
- -
Valoración de la presencia de trombos, masas, catéteres o vegetaciones.
- -
Estudio del pericardio: derrame o calcificación.
- -
Detección de placas de ateroma en aorta que puedan condicionar modificación del lugar de canulación o pinzamiento aórtico.
- -
Parámetros específicos de la cirugía. Obtención de parámetros y medidas que sean de utilidad en la estrategia quirúrgica (anillo aórtico, senos de Valsalva, unión sinotubular, aorta ascendente, anillo mitral, anillo tricúspide, longitud de velos mitral, grosor septal, etc.).
- -
Evaluación de la correcta colocación de cánula venosa en vena cava inferior y cánula de cardioplejía retrógrada en seno coronario.
- -
Detección de derrame pleural y atelectasias y consolidaciones.
- -
Contractilidad orejuela izquierda.
- -
Comparación con el estudio preoperatorio.
- -
Detección de aire intracavitario para guiar las maniobras de deaireación.
- -
Evaluación de la precarga para guiar las maniobras de reposición de volumen.
- -
Evaluación de la función ventricular para guiar el aporte de fármacos y asistencias mecánicas.
- -
Detección de nuevas alteraciones de la contractilidad.
- -
Detección de alteraciones valvulares no existentes pre-CEC.
- -
Descartar la presencia de hematoma periaórtico poscanulación u otras lesiones secundarias a la manipulación quirúrgica.
- -
Contractilidad orejuela izquierda
- -
Valoración de los resultados quirúrgicos.
- -
Evaluación de normoposición del extremo distal del BCIAo.
- -
Valoración del pulmón (atelectasias) y pleuras (derrame pleural). Transesophageal echocardiography lung ultrasound (TELU).
Además de la información obtenida en la monitorización básica, hay que añadir una valoración específica dependiendo del tipo de cirugía que se vaya a realizar.
Cirugía valvular: reparación y recambio- -
Normoinserción y estabilidad de la prótesis.
- -
Valoración de los ostia coronarios.
- -
Obtención de velocidades y gradientes transprotésicos.
- -
Presencia de fugas intra- o periprotésicas.
- -
Evaluación de competencia funcional: apertura global y presencia de insuficiencia residual o estenosis posreparación.
- -
Presencia de obstrucción dinámica en el tracto de salida del VI con o sin insuficiencia mitral (IM).
- -
Evaluación de CIA residual yatrógena.
- -
Presencia de movimiento sistólico anterior (SAM) residual.
- -
Descartar comunicación interventricular residual.
- -
-Valoración de puertas de entrada/salida de la disección y vasos sanguíneos dependientes de luz verdadera/falsa.
- -
-Competencia de la válvula aórtica (VAo).
- -
Parámetros de monitorización básica y valoración de la contractilidad global y segmentaria antes y después de la revascularización.
- 1.
Colocación de asistencias ventriculares.
- -
Comprobación de la normoposición de las cánulas intracardiacas.
- -
Control hemodinámico en el manejo de la asistencia ventricular. Información sobre distensión ventricular, falta de volumen o complicaciones trombóticas.
- 2.
Extracción transvenosa de electrodos de dispositivos de estimulación cardiaca.
- -
Seguimiento del procedimiento.
- -
Diagnóstico precoz de complicaciones: derrame pericárdico, rotura cardiaca, insuficiencia tricuspídea.
- 3.
Extirpación de tumores intracardiacos.
- 4.
Reparación de aneurismas ventriculares.
- 5.
Tromboendarterectomía pulmonar.
- 6.
Nuevos procedimientos endovasculares (TAVI, implante endovascular clip mitral, tricuspídea, cierre de fugas periprotésicas, cierre de CIA, cierre de orejuela izquierda)
- 7.
Procedimientos vía transapical por toracotomía (TAVI, implante de neocuerdas, cierre de fugas periprotésicas).
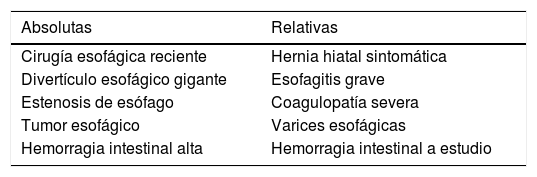
La ETE está considerada una técnica semiinvasiva con bajo riesgo de complicaciones. Sin embargo, hay que tener en cuenta los tipos de incidencias relacionadas con su uso y los factores predisponentes para poder prevenir su aparición. En la visita preanestésica deben ser investigadas las posibles contraindicaciones al examen con ETE y consideradas conjuntamente con la planificación del acto quirúrgico. Las principales contraindicaciones están relacionadas con las patologías de la orofaringe, esófago o estómago. Las contraindicaciones absolutas y relativas están desglosadas en la tabla 1. A pesar de ser considerada una contraindicación relativa, a los pacientes con varices esofágicas de grado 1 o 2, sin episodios recientes de hemorragia, se les puede realizar la ETE con seguridad, pero debe valorarse la necesidad real de los planos transgástricos y evitarse en caso de ser prescindibles para minimizar riesgos innecesarios3.
Contraindicaciones para la inserción del ETE
| Absolutas | Relativas |
|---|---|
| Cirugía esofágica reciente | Hernia hiatal sintomática |
| Divertículo esofágico gigante | Esofagitis grave |
| Estenosis de esófago | Coagulopatía severa |
| Tumor esofágico | Varices esofágicas |
| Hemorragia intestinal alta | Hemorragia intestinal a estudio |
Las complicaciones están relacionadas con el trauma directo de la vía aérea, fundamentalmente durante su introducción y el calentamiento esofágico durante la utilización de la ETE que puede provocar ulceración en grado variable. El riesgo de posibles complicaciones térmicas o mecánicas ha de tenerse siempre en cuenta y valorar el riesgo beneficio de su utilización y la información que vamos a obtener de ella. Las complicaciones más frecuentes son: odinofagia (0,1%), lesión dental (0,03%), movilización de tubo endotraqueal (0,03%) y sangrado digestivo alto (0,03-0,08%)17,18. En algunos centros se incluye en el consentimiento informado de anestesia para cirugía cardiaca las complicaciones asociadas a la técnica ecocardiográfica, lo cual consideramos recomendable.
Sistemática de estudio. Aspectos técnicosCuidados en la introducción de la sondaSe deben extremar las medidas para evitar la extubación orotraqueal durante la colocación de la sonda mediante la correcta fijación del tubo endotraqueal. Es obligatorio colocar de manera sistemática el protector bucal de mordida, lo que evitará la aparición de algún daño dentario, lingual o de la encía, así como desperfectos en la sonda. Puede aparecer una ligera resistencia a la altura del neumotaponamiento del tubo endotraqueal o de las estructuras glóticas, por lo que la inserción debe ser cuidadosa para evitar lesiones y siempre se recomienda la lubricación abundante. Esta dificultad de paso a través de hipofaringe se suele resolver con la tracción anterior mandibular manual, con la anteflexión de la sonda y ligera lateralización hacia la izquierda por la disposición del esófago o, en algunas ocasiones, con laringoscopia directa. Conviene aspirar el contenido gástrico antes de la inserción de la sonda de ETE para optimizar la imagen ecográfica, sobre todo a nivel de los planos más profundos.
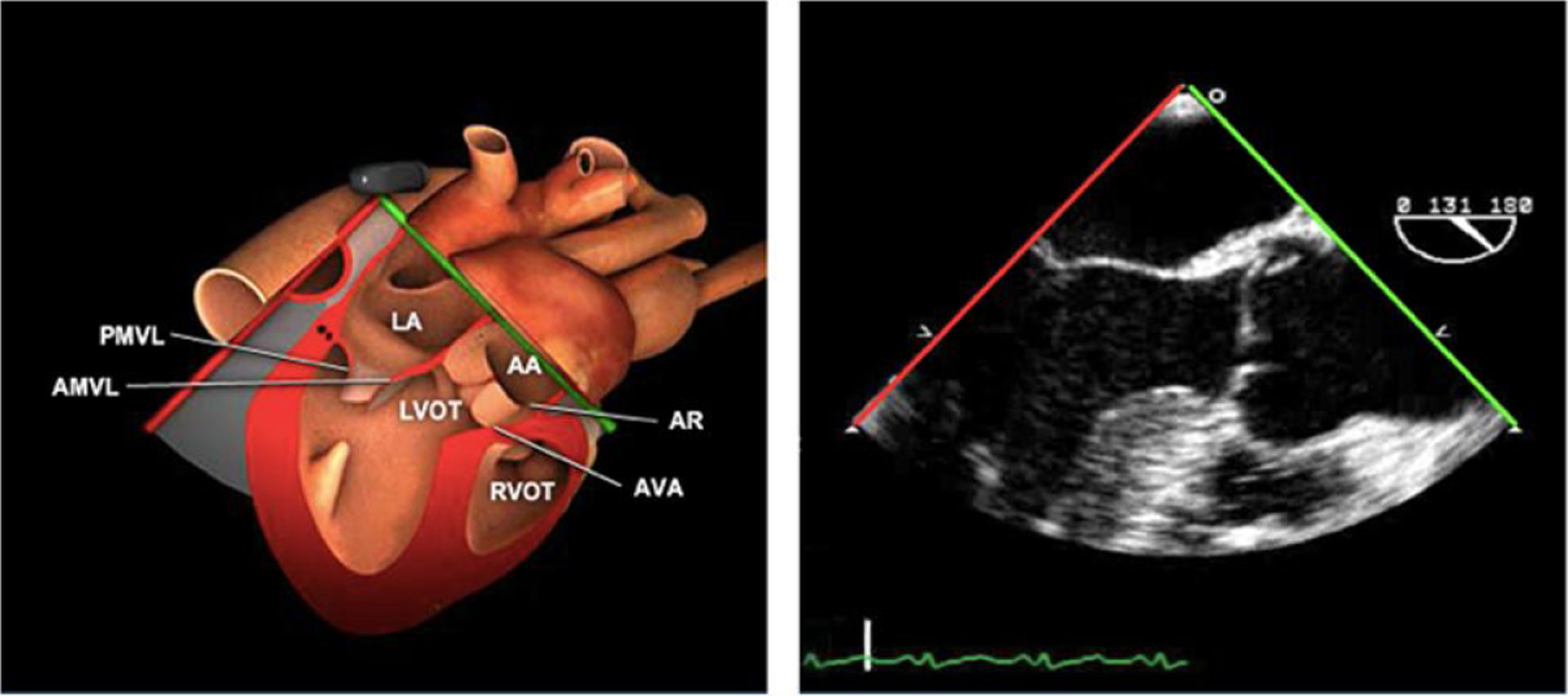
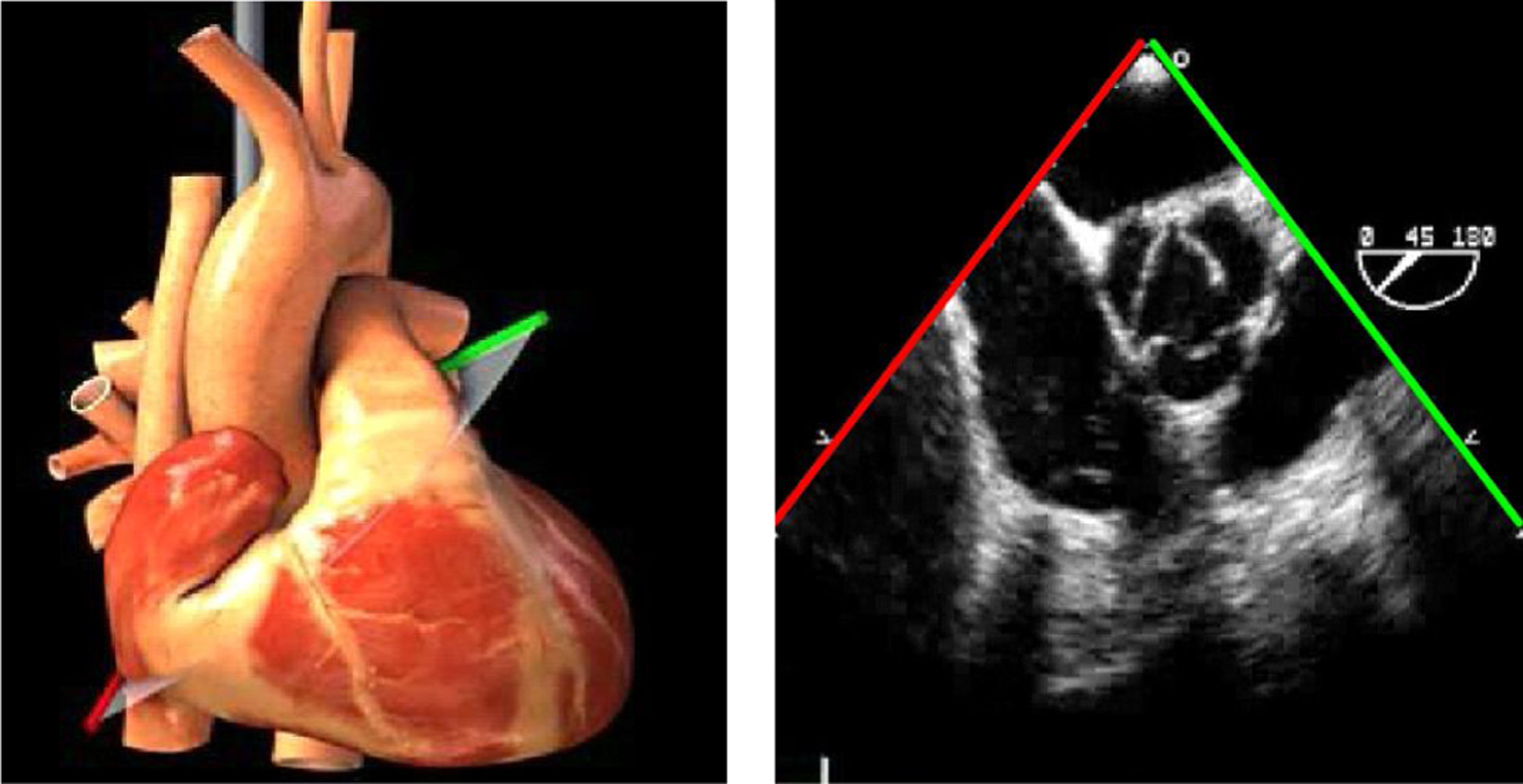
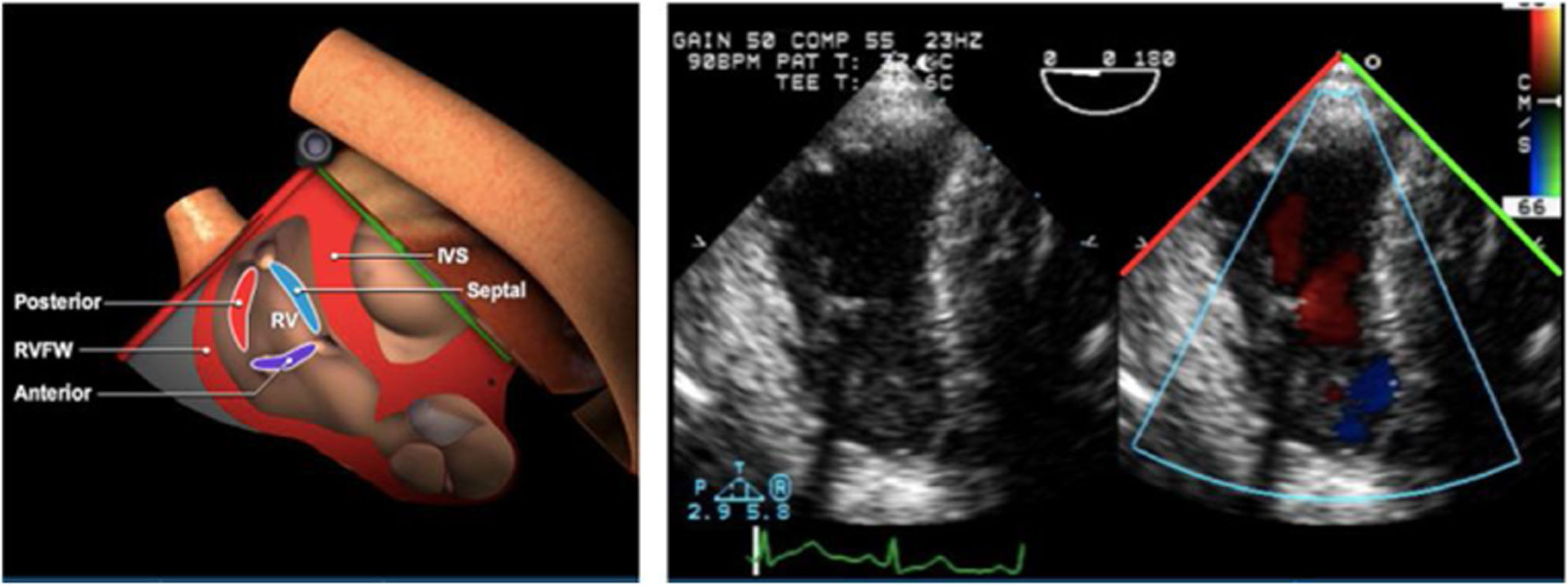
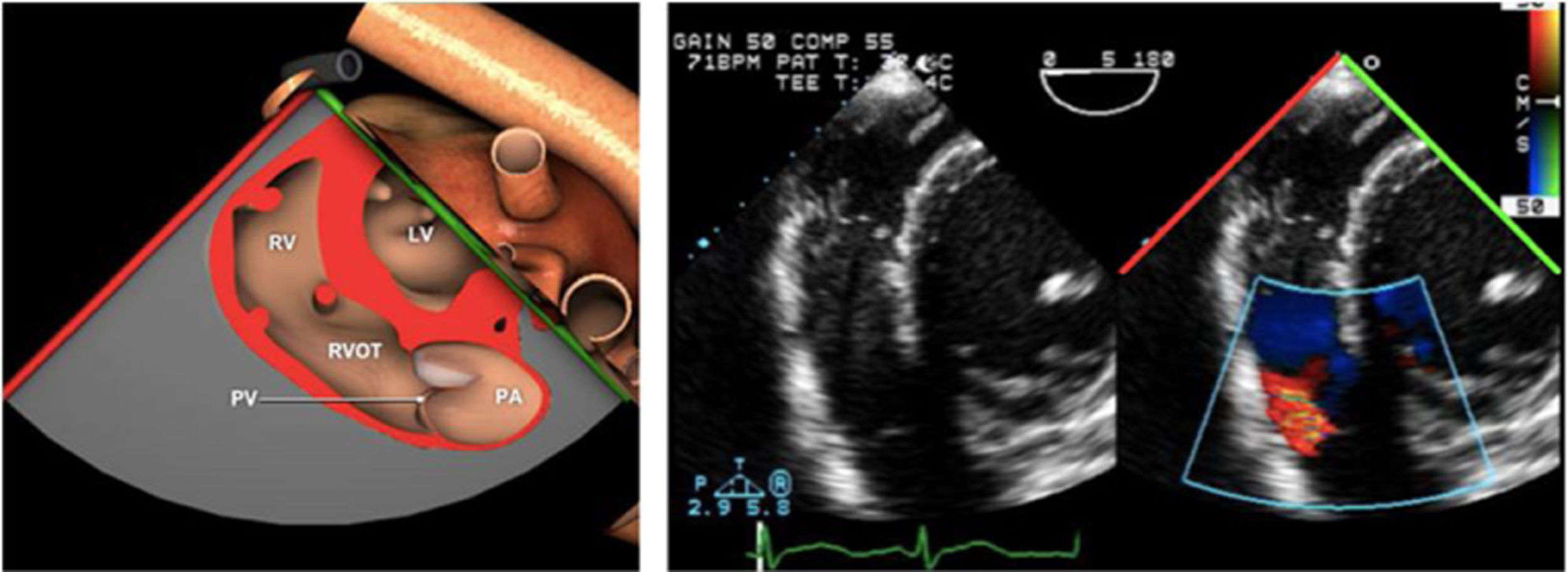
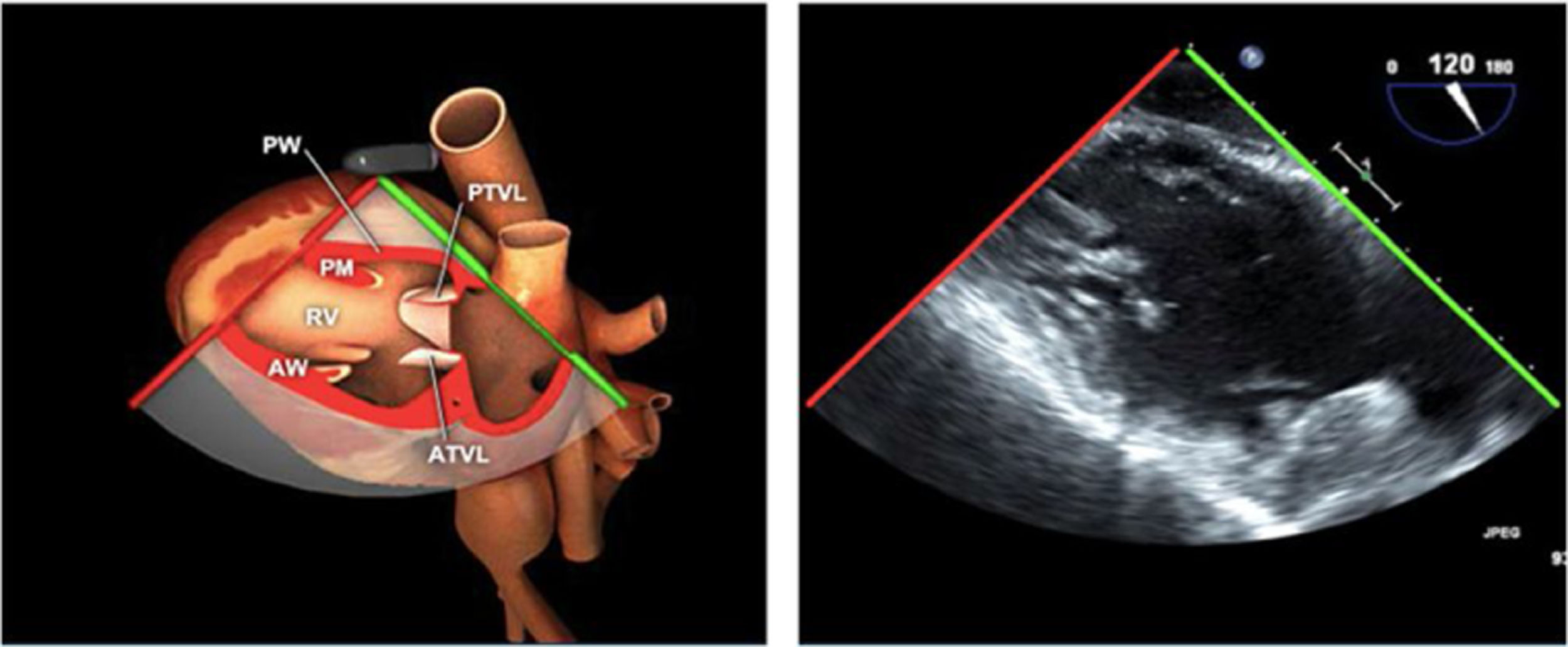
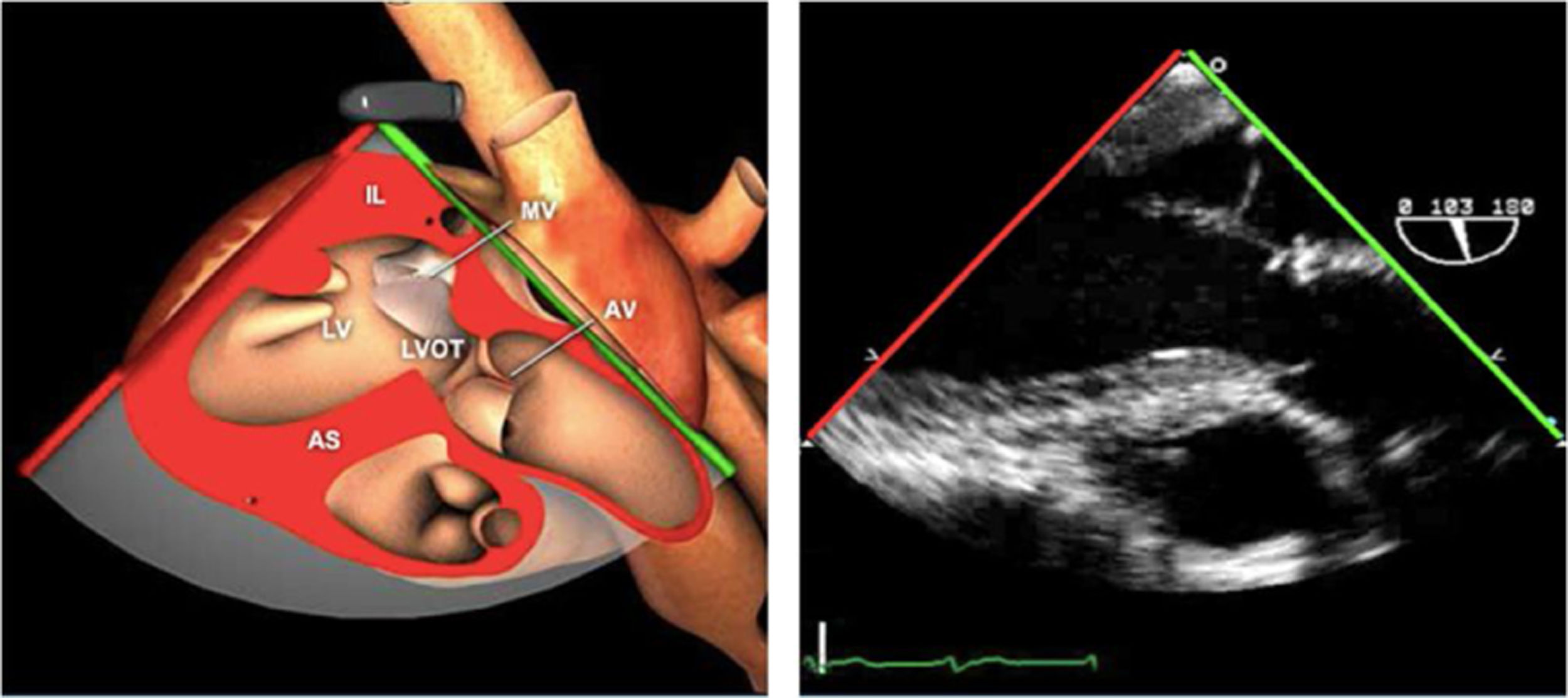
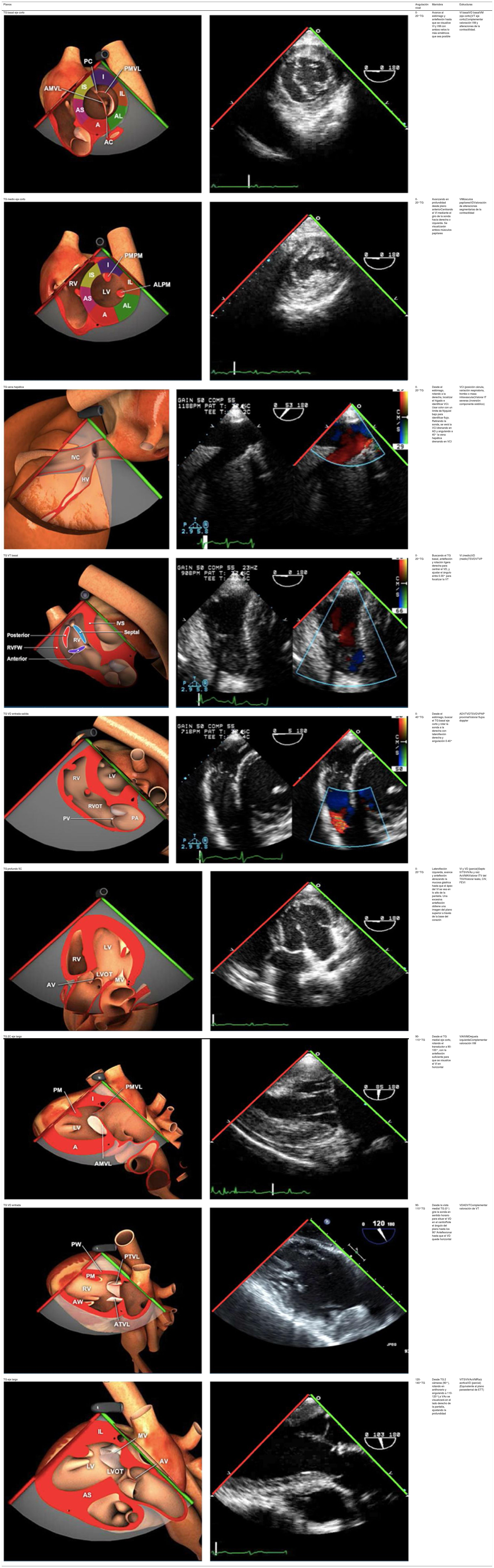
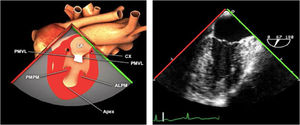
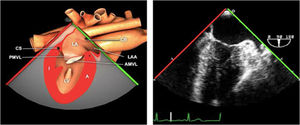
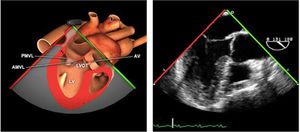
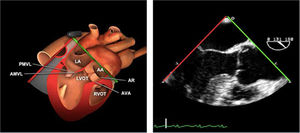
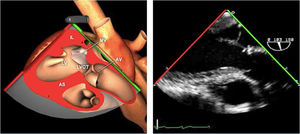
Planos básicos de estudioUna vez introducida la ETE, el manejo consiste en direccionarla mediante el avance, retroceso y rotación de la sonda. Así nos encontramos 4 niveles de profundidad medidos desde el arco dentario donde situamos los planos ecocardiográficos más utilizados: esófago superior (20-25cm), esófago medio (30-40cm), transgástrico (40-45cm) y transgástrico profundo (45-50cm). La distancia teórica de los planos ecográficos es aproximada, aunque en la práctica es muy variable. En cada altura se pueden obtener varios planos. La extremidad distal de la sonda es flexible y la proximal, que es fija, está dotada de 2 mecanismos de control que permiten movimientos de anteflexión y retroflexión del transductor, así como desplazamientos laterales. La posición de la extremidad del transductor se dirige mediante los mandos de control, considerando la posición de las cámaras cardiacas respecto al esófago, de manera que la dirección del haz de ultrasonidos sea la deseada para la identificación de cada estructura cardiaca. Todos estos movimientos, junto con la rotación manual de la sonda en sentido horario y antihorario, posibilitan la obtención de la mayoría de los cortes ecocardiográficos.
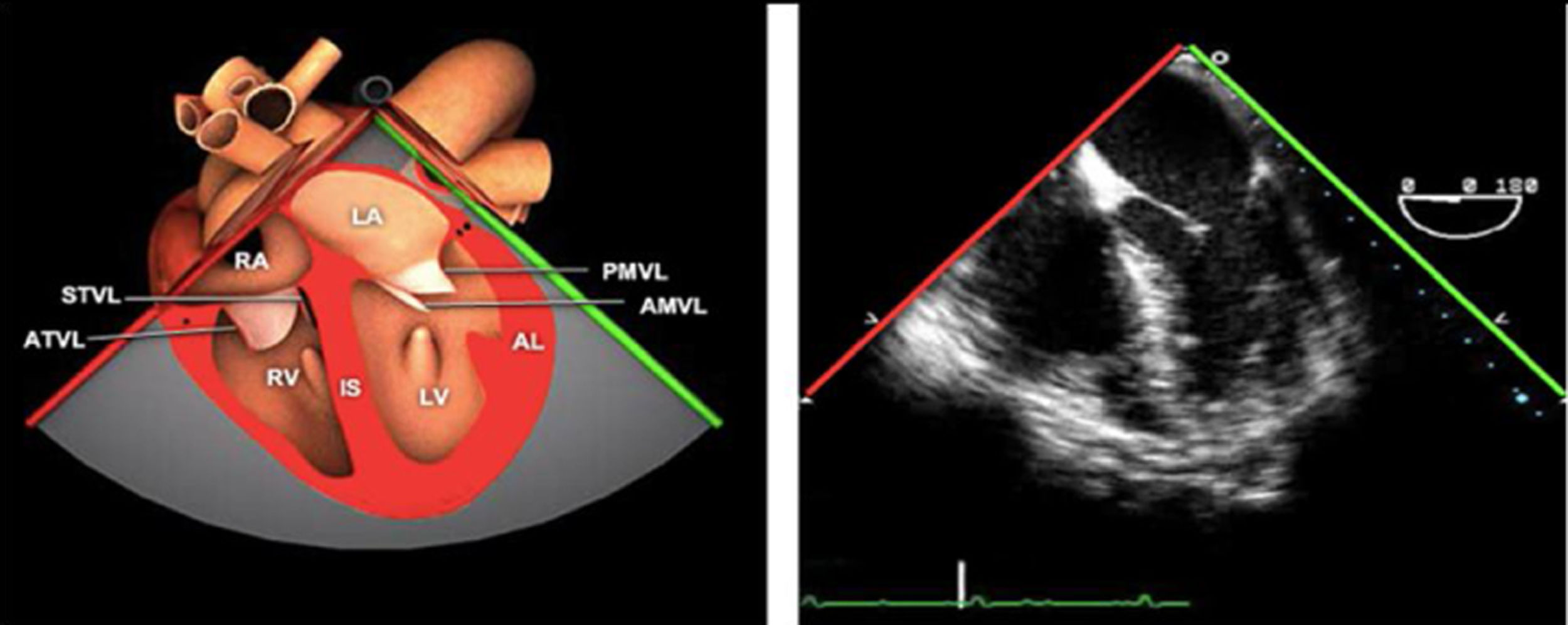
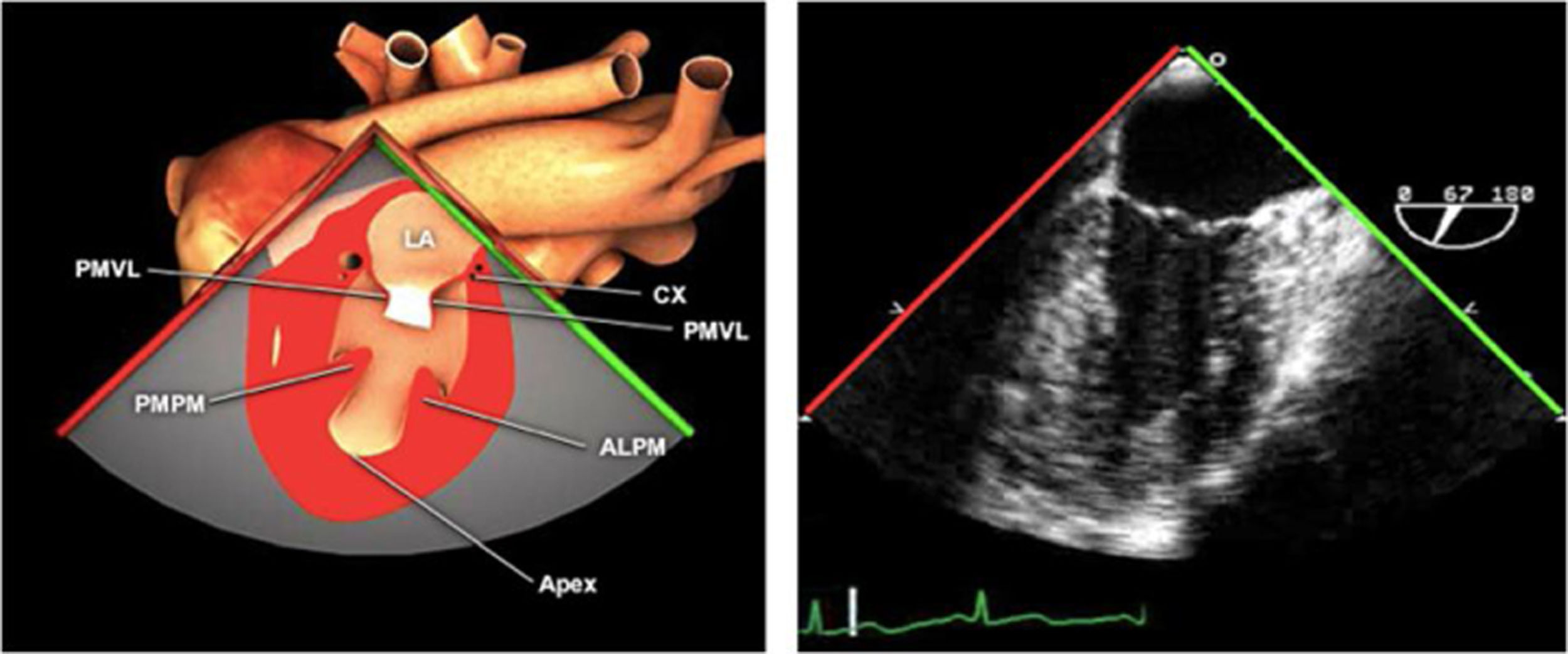
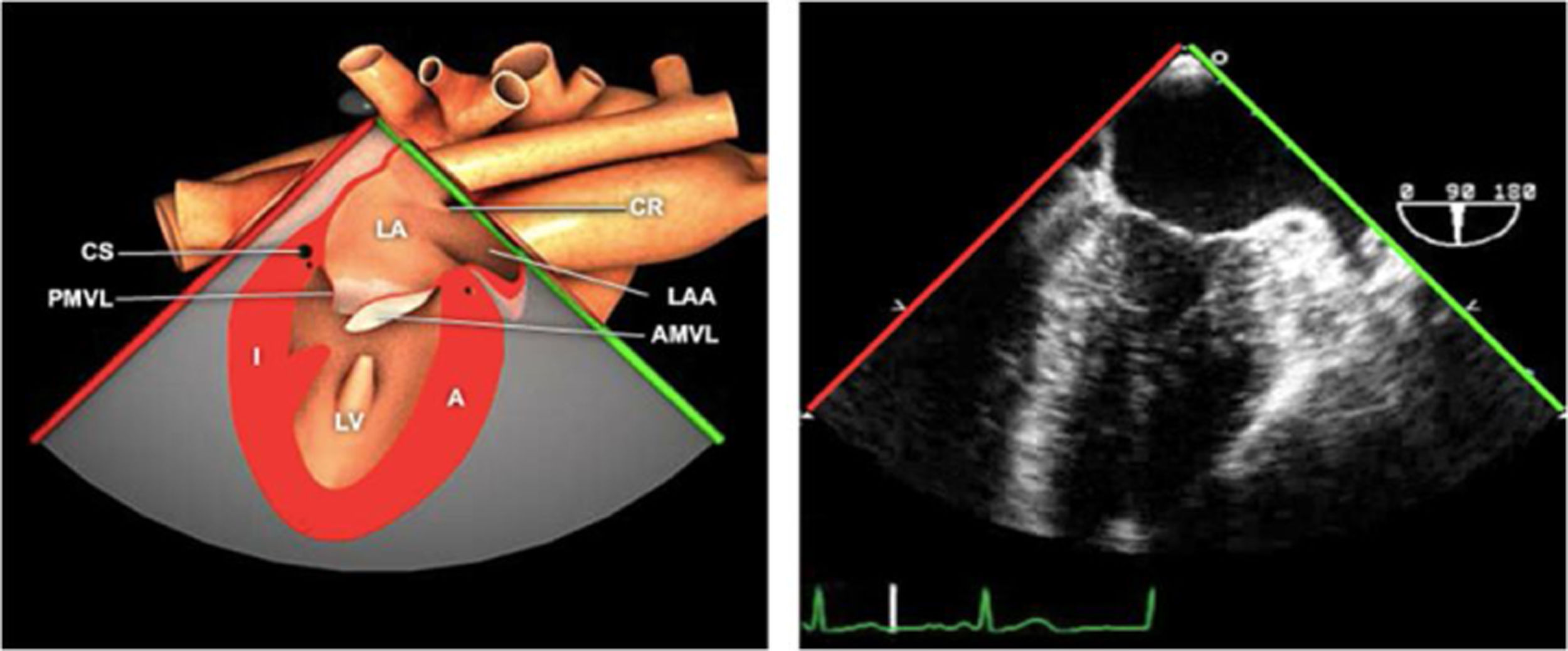
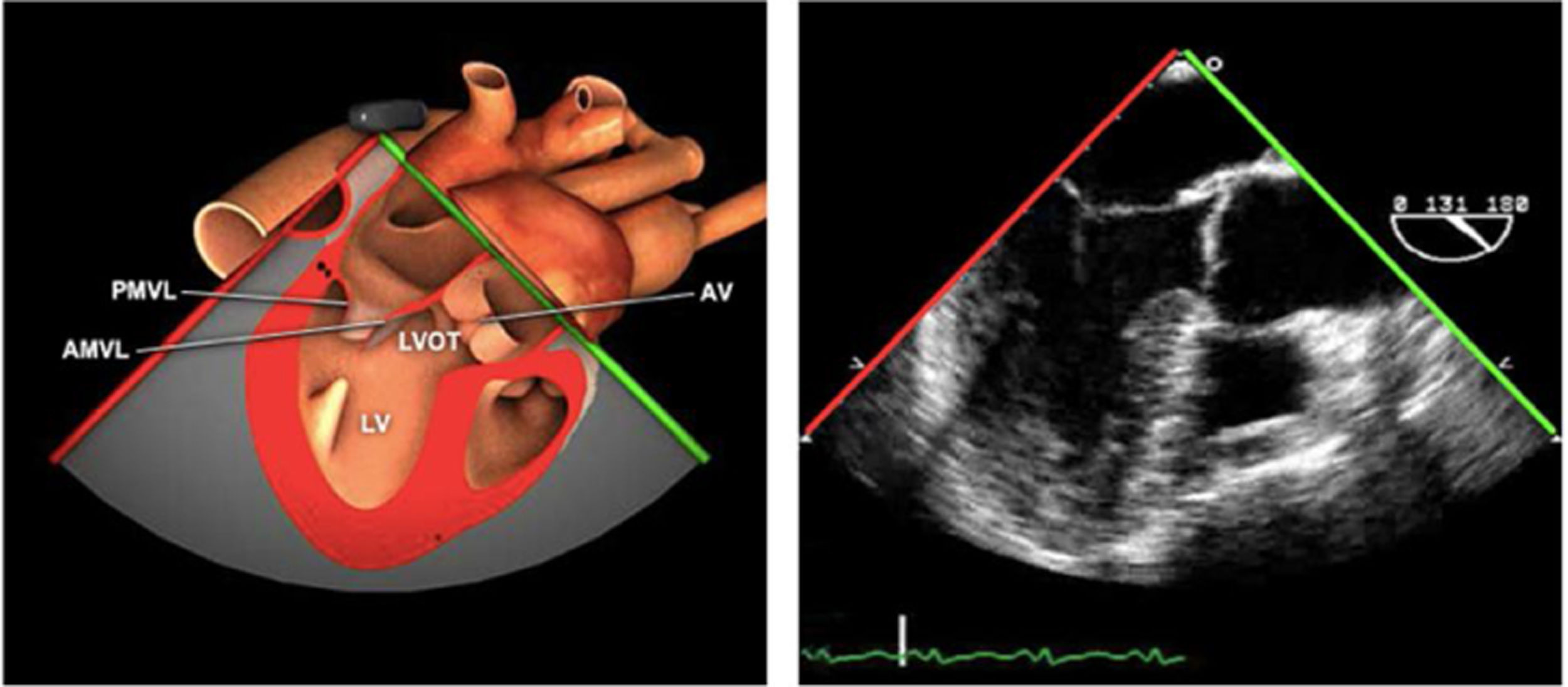
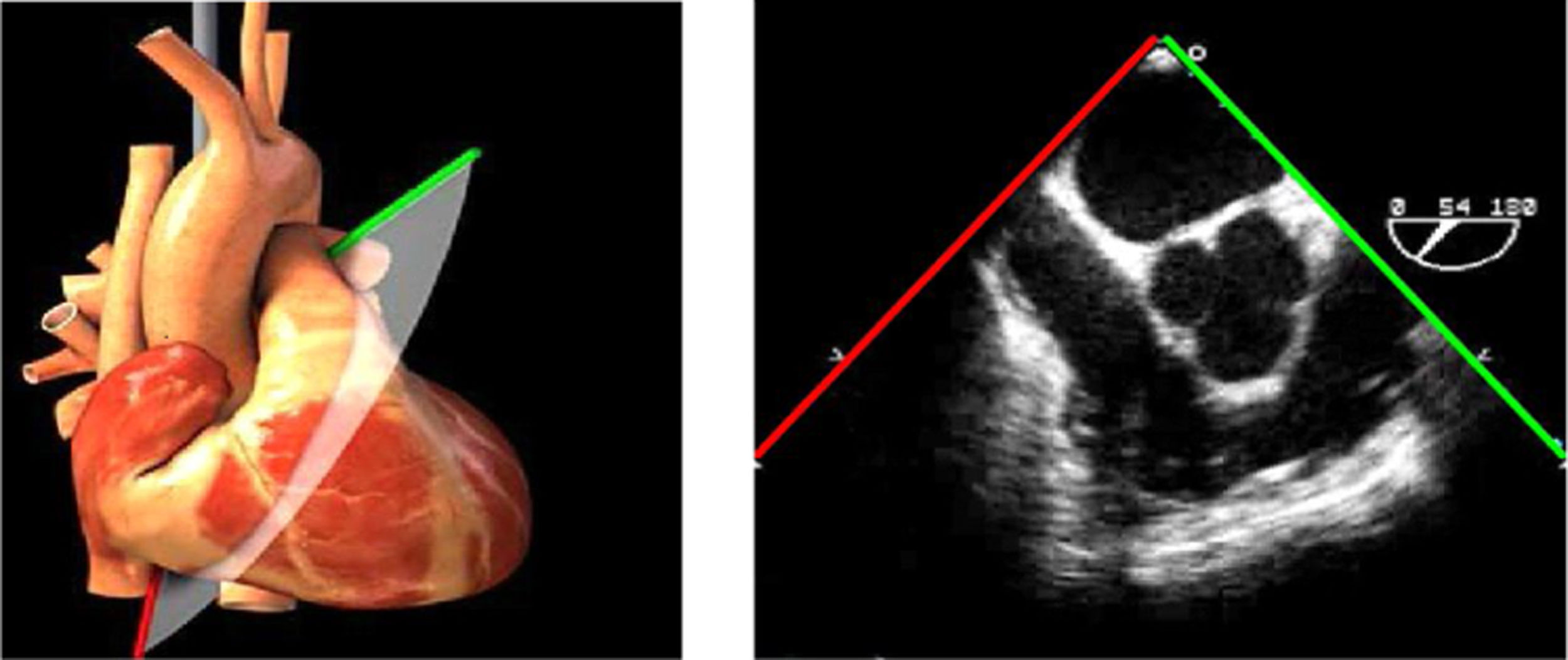
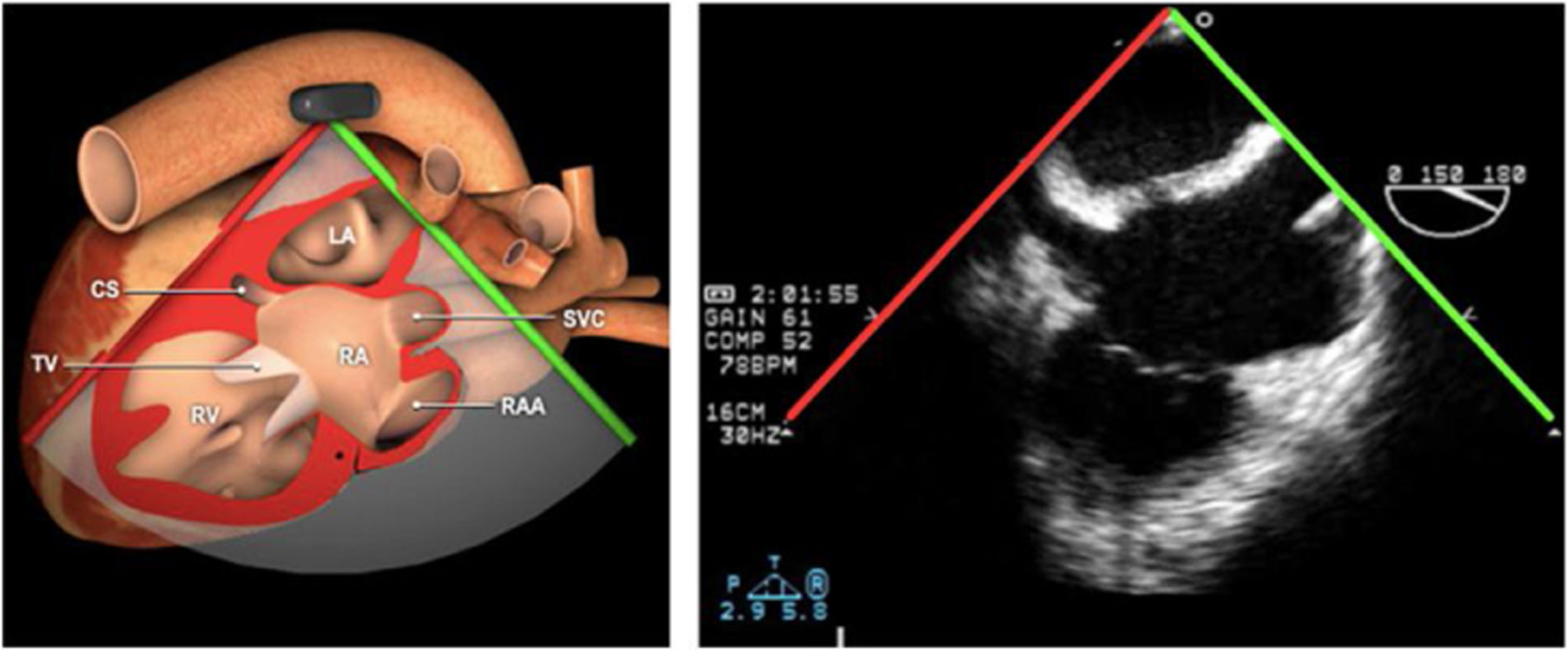
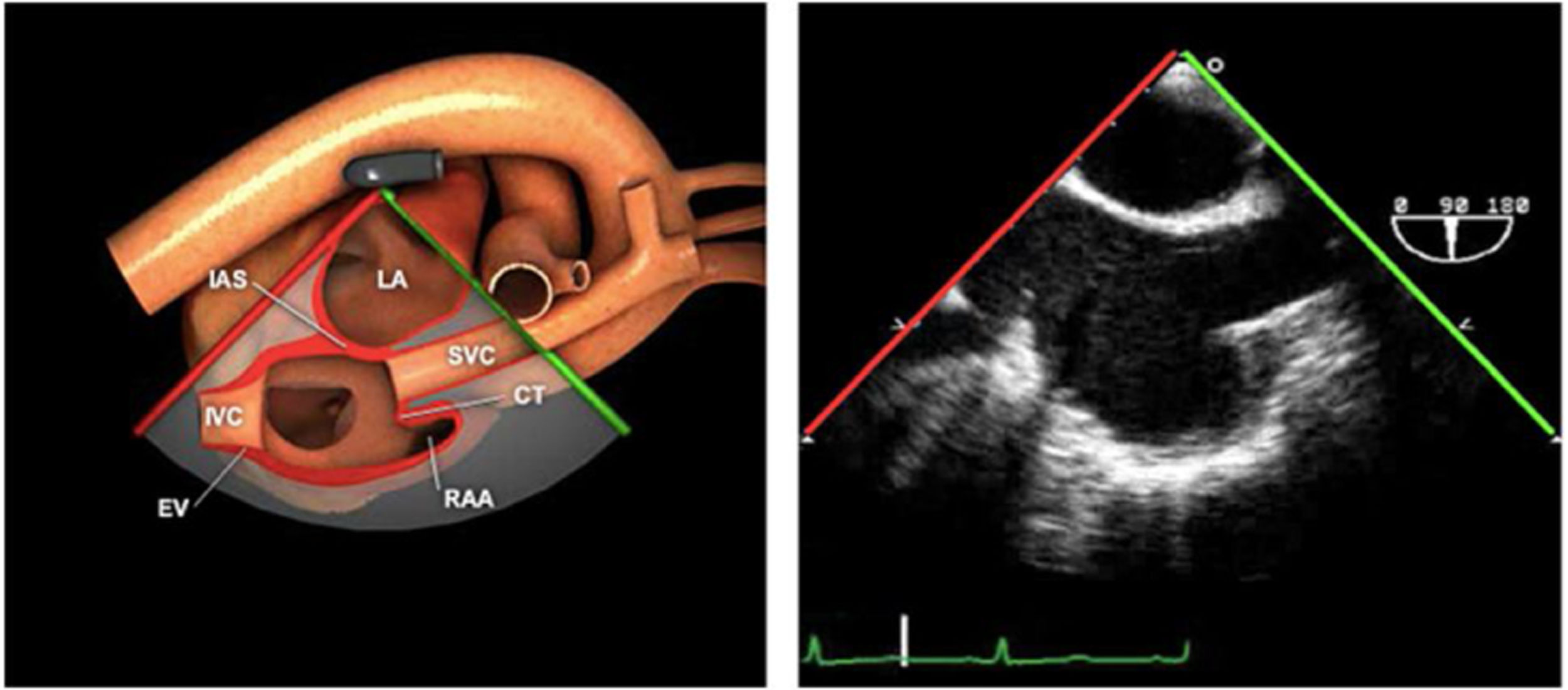
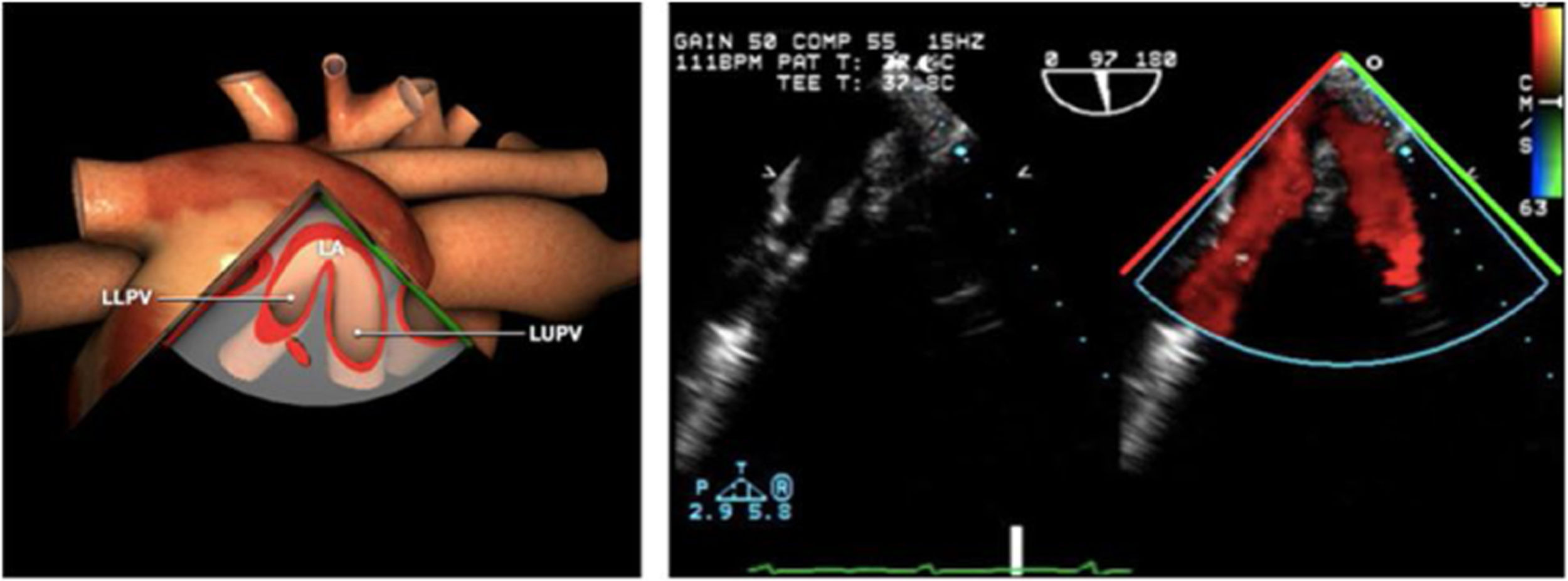
Las sociedades científicas recomiendan la realización de un análisis sistemático que incluye la exploración de las cavidades cardiacas, los grandes vasos y las válvulas tanto en estudio bidimensional (2D), en modo M y en doppler color y espectral, dejando la Eco-3D para evaluadores más experimentados. Se han establecido 20 planos de estudio que quedan tipificados respecto a la profundidad de la sonda en tubo digestivo en: a) esofágicos superiores, b) esofágicos medios (ME), c) transgástricos (TG), así como respecto al plano de imagen (eje corto y largo en referencia al plano transversal y longitudinal del haz de ultrasonidos)1,16,19.
Además, se han añadido 8 planos, para completar la exploración exhaustiva de estructuras clave en la toma de decisiones quirúrgicas. A continuación se detallan los principales planos, su utilidad y su técnica de estudio, teniendo siempre en cuenta que variaciones antropométricas o circunstancias clínicas de cada paciente pueden variar ligeramente el grado de angulación del transductor o de flexión de la sonda para conseguir el plano que permita la valoración más idónea (tablas 2, 3 y 4). Se recomienda en la medida de lo posible una exploración sistematizada con todos los planos y colocación de monitor de electrocardiograma continuo. Como estándar de calidad asistencial se recomienda, siempre que sea posible, realizar la grabación de las imágenes para su revisión facilitando la docencia y el aprendizaje así como la calidad asistencial. Esto permitiría comparar con exploraciones previas y posteriores del mismo paciente analizando los diversos momentos de la intervención y comprendiendo los cambios clínicos evolutivos durante el postoperatorio.
Planos medioesofágicos y esofágicos altos o superiores (ME ES)
| Planos | Angulación nivel | Maniobra | Estructuras |
|---|---|---|---|
| 5 cámaras | 0-10°ME | Avanzando la sonda en esófago y anteflexión ligera para integrar al TSVI en la imagen de las 4C. Prácticamente el plano aparece solo. | VAoTSVIAI/AD/VD/VISepto IVVTVM (A2A1-P1) |
| 4 cámaras | 0-10°ME | Avanzar la sonda y optimizar el ápex del LV mediante ligera retroflexión. Desaparecerán el TSVI y la VAo | AI/ADSepto IAVDVI: paredes IS+ALSepto IVVM (A3A2-P2P1)VT (v. ant/postseptal) |
| Mitral comisural | 50-70°ME | Desde el 4C, mantener la misma posición y la VM en el centro. Rotando el ángulo del plano 50-70° hasta que desaparezca AD y VD. Flexione hacia atrás para obtener el ápex del VI | AISeno coronarioVIVM (P3-A2-P1)Músculo papilarCuerdas tendinosasA. circunflejaValoración mitral (medición anillo intercomisural) |
| 2 cámaras | 80-100°ME | Desde el anterior, totar a 80-100°. Retroflexionar la punta de la sonda para obtener el verdadero ápex del VI, ajuste la profundidad para ver el ápex entero del VI | AIOISeno coronarioVI (Pared ant e Inf)VM (P3-A3 A2A1)«Cresta cumadínica» que separa la LAA y el LUPVValoración mitral (medición anillo A-P) |
| 3 cámaras | 120-140°ME | Ligera anteflexión y rotación a partir de 120°. Ajusta la profundidad para mantener todas las estructuras del VI en el plano | AI/VITSVITSVDVAoRaíz AoVM (A2-P2) |
| ME VAo eje largo | 120-140°ME | Desde el plano anterior, retirando hacia afuera para centrarse en la raíz aórtica | AITSVITSVDVM (A2-P2)VAo y raíz AoValoración protésica aórtica, medición anillo, diámetro TSVI, UST y resto de raíz aórticaValoración SAM |
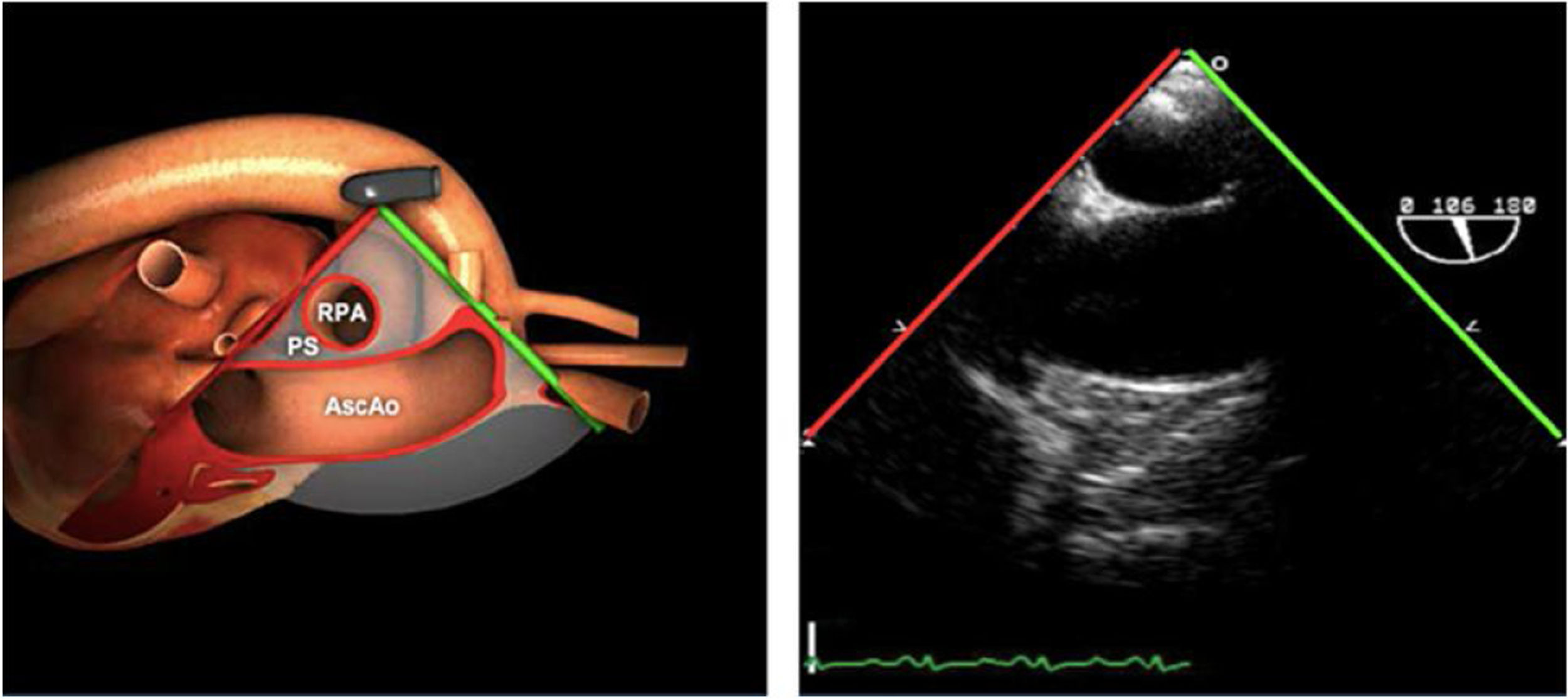
| ME AO ASC eje largo | 90-110°ES | Desde el plano ME VAo eje largo (120°), retirando la sonda para traer la arteria pulmonar a la vista. Disminuir el ángulo del plano ligeramente unos 10-20° para que la pared aórtica quede simétrica | Ao Asc media (eje largo)AP derechaValoración aneurismas y canulación anterógrada |
| ME AO ASC eje corto | 0-30°ES | Desde ME VAo eje corto o eje largo, retirar la sonda (aorta ascendente eje corto), rotando el ángulo del plano a 0° | Ao Asc media (eje corto)AP bifurcándoseCava superior |
| ME VAo eje corto | 20-40°ME | Ligera anteflexión de la sonda la VAo aparece en el centro de la pantalla en eje plano transverso | Válvula aórtica y velos, válvula tricúspideAD, AI y VDTabique IAVálvula pulmonarTroncos coronarios |
| ME tracto de entrada y salida VD | 60-75° | Desde el plano VAo eje corto avanzamos hasta aproximadamente 70° y se desplegara el tracto de entrada y salida del VD | AI, AD, VAo, Val tricúspide (velo anterior/septal y posterior), Val pulmonar y tracto de entrada y salida del VD |
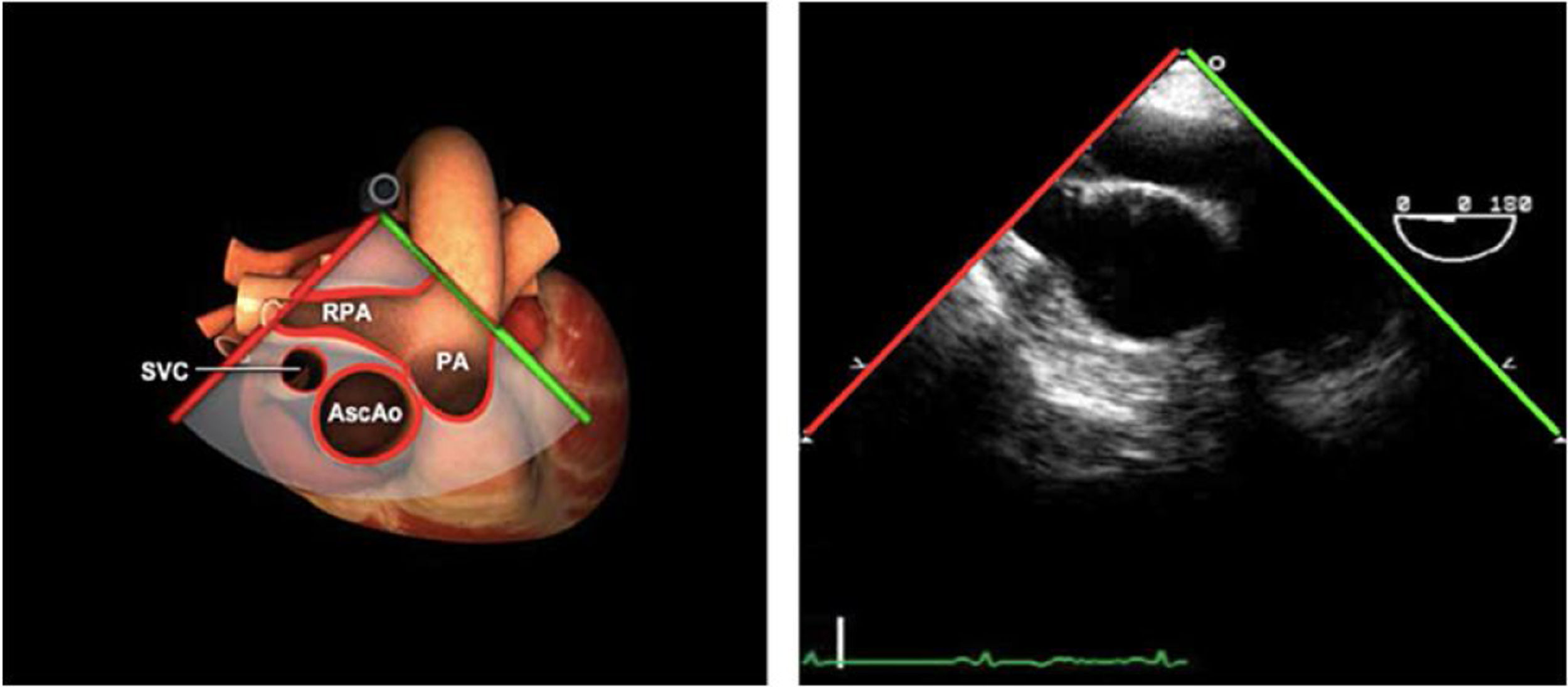
| BICAVA modificado | 50-70°ME | Desde el plano bicava, incrementar el ángulo a 120° rotando la sonda a la derecha en sentido horario. Intentar centrar la VT en el plano. | AD/VDVTS epto IA (medio)Cava inferior y superiorSeno coronarioValoración funcional VT, flujo y estimación PsAP |
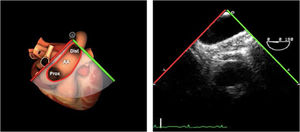
| Bicava | 90-110°ME | Desde el ME 2C (90°) rotando sentido horario (hacia la derecha)Cambie el ángulo o rote la sonda ligeramente para proyectar simultáneamente tanto la IVC (izquierda) como la SVC (derecha) | AIADSepto IACavasOrejuela DVálvula de Eustaquio (EV) (en el limite de la IVC/AD)Cresta terminal (CT) (en el limite de la SVC/AD) |
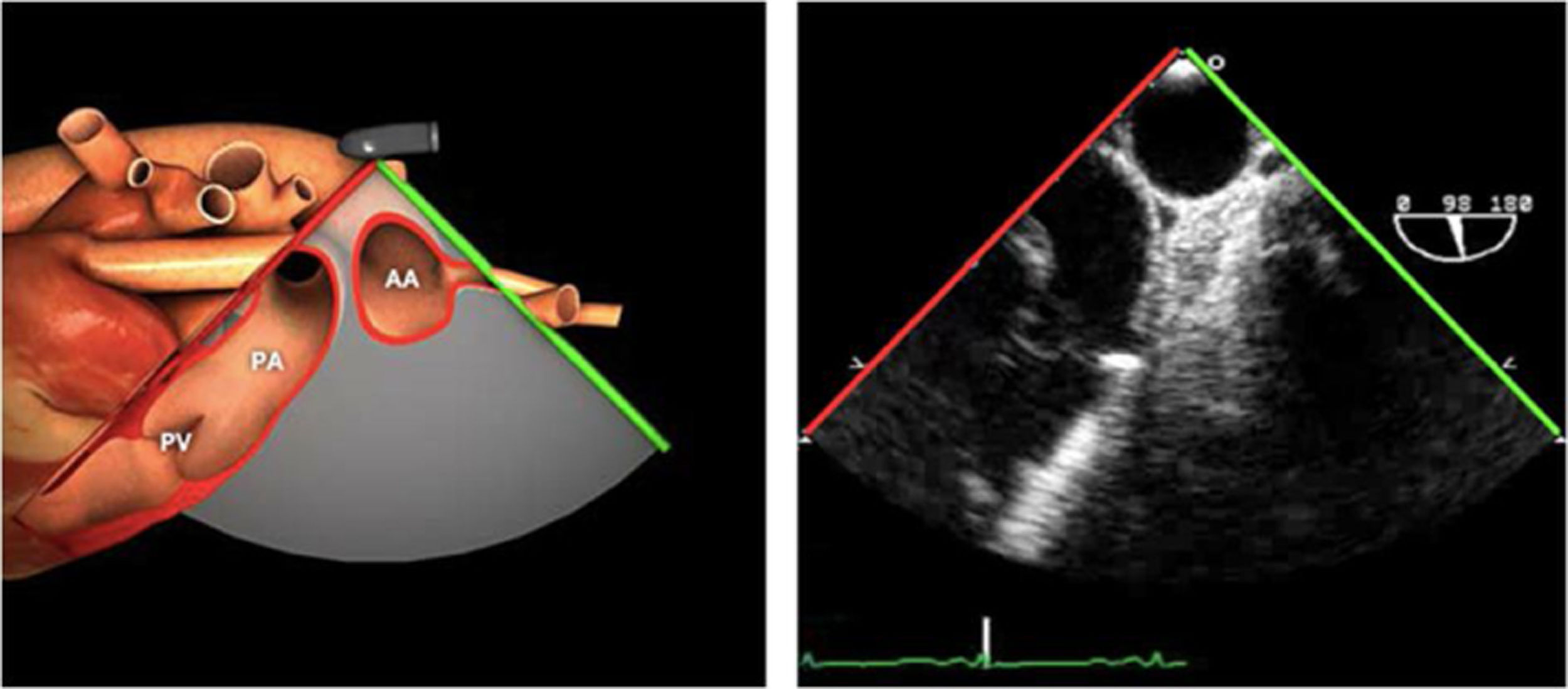
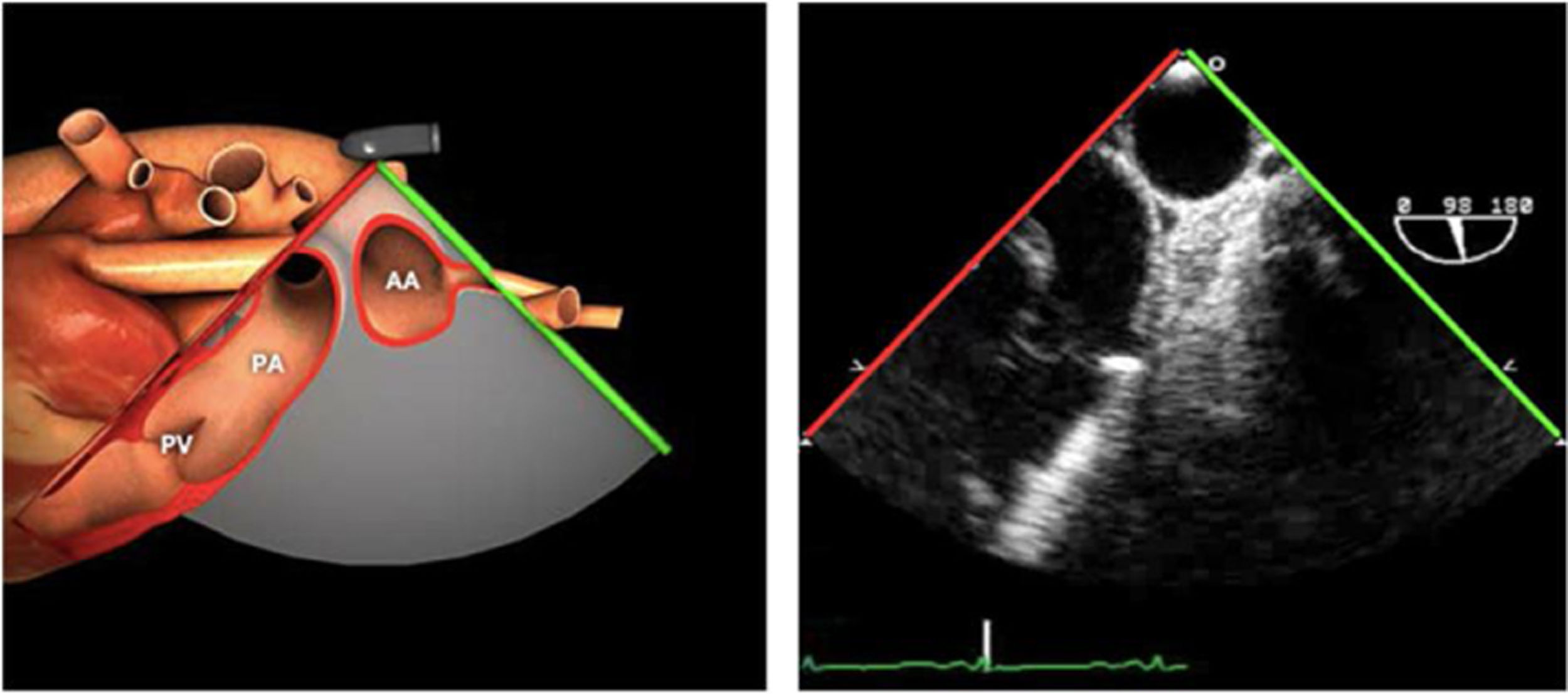
| ES VVPP | 90-110°ES | Retirando hacia ES, girar a la D para VVPP derechas y a la inversa para las Izquierdas | VVPPArteria pulmonar (eje corto)Medición de flujos y drenajes anómalos |
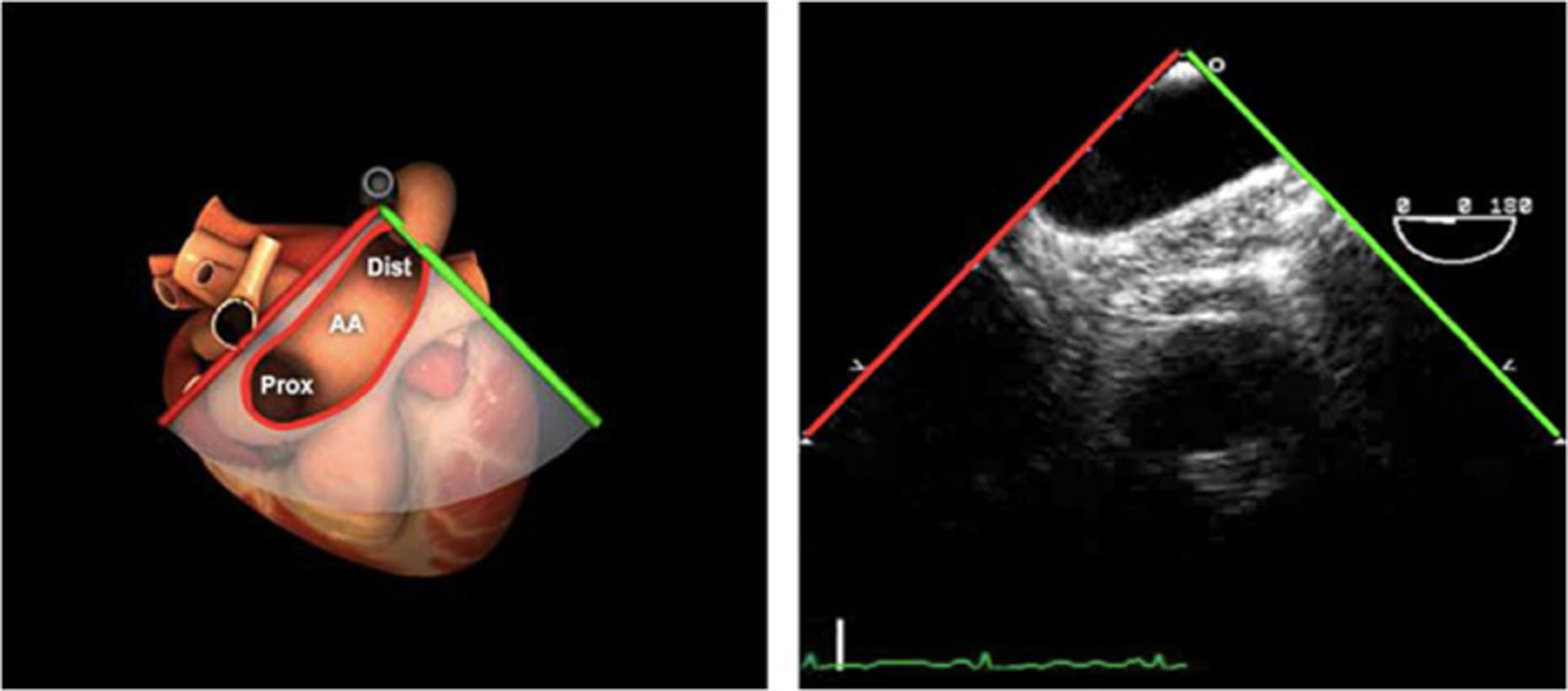
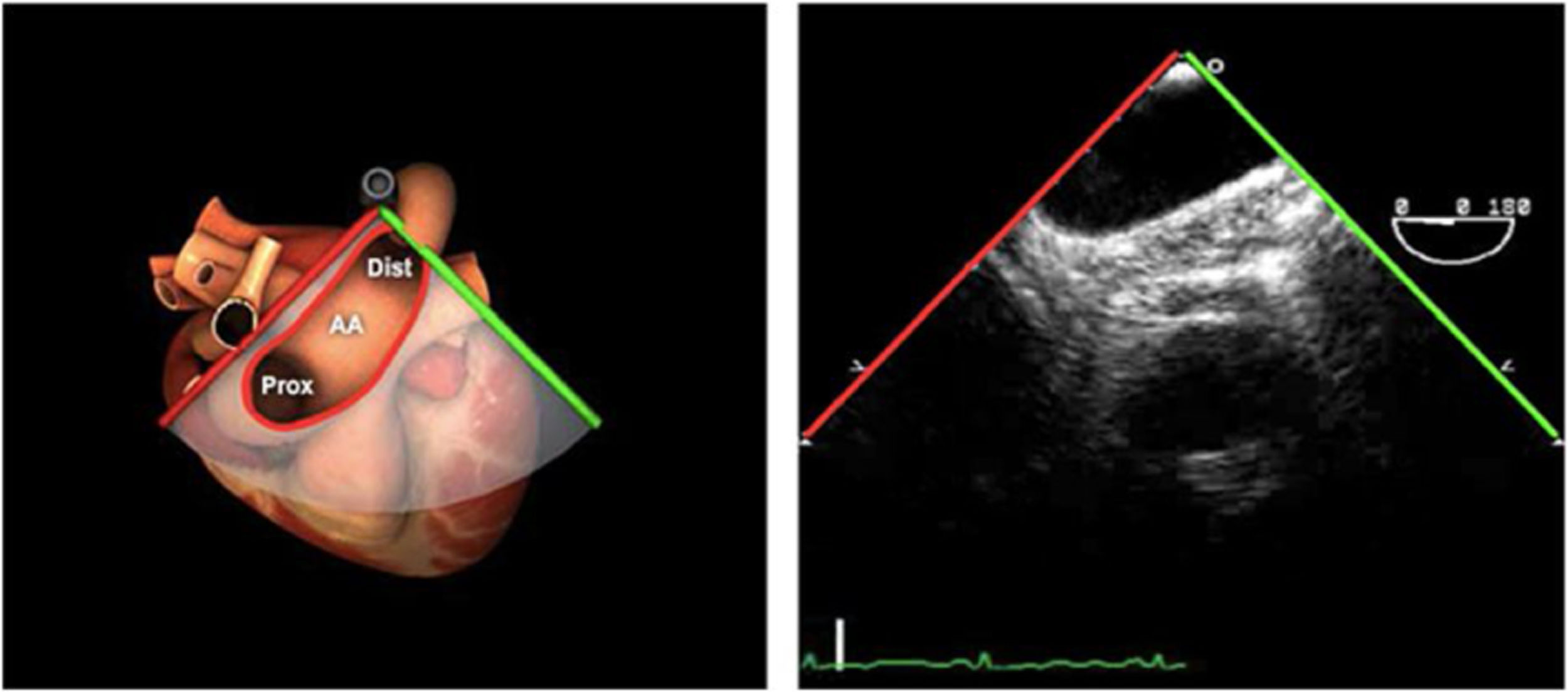
| ME orejuela Izquierda | 90-110°ME | Desde plano ME 2C (90°) identificar la VM y rotar la sonda a la izquierda disminuyendo la profundidad. Identificar la OI en eje largo y retirar la sonda para explorar la VPSI | OIVPSI (flujo reverso, velocidad..)Valorar AAAValorar severidad de IM mediante flujo reverso OI |
Planos transgástricos
| Planos | Angulación nivel | Maniobra | Estructuras |
|---|---|---|---|
| TG basal eje corto | 0-20°TG | Avance al estómago y anteflexión hasta que se visualice VI y VM con ambos velos lo más simétricos que sea posible | VI basalVD basalVM (eje corto)(VT eje corto)Complementar valoración VM y alteraciones de la contractilidad. |
| TG medio eje corto | 0-20°TG | Avanzando en profundidad desde plano anteriorCentrando el VI mediante el giro de la sonda hacia derecha o izquierda. Se visualizarán ambos músculos papilares | VIMúsculos papilaresVDValoración de alteraciones segmentarias de la contractildad |
| TG vena hepática | 0-20°TG | Desde el estómago, rotando a la derecha, localizar el hígado e identificar VCI. Usar color con un límite de Nyquist bajo para identificar flujo. Retirando la sonda, se verá la VCI drenando en AD y angulando a 40° la vena hepática drenando en VCI | VCI (posición cánula, variación respiratoria, trombo o masa intravascular)Valorar IT severas (inversión componente sistólico) |
| TG VT basal | 0-20°TG | Buscando el TG basal, anteflexión y rotación ligera derecha para centrar el VD, y ajustar el ángulo entre 0-30° para focalizar la VT | VI (medio)VD (medio)TSVDVTVP |
| TG VD entrada-salida | 0-40°TG | Desde el estómago, buscar el TG basal eje corto y rotar la sonda a la derecha con lateroflexión derecha y angulación 0-40° | ADVTVDTSVDVPAP proximalValorar flujos doppler |
| TG profundo 5C | 0-20°TG | Lateroflexión izquierda, avance y anteflexión abrazando la mucosa gástrica hasta que el ápex del VI se vea en lo alto de la pantalla. Una excesiva anteflexión obtiene una imagen del plano superior a través de la base del corazón | VI y VD (parcial)Septo IVTSVIVAo y raíz AoVMAIValorar ITV del TSVIValorar leaks, CIV, FEVI |
| TG 2C eje largo | 90-110°TG | Desde el TG medial eje corto, rotando el transductor a 90-100°, con la anteflexión suficiente para que se visualice el VI en horizontal | VIAIVMOrejuela izquierdaComplementar valoración VM |
| TG VD entrada | 90-110°TG | Desde la vista medial TG (0°) gire la sonda en sentido horario para situar el VD en el centroRote el ángulo del plano hasta los 90°Anteflexionar hasta que el VD quede horizontal | VDADVTComplementar valoración de VT |
| TG eje largo | 120-140°TG | Desde TG 2 cámaras (90°), rotando en antihorario y angulando a 110-120°La VAo se visualizará en el lado derecho de la pantalla, ajustando la profundidad | VITSVIVAoVMRaíz aorticaVD (parcial)(Equivalente al plano paraesternal de ETT) |
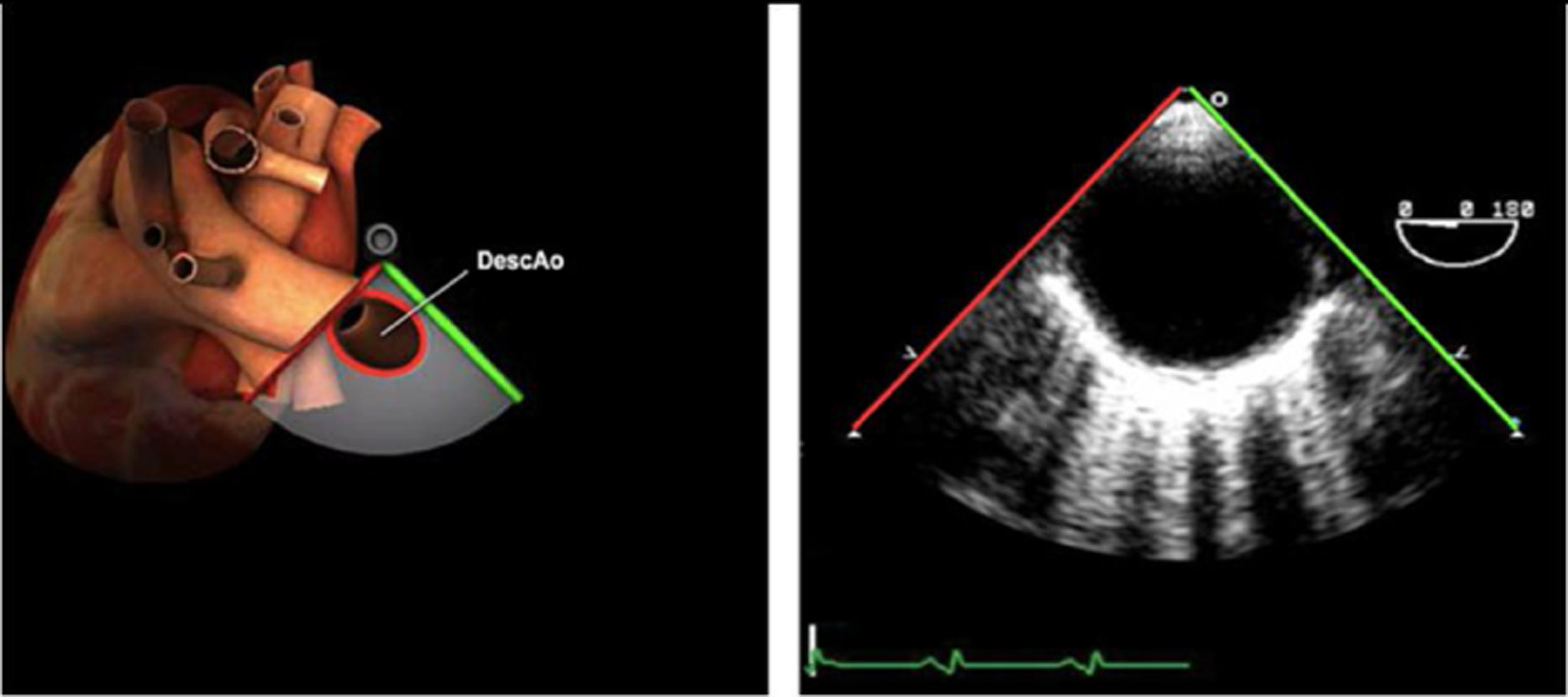
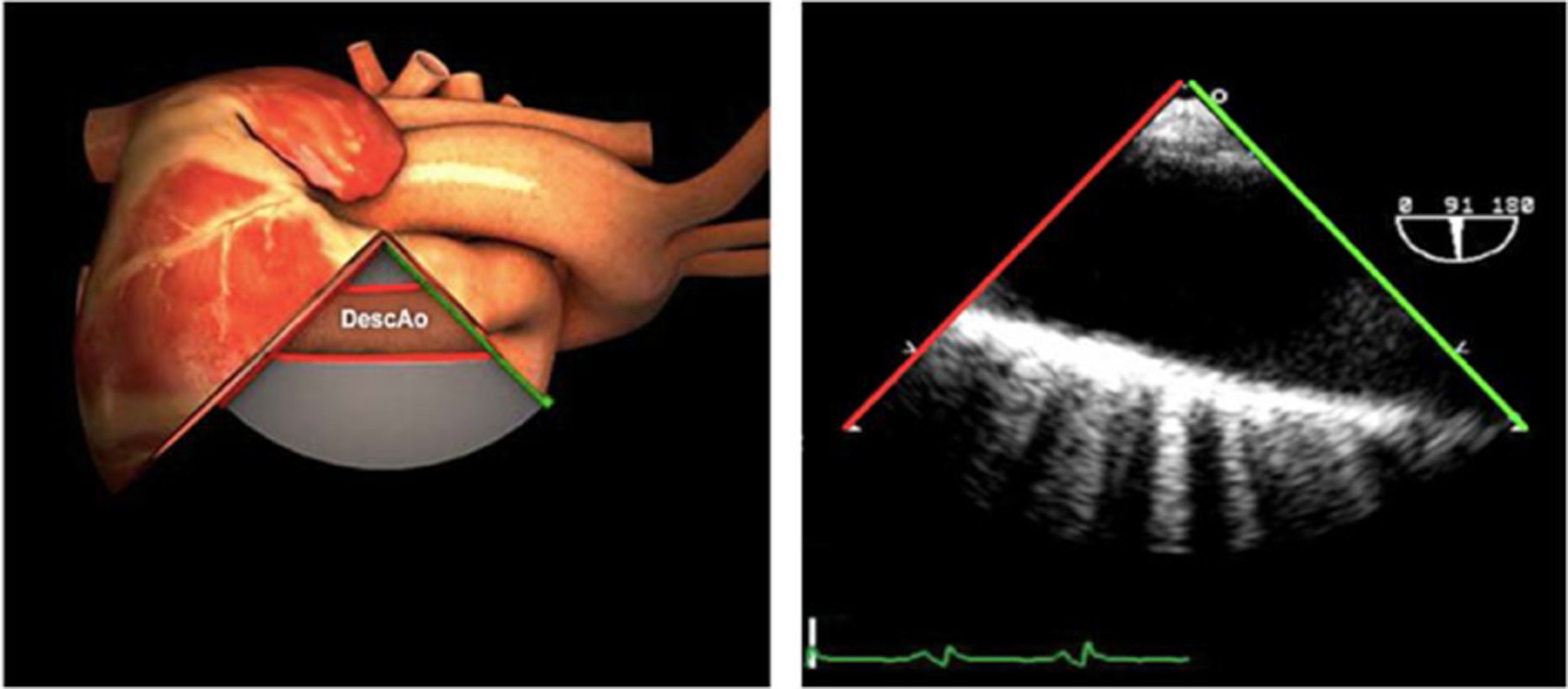
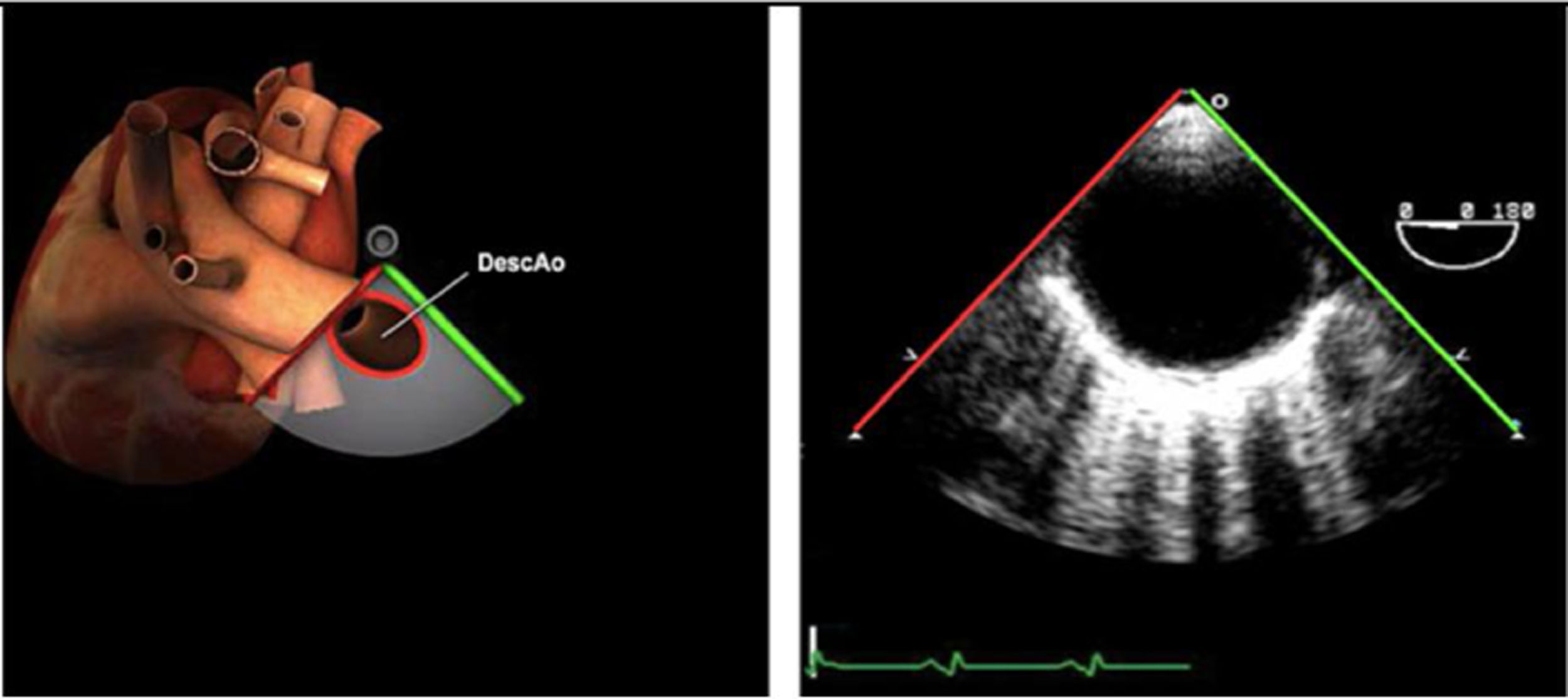
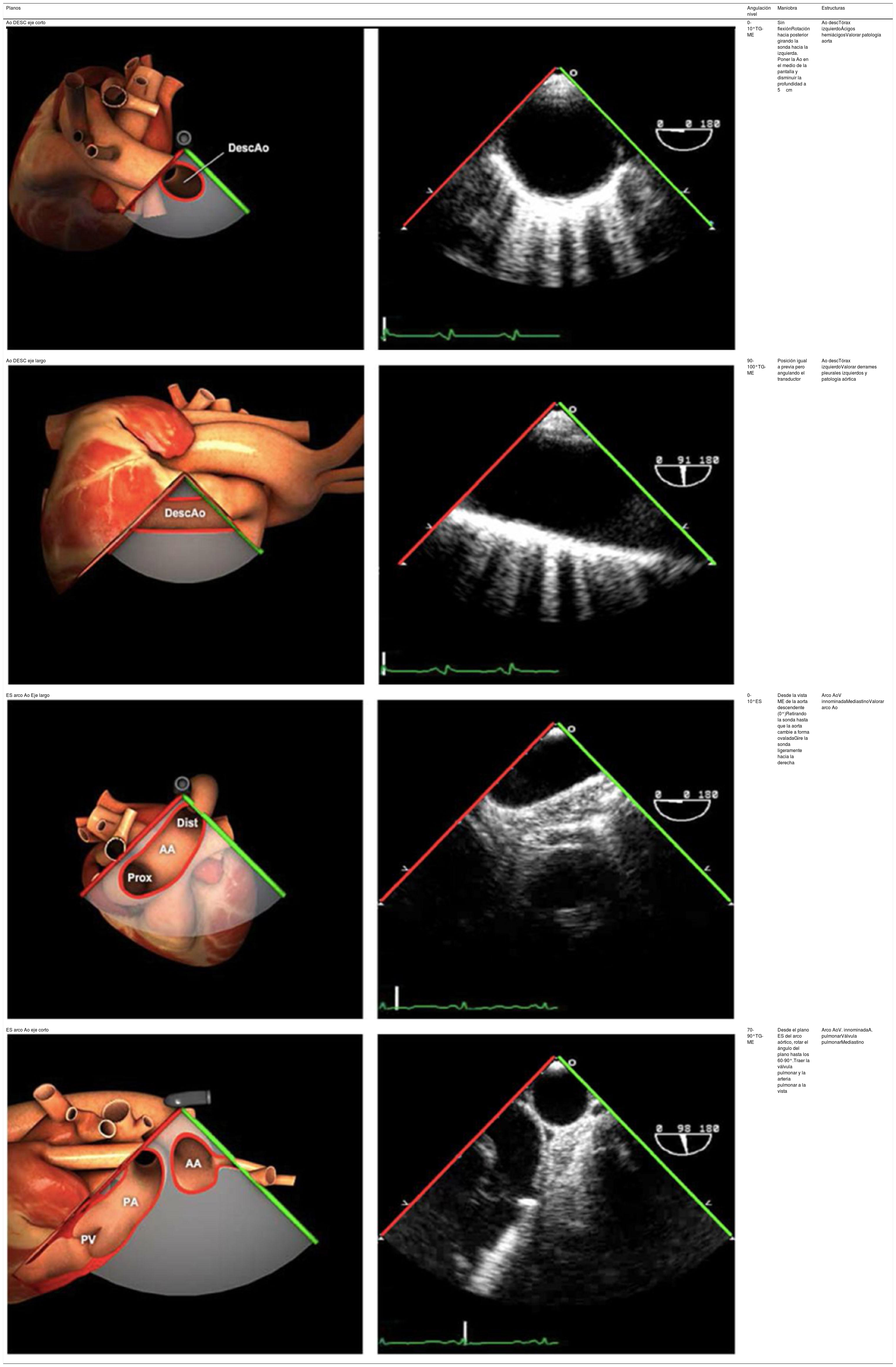
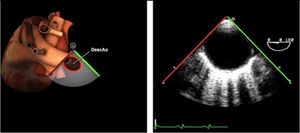
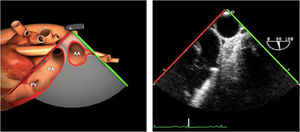
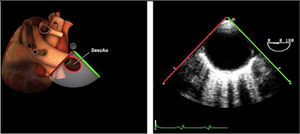
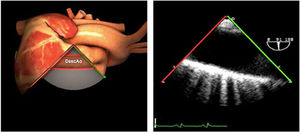
| Ao DESC eje corto | 0-10°TG-ME | Sin flexiónRotación hacia posterior girando la sonda hacia la izquierda. Posicionar la Ao en el medio de la pantalla y disminuir la profundidad a 5cm | Ao descTórax izquierdaÁcigos hemiácigosValorar patología Aorta |
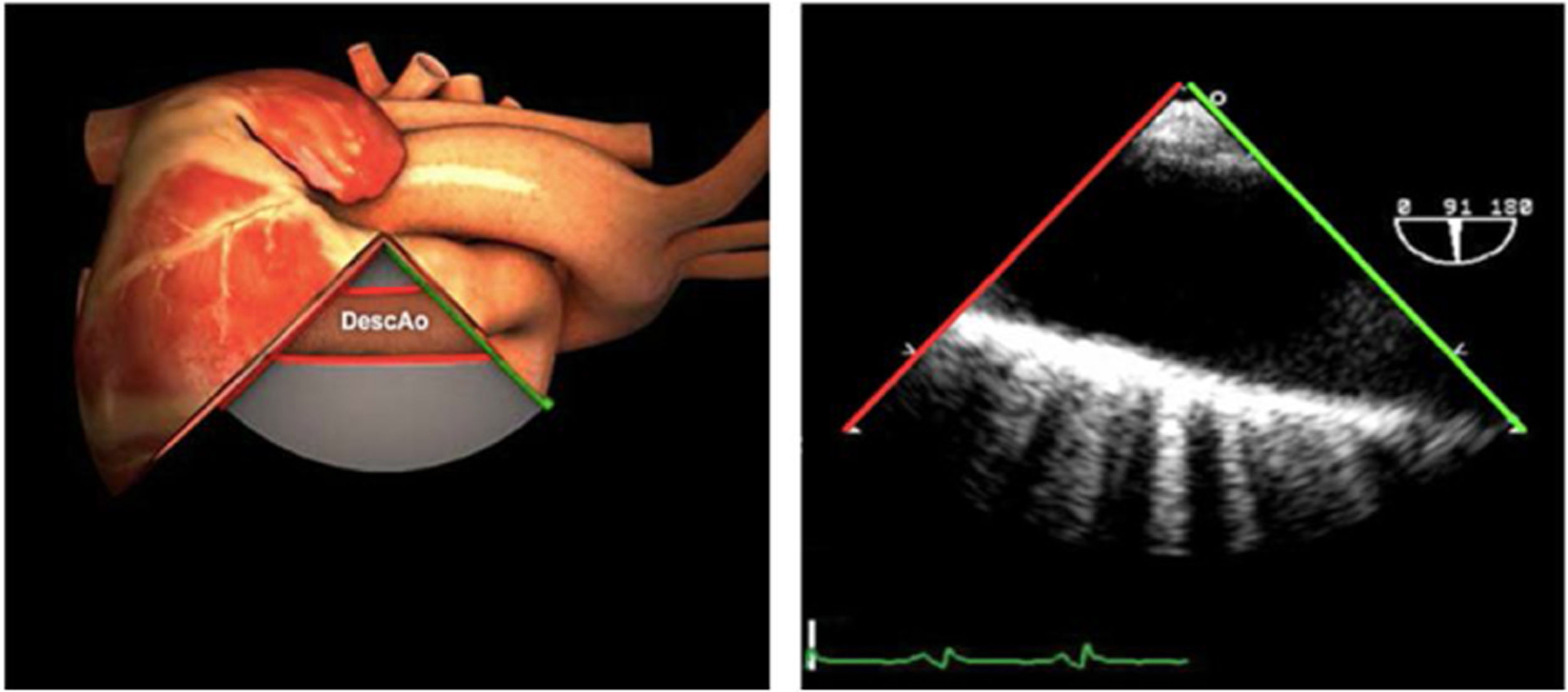
| Ao DESC eje largo | 90-100°TG-ME | Posición igual a previa pero angulando el transductor | Ao descTórax izquierdoValorar Derrames pleurales izq y patología aórtica. |
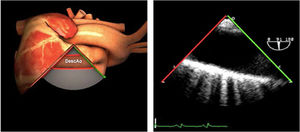
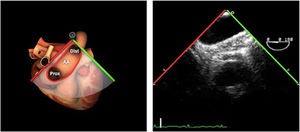
| ES arco Ao eje largo | 0-10°ES | Desde la vista ME de la aorta descendente (0°)Retirando la sonda hasta que la aorta cambie a forma ovaladaGire la sonda ligeramente hacia la derecha | Arco AoV innominadaMediastinoValorar arco Ao |
| ES arco Ao eje corto | 70-90°TG-ME | Desde el plano ES del arco aórtico, rotar el ángulo del plano hasta los 60-90°Traer la válvula pulmonar y la arteria pulmonar a la vista | Arco AoV. innominadaA. pulmonarVálvula pulmonarMediastino |
Planos grandes vasos
| Planos | Angulación nivel | Maniobra | Estructuras |
|---|---|---|---|
| Ao DESC eje corto | 0-10°TG-ME | Sin flexiónRotación hacia posterior girando la sonda hacia la izquierda. Poner la Ao en el medio de la pantalla y disminuir la profundidad a 5cm | Ao descTórax izquierdoÁcigos hemiácigosValorar patología aorta |
| Ao DESC eje largo | 90-100°TG-ME | Posición igual a previa pero angulando el transductor | Ao descTórax izquierdoValorar derrames pleurales izquierdos y patología aórtica |
| ES arco Ao Eje largo | 0-10°ES | Desde la vista ME de la aorta descendente (0°)Retirando la sonda hasta que la aorta cambie a forma ovaladaGire la sonda ligeramente hacia la derecha | Arco AoV innominadaMediastinoValorar arco Ao |
| ES arco Ao eje corto | 70-90°TG-ME | Desde el plano ES del arco aórtico, rotar el ángulo del plano hasta los 60-90°.Traer la válvula pulmonar y la arteria pulmonar a la vista | Arco AoV. innominadaA. pulmonarVálvula pulmonarMediastino |
AAA: arteria aorta ascendente; AD: aurícula derecha; AI: aurícula izquierda; AP: arteria pulmonar; CIV: comunicación interventricular; CT: cresta terminal; ES: esofágico superior; FEVI: fracción eyección ventrículo izquierdo; IAo: insuficiencia aórtica; IV: interventricular; ME: medioesofágico; OI: orejuela Izquierda; PsAP: presión sístólica de arteria pulmonar;TG: transgástrico; TIA: tabique interauricular; TSVD: tracto de salida del ventrículo derecho; TSVI: tracto de salida del ventrículo izquierdo; UST: unión sinotubular; VAo: válvula aórtica; VCI: vena cava inferior; VCS: vena cava superior; VD: ventrículo derecho; VE: válvula Eustaquio; VI: ventrículo izquierdo; VM: válvula mitral; VP: válvula pulmonar; VPSI: Vena pulmonar superior izquierda; VPSD: Vena pulmonar superior derecha; VT: válvula tricúspide; VVPP: venas pulmonares.
Tablas 2, 3 y 4: adaptado con autorización: http://pie.med.utoronto.ca/TEE/index.htm
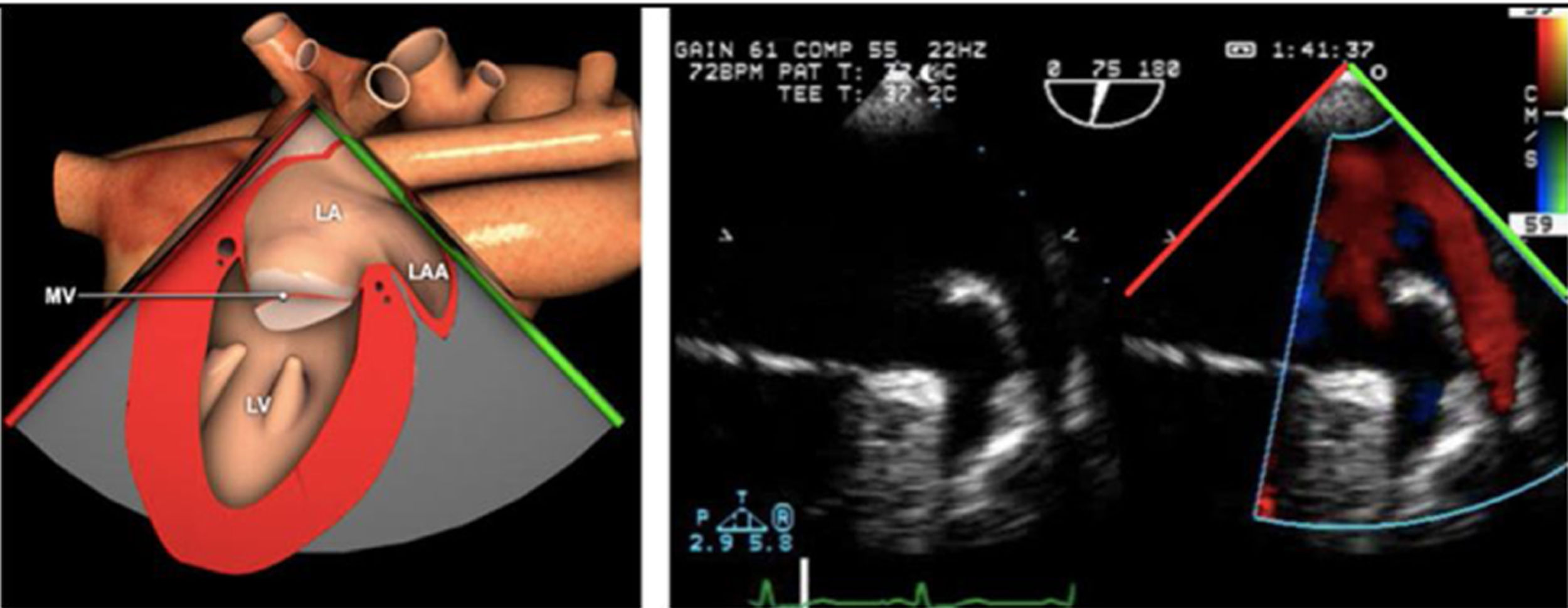
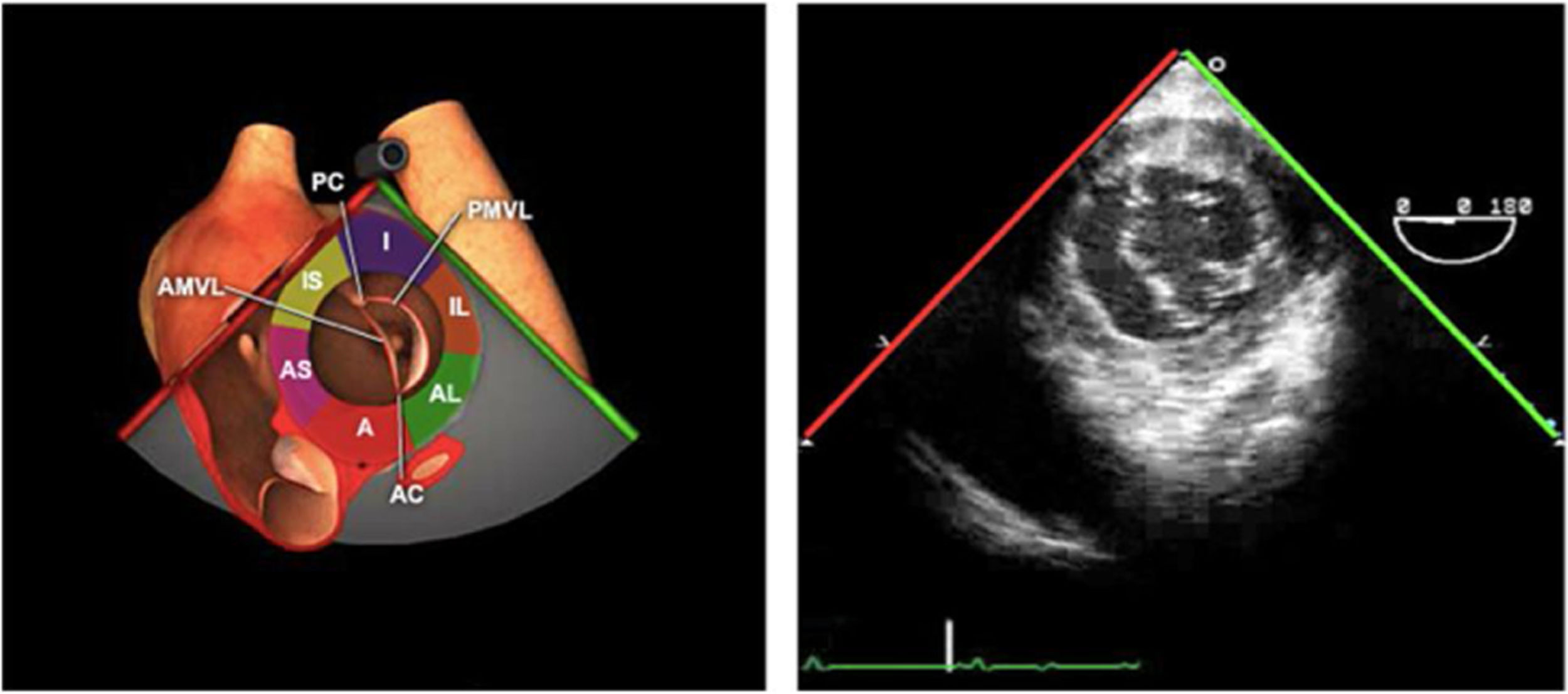
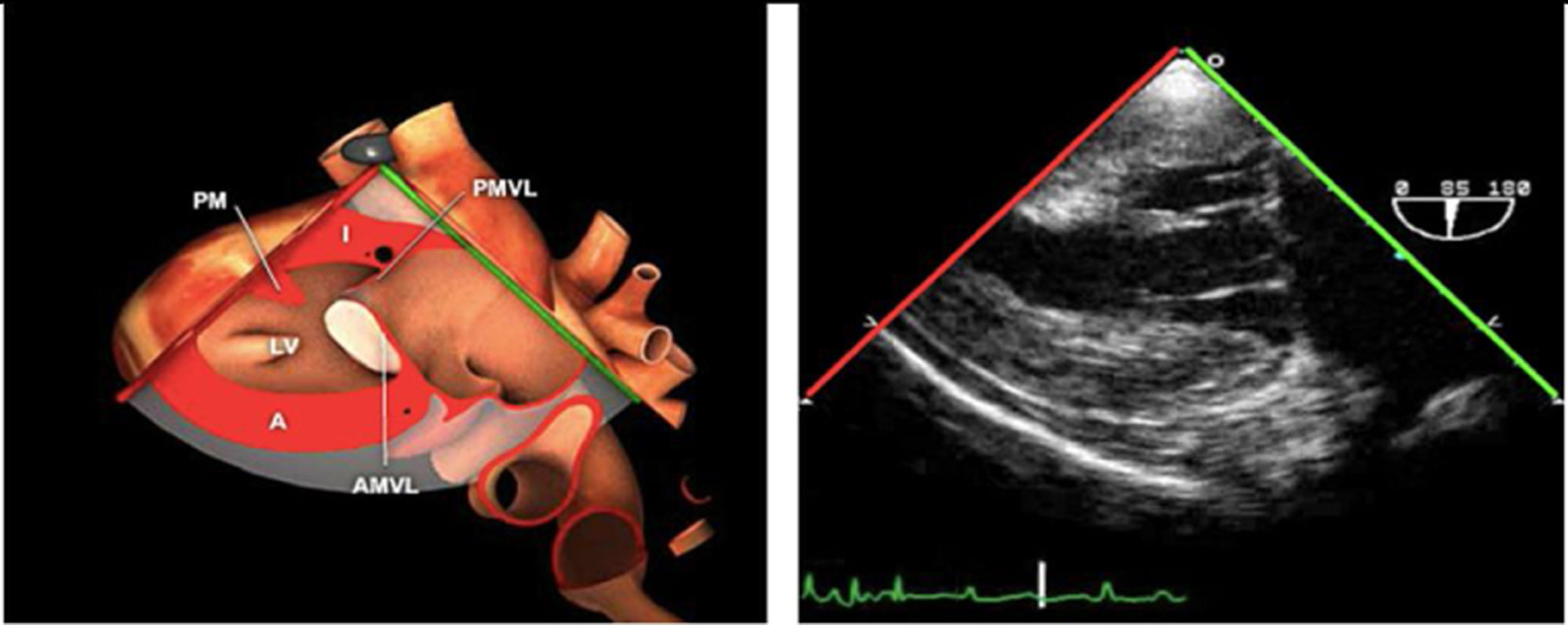
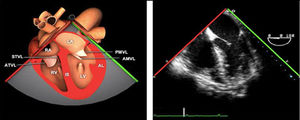
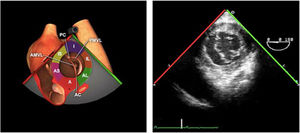
La exploración ecográfica de la válvula mitral se realiza como parte de la del aparato valvular mitral, compuesto por el anillo mitral, los velos (anterior y posterior), las cuerdas tendinosas y los músculos papilares del VI. Los velos anteriores y posteriores se han dividido de acuerdo a la clasificación de Carpentier en segmentos A1, A2, A3 y P1, P2, P 3 respectivamente siendo A1 y P1 los más anteriores.
Se debe analizar y describir las características anatómicas del aparato valvular, identificar la lesión o lesiones, determinar el mecanismo causante y el grado de insuficiencia (tabla 5).
Mecanismo de insuficiencia mitral
| Tipo I | Tipo II | Tipo III |
|---|---|---|
| Velos con movilidad conservada y/o anillos dilatadosEj: Endocarditis, perforación de velo mitral, dilatación anular en AI dilatadas | Velos con excesiva movilidadEj: Enfermedad de Barlow, deficiencia fibroelástica | Velos con movilidad reducida3A: Fusión y calcificación del aparato subvalvular. Ej: Enfermedad reumática3B: Velos con movilidad reducida por dilatación ventricular simétrica3C: Velos con movilidad reducida de forma asimétrica |
La válvula mitral se explora en los siguientes planos:
- -
Plano medioesofágico 4 cámaras. Nos permitirá la evaluación del velo anterior y posterior (A3-A2 y P2-P1), el punto de coaptación de ambos, exploración de las cuerdas tendinosas y músculos papilares. En este plano podemos medir el área y altura de tenting en los casos de IM isquémica o funcional así como la identificación de prolapsos. Mediante doppler color y doppler espectral podemos analizar los flujos entrantes y regurgitantes así como el gradiente valvular.
- -
Plano medioesofágico 5 cámaras. Observamos el TSVI y la válvula mitral con los festones A1-A2 y P1-P2.
- -
Plano medioesofágico 2 cámaras. Nos permite la identificación de los distintos festones del velo anterior y posterior
- -
Plano medioesofágico bicomisural. Nos permite identificar los festones P1-A2-P3 desde la derecha hacia la izquierda.
- -
Plano medioesofágico eje largo. Nos permite identificar los festones P2-A2. En este plano se puede medir la longitud de A2 para la estimación del anillo mitral. La medición del anillo mitral se realiza en este plano desde la inserción del velo posterior hasta la base de la VAo en sístole. Diámetros superiores a 40mm indican dilatación.
- -
Plano transgástrico 0° plano basal.
- -
Plano transgástrico eje largo 2 cámaras.
La exploración de la válvula mitral debe incluir la evaluación de la función biventricular, válvula tricúspide (VT) morfológica y funcionalmente, así como la estimación de presiones sistólicas pulmonares. Los mecanismos de la regurgitación se muestran en tabla 5.
La identificación de masas intraauriculares es indicación de su extracción en la cirugía mitral.
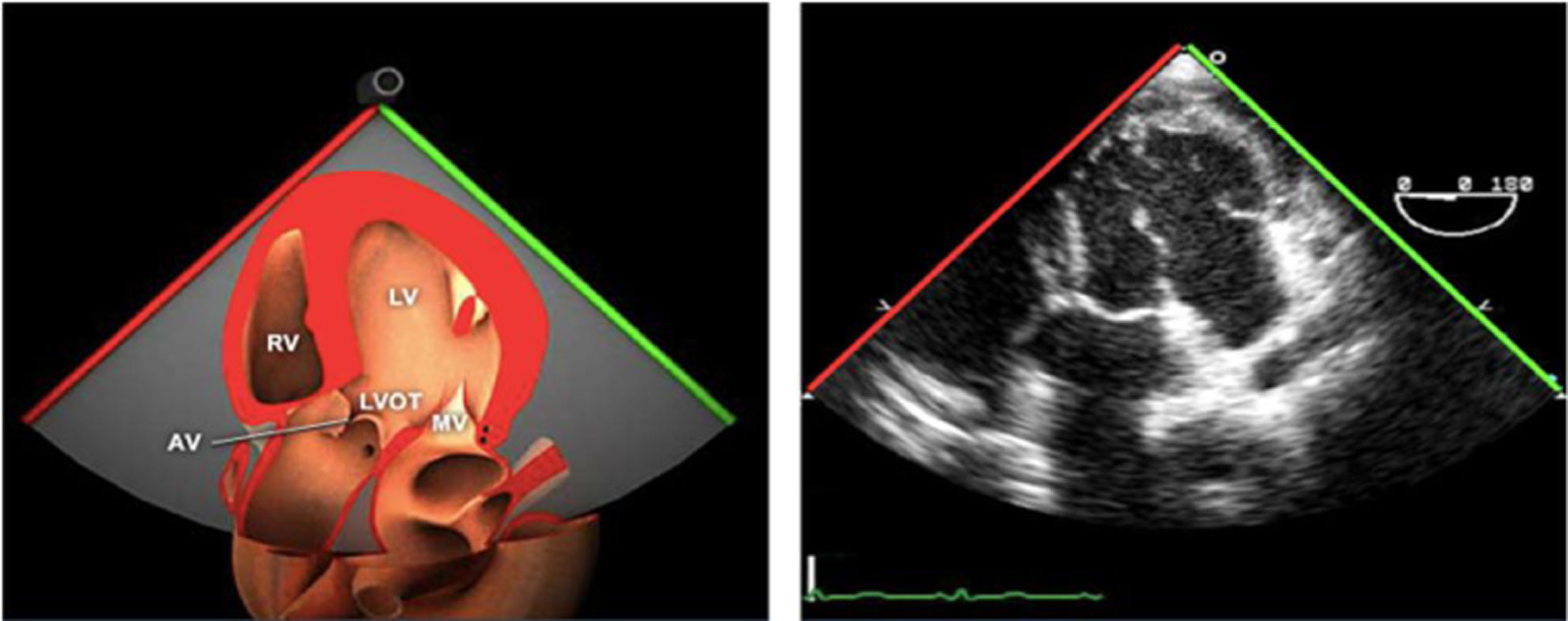
Válvula aórticaLa VAo es parte de la raíz aórtica que se extiende desde el anillo de la VAo hasta la unión sinotubular, con los senos de Valsalva entre ambas estructuras. La patología puede afectar a cualquiera de estos componentes y al tracto de salida del VI. El examen de la raíz y la VAo se realiza en los siguientes planos:
- -
Plano medioesofágico VAo eje corto. Permite analizar la anatomía de los 3 velos valvulares y la salida del tronco coronario izquierdo y menos frecuentemente la del tronco coronario derecho en una posición algo más superior.
- -
Plano medioesofágico VAo eje largo. Permite analizar el septo interventricular, TSVI, la raíz aórtica (incluye anillo, válvula, senos de Valsalva y unión senotubular) y aorta ascendente. En este plano la exploración con doppler color permite analizar flujos regurgitante o turbulentos, dirección y severidad. Podemos realizar mediciones de todos los elementos implicados y determinar movilidad de los velos y la relación entre ellos para determinar prolapsos o restricciones. El diámetro del TSVI se mide 5mm por debajo del anillo aórtico.
- -
Plano transgástrico profundo 5 cámaras. Este plano permite la evaluación de la VAo mediante doppler color y mediante doppler espectral dado que la imagen está alineada con el flujo sanguíneo y podremos medir gradientes valvulares y volumen sistólico eyectado latido a latido.
- -
Plano transgástrico eje largo. En este plano podremos estar alineados con el flujo para medición de velocidades.
- -
Evaluación de aorta ascendente mediante planos de grandes vasos y ME VAo eje largo. La exploración con doppler color nos permitirá la identificación de flujos anómalos y caracterización de patología tal como: disección de aorta, hematomas intramurales, placas complejas ateromatosas.
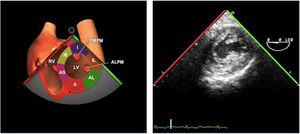
El examen de la VT se realiza en los siguientes planos:
- -
Plano medioesofágico 4 cámaras. Desde este plano en ocasiones es necesario avanzar ligeramente y anteflexionar la sonda para una correcta visión de la VT. A nivel infradiafragmático es la localización recomendada para la medición del diámetro del anillo tricuspídeo. En este plano se observa el velo anterior o posterior y a la derecha el velo septal de la misma.
- -
En plano bicava también se puede obtener una visión de la VT así como mediante doppler color identificar flujos regurgitantes o estenóticos. En caso de flujos regurgitantes mediante doppler espectral estaremos alineados con el flujo para la valoración cualitativa y estimación de presión sistólica pulmonar.
- -
En el plano ME tracto de entrada y salida del VD también se puede observar la VT con la identificación de sus velos, anterior/septal y posterior.
- -
En planos transgástricos, TG entrada VD y TG eje corto de la VT podremos analizar la anatomía y movilidad de sus 3 velos.
La evaluación ecográfica mediante ETE de la VP es difícil. Se realiza en los siguientes planos:
- -
Plano medioesofágico tracto de entrada y salida VD. En este plano se evalúa el tracto de salida del VD así como los velos de la válvula pulmonar.
- -
Plano transgástrico tracto de entrada y salida del ventrículo derecho (VD).
- -
Plano ME Aorta ascendente eje corte y eje largo y plano esofágico alto arco aórtico eje corto. En estos planos la válvula pulmonar y salida del tronco de la arteria pulmonar pueden observarse, aunque son estructuras difíciles de identificar. Una vez identificadas, la alineación con el flujo suele ser favorable y, por tanto, realizarse la medición de velocidades.
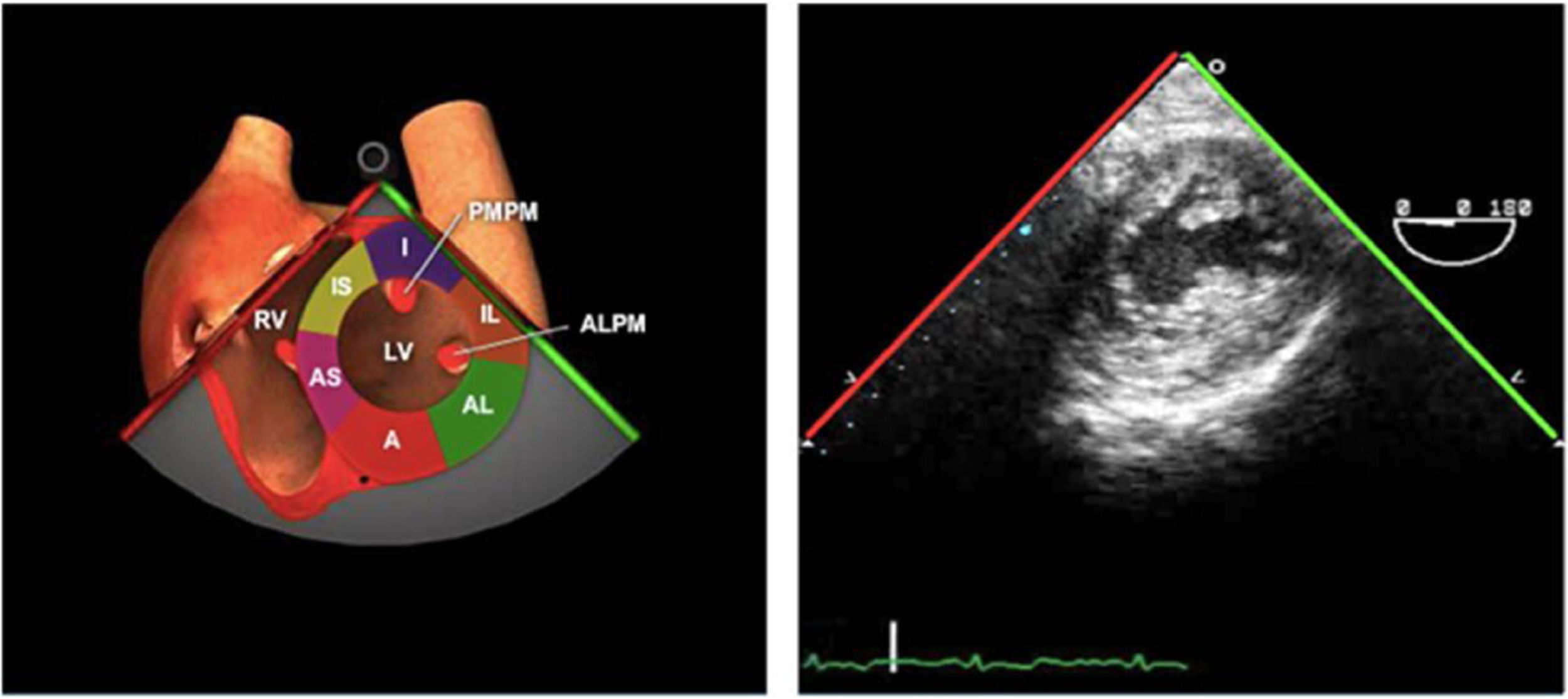
La evaluación de la morfología y función del VI es una parte importante en el intraoperatorio. El grado de disfunción ventricular, además de ser un predictor de resultados clínicos, ayuda a la estratificación del riesgo y de las intervenciones terapéuticas. La ETE permite una valoración de la función global y segmentaria a través del análisis del engrosamiento de los segmentos, tamaños y volúmenes ventriculares20. Es recomendable la realización de estudios cuantitativos y cualitativos de la función del VI.
La valoración del VI se realiza mediante las siguientes vistas:
- -
Plano medioesofágico 4 cámaras.
- -
Plano medioesofágico 2 cámaras.
- -
Plano medioesofágico 3 cámaras.
- -
Plano transgástrico eje corto: En este plano a nivel medial podemos visualizar los segmentos irrigados por los 3 vasos principales.
- -
Plano transgástrico eje largo.
Se recomienda la inspección de todos los segmentos en los planos indicados para la detección de alteraciones de la contractilidad segmentaria con una correcta visualización del endocardio y evitando el acortamiento del ápex.
Los métodos utilizados más frecuentemente para cuantificar la función sistólica son la estimación de la fracción de eyección mediante el método de Simpson, fracción de acortamiento, fracción de cambio de área y métodos que cuantifican la velocidad tisular del miocardio mediante doppler tisular.
En 2016 la Sociedad Americana de Ecocardiografía y la Asociación Europea de Imagen Cardiovascular crearon un documento de consenso para la evaluación de la función diastólica que simplificó esta valoración, proporcionando algoritmos que hacían que la valoración intraoperatoria fuese más simple y a la vez más eficiente21, recomendando que el estudio de la función diastólica del VI se debería utilizar para identificar aquellos pacientes con elevadas presiones de llenado22. Estos algoritmos ofrecen una combinación óptima de índices para clasificar la función diastólica y se basan en la determinación de parámetros ecocardiográficos en 2 grupos de pacientes: los pacientes con FEVI conservada y los pacientes con FEVI deprimida. La disfunción diastólica se ha observado como predictor de incremento de la mortalidad perioperatoria, ventilación mecánica prolongada e incremento de la estancia en la UCI independientemente de la función sistólica tras cirugía cardiaca23.
Los parámetros ecocardiográficos de función diastólica que se utilizan en la actualidad son:
- -
Doppler pulsado del flujo transmitral, registrado en el VI, en el punto de apertura de las valvas mitrales: velocidad de las ondas E y A.
- -
Doppler tisular del anillo mitral: velocidad de excursión del anillo mitral (e’).
- -
Doppler pulsado de las venas pulmonares: patrón de flujo.
- -
Doppler del flujo transtricuspídeo: velocidad del jet de regurgitación tricuspídea
- -
Volumen indexado de la aurícula izquierda (mL/m2)
La forma triangular e irregular del VD así como la trabeculación de su interior con escasa definición del endocardio hace que su evaluación morfológica y funcional sea difícil mediante ecografía.
La evaluación del mismo se realiza en los siguientes planos:
- -
Plano medioesofágico 4 cámaras. Se visualiza la pared libre del VD.
- -
Plano medioesofágico tracto de entrada y salida del VD.
- -
Plano medioesofágico bicava.
- -
Plano transgástrico eje corto y largo enfocado sobre VD donde se puede observar el VD, VT y aparato subvalvular.
- -
Plano transgástrico profundo tracto de entrada del VD.
- -
Plano transgástrico profundo focalizado en VD
La evaluación de la función sistólica se realiza mediante medidas cuantitativas de función global sistólica como el cambio fraccional de área (FAC), y acortamiento longitudinal como la excursión sistólica del anillo tricuspídeo (TAPSE) y la medición de la velocidad sistólica mediante doppler tisular del anillo tricuspídeo (Ś). Es importante reseñar que la cuantificación de TAPSE y Ś tras CEC no son valorables para cuantificar la función global del VD24,25.
La evaluación de los diámetros ventriculares derechos, el movimiento del septo y la posición del ápex son indicadores indirectos de la función del VD en el intraoperatorio tras salida de CEC.
Parámetros de estudioUtilidad durante el periodo previo a la circulación extracorpóreaConfirmación de la patología programada para tratar y detección de otras alteracionesUn examen ecocardiográfico adecuado pre-CEC o preintervención permite validar la indicación preoperatoria de cirugía y detectar hallazgos nuevos subsidiarios de intervención.
En función del tipo de cirugía remarcamos las siguientes consideraciones:
- •
En la ETE pre-CEC, además de encontrar nuevos hallazgos patológicos que puedan generar un cambio en la indicación programada, se deben explorar alteraciones que obligan al cirujano a modificar su práctica habitual: la presencia de una insuficiencia aórtica (IAo) mayor de ligera puede dificultar la protección miocárdica mediante la administración de cardioplejía anterógrada, requiriendo otras estrategias como la administración retrógrada a través del seno coronario26. La identificación de hipertrofia concéntrica o excéntrica y de la función sistólica y diastólica basal resulta imprescindible para predecir dificultades en la salida post-CEC y optimizar el tratamiento farmacológico y protección miocárdica mediante la cardioplejía.
- •
El daño neurológico es una de las complicaciones más importantes tras la cirugía cardiaca. Su etiología es multifactorial y la ETE tiene un papel esencial en la detección de las placas ateromatosas aórticas, ya que es más sensible que la palpación de la aorta27,28. La presencia de placas importantes con elementos móviles puede determinar un cambio de la estrategia quirúrgica, modificar el lugar de colocación de la cánula aórtica y pinzamiento aórtico, la utilización de cánulas arteriales con filtros de protección e incluso la realización de la cirugía sin CEC o sin pinzamiento, en el caso de que el procedimiento lo permita. Una de las limitaciones de la ETE es la limitada visualización de la porción distal de la aorta ascendente y la región proximal del arco aórtico debido a la interposición de la tráquea y del bronquio principal izquierdo29. La presencia de placas significativas a nivel de aorta descendente pueden determinar la contraindicación de implantación de BCIAo o establecimiento de CEC vía periférica.
- •
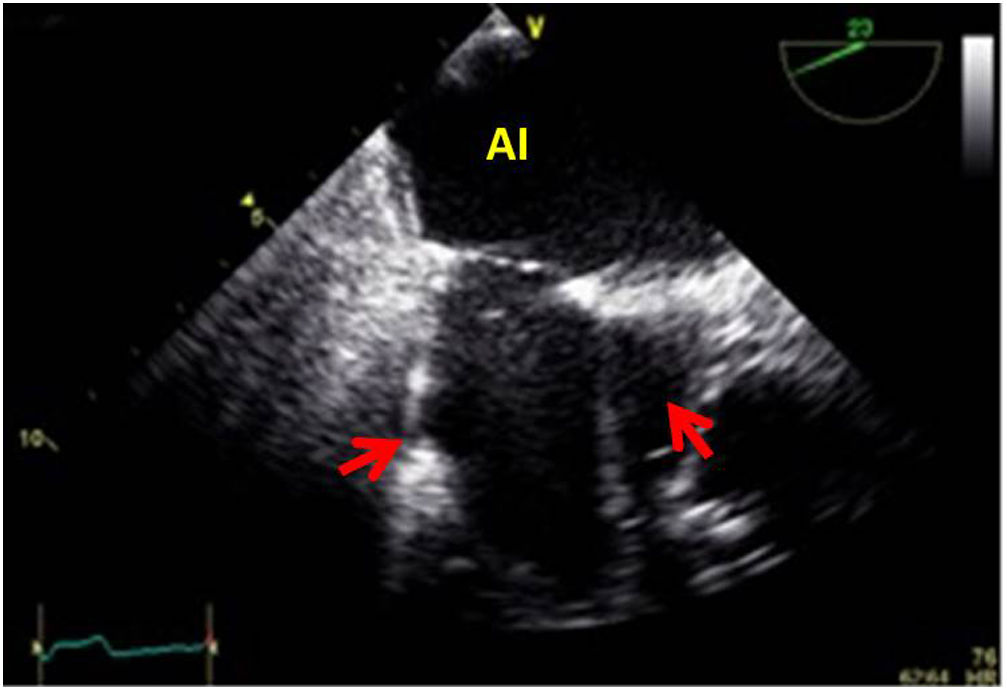
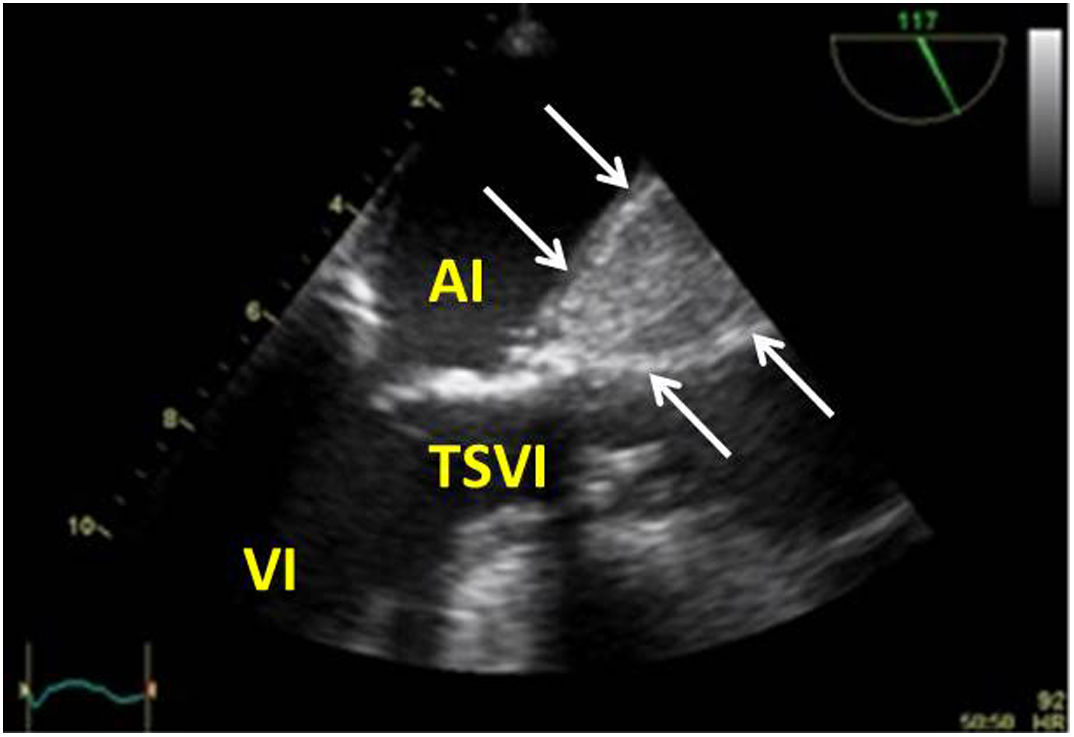
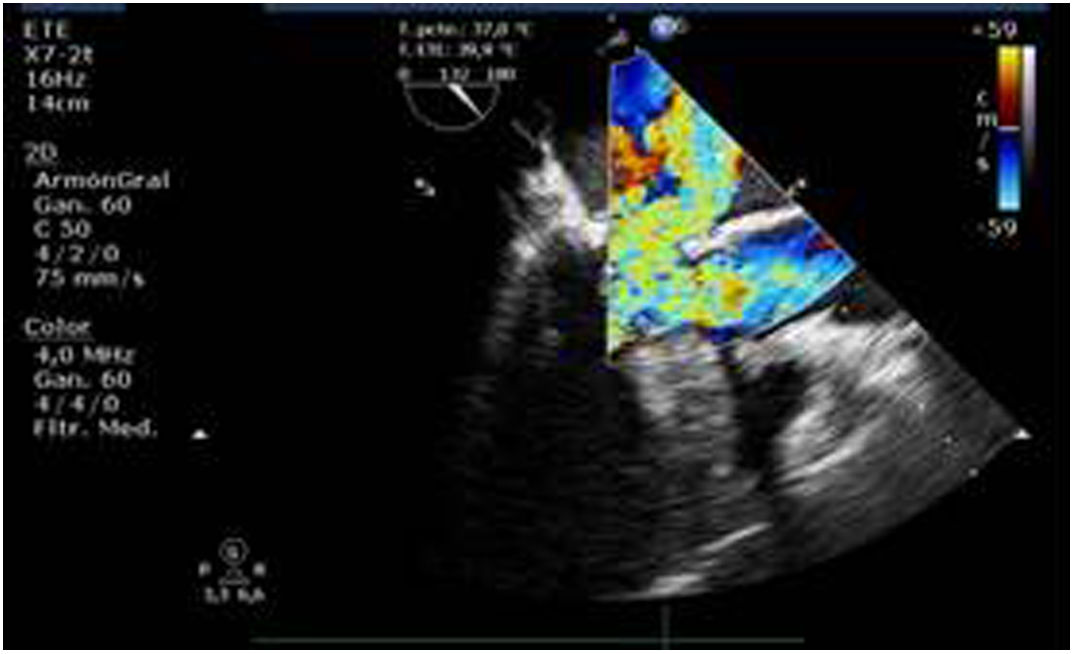
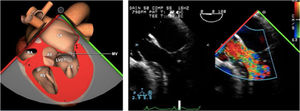
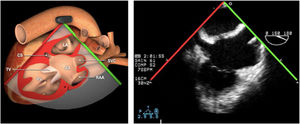
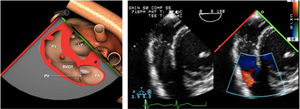
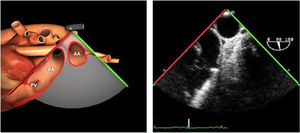
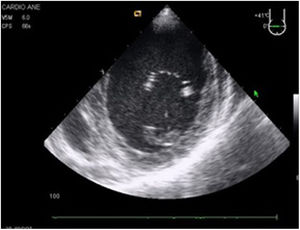
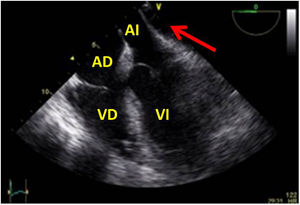
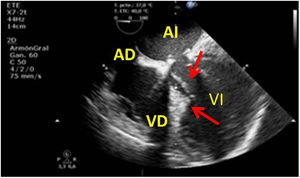
Valvulopatía mitral. La corroboración del mecanismo de IM así como la determinación de los festones afectados es fundamental. La cuantificación de la IM por ETE pre-CEC se correlaciona en gran medida con el estudio transtorácico (ETT) preoperatorio cuando el mecanismo de la lesión es una rotura de cuerda tendinosa o de músculo papilar, pero esta concordancia es menor cuando el mecanismo predominante de la lesión es degenerativo o funcional. Las condiciones hemodinámicas asociadas a la anestesia general determinan una infraestimación de la IM, particularmente en pacientes con IM isquémica que es necesario tener en cuenta en nuestra exploración30,31 (fig. 1). La administración de volumen y vasoconstrictores (fenilefrina o efedrina) permite restaurar las condiciones fisiológicas y realizar una adecuada valoración de la severidad y del mecanismo que la origina.
- •
Valvulopatía aórtica. En los pacientes con estenosis aórtica severa el diagnóstico se confirmará mediante el análisis de la válvula con ecocardiografía 2D en un plano medioesofágico eje corto y estimación de gradientes en planos transgástricos. En el plano medioesofágico eje largo de la VAo se obtendrá información sobre el TSVI, la VAo y la raíz de la aorta y permitirá diferenciar la patología valvular de la supra- y subvalvular, descartando rodetes subaórticos e hipertrofia septal que puedan condicionar gradientes subaórticos y ser subsidiarios de cirugía en el mismo procedimiento. La cuantificación de la IAo por ETE pre-CEC concuerda de forma parcial con el ETT preoperatorio pero es muy fiable la valoración del mecanismo de la IAo mediante la valoración de la movilidad de los velos y la dirección del chorro de regurgitación32,33. La determinación de prolapsos, fenestraciones, asimetría de las comisuras, distribución del calcio son variables importantes para predecir la reparabilidad de la VAo34.
- •
En la cirugía de aneurisma de aorta ascendente, la ETE pre-CEC confirma la dilatación de la aorta en el plano medioesofágico eje largo y la asociación o no de IAo así como la determinación de las medidas del anillo, senos de Valsalva y unión senotubular35. En las disecciones aórticas tipo A nos permite identificar el flap intimal, el sitio de entrada, diferenciar la luz verdadera de la falsa y la detección de trombo intramural. También deben evaluarse las complicaciones asociadas a la disección como derrame pericárdico que puede condicionar taponamiento; la presencia y severidad de IAo y alteraciones de la contractilidad segmentaria por afectación de una arteria coronaria36.
- •
En la cirugía mínimamente invasiva la asistencia mediante ETE para la correcta colocación de las cánulas venosas en vena cava inferior y superior mediante la visualización de guías y cánulas en plano medioesofágico bicava resulta de gran ayuda. La visualización de la guía en aorta descendente confirma la correcta introducción de la cánula arterial en arteria femoral37,38.
- •
La detección de trombos en orejuela izquierda podría determinar su extracción si la cirugía implica apertura de cavidades o incluso el cierre de orejuela en pacientes con factores de riesgo, aunque su indicación sistemática es controvertida39.
Las mediciones ecográficas recomendadas según el tipo de cirugía son las siguientes:
- -
En la cirugía reparadora mitral, deberán hacerse las siguientes mediciones: longitud de velo mitral anterior (A2) en un plano medioesofágico eje largo, que se correlaciona con el tamaño del anillo a implantar40.
- -
En la IM isquémica la medida de la altura y del área de «tenting» y la longitud del anillo ayuda a predecir el éxito de la reparación41.
- -
La determinación de predictores de fracaso de reparación mitral y complicaciones con el SAM con obstrucción del TSVI es esencial. Tales medidas son: la distancia septo-punto de coaptación (predictor de riesgo cuando mide<2,5cm), longitud de velo posterior (en plano ME 5 cámaras eje largo>1,5cm) y relación de longitud velo A/P<1,4cm, hipertrofia septal (>1,5) con cavidad ventricular pequeña (diámetro<4,5cm)42.
- -
El diámetro del anillo tricúspide en telediástole, en un plano medioesofágico 0° 4 cámaras a nivel infradiafragmático, cuando es mayor de 40mm o 21mm/m2 está indicada la reparación tricúspide a pesar de que no esté presente una insuficiencia significativa43.
- -
La medición del anillo aórtico en un plano medioesofágico eje largo se correlaciona aceptablemente con las dimensiones anatómicas44.
El papel del ETE específicamente tras la salida de CEC y ante pacientes con inestabilidad hemodinámica resulta de vital importancia para diagnosticar las causas y tratarlas de forma dirigida.
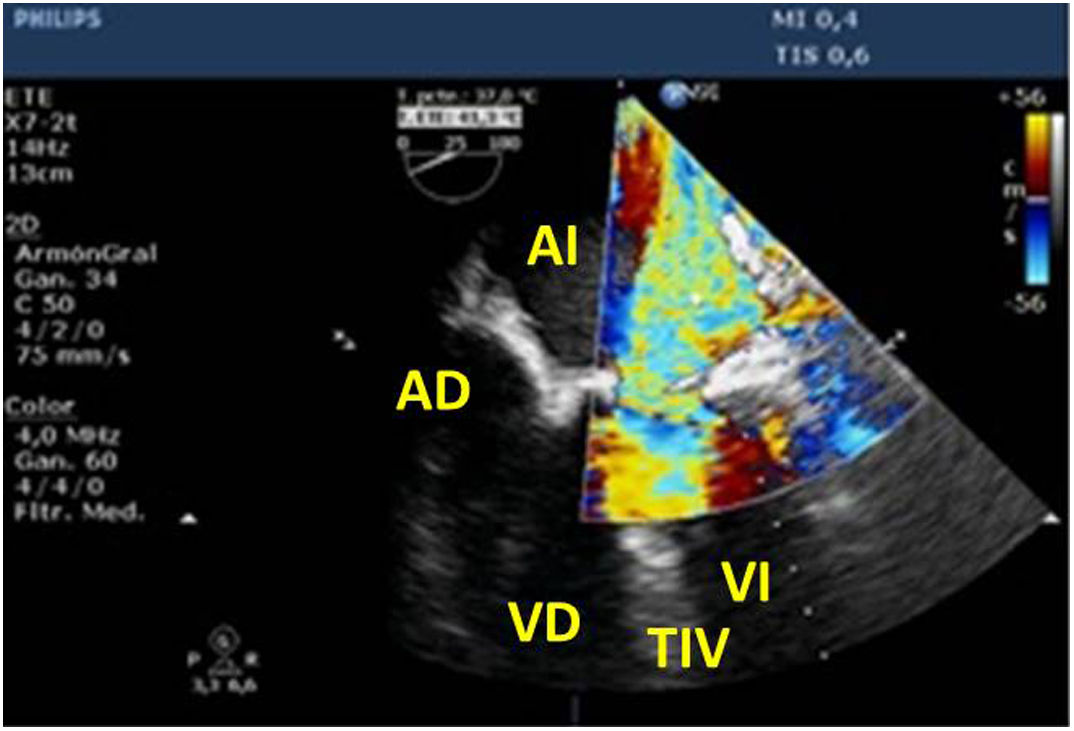
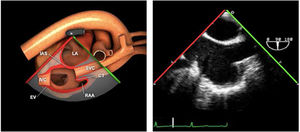
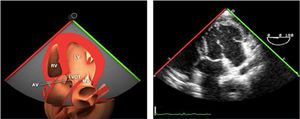
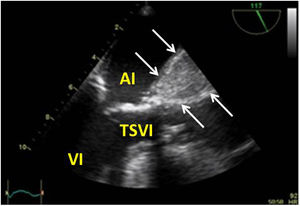
Utilidad en el shock postcardiotomíaLa evaluación hemodinámica mediante la ETE nos va a proporcionar información tanto de la etiología de la inestabilidad hemodinámica (hipovolemia, depresión miocárdica, disfunción valvular), como de la orientación terapéutica (carga de volumen, uso de inotrópicos o vasoconstrictores, nuevo bypass o corrección quirúrgica de un defecto protésico o una reparación subóptima) como de la respuesta al tratamiento45 (fig. 2).
Muchos de los pacientes sometidos a cirugía cardiaca presentan disfunción ventricular previa a la cirugía y otros con función ventricular normal pueden presentan alteraciones transitorias o permanentes tras el procedimiento, por lo que la valoración de la función sistólica y diastólica biventricular basal es un aspecto fundamental.
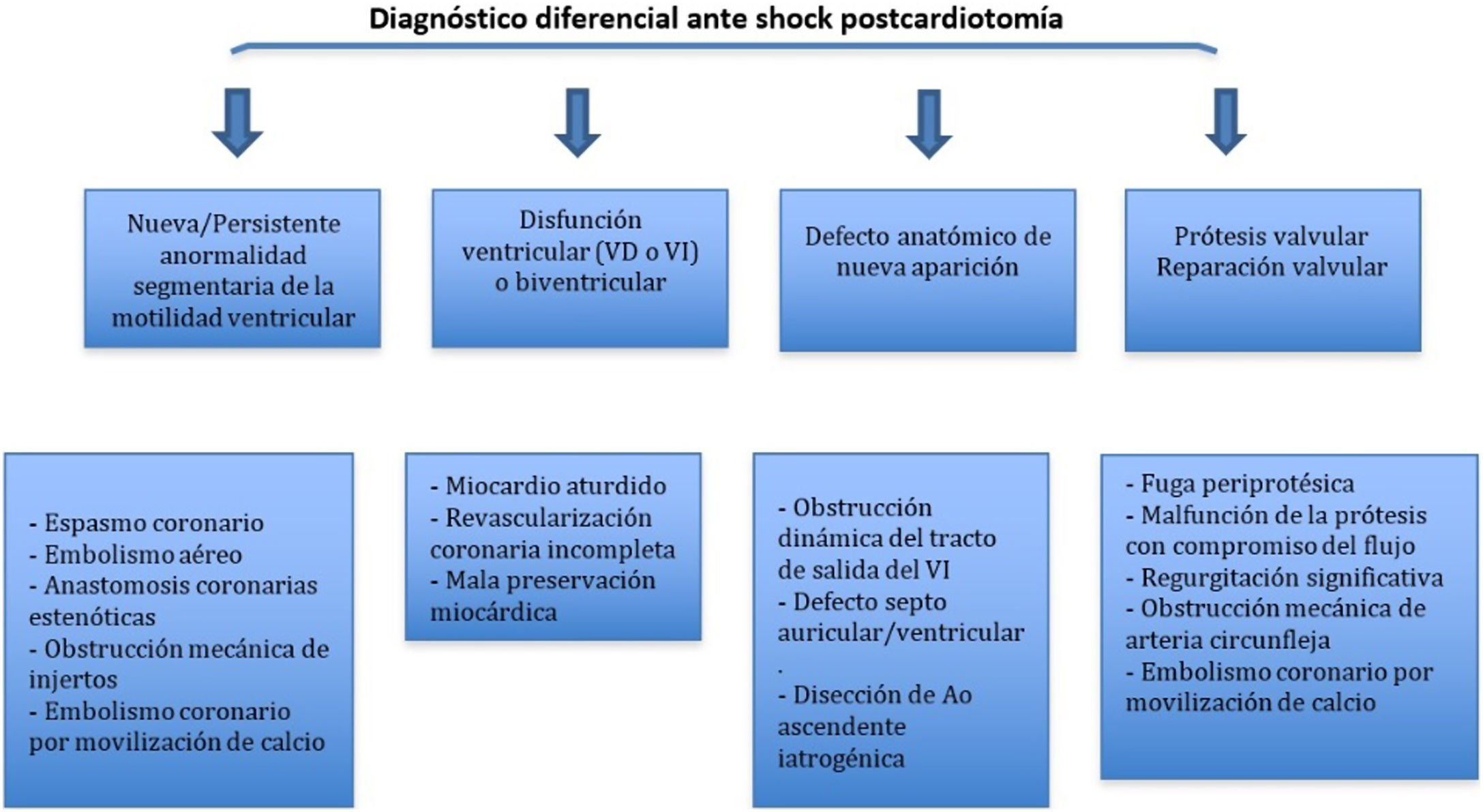
La aparición de disfunción ventricular de novo tras la salida de CEC, tanto izquierda como derecha, obliga a plantearse los distintos diagnósticos (tabla 6).
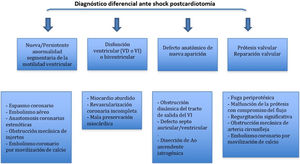
Si la disfunción ventricular se acompaña de alteraciones de la contractilidad segmentaria o aparecen nuevos defectos sin disfunción sistólica marcada es necesario plantearse los siguientes diagnósticos (tabla 7):
Diagnóstico diferencial etiológico de aparición de nuevas alteraciones de la contractilidad segmentaria tras CEC
| - Espasmo coronario |
| - Embolismo aéreo |
| - Anastomosis coronarias estenóticas |
| - Obstrucción mecánica de injertos |
| - Obstrucción mecánica de arteria circunfleja en cirugía mitral |
| - Oclusión de vasos coronarios por movilización de material embolígeno |
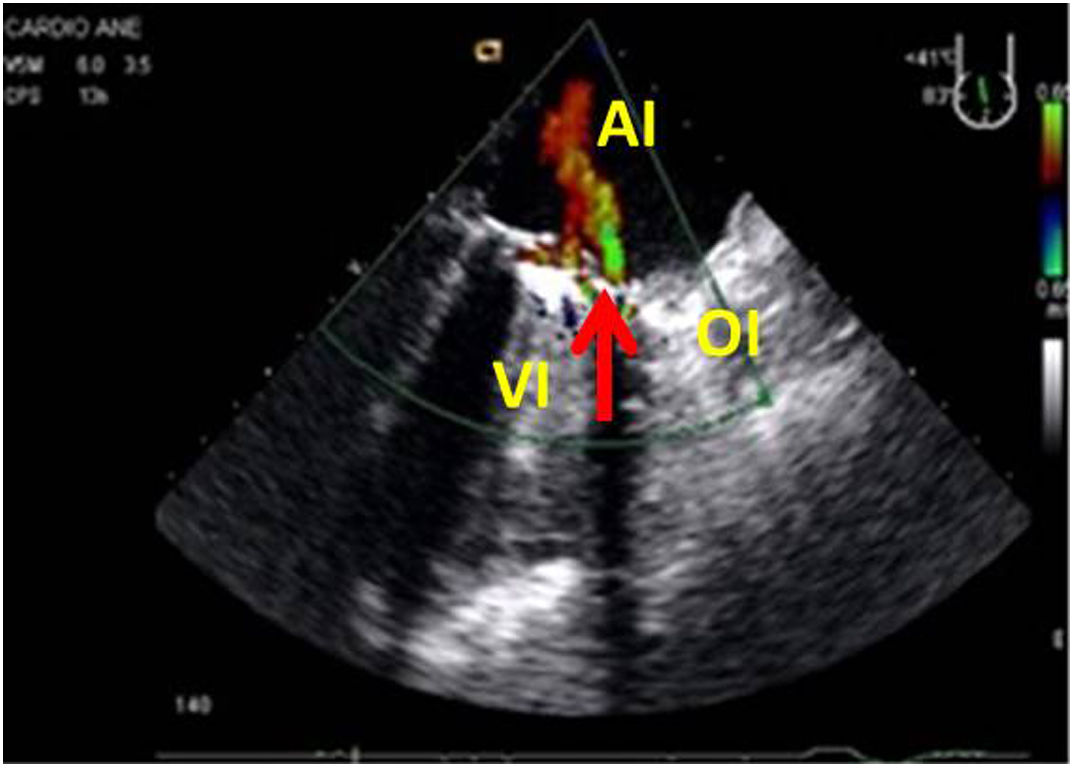
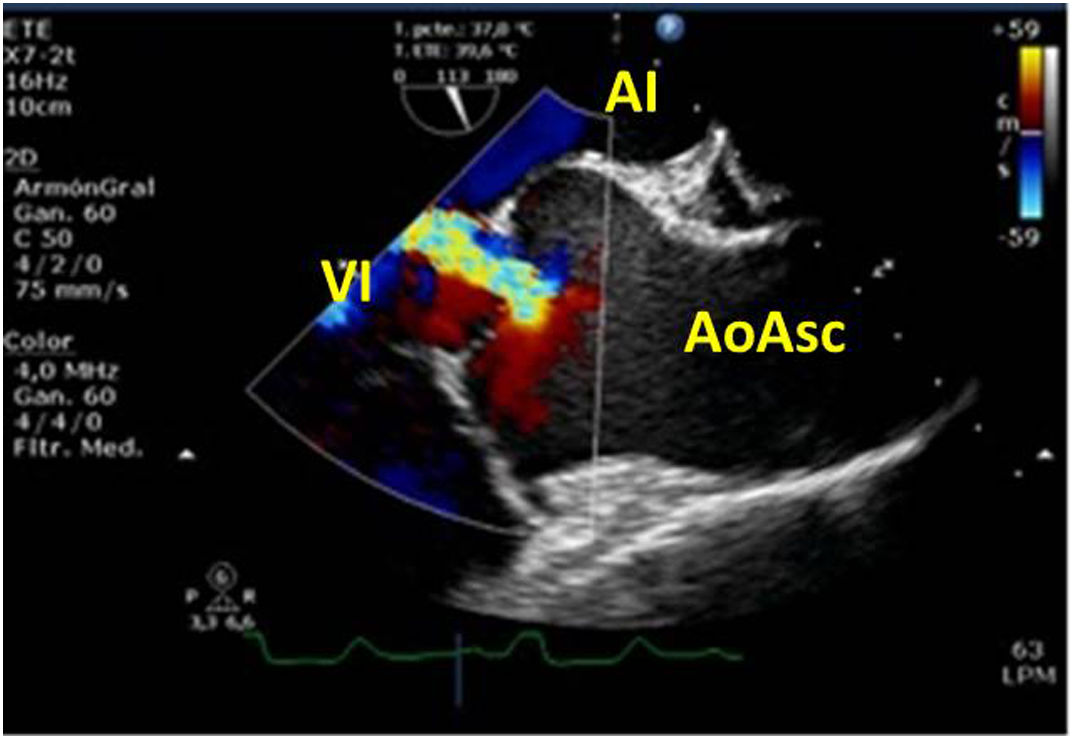
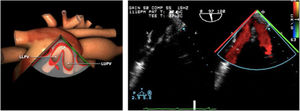
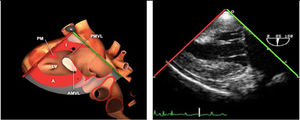
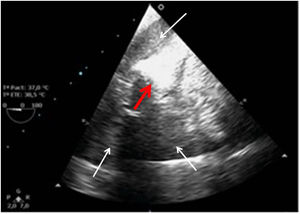
Cerrada la cardiotomía, el purgado de aire intracardiaco es importante para evitar embolias coronarias que pueden ser la causa de disfunciones ventriculares transitorias, alteraciones de la contractilidad segmentaria y cuadros de severa inestabilidad hemodinámica (fig. 3).
Ante disfunciones graves ventriculares sin respuesta adecuada a fármacos inotrópicos será necesario el uso de dispositivos mecánicos como el BCIAo o asistencias mecánicas ventriculares (ej.: ECMO). En estos casos, la ETE permite la colocación guiada de las cánulas y confirma el correcto funcionamiento del dispositivo. Los planos adecuados son el plano medioesofágico de aorta descendente que permite comprobar la correcta colocación del BCIAo a unos centímetros por debajo de la salida de la subclavia izquierda46.
Consideraciones especiales sobre la valoración de la volemiaLa ETE es un excelente método para valorar el estado de la volemia intraoperatoriamente47. Una de las causas frecuentes de inestabilidad tras salida de CEC es la depleción de volumen. Los principales parámetros para valorar la volemia mediante ETE son las siguientes47,48:
- •
Índices estáticos de valoración de la volemia:
- –
Reducción de los diámetros y áreas del VI: Existe una buena correlación lineal entre los cambios en la superficie telediastólica del VI (STDVI) (en el eje corto transgástrico mediopapilar) y cambios en el volumen sistólico en casos de hipovolemia, incluso en pacientes con baja fracción de eyección49.
- –
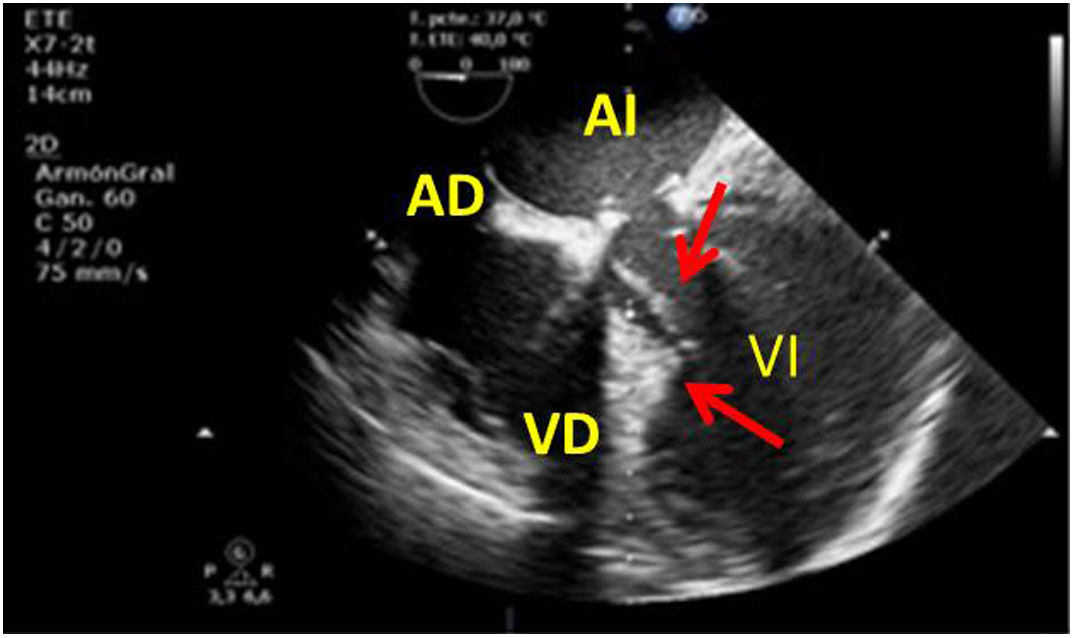
VI de contractilidad vigorosa, que junto con la reducción de la superficie telesistólica da la imagen típica de «kissing walls o kissing paps» (obliteración de la cavidad, con paredes que se tocan). La hipovolemia puede dar la falsa impresión de hipertrofia ventricular (figs. 4 y 5).
- –
Gran oscilación del tabique interauricular durante los 2 tiempos respiratorios50.
- –
Medidas indirectas de presión elevada en AI51:
- ∘
Onda E (patrón transmitral)<60cm/s se correlaciona con presiones telediastólicas bajas.
- ∘
Relación E/E’>15 se correlaciona con PTDVI>15mmHg.
- •
Índices dinámicos de indicación de respuesta a fluidos.
Los parámetros de precarga dinámicos de repuesta positiva a fluidos son variables que se basan en la interacción cardiopulmonar provocada por la ventilación mecánica controlada y permiten predecir si la administración de volumen va a aumentar el gasto cardiaco52. Estos parámetros durante la cirugía con esternotomía abierta no son valorables pero sí en el postoperatorio. Es necesario tener en cuenta que los parámetros propuestos tampoco son fiables en situaciones de disfunción severa del VD.
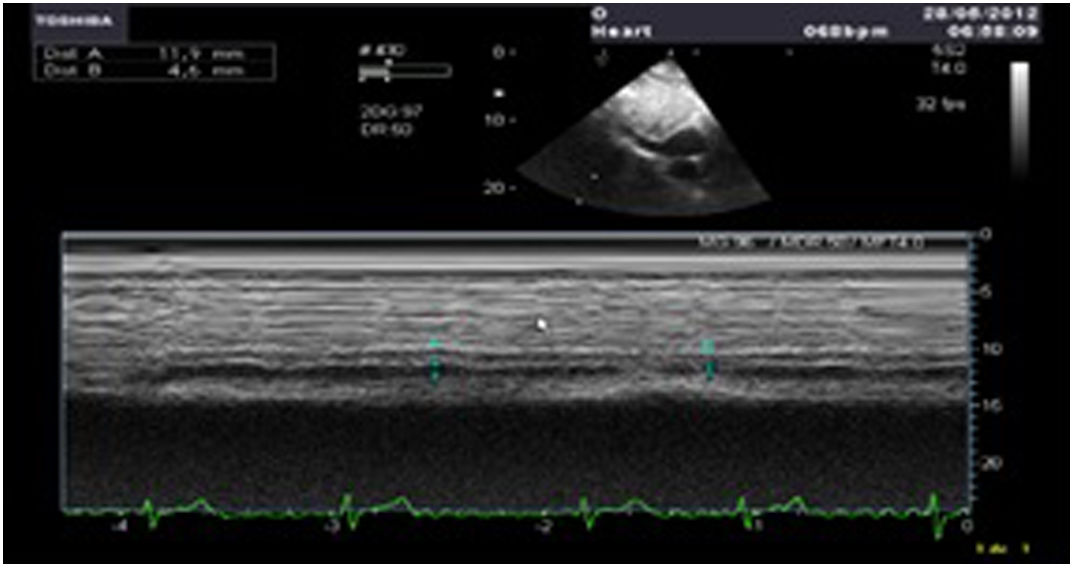
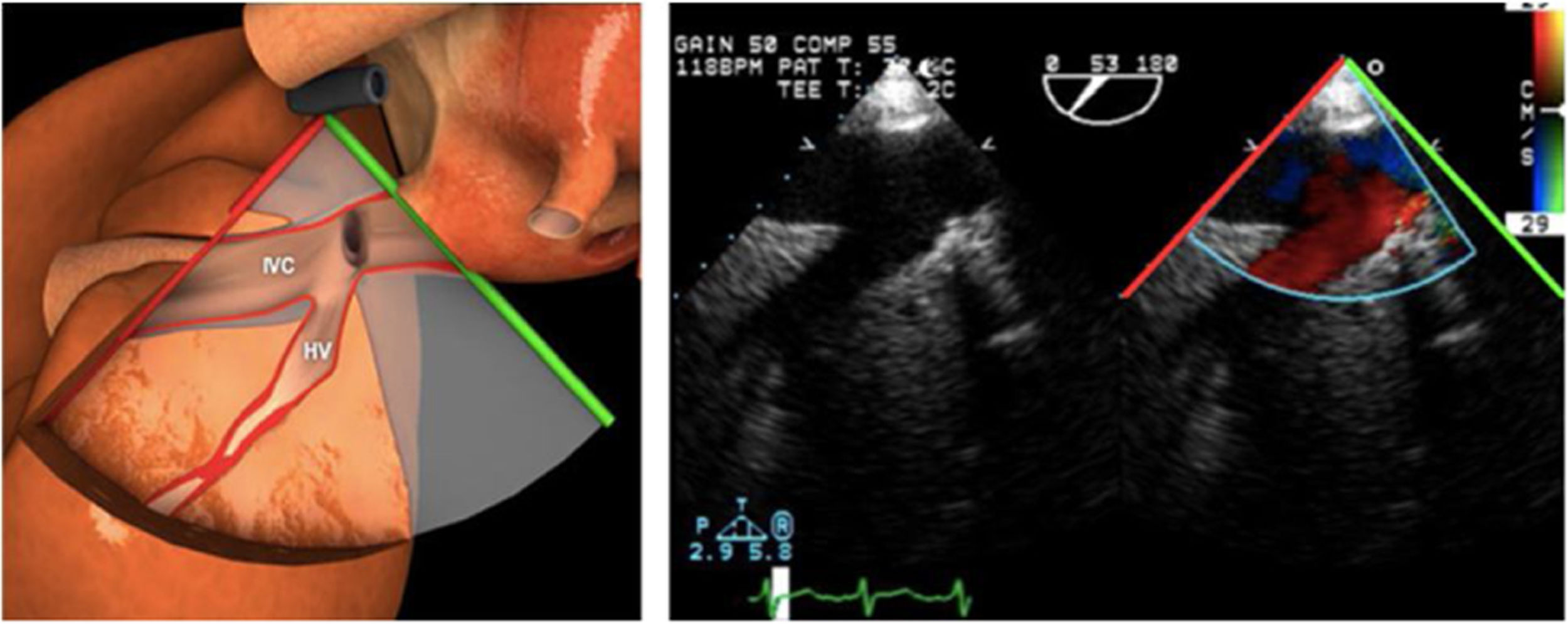
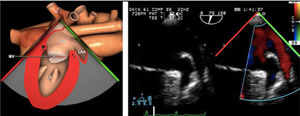
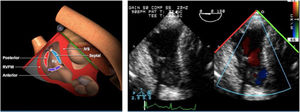
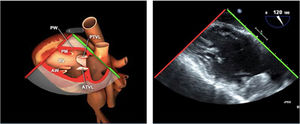
Los índices más utilizados son el tamaño y la colapsabilidad de la cava inferior (planos transgástricos orientados hacia el VD y VCI)53(fig. 6):
- –
Índice de colapsabilidad de la VCI: Dmáx-Dmín/Dmáx100>36%
- –
Variación de la VCI: Dmáx-Dmín/Dmedio×100>12%
- –
Índice de distensibilidad VCI: Dmáx-Dmín/Dmín×100>18%
- –
Vena cava superior (en el plano bicava o de aorta ascendente eje largo)
- –
Índice de colapsabilidad VCS: Dmáx-Dmín/Dmáx×100>36%
- –
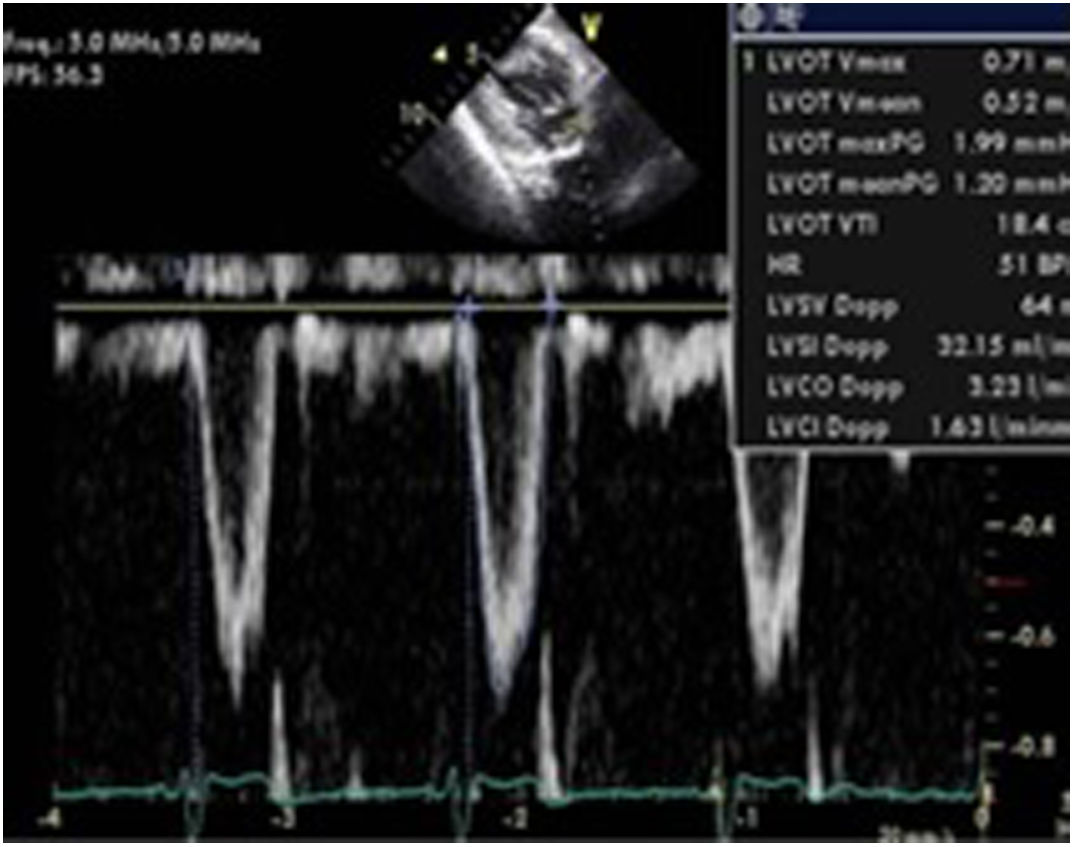
Variabilidad flujo aórtico. Mediante la medición de la integral velocidad tiempo (ITV) con doppler pulsado en el TSVI y el diámetro del mismo estimaremos el gasto cardiaco (GC=VS (ITVtsvi×diámetro tsvi)×FC).
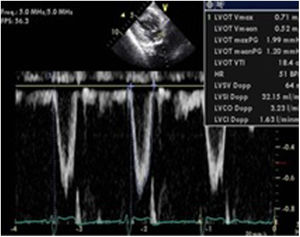
La variabilidad respiratoria del mismo calculada mediante la siguiente fórmula: [ΔVmáx flujo aórtico=Pico velocidad ITV mayor-Pico velocidad ITV menor]/[(Pico velocidad ITV mayor+Pico velocidad ITV menor)/2]. Si esta variabilidad es>12% es indicativo de respuesta positiva a la administración de volumen54(fig. 7).
En ocasiones la inestabilidad hemodinámica se caracteriza por hipotensión marcada sin disfunción ventricular. En estos casos es necesario descartar un sangrado no evidenciado en el campo quirúrgico y evaluar la cavidad pleural dado que en estos recesos es frecuente la acumulación de grandes cantidades de volumen. La exploración del pulmón (TELU) puede ser de utilidad mediante los planos medioesofágicos y transgástrico posteriores. Cuando observemos la aorta descendente estaremos viendo la pleura izquierda y cuando observemos la cavidad con espacio anecoico que se corresponde con el líquido pleural pero sin ver en primer lugar la aorta, se tratará de derrame pleural derecho (fig. 8). Otra causa de hipotensión poscardiotomía con función sistólica conservada y volemia correcta es la vasoplejía cuyos signos ecocardiográficos serán la evidencia de ventrículos hiperdinámicos con diámetros telesistólicos reducidos y gasto cardiaco elevado. Si bien es frecuente observar que responden a volumen, pueden ser tratados con dosis bajas de NA, evitando una sobrecarga de fluidos y la hemodilución correspondiente. La monitorización intermitente del gasto cardiaco nos ayuda a orientar el cuadro y elegir el tratamiento correcto en situaciones dinámicas.
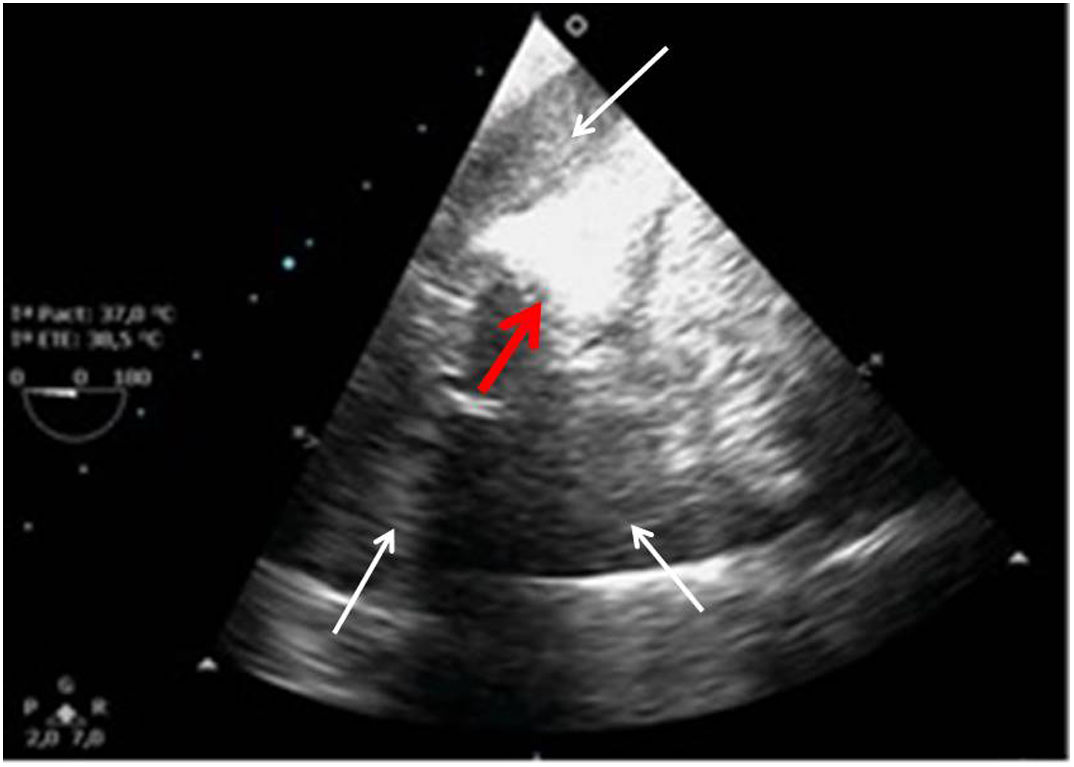
Tras el cierre de la esternotomía puede acumularse sangre en el saco pericárdico en regiones posteriores con compromiso de cavidades de forma local y que producen importante repercusión hemodinámica por la rapidez de su instauración (fig. 9).
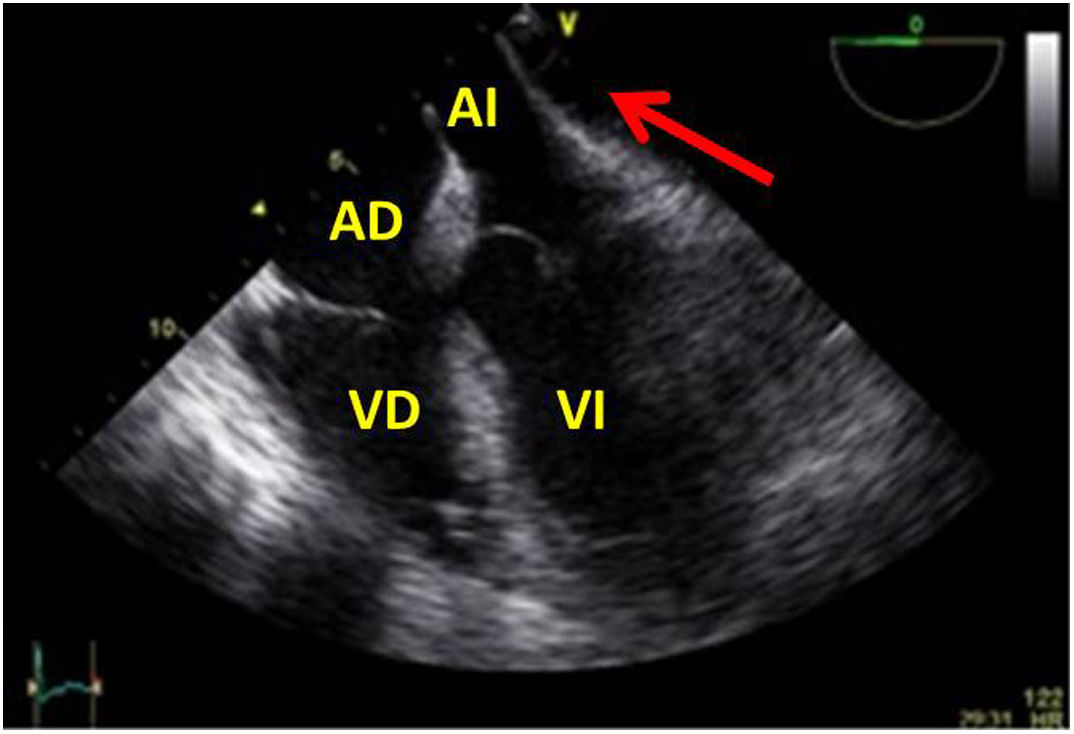
Una causa infrecuente pero importante de diagnosticar son las complicaciones sobre la aorta ascendente. En toda cirugía cardiaca en la que se manipula la aorta (canulación, pinzamiento), puede existir como complicación la disección de la misma o hematomas intramurales en el lugar del pinzamiento o administración de cardioplejía, por tanto, antes de iniciar el cierre, será necesaria su exploración mediante la ETE. Utilizaremos el plano medioesofágico eje largo para la aorta ascendente y los planos posteriores medioesofágicos para la aorta descendente (fig. 10).
Consideraciones en procedimientos específicosValoración de la sustitución valvular protésicaLa utilidad de la ETE post-CEC en los enfermos en los que se realizan sustituciones valvulares se centrará principalmente en comprobar la correcta movilidad de los discos protésicos, en la medición de gradientes y en descartar la presencia de fugas periprotésicas o intraprotésicas significativas55. Para ello es necesaria la realización de un estudio completo con todos los planos sobre la válvula a estudio. La presencia de desproporción o mismatch valvular tras la implantación protésica es infrecuente pero con importantes consecuencias56. No obstante, la interpretación de gradientes elevados intraprotésicos tiene que ser evaluada de forma cautelosa dada la situación hemodinámica particular existente tras la CEC. La utilización de medidas ecocardiográficas independientes de la situación hemodinámica puede ser de utilidad en este contexto. Mediciones tales como la relación de velocidades máximas o la integral velocidad tiempo entre el TSVI y la VAo (ITV TSVI/ITV VAo<0,35) son indicativas de estenosis significativa con independencia de la situación hemodinámica57.
En la exploración de las prótesis valvulares es importante descartar la presencia de regurgitaciones periprotésicas significativas que obligue a una nueva corrección (fig. 11). En estos casos la información sobre el lugar exacto en el que se encuentra la dehiscencia periprotésica orienta al cirujano, ya que una vez abierta la cavidad es más difícil localizarla. No obstante, las fugas periprotésicas aunque significativas no suelen ser causa de inestabilidad hemodinámica importante postCEC58,59.
En ocasiones, en la salida de CEC tras sustituciones valvulares aórticas se puede observar en la ETE un aumento de gradientes subaórticos que condicionan inestabilidad hemodinámica. Si esta situación se asocia a hipertrofia septal significativa con obstrucción dinámica al tracto de salida e incluso SAM con IM puede ser necesaria la reentrada en CEC para realización de miectomía si tras la corrección de la volemia y la retirada de fármacos inotrópicos no mejora60 (fig. 12).
Valoración en la cirugía reparadora valvular mitralLa ETE post-CEC nos permite evaluar la calidad de la reparación. La presencia de reparaciones subóptimas y la indicación de reentrada en CEC debe ser valorada de forma individualizada teniendo en cuenta los riesgos basales, los tiempos de pinzamiento aórtico y las posibilidades de mejorar la reparación. La evaluación de la severidad de la misma debe hacerse en las condiciones hemodinámicas más fisiológicas posibles.
Las complicaciones asociadas a la reparación mitral que pueden condicionar inestabilidad hemodinámica tras salida de CEC se muestran en la tabla 8.
Complicaciones tras la reparación mitral
| Insuficiencia mitral residual |
| Estenosis mitral |
| SAM con obstrucción dinámica del TSVI e IM |
| Disfunción ventricular por oclusión o distorsión de la arteria circunfleja |
| Seudoaneurisma en la zona de descalcificación del anillo mitral y fugas perianillo. |
| Insuficiencia aórtica secundaria a la distorsión del anillo mitroaórtico |
IM: insuficiencia mitral; SAM: movimiento sistólico anterior; TSVI: tracto salida ventrículo izquierdo.
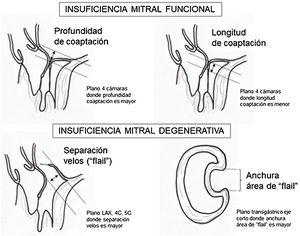
La necesidad para una reentrada en CEC por IM residual significativa tras reparación mitral puede llegar al 8%61. La frecuencia de estenosis mitral con gradiente transmitral elevado tras reparación se aproxima al 1,6%55. El espectro clínico del SAM tras reparación mitral es variable oscilando entre el 1% y el 16% (figs. 13 y 14). Si esta complicación persiste tras un manejo hemodinámico adecuado (retirada de los inotrópicos, administración de vasopresores y cargas de volumen para lograr la normovolemia), sería necesaria la corrección quirúrgica o incluso la sustitución valvular mitral62. La valoración de la severidad de la IM residual se realiza de forma cualitativa con doppler color y características del chorro de regurgitación y medición de vena contracta.
La oclusión o distorsión de la arteria circunfleja puede ocurrir durante la reparación o sustitución de la válvula mitral y puede aparecer hasta en el 2% de las reparaciones mitrales63. El compromiso coronario puede deberse a la oclusión directa o a la distorsión del vaso por la sutura del anillo y puede provocar un infarto miocárdico si no se hace un diagnóstico precoz. El estudio ecocardiográfico post-CEC permitirá la visualización de anormalidades segmentarias en la contracción en el territorio irrigado por esta arteria.
Valoración en la cirugía reparadora valvular aórticaEn cuanto a la reparación aórtica, la evaluación inicial post-CEC se centra en la competencia de la válvula y en la existencia de insuficiencia residual. Los elementos a valorar tras la reparación son64,65:
- -
Nivel de la coaptación de las valvas en un plano medioesofágico eje largo, debiendo estar por encima del anillo aórtico.
- -
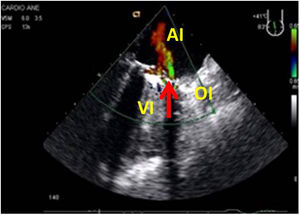
Presencia, grado de severidad y dirección de chorro de regurgitación residual. Una IAo residual superior a moderada puede producir inestabilidad hemodinámica y dificultades para la salida de CEC por la sobrecarga de volumen hacia el VI (fig. 15).
- -
Medición de la longitud de la superficie de coaptación de las valvas. Una longitud de coaptación<4mm es un predictor importante de recurrencia de IAo postoperatoria. Otros autores, han definido el término de altura de coaptación como la distancia desde la línea de inserción de las valvas y el punto más alto de la coaptación estableciendo una altura de 9-10mm como óptima con menor recurrencia de prolapso.
- -
Medición de gradientes transvalvulares: Gradientes pico superiores a 30mmHg o medios mayores de 15mmHg se consideran inadecuados y se asocian a un mayor riesgo de desarrollar una estenosis aórtica significativa. Estos gradientes pueden estar muy influenciados por el flujo, que vendrá marcado por la situación hemodinámica del paciente en la salida de CEC por lo que la valoración debe ser individualizada. Mediciones independientes de la situación hemodinámica pueden ser útiles en estos casos.
- -
Además de la valoración morfológica y funcional de la válvula, la decisión de un nuevo intento de reparación en caso de resultados subóptimos, dependerá del mecanismo de la IAo, de la calidad del tejido valvular y de los factores relacionados con el paciente (la edad, comorbilidad, función ventricular, etc.).
La ETE antes de la salida de CEC en la cirugía de revascularización miocárdica desempeñará un papel en todos los aspectos mencionados en el apartado anterior y además servirá para valorar la contractilidad ventricular en los territorios revascularizados con objeto de descartar problemas técnicos que limiten el flujo coronario que puedan condicionar la reentrada en CEC.
Las causas de alteraciones de la contractilidad segmentaria de novo tras cirugía son idénticas a las reflejadas en tabla 4.
Consideraciones en la cirugía coronaria sin CECLa monitorización intraoperatoria mediante la ETE en la cirugía coronaria sin CEC aporta información antes, durante y después de la realización de los injertos coronarios66. Tiene especial interés la valoración de la función sistólica del VI y las alteraciones segmentarias de la contractilidad, así como valorar la función del ventrículo derecho y de las válvulas. La inestabilidad hemodinámica durante este tipo de cirugía puede deberse a: isquemia miocárdica durante la manipulación, reducción de la precarga, compresión cardiaca, disfunción ventricular de base, IM aguda por la movilización de las cavidades y distorsión del anillo mitral o a una combinación de estas causas67. La valoración mediante los planos medioesofágicos permitirá valorar todos los segmentos del ventrículo izquierdo y la aparición de IM mediante la aplicación del doppler color sobre la VM. Es frecuente la obtención de imágenes subóptimas especialmente en los planos transgástricos durante ciertas fases de la cirugía por la disposición vertical del corazón y la colocación de compresas debajo del corazón.
Exploración del pulmón por ecocardiografía transesofágica en el intraoperatorio. Transesophageal Echocardiography Lung Ultrasound (TELU)La exploración pulmonar mediante ecografía transesofágica si bien no se encuentra por el momento validada a diferencia de la exploración transtorácica de la que se puede extrapolar los hallazgos, puede constituir una herramienta de utilidad en el intraoperatorio del paciente cardiovascular. Su papel tiene especial relevancia para identificar causas de hipoxemia, muy frecuentes tras la salida de CEC68. En cirugía cardiaca la exploración más descrita corresponde a la visualización de los espacios pleurales, permitiendo una valoración cualitativa (exudados, sangre, derrames organizados) y cuantitativa de los derrames (midiendo el área seccional y multiplicándolo por la longitud axial)68. Puede ser, por otra parte, de gran utilidad en el diagnóstico de consolidaciones, ya que en el perioperatorio es habitual encontrar atelectasias, y mediante ecografía se puede optimizar la ventilación y valorar la eficacia de las maniobras de reclutamiento y diagnosticar causas de hipoxemia69,70. La aparición de líneas B de forma aguda se asocia a edema pulmonar, distribuyéndose de forma homogénea, bilateral y en zonas dependientes. Junto a la valoración cardiológica permite un manejo precoz y una monitorización continua de la respuesta al tratamiento. Sin embargo, en el neumotórax, en el que la ETT desempeña un papel importante en el diagnóstico, la TELU carece de valor diagnóstico, debido a que el aire tiende a acumularse en zonas no dependientes (campos anteriores), que no se exploran de forma adecuada, aunque puede ser útil para la valoración de signos indirectos de incremento de presión intratorácica, como el colapso de cavidades derechas.
Consideraciones en nuevos procedimientos endovasculares (TAVI, tratamiento endovascular mitral)En la actualidad, el aumento tanto en número como en frecuencia de los procedimientos mínimamente invasivos y endovasculares pone de manifiesto un nuevo e importante campo donde la ecocardiografía es un arma fundamental tanto en la sala de hemodinámica, quirófano híbrido y/ o quirófano convencional. Así se pone de manifiesto en la encuesta realizada por la SECCE en el año 2019, que un 83% de los centros realiza ecocardiografía de manera rutinaria en casi todos sus procedimientos, y este porcentaje aumenta cuando se trata de procedimientos endovasculares.
Hoy en día en la mayoría de los centros el control ecocardiográfico de estos procedimientos está en manos de ecocardiografistas expertos y no está muy extendido el aprendizaje necesario entre los anestesiólogos. La extensión de estos procedimientos a quirófanos híbridos podría hacer necesario nuestra formación específica en estos procedimientos.
Las técnicas más habituales se resumen en: TAVI, reparación mitral percutánea, cierre de orejuela, cierre de comunicaciones interauriculares, cierre de «leaks» periprotésicos, implante de asistencias ventriculares y de oxigenación por membrana extracorpórea (ECMO).
ETE durante el procedimiento TAVI y control postimplanteEn procedimientos TAVI es fundamental el uso de ETE prequirúrgico tanto para visualizar el grado de estenosis aórtica como el grado de asimetría de los velos y su calcificación. Es importante el grado de calcificación y su distribución geométrica ya que así se puede predecir las posibles complicaciones como «leaks» periprotésicos, obstrucción de arterias coronarias o incluso rotura de anillo, así como elegir el tamaño de la prótesis71,72. La ETE 2D subestima los tamaños valvulares y las distancias, sobre todo en anillos no simétricos73,74. La medida se toma en el eje largo de la aorta a nivel medioesofágico a 120°. El problema en ánulos no simétricos es que este diámetro no es representativo del área y para ello es útil el eco 3D que se correlaciona más con las medidas obtenidas por TAC16.
Hoy en día y en la mayoría de los centros las maniobras como pasar las guías a través de la VAo, la valvuloplastia con balón, el posicionamiento de la prótesis y el despliegue de la misma no se realizan con control de ETE sino con fluoroscopia. Esto permite llevar a cabo el procedimiento sin anestesia general. En cambio, a la hora de valorar la funcionalidad de la prótesis implantada, sigue siendo indispensable el uso de la ETT una vez finalizado el procedimiento. Mediante ETT podemos medir los gradientes transprotésicos y definir correctamente la localización de la regurgitación periprotésica ya que la fluoroscopia no lo permite. Por ETE se define como una regurgitación periprotésica severa aquella generada por un orificio regurgitante de>20% de la circunferencia valvular (>72°) en eje corto75. Con ETE 3D además se puede localizar con más exactitud el punto regurgitante. En función de la causa de esta regurgitación se realizará una nueva valvuloplastia con balón si el problema es debido a falta de expansión de la prótesis o incluso el implante de una nueva prótesis si el problema es un tamaño inadecuado de la prótesis elegida.
Otras complicaciones postimplante que pueden visualizarse por ETE son: disección de aorta, taponamiento cardiaco por perforación tanto de VI como VD o aurículas por las guías, disfunción ventricular u oclusión de la salida de las arterias coronarias.
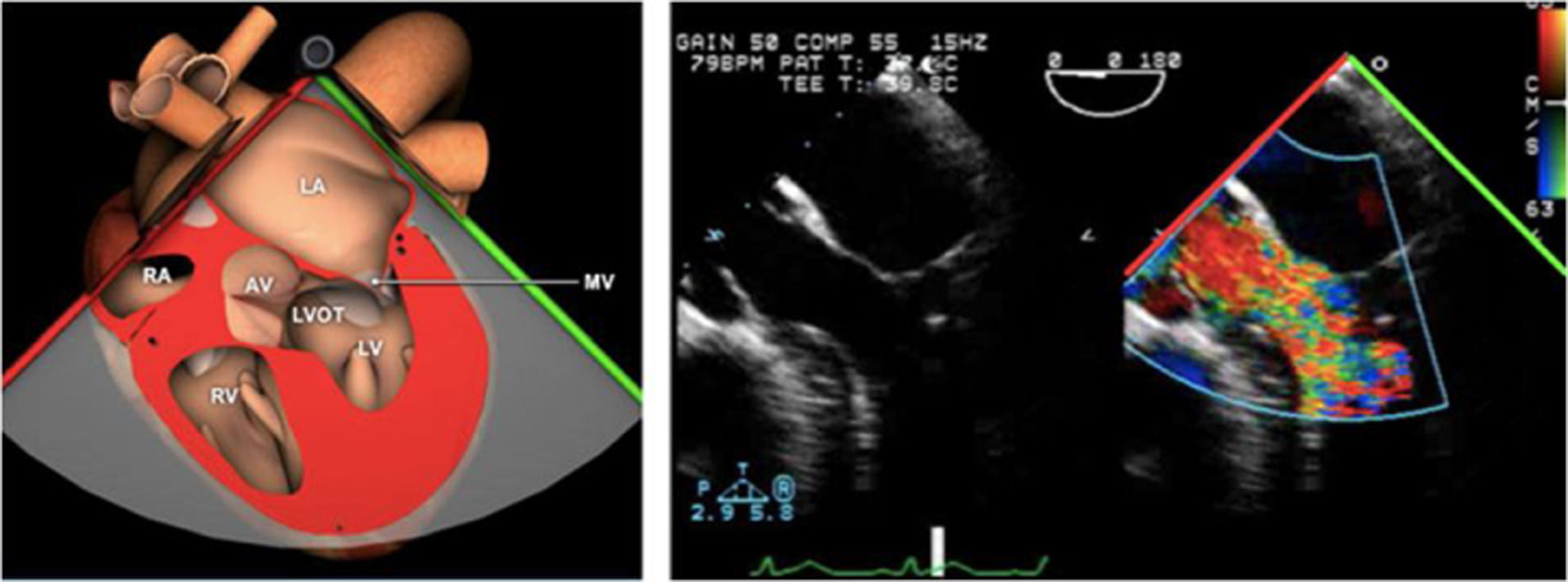
ETE durante el procedimiento endovascular mitralAquellos pacientes subsidiarios de reparación mitral percutánea debido a su inoperabilidad y/o alto riesgo quirúrgico, con insuficiencia mitral severa funcional o debido a prolapso, tienen la opción de tratamiento intervencionista utilizando un clip mitral semejando la técnica de Alfieri. Estudios como el EVEREST y EVEREST II muestran la eficacia de esta técnica para casos muy seleccionados en los que se reduce la regurgitación en la mayoría de los pacientes de una manera segura76,77 (tabla 9).
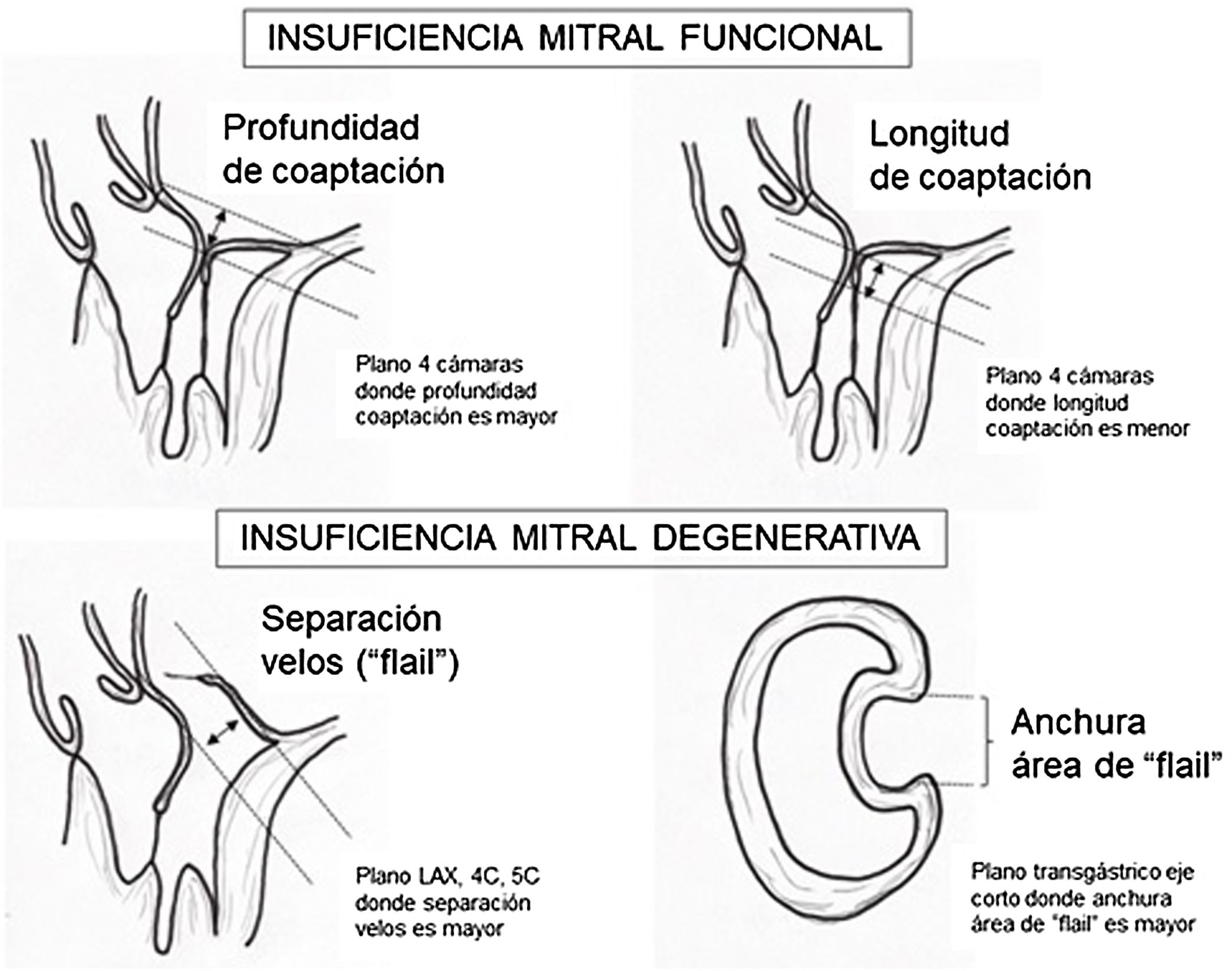
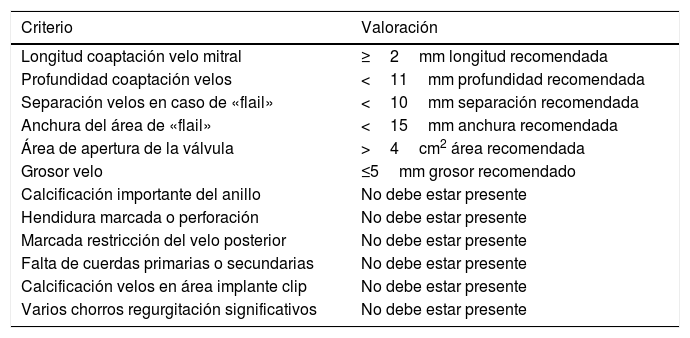
Criterios ecocardiográficos recomendados para reparación valvular mitral percutánea con mitraclip75
| Criterio | Valoración |
|---|---|
| Longitud coaptación velo mitral | ≥2mm longitud recomendada |
| Profundidad coaptación velos | <11mm profundidad recomendada |
| Separación velos en caso de «flail» | <10mm separación recomendada |
| Anchura del área de «flail» | <15mm anchura recomendada |
| Área de apertura de la válvula | >4cm2 área recomendada |
| Grosor velo | ≤5mm grosor recomendado |
| Calcificación importante del anillo | No debe estar presente |
| Hendidura marcada o perforación | No debe estar presente |
| Marcada restricción del velo posterior | No debe estar presente |
| Falta de cuerdas primarias o secundarias | No debe estar presente |
| Calcificación velos en área implante clip | No debe estar presente |
| Varios chorros regurgitación significativos | No debe estar presente |
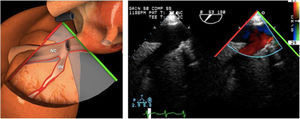
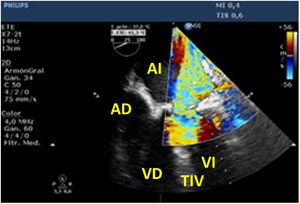
Para esta intervención la ETE resulta indispensable, tanto para sentar la indicación y viabilidad de la técnica como para guiar el procedimiento y comprobación del resultado. Para intentar asegurar el éxito de implante del clip tiene que cumplir una serie de criterios recogidos en ensayos clínicos de estudios como Everest II (fig. 1)77. Estos criterios son puramente ecocardiográficos, ya que es la manera de caracterizar la morfología valvular y así procurar aplicar la técnica en aquellos pacientes en los que puede resultar exitosa77 (tabla 9).
Durante el implante, los pasos fundamentales a monitorizar con ETE son:
- -
Punción transeptal: plano bicava (115°-130°) y en eje corto (30-60°)
- -
Correcto posicionamiento del clip: intercomisural (55°-75°) para el alineamiento mediolateral y visión de tracto de salida de VI (120°-150°) para alineamiento anteroposterior78,79.
Para asegurar la perpendicularidad del clip con la línea de coaptación lo ideal es disponer de una ecocardiografía 3D, pero si no es posible, con el ETE 2D se debe realizar un eje corto transgástrico así como volver a mostrar este plano una vez avanzado el sistema hasta ventrículo. Es importante grabar una secuencia de vídeo larga del alineamiento para poder consultarlo cuantas veces se quiera a modo de «road map» y corregir posibles errores. Si no se realiza correctamente el posicionamiento, puede fallar el implante del dispositivo por escape de uno de los velos del clip.
Una vez implantado el sistema hay que valorar tanto con doppler color 2D y/o 3D29 el grado de IM por los 2 orificios remanentes, lateral y medial, así como el grado de estenosis residual debida a esta unión anteroposterior con el clip, ya que no es infrecuente la necesidad de implantar más de un clip para ir reduciendo el grado de insuficiencia pero siempre controlando el grado de estenosis residual80.
Complicaciones a tener en cuenta con este procedimiento pueden ser el fallo de captura de velo por mal posicionamiento, rotura de velo mitral, rotura de cuerdas, rotura de pared libre de aurícula o CIA.
Manejo de la información: informe verbal y escritoCreemos necesario que el profesional que realiza la ETE intraoperatoria elabore de forma sistemática un informe estandarizado registrando los principales hallazgos y conclusiones, lo que permitirá transmitir la información al resto del equipo médico, facilitar el seguimiento del paciente y comparar los estudios realizados por diferentes profesionales en diferentes centros.
Por otra parte, se debe informar verbalmente de la existencia de discrepancias entre el informe preoperatorio y los hallazgos intraoperatorios previo a la cirugía. Las sociedades recomiendan dejar constancia por escrito mediante modelos estandarizados de los hallazgos pre- y post-CEC.
En el caso de tratarse de un procedimiento urgente sin estudio preoperatorio, se informará verbalmente y por escrito de forma más detallada.
Las funciones de un informe ecográfico realizado en quirófano son las siguientes81:
- -
Ayudar en las decisiones quirúrgicas confirmando el diagnóstico y apoyando la necesidad de cambios en el plan quirúrgico si procede; modificar el manejo hemodinámico y la necesidad de medidas más invasivas.
- -
Dejar constancia de los hallazgos intraoperatorios para evaluaciones postoperatorias.
- -
La información debe ser entendible para profesionales no especialistas en ecocardiografía implicados en el manejo posterior del paciente.
- -
Nuestro informe constituye un documento con carácter médico legal por lo que el registro de las incidencias y hallazgos debe realizarse.
- -
Constituye un documento que avala la formación y acreditación de especialistas en ETE.
- -
Representa un documento útil para realizar investigaciones clínicas prospectivas y retrospectivas
Las recomendaciones para redactar un informe son las siguientes82: En primer lugar, realizar la identificación del paciente (datos que identifican al paciente, sus características, el diagnóstico e indicación de estudio). En segundo lugar, se incluirá el estudio morfológico y determinación de la función global de ambos ventrículos con las descripciones más relevantes de las cámaras cardiacas, la aorta torácica y morfología y función valvular pre- y post-CEC. Es esencial describir si durante el procedimiento quirúrgico ha habido cambios relevantes, agudos o mantenidos, de la función ventricular derecha o izquierda. En la cirugía valvular se deberá resumir la función valvular nativa y protésica. En la cirugía de reparación valvular (incluida la anuloplastia) se informará de los resultados especificando el grado de insuficiencia residual. El análisis ETE intraoperatorio después de la reparación valvular mitral es esencial para considerarla óptima o decidir la sustitución valvular. Se informará del grado de insuficiencia residual y la superficie de coaptación y se descartará la presencia de complicaciones, como estenosis mitral, presencia de SAM con obstrucción del TSVI y disfunción ventricular. De la válvula protésica se informará si es o no normofuncionante, si mantiene gradientes normales y si existe o no alguna fuga periprotésica. Si ésta existe se informará del grado de severidad y localización lo más exactamente posible.
En último lugar se relatarán las conclusiones:
- 1.
Resumir los hallazgos ecocardiográficos preintervención, en orden de relevancia.
- 2.
Descripción del procedimiento quirúrgico realizado.
- 3.
Estudio postintervención.
Proponemos como modelo el protocolo de recogida propuesto por la EACTA (ver documento adjunto en el material adicional).
ConclusionesLa aparición y difusión de la ETE nos ha permitido realizar una monitorización anatómica y funcional del corazón en tiempo real, lo cual la ha convertido en una herramienta de monitorización esencial e insustituible en las intervenciones de cirugía cardiovascular. La interpretación y comunicación de hallazgos patológicos mediante la ETE es parte integral de la anestesia cardiaca. Consideramos que la realización de la ETE en el ámbito perioperatorio de la patología quirúrgica cardiaca corresponde al anestesiólogo responsable que precisa formación y/o acreditación específica en anestesia cardiovascular y ETE para el contexto perioperatorio. No obstante, en función de su nivel de competencia, formación y experiencia pudiera ser necesaria la colaboración de cardiología.
Describimos el protocolo de estudio estandarizado y aceptado por todas las sociedades científicas que permite la exploración anatómica y funcional en las distintas fases de la cirugía, aportando información útil cualitativa y cuantitativa en cada procedimiento y sus fases para la toma de decisiones y modificación de las actitudes terapéuticas intraoperatorias si fuera necesario. En las intervenciones menos invasivas el papel del ETE resulta incluso más importante ya que guía el procedimiento en determinados momentos y se requiere para ello un mayor conocimiento y experiencia en la técnica ecocardiográfica. Es requisito indispensable comunicar los hallazgos obtenidos mediante la elaboración de un informe primero verbal y posteriormente escrito del estudio realizado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este Documento se publica simultáneamente en la revista: Rev Esp Anestesiol Reanim. 2020. doi:10.1016/j.redar.2020.06.001.