Definir factores pronóstico de supervivencia a largo plazo tras la duodenopancreatectomía cefálica por adenocarcinoma pancreático.
IntroducciónLa cirugía es el tratamiento aceptado en el adenocarcinoma de páncreas cefálico, sin embargo la supervivencia a largo plazo sigue siendo baja.
Material y métodosHemos recogido la experiencia en el tratamiento del adenocarcinoma de cabeza de páncreas (ADCP) en el Hospital Universitari de Bellvitge mediante duodenopancreatectomía cefálica (DPC) desde 1991 hasta 2007.
ResultadosSe realizaron 204 DPC por ADCP. El estudio histológico evidenció que el tumor resecado tenía un tamaño superior a 3cm. en 70, con permeación linfática en un 73%, invasión perineural en 89% y afectación linfática en 71%. En 120 pacientes se resecaron más de 15 adenopatías. Tras la cirugía, se administró tratamiento adyuvante a 113 pacientes (60%). Se contabilizaron 148 fallecimientos (73%), estando vivos al cierre del mismo 55 (27%). La supervivencia actual media fue de 2,54 años (IC95% 2,02–3,07) y la supervivencia actuarial a 5 años de 13,55% (IC95% 7,69–19,41).
El estudio de factores de riesgo de mortalidad reveló que el sexo femenino (p=0,005), la ausencia de transfusión perioperatoria (p=0,003), la resección de más de 15 adenopatías en la intervención (p=0,004) y la administración de tratamiento adyuvante (p=0,004) comportaron mejor pronóstico a largo plazo. El estudio multivariante demostró que transfusión y sexo fueron las variables de interés.
ConclusionesLa cirugía del adenocarcinoma de cabeza de páncreas debe incluir una linfadenectomía suficiente y debe realizarse con baja morbilidad y sin necesidad de transfusión perioperatoria.
Surgery is the accepted treatment in adenocarcinoma of the head of the pancreas; however, the long-term survival continues to be low. The aim of this study is to define prognostic factors of long-term survival after cephalic duodenopancreatectomy due to pancreatic adenocarcinoma.
Material and methodsWe have collected data on the treatment of adenocarcinoma of the head of the pancreas (ADHP) by means of a cephalic duodenopancreatectomy (CDP) performed n the Bellvitge University Hospital (Barcelona) from 1991 to 2007.
ResultsA total of 204 CDP due to ADHP were performed. The histology showed that the resected tumour was larger than 3cms in 70 cases, with lymphatic infiltration in 73%, perineural invasion in 89%, and lymphatic involvement in 89%. More than 15 lymph nodes were resected in 120 patients. A total of 113 (60%) patients received adjuvant treatment after surgery. There were 148 (73%) deaths, of which 55 (27%) were alive at closure. The actual mean survival was 2.54 years (95% CI; 2.02–3.07) and an actuarial survival at 5 years of 13.55% (95% CI; 7.69–19.41).
The study of mortality risk factors showed that, female gender, absence of peri-operative transfusion (p=0.003), the resection of more than 15 lymph nodes during the operation (P=0.004), and the administration of adjuvant treatment (p=0.004) had a better long-term prognosis. The multivariate analysis showed that transfusion and gender were the most significant variables.
ConclusionsSurgery of head of the pancreas adenocarcinoma must include an adequate lymphadectomy, and must be performed with a low morbidity and without the need of a peri-operative transfusion.
El cáncer de páncreas sigue siendo un problema importante de salud, siendo la cuarta causa de muerte relacionada con el cáncer, y afectando a 8–10 casos por 100.000 habitantes/año1,2. Es especialmente alarmante comprobar que la incidencia es muy similar a la mortalidad anual, es decir, el número de enfermos nuevos por año es similar a los fallecimientos. Como vemos, la supervivencia del cáncer de páncreas es baja, según algunos grupos entre el 0,4 al 4% a los 5 años3,4. Actualmente, está aceptado que la resección quirúrgica aumenta la supervivencia en pacientes con enfermedad localizada, sin embargo tan solo entre un 10 y un 20% de los pacientes podrán ser intervenidos en el momento del diagnóstico5. Por otra parte, aunque el tratamiento adyuvante parece aumentar la supervivencia del paciente6–8, el esquema terapéutico no es uniforme y su beneficio es controvertido9–13. El objetivo de este estudio es revisar los resultados obtenidos en nuestro centro en el tratamiento quirúrgico del cáncer de cabeza de páncreas y definir las variables que influyen supervivencia a largo plazo.
Material y métodosHemos recogido la experiencia en el tratamiento del adenocarcinoma de cabeza de páncreas (ADCP) en el Hospital Universitari de Bellvitge mediante duodenopancreatectomía cefálica (DPC) desde 1991 hasta 2007. Hemos registrado de forma prospectiva los datos demográficos, anatomopatológicos y de seguimiento de todos ellos.
Estudio preoperatorioDada la extensión temporal de la serie, la técnica del TC se ha modificado. Desde 1991 a 1994 se utilizo TC no helicoidal. Desde 1994 a 2004 se utilizo TC helicoidal de una corona. A partir de 2003 se utilizó el TC multidetector de 4, 16 y posteriormente 64 coronas. El drenaje biliar preoperatorio no se lleva a cabo de forma sistemática6 y únicamente se indica a aquellos pacientes con dudas sobre el manejo final o bien con una demora prevista de la cirugía superior a quince días. Ni la edad avanzada del paciente ni el tamaño tumoral han sido un motivo de contraindicación para la cirugía.
Los criterios de irresecabilidad han sido la presencia de metástasis, invasión arterial (arteria mesentérica superior, arteria hepática o tronco celíaco), obliteración venosa o invasión de otros órganos por contigüidad (excepto duodeno)7. La definición de invasión arterial ha sido la presencia de contacto directo entre el tumor y el vaso arterial, aunque no sea superior al 50%. En cuanto a la afectación venosa, se considera invasión a un contacto superior al 50% entre el tumor y el vaso, y se considera irresecable la obliteración de algún segmento del eje venoso portomesentérico14–17. El resto de afectaciones parietales venosas se han considerado para resección. La presencia de adenopatías a distancia contraindicó la resección quirúrgica18,19. La presencia de adenopatías preaortocavales patológicas en el estudio preoperatorio implicó un análisis en fresco al inicio de la intervención, y en caso de afectación de las mismas se contraindicó la resección20–23.
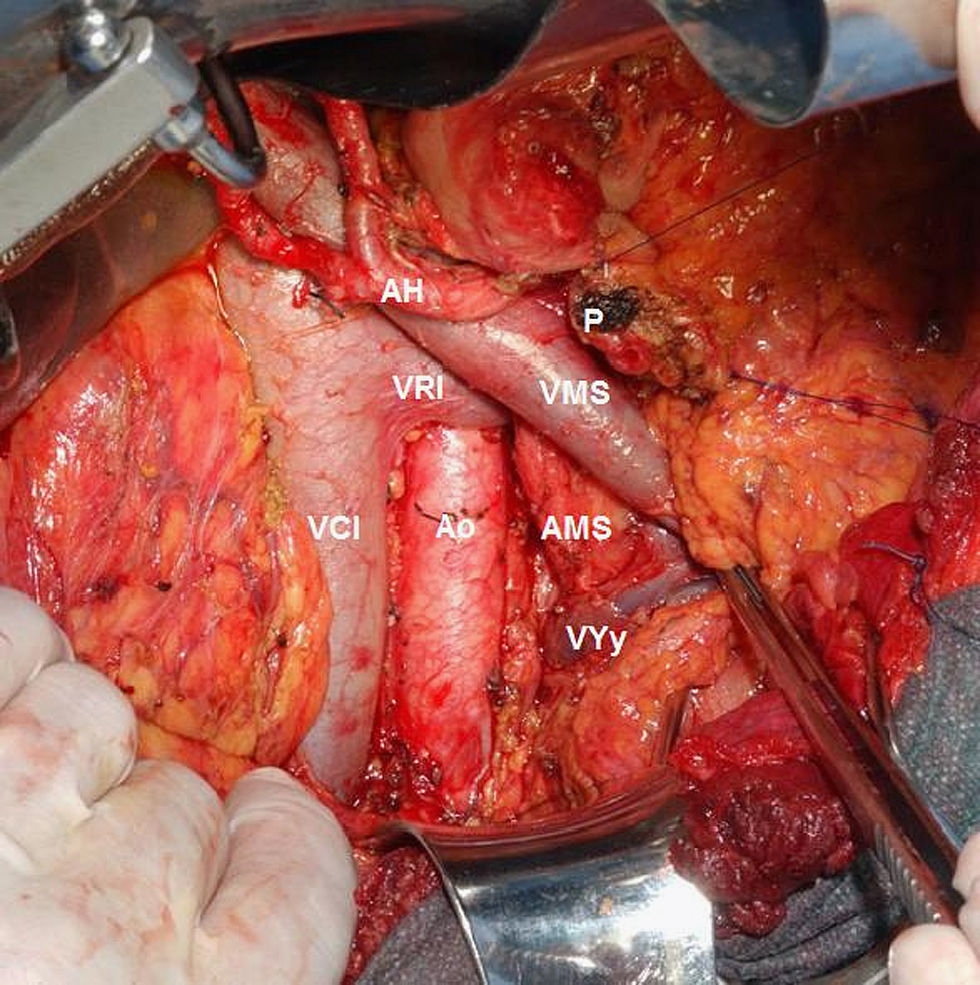
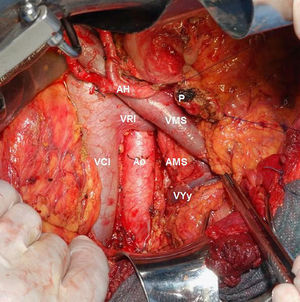
Técnica quirúrgica y estudio anatomopatológicoEn todos los pacientes se realizó una linfadenectomía estándar (tejido linfático peripancreático y periduodenal) ampliada al hilio hepático, margen derecho de arteria mesentérica superior y región preaortocava (fig. 1)24,25. Para simplificar el estudio de los territorios de afectación ganglionar, definimos territorio local (loc) al peripancreático y territorio regional (reg) al interaortocaval18,26–30.
El estudio anatomopatológico fue realizado por una misma patóloga con un especial interés en la patología, en todos los casos. La inclusión de dicha pieza siguió un estricto protocolo de los márgenes de resección, con análisis del márgen retroperitoneal31,32 y del margen de sección del cuello pancreático, así como el análisis de los territorios ganglionares33. Durante la intervención se remitió una sección de cuello pancreático para estudio en fresco. La afectación del mismo obligó a la ampliación de la pancreatectomía, con análisis de nuevo y tercera resección o duodenopancreatectomía total si seguía persistiendo enfermedad34.
Tratamiento adyuvanteEn cuanto al tratamiento adyuvante, se indicó en los pacientes con factores anatomopatológicos de mal pronóstico, es decir la presencia de tumores con adenopatías afectas, invasión perineural, invasión vascular, o invasión venosa. Se ha administrado una pauta basada en 5-FU en infusión contínua de 5 días en la 1.a y 4.a semanas de la radioterapia. Se administró radioterapia hasta alcanzar dosis de entre 50,4 y 59,4 Gray (Gy) dependiendo de la afectación, o no de los márgenes quirúrgicos10.
Estudio estadísticoAnálisis descriptivo según medidas de tendencia central (media, mediana) y de dispersión (desviación estándar y rango intercuartílico) según criterios de normalidad (test de Kolmogorov-Smirnov). Posteriormente se realizó un estudio comparativo entre variables cualitativas según Chi-cuadrado o Fisher y variables cuantitativas según test de t de Student o U de Mann Whitney. Se realizó un análisis de Kaplan Meier para determinar la supervivencia global y sus factores predictores, y aquellas variables que mostraron una asociación estadísticamente significativa en el test de log-rank (p<0,05) sin interacción fueron consideradas en un modelo de regresión de Cox. La bondad de ajuste de los modelos multivariantes comentados previamente fue estudiada según Hosmer-Lemershow y Area Under Curve (AUC). Se utilizó el paquete estadístico SPSS 12.0®, y el valor estadísticamente significativo considerado fue de p-valor<0,05 en todos los casos.
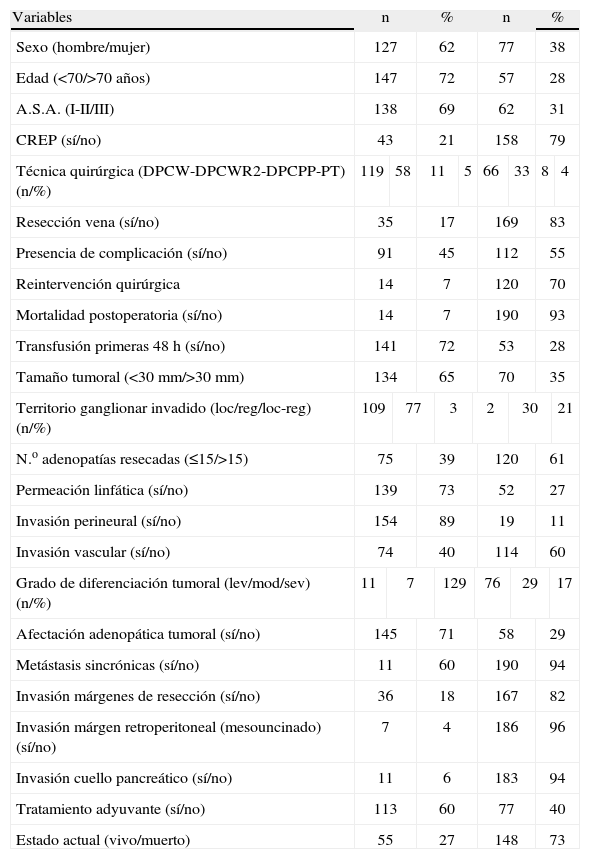
ResultadosDetalles demográficosSe realizaron 204 DPC por ADCP en nuestro centro durante el período 1991 a 2007. En cuanto a los datos demográficos, la edad de los pacientes fue superior a los 70 años en 57 casos (28%), y en su mayoría fueron hombres (62%) (tabla 1).
Características de los pacientes intervenidos por adenocarcinoma pancreático mediante duodenopancreatectomía cefálica. Hospital Universitari de Bellvitge, 1991–2007
| Variables | n | % | n | % | ||||||||||||
| Sexo (hombre/mujer) | 127 | 62 | 77 | 38 | ||||||||||||
| Edad (<70/>70 años) | 147 | 72 | 57 | 28 | ||||||||||||
| A.S.A. (I-II/III) | 138 | 69 | 62 | 31 | ||||||||||||
| CREP (sí/no) | 43 | 21 | 158 | 79 | ||||||||||||
| Técnica quirúrgica (DPCW-DPCWR2-DPCPP-PT) (n/%) | 119 | 58 | 11 | 5 | 66 | 33 | 8 | 4 | ||||||||
| Resección vena (sí/no) | 35 | 17 | 169 | 83 | ||||||||||||
| Presencia de complicación (sí/no) | 91 | 45 | 112 | 55 | ||||||||||||
| Reintervención quirúrgica | 14 | 7 | 120 | 70 | ||||||||||||
| Mortalidad postoperatoria (sí/no) | 14 | 7 | 190 | 93 | ||||||||||||
| Transfusión primeras 48h (sí/no) | 141 | 72 | 53 | 28 | ||||||||||||
| Tamaño tumoral (<30mm/>30mm) | 134 | 65 | 70 | 35 | ||||||||||||
| Territorio ganglionar invadido (loc/reg/loc-reg) (n/%) | 109 | 77 | 3 | 2 | 30 | 21 | ||||||||||
| N.o adenopatías resecadas (≤15/>15) | 75 | 39 | 120 | 61 | ||||||||||||
| Permeación linfática (sí/no) | 139 | 73 | 52 | 27 | ||||||||||||
| Invasión perineural (sí/no) | 154 | 89 | 19 | 11 | ||||||||||||
| Invasión vascular (sí/no) | 74 | 40 | 114 | 60 | ||||||||||||
| Grado de diferenciación tumoral (lev/mod/sev) (n/%) | 11 | 7 | 129 | 76 | 29 | 17 | ||||||||||
| Afectación adenopática tumoral (sí/no) | 145 | 71 | 58 | 29 | ||||||||||||
| Metástasis sincrónicas (sí/no) | 11 | 60 | 190 | 94 | ||||||||||||
| Invasión márgenes de resección (sí/no) | 36 | 18 | 167 | 82 | ||||||||||||
| Invasión márgen retroperitoneal (mesouncinado) (sí/no) | 7 | 4 | 186 | 96 | ||||||||||||
| Invasión cuello pancreático (sí/no) | 11 | 6 | 183 | 94 | ||||||||||||
| Tratamiento adyuvante (sí/no) | 113 | 60 | 77 | 40 | ||||||||||||
| Estado actual (vivo/muerto) | 55 | 27 | 148 | 73 | ||||||||||||
DPCPP: duodenopancreatectomía cefálica con preservación pilórica; DPCW: duodenopancreatectomía cefálica con gastrectomía; DPCWR2: duodenopancreatectomía cefálica con gastrectomía y linfadenectomía extendida a tronco celíaco y arteria mesentérica superior; lev: leve; loc: local; loc-reg: local y regional; mod: moderada; PT: pancreatectomía total; reg: regional; sev: severa.
La técnica quirúrgica empleada con más frecuencia fue la resección de la cabeza del páncreas con gastrectomía en un 58% de los casos (DPDW) a pesar que la preservación del píloro se llevó a cabo en 66 DPCPP, (33%). Se realizó resección de vena porta o VMS en 35 pacientes (17%) y la afectación del margen obligó a completar la pancreatectomía total (PT) en 8 casos (4%). Se asoció una linfadenectomía extendida (DPCWR2, resección de adenopatías en territorios tronco celíaco y lado izquierdo de Arteria Mesentérica Superior) a 11 pacientes (5%), técnica que fue abandonada debido a la elevada morbilidad (tabla 1).
El estudio histológico evidenció que el tumor resecado tenía un tamaño superior a 3cm en 70 (35%) con un tamaño mediano de 29mm (10–75). Definimos dos grupos de pacientes según el número de adenopatías resecado, con identificación de 15 ganglios o menos (76/38%) y con más de 15 ganglios (120/62%). En cuanto al número medio de ganglios resecado por paciente según el grupo, fue de 10,1 vs, 25 (p<0,001). Y la media de adenopatías afectas por paciente fue de 1,7 vs 3,2 (p=0,001), con una ratio ganglios afectos/resecados de 0,17 vs 0,13 (p=0,05). Por tanto, la ratio ganglios afectos/resecados fue superior entre aquellos pacientes con resección de pocos ganglios. La afectación ganglionar (pN1) fue similar entre los pacientes con resección ganglionar de más o menos de 15 adenopatías. Un total de 51/76 (67%) pacientes presentaban afectación ganglionar en el grupo con resección de menos de 15 adenopatías, y 90/120 (75%) del grupo con resección de más de 15 adenopatías (n.s.). Tampoco hubo diferencias entre el grupo ganglionar resecado (local o regional).
Los tumores presentaban signos patológicos de mal pronóstico en la mayoría de casos, como son la permeación linfática (73%), invasión perineural (89%), y afectación linfática (71%). Asimismo, se evidenciaron signos dudosos de afectación a distancia en 11 pacientes (6%), con un resultado peroperatorio negativo. Por último, la afectación de alguno de los márgenes de resección se detectó en 36 (18%) (tabla 1).
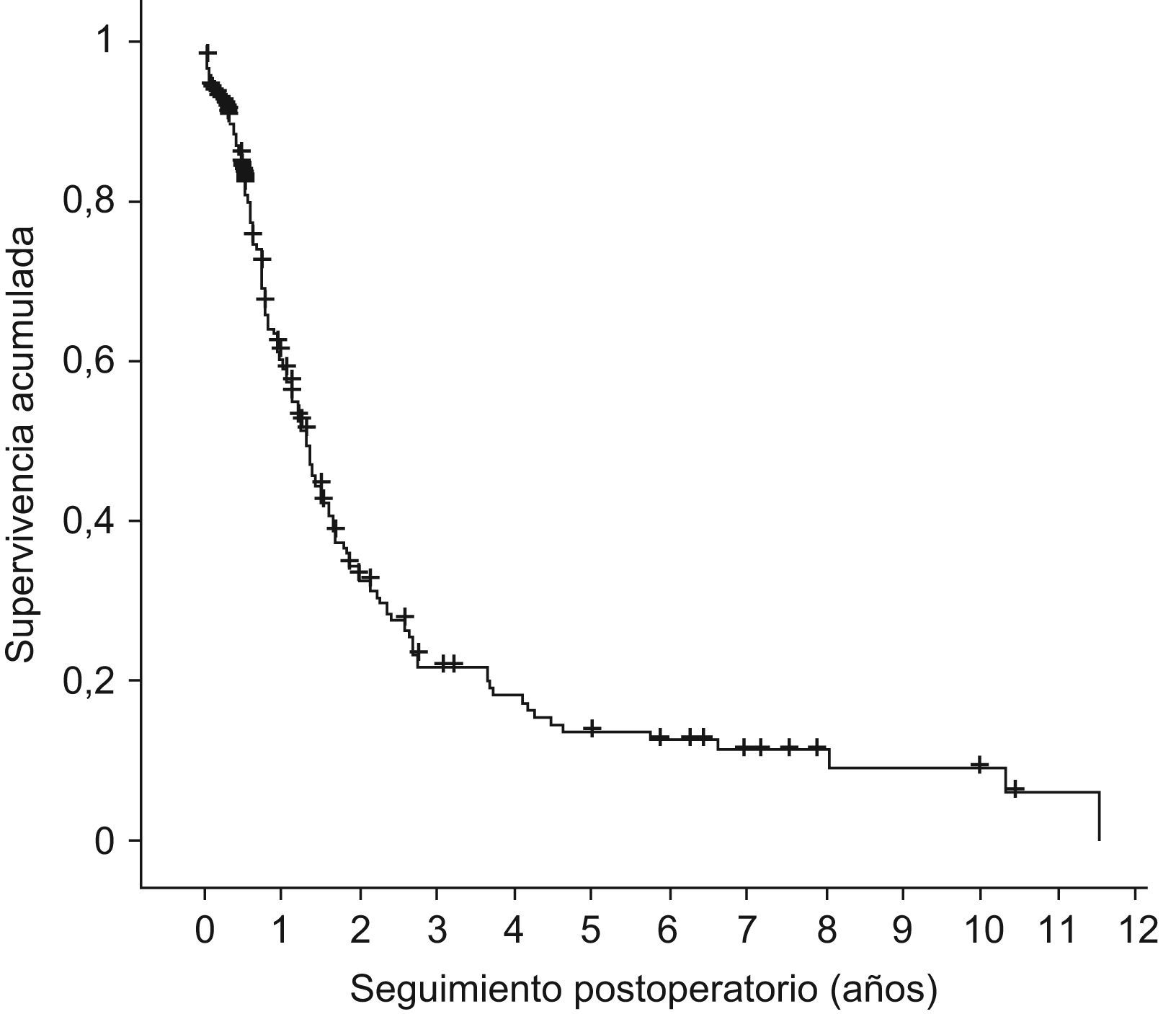
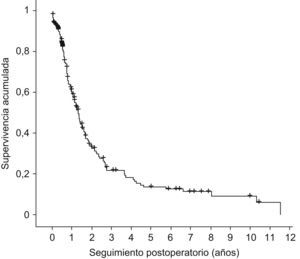
Seguimiento a largo plazoTras la cirugía se remitieron los pacientes a los servicios de oncología médica y oncología radioterápica, administrando tratamiento adyuvante a 113 pacientes (60%). Durante el seguimiento se contabilizaron 148 fallecimientos (73%), estando vivos al cierre del mismo 55 enfermos (27%). La supervivencia actual media fue de 2,54 años (IC95% 2,02–3,07) y una mediana de 1,33 años (IC95% 1,15–1,51); la supervivencia actuarial al año fue del 60%, de los 3 años del 21%, y a los 5 años de 13,55% (IC95% 7,69–19,41) (fig. 2).
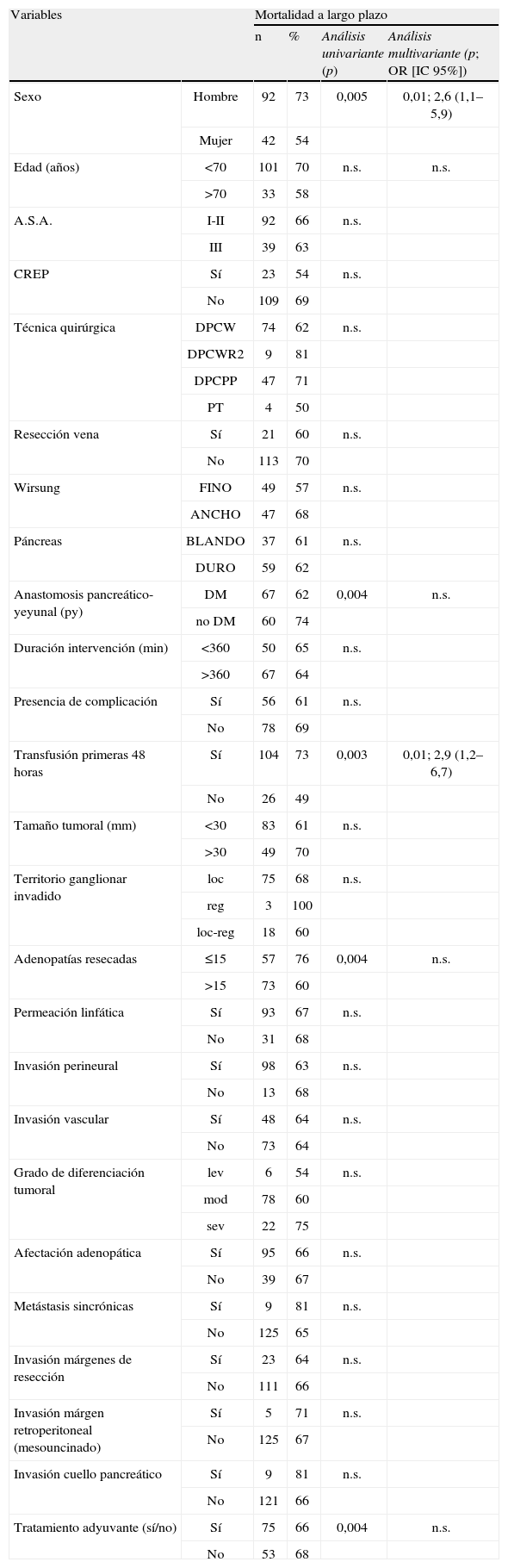
El estudio de factores de riesgo de mortalidad reveló que el sexo femenino (p=0,005), la ausencia de transfusión perioperatoria (p=0,003), la resección de más de 15 adenopatías en la intervención (p=0,004), y la administración de tratamiento adyuvante (p=0,004) comportaron un mejor pronóstico del paciente a largo plazo. El estudio multivariante demostró que únicamente la transfusión y el sexo fueron variables de interés. Ninguno de los datos anatomopatológicos estudiados fueron determinantes en la evolución del enfermo (tabla 2). Por último, analizamos la distribución de pacientes según el margen de resección y el tratamiento adyuvante, y fue similar. Así, un 60% de pacientes con margen afecto y un 59% con margen libre recibió tratamiento concomitante (n.s.). En cuanto al seguimiento a largo plazo, tampoco hubo diferencias en la supervivencia según el estudio del margen de resección.
Análisis de factores de riesgo de mortalidad a largo plazo tras duodenopancreatectomía cefálica por adenocarcinoma pancreático. Se reflejan el número de pacientes por variable (n) que fallecen durante el seguimiento y el porcentaje respecto al número de pacientes total según la variable (%)
| Variables | Mortalidad a largo plazo | ||||
| n | % | Análisis univariante (p) | Análisis multivariante (p; OR [IC95%]) | ||
| Sexo | Hombre | 92 | 73 | 0,005 | 0,01; 2,6 (1,1–5,9) |
| Mujer | 42 | 54 | |||
| Edad (años) | <70 | 101 | 70 | n.s. | n.s. |
| >70 | 33 | 58 | |||
| A.S.A. | I-II | 92 | 66 | n.s. | |
| III | 39 | 63 | |||
| CREP | Sí | 23 | 54 | n.s. | |
| No | 109 | 69 | |||
| Técnica quirúrgica | DPCW | 74 | 62 | n.s. | |
| DPCWR2 | 9 | 81 | |||
| DPCPP | 47 | 71 | |||
| PT | 4 | 50 | |||
| Resección vena | Sí | 21 | 60 | n.s. | |
| No | 113 | 70 | |||
| Wirsung | FINO | 49 | 57 | n.s. | |
| ANCHO | 47 | 68 | |||
| Páncreas | BLANDO | 37 | 61 | n.s. | |
| DURO | 59 | 62 | |||
| Anastomosis pancreático-yeyunal (py) | DM | 67 | 62 | 0,004 | n.s. |
| no DM | 60 | 74 | |||
| Duración intervención (min) | <360 | 50 | 65 | n.s. | |
| >360 | 67 | 64 | |||
| Presencia de complicación | Sí | 56 | 61 | n.s. | |
| No | 78 | 69 | |||
| Transfusión primeras 48 horas | Sí | 104 | 73 | 0,003 | 0,01; 2,9 (1,2–6,7) |
| No | 26 | 49 | |||
| Tamaño tumoral (mm) | <30 | 83 | 61 | n.s. | |
| >30 | 49 | 70 | |||
| Territorio ganglionar invadido | loc | 75 | 68 | n.s. | |
| reg | 3 | 100 | |||
| loc-reg | 18 | 60 | |||
| Adenopatías resecadas | ≤15 | 57 | 76 | 0,004 | n.s. |
| >15 | 73 | 60 | |||
| Permeación linfática | Sí | 93 | 67 | n.s. | |
| No | 31 | 68 | |||
| Invasión perineural | Sí | 98 | 63 | n.s. | |
| No | 13 | 68 | |||
| Invasión vascular | Sí | 48 | 64 | n.s. | |
| No | 73 | 64 | |||
| Grado de diferenciación tumoral | lev | 6 | 54 | n.s. | |
| mod | 78 | 60 | |||
| sev | 22 | 75 | |||
| Afectación adenopática | Sí | 95 | 66 | n.s. | |
| No | 39 | 67 | |||
| Metástasis sincrónicas | Sí | 9 | 81 | n.s. | |
| No | 125 | 65 | |||
| Invasión márgenes de resección | Sí | 23 | 64 | n.s. | |
| No | 111 | 66 | |||
| Invasión márgen retroperitoneal (mesouncinado) | Sí | 5 | 71 | n.s. | |
| No | 125 | 67 | |||
| Invasión cuello pancreático | Sí | 9 | 81 | n.s. | |
| No | 121 | 66 | |||
| Tratamiento adyuvante (sí/no) | Sí | 75 | 66 | 0,004 | n.s. |
| No | 53 | 68 | |||
DM: ducto-mucosa; DPCPP: duodenopancreatectomía cefálica con preservación pilórica; DPCW: duodenopancreatectomía cefálica con gastrectomía; DPCWR2: duodenopancreatectomía cefálica con gastrectomía y linfadenectomía extendida a tronco celíaco y arteria mesentérica superior; lev: leve; loc: local; loc-reg: local y regional; mod: moderada; PT: pancreatectomía total; reg: regional; sev: severa.
El adenocarcinoma de páncreas comporta una supervivencia nefasta en las series publicadas hasta el momento, con una supervivencia similar a la presentada23,35–39. En este desolador escenario, el único tratamiento que ha demostrado mejorar la supervivencia del paciente ha sido la cirugía, con un controvertido apoyo de la quimioterapia y la radioterapia13,40,41.
Los factores pronósticos demostrados que influyen en la supervivencia del adenocarcinoma de páncreas son numerosos. Algunos de ellos se refieren a la biología tumoral, como la diferenciación celular42, ploidia celular43, densidad microvascular44, tamaño de la lesión42,45, invasión vascular45,46, o invasión linfática en el momento de la resección47,48. En cuanto a la cirugía, la transfusión durante el curso perioperatorio45,42 o la experiencia del centro hospitalario49,50 son variables que también influyen en el pronóstico del paciente tras la intervención. Sin embargo, la influencia de lo acontecido durante el período perioperatorio sobre la supervivencia no es bien conocida. Recientemente, se han relacionado la presencia de complicaciones postoperatorias con la disminución de la supervivencia34,51. En el presente estudio no hemos podido confirmar dichos hallazgos.
Transfusión de hemoderivados y supervivencia del pacienteLa transfusión de hemoderivados en el postoperatorio de cirugía oncológica del cáncer de colon o metástasis hepáticas empeora el pronóstico del paciente52. En cuanto a la cirugía del cáncer de páncreas, inicialmente varios grupos pusieron de manifiesto la pérdida sanguínea intraoperatoria como factor pronóstico tanto en análisis univariantes19,53 como multivariantes39,51,54. Paralelamente, la transfusión durante el período perioperatorio se relacionó como factor a tener en cuenta en la supervivencia de estos pacientes55. Así, tanto en series ya antíguas56 como recientes55,57,58 señalan la transfusión como factor negativo. Durante el seguimiento, evidenciamos que el 77% de los 141 pacientes trasfundidos fallecieron, frente al 54% de los 53 pacientes no trasfundidos, diferencia estadísticamente significativa. Parece demostrado que la administración de hemoderivados influye también en el pronóstico del cáncer de páncreas. La meticulosidad durante la intervención podrá implicar una menor hemorragia intraoperatoria, y ésta debería ser una de las prioridades de los cirujanos que se dediquen al tratamiento de este tipo de tumores.
Papel de la linfadenectomía en el pronóstico a largo plazoEn nuestra experiencia, la resección de más de 15 adenopatías ha sido un factor que comporta mayor supervivencia en el estudio univariante, sin embargo no parece ser definitivo puesto que el estudio multivariante lo descarta. De forma contraria, Pawlik48 demostró cómo la resección de más de 15 adenopatías y el «ratio adenopatías resecadas/afectas» era importante en la supervivencia del paciente. Ahora bien, en el momento actual sigue habiendo controversia acerca del beneficio de linfadenectomías extendidas. Estudios randomizados publicados no han podido demostrar diferencias con linfadenectomías extendidas19,26,42,59,60. Ante la falta de unanimidad y falta de evidencia científica al respecto, en nuestro centro optamos por realizar una linfadenectomía estándar ampliada. Es decir, incluimos el grupo ganglionar retroperitoneal, y evitamos la linfadenectomía alrededor del tronco celíaco y del borde izquierdo de la arteria mesentérica superior. Dicha técnica, aunque aumenta discretamente el tiempo quirúrgico, no parece implicar mayor morbilidad posquirúrgica y puede comportar un aumento en la supervivencia de los pacientes según algunos grupos, al aumentar el número de adenopatías resecadas48.
Tratamiento adyuvante en el cáncer de páncreasEl papel del tratamiento adyuvante en el cáncer de páncreas sigue siendo motivo de polémica ya que la mayor parte de los datos disponibles sobre ensayos clínicos aleatorizados tienen una potencia estadísticamente insuficiente, y proporcionan resultados contradictorios. En los primeros estudios del GISTG9 en 1985, se demuestró una ventaja en supervivencia y se estableció la quimioterapia basada en 5-FU y radioterapia como tratamiento adyuvante estándar en los Estados Unidos. Posteriormente, el estudio de la EORTC10 confirmó esos resultados con tendencia a una mejor supervivencia, aunque sin diferencias estadísticamente significativas. Ya en el año 2001, el grupo europeo ESPAC llevó a cabo el ensayo ESPAC-1 en el que se concluyó que la quimioradioterapia era inefectiva y que todos los pacientes deberían recibir quimioterapia adyuvante13. Recientemente, el estudio CONKO-001 ha demostrado una supervivencia libre de enfermedad a 4 años muy superior en los pacientes del grupo Gemcitabina frente al grupo Control61. Por último, en el ensayo RTOG-9704 se objetivó una mejora en el brazo Gemcitabina frente al brazo 5-FU en la supervivencia mediana (20,6 meses frente a 16,9 meses), y en la supervivencia a 3 años (32% frente a 21%; p=0,03)62. En realidad, los resultados de los dos últimos estudios no resuelven la controversia referente al óptimo tratamiento adyuvante del cáncer de páncreas. Sí se podría deducir, que los esquemas basados en Gemcitabina representan la alternativa de tratamiento adyuvante más adecuada para los pacientes con ADCP resecado, al igual que las bases para el diseño de ensayos clínicos futuros. Nuestro estudio pone de manifiesto la utilidad del tratamiento adyuvante, en el estudio univariante de supervivencia a largo plazo.
ConclusiónA la vista de nuestros resultados creemos que la cirugía oncológicamente completa debería incluir la linfadenectomía de los territorios peripancreáticos y retroperitoneal, y debería realizarse con baja morbilidad34 y sin transfusión perioperatoria.
Existe un amplio consenso en la literatura en cuanto al beneficio a corto y largo plazo en realizarse esta cirugía en centros con elevado volumen49,50,63–65. Incluso algunas guías clínicas aconsejan la realización de esta cirugía únicamente en centros que practiquen más de 20 DPC/año66–69. La creación de equipos multidisciplinares en dichos centros es un factor clave en la mejora de resultados en el tratamiento de pacientes con ADCP70.
En una reciente editorial, Bradley63 reflexiona sobre el concepto «curación» en el cáncer de páncreas, remarcando la diferencia entre supervivencia actual y supervivencia actuarial en referencia a esta patología. Tras revisar todas las series que reportasen resultados de supervivencia actual, y con un seguimiento largo (a 5 y 10 años) señala que únicamente 177 y 51 pacientes, respectivamente, siguen vivos tras la cirugía. Ello supone una supervivencia actual inferior al 10% a los 5 años e inferior al 3% a los 10 años, similar a nuestra experiencia. La mejoría de resultados a largo plazo probablemente está condicionada al desarrollo de tratamientos adyuvantes más efectivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.