La esofaguectomía es el principal tratamiento del cáncer de esófago. La dehiscencia de la anastomosis esofagogástrica es una complicación grave de la operación de Ivor Lewis que se asocia a una elevada mortalidad. El objetivo de este estudio es analizar su incidencia, su diagnóstico y los resultados del tratamiento.
Material y métodosAnálisis descriptivo de una serie consecutiva de esofaguectomías según la técnica de Ivor Lewis realizadas durante 5 años. Todas las anastomosis se realizaron de forma manual. Se registró la morbilidad general, dehiscencia de anastomosis, mortalidad intrahospitalaria, supervivencia y estenosis de la anastomosis.
ResultadosSe realizaron 41 anastomosis intratorácicas. Se presentaron complicaciones, de cualquier índole, en el 49% de los casos y se diagnosticaron 3 dehiscencias de la anastomosis (7,3%), una de ellas asintomática. Se reintervino de urgencia a un paciente, y los otros dos fueron tratados con drenajes y tratamiento conservador. La mortalidad de la serie fue del 7,3%, ninguna relacionada con la dehiscencia. La supervivencia a los 5 años fue del 27%. Un 34% de los pacientes desarrollaron estenosis de la anastomosis.
ConclusionesLa anastomosis intratorácica tras esofaguectomía puede realizarse, en nuestra experiencia, con una baja incidencia de dehiscencias y sin mortalidad por esta causa. El tratamiento de las mismas debe individualizarse y una parte considerable no precisa reintervención quirúrgica.
Oesophagectomy is the principal treatment for cancer of the oesophagus. The oesophagogastric anastomotic leak is a serious complication of the Ivor Lewis operation, and is associated with increased mortality. The objective of this study is to analyse its incidence, its diagnosis and treatment results.
Material and methodsA descriptive analysis of a consecutive series of oesophagectomies, carried out during a 5 year period, using the Ivor Lewis technique. All patients had hand sewn anastomosis. Data were collected on general morbidity, anastomosis leak, hospital mortality, survival, and stenosis of the anastomosis.
ResultsA total of 41 intrathoracic anastomoses were performed. Complications, of any type, were observed in 49% of cases, of which 3 (7.3%) were anastomotic leaks, one of them asymptomatic. One patient was urgently reoperated, and two others were treated with drains and conservative treatment. The mortality of the series was 7.3%, none associated with the anastomotic leak. The survival at 5 years was 27%, and 34% of the patients developed stenosis of the anastomosis.
ConclusionsIntrathoracic anastomosis after oesophagectomy, in our experience, can be performed with a low incidence of anastomotic leaks and without mortality due to this cause. Their treatment must be individualised and a considerable proportion do not require surgical intervention.
El cáncer de esófago es una de las neoplasias con peor pronóstico debido fundamentalmente a que el diagnóstico se efectúa en fases avanzadas de su evolución, cuando no es tributario de tratamiento curativo. Además también influye la comorbilidad de los pacientes como factor de riesgo asociado y la complejidad inherente a la cirugía asociada1–3. La cirugía como parte de un planteamiento multidisciplinario de su tratamiento, sea con intención curativa, sea paliativa, sigue siendo la primera opción terapéutica dado que la quimio y radioterapia como tratamiento único no han demostrado mejores resultados4–7. A pesar de los avances en anestesia, cirugía y cuidados postoperatorios, el tratamiento quirúrgico se asocia a una importante morbilidad y mortalidad, aunque esta última se ha logrado disminuir en los últimos años.
Tras la resección esofágica se restablece la continuidad digestiva mediante una plastia gástrica. La dehiscencia de la anastomosis esofagogástrica es una de las principales complicaciones, y la causa principal de la mortalidad postoperatoria8–10. La localización intratorácica de la anastomosis se ha asociado a una menor incidencia de dehiscencia pero a una mayor morbilidad y mortalidad cuando esta ocurre. Se han estudiado diversas técnicas para disminuir su frecuencia: sutura manual o mecánica (sin demostrarse superioridad clara de una sobre otra), pre-acondicionamiento isquémico, distinto tipo o material de sutura. A pesar de todo, la frecuencia de dehiscencia de la anastomosis descrita en la literatura oscila entre el 0 y el 11,6%. La principal complicación tardía de la anastomosis intratorácica es la estenosis, cuya frecuencia en grupos quirúrgicos muy especializados puede variar del 20 al 40%, y en la que influyen factores tales como la realización de anastomosis manual o mecánica y el antecedente de dehiscencia10–14.
El objetivo de este trabajo es analizar la frecuencia, características y resultados del tratamiento de las dehiscencias de la anastomosis esofagogástrica intratorácica.
Material y métodosPacientesAnálisis descriptivo de una serie consecutiva de pacientes a los que se les realizó una esofaguectomía según la técnica quirúrgica de Ivor Lewis (laparotomía, toracotomía derecha y plastia gástrica) durante un período de 5 años (2004-2008) en la Unidad de Cirugía Esófago-gástrica del Complejo Hospitalario de Navarra, Pamplona. Se excluyeron del estudio los casos de esofaguectomía realizados durante este período de tiempo en los que se utilizó otra técnica quirúrgica.
Técnica quirúrgica y cuidados perioperatoriosLa linfadenectomía se realizó en 2 campos (incluyendo en el tiempo torácico el tejido linfograso de la región yuxtacarinal, mediastino posterior y periesofágico). La plastia gástrica se confeccionó con grapadora mecánica y su vascularización dependió exclusivamente de las arterias gastroepiploica derecha y pilórica. Se practicó piloromiotomía extramucosa y se añadió una yeyunostomía de alimentación en todos los casos. La anastomosis esofagogástrica se realizó en todos los casos de forma manual en un plano con puntos sueltos de material reabsorbible de larga duración, y localizada a nivel del vértice del tórax. Se colocó sonda nasodigestiva, a través de la anastomosis, hasta la región suprapilórica y se dejó conectada a aspiración suave intermitente. Esta sonda digestiva se retiró al tercer-cuarto día del periodo postoperatorio. Al tercer día se inició la alimentación enteral por la yeyunostomía. Al octavo día de postoperatorio se realizó un control radiológico de la anastomosis esofagogástrica con contraste hidrosoluble y en caso de normalidad se inició la alimentación por vía oral. En caso de sospecha clínica de dehiscencia de la anastomosis intratorácica se realizó de forma urgente control radiográfico y tomografía computarizada (TAC) con contraste o endoscopia. Todos los casos fueron intervenidos por el mismo cirujano.
La morbilidad postoperatoria fue definida como la aparición de cualquier complicación independientemente de su gravedad, y la mortalidad como el fallecimiento por cualquier causa dentro de los 30 días posteriores a la intervención. El seguimiento postoperatorio se realizó con controles clínicos y exámenes periódicos. Los exámenes incluyeron TAC y analítica con marcadores CEA y CA 19-9.
Análisis estadísticoLas variables cuantitativas se han expresado como media y desviación estándar (DE) si presentaban una distribución normal (test Kolmogorov-Smirnov) o mediana y amplitud intercuartil si no se ajustaban a una distribución normal. Las variables cualitativas se han expresado en frecuencias y porcentajes. El análisis de supervivencia se realizó con el método de Kaplan-Meier utilizando para el cálculo de las diferencias estadísticas el log-Rank test. Se consideró estadísticamente significativos aquellos valores de p menores de 0,05. Para el análisis estadístico de todos los datos se empleó el programa SPSS (SPSS for Windows v 17.0; SPSS Inc., Chicago, IL, EE. UU.).
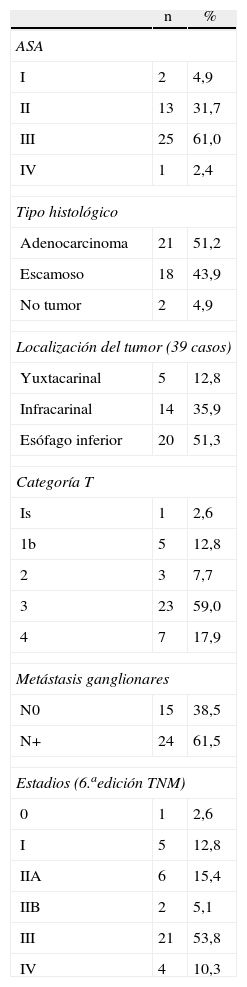
ResultadosDurante este período de 5 años, 53 pacientes fueron tratados con una esofaguectomía. En 41 de ellos se realizó la anastomosis esofagogástrica intratorácica, siendo estos casos el objeto del presente estudio. Las características de los pacientes se presentan en la tabla 1. La distribución por sexo fue: 33 varones (80,5%) y 8 mujeres, con una media de edad de 61,9 (DE: 10,3). En 39 se realizó la esofaguectomía como tratamiento de un cáncer de esófago. Los otros dos casos resecados fueron por estenosis esofágicas intratorácicas no dilatables y de naturaleza benigna. La media de ganglios resecados fue de 18,5 ganglios por caso (DE: 9,7). Tres de 39 pacientes (7,7%) recibieron tratamiento neoadyuvante con radio y quimioterapia según esquema Al-Sarraf15. La resección fue R0 en 38 casos (97,4%), y R2 en uno.
Esofaguectomías con anastomosis intratorácica
| n | % | |
| ASA | ||
| I | 2 | 4,9 |
| II | 13 | 31,7 |
| III | 25 | 61,0 |
| IV | 1 | 2,4 |
| Tipo histológico | ||
| Adenocarcinoma | 21 | 51,2 |
| Escamoso | 18 | 43,9 |
| No tumor | 2 | 4,9 |
| Localización del tumor (39 casos) | ||
| Yuxtacarinal | 5 | 12,8 |
| Infracarinal | 14 | 35,9 |
| Esófago inferior | 20 | 51,3 |
| Categoría T | ||
| Is | 1 | 2,6 |
| 1b | 5 | 12,8 |
| 2 | 3 | 7,7 |
| 3 | 23 | 59,0 |
| 4 | 7 | 17,9 |
| Metástasis ganglionares | ||
| N0 | 15 | 38,5 |
| N+ | 24 | 61,5 |
| Estadios (6.aedición TNM) | ||
| 0 | 1 | 2,6 |
| I | 5 | 12,8 |
| IIA | 6 | 15,4 |
| IIB | 2 | 5,1 |
| III | 21 | 53,8 |
| IV | 4 | 10,3 |
ASA: American Society of Anesthesiologists.
Veinte de 41 casos presentaron complicaciones (48,8%), alguno de ellos más de una. Las complicaciones más frecuentes fueron respiratorias: atelectasias que se solucionaron espontáneamente en 2 casos (4,9%), neumonía en 6 casos (14,6%) y empiema en un caso (2,4%). Hubo cuatro casos (9,8%) de arritmias (fibrilación auricular) que requirieron solo tratamiento médico y no tuvieron consecuencias. Se diagnosticaron 3 dehiscencias de la anastomosis esofagogástrica (7,3%). Solo un paciente requirió reintervención quirúrgica; se trataba de un varón de 62 años con un carcinoma escamoso localmente avanzado yuxtacarinal y que no había recibido tratamiento neoadyuvante. Al octavo día postoperatorio presentó dolor torácico intenso e insuficiencia respiratoria. Se realizó TAC de tórax que mostró fuga de contraste hidrosoluble al mediastino. Se reintervino y se encontró dehiscencia parcial a nivel de la cara anterior de la anastomosis con bordes bien vascularizados; se reparó con puntos sueltos y el paciente presentó buena evolución posterior, por lo que fue dado de alta a los 28 días de la intervención quirúrgica inicial. Al año y medio de la cirugía permanece asintomático. El segundo caso fue un varón de 52 años con un adenocarcinoma de esófago inferior muy avanzado y que había recibido tratamiento previo oncológico con esquema de Al-Sarraf. Ante la aparente buena respuesta clínica fue reconsiderado para tratamiento quirúrgico y al octavo día postoperatorio se observó salida de material purulento por la cicatriz de la toracotomía asociada a fiebre y leucocitosis. En el estudio radiográfico y endoscópico urgente se comprobó dehiscencia parcial a nivel de la anastomosis esofagogástrica. Se trató mediante la colocación de drenaje torácico adecuado y la evolución clínica fue favorable. Se confirmó el cierre de la fuga y fue dado de alta a los 35 días de la intervención. A los 2 años sigue asintomático. El tercer caso corresponde a un varón de 61 años con múltiples antecedentes de patología vascular y enfermedad pulmonar obstructiva crónica intervenido por un adenocarcinoma intramucoso sobre esófago de Barrett. En la operación se comprobó pulsación débil de la arcada gastroepiploica. Estando asintomático al séptimo día postoperatorio, en el estudio radiográfico de control se objetivó pequeña fuga a nivel de la anastomosis que evolucionó favorablemente con tratamiento médico. A los 5 años sigue asintomático. Otras complicaciones quirúrgicas fueron: infección superficial de la herida quirúrgica en 3 casos (7,3%) y evisceración contenida en 1 caso (2,4%).
La mortalidad postoperatoria fue de 3 casos (7,3%) pero ninguno debido a dehiscencia anastomótica. El primer paciente falleció al tercer día de la intervención de forma repentina, demostrándose en la necropsia un infarto agudo de miocardio. El segundo, con antecedentes de enfermedad pulmonar obstructiva crónica y un riesgo anestésico ASA III, falleció al noveno día por sepsis respiratoria. El tercer paciente, también con antecedentes respiratorios importantes, falleció a los 20 días por insuficiencia respiratoria progresiva.
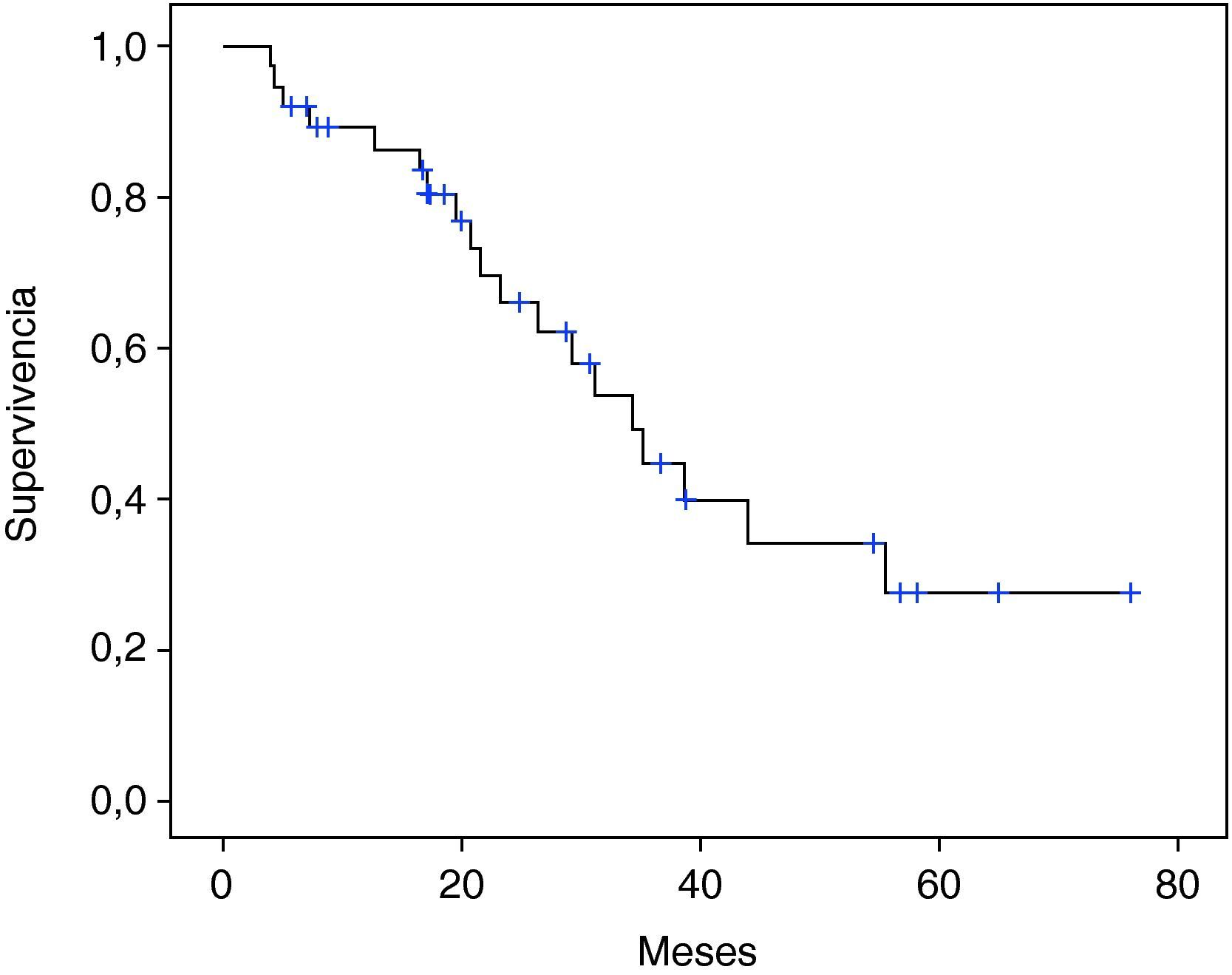
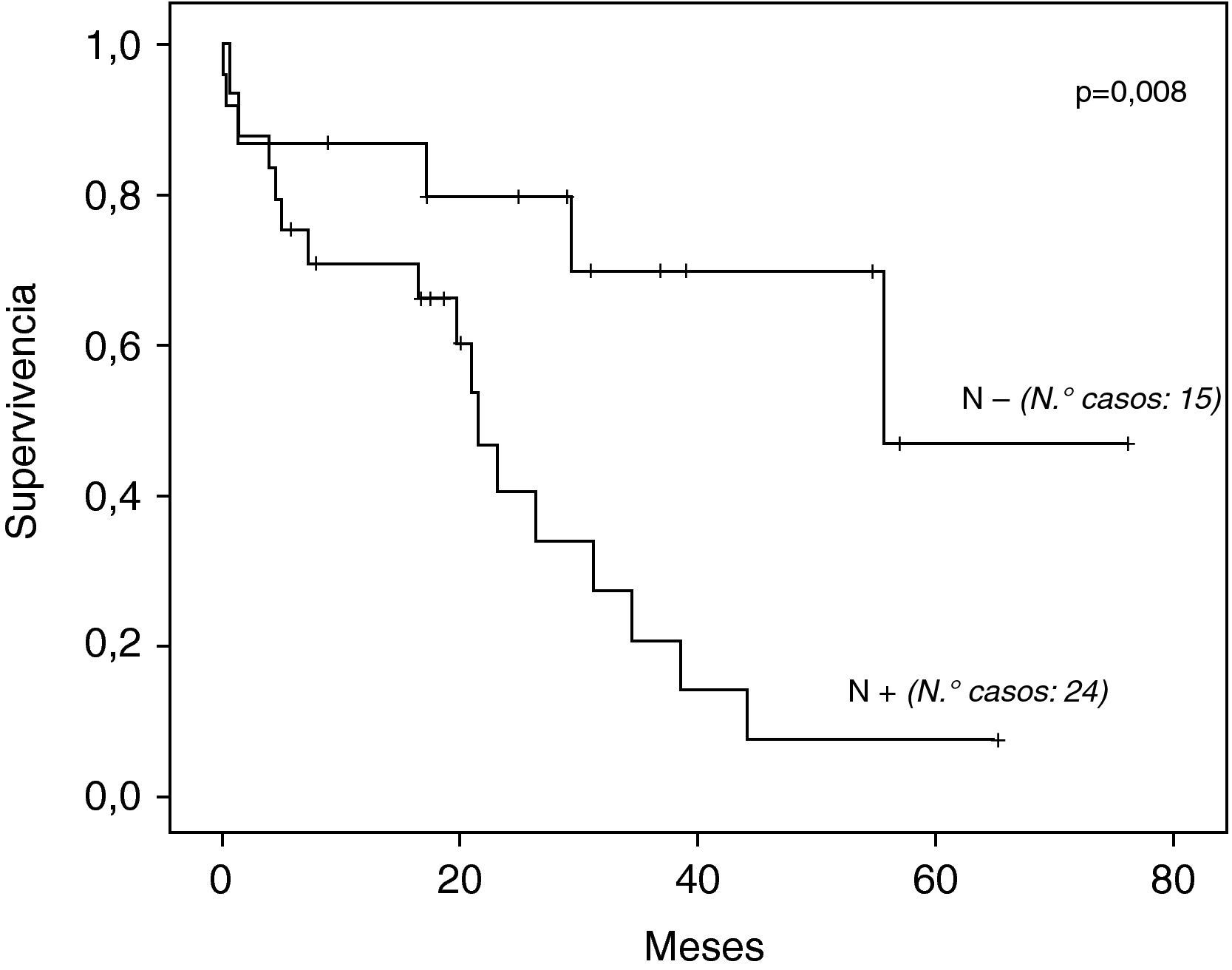
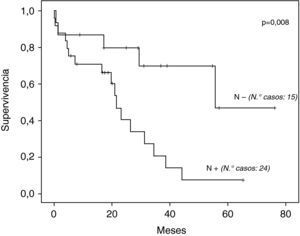
La supervivencia global a los 5 años de los 39 casos operados por tumor fue de 27,1% (fig. 1), con una mediana de 34,4 meses. La mediana de supervivencia según tipo histológico fue de: 44,1 y 26,4 meses para adenocarcinoma y carcinoma escamoso respectivamente, sin diferencias estadísticamente significativas (p=0,071). Según presencia o no de metástasis ganglionares fue: 22 y 56 meses respectivamente, con diferencia muy significativa (p=0,008) (fig. 2).
En los controles de seguimiento se comprobó estenosis de la anastomosis esofagogástrica, en algún momento de la evolución, en 14 casos (34%), siendo la media de dilataciones endoscópicas 3,9 (DE 2,9; rango 1-8), aunque el 43% requirió 2 o menos dilataciones en total. Los tres casos descritos de dehiscencia de la anastomosis requirieron dilataciones en el seguimiento posterior (en una ocasión el primer caso, y en ocho los dos restantes). No se utilizó prótesis en ningún caso.
DiscusiónLa morbilidad general de nuestra serie está dentro del rango publicado por otros autores, que oscila entre 27 y 67%, teniendo en cuenta que están incluidas todas las complicaciones postoperatorias independientemente de su importancia16–22. La mortalidad postoperatoria en general está en torno al 7-8%, aunque en los últimos años se comunica una mortalidad más baja por grupos especializados. En nuestra serie no ha habido mortalidad por dehiscencia de la anastomosis y, además, hay que contemplar que más del 60% de los casos tenían un riesgo anestésico ASA III y IV16–21.
La incidencia de dehiscencia anastomótica de nuestra serie (7,3%) es aceptable, ya que está dentro del rango publicado por varios grupos especializados, y además considerando que uno de los tres casos fue un hallazgo radiológico en un paciente asintomático11–14,23–25.
Los factores implicados en el aumento del riesgo de dehiscencias son diversos. La quimioterapia y radioterapia muchas veces forman parte del tratamiento de estos pacientes y se ha considerado como un factor de riesgo de complicaciones en general y de la dehiscencia anastomótica en particular, aunque esto no ha sido confirmado por todos los autores4,7,23,26–29. En nuestra serie solo uno de los tres pacientes sometidos a tratamiento neoadyuvante presentó dehiscencia de sutura, aunque el bajo número de casos no nos permite sacar conclusiones al respecto. La isquemia de la plastia gástrica es otro factor que afecta claramente la incidencia de dehiscencia, por lo cual la vascularización de esta ha sido objeto de estudio y se han desarrollado diversas técnicas para mejorarla12,26,30–32. En nuestra serie se comprobó un solo caso con pulsación débil en la arcada gastroepiploica en uno de los casos de dehiscencia, aunque esta fue mínima y no requirió tratamiento específico. Otros factores técnicos que claramente disminuyen la tasa de dehiscencia son: adecuada hemostasis, resección tipo R0 y cuidadoso manejo de los tejidos23. Con respecto a las distintas técnicas empleadas, manuales o mecánicas, no se han demostrado diferencias significativas en la tasa de dehiscencia8,11,13. Por otro lado, se menciona la versatilidad de la sutura manual que se adaptaría mejor a las diferentes situaciones anatómicas: diámetro de los cabos, localización de la anastomosis. Se considera que, en general, la sutura mecánica sería técnicamente más sencilla de realizar y aprender por los cirujanos en formación. De todas formas, no se ha logrado demostrar aún superioridad de un método sobre otro, quedando por tanto la elección de la técnica a cargo del cirujano de acuerdo con sus preferencias. En nuestros pacientes se ha realizado sutura manual en monoplano a puntos sueltos en todos los casos, la cual preferimos por su versatilidad y la seguridad que nos proporciona. Creemos que otro de los factores que podría explicar la baja tasa de dehiscencias que hemos observado en este estudio sería la técnica adecuada, ya que solo hubo un caso de resección tipo R2 por compromiso del margen lateral y no de los márgenes proximal o distal.
El diagnóstico correcto y precoz de la dehiscencia es fundamental, ya que hace posible un tratamiento adecuado al tiempo que influye en la evolución del paciente24. La presentación clínica varía ampliamente según el grado, localización y causa de dehiscencia (anastomosis esofagogástrica, plastia gástrica o necrosis de la misma). Puede presentarse con la aparición de contenido purulento en el drenaje pleural y/o colección intratorácica y acompañarse de sepsis, o de forma más insidiosa con fiebre, leucocitosis, y sin contenido patológico en el drenaje pleural9. Los dos primeros casos de esta serie se presentaron con síntomas que hacían sospechar una dehiscencia aunque con mayor y más rápido deterioro general en el primer caso, mientras que el tercero fue totalmente asintomático, lo cual estuvo acorde al grado de dehiscencia. Los dos casos sintomáticos se presentaron al octavo día de postoperatorio de forma similar a lo referido en otras series14,24. Dadas las dificultades de diagnóstico en los casos no evidentes y el riesgo de iniciar la vía oral en caso de dehiscencia, es fundamental la vigilancia monitorizada de los signos clínicos e imprescindible la disponibilidad de métodos diagnósticos, como la radiología con contraste, TAC y endoscopia. El estudio radiológico esófago-gástrico con contraste para detectar fugas anastomóticas es realizado de rutina por gran parte de los autores argumentando el riesgo de aumentar una dehiscencia subclínica al iniciar la alimentación por vía oral14,25. Sin embargo, otros no lo utilizan de rutina dada su baja sensibilidad, indicándolo solo en pacientes con sospecha clínica24,33. Nosotros lo hemos realizado en todos los casos y ha evidenciado las dehiscencias, sin falsos negativos, por ello creemos adecuada su realización siempre que se valore por radiólogos y cirujanos especializados. Cuando el contraste hidrosoluble no demuestra fuga se puede utilizar bario, lo cual aumenta su sensibilidad34. La TAC es otro método útil, fundamentalmente para evaluar la presencia de colecciones intratorácicas, aunque puede también demostrar la fuga de contraste administrado por vía oral, como hemos observado en el primer caso, o incluso la presencia de aire a nivel mediastínico. Según un reciente trabajo, el rendimiento diagnóstico sería incluso superior al estudio radiológico convencional esófago-gástrico35. La endoscopia es un método fundamental para descartar isquemia de la plastia gástrica y útil para detectar dehiscencias, debiendo ser realizada por un endoscopista experimentado para evitar insuflación excesiva y posible iatrogenia9. La hemos utilizado en uno de los tres casos y ha permitido un correcto diagnóstico.
Una vez hecho el diagnóstico y de acuerdo con la situación clínica del paciente se realizará el tratamiento oportuno. En los casos con presentación brusca y rápido deterioro del estado general, habitualmente antes del séptimo día de postoperatorio, el tratamiento indicado es la intervención quirúrgica urgente actuando según los hallazgos, ya que puede tratarse de una dehiscencia de la anastomosis o de necrosis de la plastia gástrica. En los demás casos el tratamiento debe ser individualizado y adaptado a cada caso. En general se prefiere el tratamiento conservador mediante antibioticoterapia, dieta absoluta, soporte nutricional adecuado, y drenaje correcto mediante tubos torácicos o drenaje percutáneo guiado por TAC14,23–25,33,36,37. En nuestra serie, se reintervino solo a un paciente, y se llevó a cabo tratamiento conservador en los dos restantes. En la reintervención se realizó una reparación de la cara anterior de la sutura, con buena evolución; este procedimiento, en casos con buena vascularización y aspecto de los tejidos, es el recomendado por otros autores36. En nuestra serie no hemos tenido mortalidad por esta causa; en la literatura la misma se sitúa generalmente entre el 8,5 y el 35% de los pacientes con dehiscencias, aunque algunos han publicado cifras de mortalidad prácticamente nulas13,14,23–25,36.
La incidencia de estenosis de la anastomosis que hemos observado está dentro de la referida por otros grupos especializados, que publican cifras entre 19,2 y 40%, aunque estas cifras pueden estar influenciadas por la técnica quirúrgica de sutura o la utilización de grapadoras mecánicas, y destacando además que casi la mitad de los casos solo requirieron 2 sesiones de dilatación como máximo8,11,13,38.
Por otra parte, la supervivencia global a 5 años obtenida por otros grupos oscila entre el 19 y 33%. Creemos que nuestros resultados, 27,1%, son aceptables teniendo en cuenta que más del 60% eran estadios III y IV y que en la mayoría el tratamiento quirúrgico fue el único realizado18,39,40. Nosotros no encontramos diferencias entre los adenocarcinomas y carcinomas escamosos, aunque creemos que la dimensión de la serie no permite sacar conclusiones en este sentido18,41. Con un porcentaje de ganglios aislados por caso que creemos adecuado, sí encontramos diferencias significativas en relación con la presencia o ausencia de ganglios metastásicos, como en otras series29,39,40.
Como conclusiones, la morbilidad de la esofaguectomía continúa siendo elevada, aunque la mortalidad ha disminuido actualmente. Creemos importante la realización de esta intervención por cirujanos experimentados y parece fundamental establecer criterios rigurosos de indicación quirúrgica, sobre todo en relación con los factores de riesgo cardiorrespiratorios. En relación con la anastomosis esofágica intratorácica creemos que, de acuerdo con nuestros resultados, es posible realizarla con una baja incidencia de dehiscencias y una reducida mortalidad. Todo esto confirma la relación entre la experiencia de los cirujanos y de los grupos que se dedican a esta cirugía y la incidencia de dehiscencias. Los factores que, a nuestro juicio, intervienen fundamentalmente son: técnica quirúrgica y cuidados perioperatorios, equipo multidisciplinar, vigilancia estrecha de los signos clínicos de sospecha, disponibilidad de los medios de diagnóstico, reintervención quirúrgica solamente en una parte de ellas, así como tratamiento con drenajes correctos de las fugas y colecciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.