Se analizan en esta revisión las complicaciones más frecuentes después de una pancreaticoduodenectomía: el retraso del vaciamiento gástrico, la fístula pancreática, la hemorragia postoperatoria y las complicaciones tras la reconstrucción vascular, en los casos de cáncer de páncreas localmente extendido. Para ello se han valorado los estudios prospectivos aleatorizados, los metaanálisis sistemáticos y las guías clínicas sobre la definición, grados de gravedad clínica y tratamiento de estas complicaciones.
The most frequent complications after pancreaticoduodenectomy are analysed in this review. These include, delayed gastric emptying, pancreatic fistula, post-operative bleeding, and the complications after vascular reconstruction in the cases of locally extended pancreatic cancer. For this, randomised prospective studies, systematic meta-analyses and clinical guidelines on the definition, clinical severity grade and treatment of these complications have been evaluated.
La pancreaticoduodenectomía (PD) es una de las intervenciones que exige unos cirujanos especializados. Constituye la técnica de elección para el tratamiento de tumores benignos y malignos del páncreas, así como de lesiones tumorales de la región distal del conducto biliar y del duodeno. La mortalidad de esta cirugía ha descendido en estos últimos años a < 5%, pero se asocia a una morbilidad elevada que oscila entre el 30 y el 50%1, y que se relaciona en algunos casos con las características generales de los pacientes, tales como edad avanzada con comorbilidades asociadas, desnutrición, etc. Sin embargo en la mayoría de los casos la morbimortalidad está directamente relacionada con la técnica quirúrgica2,3.
Vaciamiento gástrico retardadoEl vaciamiento gástrico retardado (VGR) es una complicación frecuente que aparece tras la PD y que altera el normal curso postoperatorio fundamentalmente a expensas de prolongar la estancia y aumentar los costes. Fue descrito por primera vez por Warshaw y Torchiana en 1985 como una complicación asociada a la PD con preservación pilórica y con una incidencia en su serie del 70%4, aunque series posteriores han encontrado una incidencia de esta complicación muy variable, del 5 al 75%, y asociada a la preservación pilórica y a la PD clásica tipo Whipple5–8
La aparición del VGR parece tener un origen multifactorial ya que en su patogenia se han involucrado numerosos factores, tanto intraoperatorios como postoperatorios (tabla 1)9,10.
Patogenia del vaciamiento gástrico retardado
| Factores intraoperatorios |
| Extirpación del duodeno (regulación de la secreción de hormonas gastrointestinales y pancreáticas) |
| Tipo de reconstrucción gastrointestinal (B-I o B-II, ante- o retrocólica) |
| Reconstrucción pancreática (PY o PG) |
| Extensión linfadenectomía |
| Sección arteria gástrica derecha |
| Isquemia o congestión o espasmo de píloro |
| Disrupción inervación gastrointestinal (complejos motores migratorios) |
| Factores postoperatorios |
| Complicaciones postoperatorias |
| Pancreatitis |
| Sepsis/abscesos intraabdominales/fístula pancreática |
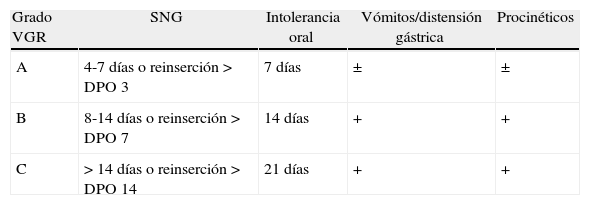
Actualmente tenemos una definición estandarizada y consensuada del VGR11. Esta definición, propuesta por el grupo de estudio internacional de cirugía pancreática y publicada en 2007 incluye también dos aspectos previamente señalados que se identificaban en la mayoría de las definiciones previas al consenso, acota la duración y establece una gradación en la gravedad del vaciamiento retardado. La definición consensuada de VGR comprende la necesidad de sonda nasogástrica (SNG) durante más de 3 días o su colocación a partir del tercer día del postoperatorio, así como la intolerancia a la dieta oral al terminar la primera semana postoperatoria. La duración de estos parámetros y sus consecuencias clínicas modulan 3 grados diferentes de VGR que definen la gravedad clínica. Un primer grado A conlleva poca relevancia clínica y otros dos, B y C, son crecientes en gravedad y con posibles consecuencias (tablas 2 y 3).
Definición de consenso según el International Study Group of Pancreatic Surgery de vaciamiento gástrico retardado
| Grado VGR | SNG | Intolerancia oral | Vómitos/distensión gástrica | Procinéticos |
| A | 4-7 días o reinserción > DPO 3 | 7 días | ± | ± |
| B | 8-14 días o reinserción > DPO 7 | 14 días | + | + |
| C | > 14 días o reinserción > DPO 14 | 21 días | + | + |
DPO: día postoperatorio; SNG: sonda nasogástrica; VGR: vaciamiento gástrico retardado.
Para excluir causas mecánicas de vaciamiento gástrico anormal, se debe confirmar la permeabilidad de la gastroyeyunostomía o duodenoyeyunostomía mediante endoscopia o tránsito gastrointestinal con gastrografín.
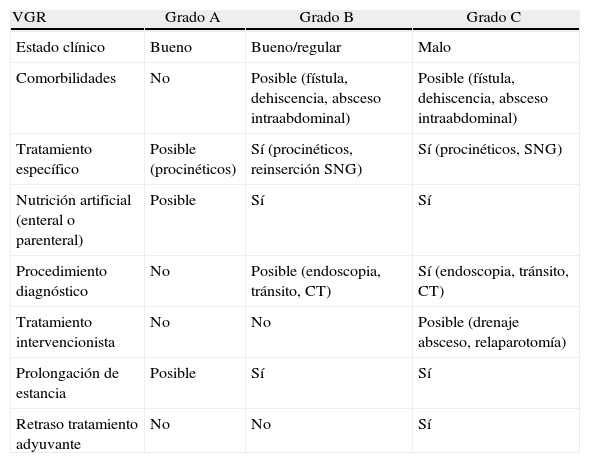
Parámetros de gradación del vaciamiento gástrico retardado
| VGR | Grado A | Grado B | Grado C |
| Estado clínico | Bueno | Bueno/regular | Malo |
| Comorbilidades | No | Posible (fístula, dehiscencia, absceso intraabdominal) | Posible (fístula, dehiscencia, absceso intraabdominal) |
| Tratamiento específico | Posible (procinéticos) | Sí (procinéticos, reinserción SNG) | Sí (procinéticos, SNG) |
| Nutrición artificial (enteral o parenteral) | Posible | Sí | Sí |
| Procedimiento diagnóstico | No | Posible (endoscopia, tránsito, CT) | Sí (endoscopia, tránsito, CT) |
| Tratamiento intervencionista | No | No | Posible (drenaje absceso, relaparotomía) |
| Prolongación de estancia | Posible | Sí | Sí |
| Retraso tratamiento adyuvante | No | No | Sí |
CT: computer tomography: SNG: sonda nasogástrica.
En la serie de Akizuki12 sobre 85 PD la frecuencia de VGR de acuerdo con la definición de consenso fue de 44%, de los cuales fue clínicamente relevante el 23%, mientras que si se valoraba de acuerdo a la definición de van Berge Henegouwen era del 13%. Otra serie reciente, la de Hashimoto y Traverso13, que incluye 507 pacientes, presenta una tasa de VGR del 59% de acuerdo a la definición de consenso, clínicamente relevante en el 12% de los casos.
Varias investigaciones han señalado la posible implicación de la motilina en el VGR, por lo que se ha propuesto la administración de la propia hormona o productos con estructura molecular muy parecida motilin-like. Sobre este tipo de estudios hay que señalar que frente a la dosis de 200mg de eritromicina cada 6 horas propuesta años atrás por Yeo et al.14, en la actualidad se proponen dosis más bajas, de 1mg/kg cada 8 horas15. Al parecer las dosis altas producen contracciones muy intensas a nivel antral que no se propagan al intestino, mientras que dosis bajas inducen la fase III del complejo motor de forma prematura con capacidad de propagarse al intestino de forma similar a lo que ocurre de forma fisiológica. Últimamente se están relacionado con la reducción o prevención del VGR los programas de rehabilitación multimodal o fast-track. Así, un estudio reciente del grupo de DiCarlo en Milán detecta VGR en el 14% de los pacientes incluidos en un protocolo de “fast-track” frente al 24% de su serie histórica16. También ha sido implicado en la mayor o menor tasa de VGR el tipo de reconstrucción gastro- o duodeno-yeyunal, resultando más favorable una reconstrucción tipo Billroth II que la Billroth I17 y antecólica frente a la retrocólica. Esta última probablemente relacionada con la menor angulación o torsión de la anastomosis cuando se realiza por delante del colon18–20.
Lo primero que hay que hacer cuando se presenta VGR es buscar y tratar si existe alguna posible complicación, por ejemplos las colecciones intraabdominales y en íntima relación con estas, la presencia de una fístula pancreática. Por otra parte es importante mantener la SNG mientras sea necesario y procurar un adecuado estado nutricional, y un balance hídrico y electrolítico. En una gran mayoría la nutrición se realiza por vía parenteral, pero en los casos en los que se haya optado por la enteral sería preferible administrarla cíclicamente y así evitar los niveles altos de colecistoquinina que podrían prolongar la gastroparesia a través de mecanismos de feedback yeyunogástricos17. Otras medidas serían la administración de inhibidores de la bomba de protones y el tratamiento con eritromicina a dosis bajas. Hay otro factor a tener muy en cuenta y que puede ser fuente de problemas a la hora de tratar un paciente con VGR: la paciencia. Raramente hay que tomar alguna medida de naturaleza quirúrgica para resolver el VGR a no ser que esté asociado a alguna complicación que sí lo requiera.
Fístula pancreáticaEl fracaso de la anastomosis pancreática produce una salida de líquido después de una pancreaticoenterostomía (fístula), con frecuencia contiene enzimas pancreáticas activadas con capacidad de digerir los tejidos adyacentes y provocar una lesión vascular y hemorragia grave. Las complicaciones más frecuentes de la fístula son la aparición de colecciones intraabdominales y una sepsis local más o menos extensa. En 2005, Bassi et al.21 publicaron los criterios que definen una fístula pancreática a partir de los trabajos de un grupo internacional de cirujanos bajo las siglas ISGPF21: un volumen de líquido recogido en un drenaje intraabdominal el día 3 del postoperatorio o a partir de ese día con un contenido de amilasa 3 veces superior al valor de la normalidad de la amilasa en suero. La importancia clínica de esta complicación se divide en tres grados: grado A, no asocia alteración clínica alguna; grado B, asociada a cambios en el manejo clínico del paciente que puede requerir tratamientos tales como alimentación parenteral, mantenimiento prolongado de los drenajes y/o recolocación de los drenajes, y el grado C, que exige unas terapias agresivas en un paciente con deterioro del estado general, que pueden conllevar una reoperación e incluso acarrear la muerte del paciente. Recientemente se han revisado los criterios del ISGPF, y se ha considerado que la fístula pancreática grado A no es una complicación ya que la manifestación clínica en los pacientes es nula22. Recientemente, Strasberg23 et al. han propuesto una nueva clasificación del fracaso de la anastomosis pancreática que tiene en cuenta los cambios en el manejo clínico del paciente y los requerimientos de una serie de actuaciones terapéuticas.
El fracaso de la anastomosis pancreática puede deberse a condiciones generales del paciente, como edad avanzada, diabetes, obesidad, etc., a condiciones intraoperatorias tales como intervenciones de larga duración, a la necesidad de transfusión sanguínea per-operatoria, pero frecuentemente, también a condiciones locales del remanente pancreático: exceso de grasa peripancreática, conducto de Wirsung de diámetro inferior a 3mm y textura blanda24,25. No obstante la técnica quirúrgica y la experiencia del cirujano son las variables de mayor importancia en la aparición de esta complicación1–3. A pesar del tiempo transcurrido desde que se describió la PD, no existe una técnica de reconstrucción pancreática que haya sido aceptada universalmente.
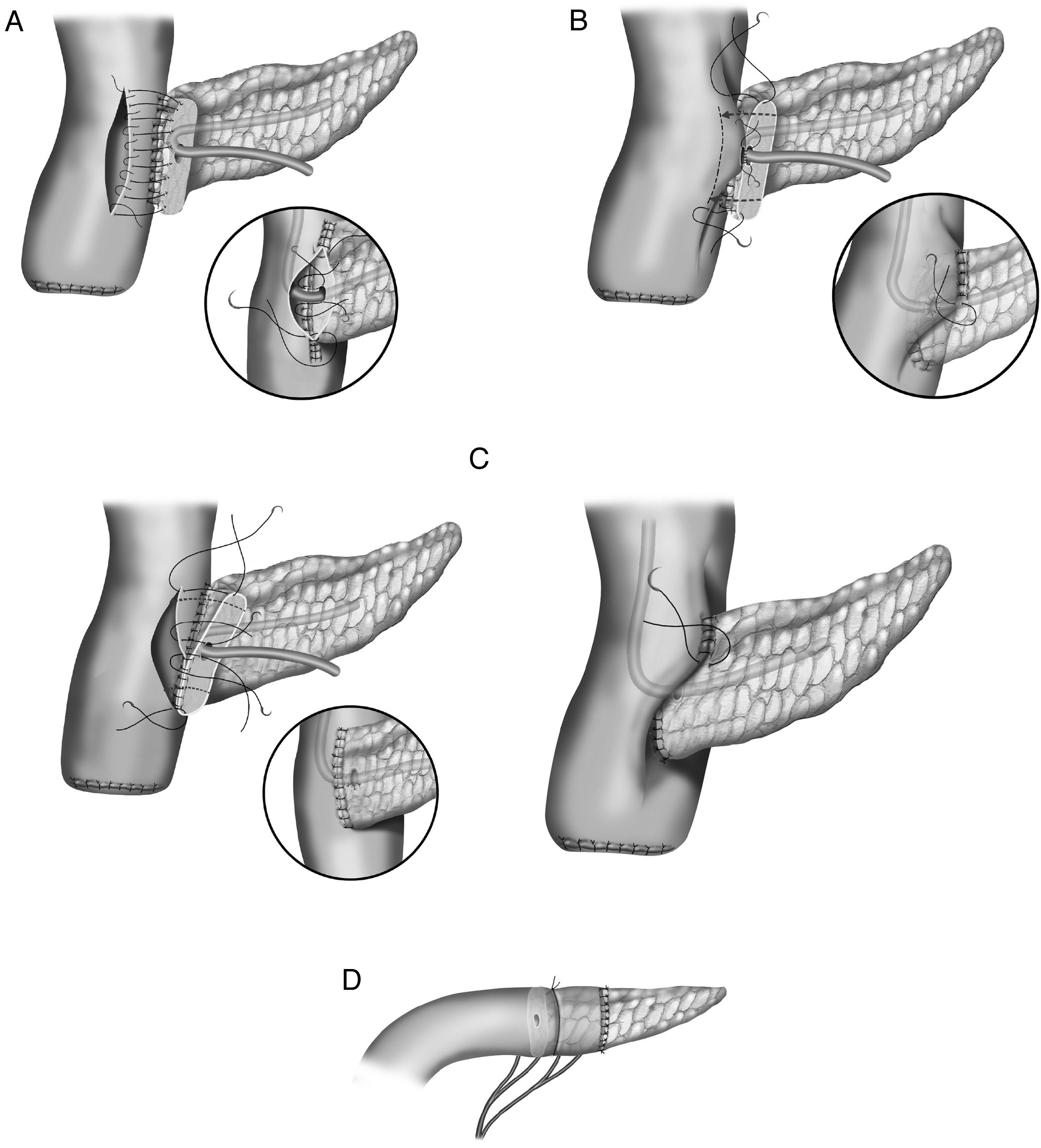
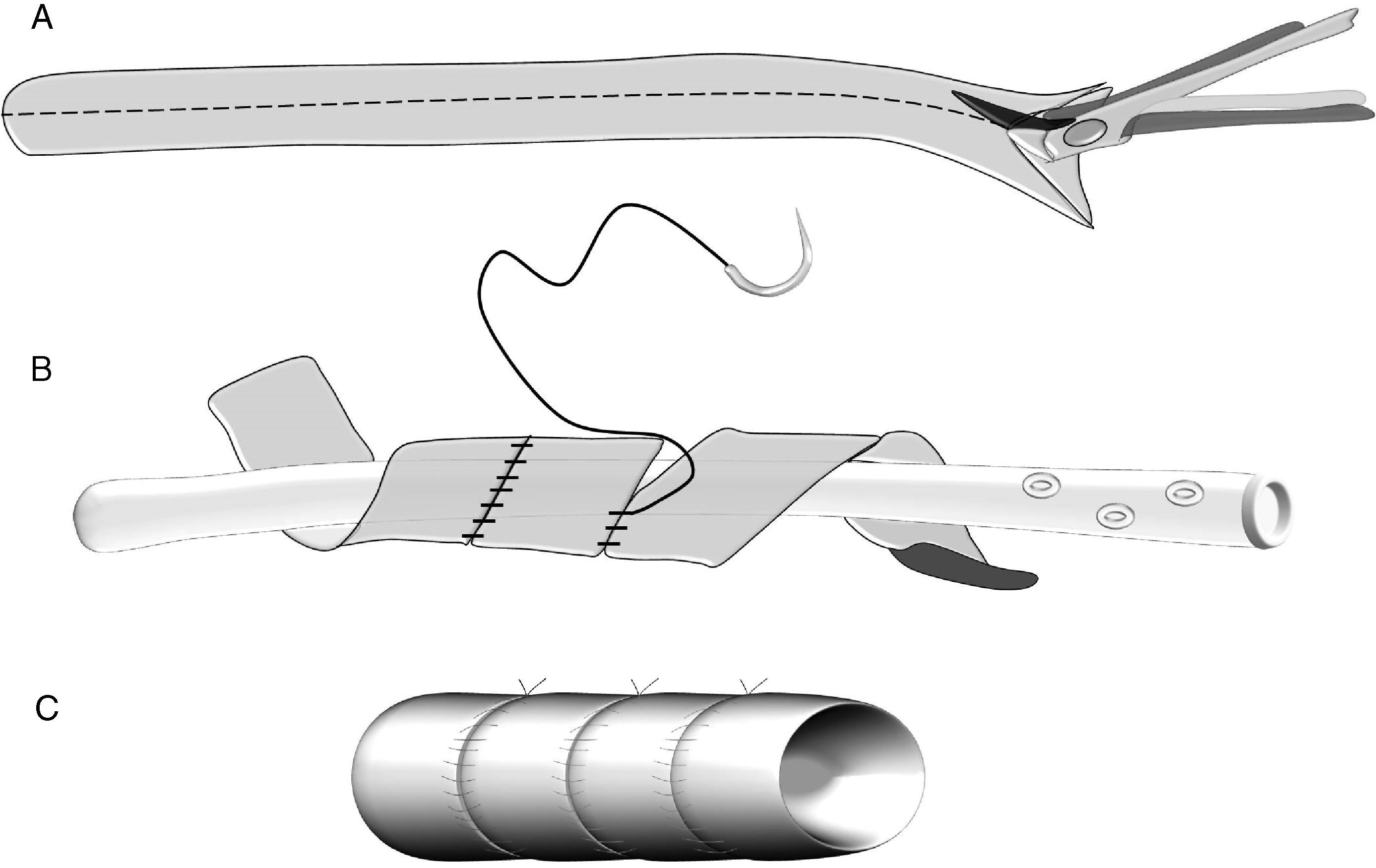
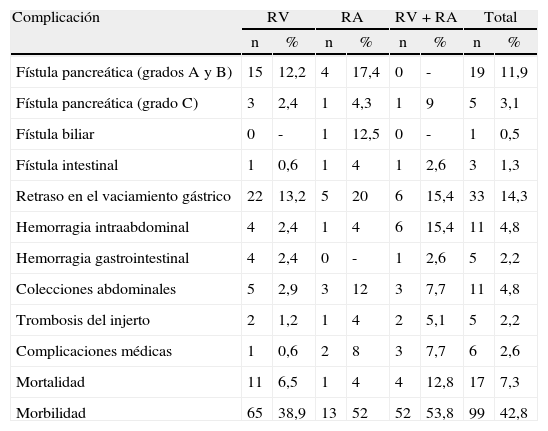
En la literatura quirúrgica no existe una uniformidad en las técnicas de la anastomosis entre el segmento pancreático y el yeyuno25–27 (fig. 1). En unos casos la técnica consiste en una anastomosis término-lateral (fig. 1A), en otros en una anastomosis término-terminal o bien en una invaginación del extremo pancreático en el yeyuno (fig. 1C). La técnica de anastomosis término-lateral tiene dos variantes la anastomosis directa en un solo plano entre los bordes superior e inferior pancreáticos y la abertura longitudinal (3-4cm) en el yeyuno (fig. 1A) y la anastomosis ducto-mucosa (fig. 1B). Para realizar estas anastomosis, algunos cirujanos utilizan transitoria o permanentemente la colocación de un drenaje transanastomótico. Otra de las variaciones que han sido descritas es la técnica de invaginación pancreático-yeyunal (binding): el segmento proximal del intestino es evertido, destruida la mucosa con ácido carbólico e introducido de 1 a 2cm de remanente pancreático en la luz intestinal. Una ligadura envuelve el área del segmento pancreático invaginado en el intestino28 (fig. 1D).
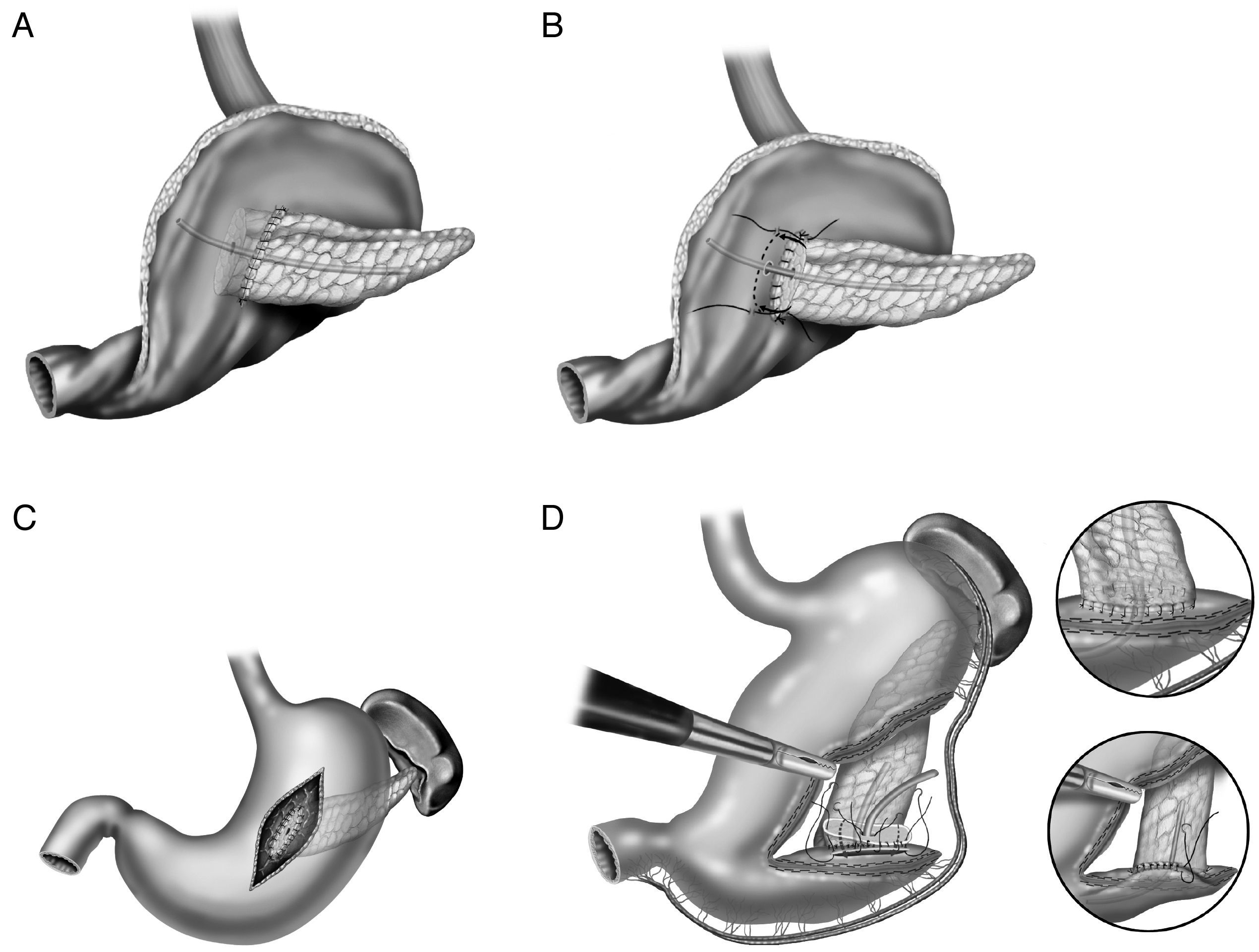
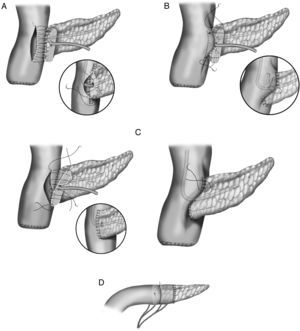
En la literatura tampoco existe una uniformidad en la realización de la anastomosis del segmento pancreático con el estómago (fig. 2A-D). Al igual que con la técnica de la pancreaticoyeyunostomía, las variaciones giran en torno a una anastomosis directa, invaginación o a la anastomosis ducto-mucosa29–33. Esta última exige la colocación de un drenaje transanastomótico. Recientemente ha sido descrita la técnica de la pancreaticogastrostomía con un segmento de estómago después de una partición gástrica34 (fig. 2D); esta anastomosis puede realizarse aplicando la técnica ducto-mucosa o la técnica de la invaginación.
A) anastomosis ducto-mucosa y colocación de un drenaje transanastomótico; B) invaginación de unos 2-3cm del remanente pancreático a través de la cara posterior gástrica; C) invaginación del remanente pancreático a través de la cara posterior gástrica y anastomosis pancreaticogástrica a través de una gastrotomía anterior; D) pancreaticogastrostomía con un segmento de estómago después de una partición gástrica.
Por otra parte, cabría preguntarnos cuál de las técnicas aquí descritas resulta más favorable. La respuesta solo puede hallarse en los estudios prospectivos aleatorizados. Bassi et al.35 respecto a la técnica de la pancreaticoyeyunostomía aleatorizaron 144 pacientes con páncreas blando; a un grupo se le realizó una anastomosis ducto-mucosa en dos planos, y a otro una anastomosis directa en un solo plano; el porcentaje de fístula pancreática fue de 13 y 15% respectivamente. Berger et al.36 en un estudio prospectivo aleatorizado en el que participaron 2 instituciones hospitalarias con 197 pacientes, compararon la técnica de invaginación con la técnica ducto-mucosa y observaron que el porcentaje de fístula pancreática global fue de 12 y 25% respectivamente. Los resultados que se obtuvieron cuando se analizaron los casos según la textura del páncreas, fueron de especial interés: en los pacientes con páncreas blando, la fístula pancreática apareció en el 36% con la anastomosis ducto-mucosa y en el 18% con la técnica de la invaginación; en los pacientes con páncreas duro la fístula pancreática fue de 11% con la técnica ducto-mucosa y de un 5% con la técnica de la invaginación. Esta aparece como la técnica más segura y eficaz y se considera como la más recomendable.
Peng et al.37 compararon, en un estudio prospectivo aleatorizado con 217 pacientes, la técnica de ligadura envolvente (binding) del segmento pancreático invaginado en el intestino con la pancreaticoyeyunostomía término-terminal; la fístula pancreática apareció en el 0 y 7% respectivamente. La ausencia de fístula pancreática con la técnica de Peng no ha podido ser reproducida en 2 estudios independientes por cirujanos franceses, en los que la fístula pancreática apareció en el 17 y 36% respectivamente38,39.
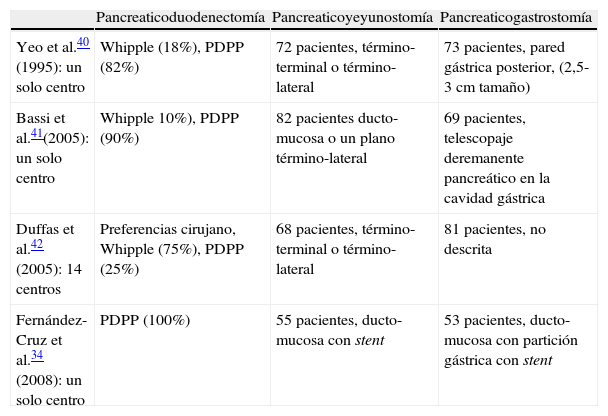
Actualmente existen 4 estudios prospectivos aleatorizados que han comparado las técnicas de pancreaticoyeyunostomía con la pancreaticogastrostomía. En tres de estos estudios no se evidenció superioridad alguna en cuanto a resultados de una técnica sobre la otra40–42. Tan solo el estudio con la realización de la pancreaticogastrostomía después de la partición gástrica demostró una diferencia significativa favorable en lo que a morbilidad y fístula pancreática se refiere, al compararla con la pancreaticoyeyunostomía34. Sin embargo hay que hacer hincapié en el hecho de que las técnicas de pancreaticoyeyunostomía y de pancreaticogastrostomía utilizadas en los 4 estudios prospectivos aleatorizados no fueron semejantes (tabla 4). Consecuentemente, con carácter general, cada cirujano deberá decidir la técnica que en sus manos resulte más segura y eficaz. Sería aconsejable aplicar la técnica de la pancreaticoyeyunostomía en pacientes con páncreas duro y la técnica de la pancreaticogastrostomía en pacientes con páncreas blando y con un conducto pancreático de un diámetro inferior a 3mm, que presentan un riesgo elevado de fracaso de la anastomosis pancreaticoentérica.
Estudios prospectivos aleatorizados que comparan la pancreaticoyeyunostomía con la pancreaticogastrostomía
| Pancreaticoduodenectomía | Pancreaticoyeyunostomía | Pancreaticogastrostomía | |
| Yeo et al.40 (1995): un solo centro | Whipple (18%), PDPP (82%) | 72 pacientes, término-terminal o término-lateral | 73 pacientes, pared gástrica posterior, (2,5-3cm tamaño) |
| Bassi et al.41(2005): un solo centro | Whipple 10%), PDPP (90%) | 82 pacientes ducto-mucosa o un plano término-lateral | 69 pacientes, telescopaje deremanente pancreático en la cavidad gástrica |
| Duffas et al.42 (2005): 14 centros | Preferencias cirujano, Whipple (75%), PDPP (25%) | 68 pacientes, término-terminal o término-lateral | 81 pacientes, no descrita |
| Fernández-Cruz et al.34 (2008): un solo centro | PDPP (100%) | 55 pacientes, ducto-mucosa con stent | 53 pacientes, ducto-mucosa con partición gástrica con stent |
PDPP: pancreaticoduodenectomía con preservación pilórica.
La hemorragia postoperatoria postpancreatectomía (HPP) aparece con una frecuencia de entre el 5 y el16%7 y es una de las complicaciones más graves después de la cirugía pancreática, con una mortalidad que varía entre el 14 y el 54%43,44.
Un grupo internacional de cirujanos (ISGPS), formado por especialistas de centros con un gran volumen de pacientes y con una dilatada experiencia en cirugía pancreática, publicó en 200745 un documento que define esta complicación en base a unos criterios tales como el intervalo entre la cirugía y el inicio de la hemorragia, la localización, el grado de gravedad y el impacto clínico de la complicación. En relación con intervalo de aparición de la HPP se distingue: la hemorragia precoz durante las primeras 24 horas del postoperatorio, y más allá de las 24 horas y generalmente varios días e incluso semanas después de la intervención. La hemorragia precoz estaría más relacionada con un fallo de la hemostasia quirúrgica o con una coagulopatía perioperatoria. La hemorragia postpancreatectomía tardía (HPPT) está asociada a complicaciones postoperatorias (fístula pancreática, abscesos intrabdominales, decúbitos de los drenajes, etc.), y muchas veces es secundaria a la erosión de una arteria peripancreática asociada o no a la formación de un pseudoaneurisma46–48. Según la localización, la HPP puede presentarse intraluminal o digestiva de origen en las áreas donde se han practicado las anastomosis, por erosiones gástricas o duodenales, etc., y extraluminal o intraabdominal por causas relacionadas con una hemostasia defectuosa en el lecho quirúrgico. Según la gravedad, la HPP puede ser leve-moderada o grave. La HPP leve-moderada se define cuando hay una caída de la concentración de hemoglobina inferior a 3 gr/dl, acompañada o no de un mínimo deterioro clínico; su tratamiento solo necesita de fluidoterapia o una trasfusión de 2-3 concentrados de hematíes, y la grave cuando hay una mayor pérdida de volumen sanguíneo, con un deterioro clínico evidente que precisa de un tratamiento agresivo mediante una reintervención o la utilización de una arteriografía intervencionista. Estas definiciones permiten distinguir tres grados de HPP (A, B y C) que tienen en cuenta el intervalo de aparición de la hemorragia, la localización, la gravedad y la repercusión clínica. El grado A constituye una variación mínima en el curso postoperatorio sin un retraso en el alta hospitalaria; el grado B requiere un ajuste en el tratamiento habitual (trasfusión, ingreso en una unidad de cuidados intermedios e incluso una intervención agresiva) que prolongará la estancia postoperatoria; en el grado C las consecuencias son más graves incluso con riesgo para la vida del paciente, por lo que es necesaria una estancia prolongada en la UCI.
La HPP precoz tiene mejor pronóstico que la HPP tardía. Esta última tiene una incidencia de entre un 3 y un 10%y una elevada morbimortalidad49–51 con frecuencia secundaria a una erosión arterial o a la rotura de un pseudoaneurisma. Está relacionada casi en el 100% de los casos con la presencia de una fístula pancreática o un proceso séptico local43. Probablemente hay también otras circunstancias que predisponen a la hemorragia tardía: las linfadenectomías extensas las resecciones por cáncer con una gran exposición de las arterias viscerales del área, las ligaduras de muñones arteriales excesivamente ajustadas, un remanente pancreático normal con secreción de un jugo pancreático muy corrosivo y el tratamiento quimiorradioterápico neoadyuvante. Los vasos implicados, con mayor frecuencia, son el muñón de la arteria gastroduodenal y los muñones de las ramas de las arterias pancreático duodenales. No obstante cualquier arteria visceral del área quirúrgica puede ser también el origen de la hemorragia. Algunos autores recomiendan dejar el muñón de la arteria gastroduodenal largo y también ampliar hacia la izquierda la resección pancreática para que los troncos vasculares se encuentren lo suficientemente alejados en el caso de una fístula pancreática. Esta HPPT se relaciona con la hemorragia centinela, que se define como una hemorragia discreta o leve a través de los drenajes y/o a través de la herida quirúrgica que precede en un periodo de unas 10-12 horas (en ocasiones incluso días) a una hemorragia más grave que puede conducir a un shock50,52,53. La HPP también puede manifestarse como una hemorragia digestiva que se produce cuando el hematoma o la hemorragia se evacuan a través de una dehiscencia anastomótica frecuentemente la pancreaticoentérica.
La realización de un TAC multidetector (TCMD) es la prueba más sensible para el diagnóstico y localización de la lesión sangrante tras una HPPT en pacientes estabilizados. Posteriormente se realizará una arteriografía dirigida que nos ofrecerá un diagnóstico más preciso, y permitirá realizar una embolización terapéutica47.
El tratamiento de la HPPT se debate entre una cirugía urgente y la utilización de la arteriografía intervencionista. La ligadura del vaso sangrante no está exenta de riesgos y se asocia a una elevada morbilidad. De la experiencia de De Castro et al.54 se concluye que el tratamiento quirúrgico es el mejor tratamiento. Blanc et al.44 obtuvieron buenos resultados en 5 pacientes que presentaban pseudoaneurismas, y que fueron tratados con un control vascular (ligadura) y con una resección pancreática preservando la cola. Aunque otras experiencias tienen unos resultados más desalentadores con una mortalidad del 63%52 de los casos. Mayoritariamente, esta mortalidad está relacionada con la necesidad de completar la pancreatectomía por una dehiscencia grave de la anastomosis pancreaticoentérica54,55. Otra opción menos agresiva y que se acompaña de buenos resultados, es la limpieza de los tejidos necróticos y colocación de drenajes en el área del remanente pancreático44,47. Yekebas et al.43 proponen la reconstrucción arterial completando la pancreatectomía en aquellos casos que no presenten un proceso séptico peri-pancreático grave. El tratamiento quirúrgico sigue siendo una opción para los pacientes en los que ha fracasado la arteriografía intervencionista.
No obstante, la embolización debe ser el procedimiento inicial que en unos casos será el tratamiento definitivo, y en otros permitirá estabilizar al paciente para una posible reintervención48. Las complicaciones potenciales de la embolización se relacionan con la oclusión de la vascularización del hígado, bazo o intestino. Esta práctica puede asociarse en algunos casos a un desenlace fatal de los pacientes por insuficiencia hepática secundaria a una isquemia hepática45,53. Es preferible la colocación de una prótesis recubierta en los casos en que la embolización selectiva del muñón de la arteria gastroduodenal no es posible, o en las situaciones en que para conseguir la hemostasia mediante embolización podríamos comprometer la irrigación del hígado o del intestino. La finalidad de esta prótesis sería recubrir en unos casos el origen del pseudoaneurisma o en otros la erosión vascular manteniendo el flujo vascular, evitando las complicaciones isquémicas45,56,57. Yekebas et al.43 en un análisis de una larga serie comunican una eficacia del 80% con la arteriografía intervencionista. Algunos autores recomiendan la arteriografía sistemática como primera exploración ante una hemorragia centinela, lo que permite el tratamiento endovascular de la lesión, antes de que se manifieste como una hemorragia masiva58. La mortalidad después de una embolización está con frecuencia más relacionada con el estado del paciente que con el procedimiento.
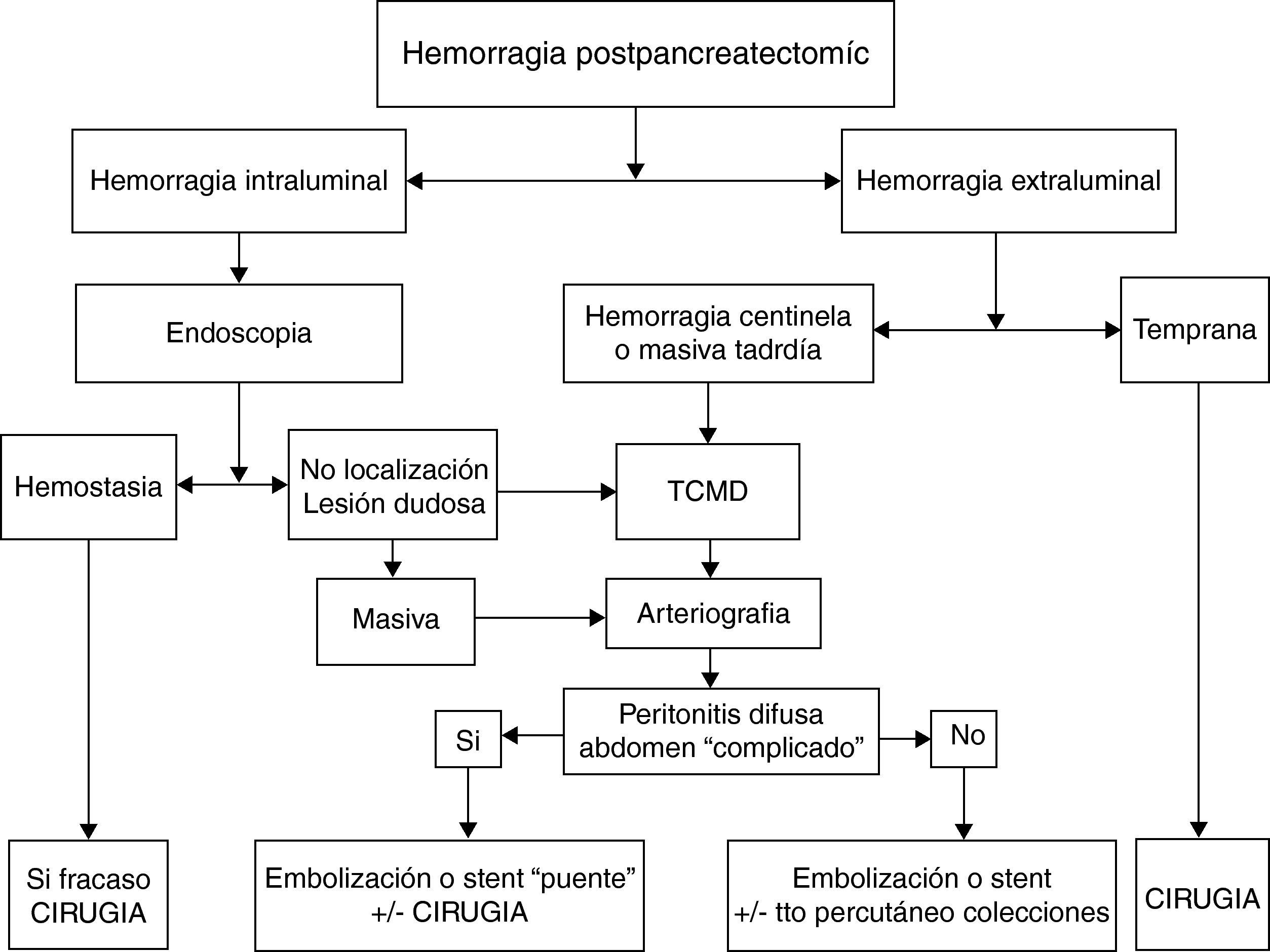
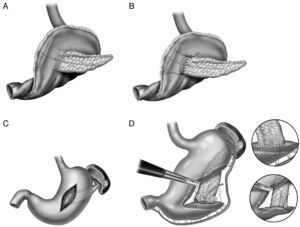
En un metaanálisis recientemente publicado para determinar cuál de las dos opciones terapéuticas (cirugía vs arteriografía intervencionista) es la mejor en el tratamiento de la HPPT49, la arteriografía intervencionista tiene menos complicaciones que la cirugía (36 vs 70%) y menos mortalidad (21 vs 43%), si bien las diferencias no fueron significativas. Basándonos en estos resultados el tratamiento de la HPPT dependería de la gravedad clínica de la complicación, siendo el tratamiento endovascular la primera opción terapéutica y reservando la cirugía para el fracaso de esta o bien para aquellos casos que presentan otras complicaciones graves. Cuando se produce una hemorragia centinela, se debería realizar un TCMD y según los hallazgos se practicará un tratamiento endovascular; si este tratamiento fracasa, estará indicada una reintervención (fig. 3).
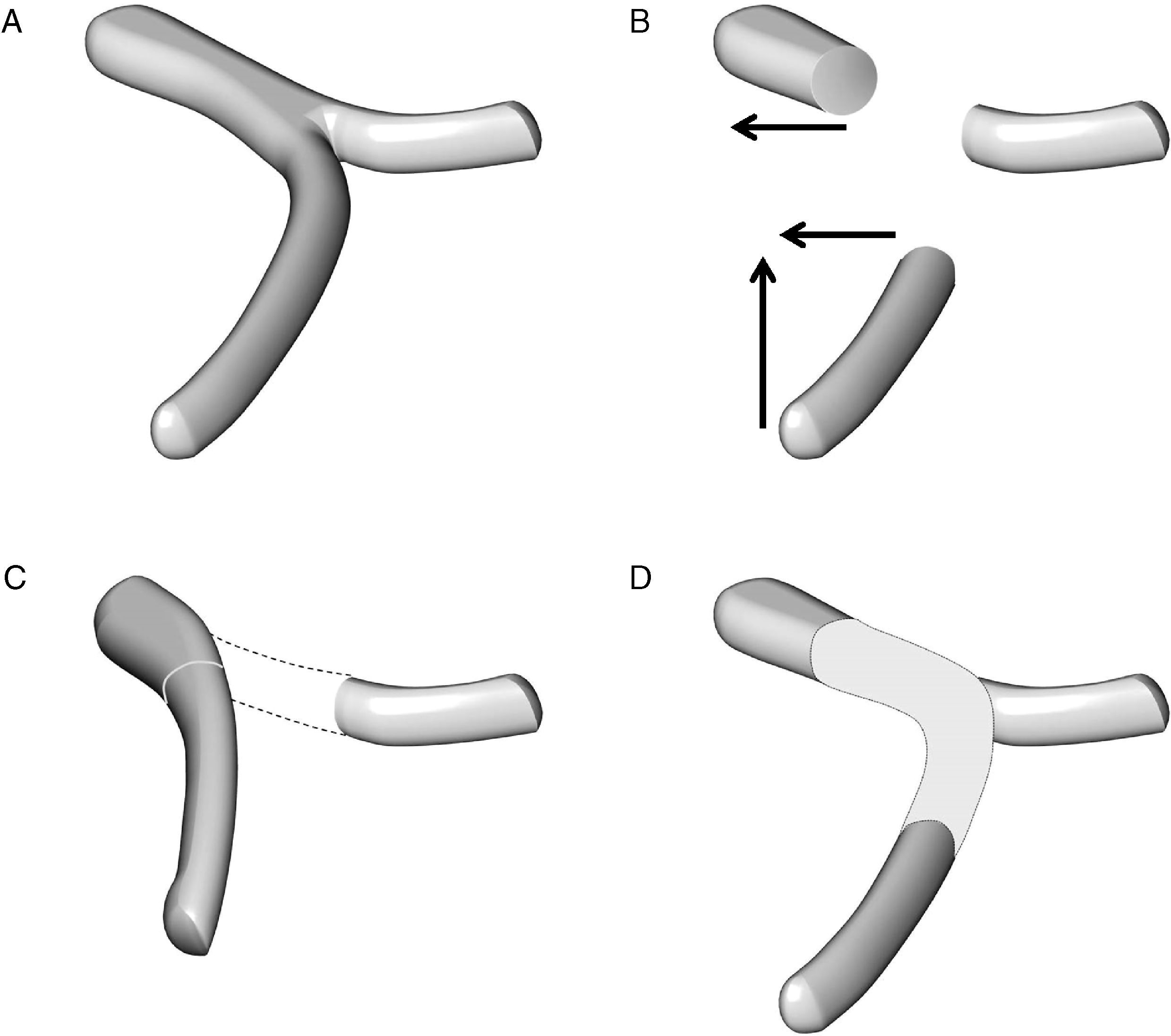
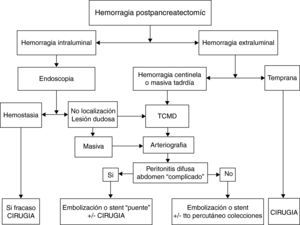
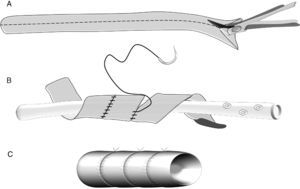
Complicaciones después de una reconstrucción vascularEn pacientes con cáncer de páncreas la PD asociada a resección vascular venosa (segmento del tronco mesentérico portal) y más raramente arterial (segmento de la arteria mesentérica superior) puede estar indicada en casos seleccionados para conseguir una cirugía Ro59–64. Sin embargo este objetivo solo estará justificado cuando la morbilidad de la intervención no interfiera en la recuperación de los pacientes que en un tiempo adecuado deberán recibir el tratamiento oncológico. Durante el periodo comprendido entre 1987 y 2010 Boggi realizó un estudio sobre las complicaciones postoperatorias y de la supervivencia de los pacientes en 231 resecciones pancreáticas con resección vascular por cáncer de páncreas. En 167 pacientes se resecó un segmento venoso (RSV), en 64 pacientes un segmento arterial (RSA), y en 25 pacientes se combinó la resección de segmentos venosos y arteriales (RSV+RSA). La morbilidad y la mortalidad globales fueron del 42,8 y del 7,3% respectivamente. La morbilidad y la mortalidad para el tipo de resección vascular RSV, RSA, RSV+RSA fueron del 38,9, 6,5 y 52% y 4, 53,8 y 12,8% respectivamente. La mortalidad fue superior en pacientes después de una pancreatectomía total (13,5%) comparada con la de los pacientes después de PD (4,8%). En la tabla 5 se presentan las complicaciones específicas con relación al tipo de resección vascular realizada. En estos resultados destaca que la aparición de complicaciones postoperatorias es mayor cuando la PD se asocia a una RSA en comparación con la PD+RSV; que el porcentaje global de trombosis ligada a la utilización de injertos vasculares fue relativamente bajo (2,2%). Al respecto Boggi señala que el riesgo de complicaciones sépticas intraabdominales después de una PD no aconseja la utilización de prótesis para la reconstrucción vascular. Cuando es necesaria la RSV la movilización del intestino es suficiente para llegar, sin tensión, al segmento venoso proximal (fig. 4). No obstante si la RSV es larga incluyendo la unión espleno-mesentérica se hace necesaria la utilización de injertos vasculares del tipo de una vena yugular izquierda, o la reconstrucción en espiral de la vena safena (fig. 5). Es recomendable la reconstrucción vascular entre la vena esplénica y el injerto de unión mesentérica-portal. Cuando se trata de la RSA, la continuidad de la arteria mesentérica superior puede realizarse con un segmento de la arteria iliaca interna. Cuando se realiza una pancreatectomía total la reconstrucción vascular podría realizarse con un segmento de la arteria esplénica. En la experiencia de Boggi, la supervivencia de los pacientes a 1, 3 y 5 años con cáncer de páncreas y resección vascular no fue estadísticamente diferente en aquellos pacientes que tuvieron complicaciones postoperatorias (29, 9, y 4%) de aquellos que cursaron con un postoperatorio sin consecuencias (61, 5, 4%). Recientemente ha sido publicada una revisión que abarca el periodo comprendido entre 1995 y 2009 sobre un total de 1.458 pacientes con cáncer de páncreas a los que se practicó una PD extendida con resección vascular. La mortalidad mediana de los pacientes fue del 4%, y los porcentajes de resecciones Ro y R fueron del 75 y 25% respectivamente. La supervivencia media de este grupo fue del 15%63. En esta revisión la mayor parte de las resecciones vasculares fueron venosas. En estos últimos años han sido publicados los resultados de la PD con resección de segmentos arteriales, de la arteria hepática, de la arteria mesentérica superior e incluso del tronco celíaco en pacientes con cáncer de páncreas; la supervivencia media de estos pacientes oscila entre 17 y 20 meses, resultados que no difieren de los esperados después de una PD estándar65–67.
Complicaciones postoperatorias después de resección vascular
| Complicación | RV | RA | RV+RA | Total | ||||
| n | % | n | % | n | % | n | % | |
| Fístula pancreática (grados A y B) | 15 | 12,2 | 4 | 17,4 | 0 | - | 19 | 11,9 |
| Fístula pancreática (grado C) | 3 | 2,4 | 1 | 4,3 | 1 | 9 | 5 | 3,1 |
| Fístula biliar | 0 | - | 1 | 12,5 | 0 | - | 1 | 0,5 |
| Fístula intestinal | 1 | 0,6 | 1 | 4 | 1 | 2,6 | 3 | 1,3 |
| Retraso en el vaciamiento gástrico | 22 | 13,2 | 5 | 20 | 6 | 15,4 | 33 | 14,3 |
| Hemorragia intraabdominal | 4 | 2,4 | 1 | 4 | 6 | 15,4 | 11 | 4,8 |
| Hemorragia gastrointestinal | 4 | 2,4 | 0 | - | 1 | 2,6 | 5 | 2,2 |
| Colecciones abdominales | 5 | 2,9 | 3 | 12 | 3 | 7,7 | 11 | 4,8 |
| Trombosis del injerto | 2 | 1,2 | 1 | 4 | 2 | 5,1 | 5 | 2,2 |
| Complicaciones médicas | 1 | 0,6 | 2 | 8 | 3 | 7,7 | 6 | 2,6 |
| Mortalidad | 11 | 6,5 | 1 | 4 | 4 | 12,8 | 17 | 7,3 |
| Morbilidad | 65 | 38,9 | 13 | 52 | 52 | 53,8 | 99 | 42,8 |
RA: resección arterial; RV: resección venosa.
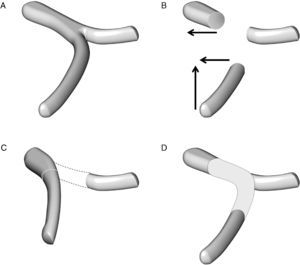
Técnica de reconstrucción vascular en el caso de una resección de un segmento de la vena mesentérica superior y de la unión entre la vena esplénica y la vena porta: A) anatomía esplenomesentérica-porta. B) movilización de la vena mesentérica superior en sentido craneal y de la vena porta en sentido lateral. C) la reconstrucción mesentérico-portal es casi siempre factible pero la vena esplénica no puede anastomosarse al segmento vascular reconstruido. D) la reconstrucción vascular de la vena esplénica puede hacerse con la colocación de un injerto vascular.
Los autores declaran no tener ningún conflicto de intereses.