Staphylococcus lugdunensis es un estafilococo coagulasa negativo relacionado con diversos tipos de infección. En este trabajo se presentan los resultados de un estudio comparativo mediante cuatro métodos para determinar la sensibilidad a oxacilina y penicilina.
Material y métodosse estudiaron 60 aislamientos de S. lugdunensis procedentes de muestras clínicas enviadas a nuestro laboratorio durante 8 años. Todos los aislados fueron coagulasa y DNasa negativos. La identificación se realizó bioquímicamente mediante API ID 32 STAPH (bioMérieux). En todos los casos se analizó la presencia de betalactamasa y la detección del gen mecA. La susceptibilidad antimicrobiana se determinó mediante: Vitek 2 System (bioMérieux) y microdilución en caldo (Wider) (Soria Melguizo) para oxacilina y penicilina; E-test (AB Biodisk) y método de difusión con disco de cefoxitina (BD BBLTM), para ensayar la sensibilidad a oxacilina.
Resultadostodos los aislamientos fueron mecA negativos y sensibles a oxacilina en microdilución en caldo, E-test y en el método de difusión con cefoxitina, mientras que en Vitek 2 solamente dos aislamientos fueron resistentes a oxacilina; 24 (40%) fueron betalactamasa positivos, 4 tras inducción. Los resultados de susceptibilidad a penicilina mostraron que 48 aislamientos presentaban concordancia entre los obtenidos por microdilución en caldo y Vitek 2, pero 12 (20%) mostraron resultados discrepantes.
Conclusionesen nuestro estudio no hemos hallado ningún aislamiento de S. lugdunensis resistente a oxacilina; los métodos de microdilución en caldo (Wider), E-test de oxacilina y difusión con disco de cefoxitina son adecuados para el estudio de sensibilidad a este antibiótico. El empleo del sistema Vitek 2 es útil para el estudio de la sensibilidad a penicilina si se aplica la prueba de betalactamasa a los aislamientos con concentración mínima inhibitoria (CMI) de 0,25μg/ml para evitar la interpretación de una falsa resistencia a dicho antibiótico.
Staphylococcus lugdunensis is a coagulase-negative staphylococcus associated with a variety of clinical infections. In this paper we present the results of a comparative study using 4 methods to determine antimicrobial susceptibility to oxacillin and penicillin in 60 S. lugdunensis isolates.
Material and methodsWe studied 60 S. lugdunensis isolates obtained from clinical specimens sent to our laboratory over an 8-year period. All isolates were free coagulase-negative and DNase-negative, and biochemically identified by API ID 32 STAPH (bioMérieux). Presence of mecA and ß-lactamase production were studied in all cases. Antimicrobial susceptibility was determined by the Vitek 2 System (bioMérieux) and broth microdilution (Wider) (Soria Melguizo) for penicillin and oxacillin, and the E-test (AB Biodisk) and cefoxitin disk diffusion test (BD BBLTM) for oxacillin.
ResultsAll isolates lacked the mecA gene and were susceptible to oxacillin by broth microdilution, E-test, and cefoxitin disk diffusion test. Only two isolates were oxacillin-resistant by the Vitek 2 System. Twenty-four isolates (40%) were ß-lactamase-positive, 4 after induction. Susceptibility testing to penicillin determined that 48 isolates showed concordance between the results obtained by broth microdilution and Vitek 2, but 12 isolates (20%), showed divergent results.
ConclusionsWe detected no resistance to oxacillin in S. lugdunensis. All the methods evaluated were adequate for determining oxacillin resistance. The Vitek 2 System is useful for detecting penicillin resistance, but the ß-lactamase test should be applied to isolates with a MIC=0.25μg/ml to avoid the interpretation of false resistance to this antibiotic.
Staphylococcus lugdunensis se ha mostrado, desde su descripción en 1988, como uno de los estafilococos coagulasa negativos con mayor capacidad patógena1. Desde entonces se ha estudiado la sensibilidad frente a diversos antimicrobianos de algunas series de aislados, sobre todo, con los métodos de dilución en agar2,3 y microdilución en caldo4,5, y sólo en contadas ocasiones se han hecho estudios comparativos entre diversas técnicas6–8. El estudio de la sensibilidad a penicilina se ha determinado mediante el empleo de la prueba de betalactamasa, tras inducción o no, con resultados diversos. Asimismo, se ha analizado, en algunos casos, la utilidad de diversos sistemas comerciales automatizados7,9–12, aunque generalmente se han analizado series de estafilococos coagulasa negativos con escasa representación de S. lugdunensis.
El objetivo de nuestro estudio es analizar y comparar la sensibilidad a penicilina y oxacilina de 60 aislamientos clínicos de S. lugdunensis mediante cuatro métodos de sensibilidad antimicrobiana.
Material y metodosAislamientos bacterianosSe estudiaron 60 aislamientos de S. lugdunensis recopilados durante un período comprendido entre 1999 y 2007. Estos aislados procedían de diversos tipos de muestras clínicas (líquidos orgánicos y exudados de piel y tejidos blandos) obtenidos de 58 pacientes atendidos en el área de salud del Hospital Nuestra Señora de Candelaria de Santa Cruz de Tenerife.
Los aislamientos fueron conservados a una temperatura de −80°C en viales estériles Microbank™ (ProLab Diagnostics, Richmond Hill, Ontario, Canadá), subcultivados en placas de Agar Columbia +5% de sangre de cordero (bioMérieux, Marcy I’Ètoile, Francia) e incubados a 37°C durante 24h en atmósfera de aerobiosis.
Cepas controlLas cepas de control utilizadas fueron S. lugdunensis ATCC 43809 y S. aureus ATCC 25923.
Métodos de identificación de especieLa identificación fenotípica se realizó mediante tinción de Gram, producción de catalasa, actividad de desoxirribonucleasa, producción de coagulasa en tubo (BD BBLTM Coagulase Plasma, Becton Dickinson, Maryland, Estados Unidos), pirrolidonilarilamidasa (PYR) (Oxoid, Inglaterra) y galería API ID 32 Staph (bioMérieux, Marcy I’Ètoile, Francia).
Métodos de estudio de susceptibilidad antimicrobiana a oxacilina y penicilinaLas pruebas de susceptibilidad se realizaron a partir de cultivos incubados durante 18–24h. Los métodos empleados fueron:
A. Sistema automático Vitek 2, tarjetas AST P523 y AST P536 (bioMérieux, Marcy I’Ètoile, Francia); intervalo de concentración mínima inhibitoria (CMI): penicilina, ⩽0,03–⩾0,5μg/ml; oxacilina, 0,25–4μg/ml (la casa comercial sustituyó la tarjeta AST P523 por la AST P536, con las mismas concentraciones de CMI para penicilina y oxacilina).
B. Microdilución (MIC) en caldo con sistema semiautomático Wider mediante panel MIC grampositivos (Soria Melguizo, España); intervalo de CMI: penicilina, 0,06–8μg/ml; oxacilina, 0,25–4μg/ml.
C. E-test de oxacilina (AB Biodisk, Suecia): intervalo de CMI, 0,016–256μg/ml; la lectura se realizó a las 24 y las 48h.
D. Método de difusión con disco de 30μg de cefoxitina (BD BBLTM, Becton Dickinson, Maryland, Estados Unidos).
Para determinar la susceptibilidad a penicilina se utilizaron los métodos A, B y prueba de betalactamasa como método de referencia. La sensibilidad a oxacilina se determinó mediante los cuatro métodos antes descritos.
Los métodos A, B y C se realizaron según las normas del fabricante.
Los resultados fueron interpretados aplicando los criterios CLSI 2007 (CMI oxacilina, ⩽2μg/ml, ⩾4μg/ml; CMI penicilina, ⩽0,12μg/ml, ⩾0,25μg/ml; halos de inhibición cefoxitina, ⩽21mm, ⩾22mm)13.
Se valoró la presencia del gen mecA en los 60 aislamientos como método de referencia para detrminar la resistencia a oxacilina, para lo cual se empleó una PCR previamente validada14.
Estudio de producción de betalactamasaEn todos los aislamientos se determinó la producción de betalactamasa mediante cefalosporinasa cromogénica (Nitrocefín) (Cefinase, Becton Dickinson, Estados Unidos). En los casos en que se observaron valores de CMI resistentes a penicilina, en Vitek 2 o MIC caldo, y con betalactamasa inicial negativa, se repitió la prueba tras inducción con oxacilina6.
Análisis estadístico de los resultadosPara las comparaciones de las CMI obtenidas entre los métodos de susceptibilidad se emplea la prueba de Kruskal-Wallis y, de haber diferencia, el método frente a método con la prueba U de Mann-Whitney. Para las comparaciones de las proporciones de resistencia obtenidas con cada método se emplea la prueba de la χ2 de Pearson. Todas las pruebas de contraste de hipótesis son bilaterales a un nivel de significación estadística de 0,05 y los cálculos se realizan con el paquete de ordenador SPSS 15.0.
ResultadosSusceptibilidad a oxacilinaTodos los aislamientos fueron sensibles en MIC en caldo (B); se obtuvieron unos valores de CMI comprendidos entre ⩽0,25μg/ml y 1μg/ml; también fueron sensibles en el E-test de oxacilina (C) con CMI entre 0,094 y 0,75μg/ml, sin variaciones significativas en la lectura de los resultados a las 24 y las 48h de incubación, así como en el método de difusión con disco de cefoxitina (D) con unos halos de inhibición entre 29 y 35mm. La sensibilidad de estos tres métodos fue del 100%, así como la concordancia entre ellos.
Mediante el sistema Vitek 2, 58 de los 60 aislamientos mostraron valores de CMI entre ⩽0,25μg/ml y 2μg/ml, con una sensibilidad del 96,8%. Los dos aislamientos restantes que resultaron ser resistentes en Vitek 2 (ambos con CMI ⩾4μg/ml) fueron sensibles en MIC en caldo (⩽0,25μg/ml y 1μg/ml, respectivamente), en E-test de oxacilina (0,38μg/ml y 0,25μg/ml) y en el método de difusión con disco de cefoxitina (33 y 32mm). Ambos fueron betalactamasa positivos y resistentes a penicilina.
Se observa una tendencia en los valores de CMI al comparar los resultados entre las pruebas. En el 64% de las determinaciones el sistema Vitek 2 produce valores de CMI mayores que los obtenidos en MIC en caldo, que llegan a alcanzar 1,75μg/ml, y en el 97%, superiores a E-test, con una diferencia de 1,88μg/ml, mientras las CMI obtenidas con MIC en caldo exceden a las del E-test en el 95% de aislamientos, que llegan a alcanzar una diferencia de hasta 0,88μg/ml. Todas estas tendencias alcanzan la significación estadística (p<0,001).
PCR para el gen mecATodos aislamientos fueron mecA negativos.
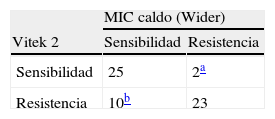
Susceptibilidad a penicilina y producción de betalactamasaLos resultados de susceptibilidad a penicilina obtenidos en el sistema Vitek 2 y en MIC en caldo se recogen en la tabla 1.
Veinticinco aislamientos (41%) fueron sensibles tanto con el sistema Vitek 2 (CMI, 0,03–0,12μg/ml) como con el método de MIC en caldo (0,06–0,12μg/ml), todos fueron betalactamasa negativos; 23 (38%) se mostraron resistentes por ambos métodos (Vitek 2, 0,25–0,5μg/ml, sensibilidad del 96%; MIC caldo, 0,5–>8μg/ml, 100% de sensibilidad) y todos fueron betalactamasa positivos. La concordancia entre el sistema Vitek 2 y la MIC en caldo alcanza el 79%.
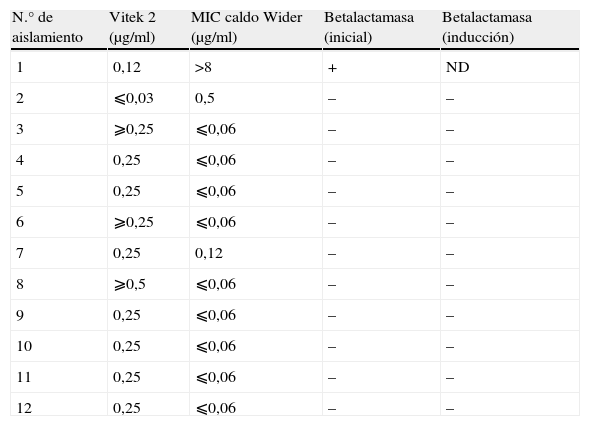
En 12 (20%) casos se observaron discrepancias en los valores de CMI entre los dos métodos (tabla 2). Todos los aislamientos con resultados discrepantes fueron reanalizados, con los mismos resultados.
Discrepancias en los resultados de CMI para penicilina entre los sistemas Vitek 2 y microdilución en caldo (Wider)
| N.° de aislamiento | Vitek 2 (μg/ml) | MIC caldo Wider (μg/ml) | Betalactamasa (inicial) | Betalactamasa (inducción) |
| 1 | 0,12 | >8 | + | ND |
| 2 | ⩽0,03 | 0,5 | – | – |
| 3 | ⩾0,25 | ⩽0,06 | – | – |
| 4 | 0,25 | ⩽0,06 | – | – |
| 5 | 0,25 | ⩽0,06 | – | – |
| 6 | ⩾0,25 | ⩽0,06 | – | – |
| 7 | 0,25 | 0,12 | – | – |
| 8 | ⩾0,5 | ⩽0,06 | – | – |
| 9 | 0,25 | ⩽0,06 | – | – |
| 10 | 0,25 | ⩽0,06 | – | – |
| 11 | 0,25 | ⩽0,06 | – | – |
| 12 | 0,25 | ⩽0,06 | – | – |
ND: no determinada.
En el 41% de los aislamientos la prueba Vitek ofrece valores de CMI que superan los de MIC en caldo, estas diferencias llegan a alcanzar valores de 0,19μg/ml, con significación estadística (p<0,001).
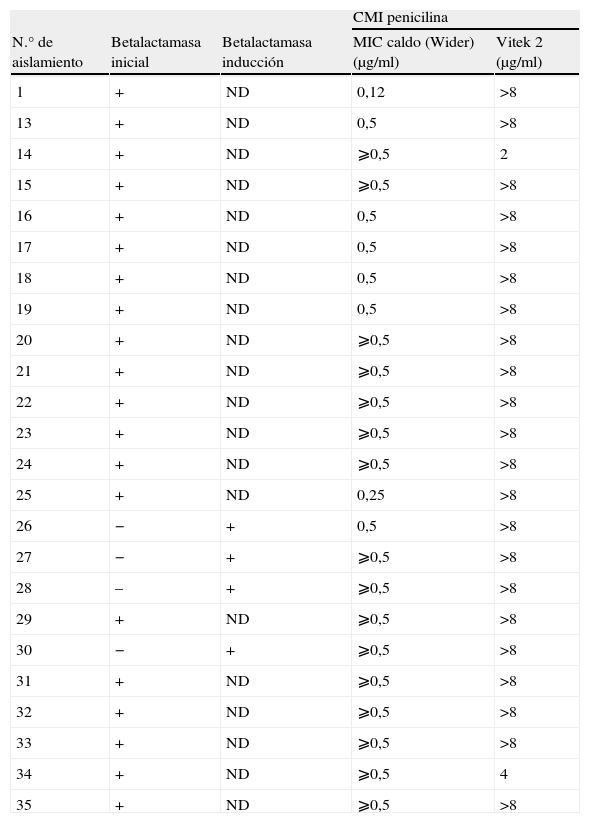
De los 60 aislamientos, 20 fueron betalactamasa positivos inicialmente, todos resistentes a penicilina (CMI, 2–>8μg/ml en MIC en caldo; 0,25–⩾0,5μg/ml en Vitek 2).
En 15 casos se repitió la prueba de betalactamasa mediante inducción con oxacilina, de los cuales cuatro resultaron ser positivos y resistentes a penicilina por ambos métodos (CMI >8μg/ml en MIC en caldo y⩾0,5μg/ml en Vitek 2) (aislamientos n.° 26, 27, 28, 30; tabla 3), mientras que los 11 restantes, representados en la tabla 2 (aislamientos n.° 2 a 12), tuvieron una prueba negativa.
Relación de aislamientos de S. lugdunensis con prueba de betalactamasa positiva
| CMI penicilina | ||||
| N.° de aislamiento | Betalactamasa inicial | Betalactamasa inducción | MIC caldo (Wider) (μg/ml) | Vitek 2 (μg/ml) |
| 1 | + | ND | 0,12 | >8 |
| 13 | + | ND | 0,5 | >8 |
| 14 | + | ND | ⩾0,5 | 2 |
| 15 | + | ND | ⩾0,5 | >8 |
| 16 | + | ND | 0,5 | >8 |
| 17 | + | ND | 0,5 | >8 |
| 18 | + | ND | 0,5 | >8 |
| 19 | + | ND | 0,5 | >8 |
| 20 | + | ND | ⩾0,5 | >8 |
| 21 | + | ND | ⩾0,5 | >8 |
| 22 | + | ND | ⩾0,5 | >8 |
| 23 | + | ND | ⩾0,5 | >8 |
| 24 | + | ND | ⩾0,5 | >8 |
| 25 | + | ND | 0,25 | >8 |
| 26 | − | + | 0,5 | >8 |
| 27 | − | + | ⩾0,5 | >8 |
| 28 | – | + | ⩾0,5 | >8 |
| 29 | + | ND | ⩾0,5 | >8 |
| 30 | − | + | ⩾0,5 | >8 |
| 31 | + | ND | ⩾0,5 | >8 |
| 32 | + | ND | ⩾0,5 | >8 |
| 33 | + | ND | ⩾0,5 | >8 |
| 34 | + | ND | ⩾0,5 | 4 |
| 35 | + | ND | ⩾0,5 | >8 |
CMI: concentración mínima inhibitoria; ND: no determinada.
En total, se detectó producción de betalactamasa en 24 (40%) casos, todos ellos resistentes a penicilina (tabla 3).
DiscusiónEn los últimos años, las normas de interpretación de resultados obtenidos en pruebas de sensibilidad antimicrobiana, han sufrido diversas modificaciones en relación con los estafilococos, especialmente S. aureus y S. lugdunensis (NCCLS hasta el año 2004 y CLSI a partir de dicho año).
Hasta el año 2004, las normas para el estudio de sensibilidad a oxacilina y penicilina de aislados de S. lugdunensis se asimilaban a las establecidas para el conjunto de los estafilococos coagulasa negativos (ECN)15.
Tras el hallazgo, en diversos estudios3,12,16, de discrepancias entre los resultados de resistencia a oxacilina y ausencia del gen mecA en distintas especies de ECN, entre los que se incluía S. lugdunensis, se propuso asimilar la interpretación de los resultados de S. lugdunensis a los de S. aureus, de forma que una CMI ⩽2μg/ml determina la sensibilidad a oxacilina y una CMI ⩾4μg/ml, la resistencia17. Además, en 2006 se recomendó el empleo del método de difusión con disco de 30μg de cefoxitina18 en vez del disco de oxacilina para la detección de resistencia a oxacilina en S. lugdunensis, y en 2007, se modificó la medida del halo de lectura del disco de cefoxitina de 20 a 22mm13.
Ninguno de los aislamientos estudiados en nuestro trabajo presentaba el gen mecA. En la literatura inglesa solamente se hallan referidos dos aislamientos de S. lugdunensis mecA positivos; uno de ellos relacionado con una bacteriemia por catéter (caracterizado por PCR y con una CMI a oxacilina >256μg/ml en E-test)19. El otro mostraba un resultado sensible en el método de dilución en agar con cefoxitina, aunque sí era resistente en el mismo método con oxacilina (no se indicaba CMI)20.
Mateo et al7 usaron el método Vitek 2 para estudiar una serie de 17 aislamientos de S. lugdunensis; hallaron que 13 de de ellos presentaban valores de CMI entre 0,5 y 2μg/ml, pero eran mecA negativos, lo que coincidía con los resultados referidos por otros autores10,11,16 puesto que se aplicaban las normas vigentes hasta el año 200415.
En este estudio se hallaron dos aislamientos con CMI ⩾4μg/ml mediante el sistema Vitek 2, que luego no se confirmaron por MIC en caldo ni presentaban el gen mecA, lo que determinó que se trataba de una falsa resistencia.
Tanto el método de difusión con disco de cefoxitina como el E-test mostraron resultados de sensibilidad a oxacilina en todos los aislados, concordantes con el método de MIC en caldo.
Por otra parte, las normas de interpretación para la lectura de resultados de sensibilidad a penicilina en estafilococos han permanecido estables desde 2004 hasta hoy (CLSI 2007), de forma que son sensibles aquellos con CMI ⩽0,12μg/ml y resistentes los de CMI ⩾0,25μg/ml. Las normas actuales indican que los aislamientos de S. aureus resistentes a penicilina son productores de betalactamasa y los que tienen una CMI ⩽0,03μg/ml son betalactamasa negativos, por otra parte, en los casos con CMI entre 0,06 y 0,12μg/ml se recomienda hacer la prueba de inducción de betalactamasa.
Para analizar los resultados de sensibilidad a penicilina obtenidos en nuestro trabajo hemos aplicado estas normas a los aislamientos de S. lugdunensis incluidos en este estudio, teniendo en cuenta que en esta especie no se considera de modo específico la interpretación de los resultados de los ensayos con penicilina.
De esta forma, hallamos que un 40% de nuestros aislamientos eran productores de betalactamasa, lo que supone un mayor porcentaje que el referido por otros autores4–9, esto podría atribuirse a una cuestión epidemiológica, aunque hay que tener en cuenta que en el presente trabajo no se ha estudiado la relación clonal de los aislamientos. Por otra parte, la prueba de inducción con oxacilina ha sido poco utilizada6,9, aunque en nuestro trabajo sólo cuatro aislados dieron resultado positivo tras la aplicación de esta prueba.
De los dos aislamientos sensibles a penicilina en Vitek 2 y resistentes en MIC caldo, uno era productor de betalactamasa, lo que podría explicar este resultado, pero el segundo resultó ser betalactamasa negativo incluso tras inducción, lo que permitiría pensar en un mecanismo de resistencia diferente. Otros 10 aislamientos con resultados discrepantes presentaron CMI cercanas al límite de sensibilidad en casi todos los casos (tabla 2).
Aunque se recomienda aplicar la prueba de betalactamasa tras inducción a los estafilococos con CMI a penicilina de 0,06–0,12μg/ml, todos los aislamientos incluidos en nuestro estudio que presentaron dichos valores de CMI fueron betalactamasa negativos, tal como señalan también Zbinden et al9. Además, los aislamientos resistentes a penicilina en Vitek 2 y sensibles en MIC en caldo (tabla 2) también fueron betalactamasa negativos, incluso tras inducción.
De los datos obtenidos en este trabajo, podríamos concluir que no hemos hallado ningún aislamiento resistente a oxacilina y que la producción de betalactamasa es una característica de frecuencia variable en S. lugdunensis. Por otra parte, la sensibilidad a oxacilina se puede estudiar de forma fiable por el sistema Vitek 2, el método E-test y el método de difusión con disco de 30μg de cefoxitina; este último es el método más sencillo y económico. En relación con los resultados de penicilina obtenidos mediante el sistema Vitek 2, podría proponerse la realización de una prueba de betalactamasa tras inducción en los aislamientos con CMI a penicilina ⩾0,25μg/ml, dado que se hallaron 9 (15%) aislamientos con este valor de CMI y todos fueron betalactamasa negativos, y según las normas CLSI se los habría considerado como resistentes.
En resumen, este trabajo ha tratado de establecer los métodos más adecuados para evaluar la resistencia a oxacilina y penicilina en S. lugdunensis, mediante el estudio de un número apreciable de aislamientos, aplicando las últimas normas del CLSI.
A Armando Aguirre Jaime (Metodología de la Investigación del Hospital Universitario Nuestra Señora de Candelaria).