describir las tendencias en la prescripción de antibióticos y analizar su posible relación con la evolución de la sensibilidad a antimicrobianos de los patógenos respiratorios aislados en el área de salud.
Material y métodosestudio descriptivo de la prescripción de antimicrobianos y evolución de las resistencias de Streptococcus pyogenes, Streptococcus pneumoniae y Haemophilus influenzae, desde 1996 hasta 2005. El consumo se expresa en dosis por 1.000 habitantes día (DHD). Para analizar las tendencias se utilizan pruebas de la χ2, pruebas exactas, coeficientes de correlación de Spearman y un análisis de series temporales.
Resultadosaislamos 1.301 cepas de S. pyogenes, todas sensibles a penicilina, con porcentajes de resistencia a eritromicina decreciente y a clindamicina creciente. Identificamos 579 cepas de neumococo, con descensos significativos de resistencia a penicilina, amoxicilina-clavulánico, cefotaxima y cefuroxima; las resistencias a eritromicina y azitromicina ascendieron los primeros años, y luego descendieron, aunque no significativamente. Aislamos 769 cepas de H. influenzae, todas sensibles a cefotaxima, altamente sensibles a amoxicilina-clavulánico y cefuroxima, con resistencias mantenidas a ampicilina y un significativo descenso de resistencia a azitromicina. Simultáneamente hay un descenso progresivo del consumo general de antibióticos (20,45 DHD en 1996; 18,90 DHD en 2005); la prescripción de penicilinas se mantiene, a expensas del aumento de la dosificación de amoxicilina-clavulánico; la de cefalosporinas y macrólidos desciende (excepto azitromicina), y aumenta la de fluoroquinolonas. Observamos una correlación significativa entre prescripción y resistencias.
Conclusionesencontramos una recuperación de la sensibilidad a antimicrobianos de los patógenos respiratorios coincidente con un descenso progresivo de la prescripción.
To describe the trends in prescribing antibiotics and analyze a possible relationship with the evolution of antimicrobial sensitivity in respiratory pathogens isolated in the health area of Zamora (Spain).
Materials and methodsDescriptive study investigating the prescription of antimicrobials and the evolution of resistance in Streptococcus pyogenes, Streptococcus pneumoniae and Haemophilus influenzae, from 1996 to 2005. Antibiotic use is expressed in doses per 1,000 inhabitants per day (DHD). The χ2 test, exact tests, Spearman correlation coefficients, and a time series analysis were used to analyze the trends.
ResultsA total of 1301 S. pyogenes strains were isolated. All were sensitive to penicillin, with decreasing percentages of resistance to erythromycin and increasing percentages of resistance to clindamycin. Among 579 pneumococcal strains isolated, a significant decreasing resistance to penicillin, amoxicillin-clavulanic, cefotaxime and cefuroxime was observed; resistance to erythromycin and azithromycin increased during the first few years, but decreased later. Among a total of 769 strains of H. influenzae, all were sensitive to cefotaxime and highly sensitive to amoxicillin-clavulanic acid and cefuroxime; resistance to ampicillin was maintained and there was a significant decreasing resistance to azithromycin. Simultaneously, there was a progressive decrease in overall antibiotic use (20.45 DHD in 1996; 18.90 DHD in 2005). Prescription of penicillins remained stable, with increased use of amoxicillin-clavulanic, decreased use of cephalosporins and macrolides (except azithromycin), and increased use of fluorquinolones. We observed a significant correlation between prescription and resistance.
ConclusionsA recovery of sensitivity to antibiotics was seen in respiratory pathogens parallel to a progressive decrease in prescription of antibiotics.
Los procesos infecciosos son las enfermedades agudas más frecuentes en atención primaria (AP)1–4, ya que suponen una de cada tres consultas de pacientes adultos y hasta el 75% de las consultas en pediatría5; las infecciones respiratorias son las más habituales y las que originan mayor prescripción de antimicrobianos6.
Los antibióticos constituyen un grupo farmacológico de enorme importancia, tanto por sus beneficios terapéuticos y clínicos como por el impacto social y económico de su empleo5. Según un estudio de la Sociedad Española de Quimioterapia, el 88% de los españoles reciben antibióticos al menos una vez al año5, que llega a suponer un 10–15% del total de la prescripción, tanto en número de envases como en gasto.
Se ha constatado que los problemas en el uso de antimicrobianos son: la sobreutilización, el uso innecesario (infecciones virales), el tratamiento empírico, la selección inadecuada del principio activo, la utilización de fármacos más nuevos y de mayor espectro, la duración y la pauta de tratamiento incorrecto, la automedicación y el incumplimiento terapéutico. Todo ello genera importantes problemas de salud pública, como aparición y desarrollo de resistencias bacterianas, fracasos terapéuticos, efectos indeseables, así como un aumento de la morbilidad y un coste económico importante3,5,7,8. Según una encuesta realizada en 1994 sobre pacientes vistos en atención primaria, se consideró inapropiadas más del 35% de las prescripciones de antibióticos3,9.
La resistencia bacteriana es un problema clínico, epidemiológico y de salud pública, con consecuencias múltiples, reconocido en todo el mundo10. En Europa, presentan un claro patrón norte-sur con unas prevalencias que, en general, son mucho más elevadas en los países mediterráneos que en los nórdicos o centroeuropeos; España es uno de los países más afectados10–12 y se ha relacionado con su alto consumo13–17.
Dada la correlación entre la aparición de resistencias y el consumo de antibióticos2,7,8,15, el objetivo de este estudio es describir las tendencias en la prescripción de antibióticos en Zamora y analizar su posible relación con la evolución de la sensibilidad a antimicrobianos de los patógenos respiratorios aislados en el área de salud, desde 1996 hasta 2005.
Material y métodosSe realizó un estudio descriptivo de los aislamientos de Streptococcus pyogenes, Streptococcus pneumoniae y Haemophilus influenzae procedentes de todas las muestras recibidas de atención primaria y hospitalizada, desde 1996 hasta 2005, en el único laboratorio de microbiología clínica público del área. Correspondían a muestras de atención primaria el 58,3% de las cepas de S. pyogenes, el 19,2% de las de neumococo y el 21% de las de H. influenzae. Los tipos de muestra de los que más frecuentemente procedían los aislamientos eran para S. pyogenes: exudado faringoamigdalar (80%); para neumococo: aspirado bronquial (11,5%), esputo (24%), hemocultivo (26%), exudado conjuntival (14,8%) y exudado ótico (8%), y para H. influenzae: esputo (33,5%), aspirado bronquial (21%), exudado conjuntival (16,9%) y hemocultivo (3,8%).
Estudiamos la evolución de las resistencias a antimicrobianos (determinación de concentración mínima inhibitoria [CMI] por método de microdilución en placa, Sensititre®). Para la clasificación de la resistencia se siguieron los criterios del NCCLS (CLSI), sin cambios durante el periodo de estudio.
El consumo se analizó mediante un estudio retrospectivo de las dispensaciones efectuadas por las oficinas de farmacia del área de Zamora, con recetas del Sistema Nacional de Salud (SNS) en las que se prescribió algún antibiótico del grupo terapéutico J01, antibacterianos de uso sistémico según el sistema de clasificación anatómica terapéutica de medicamentos (ATC) del Ministerio de Sanidad y Consumo, en el periodo 1996–2005.
Como fuente de datos se utilizó la base de datos ECOM del Ministerio de Sanidad y Consumo, que contiene información sobre el número de envases de especialidades farmacéuticas dispensadas con receta del SNS por las oficinas de farmacia. Como el 99% de la población española está protegida por la Seguridad Social, el consumo obtenido es considerado una aproximación aceptable del consumo real18.
Para cada principio activo se obtuvo la dosis diaria definida (DDD)19 por 1.000 habitantes y día (DHD). La DDD es la dosis media diaria de mantenimiento en adultos de un medicamento cuando se utiliza en su principal indicación.
Para cada principio activo y año se calculó la DHD mediante la fórmula18,20,21 (número de DDD×1.000 habitantes)/(población×365 días), y el número de DDD con la fórmula (n.° de envases dispensados anualmente de cada especialidad farmacéutica×n.° de formas farmacéuticas por envase×miligramos de principio activo por forma farmacéutica)/DDD en miligramos.
Los datos de población se obtuvieron de las proyecciones y estimaciones intercensales de población de derecho publicadas por el Instituto Nacional de Estadística para los años del periodo de estudio22.
Se calcularon frecuencias absolutas y relativas para todas las variables de sensibilidad. Se valoraron los cambios a lo largo del tiempo de la sensibilidad de los distintos microorganismos a los principales antibióticos, agrupados por períodos de 3–4 años (1996–1998, 1999–2002, 2003–2005), mediante pruebas de la χ2 o pruebas exactas. No se empleó la prueba de la χ2 de tendencias porque los cambios de resistencia no tenían una dirección homogénea.
Para valorar la correlación entre el consumo de antibióticos (total y por grupos de antibióticos) y las resistencias bacterianas, se utilizaron los datos de resistencias y consumo trimestrales, calculando los coeficientes de correlación de Spearman bivariables y su significación estadística. Asimismo se diseñaron modelos de series temporales (ARIMA: modelos de media móvil integrada autorregresiva) para las tendencias trimestrales de resistencia de S. pyogenes a macrólidos y de neumococo a penicilina, valorando la contribución del consumo de macrólidos, betalactámicos y antibióticos en conjunto a dichos modelos.
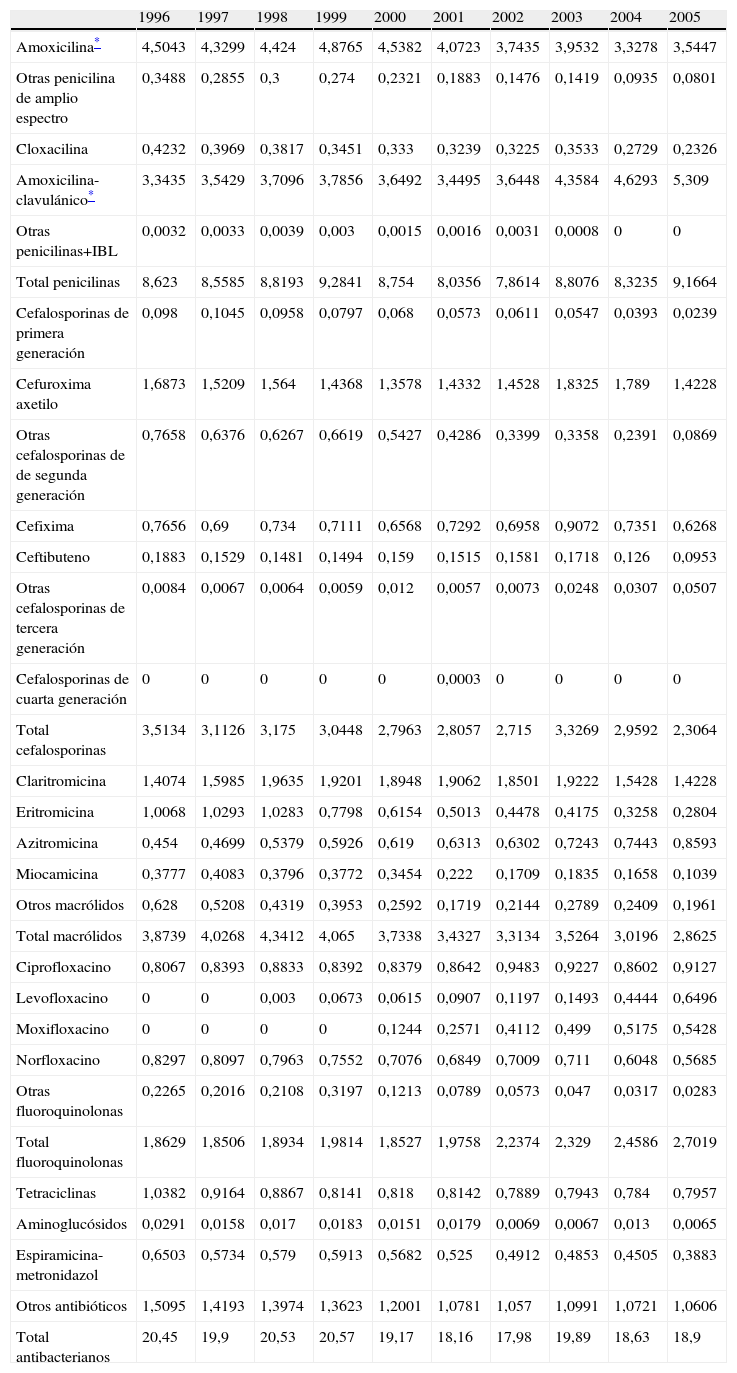
ResultadosEl consumo medio total de antibióticos en la provincia de Zamora fue de 19,42 DHD durante el periodo de estudio, con un descenso progresivo desde 20,45 DHD en 1996 a 18,90 DHD en 2005. En la tabla 1 se detalla la evolución de las DHD de cada principio activo en los años de estudio.
Consumo de antiinfecciosos en Zamora, años 1996–2005, expresado en dosis por 1.000 habitantes/día (DHD)
| 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | |
| Amoxicilina* | 4,5043 | 4,3299 | 4,424 | 4,8765 | 4,5382 | 4,0723 | 3,7435 | 3,9532 | 3,3278 | 3,5447 |
| Otras penicilina de amplio espectro | 0,3488 | 0,2855 | 0,3 | 0,274 | 0,2321 | 0,1883 | 0,1476 | 0,1419 | 0,0935 | 0,0801 |
| Cloxacilina | 0,4232 | 0,3969 | 0,3817 | 0,3451 | 0,333 | 0,3239 | 0,3225 | 0,3533 | 0,2729 | 0,2326 |
| Amoxicilina-clavulánico* | 3,3435 | 3,5429 | 3,7096 | 3,7856 | 3,6492 | 3,4495 | 3,6448 | 4,3584 | 4,6293 | 5,309 |
| Otras penicilinas+IBL | 0,0032 | 0,0033 | 0,0039 | 0,003 | 0,0015 | 0,0016 | 0,0031 | 0,0008 | 0 | 0 |
| Total penicilinas | 8,623 | 8,5585 | 8,8193 | 9,2841 | 8,754 | 8,0356 | 7,8614 | 8,8076 | 8,3235 | 9,1664 |
| Cefalosporinas de primera generación | 0,098 | 0,1045 | 0,0958 | 0,0797 | 0,068 | 0,0573 | 0,0611 | 0,0547 | 0,0393 | 0,0239 |
| Cefuroxima axetilo | 1,6873 | 1,5209 | 1,564 | 1,4368 | 1,3578 | 1,4332 | 1,4528 | 1,8325 | 1,789 | 1,4228 |
| Otras cefalosporinas de de segunda generación | 0,7658 | 0,6376 | 0,6267 | 0,6619 | 0,5427 | 0,4286 | 0,3399 | 0,3358 | 0,2391 | 0,0869 |
| Cefixima | 0,7656 | 0,69 | 0,734 | 0,7111 | 0,6568 | 0,7292 | 0,6958 | 0,9072 | 0,7351 | 0,6268 |
| Ceftibuteno | 0,1883 | 0,1529 | 0,1481 | 0,1494 | 0,159 | 0,1515 | 0,1581 | 0,1718 | 0,126 | 0,0953 |
| Otras cefalosporinas de tercera generación | 0,0084 | 0,0067 | 0,0064 | 0,0059 | 0,012 | 0,0057 | 0,0073 | 0,0248 | 0,0307 | 0,0507 |
| Cefalosporinas de cuarta generación | 0 | 0 | 0 | 0 | 0 | 0,0003 | 0 | 0 | 0 | 0 |
| Total cefalosporinas | 3,5134 | 3,1126 | 3,175 | 3,0448 | 2,7963 | 2,8057 | 2,715 | 3,3269 | 2,9592 | 2,3064 |
| Claritromicina | 1,4074 | 1,5985 | 1,9635 | 1,9201 | 1,8948 | 1,9062 | 1,8501 | 1,9222 | 1,5428 | 1,4228 |
| Eritromicina | 1,0068 | 1,0293 | 1,0283 | 0,7798 | 0,6154 | 0,5013 | 0,4478 | 0,4175 | 0,3258 | 0,2804 |
| Azitromicina | 0,454 | 0,4699 | 0,5379 | 0,5926 | 0,619 | 0,6313 | 0,6302 | 0,7243 | 0,7443 | 0,8593 |
| Miocamicina | 0,3777 | 0,4083 | 0,3796 | 0,3772 | 0,3454 | 0,222 | 0,1709 | 0,1835 | 0,1658 | 0,1039 |
| Otros macrólidos | 0,628 | 0,5208 | 0,4319 | 0,3953 | 0,2592 | 0,1719 | 0,2144 | 0,2789 | 0,2409 | 0,1961 |
| Total macrólidos | 3,8739 | 4,0268 | 4,3412 | 4,065 | 3,7338 | 3,4327 | 3,3134 | 3,5264 | 3,0196 | 2,8625 |
| Ciprofloxacino | 0,8067 | 0,8393 | 0,8833 | 0,8392 | 0,8379 | 0,8642 | 0,9483 | 0,9227 | 0,8602 | 0,9127 |
| Levofloxacino | 0 | 0 | 0,003 | 0,0673 | 0,0615 | 0,0907 | 0,1197 | 0,1493 | 0,4444 | 0,6496 |
| Moxifloxacino | 0 | 0 | 0 | 0 | 0,1244 | 0,2571 | 0,4112 | 0,499 | 0,5175 | 0,5428 |
| Norfloxacino | 0,8297 | 0,8097 | 0,7963 | 0,7552 | 0,7076 | 0,6849 | 0,7009 | 0,711 | 0,6048 | 0,5685 |
| Otras fluoroquinolonas | 0,2265 | 0,2016 | 0,2108 | 0,3197 | 0,1213 | 0,0789 | 0,0573 | 0,047 | 0,0317 | 0,0283 |
| Total fluoroquinolonas | 1,8629 | 1,8506 | 1,8934 | 1,9814 | 1,8527 | 1,9758 | 2,2374 | 2,329 | 2,4586 | 2,7019 |
| Tetraciclinas | 1,0382 | 0,9164 | 0,8867 | 0,8141 | 0,818 | 0,8142 | 0,7889 | 0,7943 | 0,784 | 0,7957 |
| Aminoglucósidos | 0,0291 | 0,0158 | 0,017 | 0,0183 | 0,0151 | 0,0179 | 0,0069 | 0,0067 | 0,013 | 0,0065 |
| Espiramicina-metronidazol | 0,6503 | 0,5734 | 0,579 | 0,5913 | 0,5682 | 0,525 | 0,4912 | 0,4853 | 0,4505 | 0,3883 |
| Otros antibióticos | 1,5095 | 1,4193 | 1,3974 | 1,3623 | 1,2001 | 1,0781 | 1,057 | 1,0991 | 1,0721 | 1,0606 |
| Total antibacterianos | 20,45 | 19,9 | 20,53 | 20,57 | 19,17 | 18,16 | 17,98 | 19,89 | 18,63 | 18,9 |
IBL: inhibidores de betalactamasa.
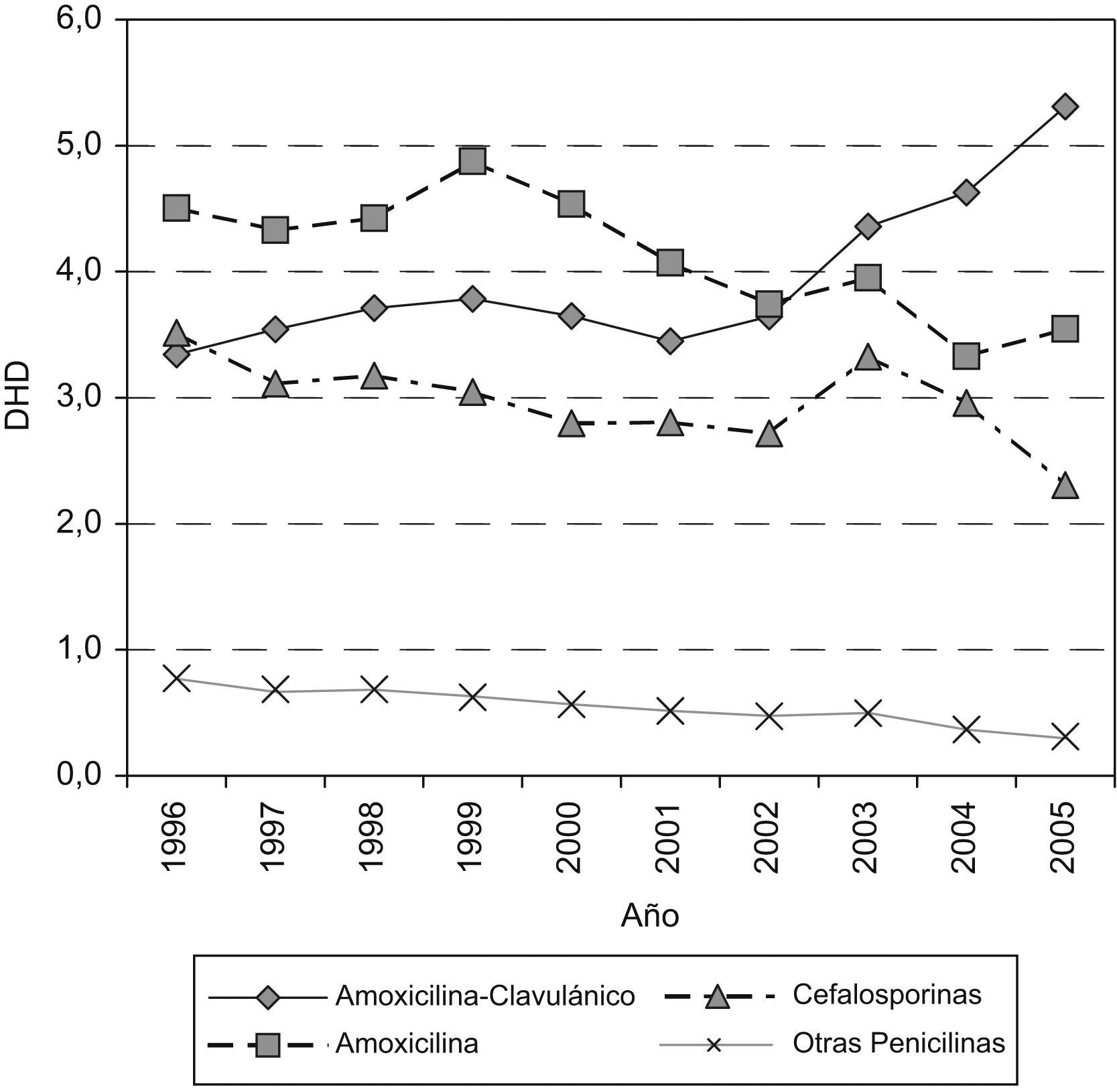
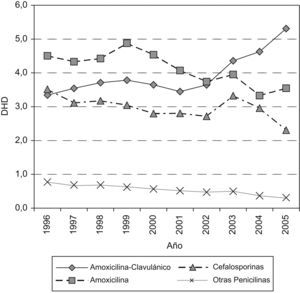
Las penicilinas aumentan desde 8,62 a 9,16 DHD debido al incremento del 59% de penicilinas en combinación con inhibidores de betalactamasa y, concretamente, con amoxicilina-clavulánico, que pasa de 3,3 DHD en 1996 a 5,3 DHD en 2005. Sin embargo, en las penicilinas de amplio espectro se observa una disminución del 25% entre el primero y el último año de estudio.
Macrólidos y tetraciclinas sufren una disminución del 26 y el 23% en el consumo. Azitromicina es el único macrólido que aumenta de 0,45 DHD en 1996 a 0,86 DHD en 2005, mientras que claritromicina, que alcanza una DHD media de 1,9 entre 1998 y 2003, cae en el año 2004 hasta llegar a 1,42 DHD en 2005, similar a la del inicio del periodo. Respecto a las tetraciclinas, la reducción más significativa es la de doxiciclina con un 62%.
Las cefalosporinas descienden un 35% al pasar de 3,51 DHD a 2,30 DHD al final del periodo; el descenso más acusado se produce en las cefalosporinas de primera generación. Respecto a las de segunda generación, cabe destacar el máximo aumento que se produce en cefuroxima-axetilo en 2003–2004. Las de tercera generación siguen la misma tendencia de disminución; cefixima es la más utilizada y llega a alcanzar una DHD máxima de 0,9 en el año 2003.
Las fluoroquinolonas son las que experimentan un aumento más destacado (45%). La mayor parte del consumo corresponde a ciprofloxacino, que se incrementa su prescripción junto a levofloxacino y moxifloxacino.
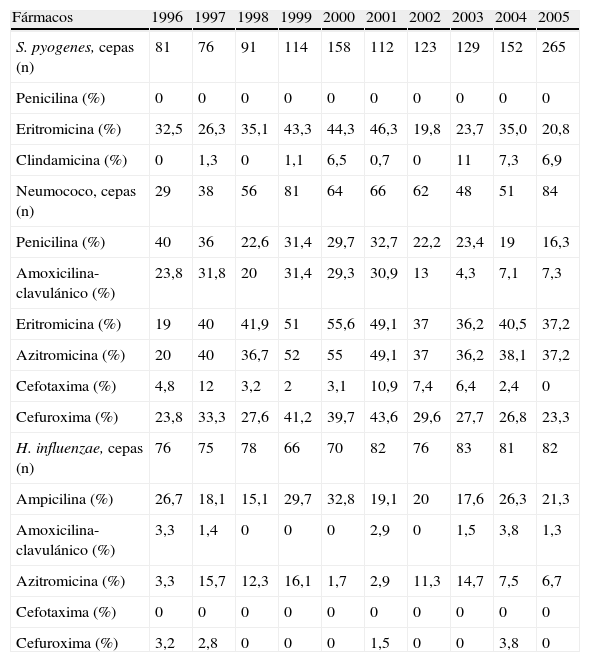
Para hacer el estudio de las resistencias se consideraron los microorganismos aislados en el periodo de estudio. La tabla 2 muestra las resistencias más significativas de S. pyogenes, neumococo y H. influenzae a los diferentes antibióticos. Se aislaron 1.301 cepas de S. pyogenes, todas sensibles a penicilina, con porcentajes de resistencia a eritromicina decreciente (p=0,022) y a clindamicina creciente (p<0,001).
Resistencias (%) de S. pyogenes, neumococo y H. influenzae a los diferentes antibacterianos
| Fármacos | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 |
| S. pyogenes, cepas (n) | 81 | 76 | 91 | 114 | 158 | 112 | 123 | 129 | 152 | 265 |
| Penicilina (%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Eritromicina (%) | 32,5 | 26,3 | 35,1 | 43,3 | 44,3 | 46,3 | 19,8 | 23,7 | 35,0 | 20,8 |
| Clindamicina (%) | 0 | 1,3 | 0 | 1,1 | 6,5 | 0,7 | 0 | 11 | 7,3 | 6,9 |
| Neumococo, cepas (n) | 29 | 38 | 56 | 81 | 64 | 66 | 62 | 48 | 51 | 84 |
| Penicilina (%) | 40 | 36 | 22,6 | 31,4 | 29,7 | 32,7 | 22,2 | 23,4 | 19 | 16,3 |
| Amoxicilina-clavulánico (%) | 23,8 | 31,8 | 20 | 31,4 | 29,3 | 30,9 | 13 | 4,3 | 7,1 | 7,3 |
| Eritromicina (%) | 19 | 40 | 41,9 | 51 | 55,6 | 49,1 | 37 | 36,2 | 40,5 | 37,2 |
| Azitromicina (%) | 20 | 40 | 36,7 | 52 | 55 | 49,1 | 37 | 36,2 | 38,1 | 37,2 |
| Cefotaxima (%) | 4,8 | 12 | 3,2 | 2 | 3,1 | 10,9 | 7,4 | 6,4 | 2,4 | 0 |
| Cefuroxima (%) | 23,8 | 33,3 | 27,6 | 41,2 | 39,7 | 43,6 | 29,6 | 27,7 | 26,8 | 23,3 |
| H. influenzae, cepas (n) | 76 | 75 | 78 | 66 | 70 | 82 | 76 | 83 | 81 | 82 |
| Ampicilina (%) | 26,7 | 18,1 | 15,1 | 29,7 | 32,8 | 19,1 | 20 | 17,6 | 26,3 | 21,3 |
| Amoxicilina-clavulánico (%) | 3,3 | 1,4 | 0 | 0 | 0 | 2,9 | 0 | 1,5 | 3,8 | 1,3 |
| Azitromicina (%) | 3,3 | 15,7 | 12,3 | 16,1 | 1,7 | 2,9 | 11,3 | 14,7 | 7,5 | 6,7 |
| Cefotaxima (%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cefuroxima (%) | 3,2 | 2,8 | 0 | 0 | 0 | 1,5 | 0 | 0 | 3,8 | 0 |
Se identificaron 579 cepas de neumococo, con porcentajes de resistencia de tendencia decreciente a penicilina (p=0,015), amoxicilina-clavulánico (p<0,001), cefotaxima (p<0,001) y cefuroxima (p=0,021); sin embargo, las resistencias a eritromicina y azitromicina ascendieron los primeros años hasta el año 2000 y, a continuación, descendieron, aunque estos cambios no fueron estadísticamente significativos (p=0,27 y p=0,39).
Se aislaron 769 cepas de H. influenzae, todas sensibles a cefotaxima, muy sensibles a amoxicilina-clavulánico y cefuroxima, con resistencias mantenidas a ampicilina y un significativo descenso de resistencia a azitromicina (p=0,035).
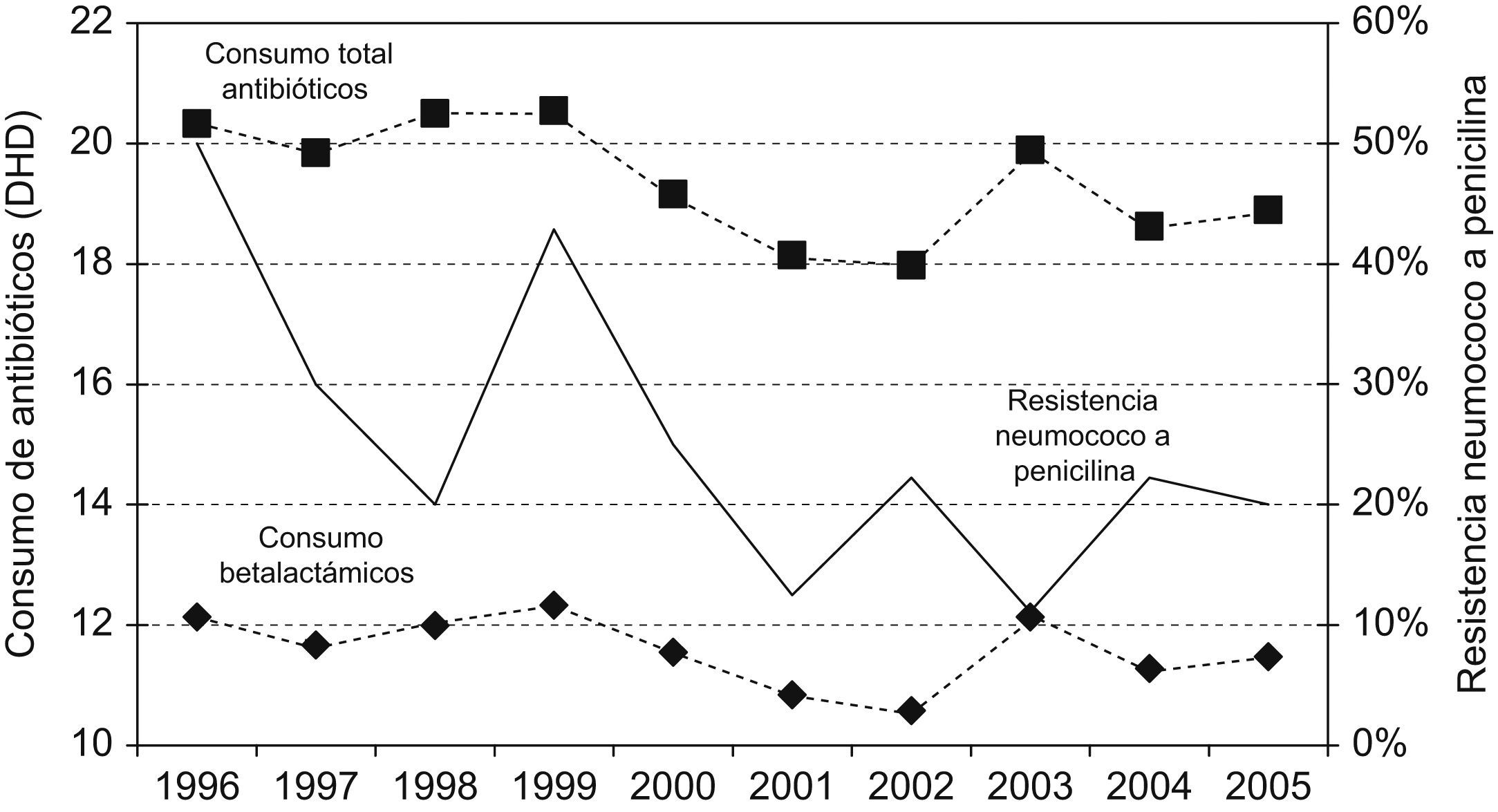
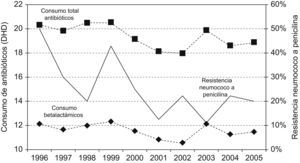
En la figura 1 se representa la evolución del consumo general de antibióticos y el de betalactámicos en particular, junto con la tendencia en la resistencia de neumococo a penicilina. El consumo general de antibióticos y el de betalactámicos se correlacionó significativamente con el descenso de resistencia de los neumococos a penicilina (coeficiente de correlación de Spearman, 0,41; p<0,01).
En la figura 2 se representa la evolución del consumo de antibióticos betalactámicos; se observa que el descenso de amoxicilina y cefalosporinas contrasta con el aumento de amoxicilina-clavulánico.
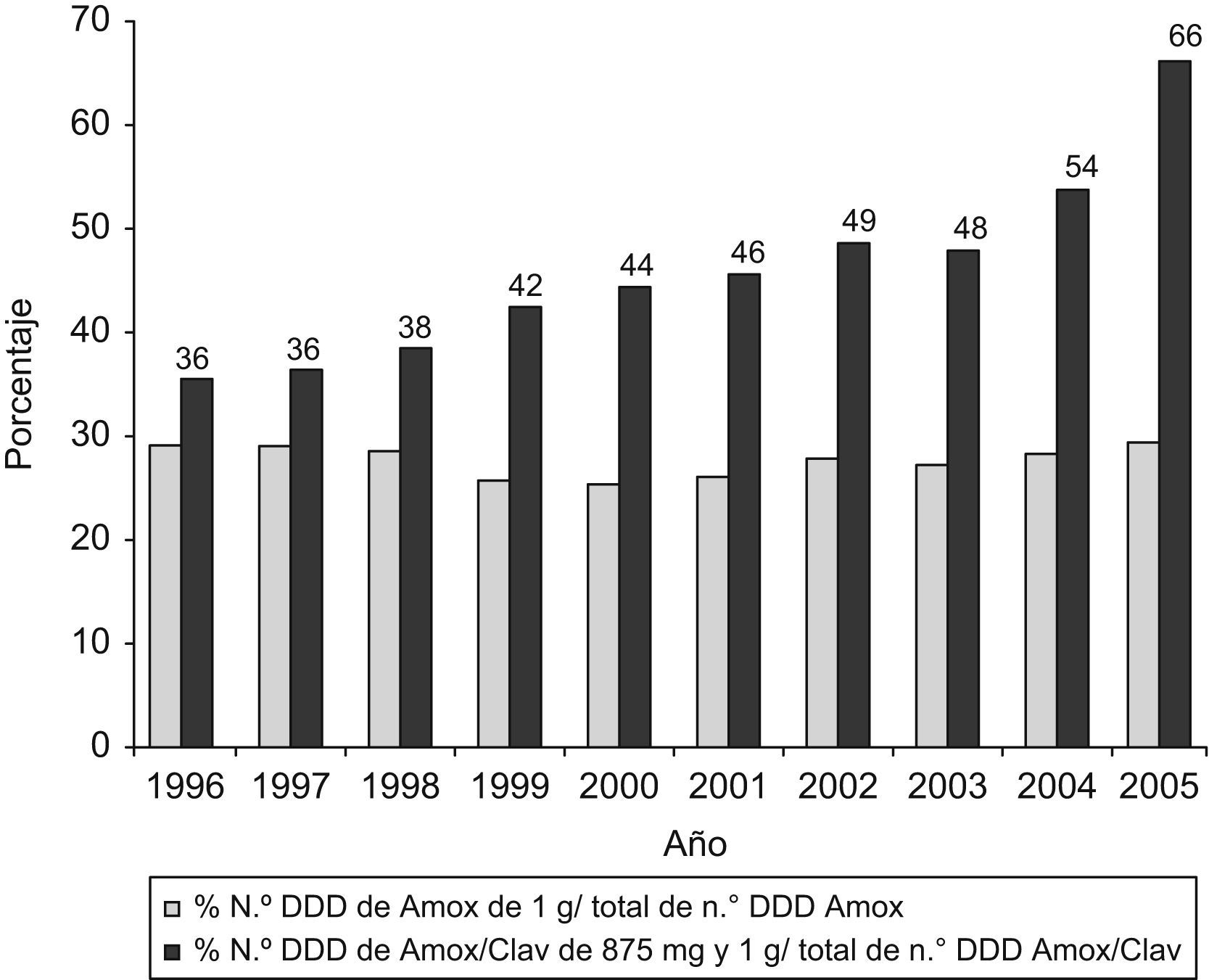
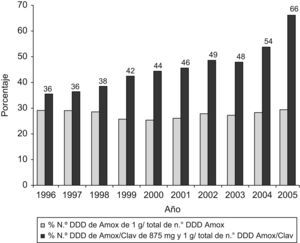
Tratando de evaluar la discordancia entre el comportamiento general del consumo de antibióticos y de los betalactámicos en particular y el aumento del número de DHD de amoxicilina-clavulánico, hemos analizado la evolución de las formas de prescripción de altas dosis de este antibiótico. En la figura 3 se observa el desplazamiento hacia la prescripción de altas dosis por presentación de amoxicilina-clavulánico.
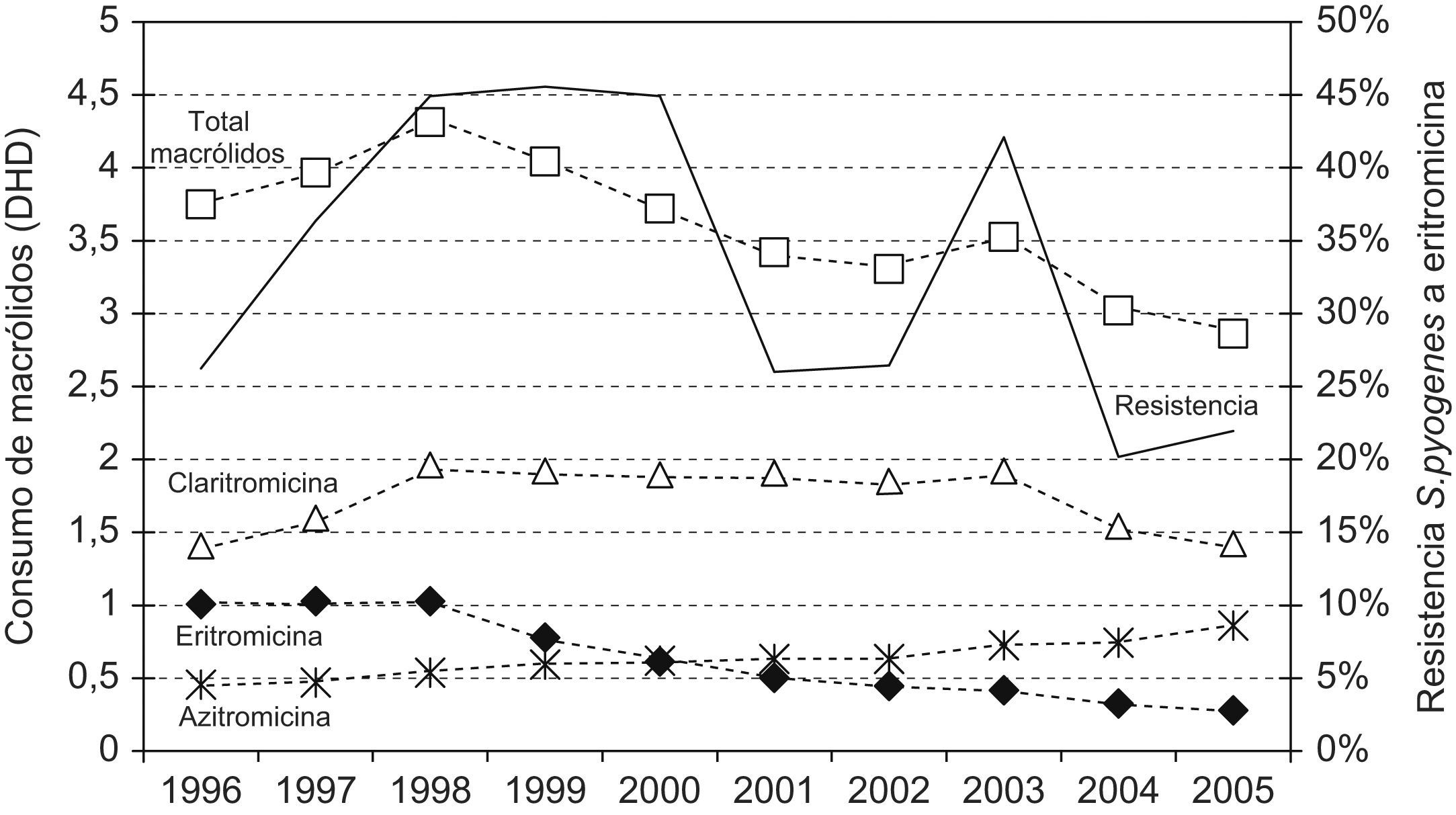
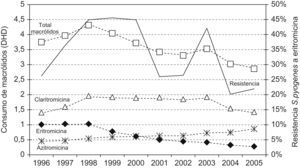
En la figura 4 se presentan las tendencias en el consumo de macrólidos, junto con la evolución de las resistencias de S. pyogenes a eritromicina. Ambos parámetros se correlacionaron significativamente (coeficiente de correlación de Spearman, 0,45; p<0,01).
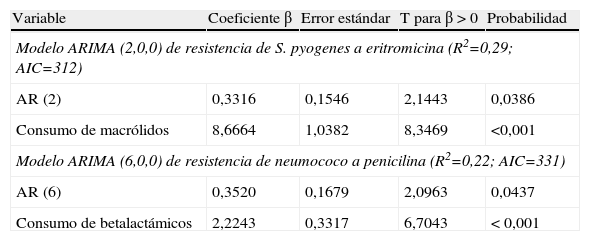
Se diseñaron varios modelos ARIMA para la evolución de las resistencias de S. pyogenes a eritromicina y de neumococo a penicilina, considerando la contribución a ellos de los consumos de antibióticos en general, betalactámicos y macrólidos. En la tabla 3 se presentan los resultados de dichos modelos. Los modelos con mayor capacidad predictiva incluían el consumo de macrólidos, para la resistencia de S. pyogenes a eritromicina, y el consumo de betalactámicos, para la resistencia de neumococo a penicilina. No obstante, dichos modelos sólo permitían explicar el 29 y el 22%, respectivamente, de la variabilidad de la evolución de la resistencias.
Modelos de series temporales (ARIMA) para la predicción de tendencias de resistencias de S. pyogenes a eritromicina y de neumococo a penicilina
| Variable | Coeficiente β | Error estándar | T para β > 0 | Probabilidad |
| Modelo ARIMA (2,0,0) de resistencia de S. pyogenes a eritromicina (R2=0,29; AIC=312) | ||||
| AR (2) | 0,3316 | 0,1546 | 2,1443 | 0,0386 |
| Consumo de macrólidos | 8,6664 | 1,0382 | 8,3469 | <0,001 |
| Modelo ARIMA (6,0,0) de resistencia de neumococo a penicilina (R2=0,22; AIC=331) | ||||
| AR (6) | 0,3520 | 0,1679 | 2,0963 | 0,0437 |
| Consumo de betalactámicos | 2,2243 | 0,3317 | 6,7043 | < 0,001 |
AIC: criterio de información de Akaike; AR: factor de autorregresión; R2: coeficiente de determinación.
Antes de analizar e interpretar los resultados obtenidos, hay que tener en cuenta una serie de limitaciones ya referidas en estudios similares9,23,24:
- •
Sólo se incluye el consumo extrahospitalario de antibióticos a través de receta del SNS; se desconoce la dispensación sin receta (automedicación) y los prescritos en el ámbito privado (ISFAS o MUFACE), por lo que el consumo real será necesariamente mayor que el obtenido.
- •
Se desconoce la indicación real para la que fueron recetados estos fármacos.
- •
Se tienen datos de dispensación en oficina de farmacia, lo que no significa que los fármacos sean consumidos o administrados en su totalidad (incumplimiento terapéutico).
- •
Las dosis diarias definidas empleadas pueden ser diferentes según la indicación para la que se empleen o la edad del paciente y se considera una sola DDD por fármaco.
- •
Aunque hemos incrementado las DDD asignadas a amoxicilina y amoxicilina-clavulánico de 1.000 a 1.500mg (dosis más cercanas a las utilizadas habitualmente en clínica), la tendencia progresiva a emplear dosis altas de dichos antibióticos indica que esta DDD podría ser todavía mayor. Una corrección de este desajuste originaría una reducción relativa de las estimaciones de prescripción de esos antibióticos, que sería más congruente con los resultados observados.
- •
Como población se han utilizado las proyecciones y estimaciones intercensales de población de derecho publicadas por el Instituto Nacional de Estadística, contabilizándose colectivos como ISFAS o MUFACE, a quienes no se les prescribe en receta del SNS. No obstante, el volumen de estos colectivos no se ha modificado durante los años de estudio.
- •
No se ha podido controlar la influencia de posibles cambios en las condiciones climáticas o en la intensidad de las epidemias de gripe en la prescripción durante el periodo de estudio. Sin embargo, otros factores que influyen en la prescripción, como la proporción de población infantil, no se ha modificado en estos años.
- •
La relación estadística en los datos de resistencia y consumo no permite asumir que haya una relación causal entre ambos fenómenos. Otros factores, como la aparición de clones de microorganismos más sensibles, han podido influir en los cambios observados.
Hechas las anteriores consideraciones, en los resultados de este trabajo se observa una reducción en la utilización de antibióticos coincidiendo con una recuperación de la sensibilidad a antimicrobianos de los patógenos respiratorios. Aunque la correlación de ambos hallazgos sólo permite realizar una aproximación simplista al complejo problema de la resistencia microbiana, consideramos de gran importancia conocer y controlar la prescripción antibiótica, por ser uno de los pocos factores implicados en los que podemos intervenir.
El consumo de antibióticos en Zamora es de 20,4 DHD en 1996, mayor que los 17 DHD obtenidos por otros autores en 1995 en Cataluña24 y un área de Asturias9; 18 DHD en 1994 en Zaragoza25; 18 y 17 DHD en 1995 y 1996 en Costa de Ponent4; sin embargo, resulta inferior a la media nacional en 1995 y 199610,14 (23 DHD). Este consumo desciende en 2005 hasta 18,9 DHD en Zamora y 19 DHD en España10, y se acompaña, en estos 10 años, de modificaciones notables en el patrón de uso de los diferentes grupos de antibióticos.
En Europa hay diferencias significativas en el uso extrahospitalario de antibióticos que, en 2002, en Francia (32 DHD) el consumo llegó a ser 3 veces mayor que en Noruega (10 DHD). Son precisamente los países mediterráneos (Francia, Portugal, Italia, Croacia, Grecia o España) los que se caracterizan por un mayor consumo de antibióticos17.
El grupo de penicilinas, al igual que en el estudio en Costa de Ponent16, Francia (16 DHD) en 200215 y el resto de Europa17, es el más consumido durante los 10 años de estudio, el cual se incrementa y llega a ser el 50% del consumo en 2005. La amoxicilina fue la más consumida en 1996 en Zamora (4,5 DHD), seguida de amoxicilina-clavulánico (3,3 DHD), del mismo modo que en el País Vasco2 y Zaragoza25 en 1994 con 5,6 y 2,8 DHD respectivamente; sin embargo, a partir de 2003 se invierte el orden en el consumo, en que amoxicilina-clavulánico (5,3 DHD) es la más utilizada en el año 2005, como en Cuenca26 en 1998, seguida de amoxicilina (3,5 DHD). En 2002, en España y otros países, como Portugal, Bélgica, Austria e Irlanda, entre otros, también es amoxicilina-clavulánico la más consumida, mientras que en Francia, Italia, Grecia, Alemania o Inglaterra son las penicilinas de amplio espectro, como amoxicilina27. En una revisión realizada por Goldaracena et al25 en 1996, también se observó que amoxicilina era la más prescrita, hecho que se corroboró después en el estudio realizado por Orero et al28 en 1997, que refleja la extensión del uso de amoxicilina; amoxicilina-clavulánico es el segundo principio activo más utilizado.
El consumo predominante de penicilinas, en especial de estas dos, confirma la adecuación a las recomendaciones actuales de política de antibióticos en atención primaria4, aunque en el año 2006 se envió una nota a todos los médicos recordándoles el riesgo de hepatotoxicidad en relación con amoxicilina-clavulánico29. El incremento también obedece a una posible prescripción innecesaria que podría explicarse, probablemente, por la imagen que tiene la amoxicilina de «producto suave»26,28, a pesar de que contra neumococo, principal objetivo terapéutico en las infecciones respiratorias, la combinación de clavulánico y amoxicilina no ofrece ventajas. El alto consumo de amoxicilina-clavulánico, expresado en DHD, también se debe al desplazamiento hacia la prescripción de presentaciones con dosis más elevadas por forma farmacéutica, como se observa en la figura 3. Esta prescripción podría deberse a las recomendaciones realizadas en los últimos años, que tratan de ofrecer una mayor eficacia contra neumococos parcialmente resistentes, mediante la obtención de un mayor porcentaje de tiempo con concentraciones de antibiótico sobre la CMI. Asimismo, parece que la utilización de dosis elevadas de amoxicilina durante menor tiempo podría tener un efecto beneficioso en la selección de resistencias.
La resistencia a penicilina de S. pneumoniae se describió hace casi 20 años y se relacionó con un elevado consumo de penicilinas4. En los últimos años, en Zamora se ha reducido dicha resistencia, al igual que en el resto de España28, y hay correlación con la disminución del consumo de antibióticos en general y de betalactámicos en particular que, sin embargo, contrasta con el aumento del consumo de amoxicilina-clavulánico, probablemente, por los cambios de dosificación experimentados. Este hecho, junto a otros factores implicados en la evolución de resistencia, podría justificar que sólo un 22% de la variabilidad se explique con el modelo predictivo desarrollado.
El descenso en la utilización de macrólidos, de 3,9 DHD en 1996 a 2,9 DHD en 2005, se correlaciona con un descenso en las resistencias de eritromicina a S. pyogenes; hasta un 29% de la variabilidad de la resistencia podía explicarse con nuestro modelo predictivo. En el periodo 1997–2000 el consumo de macrólidos tuvo un máximo de 4,3 DHD precediendo a los años de máxima resistencia de neumococo y S. pyogenes a macrólidos, tal y como lo preveían Alos et al13.
En la tabla 2 se observa que la resistencia de S. pneumoniae a eritromicina y azitromicina se solapa por igual, y queda una resistencia del 37% en 2005. Algunos países han conseguido reducir tasas elevadas de resistencias a macrólidos en S. pyogenes y S. pneumoniae tras una política de restricción en el uso de estos fármacos4,30. Al igual que en toda España, Grecia, Francia, Italia, Portugal, Bélgica y otros países europeos31 y provincias españolas16,26, claritromicina es la más utilizada en Zamora con 1,4 DHD en 1996, que crece hasta 1,9 DHD en 2003 y cae a continuación a 1,4 DHD en 2005; mientras que azitromicina es la segunda más consumida y con un crecimiento constante desde 0,4 DHD en 1996 hasta 0,8 DHD en 2005. Ambas abarcan el 80% del consumo de este grupo en el año 2005, probablemente favorecido por sus formulaciones galénicas (comodidad de administración y presentación pediátrica) y claritromicina, además, por su prescripción para la erradicación de Helicobacter pylori. Sin embargo, se reduce la prescripción del fármaco de referencia de este grupo, la eritromicina, de 1 DHD en 1996 a 0,3 DHD en 2005.
El consumo de cefalosporinas se reduce de 3,5 DHD en 1996 a 2,3 DHD en 2005, que coincide también con un descenso en las resistencias a neumococo. Mientras el consumo de cefalosporinas de primera y tercera generación es escaso durante todo el periodo, las de segunda generación suponen el 65-70% de todas ellas, como en muchos países europeos32; cefuroxima axetilo (62% sobre el total del grupo) es la más utilizada, al igual que en estudios similares33, ya que sigue estando indicada, junto a amoxicilina-clavulánico, en gran número de infecciones respiratorias30. La resistencia de neumococo a cefuroxima en nuestra área llegó a ser del 43% en 2001, y decreció a continuación hasta un 23,3% en 2005. La segunda cefalosporina más utilizada es cefixima, que mantuvo un consumo medio durante todo el periodo de 0,7 DHD, a pesar de considerarse inadecuada la prescripción de cefalosporinas de tercera generación en AP4,25,26,30 y tener muy baja actividad contra neumococo. La evolución de este grupo en Zamora es muy similar a la encontrada por Sole López et al16 en Costa de Ponent.
El uso de antimicrobianos no está exento de riesgos, tanto individuales, toxicidad o hipersensiblidad, como los relacionados con su impacto en la comunidad, por la selección de resistencias frente a ellos. Es necesario reflexionar sobre el balance beneficio/riesgo que el consumo de un determinado antibiótico conlleva10. Los antibióticos son los fármacos más implicados en reacciones alérgicas (50%), sobre todo los betalactámicos (penicilinas y cefalosporinas), aunque también tetraciclinas y macrólidos.
Los médicos de AP están sometidos a la presión de la industria farmacéutica para prescribir fármacos más nuevos, las dificultades para conseguir información sobre las resistencias bacterianas locales, la incertidumbre en la práctica médica y el poco tiempo que disponen para atender a los pacientes7.
En países como Dinamarca, donde se consumen menos antibióticos y los médicos continúan prescribiendo los de espectro reducido, las resistencias son bajas, probablemente debido, entre otras causas, a que los médicos de atención primaria utilizan test antigénicos rápidos para verificar el diagnóstico12.
Es muy importante la colaboración internacional y de todos los agentes implicados, como prescriptores, farmacéuticos, usuarios, administración sanitaria e industria farmacéutica, para hacer frente a las resistencias y al inadecuado e innecesario consumo de antibióticos10. Las acciones llevadas a cabo en algunos países como Suecia34 o Israel8 han dado como resultado un uso más racional de antimicrobianos, al conseguir un importante descenso en el número de prescripciones y, por lo tanto, en las resistencias, en las zonas donde se implementaron las estrategias de actuación. Es posible que las últimas campañas dirigidas a sanitarios y pacientes, desde el Ministerio de Sanidad y Consumo, sobre el uso racional de antibióticos, hayan impactado positivamente en nuestra área, a la vista de los resultados de este estudio.
Pastor Sánchez7 hace una recopilación importante de recomendaciones para conseguir un uso racional de antibióticos y, por ende, para el control de las resistencias bacterianas. Dado que hasta ahora ninguna de las acciones han sido definitivas, deberían diseñarse estratégicamente y cuantificar su impacto adecuadamente, en relación con variaciones cuantitativas y cualitativas del consumo, la respuesta clínica de los pacientes y la prevalencia de resistencias10.
Este trabajo apunta a que podría haber una relación entre consumo de antibióticos y desarrollo de resistencias bacterianas, lo que supone un importante problema de concienciación y salud pública. Este tipo de estudios aporta una información muy útil para facilitar el desarrollo de políticas de formación, información y racionalización en el consumo de estos fármacos, con lo que se mejorará el cumplimiento terapéutico y su perfil de utilización, para ayudar a contener el abuso y mal uso, evitar un gasto sanitario innecesario y, lo que es mas importante, frenar el problema de las resistencias.
Es necesario que los médicos de AP se adhieran a las recomendaciones de uso racional de antibióticos y conozcan datos locales, tanto de la etiología de las infecciones como de las resistencias bacterianas obtenidas de muestras de AP.
Proponemos seguir analizando la evolución del consumo de antibacterianos en nuestra área y la tasa de resistencias, así como la realización de estudios de indicación-prescripción, con el fin de evaluar y conocer la realidad del uso de los antibióticos.