Comparar la incidencia de hepatitis grave asociada al tratamiento con rifampicina más pirazinamida (RZ) en tratamiento preventivo de tuberculosis en pacientes infectados por virus de la inmunodeficiencia humana (VIH), con pauta estándar de isoniacida (H) durante 6 (6H) o 12 (12H) meses.
Pacientes y métodosMetaanálisis de ensayos clínicos de asignación aleatorizada y controlados, en los que se comparó el régimen RZ con la pauta estándar de tratamiento de la infección latente tuberculosa (6 a 12H) en pacientes infectados por VIH. Se realizó una búsqueda sistemática de la literatura médica desde 1986 hasta diciembre de 2007. Se identificaron 5 ensayos clínicos de asignación aleatorizada y controlados, realizados en España, EE. UU., Haití y Zambia. Se valoró como repuesta binaria la ausencia o presencia de hepatotoxicidad grave, definida como aquella que provocó la muerte del paciente o fue causa de retirada del tratamiento, y se estableció como medida la diferencia de riesgo de hepatotoxicidad entre los expuestos a 2RZ y los controles (6 a 12H).
ResultadosDe los 5 ensayos seleccionados, uno se excluyó del análisis final por presentar datos incompletos acerca del desarrollo de hepatotoxicidad. La población final analizada fue de 2.657 pacientes (1.324 RZ y 1.333 controles). El desarrollo de hepatotoxicidad grave con RZ fue inferior al de 6 a 12H (el 1,208 frente al 2,851%; p=0,0042, intervalo de confianza [IC] del 95%: −0,028 a −0,005). En el metaanálisis no se encontraron pruebas estadísticas de heterogeneidad entre los estudios ni sesgo de publicación. La diferencia de riesgo de hepatotoxicidad grave fue favorable al régimen RZ, tanto en el modelo de efectos fijos (−0,0119; IC del 95%: −0,0206 a −0,0033), como en el modelo de efectos aleatorizados (−0,0147; IC del 95%: −0,0289 a −0,0006).
ConclusionesEl metaanálisis no demuestra la existencia de un aumento de riesgo de hepatotoxicidad grave entre pacientes infectados por VIH que reciben 2RZ como profilaxis antituberculosa, frente a la pauta estándar de tratamiento con H durante 6 a 12 meses.
To compare the incidence of severe hepatitis in HIV-infected patients receiving rifampicin plus pyrazinamide (RZ) for antituberculosis prophylaxis with that of patients receiving a conventional isoniazid-based regime for 6 to 12 months (6–12H).
MethodsMeta-analysis of randomized controlled trials, in which RZ was compared with 6–12H, the standard regimen for latent tuberculosis infection in HIV-infected patients. A systematic search of studies published between 1986 and 2007 was carried out, and 5 randomized clinical trials conducted in Spain (2), the USA (1), Haiti (1), and Zambia (1) were identified. The absence or presence of severe hepatoxicity, which was defined as toxicity causing the death of the patient or requiring treatment withdrawal, was assessed as a binary response, and the outcome measure was the difference in the risk of hepatotoxicity between patients receiving RZ and those receiving 6–12H (controls).
ResultsAmong the 5 trials retrieved, 1 was excluded from the final analysis because of incomplete data on the development of hepatotoxicity. A final total of 2657 patients were included (1324 patients receiving RZ and 1333 receiving 6–12H). The development of severe hepatotoxicity was lower in the RZ group than in the 6–12H group (1.208% vs. 2.851%; P=0.0042, 95% CI: −0.028 to −0.005). The meta-analysis showed no statistical evidence of heterogeneity between the studies or publication bias. The difference in the risk of severe hepatotoxicity favored the RZ regimen in both the fixed effects model (−0.0119, 95% CI: −0.0206 to −0.0033) and random effects model (−0.0147, 95% CI: −0.0289 to −0.0006).
ConclusionsThe meta-analysis did not demonstrate an increased risk of severe hepatoxicity in HIV-infected patients receiving tuberculosis prophylaxis with the rifampicin/pyrazinamide combination compared to the conventional 6- or 12-month isoniazid-based regimen.
La tuberculosis (TB) es una de las complicaciones infecciosas más frecuentes que presentan los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). Además, la infección por VIH es el factor de riesgo más importante de progresión de infección latente tuberculosa (ILT) a enfermedad tuberculosa1, debido a que la inmunodepresión provocada por el VIH puede tanto favorecer la rápida progresión a enfermedad tuberculosa de una infección reciente por Mycobacterium tuberculosis2, como provocar la pérdida de la inmunidad adquirida tras una infección previa por M. tuberculosis y permitir la reinfección por nuevas cepas3. Todo esto va a condicionar que en los pacientes infectados por VIH haya un alto riesgo de desarrollo de enfermedad tuberculosa durante la evolución de su enfermedad4.
En pacientes con ILT, el tratamiento preventivo para la TB tiene como objetivo prevenir el desarrollo de la enfermedad y se basa en el uso de uno o más fármacos antituberculosos. Diversos regímenes de tratamiento han demostrado ser eficaces en este escenario, como isoniacida (H) durante 6 a 12 meses (6H y 12H)5–10, la asociación de rifampicina e isoniacida durante 3 meses (3RH) 11 y la asociación de rifampicina más pirazinamida durante 2 meses (2RZ)12. Las pautas cortas de tratamiento de la ILT tienen la ventaja de favorecer la adecuada finalización del tratamiento y disminuir la tasa de abandonos de éste13. Así, en un ensayo clínico de asignación aleatorizada se demostró que la eficacia y seguridad de 2RZ era equiparable a la lograda con 12H, pero con una tasa de cumplimiento significativamente mayor14. Sobre la base de estos resultados el Centers for Disease Control and Prevention (CDC) consideró como pautas electivas para el tratamiento de la ILT en pacientes infectados por VIH los regímenes de 2RZ y 12H15. Sin embargo, la descripción de casos de hepatitis graves en el curso del tratamiento de la ILT en pacientes no infectados por VIH que recibían 2RZ16 y la observación, en otro ensayo clínico de asignación aleatorizada llevado a cabo entre pacientes no infectados por VIH, de una mayor incidencia de hepatotoxicidad en el grupo de pacientes que recibieron 2RZ en relación con los que recibieron 6H17, hizo desaconsejar el uso de 2RZ en pacientes no infectados por VIH y plantear dudas sobre la conveniencia de su administración a pacientes infectados por VIH16. Sin embargo, en ninguno de los ensayos clínicos de asignación aleatorizada que han evaluado la eficacia y seguridad de 2RZ se ha comprobado un aumento significativo de la hepatotoxicidad.
El objetivo de este estudio es comparar mediante un metaanálisis de ensayos clínicos de asignación aleatorizada la incidencia de hepatotoxicidad grave asociada a la profilaxis antituberculosa con 2RZ con la de la pauta estándar con 6H o 12H en pacientes infectados por VIH.
Material y métodosEl objetivo principal del estudio fue evaluar la incidencia de hepatotoxicidad grave en cada grupo de tratamiento. Se consideró como patrón estándar de profilaxis antituberculosa en pacientes infectados por VIH cualquier pauta basada en la administración de H en monoterapia durante 6 a 12 meses.
Criterios de selecciónEn el metaanálisis se incluyeron estudios que cumplieran los siguientes criterios: ser ensayos clínicos de asignación aleatorizada, publicados entre 1986 y 2007, en los que se comparara la eficacia y seguridad de la pauta RZ durante 2 a 3 meses con el régimen considerado patrón (6 a 12H), y en los que se especificara el número de pacientes en los que se desarrolló hepatotoxicidad grave en ambos grupos. Se definió como hepatotoxicidad grave aquella que provocó la muerte del paciente o fue causa de retirada del tratamiento.
Estrategia de búsquedaSe realizó una búsqueda bibliográfica sistemática de la información publicada en Medline (1986 a 2007) para identificar los ensayos clínicos que se incluirían en el metaanálisis. Las palabras clave utilizadas fueron «HIV», «tuberculosis», «prophylaxis» o «chemoprophylaxis», «preventive therapy», «rifampicin» o «rifampin and pyrazinamide, and isoniazid». La búsqueda se limitó a artículos publicados en inglés y español.
Proceso de revisiónDos observadores independientes consideraron, para su inclusión en el estudio, los estudios identificados; las discrepancias entre ambos se resolvieron mediante discusión y acuerdo entre ambos, o mediante la intervención de una tercera persona. La calidad metodológica se evaluó mediante el método de Jadad et al18, que asigna a cada estudio una puntuación de 0 a 5 en función del método de aleatorización, del uso del doble ciego para la asignación de pacientes a cada grupo de estudio y de la descripción completa de efectos adversos y abandonos del estudio.
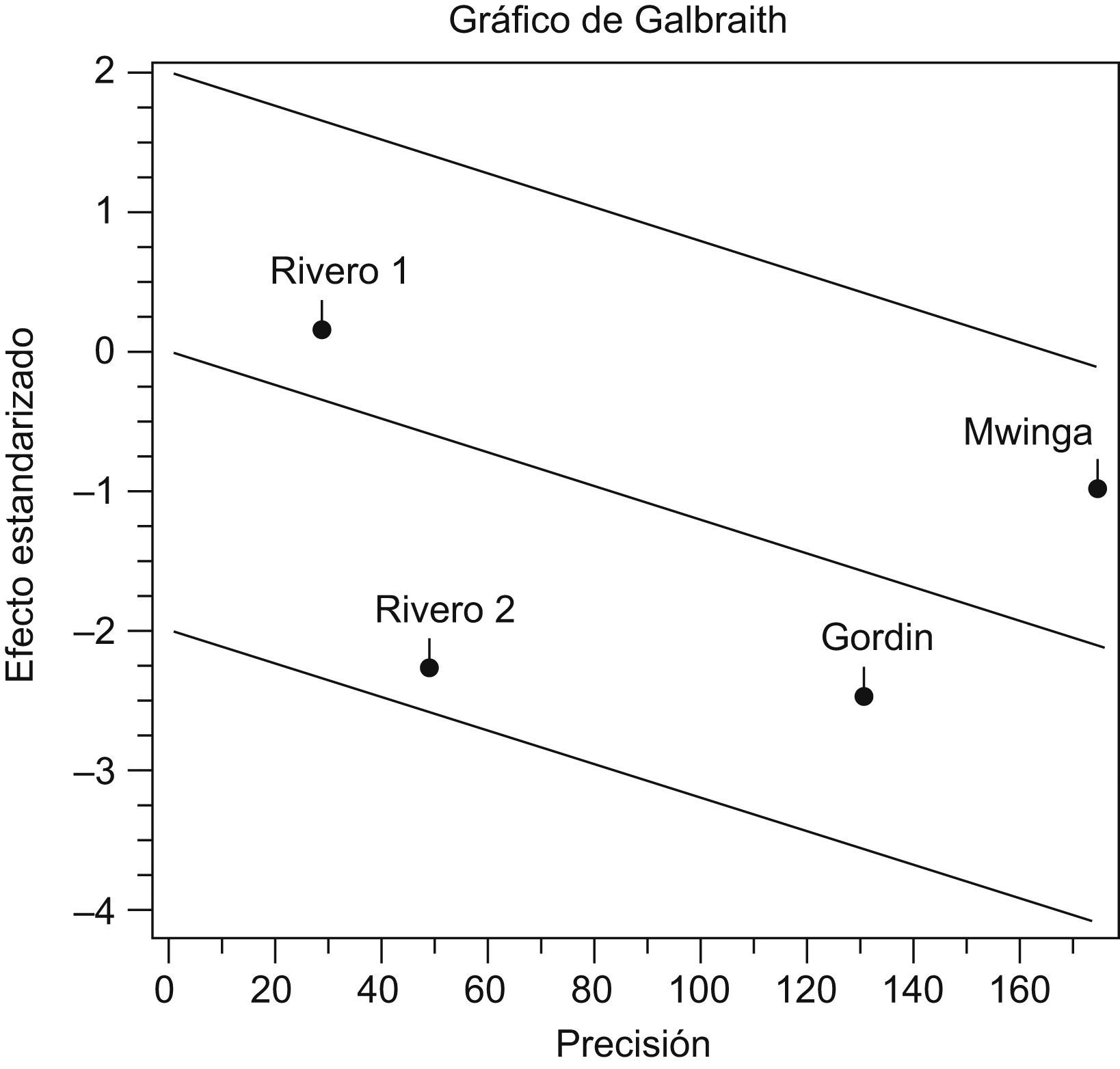
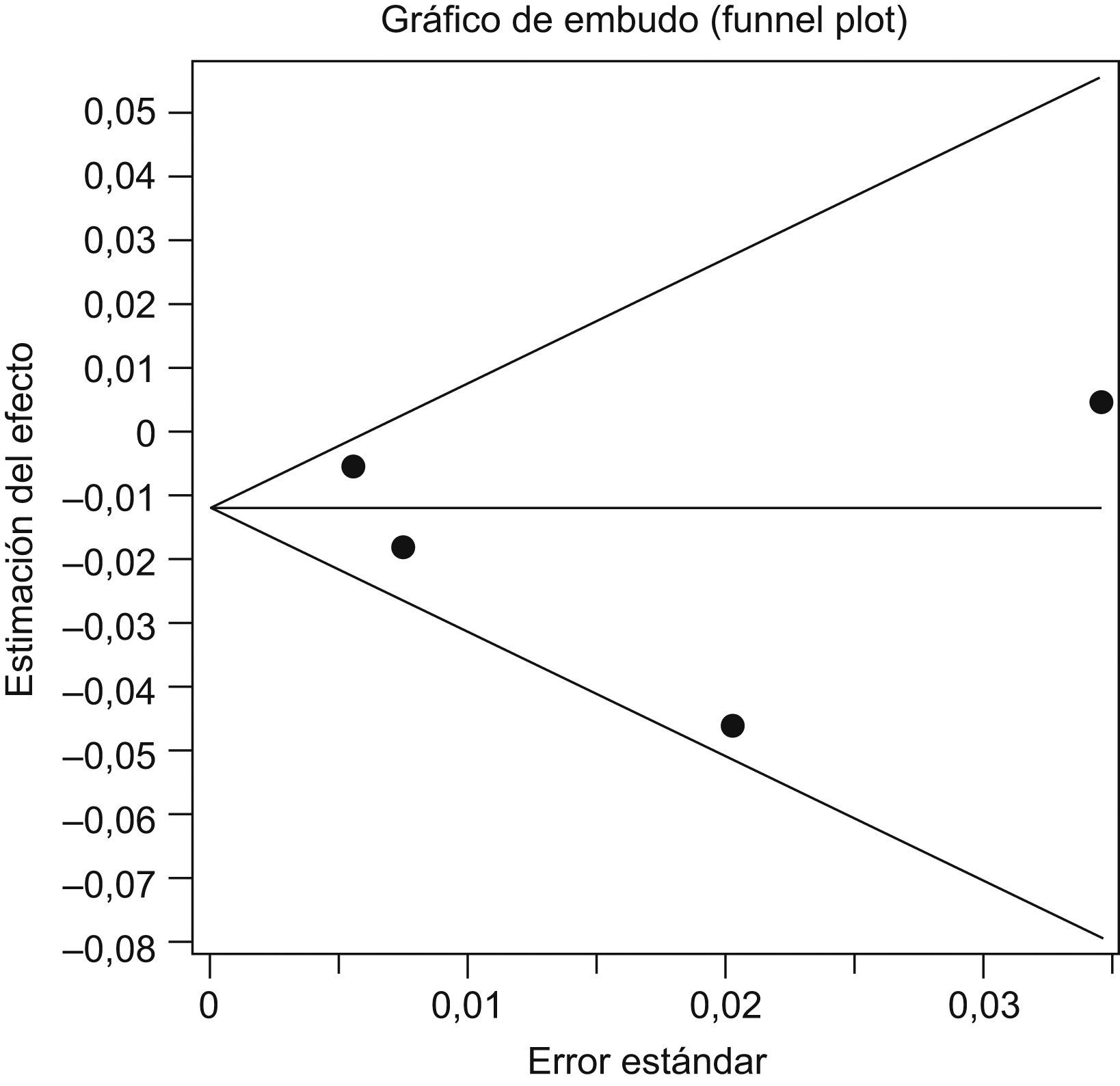
Análisis estadísticoEl análisis de heterogeneidad entre estudios se realizó mediante la prueba Q de Der Simonian y Laird y se asumió como hipótesis que la variabilidad entre estudios es nula. Se realizó una representación gráfica de la variabilidad entre estudios y para esto se utilizó el gráfico de Galbraith. Se valoró como repuesta binaria la ausencia o presencia de hepatotoxicidad grave y se estableció como medida la diferencia de riesgo de hepatotoxicidad entre los expuestos a RZ y los controles. Para la obtención de la medida resumen, los resultados de los estudios individuales se ponderaron, por la inversa de su variancia, utilizando modelos de efectos fijos, que sólo tienen en cuenta la variabilidad intraestudio y de efectos aleatorizados que valora también la existencia de variabilidad de los resultados entre los distintos estudios. Se evaluó la posible existencia de un sesgo de publicación con el método de gráfico en embudo (funnel plot) y las pruebas de Begg y de Egger. El análisis de los datos se realizó con el programa informático EPIDAT versión 3.1, y se estimó un intervalo de confianza (IC) del 95%.
ResultadosInicialmente se seleccionaron para el metaanálisis 5 ensayos clínicos de asignación aleatorizada y controlados realizados en España, EE. UU., Haití y Zambia11,12,14,19,20. Uno de ellos se excluyó para el análisis final por no cumplir los criterios de inclusión al no permitir la evaluación en éste del desarrollo de hepatotoxicidad grave en cada rama del estudio, ya que pese a que en la sección «Método» del artículo se especifica que los pacientes tuvieron seguimiento clínico y analítico durante toda la fase de tratamiento, en la sección «Resultados» sólo se comunicaron datos de seguridad hepática de las primeras 8 semanas de tratamiento12.
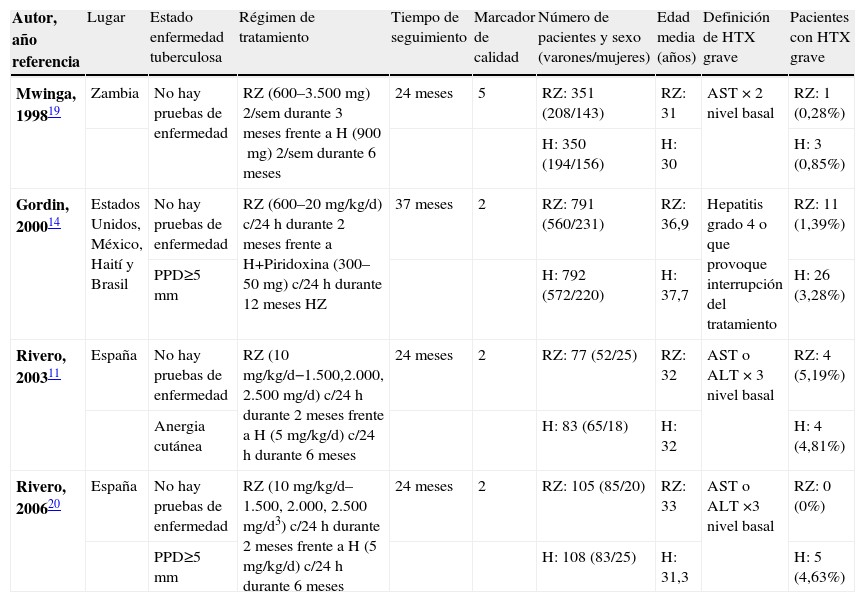
En la tabla 1 se pueden observar las características basales de cada estudio. Tres de los estudios seleccionados fueron ensayos clínicos con diseño abierto11,14,20 y uno con diseño doble ciego19. En uno de los ensayos clínicos las pautas de tratamiento se administraron 2 veces por semana19 mientras que, en el resto, el tratamiento se administró en dosis diarias14,20. En 3 ensayos clínicos la duración del tratamiento con H fue de 6 meses11,14,19 y en un ensayo clínico, la duración fue de 12 meses20.
Características basales y número de pacientes con hepatotoxicidad grave en los ensayos clínicos seleccionados
| Autor, año referencia | Lugar | Estado enfermedad tuberculosa | Régimen de tratamiento | Tiempo de seguimiento | Marcador de calidad | Número de pacientes y sexo (varones/mujeres) | Edad media (años) | Definición de HTX grave | Pacientes con HTX grave |
| Mwinga, 199819 | Zambia | No hay pruebas de enfermedad | RZ (600–3.500mg) 2/sem durante 3 meses frente a H (900mg) 2/sem durante 6 meses | 24 meses | 5 | RZ: 351 (208/143) | RZ: 31 | AST × 2 nivel basal | RZ: 1 (0,28%) |
| H: 350 (194/156) | H: 30 | H: 3 (0,85%) | |||||||
| Gordin, 200014 | Estados Unidos, México, Haití y Brasil | No hay pruebas de enfermedad | RZ (600–20mg/kg/d) c/24h durante 2 meses frente a H+Piridoxina (300–50mg) c/24h durante 12 meses HZ | 37 meses | 2 | RZ: 791 (560/231) | RZ: 36,9 | Hepatitis grado 4 o que provoque interrupción del tratamiento | RZ: 11 (1,39%) |
| PPD≥5mm | H: 792 (572/220) | H: 37,7 | H: 26 (3,28%) | ||||||
| Rivero, 200311 | España | No hay pruebas de enfermedad | RZ (10mg/kg/d−1.500,2.000, 2.500mg/d) c/24h durante 2 meses frente a H (5mg/kg/d) c/24h durante 6 meses | 24 meses | 2 | RZ: 77 (52/25) | RZ: 32 | AST o ALT × 3 nivel basal | RZ: 4 (5,19%) |
| Anergia cutánea | H: 83 (65/18) | H: 32 | H: 4 (4,81%) | ||||||
| Rivero, 200620 | España | No hay pruebas de enfermedad | RZ (10mg/kg/d–1.500, 2.000, 2.500mg/d3) c/24h durante 2 meses frente a H (5mg/kg/d) c/24h durante 6 meses | 24 meses | 2 | RZ: 105 (85/20) | RZ: 33 | AST o ALT ×3 nivel basal | RZ: 0 (0%) |
| PPD≥5mm | H: 108 (83/25) | H: 31,3 | H: 5 (4,63%) |
ALT: alanina-aminotransferasa; AST: aspartato-aminotransferasa; H: isoniacida; HTX: hepatotoxicidad; HZ: isoniacida + pirazinamida; RZ: rifampicina más pirazinamida.
En los 4 ensayos clínicos seleccionados se evaluó un total de 2.657 pacientes, de los que 1.324 recibieron RZ (351 administrada 2 veces a la semana durante 3 meses y 973 de forma diaria durante 2 meses) y 1.333 recibieron H (541 administrada diariamente durante 6 meses, 350 de ellos 2 veces a la semana durante 6 meses y 792 administrada diariamente durante 12 meses).
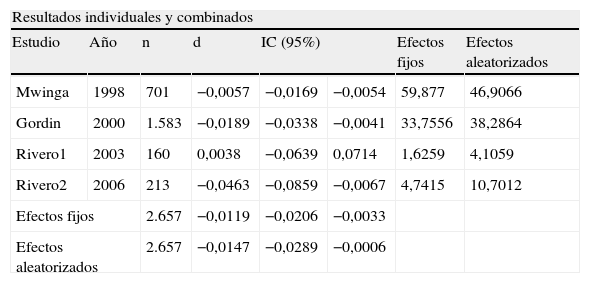
De los 2.657 pacientes incluidos en los estudios, en 54 (2%) se desarrolló hepatotoxicidad grave. De ellos, 16 se encontraban recibiendo RZ y 38 recibían 6 o 12H (el 1,208 frente al 2,851%; p=0,0042). El riesgo de desarrollo de hepatotoxicidad grave con RZ fue inferior al de H (−0,015, IC del 95%: −0,028 a −0,005).
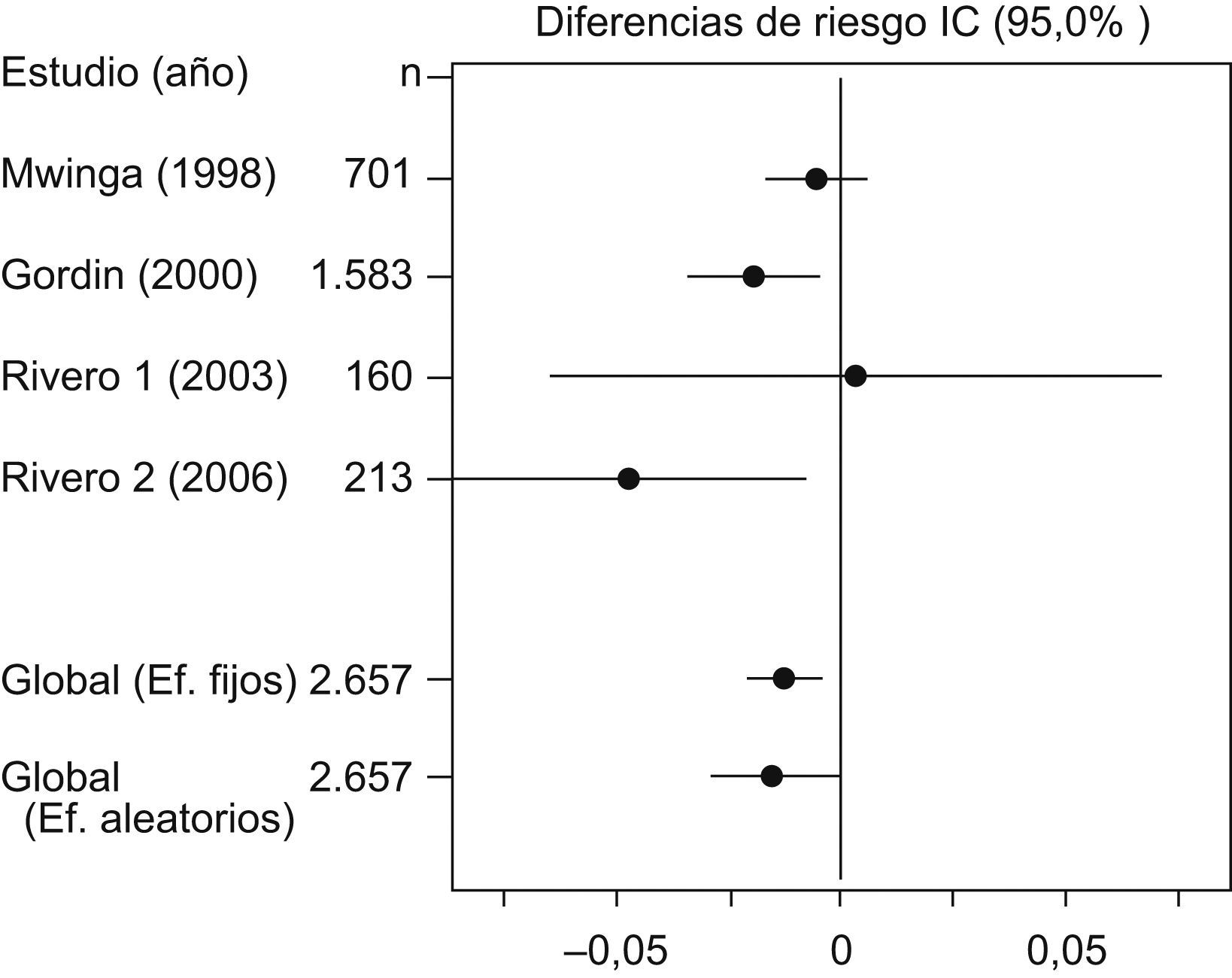
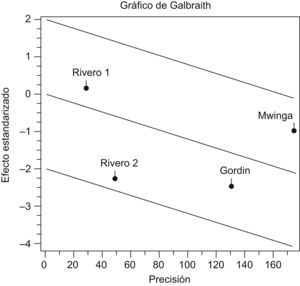
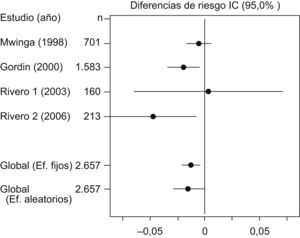
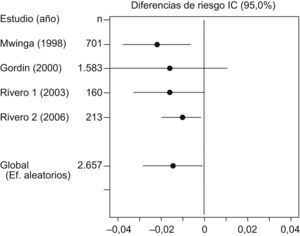
La prueba de Der Simonian y Laird, con un IC del 95% no indicó pruebas estadísticas de heterogeneidad entre los estudios (p=0,2453) (tabla 2). En la figura 1 se puede observar cómo todos los estudios se sitúan dentro de las bandas de confianza del gráfico. En la tabla 3 y en la figura 2, con un IC del 95%, se puede apreciar la diferencia de riesgos entre los regímenes evaluados, tanto en el modelo de efectos fijos (−0,0119; IC del 95%: −0,0206 a −0,0033) como en el modelo de efectos aleatorizados (−0,0147; IC del 95%: −0,0289 a −0,0006).
Análisis de heterogeneidad entre estudios realizado mediante la prueba Q de Der Simonian y Laird. Se asume como hipótesis que la variabilidad entre estudios es nula
| Estadísticos de heterogeneidad | Estimador |
| Varianza entre estudios | 0,0001 |
| Varianza intraestudios | 0,0001 |
| coeficiente de Relación de Interacción (proporción de varianza total explicada por la varianza entre-estudios) | 0,5043 |
| Coeficiente, variación entre estudios | 0,7434 |
Diferencia de riesgos entre los regímenes evaluados, tanto en el modelo de efectos fijos como en el modelo de efectos aleatorizados con un intervalo de confianza del 95%
| Resultados individuales y combinados | |||||||
| Estudio | Año | n | d | IC (95%) | Efectos fijos | Efectos aleatorizados | |
| Mwinga | 1998 | 701 | −0,0057 | −0,0169 | −0,0054 | 59,877 | 46,9066 |
| Gordin | 2000 | 1.583 | −0,0189 | −0,0338 | −0,0041 | 33,7556 | 38,2864 |
| Rivero1 | 2003 | 160 | 0,0038 | −0,0639 | 0,0714 | 1,6259 | 4,1059 |
| Rivero2 | 2006 | 213 | −0,0463 | −0,0859 | −0,0067 | 4,7415 | 10,7012 |
| Efectos fijos | 2.657 | −0,0119 | −0,0206 | −0,0033 | |||
| Efectos aleatorizados | 2.657 | −0,0147 | −0,0289 | −0,0006 | |||
Modelo de efectos fijos: sólo tiene en cuenta la variabilidad intraestudio. Modelo de efectos aleatorizados: valora también la existencia de variabilidad de los resultados entre los distintos estudios.
d: diferencia entre las 2 ramas de tratamiento; IC: intervalo de confianza; n: número de pacientes incluidos en el estudio.
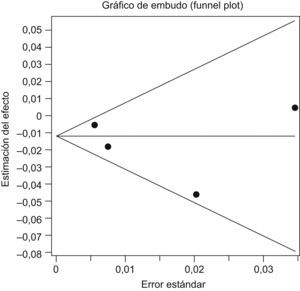
La prueba de Begg no demostró la existencia de sesgo de publicación (p=0,7341). El gráfico en embudo o funnel plot (fig. 3) muestra una nube de puntos que se distribuyen simétricamente en torno a la estimación global del efecto, lo que es indicativo de ausencia de sesgo de publicación (fig. 3). La prueba de Egger (p=0,5518) confirma la hipótesis de no existencia de sesgo, ya que la ordenada en el origen es igual a 0.
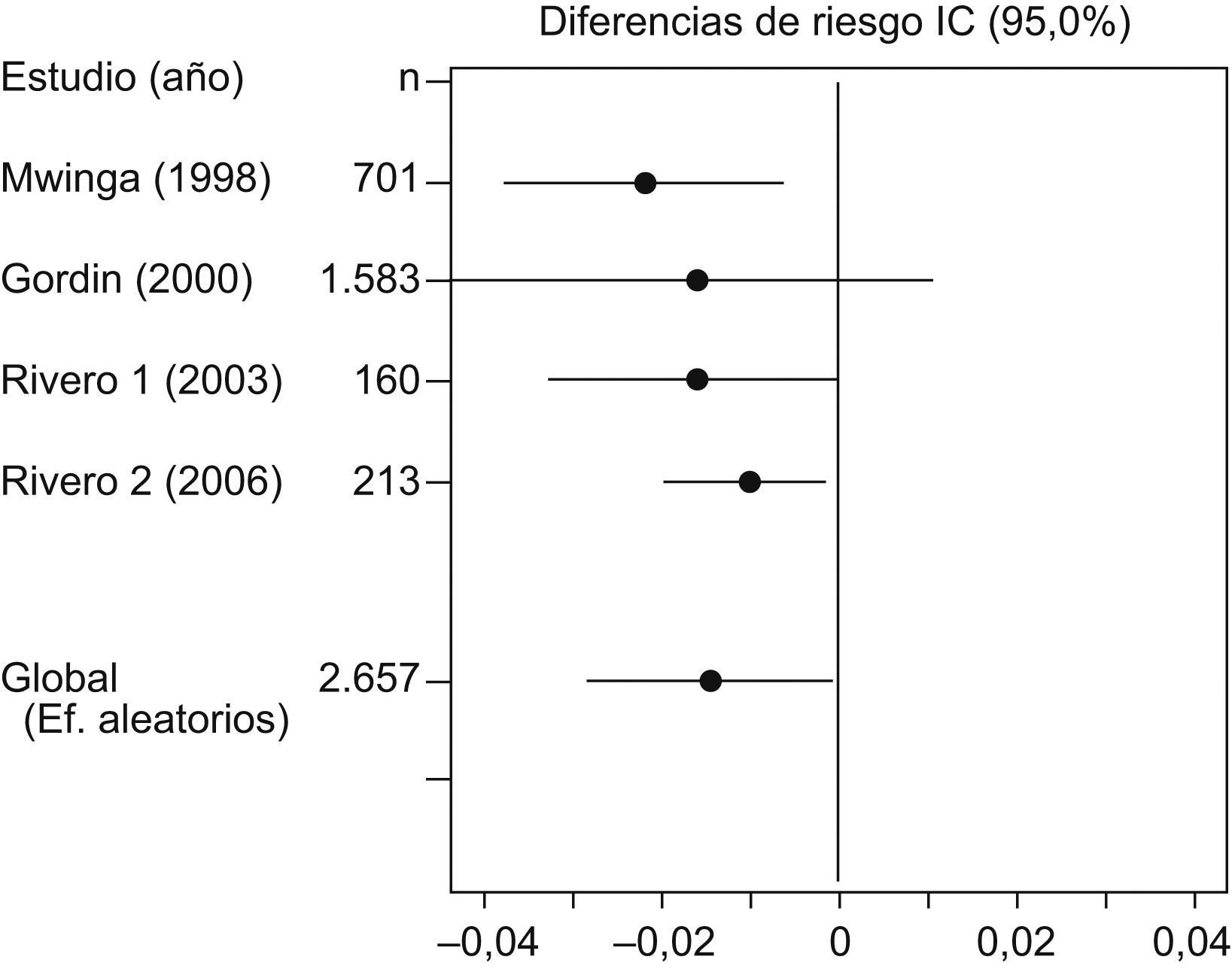
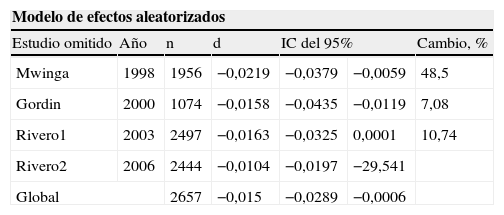
En la tabla 4 y la figura 4 se puede observar el análisis de sensibilidad en el que se comprueba que ninguno de los estudios modifica sustancialmente el resultado global si se elimina del metaanálisis.
Análisis de sensibilidad del metaanálisis
| Modelo de efectos aleatorizados | ||||||
| Estudio omitido | Año | n | d | IC del 95% | Cambio, % | |
| Mwinga | 1998 | 1956 | −0,0219 | −0,0379 | −0,0059 | 48,5 |
| Gordin | 2000 | 1074 | −0,0158 | −0,0435 | −0,0119 | 7,08 |
| Rivero1 | 2003 | 2497 | −0,0163 | −0,0325 | 0,0001 | 10,74 |
| Rivero2 | 2006 | 2444 | −0,0104 | −0,0197 | −29,541 | |
| Global | 2657 | −0,015 | −0,0289 | −0,0006 | ||
Se comprueba que ninguno de los estudios modifica sustancialmente el resultado global si se elimina del metaanálisis.
d: diferencia entre la 2 ramas de tratamiento; IC: intervalo de confianza; n: número de pacientes incluidos en el estudio.
Los resultados de este metaanálisis no demuestran que haya un aumento de riesgo de hepatotoxicidad grave entre pacientes infectados por VIH que reciben RZ para el tratamiento como profilaxis de TB, frente a la pauta estándar de 6 a 12H. Al contrario, los resultados del presente estudio indican que el riesgo de hepatotoxicidad grave con RZ en pacientes infectados por VIH puede ser inferior al de 6 a 12H.
Los datos de seguridad y eficacia de la pauta RZ en profilaxis antituberculosa analizados proceden de ensayos clínicos de asignación aleatorizada y controlados que no demuestran ni sugieren la existencia de un aumento del riesgo de hepatitis grave entre pacientes que recibieron RZ. Así, no se demostró mayor riesgo de hepatotoxicidad en un ensayo clínico realizado con 1.053 pacientes infectados por VIH, en el que se comparó la eficacia de RZ, en régimen de 2 dosis semanales durante 3 meses, con la de 6H y placebo19, y se describieron uno y 3 casos de hepatotoxicidad en los grupos de RZ e H, respectivamente. En otro ensayo clínico controlado que evaluó la eficacia y seguridad de 2RZ administrada diariamente en pacientes infectados por VIH con anergia cutánea, comparada con H y RH, sólo fue necesaria la retirada del tratamiento por hepatitis sintomática en un paciente en el grupo de H11. Estos resultados concuerdan con los de otro ensayo clínico de asignación aleatorizada que realizaron los mismos autores, en el que se incluyeron 316 pacientes infectados por VIH y en el que no se detectó ningún caso de hepatotoxicidad grave en el grupo de 2RZ20. Por último, un amplio ensayo clínico que incluyó a 1.583 pacientes con infección por VIH demostró que los pacientes que recibían 2RZ presentaban una menor incidencia de elevación de aminotransferasas que los que recibían 12H (el 1,4 y el 3,3%, respectivamente; p=0,02)14.
El estudio no incluido en el metaanálisis es un ensayo clínico de asignación aleatorizada que incluyó a 750 pacientes infectados por VIH, 370 con 6H y 380 con 2RZ. En este estudio no se comunicó ningún caso de hepatotoxicidad, aunque hay que tener en cuenta que sólo se comunicaron datos de seguridad hepática en las primeras 8 semanas de tratamiento, que representa todo el período de exposición a RZ y sólo parcialmente el tiempo de exposición a H12. Por tanto, ninguno de los estudios publicados hasta la actualidad, incluidos o no en el metaanálisis, han demostrado o sugerido que en pacientes infectados por VIH, la administración de RZ conlleve un mayor riesgo de hepatotoxicidad grave que la pauta estándar con H. De esta forma, ninguno de ellos permitiría avalar una recomendación en contra del empleo de la pauta 2RZ en profilaxis antituberculosa en pacientes infectados por VIH.
En otro metaanálisis previamente publicado, en el que se evaluó la misma estrategia de tratamiento de la ILT y que incluyó ensayos clínicos realizados tanto en pacientes infectados como no infectados por VIH, se obtuvieron resultados similares a los del presente estudio21. De los pacientes infectados sólo por VIH, en el 0,8% de los que recibieron RZ se desarrolló hepatotoxicidad grave, mientras que ésta se desarrolló en el 1,9% de los que recibieron H21.
Pese a los resultados obtenidos, se deben tener en cuenta algunas limitaciones del estudio a la hora de interpretar los resultados del metaanálisis. En primer lugar, el número de ensayos incluidos en el metaanálisis es bajo, ya que sólo se dispone de 5 ensayos clínicos de asignación aleatorizada de los que sólo 4 de ellos han resultado válidos para el análisis. En segundo lugar, la calidad de los estudios analizados es baja, ya que aunque todos los estudios seleccionados para este metaanálisis son ensayos clínicos prospectivos de asignación aleatorizada, sólo uno de ellos se diseñó como estudio doble ciego19. En tercer lugar, es importante señalar que la variable evaluada en el metaanálisis no fue la variable principal evaluada en cada uno de los ensayos clínicos, que fueron estudios diseñados para evaluar la eficacia de cada una de las pautas de tratamiento y no para analizar riesgo de hepatotoxicidad grave en cada una de ellas. En cuarto lugar, la diferente definición del desenlace evaluado en los distintos estudios podría afectar a la validez del metaanálisis. En quinto lugar, tanto el tiempo de tratamiento como la frecuencia de administración de las dosis en el grupo de RZ no fueron homogéneos en los diferentes estudios, dado que en uno de ellos los pacientes recibieron una pauta de RZ durante 3 meses 2 veces a la semana19, y en el resto de los estudios se utilizó RZ en régimen diario durante 2 meses11,14,20. Tampoco resultó homogénea la pauta de H en los diferentes ensayos clínicos incluidos en el metaanálisis. Dos estudios utilizaron una H diaria durante 6 meses11,20; en otro de ellos se administró H durante 6 meses pero dosificada 2 veces a la semana19, y finalmente, un estudio utilizó H durante 12 meses dosificada diariamente14. En sexto lugar, tampoco las características de los pacientes incluidos en los diferentes ensayos clínicos pueden considerarse homogéneas. Así, uno de los estudios sólo incluyó a pacientes infectados por VIH con anergia cutánea20; en el estudio de Mwinga et al19 la positividad a tuberculina no fue criterio de inclusión en el estudio y, de hecho, más del 75% de los pacientes incluidos presentaron una reacción a la tuberculina inferior a 5mm; por último, los otros 2 estudios incluyeron exclusivamente pacientes con reacción positiva a la tuberculina11,14.
Por último, hay que tener en cuenta que la población representada en los estudios analizados en este metaanálisis puede no ser representativa de la población infectada por VIH actual, ya que todos los estudios se diseñaron (y en su mayor parte finalizaron) en fecha anterior a la disponibilidad del tratamiento antirretrovírico de gran actividad (TARGA). Por este motivo, ninguno de los pacientes incluidos en los estudios analizados recibió TARGA en el momento de exposición a las drogas en estudio, o anteriormente a éste. La utilización del TARGA en países desarrollados ha conseguido mejorar de forma drástica el pronóstico y la supervivencia de los pacientes infectados por VIH, al lograr revertir o evitar su deterioro inmunitario22. De esta manera, un número considerable de los pacientes incluidos en este estudio podría encontrarse en situación de inmunodepresión. Sin embargo, con excepción del estudio de Rivero et al11 realizado en sujetos anérgicos, el resto de los estudios contenían una elevada proporción de sujetos sin inmunodepresión grave. En los estudios de Gordin et al14 y en el otro estudio de Rivero et al realizado en pacientes con reacción positiva a tuberculina20 la mediana de linfocitos CD4+ fue superior a 400cel/ml, es decir que más de la mitad de los pacientes incluidos no presentaban un grado grave de inmunodepresión. Por último, en el estudio de Mwinga et al, aunque no se determinaron las cifras de linfocitos CD4+, el 50% de los pacientes incluidos tenía un recuento de linfocitos totales superior a 2 x 109/l. La incidencia de hepatotoxicidad secundaria a algunos fármacos se encuentra inversamente relacionada con el grado de inmunodepresión de los pacientes23. El ejemplo más significativo de este hecho es la hepatotoxicidad por nevirapina24; el riesgo de hepatotoxicidad en pacientes infectados por VIH aumenta conforme lo hace la cifra de linfocitos CD4+. De tal modo, que se desaconseja su uso en mujeres con un recuento de linfocitos CD4+ superior a 250 x 106/l y en varones con un recuento de linfocitos CD4+ mayor de 400 x 106/l25. Por este motivo, podría especularse que el riesgo de hepatotoxicidad por RZ pudiera tener un comportamiento similar. La descripción de una mayor incidencia de hepatotoxicidad asociada a RZ17,21 y la descripción de casos de hepatotoxicidad grave en pacientes no infectados por VIH16 podrían apoyar esta hipótesis17. Sin embargo, aunque la hipótesis de la inmunodepresión resulte muy atractiva para explicar la falta de toxicidad grave de RZ en individuos infectados por VIH, las pruebas disponibles comentadas anteriormente sugieren que podría deberse a otra explicación.
En resumen, el presente estudio no demuestra la existencia de un aumento de riesgo de hepatotoxicidad grave entre pacientes infectados por VIH que reciben RZ como tratamiento de la ILT, frente a la pauta estándar de tratamiento con H durante 6 a 12 meses. Por esto, pese a las limitaciones señaladas, no hay argumentos en la literatura médica que permitan realizar una recomendación en contra del uso de la pauta 2RZ en profilaxis antituberculosa en pacientes infectados por VIH.