La vigilancia epidemiológica de la infección por el VIH ha experimentado en los últimos 10 años notables mejoras que favorecen el conocimiento de la epidemiología de la infección adaptando las intervenciones sanitarias a las características de la epidemia.
Por otra parte, el retraso del diagnóstico de la infección por VIH, tanto en el ámbito nacional como internacional, constituye un problema importante para la disminución de la transmisión del virus y el control de la epidemia. Durante los últimos 10 años, a pesar de la aparición de nuevas tecnologías de diagnóstico, la disminución del retraso diagnostico en España ha sido, aunque estadísticamente significativo, insuficiente en términos de salud publica, lo que nos obliga a revisar las estrategias utilizadas tanto para aumentar la accesibilidad a la prueba y la alerta de la población, como para disminuir las oportunidades perdidas para el diagnóstico temprano.
Epidemiological surveillance of HIV infection has made notably progress over the last decade, improving knowledge of its characteristics and adapting treatment accordingly.
On the other hand, the delayed diagnosis of HIV infection is still an important problem to reduce transmission and improve epidemic control both national and internationally. Although the increased availability of new testing technologies over the last ten years, progress, although statistically significant,in reducing late diagnosis in Spain has been, insufficient in terms of public health, meaning that additional efforts should be put in place to review strategies and increase accessibility to tests, population awareness and decrease the lost opportunities for early diagnosis.
La infección por el virus de la inmunodeficiencia humana (VIH) y el diagnóstico del sida aun constituyen unos de los mayores problemas de salud pública en el mundo. De ahí que su vigilancia epidemiológica tenga gran prioridad.
El objetivo de la vigilancia es cuantificar la magnitud de la epidemia y definir las características de la población afectada, en particular en relación con las formas de contagio del virus. Los distintos factores sociodemográficos, culturales, económicos y políticos de cada zona determinan la diferente evolución de la epidemia en las distintas áreas geográficas del planeta. La epidemia ha ido creciendo exponencialmente en muchos países, así como extendiéndose a todas las áreas del planeta que inicialmente no se habían visto afectadas, y hoy puede hablarse de pandemia del VIH. En los países más afectados ya se han producido descensos importantes en la esperanza de vida por esta causa.
El número estimado de personas que viven con el VIH en el mundo a finales del 2008 continuaba creciendo, llegando a 33,4 millones. Esta cifra representa un aumento del 16% respecto a la del año 20011 y se distribuye en: 31,3 millones de varones infectados; 15,7 millones de mujeres y 2,1 millones niños menores de 15 años.
En cuanto a las nuevas infecciones por el VIH, la evolución respecto a 2001 es de un descenso en un 15%. En 2008 hubo 2,3 millones de nuevas infecciones en adultos y 430.000 en niños. En cambio, la evolución de la mortalidad atribuible al sida continúa aumentando en 2008: 2 millones comparado con 1,9 millones en el 2001.
La principal forma de contagio en el mundo es la relación sexual no protegida y entre los casos pediátricos (menores de 15 años) el 90%2 de las infecciones son atribuibles al contagio vertical, pero los patrones de la epidemia han variado con el tiempo en algunas regiones. Así, en Europa del Este y Asia Central, epidemias que anteriormente se caracterizaban por la transmisión entre usuarios de drogas inyectadas (UDI) son cada vez más atribuibles al contacto sexual. En otras partes de Asia, la epidemia se caracteriza por la transmisión heterosexual, como en las zonas hiperendémicas como es el África subsahariana. Esta región es la más afectada, con el 71% de las nuevas infecciones en el mundo.
Las mejoras de los sistemas de vigilancia del VIH no sólo permiten tener una mejor idea de la epidemia, sino que son un elemento fundamental para que los gobiernos actúen adaptados a las características de la epidemia. Las medidas fundamentales son la prevalencia y la incidencia de la infección por el VIH.
Las formas de estimar la incidencia del VIH han evolucionado en los dos últimos años. En la actualidad, se prima la estimación según modos de transmisión. El grupo de referencia de UNAIDS para la estimación, la modelización y las proyecciones estima el número de nuevas infecciones en un año determinado. El modelo asume que el riesgo de infecciones es una función de la prevalencia del HIV entre las parejas, el número de parejas y el número de contactos con cada pareja, con un peso adicional en la presencia de infecciones de transmisión sexual y circuncisión. Este tipo de análisis se ha realizado tan sólo en 12 países, pero en el futuro es esperable su expansión por su utilidad en la detección de poblaciones escondidas.
En Europa, la evolución de la epidemia del VIH también ha sido hacia un aumento. A pesar de la variabilidad en la declaración entre países, podemos decir que en 2008 se reportaron 51.600 casos de VIH, de los cuales 25.656 eran nuevos.
Las mujeres que viven infectadas por el VIH en 2008 constituyen el 31% de todos los infectados y los niños infectados menores de 15 años constituyen el 2%.
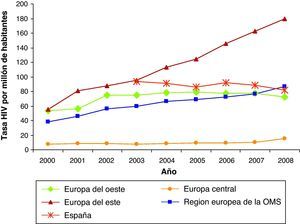
En cuanto al modo de transmisión del VIH, a diferencia del patrón mundial, el modo predominante de transmisión en Europa es el de sexo entre varones seguido por el contacto heterosexual3. El modo de transmisión del VIH varía sustancialmente según la región. Así, en Europa del Este se atribuía a los UDI y recientemente evoluciona a un patrón de transmisión sexual. En Europa central y del Oeste es el patrón de sexo entre varones seguido del heterosexual. Una de las mayores desventajas de la vigilancia es la infradeclaración y se estima que las cifras se doblarían si la cobertura de declaración fuera más completa4.
En cuanto a la incidencia de casos de sida, entre 2001 y 2008 el número de casos de sida ha descendido de 12.072 a 7.564. En 2008, España ocupa el cuarto lugar de la Unión Europea, con 29,1 casos por millón de habitantes, después de Estonia, Letonia y Portugal.
En España, la coincidencia en el tiempo del inicio de la epidemia del VIH con la del uso parenteral de drogas ilegales marcó la expansión del virus y el patrón epidemiológico observado, ya que, en nuestro país, la introducción del virus se produjo sobre todo por el uso compartido de material de inyección y, en menor medida, en hombres que tienen sexo con hombres (HSH)5.
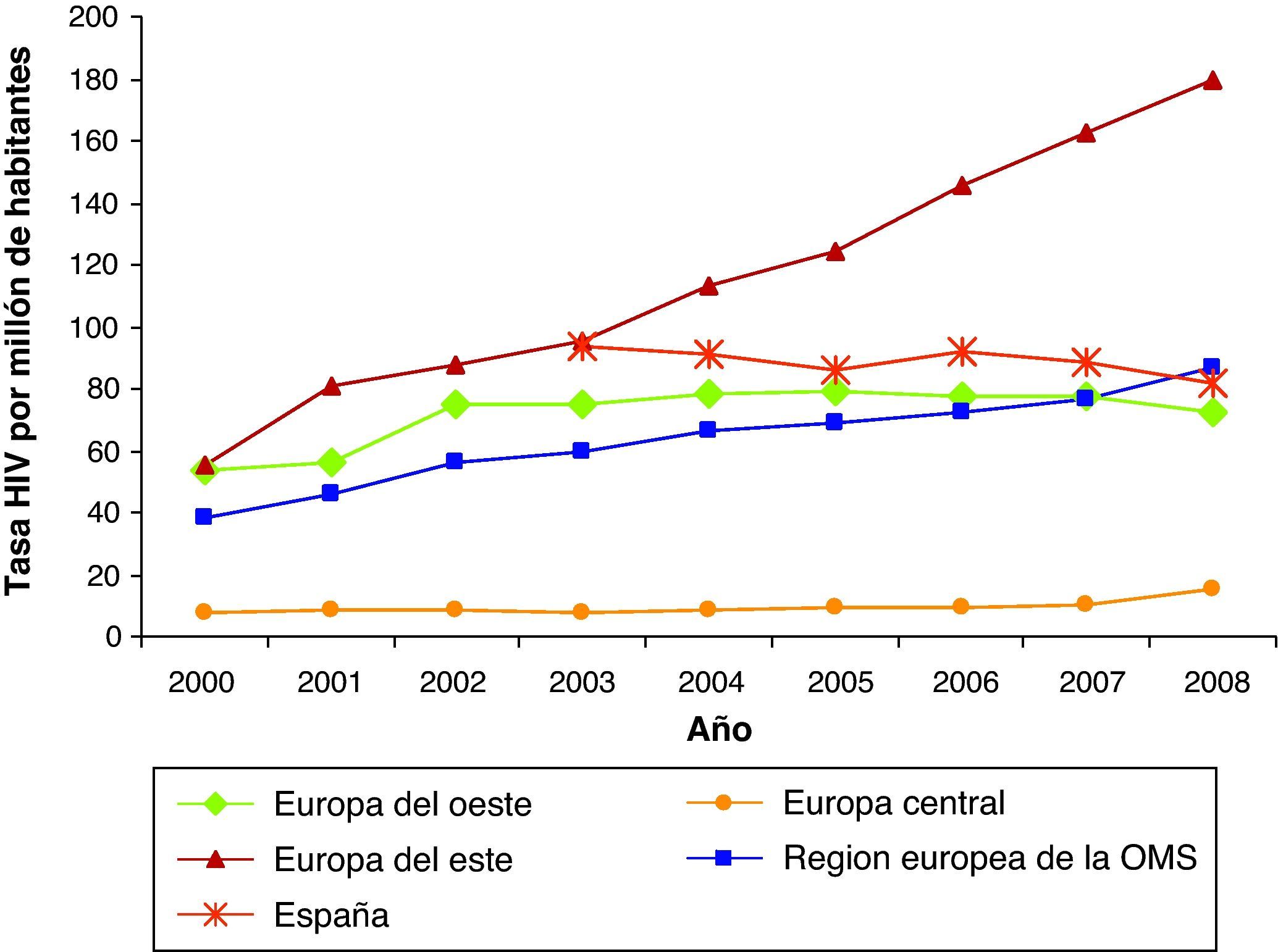
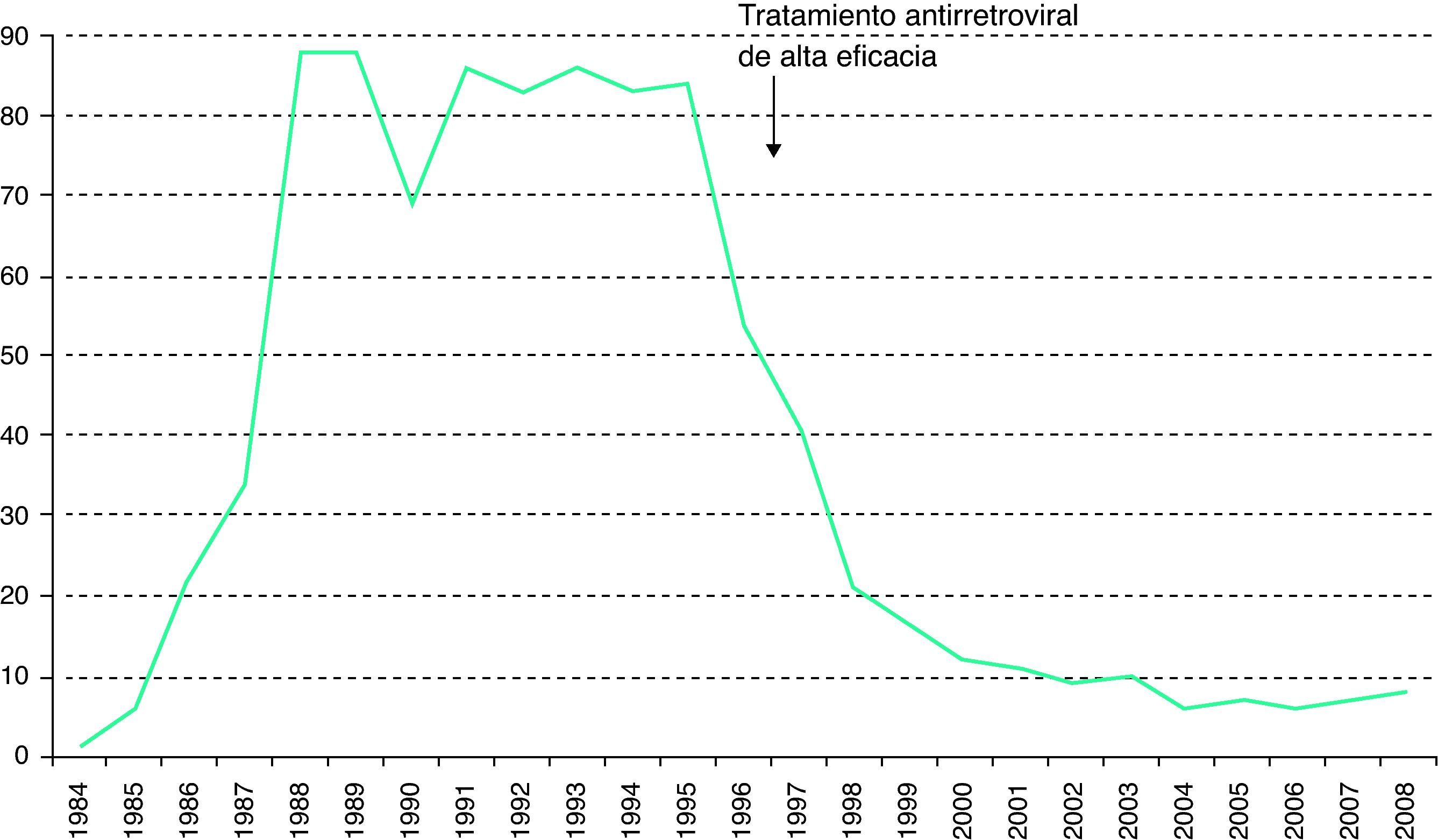
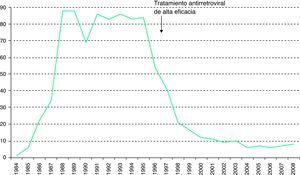
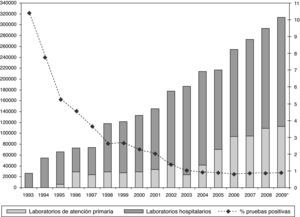
Desde 2003, a la notificación obligatoria del sida se le ha unido la notificación voluntaria de la infección por el VIH. Entre 2003 y 2008 los nuevos diagnósticos de infección por VIH han disminuido de 93,7 a 81,9 casos por millón de habitantes3 (fig. 1). En el global de las 12 comunidades autónomas (CC. AA. analizadas, los varones suponen el 77% de los nuevos diagnósticos. Para este periodo, la transmisión heterosexual es la más frecuente (42%), seguida del sexo entre varones y los UDI6. La transmisión vertical del VIH experimentó un fabuloso descenso a partir del año 1996, con la disponibilidad del tratamiento antirretroviral de alta eficacia (fig. 2).
En el año 2008, el 37% de los nuevos diagnósticos de infección por el VIH se realizó en inmigrantes. Tras el origen español, los más frecuentes fueron el latinoamericano (16%), el subsahariano (11%) y el de Europa occidental (5%).
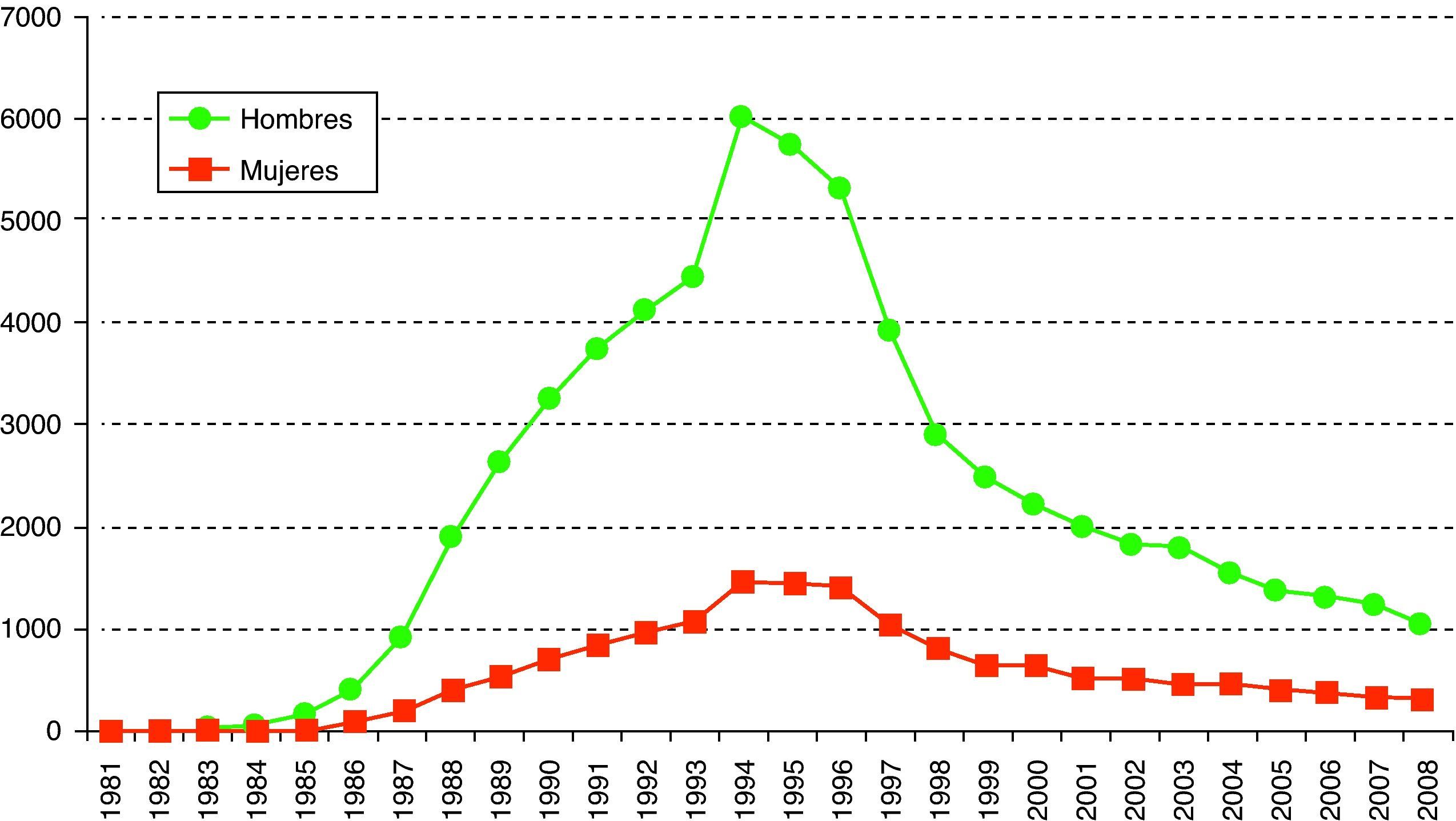
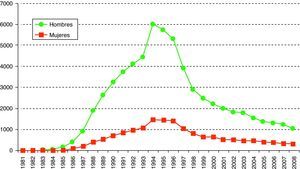
En el caso de las mujeres, más del 50% de los diagnósticos eran en inmigrantes.En cuanto a los casos de sida, desde el inicio de la epidemia en España (1993-2008) se han notificado un total de 77.953 casos de sida (fig. 3).
A pesar del marcado descenso de la incidencia de sida en España desde la extensión de los nuevos tratamientos antirretrovirales, nuestro país sigue siendo uno de los que tiene mayor incidencia de sida en Europa occidental.
Hasta 1997 la proporción de casos de sida en personas cuyo país de origen no era España estuvo por debajo del 3% pero a partir de 1998 esta cifra subió progresivamente hasta alcanzar el 26,5% en 2008. El 41% de estas personas extranjeras procedía de Latinoamérica y el 34% de países de África.
En este año, el 77% de casos de sida recayeron en varones y la edad media al diagnóstico es de 41 años. La proporción de casos pediátricos (menores de 13 años) es del 0,4% (fig. 3).
En el periodo 2004-2008, la tuberculosis de cualquier localización siguió siendo la enfermedad indicativa de sida más frecuente, afectando al 29% de los casos. Le sigue la neumonía por Pneumocystis jirovecii (22,9%) y la candidiasis esofágica (14%)7.
El retraso diagnóstico de la infección por el virus de la inmunodeficiencia humanaEn España, se estima que unas 120.000 personas viven actualmente infectadas por el VIH y que alrededor del 30% de estas personas no saben que lo están, al igual que en el resto de Europa. El conocimiento del estado serológico con respecto al VIH es uno de los aspectos clave para detener la propagación de la epidemia. Estudios recientes estiman que esta fracción oculta de población infectada por el VIH causa más de la mitad de las nuevas infecciones8.
La reducción del tiempo que pasa entre la infección y el diagnóstico del VIH es una prioridad de los programas de prevención del VIH/sida9, incluido el español10. En España, donde el acceso al tratamiento antirretroviral es gratuito y universal cuando se precisa, el retraso en el diagnóstico de la infección por el VIH tiene consecuencias negativas, tanto individuales como de salud pública. Por un lado, las personas infectadas por el VIH con un estadio avanzado de inmunosupresión presentan peor respuesta al tratamiento antirretroviral de gran actividad (TARGA)11 y tienen mayor riesgo de presentar sida o muerte12,13. Por otro lado, desde la perspectiva de salud pública, la probabilidad de transmitir la infección por el VIH es mayor cuanto más tiempo permanezca el individuo sin conocer que está infectado al no adoptar comportamientos de menor riesgo7,14 y al no recibir los beneficios de iniciar TARGA de forma temprana15.
El recuento de linfocitos CD4 al momento del diagnóstico recientemente se han incluido en los programas de vigilancia europeos16. Durante 2008, 22 países europeos proporcionaron información del recuento de linfocitos CD4 en el momento del diagnóstico del VIH. De éstos, 13 países proporcionaron información del recuento de linfocitos CD4 de más del 50% de los nuevos diagnósticos. Según la vía de transmisión, en 15 países (de los 21 con información de la vía de transmisión) el mayor porcentaje de diagnósticos del VIH con linfocitos CD4<350 fue a través del contacto heterosexual17.
En Europa, las definiciones más comunes de diagnóstico tardío (DT) se basan en los recuentos de linfocitos CD4, ya sea solos, en combinación con la presentación clínica o en combinación con el tiempo hasta la aparición del sida tras el diagnóstico de VIH18. De estas definiciones, el recuento de linfocitos CD4<200 células es el criterio más frecuentemente utilizado. Esta variación en las definiciones hace que sea difícil comparar los resultados de DT entre diferentes países.
Según los datos aportados durante el 2008 por los Sistemas de Vigilancia de Nuevos Diagnósticos de la Infección por el VIH de 12 CC. AA. españolas (cobertura del 43% del total de la población nacional), del total de los 1.583 nuevos diagnósticos del VIH el 85% (1.345) informó del recuento de linfocitos CD4 en el momento del diagnóstico.
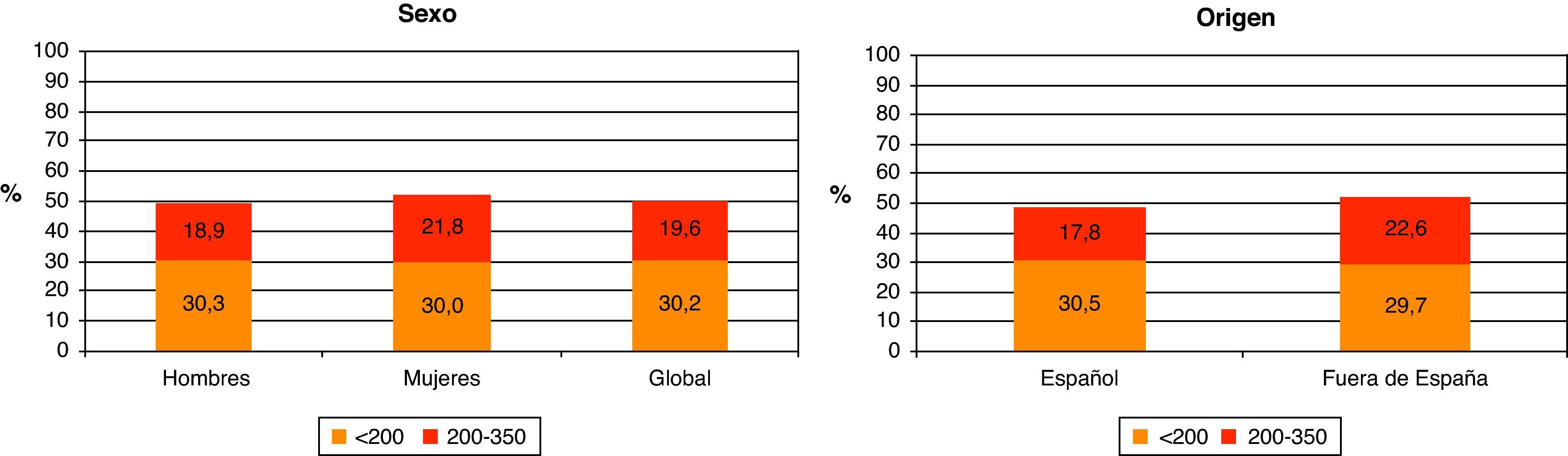
La mediana de CD4 al diagnóstico fue 352 (rango intercuartílico [RIC] 146-560). Un 49,8% de los nuevos diagnósticos presentaron un recuento de CD4 inferior a 350 cel/μl y de éstos el 30,2% el recuento de CD4 fue inferior a 200 cel/μl.
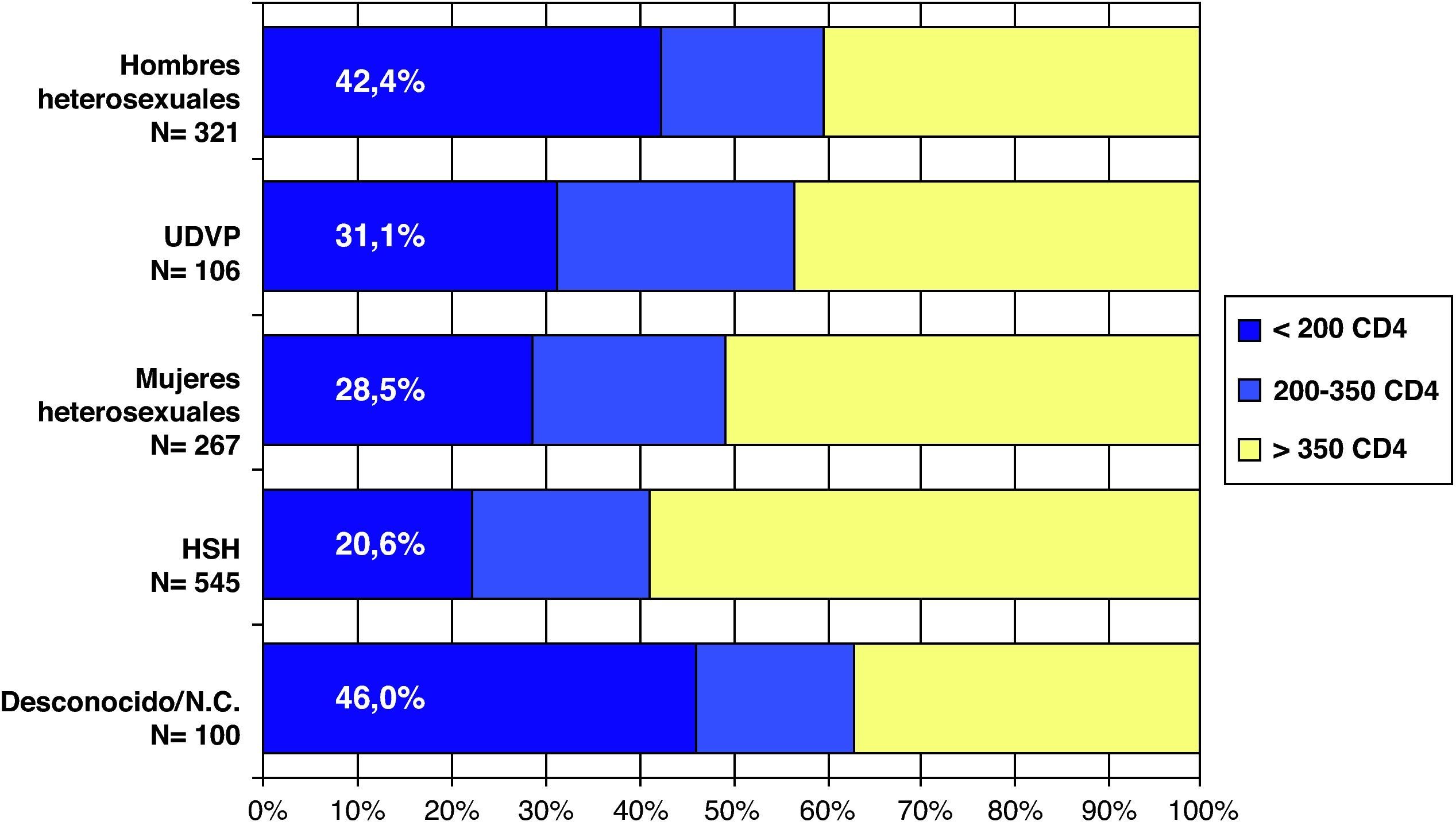
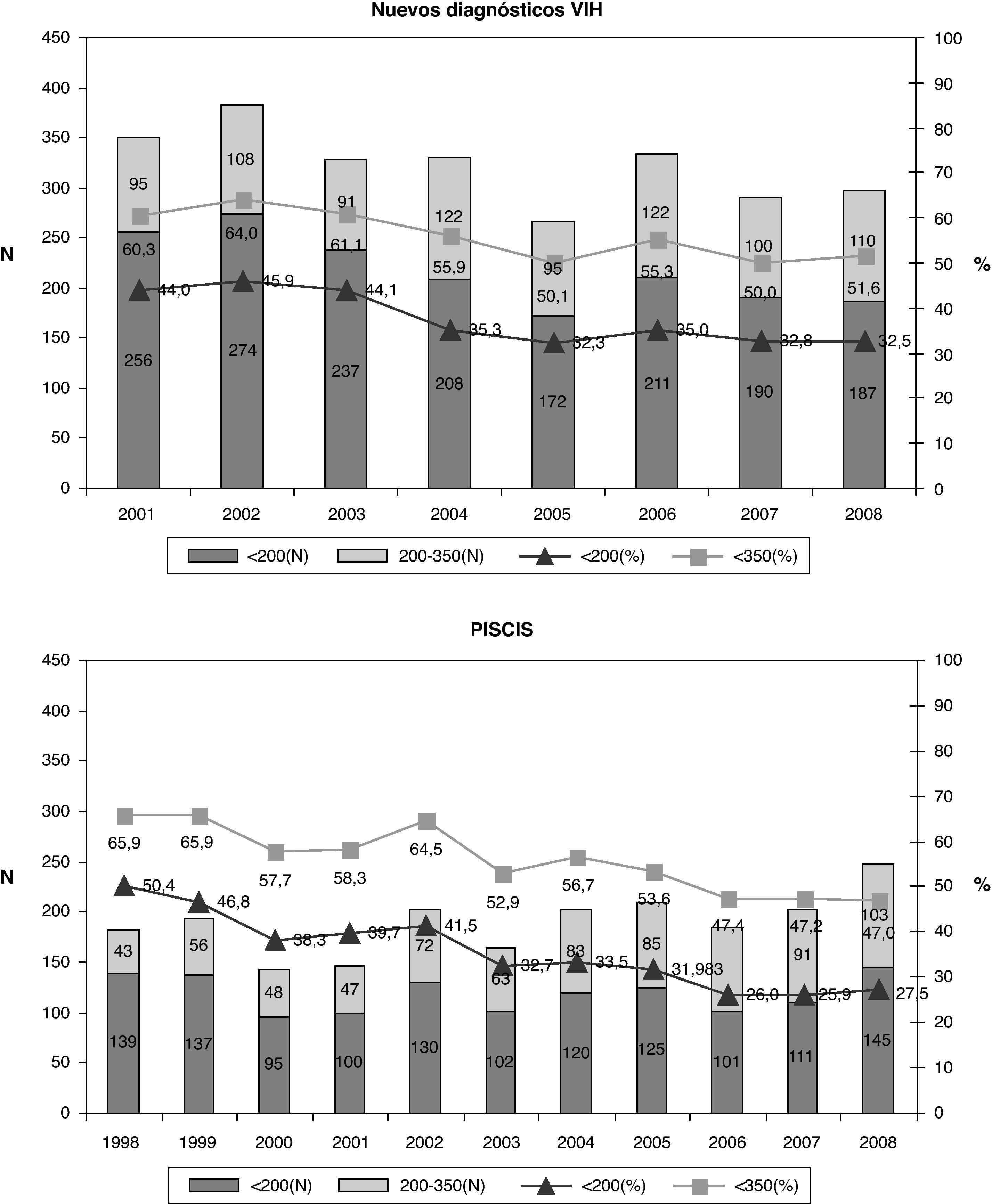
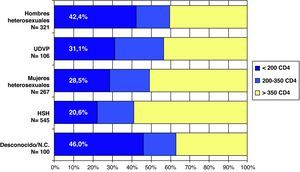
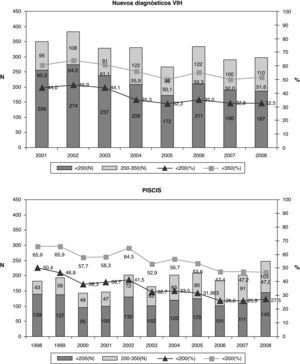
Teniendo en cuenta que el DT de la infección por el VIH se ha definido en España y en el año 2008 como un recuento de CD4 inferior a 200 cel/μl, no se observan diferencias en el porcentaje según sexo ni según si es de origen español o no (fig. 4). Al analizar el DT según la vía de transmisión, el DT es máximo en los varones heterosexuales (42,4%), siendo los HSH los que presentan un menor retraso (20,6%). Las mujeres heterosexuales y los usuarios de drogas por vía parenteral (UDVP) son los que presentan una cifra intermedia del 28,5 y el 31,1%, respectivamente (fig. 5). Para analizar el DT según la edad, se reagrupó la variable en 5 categorías (< 25 años, 25-34 años, 35-44 años, 45-54 años y>54 años). Se observa que el DT aumenta considerablemente con la edad, pasando del 10% en los menores de 25 años al 48% en los mayores de 54 años. Al analizar la tendencia del DT a lo largo del período 2004-2008, en conjunto se observa un descenso continuado de los nuevos diagnósticos del VIH del 36% en 2004 al 30,9% en 2008. Esta tendencia descendente, sin embargo, sólo se mantiene para la vía de transmisión HSH que, concretamente, pasa del 26,7% en 2004 al 20% en 2008. Para el resto de las vías de transmisión el porcentaje de DT se mantiene estable.
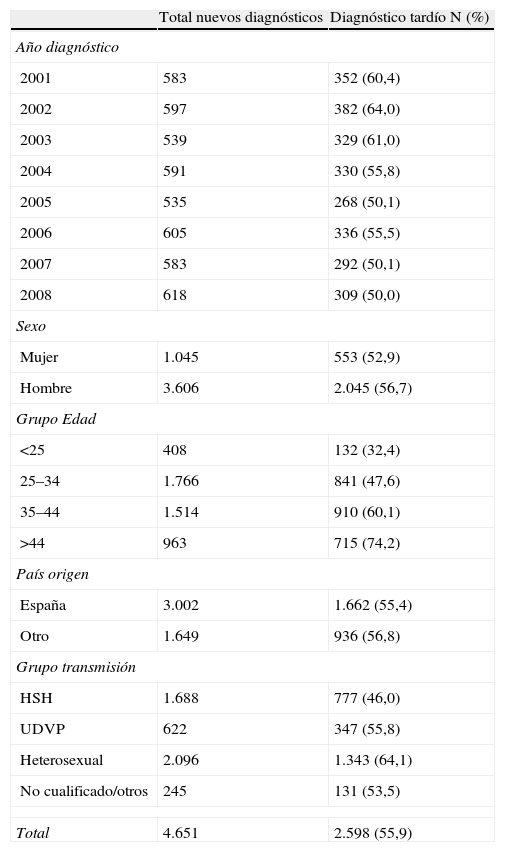
Recientemente, el grupo de trabajo europeo para el consenso del DT ha publicado una definición sobre el DT como aquella persona con un nuevo diagnóstico del VIH y recuento de linfocitos CD4 inferior a 350 o que presenta una enfermedad indicativa de sida, independientemente del recuento de CD419. En Cataluña, a partir del Sistema de Información de nuevos diagnósticos de VIH, se ha analizado el DT teniendo en cuenta esta definición. Durante el período 2001-2008, del total de los 5.569 nuevos diagnósticos se disponía del recuento de linfocitos CD4 en 4.651 (83,5%). La mediana de CD4 al diagnóstico fue 298 (RIC 102-528). Un 55,9% de los nuevos diagnósticos presentaron un recuento de CD4 inferior a 350 cel/μl y de éstos el 37,6% el recuento de CD4 fue inferior a 200 cel/μl. En la tabla 1 se observan las características del DT. No se observan diferencias en cuanto al porcentaje según sexo ni según si es de origen español o no. El porcentaje de DT aumenta con la edad, pasando del 32,4% en menores de 25 años al 74,2% en los mayores de 44 años. Al analizar el DT según la vía de transmisión, los heterosexuales son los que presentan una mayor proporción de casos con DT (45,1%). En cuanto a la tendencia del DT durante el período analizado, se observa un descenso del 60,4% en 2001 al 50,0% en 2008.
Número y proporción de individuos con retraso en el diagnóstico de infección por VIH en Cataluña, 2001–2008.
| Total nuevos diagnósticos | Diagnóstico tardío N (%) | |
| Año diagnóstico | ||
| 2001 | 583 | 352 (60,4) |
| 2002 | 597 | 382 (64,0) |
| 2003 | 539 | 329 (61,0) |
| 2004 | 591 | 330 (55,8) |
| 2005 | 535 | 268 (50,1) |
| 2006 | 605 | 336 (55,5) |
| 2007 | 583 | 292 (50,1) |
| 2008 | 618 | 309 (50,0) |
| Sexo | ||
| Mujer | 1.045 | 553 (52,9) |
| Hombre | 3.606 | 2.045 (56,7) |
| Grupo Edad | ||
| <25 | 408 | 132 (32,4) |
| 25–34 | 1.766 | 841 (47,6) |
| 35–44 | 1.514 | 910 (60,1) |
| >44 | 963 | 715 (74,2) |
| País origen | ||
| España | 3.002 | 1.662 (55,4) |
| Otro | 1.649 | 936 (56,8) |
| Grupo transmisión | ||
| HSH | 1.688 | 777 (46,0) |
| UDVP | 622 | 347 (55,8) |
| Heterosexual | 2.096 | 1.343 (64,1) |
| No cualificado/otros | 245 | 131 (53,5) |
| Total | 4.651 | 2.598 (55,9) |
Como se ha dicho, los dos principales beneficios del diagnóstico temprano del VIH son, por un lado y a nivel individual, poder tratar la infección de acuerdo con los criterios clínicos y, por tanto, contribuir a mejorar su pronóstico12,20 y a nivel poblacional, en el sentido de que una persona que se conoce infectada tiene más probabilidades de cambiar su conducta y contribuir por tanto a disminuir la incidencia de la infección13. Pero además, el hecho de identificar a las personas VIH+en estadios tempranos de la infección aumenta también el rendimiento de los estudios de contactos. Finalmente, disponer de información más precisa sobre el retraso del diagnóstico del VIH en una comunidad determinada facilitaría la interpretación de los datos de prevalencia de la infección. Por todo ello, la promoción del diagnóstico temprano de la infección por el VIH deber ser uno de los componentes prioritarios de los programas de prevención y control de esta infección.
Si bien existe un claro consenso técnico sobre estos aspectos y la pertinencia de favorecer el diagnóstico temprano, no lo hay tanto respecto a qué intervenciones implementar de forma prioritaria y cómo, siendo una de las principales dificultades la propia definición de «retraso en el diagnóstico». Desde una perspectiva clínica, se considera retraso en el diagnóstico cuando éste se realiza cuando la historia natural de la infección ya ha sobrepasado los criterios de tratamiento, hasta no hace mucho tener igual o menos de 200 CD4 y actualmente tener igual o menos de 350 CD4. Desde una perspectiva operacional, favorecer el diagnóstico temprano consistiría en conseguir que el máximo número posible de personas infectadas por el VIH sepan que lo están lo antes posible. Para conseguir este objetivo se han desarrollado distintas estrategias: campañas de sensibilización y de promoción de la prueba, hacer la prueba diagnóstica de rutina en los servicios sanitarios (exclusión voluntaria), sistematizar el estudio de contactos en el VIH, eliminar o disminuir barreras operativas, como el consejo asistido o su duración en determinados servicios o poblaciones, facilitar el acceso a las pruebas mediante servicios y tecnologías que se puedan implementar en la comunidad (puntos de atención, programas de acercamiento, pruebas de diagnóstico rápido, etc.). Cada una de ellas tiene sus ventajas y sus inconvenientes y, por tanto, las políticas de salud deberían tender a utilizar todas ellas en función del contexto. En cualquier caso, en estos momentos el tema más debatido es la utilización de las políticas de exclusión voluntaria (opt out, en inglés) en los servicios de salud, ya sean hospitalarios o de atención primaria. El concepto de exclusión voluntaria significa que, a no ser que una persona exponga activamente su oposición a ello, por el hecho de entrar en contacto con los servicios de salud se le realizará sistemáticamente una prueba de detección de anticuerpos anti-VIH. Esta aproximación es la que se realiza para muchas pruebas diagnósticas, ya sean serológicas o no, y por ello en Europa el European Centre for Disease Prevention and Control recomienda no usar esta terminología que puede llevar a cierta confusión. De hecho, lo que realmente se está discutiendo es si las pruebas de detección de anticuerpos anti-VIH se deben universalizar en el sistema de salud, independientemente de la historia clínica y sintomatología de los pacientes, o sólo se deben indicar cuando haya información sobre posibles exposiciones o la presentación clínica sugiera el diagnóstico diferencial con la infección por el VIH. En EE. UU., donde distintos estudios sugieren el coste-efectividad de las políticas de exclusión voluntaria21, los CDC vienen recomendando esta aproximación desde 200622. En Europa en general se prioriza el uso restringido de las mismas a personas potencialmente expuestas al VIH o con sintomatología compatible por esta infección, es decir, las políticas de cribado suelen priorizar los grupos vulnerables y nucleares (grupos con una alta prevalencia de infección y con elevado número de contactos entre sus miembros). A pesar de ello, Francia ha anunciado que en el año 2011 iniciará la política de cribado universal en los servicios de salud del país.
En cualquier caso, teniendo en cuenta la información disponible derivada de estudios de monitorización conductual, en Catalunya, por ejemplo, en 2009 sólo el 46,1, el 60 y el 58,5% de los UDVP, HSH y trabajadores del sexo, respectivamente, se habían realizado una prueba diagnóstica de VIH en los últimos 12 meses; es decir, existe aun un amplio margen para aumentar la cobertura de la prueba entre algunos de los grupos considerados a mayor riesgo de la población. Por ello, en ausencia de información sobre el coste-efectividad de las políticas de universalización de la prueba en el sistema sanitario de nuestro contexto, parece lógico priorizar las políticas de cribado en grupos vulnerables y nucleares, haciendo especial hincapié en los servicios y programas insertados en la comunidad que facilitan el acceso a las pruebas diagnósticas a personas que no están en contacto con los servicios sanitarios y sociales. Entre ellos cabe destacar los puntos de atención, como Checkpoint en Barcelona23, o los programas de acercamiento diseñados para poblaciones específicas.
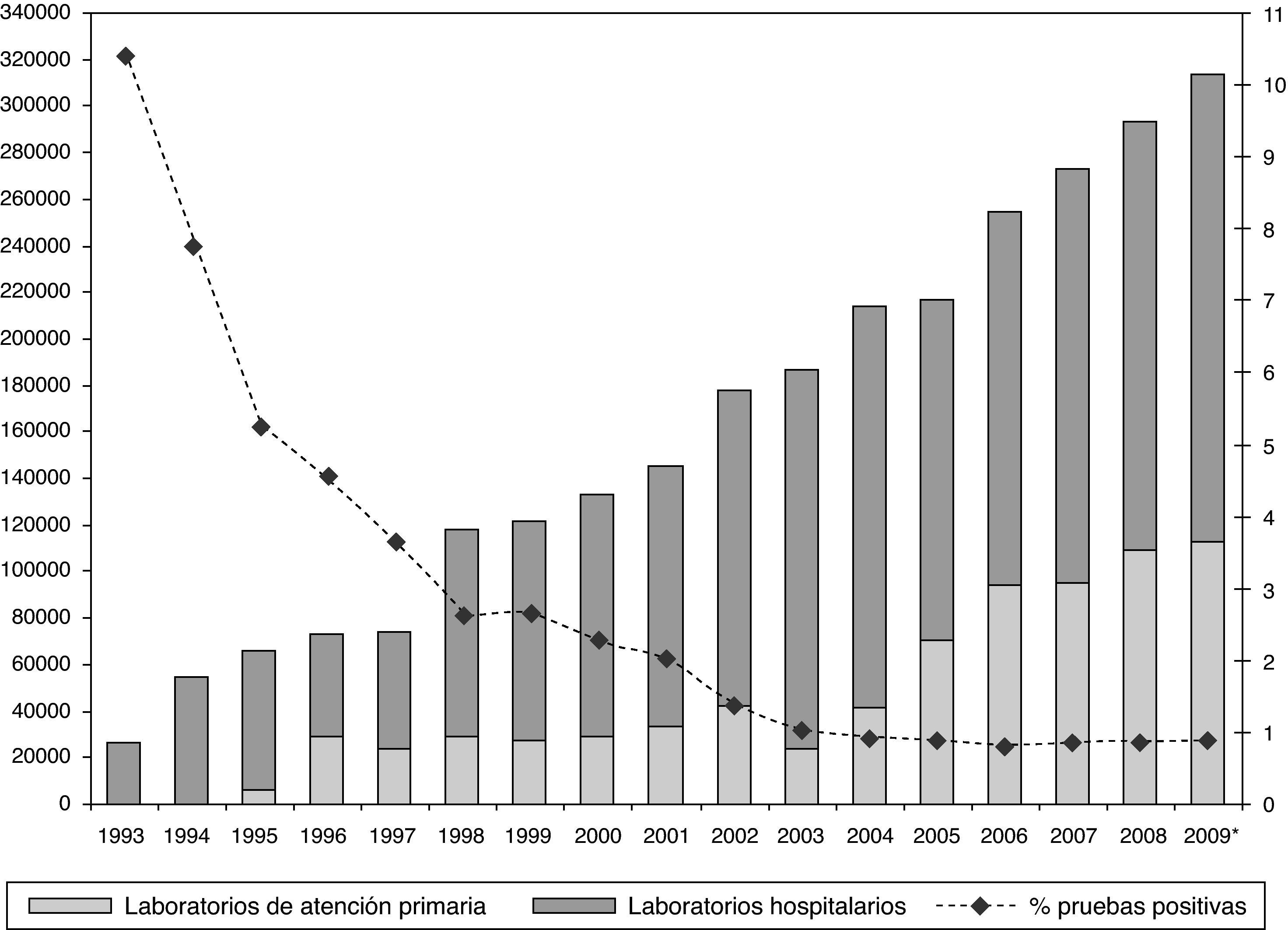
En Cataluña, el conjunto de esfuerzos realizados para aumentar la oferta y acceso a las pruebas de detección de anticuerpos anti-VIH han surgido ya algún impacto, habiendo aumentado notablemente el número de pruebas realizadas en el sector público especialmente en el ámbito de atención primaria (fig. 6) y habiéndose disminuido el retraso en el diagnóstico (fig. 7). Debemos destacar el impacto que la introducción de las pruebas de lectura rápida ha tenido en la red de centros de cribado alternativos, que en 2009 aumentó en un 100% el número de pruebas realizadas24. Les tecnologías de diagnóstico rápido, en efecto, tanto utilizando una gota de sangre como utilizando fluido oral, han demostrado tener una alta sensibilidad y especificidad, y ser un herramienta útil para aumentar la demanda de la prueba diagnóstica.
Las políticas sanitarias encaminadas a disminuir el retraso en el diagnóstico deben ser pues múltiples, mejorando tanto la oferta como el acceso a éstas en todos los niveles del sistema sanitario, incluidos los servicios en base comunitaria.
Conclusiones- 1.
Aumentar el número de personas que conocen su estado serológico y disminuir el retraso del diagnóstico han de ser objetivos prioritarios de los programas de prevención y control del VIH. Para ello es clave la «normalización social» de la prueba, disminuir el excepcionalismo y el estigma del VIH.
- 2.
En España hay margen tanto para aumentar el número total de pruebas realizadas, como la cobertura y la frecuencia del diagnóstico en determinadas poblaciones clave.
- 3.
En ausencia de datos de coste-efectividad y de aceptabilidad de la exclusión voluntaria en nuestro medio, parece lógico priorizar la promoción de la prueba en servicios específicos, grupos nucleares y poblaciones vulnerables o relevantes.
- 4.
Simplificar el consejo asistido (pre y post), adecuando su complejidad al nivel de conocimientos sobre el VIH de la población diana y a la propia demanda de éstos.
- 5.
Las pruebas de lectura rápida han sido aceptadas y efectivas. Es necesario expandir esta tecnología a más servicios (urgencias de hospitales y atención primaria), grupos nucleares, poblaciones vulnerables y/o relevantes.
- 6.
Una apropiada y clara exploración de los riesgos de infección de VIH es la clave para ofrecer la prueba en todos los servicios sanitarios y la alerta de los profesionales es crucial para disminuir las oportunidades perdidas.
- 7.
Prever la carga de trabajo derivada de las intervenciones que se implementan y, sobre todo, crear circuitos eficientes de derivación asistencial de las personas infectadas.
- 8.
Monitorizar y evaluar las políticas de cribado y sus resultados es básico para mejorar las políticas de diagnóstico temprano.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.