Staphylococcus aureus (S. aureus) resistente a meticilina (SARM) se ha convertido en el principal problema de salud pública que causan los microorganismos multirresistentes. Los centros de larga estancia (CLE) constituyen un reservorio importante de SARM. Los objetivos de este estudio fueron determinar la prevalencia y los factores relacionados con la colonización por SARM en los sujetos residentes en CLE en el sur de España.
MetodologíaEstudio transversal descriptivo en el que se incluyeron a los sujetos ingresados en 17 CLE entre el 1 de abril de 2009 y el 30 de junio de 2010. Se realizó una toma de muestra con torunda de ambas fosas nasales con cultivo posterior en medio cromogénico. Si hubo crecimiento bacteriano compatible con estafilococo, se realizó la prueba de coagulasa con el test de aglutinación en látex. Se utilizó un sistema automático para la identificación y sensibilidad del estafilococo aislado. Se construyó un modelo de regresión logística donde la variable primaria del estudio, el ser portador de SARM, fue incluida como variable dependiente y se incluyeron como covariables todas aquellas que en el análisis bivariado hubiesen mostrado un nivel de significación inferior a 0,2. Los individuos fueron clasificados en portador de SARM, S. aureus meticilín-sensible y no portador.
ResultadosSe incluyeron 744 individuos. Cuatrocientas ochenta y uno (65%) eran mujeres. La edad mediana (Q1-Q3) fue de 81 (74-86) años. Setenta y nueve (10,6%) y 67 (9%) sujetos estaban colonizados por SARM y S. aureus meticilín-sensible, respectivamente. La toma reciente de antibióticos, un ingreso hospitalario en los últimos tres meses, una elevada comorbilidad medida por el índice de Charlson y ser portador de SARM previamente conocido a la recogida de la muestra fueron las variables relacionadas con la colonización por SARM.
ConclusionesLa prevalencia de SARM en los CLE de nuestra área es similar a la descrita en otros países europeos. Los sujetos que hayan realizado recientemente tratamiento con antibióticos, una elevada comorbilidad, haber estado colonizado previamente con SARM o haber tenido un ingreso hospitalario en los últimos tres meses tienen una mayor probabilidad de estar colonizado por SARM en estos centros.
Methicillin-resistant Staphylococcus aureus (MRSA) has become the most important problem related to multiresistant microorganisms in the health care system. Long-term-care facilities (LTCFs) are one of the main reservoirs of this microorganism. The objective of our study was to determine the prevalence and factors associated with MRSA colonization among subjects living in LTCFs in southern Spain.
MethodsDuring the period from 1st April 2009 to 30th June 2010, all subjects living in 17 LTCFs of our area were included in a cross-sectional study. Patients were screened by using nasal swabs and these were cultured in a chromogenic media. Suspected S. aureus colonies were identified by the latex agglutination test. Testing for antimicrobial identification and susceptibility was performed by an automated system. A logistic regression model was built, in which to be colonized by MRSA was the dependent variable, and covariates were entered if a difference with P<.2 was detected in the bivariate analysis. Residents were classified as MRSA carriers, methicillin-susceptible S. aureus carriers and non-carriers.
ResultsSeven hundreds and forty-four subjects were included. There were 481 (65%) females. The median (Q1-Q3) age was 81 (74-86) years. Seventy-nine (10.6%) and 67 (9%) were colonized by MRSA and methicillin-susceptible S. aureus, respectively. Significant risk factors for MRSA carriers were recent antibiotic use, previous hospital admission in the last three months, a high comorbidity measured by Charlson index and a history of colonization by MRSA.
ConclusionsThe prevalence of MRSA colonization in the LTCFs of our area is similar to that described in others European countries. In our institutions, subjects with recent antibiotic use, a high comorbidity, a history of MRSA colonization and a hospital admission in the last three months are more susceptible to be colonized by MRSA.
Staphylococcus aureus (S. aureus) resistente a meticilina (SARM) se ha convertido en una de las causas más importantes de infección entre pacientes con edad avanzada en los últimos años en España, Europa y los Estados Unidos1-5. Uno de los principales factores de riesgo para desarrollar infección por SARM es ser portador previo de este microorganismo6. Este hecho no sólo aumenta el riesgo de infección grave (endocarditis, neumonía o bacteriemia), sino también se ha relacionado con un aumento en la mortalidad asociada a SARM6.
La colonización por SARM afecta predominantemente a sujetos con comorbilidad o factores de riesgo específicos, como el tener una estancia prolongada en el hospital o residir en un centro de larga estancia (CLE)7. Estudios previos han evaluado la prevalencia de colonización por SARM en CLE europeos. Estos trabajos recogen prevalencias de SARM entre el 1,1% en Alemania y el 22% en el Reino Unido8-14. En lo que respecta a los CLE norteamericanos, los datos provienen principalmente de la cohorte de veteranos, con cifras de prevalencia mucho más elevadas que las encontradas en Europa15,16. Sin embargo, las características de los sujetos de estas instituciones no son comparables con las europeas17. En España, un estudio reciente ha evaluado este aspecto en CLE de Cataluña y Baleares detectando una prevalencia de SARM del 16,8%10.
Son pocos los trabajos previos que han evaluado los factores de riesgo relacionados con la presencia de SARM entre los sujetos de los CLE. El tamaño de la residencia, la toma de antibióticos o la edad de los sujetos son variables que han sido relacionadas con la colonización por SARM en dichos centros8-14. Sin embargo, las características epidemiológicas de las residencias y de los individuos que albergan, pueden ser diferentes en cada área geográfica estudiada. Dado el cada vez más frecuente intercambio de pacientes entre los hospitales y los CLE, es importante aportar información sobre los factores de riesgo asociados a la colonización por SARM en los CLE para poder identificar a aquellos sujetos susceptibles de transmitir este microorganismo a pacientes hospitalizados o de desarrollar infección.
El objetivo de este estudio fue determinar la prevalencia y los factores asociados a la colonización por SARM entre los sujetos que residen en CLE del área sanitaria sur de la provincia de Sevilla.
MetodologíaPacientes y datos de inclusiónEstudio transversal realizado entre abril de 2009 y junio de 2010, en el que se incluyeron a todos los sujetos residentes en 17 CLE de la provincia de Sevilla. Todos ellos tienen como hospitales de referencia a un centro de agudos de 500 camas y un hospital de crónicos-paliativos de 70 camas. Ninguno de los CLE incluidos tenía medidas estandarizadas sobre el control del SARM.
En cada visita, los datos clínicos y epidemiológicos fueron recogidos en base a un cuestionario previamente estructurado con la ayuda de los responsables de cada centro. Todos los datos se incluyeron en una base de datos para su análisis posterior. Quince residentes fueron excluidos del estudio al no dar su consentimiento o no encontrarse presente en el centro en el momento de la visita. En los sujetos que se encontraban hospitalizados en alguno de los centros de referencia de agudos o crónicos en el momento de la visita al CLE, la muestra fue recogida durante el ingreso hospitalario.
La variable principal del estudio fue ser portador de SARM. También se recogió el estado de portador de S. aureus sensible a meticilina y no portador. Las siguientes covariables relacionadas con los sujetos fueron incluidas para el análisis: edad, sexo, tiempo en residencia, comorbilidad, estado funcional, tratamiento antibiótico en el último mes, aislamiento previo de SARM, ingreso hospitalario en los últimos tres meses, haber acudido a consulta/unidad de día en los últimos tres meses, presencia de úlcera por decúbito, número de visitas semanales recibidas, uso de dispositivos externos en el momento de recogida de la muestra (sondaje vesical, sonda nasogástrica, sonda de gastrostomía percutánea, ostomía, catéter venoso y ventilación mecánica) y procedimientos invasivos (endoscopia, cirugía, diálisis) durante el último año. El estado funcional fue evaluado mediante la escala de Barthel18. Los individuos fueron categorizados según este índice en dependientes o no según tuviesen una puntuación inferior e igual a 40 o mayor. La comorbilidad del sujeto fue valorada por el índice de Charlson19. Posteriormente, clasificamos a los individuos en dos categorías según tuviesen un total de puntos igual o superior a 2 frente a los que tuviesen menos de 2 puntos. También se recogieron variables relacionadas con el CLE: distancia al hospital de referencia, tipo de habitación (individual o compartida), tipo de gestión del centro y número de residentes por centro.
Recogida y procesamiento de muestrasLa recogida de muestras fue realizada por el mismo personal investigador en todos los centros. Previamente a la toma de muestras, se realizó un estudio a nivel nasal para descartar el estado de portador en el personal investigador.
Para conocer la colonización por SARM, se obtuvo una única muestra de ambas fosas nasales por residente mediante una torunda de algodón que posteriormente se introdujo en el interior del medio de transporte Stuart. En los sujetos con sondaje vesical se recogió además una muestra de orina en medio estéril. No se recogió muestra para cultivo de las úlceras que pudieran presentar los sujetos estudiados. Las torundas fueron mantenidas en frío (a 4°) durante 24 horas antes de ser cultivadas en medios cromogénicos (chromID™ MRSA ID, Biomerieux). Después de 24-48 horas de incubación a 35°, si hubo crecimiento bacteriano compatible con estafilococo, se realizó la prueba de coagulasa con el test de aglutinación en látex (Slidex Staph Plus Biomerieux). Se utilizó el medio automático (VITEK-2 Compact BioMerieux, Francia) para la identificación y sensibilidad del estafilococo aislado. En todos los casos en los que se aisló SARM se procedió a congelar las muestras a -80°.
Análisis estadísticoLas variables continuas y categóricas se expresaron mediante la mediana (Q1-Q3) y número (porcentaje), respectivamente. La comparación entre las variables continuas se realizó mediante el test de la t-Student o U-Mann-Whitney según fuese una distribución normal o no. Las comparaciones entre variables categóricas se realizaron usando los test de la χ2 o Fisher según fuese apropiado. Posteriormente se construyó un modelo de regresión logística donde la variable primaria del estudio, el ser portador de SARM fue incluida como variable dependiente y como covariables se incluyeron todas aquellas que en el análisis bivariado hubiesen demostrado una relación con la variable primaria con un nivel de significación inferior a 0,2.
El análisis estadístico fue llevado a cabo mediante el paquete estadístico informático SPSS 14.0 (SPSS, Chicago, Illinois, USA).
Aspectos éticosEl estudio fue diseñado y realizado siguiendo las normas de la declaración de Helsinki, siendo aprobado por el comité ético del hospital.
ResultadosCaracterísticas de los sujetosEl número de sujetos incluidos fue de 744, pertenecientes a los 17 CLE que participaron en el estudio. Las principales características de la población global se incluyen en la tabla 1. Entre los 32 individuos con procedimientos invasivos durante el último año, hubo 28 casos de cirugía, tres gastroscopias, dos colonoscopias y dos hemodiálisis. De los 33 sujetos con dispositivos externos, 19 tenían sonda vesical, nueve sonda nasogástrica, uno sonda de gastrostomía percutánea, dos sujetos presentaban catéter venoso para medicación parenteral y cuatro utilizaban ventilación mecánica no invasiva. Las principales patologías recogidas fueron demencia de cualquier origen en 327 (44%) individuos, diabetes en 206 (30%), enfermedad pulmonar obstructiva crónica en 79 (11%) y neoplasia sólida o hematológica en 42 (6%) sujetos. En el momento del estudio, tres sujetos se encontraban ingresados en el hospital. Cincuenta y seis (8%) sujetos habían tomado antibióticos durante el mes previo a la recogida de muestras. Amoxicilina-clavulánico, ciprofloxacino y levofloxacino fueron los más frecuentemente consumidos (en 27 [48%], 10 [18%] y 5 [9%] sujetos, respectivamente).
Principales características de la población.
| Variables | Valor (n=744) |
| Sexo mujer, n (%) | 481 (65) |
| Edad* (años) | 81 (74-86) |
| Tiempo en residencia* (meses) | 25 (10-54) |
| Charlson ≥ 2, n (%) | 218 (29) |
| Barthel ≤ 40, n (%) | 323 (43) |
| Úlcera crónica, n (%) | 64 (9) |
| Diabetes, n (%) | 206 (28) |
| Ingreso hospitalario últimos 3 meses, n (%) | 53 (7) |
| Consulta hospitalaria últimos 3 meses, n (%) | 114 (15) |
| Antibioterapia último mes, n (%) | 56 (8) |
| Dispositivo externo, n (%) | 33 (4) |
| Procedimiento invasivo último año, n (%) | 32 (4) |
| Habitación individual, n (%) | 91 (12) |
| Portador conocido de SARM, n (%) | 26 (3) |
| Individuos en centros con gestión privada, n (%) | 72 (10) |
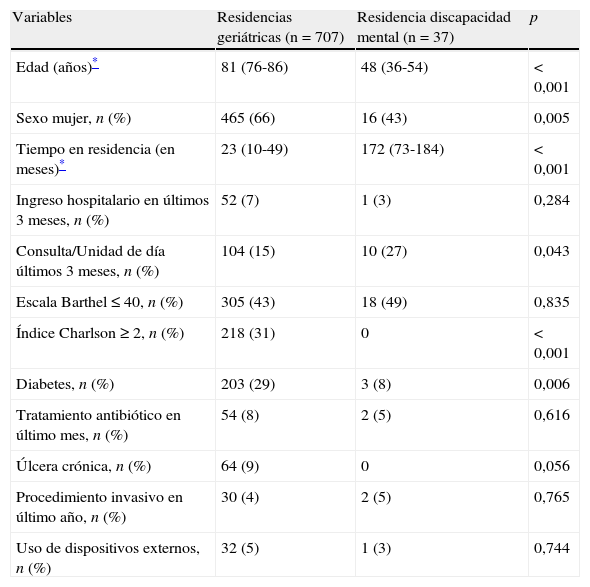
Dieciséis de estos centros están orientados al cuidado de individuos con edad avanzada, que pudieran tener además algún tipo de discapacidad para su completa autonomía. Un centro alberga a sujetos con algún grado de discapacidad mental. Las principales variables de los individuos en función de las características de la residencia en la que son atendidos se recogen también en la tabla 2.
Principales características de la población en función de las características de la residencia.
| Variables | Residencias geriátricas (n=707) | Residencia discapacidad mental (n=37) | p |
| Edad (años)* | 81 (76-86) | 48 (36-54) | < 0,001 |
| Sexo mujer, n (%) | 465 (66) | 16 (43) | 0,005 |
| Tiempo en residencia (en meses)* | 23 (10-49) | 172 (73-184) | < 0,001 |
| Ingreso hospitalario en últimos 3 meses, n (%) | 52 (7) | 1 (3) | 0,284 |
| Consulta/Unidad de día últimos 3 meses, n (%) | 104 (15) | 10 (27) | 0,043 |
| Escala Barthel ≤ 40, n (%) | 305 (43) | 18 (49) | 0,835 |
| Índice Charlson ≥ 2, n (%) | 218 (31) | 0 | < 0,001 |
| Diabetes, n (%) | 203 (29) | 3 (8) | 0,006 |
| Tratamiento antibiótico en último mes, n (%) | 54 (8) | 2 (5) | 0,616 |
| Úlcera crónica, n (%) | 64 (9) | 0 | 0,056 |
| Procedimiento invasivo en último año, n (%) | 30 (4) | 2 (5) | 0,765 |
| Uso de dispositivos externos, n (%) | 32 (5) | 1 (3) | 0,744 |
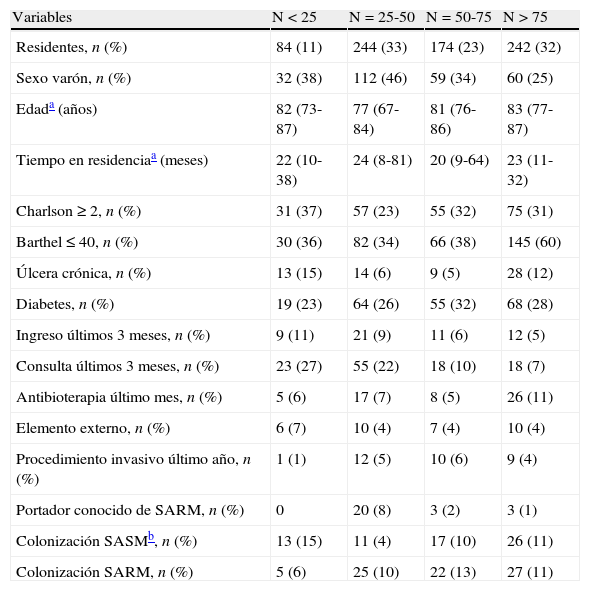
El rango de residentes por centro osciló entre 12 y 137, distribuidos de la siguiente manera: 5 CLE con < 25 individuos, 7 con > 25 y < 50 sujetos, 3 con > 50 y < 75 y 2 con > 75 individuos. Las características por residencia según su tamaño son recogidos en la tabla 3.
Principales características en función del número de sujetos en el centro de larga estancia.
| Variables | N < 25 | N=25-50 | N=50-75 | N>75 |
| Residentes, n (%) | 84 (11) | 244 (33) | 174 (23) | 242 (32) |
| Sexo varón, n (%) | 32 (38) | 112 (46) | 59 (34) | 60 (25) |
| Edada (años) | 82 (73-87) | 77 (67-84) | 81 (76-86) | 83 (77-87) |
| Tiempo en residenciaa (meses) | 22 (10-38) | 24 (8-81) | 20 (9-64) | 23 (11-32) |
| Charlson ≥ 2, n (%) | 31 (37) | 57 (23) | 55 (32) | 75 (31) |
| Barthel ≤ 40, n (%) | 30 (36) | 82 (34) | 66 (38) | 145 (60) |
| Úlcera crónica, n (%) | 13 (15) | 14 (6) | 9 (5) | 28 (12) |
| Diabetes, n (%) | 19 (23) | 64 (26) | 55 (32) | 68 (28) |
| Ingreso últimos 3 meses, n (%) | 9 (11) | 21 (9) | 11 (6) | 12 (5) |
| Consulta últimos 3 meses, n (%) | 23 (27) | 55 (22) | 18 (10) | 18 (7) |
| Antibioterapia último mes, n (%) | 5 (6) | 17 (7) | 8 (5) | 26 (11) |
| Elemento externo, n (%) | 6 (7) | 10 (4) | 7 (4) | 10 (4) |
| Procedimiento invasivo último año, n (%) | 1 (1) | 12 (5) | 10 (6) | 9 (4) |
| Portador conocido de SARM, n (%) | 0 | 20 (8) | 3 (2) | 3 (1) |
| Colonización SASMb, n (%) | 13 (15) | 11 (4) | 17 (10) | 26 (11) |
| Colonización SARM, n (%) | 5 (6) | 25 (10) | 22 (13) | 27 (11) |
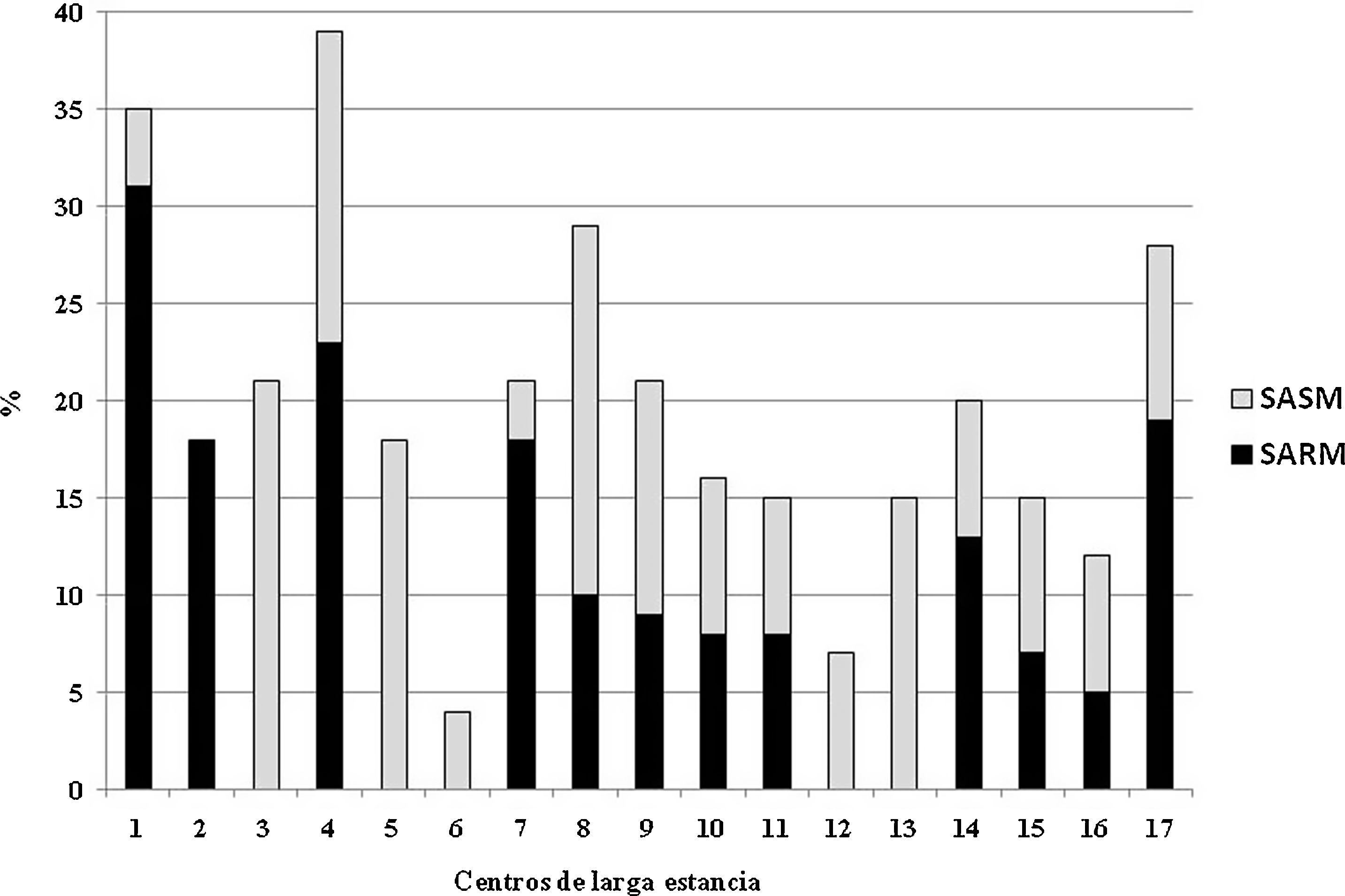
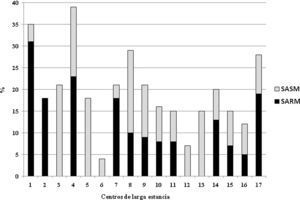
Ciento cuarenta y seis (19,6%) estaban colonizados por S. aureus. De ellos, 79 (54%) y 67 (46%) eran individuos colonizados por SARM y S. aureus meticilín-sensible, respectivamente. Esto supone una prevalencia de SARM y S. aureus meticilín-sensible en nuestra población del 10,6 y 9%, respectivamente. No hubo ningún caso de infección por SARM en el momento de recogida de las muestras. En ninguno de los individuos que portaban una sonda vesical se aisló el SARM en el cultivo de orina. En 5 CLE no se observó a ningún sujeto colonizado por SARM (fig. 1). Aunque la proporción de SARM fue inferior en las residencias de pequeño tamaño, no hubo diferencias significativas entre aquellos CLE de pequeño tamaño (< 25 sujetos) y el resto de instituciones (> 25 sujetos) (5 [6%] vs 74 [11%], p=0,137). Tampoco se encontraron diferencias entre los centros orientados a individuos mayores respecto al único centro destinado a sujetos con discapacidad mental en cuanto a la colonización por SARM (77 [11%] vs 2 [5%], p=0,287). Los datos de colonización de los 17 centros quedan reflejados en la figura 1.
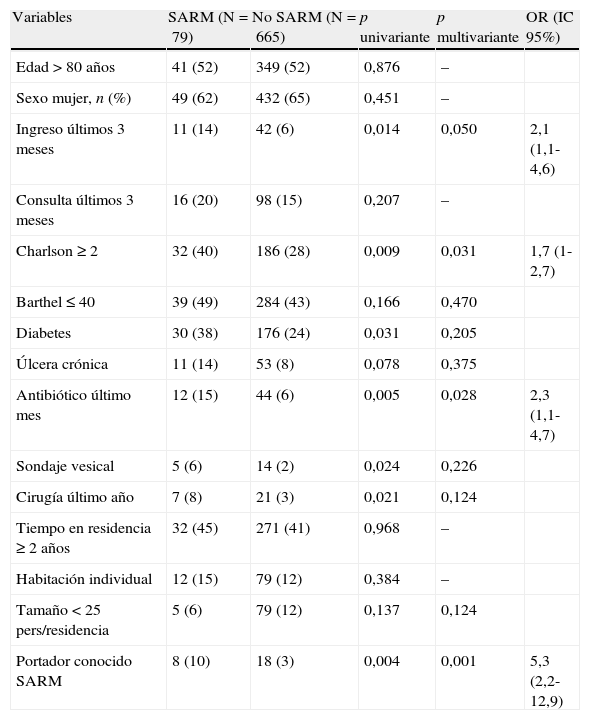
Factores asociados con la colonización por S. aureusLos factores asociados con la colonización por SARM en el estudio univariante se recogen en la tabla 4. La toma de antibióticos en el último mes previo al estudio, un ingreso hospitalario reciente, el tener un índice de Charlson ≥ 2 o el ser portador previo de SARM fueron las variables independientes que se relacionaron con la colonización por SARM.
Factores relacionados con la colonización por S. aureus resistente a meticilina.
| Variables | SARM (N=79) | No SARM (N=665) | p univariante | p multivariante | OR (IC 95%) |
| Edad>80 años | 41 (52) | 349 (52) | 0,876 | – | |
| Sexo mujer, n (%) | 49 (62) | 432 (65) | 0,451 | – | |
| Ingreso últimos 3 meses | 11 (14) | 42 (6) | 0,014 | 0,050 | 2,1 (1,1-4,6) |
| Consulta últimos 3 meses | 16 (20) | 98 (15) | 0,207 | – | |
| Charlson ≥ 2 | 32 (40) | 186 (28) | 0,009 | 0,031 | 1,7 (1-2,7) |
| Barthel ≤ 40 | 39 (49) | 284 (43) | 0,166 | 0,470 | |
| Diabetes | 30 (38) | 176 (24) | 0,031 | 0,205 | |
| Úlcera crónica | 11 (14) | 53 (8) | 0,078 | 0,375 | |
| Antibiótico último mes | 12 (15) | 44 (6) | 0,005 | 0,028 | 2,3 (1,1-4,7) |
| Sondaje vesical | 5 (6) | 14 (2) | 0,024 | 0,226 | |
| Cirugía último año | 7 (8) | 21 (3) | 0,021 | 0,124 | |
| Tiempo en residencia ≥ 2 años | 32 (45) | 271 (41) | 0,968 | – | |
| Habitación individual | 12 (15) | 79 (12) | 0,384 | – | |
| Tamaño<25 pers/residencia | 5 (6) | 79 (12) | 0,137 | 0,124 | |
| Portador conocido SARM | 8 (10) | 18 (3) | 0,004 | 0,001 | 5,3 (2,2-12,9) |
En el presente estudio, la prevalencia de colonización por S. aureus en sujetos institucionalizados es elevada. Al menos la mitad de las muestras positivas a este microorganismo son resistentes a meticilina. La toma de antibióticos en el último mes, el haber tenido un ingreso en los últimos tres meses, una elevada comorbilidad y ser portador previo de SARM son los principales factores relacionados con la colonización por SARM en los CLE.
Estudios previos habían mostrado diferentes cifras de prevalencia de colonización por SARM en los países europeos8-14. En nuestro país, el único estudio publicado hasta la fecha realizado en CLE había observado una prevalencia de SARM del 16,8% en una población de Cataluña y Baleares10. En el presente trabajo, únicamente se tomaron muestras a nivel nasal como cultivo de cribado. Esta podría ser la principal limitación de nuestro estudio, pues en el caso de existir heridas o soluciones de continuidad de la piel está indicada la toma de muestra de las mismas para cultivo20. En este sentido, Manzur et al observaron que el 63% de los casos con aislamiento de SARM en el cultivo de la úlcera también estaban colonizados a nivel nasal10. Por tanto, sólo 18 (8%) de los 231 individuos colonizados por SARM, presentó aislamiento del SARM en cultivo de úlcera con resultado negativo a nivel nasal10. En nuestro caso, esto equivaldría, si se mantuviese la misma proporción, que 6 individuos no estuvieron adecuadamente clasificados como no portadores de SARM. Por otro lado, hemos intentado minimizar la no recogida de muestra de herida para cultivo incluyendo como variable el ser portador de úlcera crónica, encontrando una proporción de sujetos con SARM y úlcera crónica del 11%, frente al 20% recogido por Manzur et al10. Otro último factor que podría justificar la menor prevalencia de colonización por SARM encontrada en los centros de nuestra área es la no utilización de cultivos de enriquecimiento en caldo selectivo para SARM ni su posterior subcultivo en medios diferenciales, aspectos que, por otra parte, tampoco son usados en la rutina diaria de nuestro hospital para la detección de sujetos colonizados por SARM.
Una cuestión relevante del presente estudio es la variabilidad de colonización por SARM que ocurre en los centros en función de su tamaño. Estudios previos habían mostrado resultados discordantes en este sentido en función del tamaño de las residencias estudiadas. En varios estudios europeos se había observado una menor prevalencia de SARM en centros de muy pequeño tamaño (por debajo de 35 o 40 camas según los criterios utilizados)8,13. Sin embargo, en el estudio español previamente publicado habían recogido una prevalencia superior en residencias pequeñas, aunque en este caso las definieron como aquellas que albergaban a menos de 150 individuos10. Las características epidemiológicas de estos centros son diferentes en cada área geográfica. En nuestra área, proliferan pequeños CLE que albergan en la mayoría de los casos menos de 100 individuos por institución. Aunque existe una tendencia a una menor colonización por SARM en aquellos centros de muy pequeño tamaño (< 25 sujetos), esta diferencia no resultó significativamente estadística. Aún así, en 5 centros con < 50 sujetos no se observó ningún caso de colonización por SARM. Aunque una posible hipótesis de esa menor frecuencia de colonización por SARM en los centros con mayor número de residentes pudiera ser porque tienen mejores infraestructuras y cuidadores más especializados respecto a los de pequeño tamaño, este aspecto no pudo ser evaluado en nuestro estudio.
Otro aspecto interesante relacionado con la colonización por SARM fue el haber tenido un ingreso hospitalario reciente. Otros estudios también habían recogido este aspecto, considerando a aquellos pacientes que habían estado ingresados en los últimos 3 o 6 meses8,13,21. En nuestro caso, evaluamos a los sujetos en función de que el ingreso hubiese ocurrido en los últimos 3, 6 o 12 meses, encontrando únicamente asociación con la colonización por SARM en el primer caso. Tampoco, se encontró relación con aquellos individuos que habían acudido a revisión en las consultas o unidad de día de las distintas especialidades quirúrgicas o médicas. No fue estudiada la relación entre el tiempo de estancia hospitalaria con el desarrollo de colonización por SARM, aspecto que sí había sido relacionado en otros trabajos13,21.
El tratamiento antibiótico previo a la toma de muestras ha sido considerado también de diversas formas en la literatura. La mayoría de los estudios europeos recogen si el sujeto ha realizado tratamiento con algún tipo de antibiótico durante el último mes8,13,21, mientras que otros recogen el tratamiento realizado en los últimos tres meses10. Sólo en uno de los trabajos que recogen el tratamiento antibiótico durante el último mes se observó una asociación significativa en el estudio multivariante con la colonización por SARM21. En ninguno de los trabajos realizados hasta el momento se ha podido establecer si alguno de los fármacos utilizados favorece más que otro al desarrollo de colonización por SARM. Debido a su uso extendido y facilidad de administración, amoxicilina-clavulánico y quinolonas fueron los tratamientos más frecuentemente recogidos en nuestro trabajo, aunque el reducido tamaño no posibilitó un estudio más pormenorizado en este sentido.
La comorbilidad de los individuos en CLE colonizados por SARM ha sido escasamente estudiada en trabajos previos. Sin embargo, cuando este aspecto es incluido en el estudio de factores asociados a colonización por SARM, es una de las principales variables relacionadas10. Demencia y diabetes son las dos patologías más frecuentes que encontramos entre los sujetos que residen en los CLE de nuestra área. La alta necesidad de cuidados de estos individuos con patologías crónicas pudiera ser la causa de una mayor proporción de colonización por SARM. Sin embargo, al contrario de lo que sucede con el índice de Charlson, la situación funcional de los sujetos medida por la escala de Barthel no parece ser determinante en el estado de portador de SARM.
La colonización previa por SARM es un factor relacionado en nuestro estudio con la presencia de SARM. En trabajos previos que incluyeron esta variable, no se relacionó de forma independiente con la colonización por SARM8,10 mientras otros estudios no incluyeron esta variable13,21. En este sentido, el conocer si ha sido portador previo de SARM está limitado a la realización de estudios previos en cada individuo, lo cual conlleva un posible infrarregistro, pues únicamente aquellos sujetos con algún tipo de contacto sanitario previo son susceptibles de haberse realizado dicha determinación.
Otras variables incluidas en nuestro estudio mostraron que los individuos con úlcera crónica, sonda vesical o que hubiesen sido sometidos a algún tipo de procedimiento invasivo tenían mayor probabilidad de estar colonizados por SARM que los sujetos que no tenían estas características, aunque no se observó asociación estadísticamente significativa. Sin embargo, el escaso número de sujetos portadores de dichas condiciones pudiera ser la causa de la falta de relación con el hecho de estar colonizado por SARM.
No encontramos ninguna característica relacionada con el CLE que se asociase a una mayor colonización por SARM. Ni la distancia de la residencia respecto del hospital de referencia, el compartir habitación o el tipo de gestión privada o concertada fueron factores asociados a la colonización por SARM (datos no mostrados). Tampoco observamos diferencias en la colonización por SARM entre los sujetos con una estancia más prolongada en los CLE. Este aspecto había mostrado hasta la fecha resultados también contradictorios entre los estudios previos13,21,22.
En resumen, la prevalencia y los factores asociados a la colonización por SARM varía en algunos aspectos en función del área geográfica estudiada. Lo que sí parece común es que estos centros se han convertido en un reservorio importante para la posterior transmisión del SARM. Los pocos datos existentes sobre los individuos que residen en CLE colonizados por SARM indican una menor susceptibilidad para desarrollar infección por SARM que los pacientes hospitalizados23-25. Sin embargo, la continua movilidad de sujetos de los CLE que acuden a los hospitales de referencia, hace necesario caracterizar adecuadamente a aquellos individuos con riesgo de padecer y transmitir el SARM entre pacientes susceptibles de desarrollar infecciones severas por este microorganismo. Habría que estar especialmente vigilantes ante aquellos sujetos procedentes de los CLE con toma reciente de antibióticos, ingreso hospitalario en los tres meses previos, aquellos que tengan una elevada comorbilidad y los que fuesen portadores previos de SARM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los responsables de los CLE participantes en el estudio, así como el personal sanitario, no sanitario y voluntario, que ayudaron en la recogida de los datos y en la identificación de los sujetos ingresados.