Las complicaciones hepáticas constituyen actualmente una de las principales causas de consulta médica, hospitalización y muerte en los pacientes infectados por el virus de la inmunodeficiencia humana (VIH). A ello contribuyen en gran medida las hepatitis víricas, que son particularmente frecuentes en esta población. La hepatitis crónica B afecta a un 5-10% de las personas infectadas por el VIH. La vacunación ha disminuido la incidencia de esta enfermedad y la disponibilidad del tenofovir ha mejorado drásticamente el pronóstico de los portadores crónicos. La hepatitis delta afecta en Europa a un 15% de los sujetos infectados por el VIH portadores del HBsAg+. Tiene mal pronóstico, dada la progresión rápida a cirrosis en la mayoría de pacientes y la ausencia de tratamiento eficaz. Por último, la hepatitis C es la causa más frecuente de hepatopatía en la población infectada por el VIH. Aunque clásicamente se ha vinculado a las personas infectadas por vía parenteral (especialmente a los usuarios de drogas intravenosas), en la última década se han descrito brotes de hepatitis aguda C en varones homosexuales. Aunque el tratamiento con interferón pegilado y ribavirina solo permitía eliminar el virus C en un 40% de los pacientes, no cabe duda de que la comercialización de nuevos antivirales (telaprevir, boceprevir) está revolucionando el manejo de esta enfermedad, de igual modo que lo hizo el tratamiento antirretroviral de gran actividad (TARGA) en 1996 en el VIH, permitiendo mejorar el pronóstico de los pacientes coinfectados. Las cuestiones relativas a las interacciones farmacológicas y el riesgo de selección de resistencias constituyen, de todos modos, desafíos importantes en esta población.
Hepatic complications currently represent one of the leading reasons for medical consultations, hospitalisation, and death in the HIV-infected population. This is due to a large extent to viral hepatitis, given its disproportionate frequency in this population. Chronic hepatitis B affects 5-10% of the HIV-infected population. Vaccination has reduced the incidence of liver disease related to hepatitis-B virus (HBV), and the availability of tenofovir has dramatically improved the prognosis of HIV/HBV carriers. Delta hepatitis affects around 15% of HIV-infected individuals in Europe harbouring positive HBsAg. It has the worst prognosis, given its accelerated course to cirrhosis and the absence of successful therapy. Lastly, chronic hepatitis C is the major cause of liver disease in the HIV population. Although classically linked to persons infected parenterally (i.e., intravenous drug users), outbreaks of acute hepatitis C among homosexual men have been reported over the last decade. Treatment with pegylated interferon plus ribavirin provides a cure in less than 40% of patients. However, the introduction of new direct acting antivirals against hepatitis- C virus (HCV) (telaprevir, boceprevir) has revolutionised the field, as HAART did in 1996 in the HIV field, improving the prognosis of co-infected patients. However, interactions between these drugs and antiretroviral agents and the risk of selective resistance pose huge threats in this population.
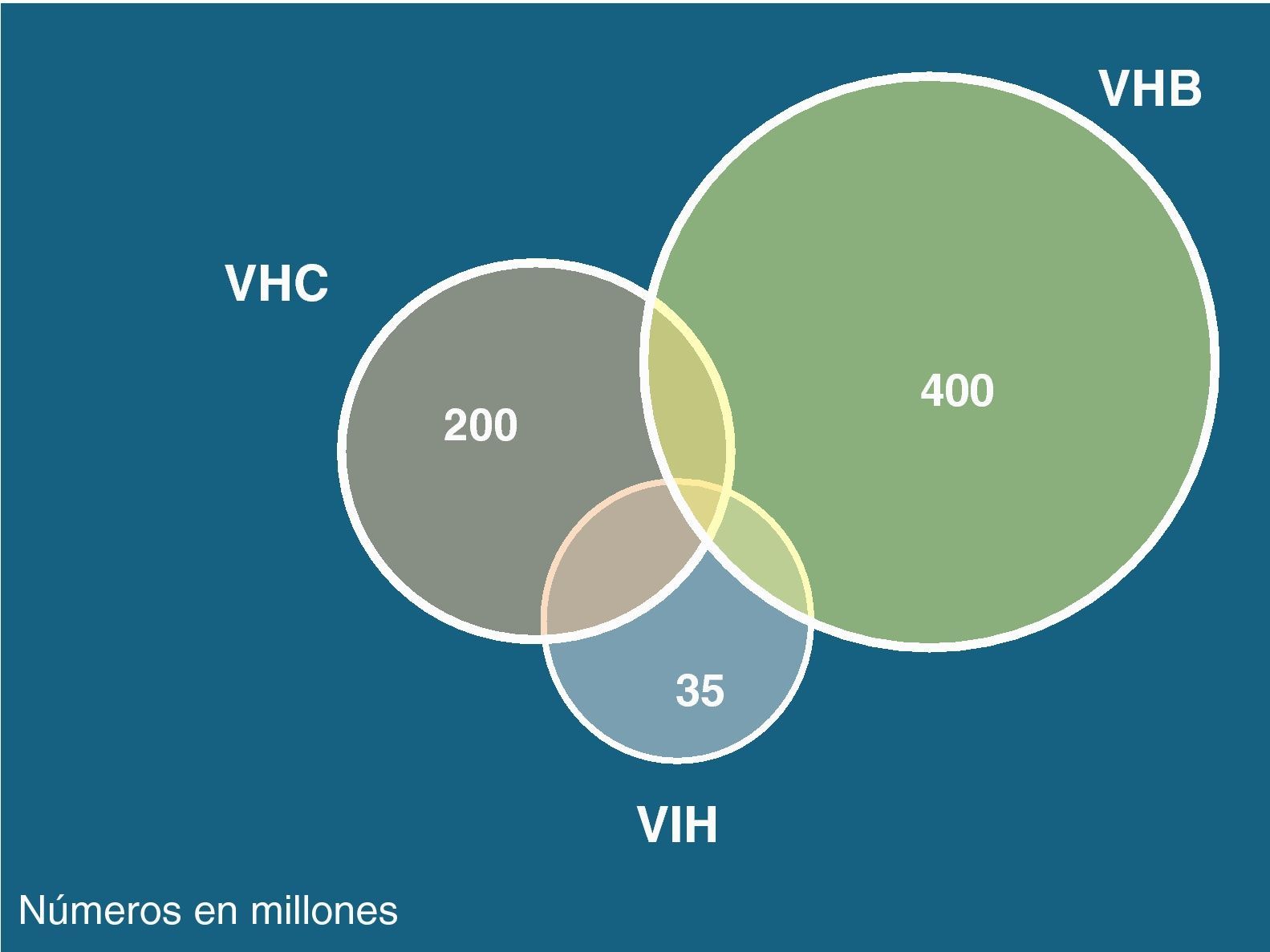
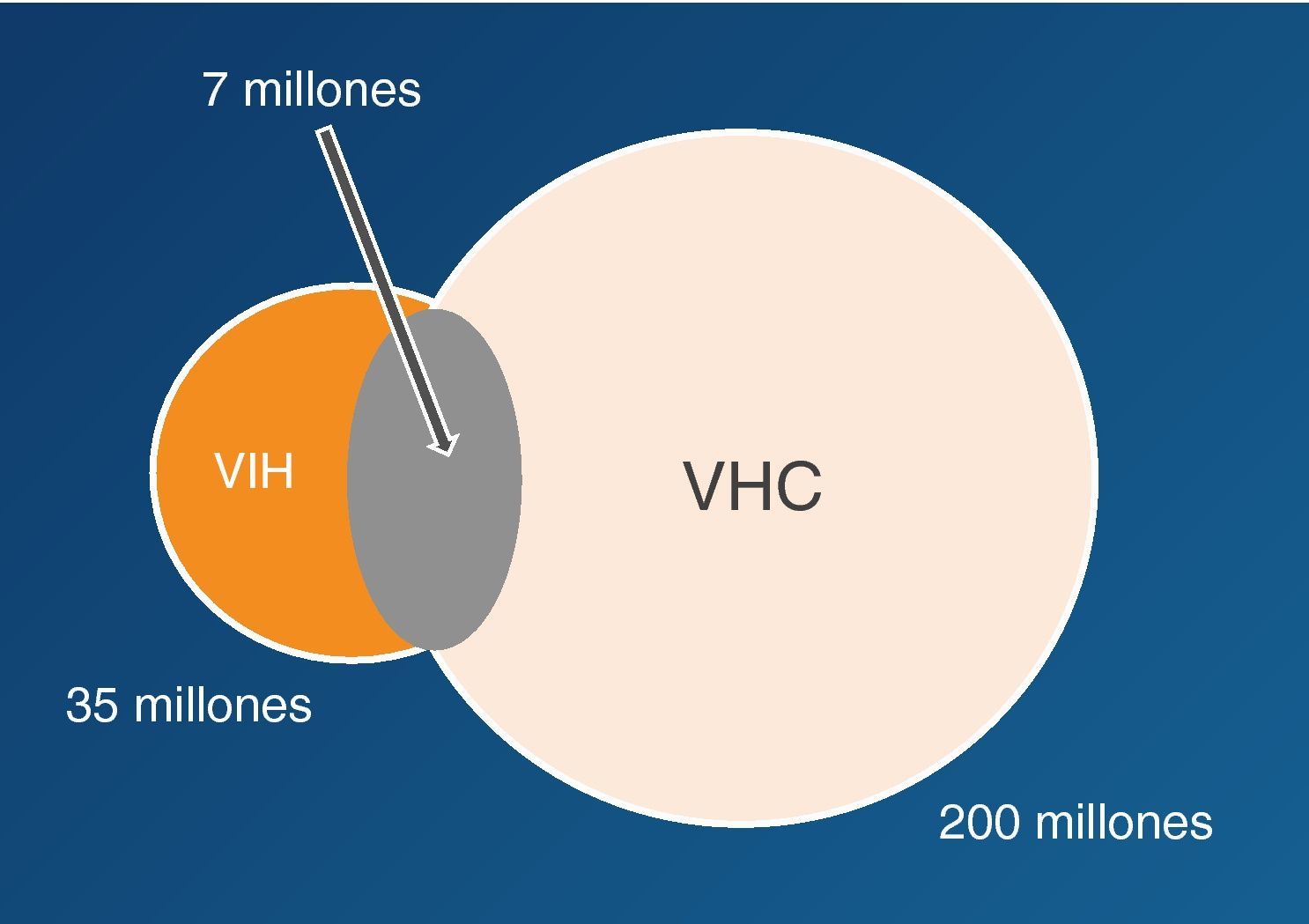
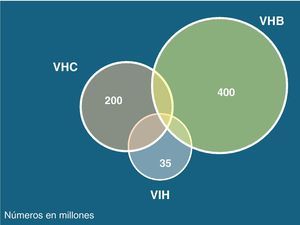
Los virus de las hepatitis B (VHB), C (VHC) y delta (VHD) comparten con el de la inmunodeficiencia humana (VIH) las mismas vías de transmisión, aunque la infectividad difiere en cada caso. Así, mientras el VHC se transmite preferentemente por vía parenteral, el VHB lo hace sobre todo por vía sexual. Esto explica por qué la coinfección VIH-VHC se da particularmente en usuarios de drogas intravenosas (UDI) y hemofílicos, mientras que la coinfección VIH-VHB es más frecuente en varones homosexuales. La infección por VHD solo ocurre en portadores del HBsAg y es más frecuente en UDI. La figura 1 recoge el número estimado de personas que actualmente viven con VIH, VHB o VHC en el mundo.
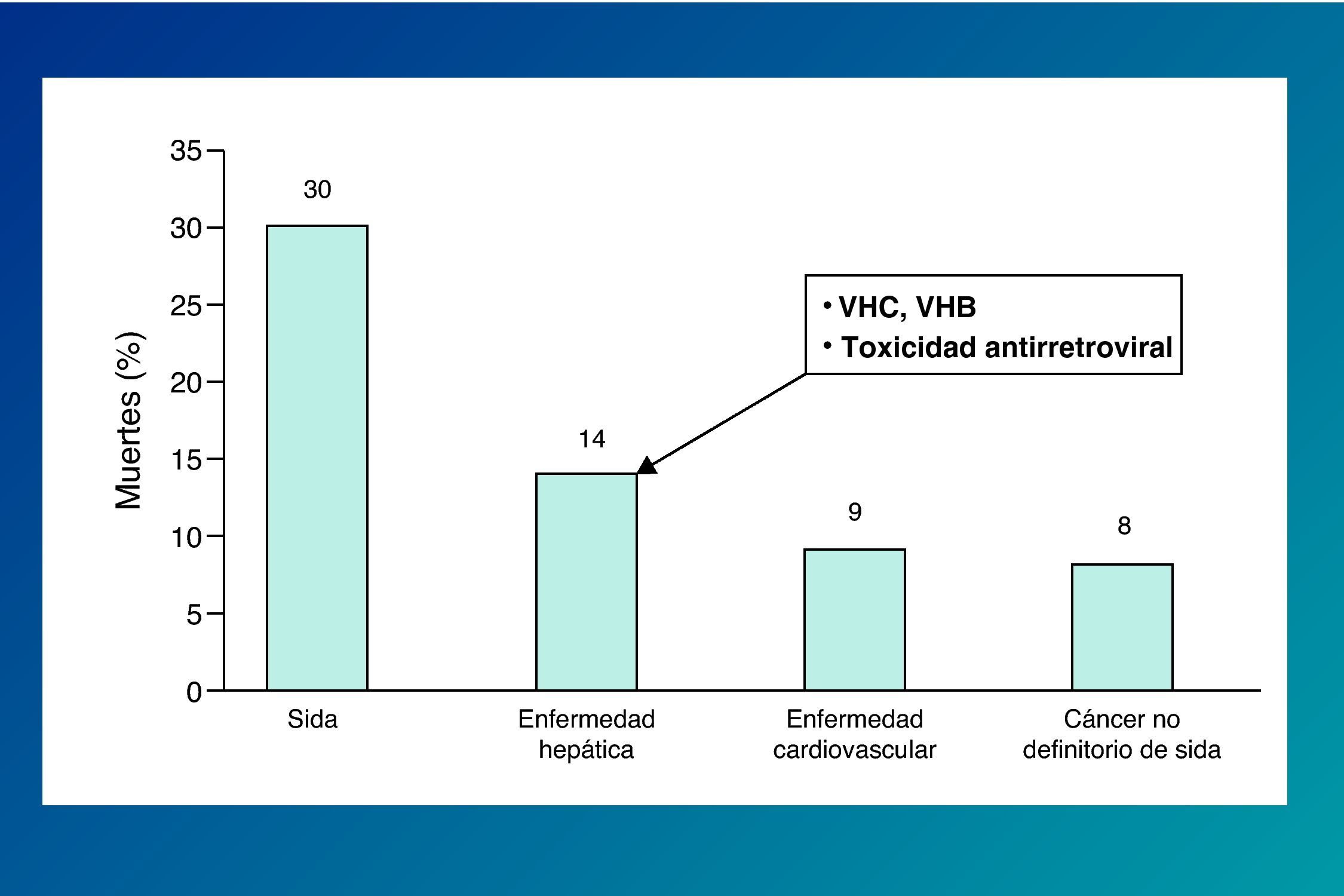
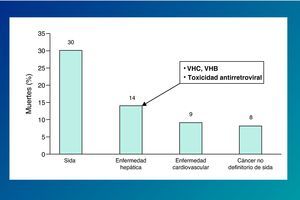
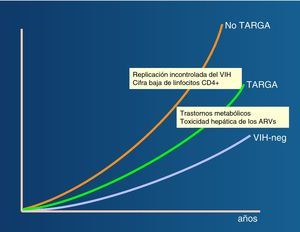
La importancia de la coinfección por virus de las hepatitis en los pacientes infectados por el VIH se ha hecho más patente tras la introducción del tratamiento antirretroviral de gran actividad (TARGA), debido a la mejora en la supervivencia de esta población. Así, la hepatopatía vírica representa en los últimos años una de las causas más frecuentes de hospitalización y mortalidad en los pacientes infectados por el VIH (fig. 2)1,2.
Aunque el VHB y el VHC muestran muchas similitudes biológicas con el VIH, la interacción entre ellos, así como su tratamiento, es muy diferente. Por este motivo, trataremos por separado la coinfección del VIH con cada uno de los virus hepatotropos principales.
Hepatitis BEpidemiología de la coinfección VIH/VHBMás del 80% de los pacientes infectados por el VIH tienen marcadores de infección pasada o presente por el VHB. La prevalencia de portadores del HBsAg varía según las areas geográficas y los grupos de riesgo, siendo más frecuente en homosexuales (6-11%) y en regiones del Tercer Mundo3,4.
Impacto del VHB en la progresión de la enfermedad por VIHEl VHB es fundamentalmente hepatotropo, pero también es linfotropo, de tal forma que VIH y VHB conviven a nivel celular en pacientes coinfectados. Este hallazgo señala una interacción compleja entre VIH y VHB. Por otro lado, el VHB altera el curso de la infección por VIH, induciendo un descenso más pronunciado de linfocitos CD4+. Molecularmente, la proteína X (HBx) estimula la replicación del VIH y la transcripción de la región LTR del VIH.
Varios estudios han evaluado el impacto de la coinfección por VHB en la progresión de la infección por VIH4. En 2 estudios longitudinales no se encontró ninguna asociación entre coinfección por VHB y depleción de linfocitos CD4+, progresión a sida o mortalidad por sida. Estos resultados se confirmaron en un análisis de una cohorte británica de homosexuales, aunque ese estudio no excluyó un efecto sobre las complicaciones relacionadas con el sida (por ejemplo, la trombocitopenia). Por el contrario, más recientemente el estudio SMART ha demostrado que la depleción de linfocitos CD4+ se acentúa en los pacientes infectados por el VIH que suspenden el tratamiento antiviral y experimentan un rebrote de la replicación del VHB5.
Finalmente, hay que mencionar la mayor dificultad de mantener una adecuada supresión de la replicación del VIH en los individuos coinfectados por virus hepatotropos, debido a la toxicidad hepática de los antirretrovirales. De forma global, la interrupción del tratamiento antirretroviral por hepatotoxicidad ocurre en un 10% de los pacientes infectados por el VIH y es el doble en los que tienen hepatopatía crónica viral6.
Impacto del VIH en la progresión de la hepatopatía por VHBEl VIH modifica el curso de la infección por VHB por varios mecanismos (tabla 1). Por una parte, las probabilidades de cronificación de la infección por VHB son más altas en sujetos infectados por el VIH, sobre todo cuando los recuentos de linfocitos CD4+ son bajos. Además, es menos frecuente la desaparición espontánea de los antígenos HBe y HBs, así como la seroconversión a anti-HBe y anti-HBs. Por otra parte, el número de reactivaciones es mayor2,3,7. Sin embargo, la persistencia de valores bajos de DNA-VHB en plasma en individuos con HBsAg negativo, un fenómeno conocido como «hepatitis B oculta», es muy infrecuente en los pacientes coinfectados por el VIH8.
Interferencias entre el VIH y el VHB
| VHB→VIH | VIH→VHB |
| • ↑ Replicación del VIH | • ↑ Cronificación del VHB |
| • ↑ Hepatotoxicidad del TARGA | • ↑ Replicación del VHB |
| • ↓ CD4 en cirrosis por hiperesplenismo | • ↓ Seroconversión anti-HBe y anti-HBs |
| • ↓ CD4 por activación inmunitaria si hay replicación VHB | • ↑ Reactivaciones de la hepatitis |
| • ↑ Progresión a cirrosis | • ↓ Eficacia del tratamiento anti-VHB |
| - ↓ Respuesta al interferón | |
| - ↑ Frecuencia de las mutaciones de resistencia a antivirales |
Los valores de replicación del VHB son más elevados cuando coexiste infección por VIH2,3. Esto puede ser debido a una inducción directa por parte del VIH o a un menor control inmunológico de la infección por VHB, resultado de la inmunodeficiencia celular producida por el VIH.
Desde el punto de vista histológico, los datos eran inicialmente contradictorios, con una menor actividad inflamatoria hepática en pacientes con coinfección VIH/VHB, sobre todo en estudios realizados en homosexuales. Esto se debería a una menor respuesta inmunitaria citotóxica, dada la naturaleza inmunitaria del daño hepático en la hepatitis crónica B. Por el contrario, datos de cohortes, en las que se incluyeron muchos UDI, han demostrado una actividad necroinflamatoria y fibrosis mayor en pacientes infectados por el VIH con hepatitis crónica B2,3.
La influencia negativa del VIH sobre la hepatopatía por VHB ha sido aportada por 2 publicaciones recientes, que identificaron la infección crónica por VHB como factor predictivo independiente de mortalidad, especialmente cuando los recuentos de linfocitos CD4+ eran bajos4,7.
Tratamiento de la hepatitis B en pacientes infectados por el VIHEl tratamiento de la hepatitis crónica B plantea problemas específicos cuando coexiste infección por VIH (tabla 1). Por un lado, la respuesta suele ser peor y/o se desarrollan resistencias con mayor frecuencia. Por otro lado, algunos de los análogos de nucleós(t)idos hasta ahora empleados para tratar la hepatitis B tienen también actividad frente al VIH, por lo que pueden desarrollarse resistencias en el VIH si se utilizan en monoterapia. Por tanto, el tratamiento de la infección por VHB debe estar perfectamente coordinado con el propio de la infección por VIH.
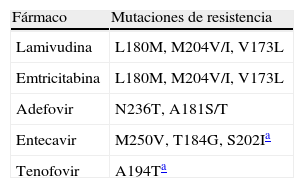
Análogos de núcleos(t)idosLa lamivudina (3TC) es un análogo de nucleósido con actividad frente al VIH y VHB. Por esta razón, aunque la dosis activa frente al VHB es menor (100mg/día), en pacientes coinfectados por VIH se administra en dosis de 300mg/día, y en el contexto de un régimen TARGA, para evitar la selección de mutaciones de resistencia en el VIH.
El 3TC produce en pacientes coinfectados VIH/VHB una inhibición de la replicación del VHB del 85% en el mejor de los casos9,10. Aunque la seroconversión a anti-HBe se alcanza solo en una minoría, se observa mejoría histológica y reversión de descompensaciones hepáticas en pacientes con cirrosis avanzada9. Sin embargo, la aparición de mutaciones de resistencia al 3TC en el VHB es mucho más frecuente en los pacientes coinfectados por VIH, con prevalencias del 50 y 90% al cabo de 2 y 4 años, respectivamente9–11. El desarrollo de mutaciones de resistencia al 3TC en el VHB se correlaciona con la duración del tratamiento y los valores basales de viremia9–11.
La aparición de mutaciones de resistencia al 3TC se ha asociado a elevación de transaminasas en algunos pacientes, que ocasionalmente han evolucionado a insuficiencia hepática con desenlace mortal9–11. Por tanto, en presencia de rebrote de la carga viral B bajo tratamiento con 3TC, debe presumirse la selección de resistencias y cambiar a otro antiviral sin resistencia cruzada (por ejemplo, tenofovir).
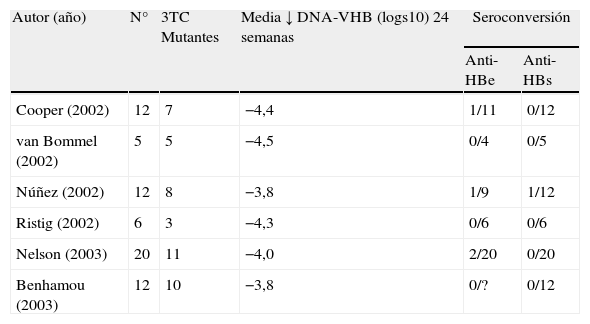
El 3TC ha perdido su protagonismo en el tratamiento de la infección por VHB en pacientes infectados por el VIH desde la introducción del tenofovir (TDF), un análogo de nucleótido con potente actividad frente al VIH y al VHB. El TDF inhibe la replicación del VHB incluso en presencia de mutaciones de resistencia al 3TC. Los resultados del tratamiento del VHB con TDF en pacientes infectados por el VIH se resumen en la tabla 2. Un descenso en los niveles plasmáticos de DNA-VHB en torno a 4 logs10 fue la norma en todos esos estudios, a pesar de ser portadora de mutaciones de resistencia al 3TC la mayoría de pacientes12–17. De forma ocasional se ha comunicado la posibilidad de selección de mutaciones de resistencia al TDF en el VHB (A194T)18. La tabla 3 recoge las mutaciones de resistencia a los antivirales seleccionadas en el virus B.
Resultados del tratamiento con tenofovir frente al VHB en coinfectados por el VIH
| Autor (año) | N° | 3TC Mutantes | Media ↓ DNA-VHB (logs10) 24 semanas | Seroconversión | |
| Anti-HBe | Anti-HBs | ||||
| Cooper (2002) | 12 | 7 | −4,4 | 1/11 | 0/12 |
| van Bommel (2002) | 5 | 5 | −4,5 | 0/4 | 0/5 |
| Núñez (2002) | 12 | 8 | −3,8 | 1/9 | 1/12 |
| Ristig (2002) | 6 | 3 | −4,3 | 0/6 | 0/6 |
| Nelson (2003) | 20 | 11 | −4,0 | 2/20 | 0/20 |
| Benhamou (2003) | 12 | 10 | −3,8 | 0/? | 0/12 |
El ADV fue aprobado para el tratamiento de la hepatitis crónica B en dosis de 10mg/día. Tiene actividad frente al VHB con mutaciones de resistencia al 3TC. En la dosis recomendada frente al VHB apenas tiene efectos tóxicos sobre el riñón. En 2 estudios realizados en pacientes coinfectados por VIH/VHB tratados con ADV y TARGA durante más de un año, no se encontraron mutaciones de resistencia en los codones 65 ni 70 de la transcriptasa inversa del VIH19,20. Por ello, el ADV podría considerarse cuando por alguna razón no se puede adelantarse el inicio del TARGA incluido el TDF.
La emtricitabina (FTC) tiene actividad también frente al VHB; se tolera muy bien, pero no está indicada tras fracaso al 3TC, con el cual comparte resistencias cruzadas. Se seleccionan mutaciones de resistencia al FTC en cerca del 20% de los pacientes con hepatitis crónica B tras 2 años de tratamiento21. Aunque el desarrollo de resistencias puede ser algo más lento que con 3TC, está claro que supone una limitación importante cuando se usa en monoterapia. Mucho más eficaz, sin embargo, es la disponibilidad de TDF y FTC en un solo comprimido (Truvada®)22,23. La disponibilidad de esta coformulación nos permite actualmente contar con una opción terapéutica óptima para el tratamiento de la hepatitis crónica B en pacientes coinfectados por el VIH. El beneficio obtenido cuando se utiliza en el contexto de regímenes TARGA es muy claro.
Interferón α pegiladoLos resultados del tratamiento de la hepatitis crónica B con interferón α (IFNα) en pacientes infectados por el VIH derivan de 7 estudios. De un total de 54 pacientes tratados, 7 tuvieron respuesta virológica frente a ninguno de los 46 controles no tratados. La respuesta se definió como aclaramiento del DNA-VHB plasmático. El metaanálisis indica que el IFNα es más efectivo que no tratar para la seroconversión a anti-HBe, pero es necesario tratar al menos 10 pacientes para obtener una sola respuesta.
En un análisis de 76 pacientes con hepatitis crónica B (26 infectados por el VIH y 50 no infectados) que recibieron 6 meses de tratamiento con IFNα entre 1987 y 1997, la respuesta virológica fue superior en los pacientes no infectados por el VIH que en los coinfectados por el VIH (52 vs. 15%)7. Además del nivel basal de transaminasas, en pacientes infectados por el VIH se correlacionó la respuesta con el recuento de linfocitos CD4+. El tratamiento con IFNα se asoció a seroconversión a largo plazo solamente en los pacientes no infectados por el VIH, mientras que las reactivaciones de la hepatitis B fueron más frecuentes en los pacientes que sí lo estaban, y se asociaron a recuentos de linfocitos CD4+ más bajos. Estos resultados confirman los de un metaanálisis de 16 estudios controlados y aleatorizados, que encontró una menor respuesta al IFNα en pacientes coinfectados por VIH2.
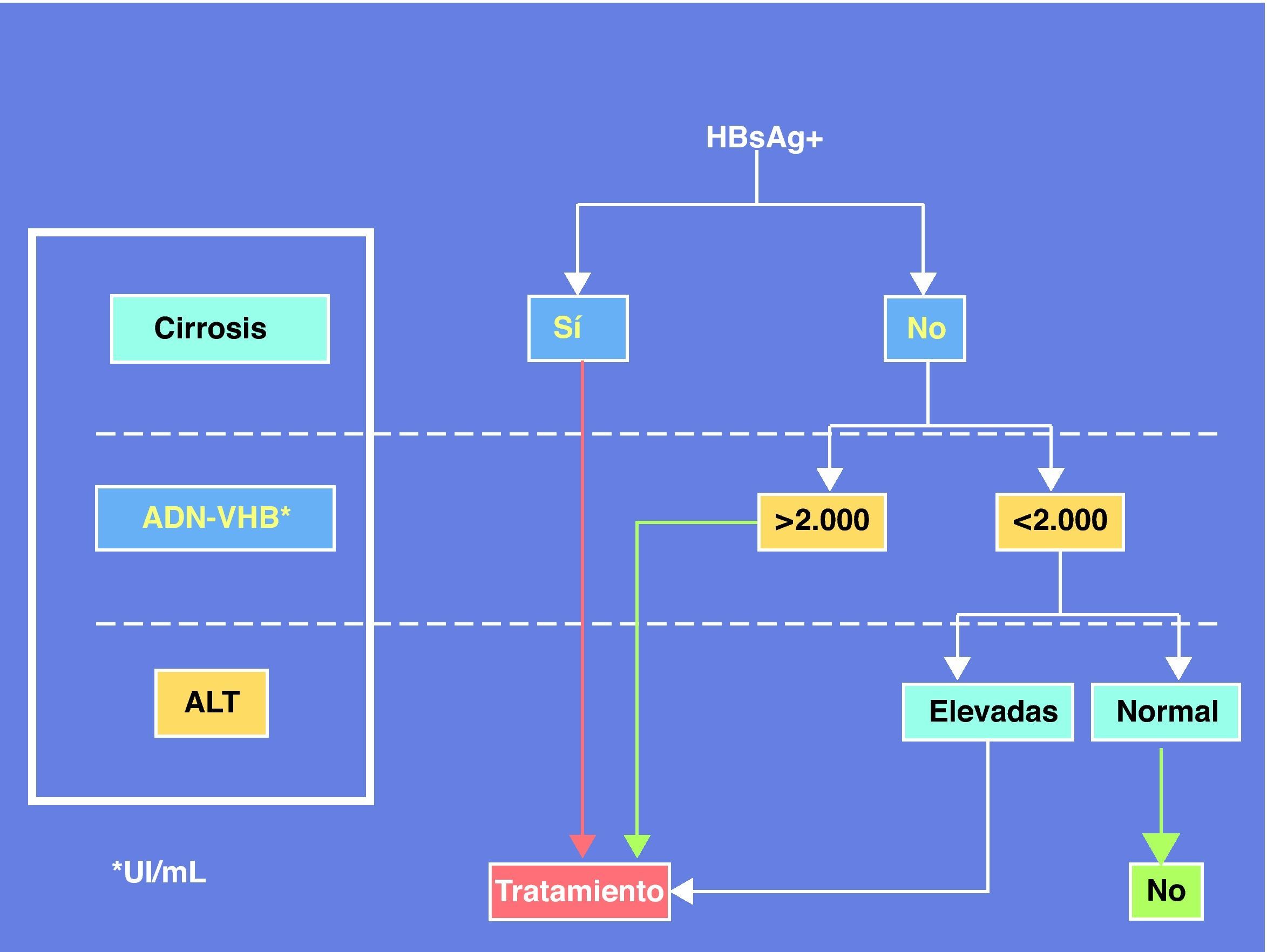
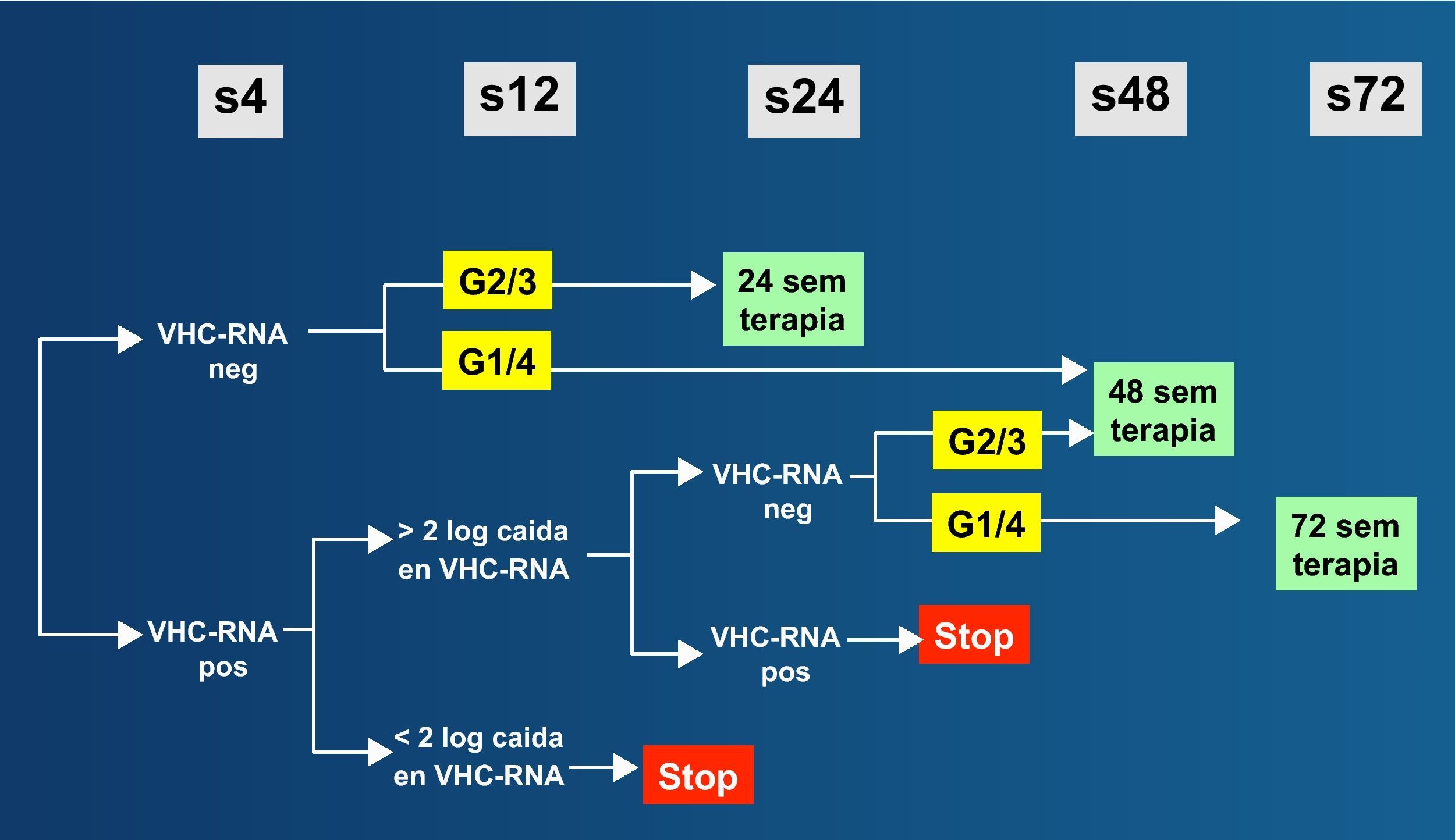
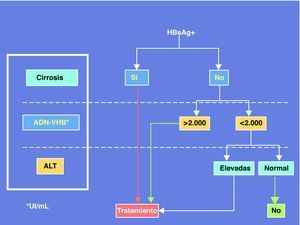
En resumen, la coinfección por VIH plantea problemas peculiares de manejo de la hepatitis crónica B debido a la necesidad de diseñar estrategias terapéuticas que atiendan conjuntamente ambos virus. La mayor velocidad de progresión de la enfermedad hepática por VHB en el contexto del VIH justifica que el tratamiento de la hepatitis B sea conveniente incluso cuando no hay criterios para tratamiento del VIH, aconsejando adelantar un régimen TARGA que incluya TDF. Un panel de expertos ha recomendado recientemente el algoritmo de la figura 3 para establecer los criterios de tratamiento de la hepatitis B en pacientes coinfectados por el VIH24.
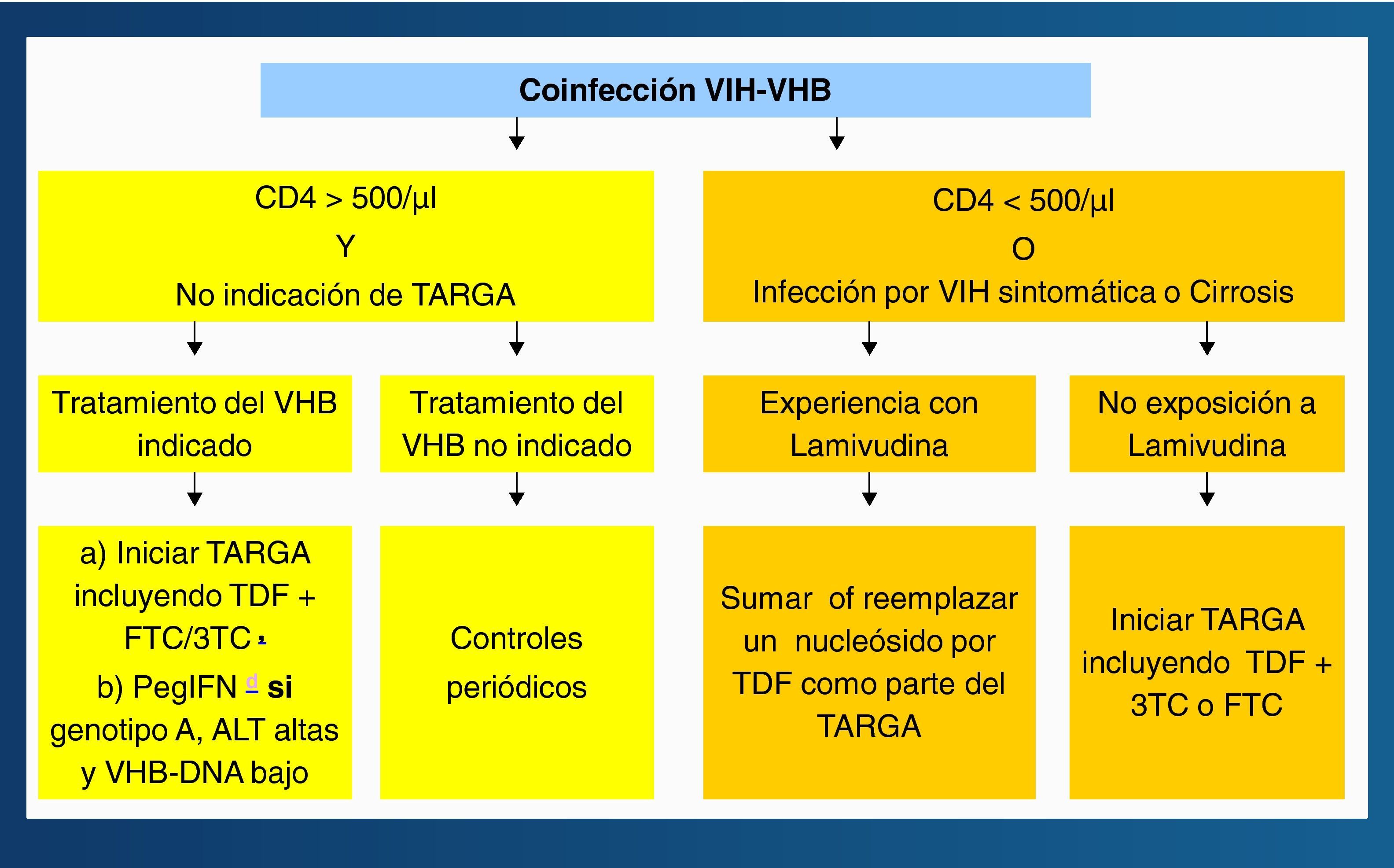
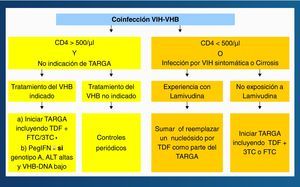
La respuesta al IFNα es más pobre en infectados por el VIH que en no infectados, sobre todo si la cifra de linfocitos CD4+ es baja. Por ello, el IFNα, preferiblemente las formas pegiladas, deben reservarse exclusivamente para sujetos HBeAg+ y con transaminasas elevadas. El uso prolongado de 3TC determina la aparición de resistencias en el VHB en la mayoría de pacientes, y algo similar es esperable con FTC. El tratamiento de la hepatitis B en pacientes coinfectados por el VIH es una de las situaciones en las que, a ser posible, debe adelantarse la administración del TARGA, ya que el tratamiento de combinación (incluyendo TDF) reduce el riesgo de selección de resistencias y proporciona una mayor potencia antiviral. En el momento actual se recomienda el algoritmo terapéutico de la figura 4 para el tratamiento de la hepatitis B en pacientes coinfectados por el VIH24.
Hepatitis CLa hepatitis crónica C es actualmente una de las principales causas de morbilidad y mortalidad en los individuos infectados por el VIH en los países desarrollados, especialmente en áreas donde la prevalencia de UDI es o ha sido elevada, como el sur de Europa y algunas ciudades de la costa este de Estados Unidos25,26. Esta relevancia clínica de la hepatopatía crónica C se debe a la drástica reducción en la incidencia de infecciones oportunistas debido al uso del TARGA; a la rápida evolución a cirrosis en los pacientes coinfectados VIH/VHC; y al mayor riesgo de toxicidad hepática del tratamiento antirretroviral en pacientes infectados por el VIH con hepatitis crónica C27,28.
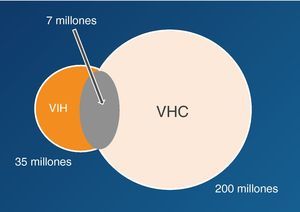
Epidemiología de la coinfección VIH/VHCSe estima que globalmente un 20-25% de los infectados por VIH presentan también infección por VHC (fig. 5)29. El VIH y el VHC comparten las mismas vías de transmisión, teniendo en cuenta que el VHC tiene 10 veces más capacidad infectiva que el VIH por vía parenteral. La coinfección VIH/VHC es más frecuente personas con historia de exposición a productos sanguíneos, como los UDI, en los que la prevalencia de coinfección puede superar el 70%. Por otra parte, la transmisión del VHC por vía sexual es infrecuente, aunque en la última década se han descrito brotes de hepatitis aguda C en varones homosexuales infectados por el VIH, en relación con determinadas prácticas de alto riesgo30–32.
Diagnóstico de la hepatitis C en pacientes infectados por el VIHTodas las guías recomiendan realizar cribado de anticuerpos anti-VHC a los pacientes infectados por el VIH33. Más del 80% de los pacientes infectados por el VIH con anti-VHC presentan RNA-VHC detectable en suero34, mientras que esto solo ocurre en el 70% de los sujetos no infectados por el VIH. En pacientes con elevación mantenida de transaminasas sin una causa clara que lo justifique y anti-VHC negativos, debe excluirse una infección oculta por virus C, especialmente en presencia de inmunodeficiencia avanzada35.
Un 20% de los pacientes infectados por el VIH con replicación del VHC muestran valores de transaminasas normales de forma mantenida. Esta cifra es del 30% en sujetos monoinfectados por el VHC. El daño hepático es generalmente menos pronunciado en este subgrupo respecto a los pacientes con transaminasas elevadas36.
Influencia del VHC sobre la enfermedad por VIHExisten resultados discordantes en los estudios que han estudiado la influencia del VHC sobre la progresión de la infección por VIH37–39. La activación inmunitaria persistente que ocasiona la infección crónica por VHC podría facilitar la transcripción del VIH en los linfocitos T infectados, provocando una destrucción más rápida de los mismos. Además, se ha demostrado que el VHC es capaz de infectar los linfocitos T, acelerando su muerte.
Existe disparidad de resultados acerca de la posible influencia negativa de la infección por VHC sobre la reconstitución inmunitaria de los pacientes que inician TARGA. Parece que la reconstitución inmunitaria está afectada en los pacientes coinfectados37; aunque pocas veces se han encontrado diferencias en la cifra de linfocitos CD4+ al comparar pacientes infectados y no infectados por el VHC. Si existe un efecto negativo en la reconstitución inmunitaria, el tratamiento del VHC podría contribuir a conseguir mayores cifras de linfocitos CD4+ en pacientes infectados por el VIH que inician TARGA.
El VHC tiene una influencia negativa de forma indirecta sobre la infección por VIH, aumentando la frecuencia de abandonos del TARGA e incrementando la toxicidad hepática28,40. Hasta hace poco, alrededor de un 10% de los pacientes coinfectados que iniciaban TARGA debían suspender el tratamiento por toxicidad hepática28. Este riesgo era mayor en pacientes infectados por el genotipo 3 del VHC, que se asocia con más esteatosis hepática41. Sin embargo, los antirretrovirales de introducción más reciente, como raltegravir o maraviroc, apenas producen daño hepático, de modo que la hepatotoxicidad es actualmente excepcional42.
Influencia de la infección por VIH sobre la hepatitis crónica CLa hepatitis aguda por VHC evoluciona a la cronicidad con más probabilidad en pacientes infectados por VIH, tanto más cuanto más avanzada es la inmunosupresión43. Una vez establecida la infección crónica por VHC, los niveles de RNA-VHC son más altos en pacientes coinfectados VIH/VHC, tanto en hígado como en plasma44,45. El peor control de la replicación del VHC en pacientes coinfectados por VIH parece deberse a una menor respuesta de células CD8+ específicas anti-VHC46.
Los valores elevados de RNA-VHC se han asociado con un mayor daño hepático solo de manera esporádica47. La progresión de la fibrosis hepática se acelera en los pacientes coinfectados VIH/VHC cuando la inmunosupresión es más profunda48,49. En un estudio multicéntrico europeo se examinó el resultado de la biopsia hepática en 914 pacientes con coinfección VIH/VHC50. La distribución del estadío de fibrosis hepática (escala METAVIR) fue F0 en el 10% de los pacientes, F1 en el 33%, F2 en el 22%, F3 en el 22% y F4 en el 13%. Cerca de la mitad de los pacientes tenían grados avanzados de fibrosis hepática (F3-F4) después de los 40 años de edad. Claramente la evolución a enfermedad hepática terminal ocurre antes en la población coinfectada. Esto también incluye el desarrollo de hepatocarcinoma a edades más jóvenes51.
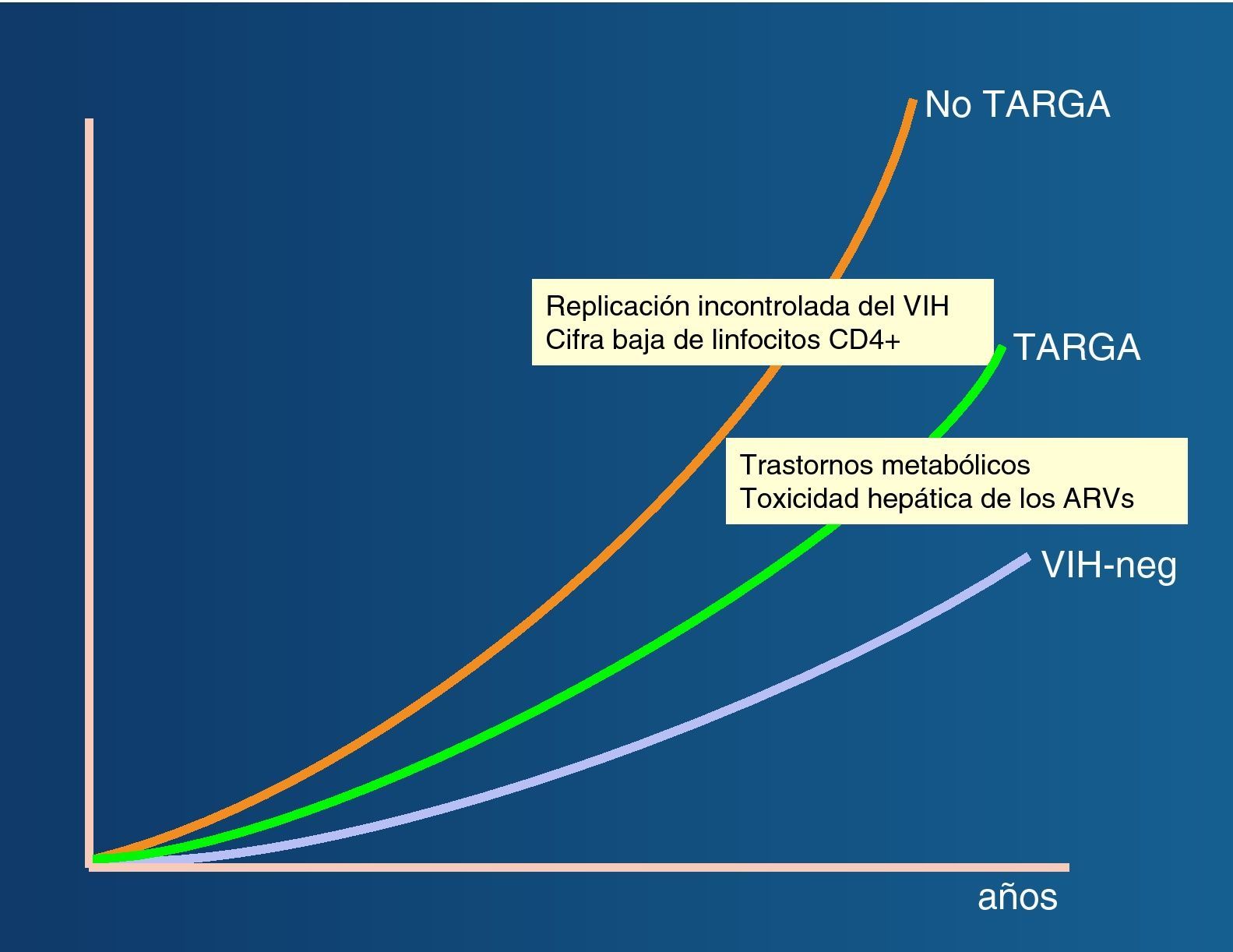
Morbilidad y mortalidad en pacientes coinfectados VIH/VHCEl mejor pronóstico que confiere el TARGA en los pacientes coinfectados VIH/VHC se debe en parte a una menor progresión de la fibrosis hepática52. En cualquier caso, el uso de TARGA no revierte por completo la progresión acelerada de la fibrosis hepática en los coinfectados53 (fig. 6).
Tratamiento de la hepatitis crónica C en pacientes infectados por el VIHEl tratamiento de la hepatitis crónica C en los pacientes infectados por el VIH es una prioridad por 3 motivos fundamentales. Primero, por la más rápida progresión a cirrosis; segundo, por la peor tolerancia y mayor riesgo de hepatotoxicidad de los antirretrovirales en presencia de hepatitis crónica C10. Por último, por el efecto deletéreo de la inmunoestimulación persistente que supone la replicación incontrolada del virus C sobreañadida a la enfermedad por VIH.
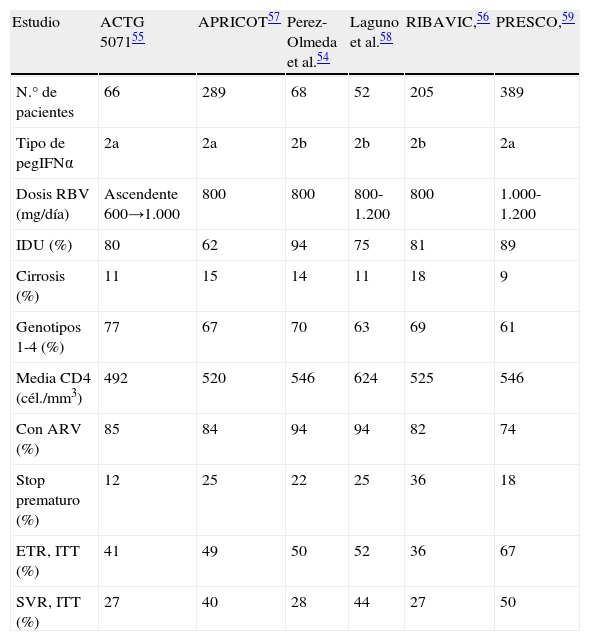
En la última década han aparecido varios estudios que han demostrado la seguridad y eficacia del tratamiento con interferón pegilado (pegIFNα) y ribavirina (RBV) en los pacientes coinfectados54–59. Muchos de esos trabajos recomendaban el tratamiento durante 12 meses en todos los pacientes, independientemente del genotipo del VHC. Debido a interacciones farmacológicas y perfil de toxicidad, inicialmente fueron utilizadas dosis bajas de RBV (800mg/día) y preferentemente se incluyeron solo pacientes con un buen estado inmunológico. En la tabla 4 se resumen las características principales de esos estudios.
Respuesta al tratamiento con interferón pegilado más ribavirina en pacientes coinfectados VHC/VIH
| Estudio | ACTG 507155 | APRICOT57 | Perez-Olmeda et al.54 | Laguno et al.58 | RIBAVIC,56 | PRESCO,59 |
| N.° de pacientes | 66 | 289 | 68 | 52 | 205 | 389 |
| Tipo de pegIFNα | 2a | 2a | 2b | 2b | 2b | 2a |
| Dosis RBV (mg/día) | Ascendente 600→1.000 | 800 | 800 | 800-1.200 | 800 | 1.000-1.200 |
| IDU (%) | 80 | 62 | 94 | 75 | 81 | 89 |
| Cirrosis (%) | 11 | 15 | 14 | 11 | 18 | 9 |
| Genotipos 1-4 (%) | 77 | 67 | 70 | 63 | 69 | 61 |
| Media CD4 (cél./mm3) | 492 | 520 | 546 | 624 | 525 | 546 |
| Con ARV (%) | 85 | 84 | 94 | 94 | 82 | 74 |
| Stop prematuro (%) | 12 | 25 | 22 | 25 | 36 | 18 |
| ETR, ITT (%) | 41 | 49 | 50 | 52 | 36 | 67 |
| SVR, ITT (%) | 27 | 40 | 28 | 44 | 27 | 50 |
ARV: tratamiento antirretroviral; ETR: respuesta al final de tratamiento; ITT: intención de tratar; pegIFN, interferón pegilado; RBV: ribavirina; SVR: respuesta virológica sostenida.
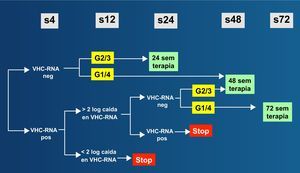
El estudio PRESCO incluyó 391 pacientes en España que recibieron tratamiento con IFNpeg y RBV a dosis de 1.000-1.200mg/día59. Se examinó el beneficio de prolongar el tratamiento (48 semanas para los genotipos 2 y 3; y 72 semanas para los genotipos 1 y 4) en lugar de la duración convencional (24 semanas para los genotipos 2 y 3; y 48 semanas para los genotipos 1 y 4). Los resultados subrayaron el beneficio de las dosis más altas de RBV en todos los grupos, mientras que la extensión del mismo solo fue beneficiosa en el subgrupo de pacientes con respuesta virológica más lenta. En función de estos datos y otros de la literatura médica, se recominda el algoritmo terapéutico de la figura 733.
Contraindicaciones al tratamiento y poblaciones especialesLos pacientes con descompensación hepática (ascitis, sangrado digestivo o encefalopatía hepática) no pueden ser tratados con pegIFN, dado el elevado riesgo de desarrollar graves complicaciones. En estos pacientes hay que considerar el trasplante hepático. Sin embargo, los pacientes con cirrosis compensada (Child-Pugh estadio A) sí que pueden ser tratados con pegIFN-RBV, ya que su tasa de respuesta es del 25-30% y son los que más se benefician en caso de curación de su hepatopatía. En contraste con el VIH, la infección por VHC puede erradicarse y esto debe presumirse para casi todos los pacientes con RNA-VHC indetectable en suero/plasma después de 3-6 meses de haber completado el tratamiento con pegIFN-RBV60,61.
Las personas con historia previa de enfermedades neuropsiquiátricas graves no pueden tratarse, porque el IFN puede agudizar estos síntomas. En los pacientes con adicción activa al alcohol u otras drogas es preferible posponer el tratamiento hasta su deshabituación, poniendo el esfuerzo médico en incluir estos pacientes en programas de desintoxicación33. Los pacientes con metadona son candidatos válidos para el tratamiento anti-VHC. En un tercio de ellos habrá que ajustar la dosis de metadona33. Para el tratamiento de estos pacientes sería ideal un equipo multidisciplinario que incluyera médicos expertos en adicciones, psicólogos y psiquiatras.
Los pacientes con enzimas hepáticas reiteradamente normales pueden beneficiarse del tratamiento anti-VHC. Diversos estudios han demostrado que hasta un 20% de pacientes coinfectados con transaminasas normales pueden tener fibrosis hepática avanzada36,56.
En resumen, todas las personas infectadas por el VIH con hepatitis crónica C deben ser consideradas para el tratamiento del VHC, dado su gran riesgo de progresión a cirrosis en comparación con los sujetos no infectados por el VIH y el mayor riesgo de hepatotoxicidad de la terapia antirretroviral. El inicio del tratamiento anti-VHC debe individualizarse. En los pacientes con enfermedades neuropsiquiátricas graves, adicción activa al alcohol u otras drogas, el tratamiento generalmente está contraindicado. Sin embargo, el tratamiento con metadona y la cirrosis compensada no contraindican la terapia para el VHC. No se aconseja el tratamiento en los pacientes con linfocitos CD4+ por debajo de 200 cél./mm3.
Monitorización y duración del tratamiento del VHC en pacientes coinfectadosCasi todos los individuos monoinfectados por el VHC en los que se aclara el virus con el tratamiento muestran una respuesta virológica precoz62,63. La viremia indetectable en la semana 4 es el mejor predictor de curación, mientras que la ausencia de caída de al menos 2 logs (dividir por 100) en la semana 12 es el mejor predictor de no curación. Por tanto, en este último grupo de pacientes se recomienda suspender el tratamiento precozmente, pues la posibilidad de curarse es errática aun cuando continúen el tratamiento63. Esta regla se conoce como «2-log early stopping rule» y es importante porque permite ahorrar efectos adversos y costes.
Algunos estudios de cinética viral inicialmente indicaron que el aclaramiento del VHC inducido por IFN podría estar retrasado en los pacientes coinfectados por VIH64. Como consecuencia, existía una preocupación sobre la aplicabilidad de la regla de los 2 logs en los pacientes coinfectados VIH/VHC. Sin embargo, datos de los estudios anteriormente citados (ACTG A5071, RIBAVIC, APRICOT y PRESCO) han demostrado que los pacientes con viremia basal reducida y una caída > 2 logs en la semana 12 son los que tienen una mayor probabilidad de respuesta virológica sostenida65,66.
El valor predictivo negativo de la regla de los 2 logs en la semana 12 es elevado también en los pacientes coinfectados67, mostrando que la única diferencia entre pacientes infectados y no infectados por el VIH con hepatitis C fue la menor proporción de coinfectados que obtuvo una respuesta virológica en ese momento. Esto podría explicarse por las menores dosis de RBV utilizadas en esos estudios. En realidad, utilizando dosis adecuadas de RBV, la cinética del VHC no muestra grandes diferencias entre los individuos infectados y los no infectados por el VIH, salvo en que los coinfectados parten de valores más elevados de RNA-VHC68,69. En resumen, las principales recomendaciones en el tratamiento anti-VHC en los individuos no infectados por el VIH se pueden aplicar a los pacientes coinfectados VIH/VHC33. La figura 7 recoge el algoritmo recomendado actualmente para el tratamiento de la hepatitis crónica C en pacientes infectados por el VIH, cuya duración depende del genotipo y de la RVR.
Hay una segunda fase de aclaramiento del RNA-VHC en los pacientes en tratamiento para el VHC, que se debe a la destrucción de los hepatocitos infectados70. Esta segunda caída del RNA-VHC puede estar también retrasada en pacientes coinfectados VIH/VHC. Esta menor disminución en el RNA-VHC en los portadores infectados por el VIH podría explicar una mayor frecuencia de recaídas en los pacientes que han mostrado una respuesta virológica precoz71. Sin embargo, es necesario reconsiderar una duración adecuada del tratamiento en los pacientes coinfectados. Los estudios RIBAVIC y APRICOT, que trataron con 800mg/día de RBV a los pacientes con genotipos 2 y 3, demostraron una reducción en las recaídas cuando se prolonga el tratamiento a 12 meses56,57. De este modo, los pacientes infectados por el VIH con genotipos 2 y 3 del VHC deberían tratarse durante un año. Sin embargo, el estudio PRESCO demostró que utilizando dosis de RBV de 1.000-1.200mg/día, los pacientes con carga viral indetectable a las 4 semanas (el 75%) pueden tratarse durante solo 6 meses59.
Las recaídas en los pacientes infectados por el VIH con genotipos 1 y 4 son del 20-35% cuando son tratados 12 meses62. En este grupo, el beneficio de prolongar el tiempo de tratamiento, al menos en los que no presentan RVR, se ha investigado con buenos resultados (menos del 15% de recaídas con 18 meses de tratamiento)72.
El uso de dosis adecuadas de RBV parece ser un punto crucial para la respuesta virológica73, y es más importante todavía en los pacientes coinfectados por el VIH69,74,75. Se debe poner todo el empeño en administrar y mantener una dosis adecuada de RBV, sobre todo durante las primeras semanas de tratamiento. El uso de eritropoyetina recombinante se ha propuesto como una buena estrategia para el tratamiento de la anemia secundaria a la RBV76. En el estudio PERICO, realizado en España y que incluyó 365 pacientes coinfectados, se examinó si la administración de dosis elevadas de RBV (2g/día) junto con eritropoyetina desde el primer día de forma preventiva podría aumentar la eficacia antiviral con un menor riesgo de anemia77. Aunque el desarrollo de anemia fue bajo con esta estrategia, no se obtuvo una mejor tasa de respuesta virológica.
Manejo de los efectos adversos del tratamiento del VHC en los pacientes infectados por el VIHLos efectos adversos de los fármacos anti-VHC se pueden agrupar en 5 categorías: síntomas seudogripales (cefalea, fiebre, astenia, mialgias, anorexia), alteraciones hematológicas, síntomas neuropsiquiátricos (depresión, irritabilidad, insomnio), síntomas gastrointestinales (náuseas, diarrea), e inflamación local en el lugar de la inyección. Otros efectos secundarios como la alopecia y la disfunción tiroidea se dan con menor frecuencia78. Los efectos secundarios provocan la suspensión del tratamiento en cerca del 15% en pacientes monoinfectados por VHC y una reducción de dosis tanto de pegIFN como de RBV en otro 20-25% de sujetos62. Tasas de abandonos mayores se han descrito en algunos estudios en pacientes coinfectados por VIH56.
La toxicidad hematológica, especialmente la anemia, es uno de los efectos adversos más limitantes del tratamiento del VHC. Puede estar provocada por el pegIFN, aunque lo más frecuente es que sea secundaria a RBV, debido a hemólisis extravascular78. Una reducción de la dosis o una suspensión temporal del fármaco puede ser útil. Pero desde que se conoce la importancia de la exposición a RBV para una buena respuesta antiviral, se deben hacer todos los esfuerzos posibles por mantener el fármaco, si es necesario recurriendo al uso de eritropoyetina76.
El tratamiento con pegIFN puede provocar una disminución de los leucocitos, y la neutropenia es un efecto adverso frecuente. El uso de factor estimulante de granulocitos (GCS-F) puede considerarse en algunos casos, pero hay pocos datos que sustenten este uso. La aparición de infecciones bacterianas es infrecuente (<2% en el estudio APRICOT)57. Como es sabido, el número absoluto de linfocitos CD4+ puede descender, pero la aparición de episodios oportunistas en pacientes con viremia por VIH indetectable es muy rara. De todas maneras, si la cifra de linfocitos CD4+ disminuye por debajo de 200 cél./mm3 es preferible introducir la quimioprofilaxis con cotrimoxazol.
Especial atención merecen los síntomas depresivos, una manifestación relativamente frecuente en pacientes infectados por el VIH, que se ven agravados por el tratamiento con pegIFN. Un tratamiento precoz de la depresión puede ser suficiente para evitar la suspensión de la terapia anti-VHC. A veces puede ser útil disminuir la dosis de pegIFN para el control de estos síntomas. El uso de tratamiento preventivo con antidepresivos se ha postulado en algunos individuos con historia previa de depresión.
Interacciones entre los antirretrovirales y la medicación anti-VHCEl tratamiento del VHC se complica en los pacientes infectados por el VIH por las interacciones de la RBV con algunos antirretrovirales. Los niveles intracelulares de algunos análogos de nucleósidos pueden disminuir debido a la RBV, pero no parece tener consecuencias clínicas. Se ha visto una mayor toxicidad con el uso concomitante de didanosina (ddI) y RBV79, y es mayor con el uso conjunto de estavudina (d4T), ddI y RBV. Se produce un aumento de la toxicidad mitocondrial80. El VHC, el VIH, la RBV y los análogos de nucleósidos pueden todos causar alteraciones mitocondriales y actuar sinérgicamente81. Se han descrito descompensaciones hepáticas, en algunos casos mortales, en pacientes cirróticos con la coadministración de estos fármacos82. Además de este efecto adverso, se han descrito también casos de acidosis láctica y pancreatitis con el uso de ddI y RBV. Así, el ddI debe ser sustituido por otro antirretroviral en los pacientes que van a iniciar tratamiento para el VHC33.
También se debe evitar la zidovudina (AZT) cuando se inicia el tratamiento para el VHC, ya que la anemia es más frecuente y grave con la administración conjunta de AZT y RBV75. Por último, varios estudios han subrayado que el uso de abacavir con ribavirina reduce la respuesta al tratamiento de la hepatitis C83–85. Tanto abacavir como RBV son análogos de guanosina y pueden competir intracelularmente en la vía de la fosforilación. De todos modos, el uso de dosis de RBV ajustadas al peso (1.000-1.200mg/día) minimiza esta inhibición competitiva.
Tratamiento de la hepatitis C en pacientes infectados por el VIH no respondedores y recidivantesEn el estudio PILOT86 se trataron durante un año con pegIFN y 1.000-1.200mg/día de RBV un total de 52 pacientes coinfectados en los que había fracasado en el pasado IFN con o sin RBV. Un 61% eran no respondedores y el 39% eran recidivantes. De forma global, se obtuvo una tasa de RVS del 31% (19% en los genotipos 1/4 vs. 73% en los genotipos 2/3; p=0,002).
Los pacientes que en el pasado recibieron monoterapia con IFN estándar son los que tienen mayor probabilidad de aclaramiento del virus en el nuevo rescate. Otra circunstancia que predice la respuesta a una segunda tanda de tratamiento es la prescripción en el pasado de bajas dosis de RBV o cortos cursos de terapia. En cambio, menos del 10% de los pacientes que han recibido regímenes adecuados de pegIFN y RBV alcanzan RVS en el retratamiento.
Para los no respondedores o recidivantes, los expertos proponen esperar si el daño hepático es mínimo, mientras que el retratamiento puede ser admisible en aquellos con un grado avanzado de fibrosis. El uso de altas dosis de pegIFN y RBV para la inducción de una respuesta virológica precoz, o la prescripción de dosis bajas de pegIFN como tratamiento de mantenimiento para reducir la progresión de la enfermedad hepática han sido desechados, por sus pobres resultados. En estos casos, no hay duda de que el advenimiento de los nuevos antivirales frente al VHC supondrá la mejor opción terapéutica.
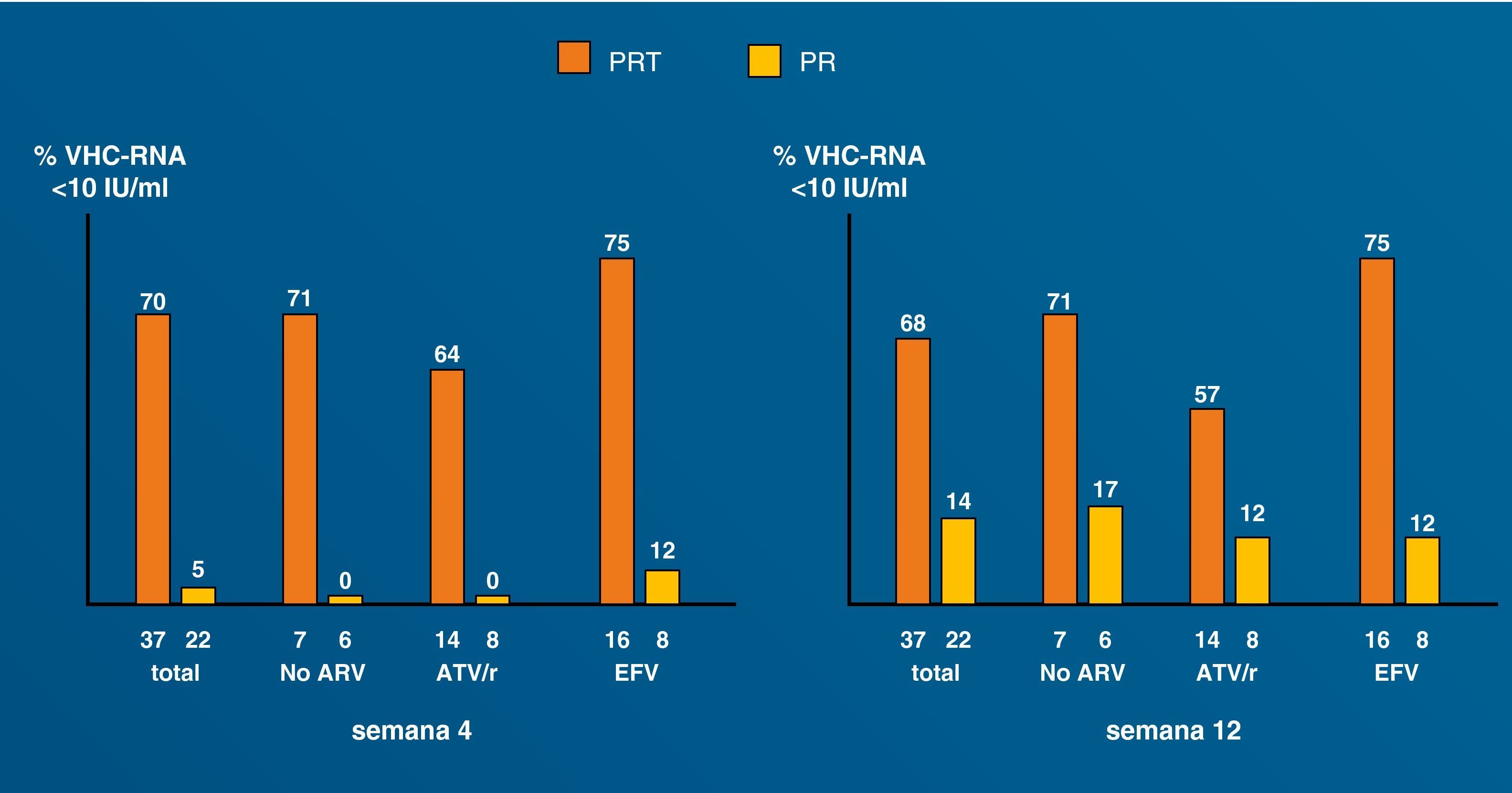
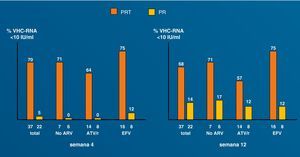
Tratamiento de la hepatitis C con antivirales de acción directa en coinfectadosLa reciente aprobación de los primeros inhibidores de la proteasa frente al VHC ha supuesto una verdadera revolución en el manejo de la enfermedad87. Los nuevos antivirales son particularmente esperados para los pacientes difíciles de tratar y, sin duda, en este grupo figuran en primera línea los pacientes coinfectados por VIH. Esto ha coincidido con la introducción de mejoras y novedades en las pruebas diagnósticas (tabla 5). De algún modo, este año 2011 recuerda al año 1996, cuando irrumpió la terapia triple antirretroviral en el manejo del VIH. No hay duda de que, de modo parecido, estamos ante un antes y un después en el tratamiento de la hepatitis C. Sin embargo, los nuevos antivirales de acción directa (AAD) presentan enormes desafíos en la población coinfectada, que deben resolverse de modo adecuado antes de que se produzca un uso indiscriminado de éstos (tabla 6). Las interacciones medicamentosas figuran entre los riesgos potenciales más importantes, dado que pueden conducir a infra o supraexposición a estos fármacos, con el riesgo consiguiente de toxicidad o falta de eficacia, respectivamente88. Otro tema de interés se refiere a la selección de resistencias. La viremia C más elevada en los pacientes coinfectados podría predisponer al fracaso por este motivo89. Asunto distinto es si los antirretrovirales podrían seleccionar mutaciones de resistencia en el VHC: la divergencia entre las enzimas del VIH y del VHC es tal que hace imposible esta eventualidad. En cualquier caso, datos preliminares sugieren que cuando la terapia triple se utiliza en las condiciones idóneas, pueden obtenerse tasas de respuesta virológica precoz en pacientes coinfectados similares a las obtenidas en los monoinfectados por el VHC (fig. 8).90
Novedades diagnósticas y terapéuticas en la hepatitis C
| Diagnóstico | Tratamiento |
| Métodos no invasivos medir la fibrosis hepática | Inhibidores de la proteasa |
| Alelos IL28B | Inhibidores de la polimerasa |
| Resistencias | Inhibidores de NS5A |
| Carga viral | Interferón lambda |
| Geno/subtipificado VHC | Alisporivir |
La hepatitis crónica delta es la forma más grave de hepatitis crónica viral. El virus delta solo infecta a pacientes con hepatitis B, ya sea coincidiendo en un mismo momento (coinfección) o contagiando un portador crónico del HBsAg (superinfección). Se estima que globalmente un 5% de los pacientes con hepatitis crónica B tienen una hepatitis delta, lo que representa 15-20 millones de personas en todo el mundo91. La prevalencia de hepatitis delta es mayor en pacientes infectados por el VIH y en Europa está presente en un 15% de los pacientes positivos para HBsAg92. Predomina en los UDI respecto a otros grupos de riesgo, en los que la hepatitis delta puede reconocerse hasta en un 40% de los portadores HBsAg+. El tratamiento con pegIFN durante un año permite negativizar la viremia delta y la normalidad de las transaminasas en el 25% de los pacientes93. En cualquier caso, la recidiva es muy frecuente tras suspender el tratamiento. Recientemente se han descrito resultados favorables de forma preliminar con la administración prolongada de tenofovir, probablemente en relación con una supresión máxima y sostenida del VHB. Sin embargo, este beneficio parece limitado al subgrupo de pacientes infectados por el genotipo A del VHB y/o portadores del HBeAg y no se observa en pacientes portadores del genotipo D del VHB y/o en los sujetos HBeAg negativos, que son los más frecuentes94,95. La terapia de combinación con tenofovir y pegIFN está siendo examinada en pacientes sin VIH en el estudio HIDIT-II.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.