En los últimos años la taxonomía de los hongos causantes de infecciones en el hombre ha cambiado sustancialmente especialmente debido al rápido desarrollo de las técnicas de secuenciación de ADN que han permitido avanzar en el conocimiento de las relaciones filogenéticas entre estos microorganismos. El número de especies fúngicas potencialmente patógenas ha sufrido un espectacular aumento, siendo muchas de ellas especies crípticas que forman parte de complejos de especies que han sustituido a lo que antes eran consideradas como simples morfoespecies. Ello ha ocurrido en diferentes géneros de mucorales y especialmente de ascomicetes tales como Aspergillus, Fusarium, Sporothrix y Scedosporium, entre otros. Es frecuente que dichas especies difieran en virulencia y en su respuesta a los antifúngicos por lo que su correcta identificación es de especial importancia para el adecuado tratamiento del paciente. En esta revisión se resumen algunos de los cambios más significativos en la taxonomía de los hongos patógenos que se han producido en los últimos años.
The advent of molecular techniques, mainly DNA sequencing, has led to important changes in the taxonomy of pathogenic fungi and a better understanding of the phylogenetic relationships among them. The number of fungal species potentially pathogenic for humans has increased dramatically. Most of them are cryptic species belonging to complex species that have replaced traditional single morphospecies. This has occurred in several genera of mucorales and particularly in different ascomycetous genera, such as Aspergillus, Fusarium, Sporothrix and Scedosporium, among others. The correct identification of these species is crucial for a better management of patients, since on many occasions those species show different virulence and different antifungal responses. This review summarises some of the most striking recent taxonomic changes produced in pathogenic fungi.
Los hongos son organismos eucarióticos caracterizados por la formación de hifas, que son estructuras filamentosas constituidas por una sucesión de células intercomunicadas, que en conjunto constituyen el micelio. Dichas estructuras representan la forma invasiva de los hongos patógenos y son las que se observan en las preparaciones histológicas del tejido infectado, aunque algunos hongos miceliares pueden esporular también en el tejido invadido lo que facilita su diseminación. Sin embargo, un grupo importante también de hongos patógenos no producen hifas y se caracterizan por presentar únicamente estructuras unicelulares (levaduras). Los hongos desarrollan un papel fundamental en el mantenimiento de la biosfera ya que son los principales descomponedores de la materia orgánica, permitiendo así completar el ciclo de la materia y de la energía. Otra característica importante de los hongos es la producción de metabolitos secundarios de interés en medicina y en biotecnología. Como aspecto negativo debemos destacar la capacidad, que presentan un número importante de hongos, de producir enfermedades en el hombre y en los animales que pueden traducirse en alergias o infecciones fúngicas (micosis).
Muchos hongos tienen un ciclo de vida característico con diferentes formas de reproducción que pueden presentarse como organismos separados con diferente morfología (pleomorfismo). Las formas de reproducción sexual se conocen como teleomorfos y las asexuales como anamorfos. El organismo en conjunto se conoce como holomorfo. Algunas especies fúngicas presentan varios anamorfos que se propagan de forma independiente y se conocen como sinanamorfos. La clasificación de los hongos se ha basado tradicionalmente en la morfología de sus estructuras fértiles.
En este trabajo hemos revisado algunos de los cambios más significativos que se han producido en la taxonomía en los hongos patógenos en los últimos años. Profundizar en el conocimiento de la biología y taxonomía de dichos organismos contribuirá, sin duda, en una mejora del tratamiento de las infecciones que producen.
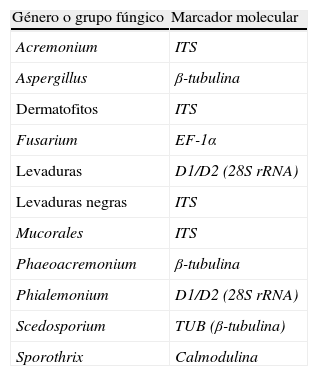
Los esquemas de clasificación de los hongos patógenos han cambiado considerablemente en la última década debido al gran avance de las técnicas moleculares, las cuales han permitido un más fácil acceso a sus secuencias de ADN (tabla 1). Un paso fundamental para un mejor conocimiento de las relaciones filogenéticas de los diversos grupos que integran el reino Fungi lo constituyó el trabajo de James et al.1. Dichos autores realizaron un análisis filogenético de las secuencias de 6 genes de un número importante de especies fúngicas representativas de los diferentes grupos taxonómicos que integran dicho reino. Como resultado de ello, se llevó a cabo una profunda reorganización de las categorías fúngicas superiores, proponiéndose incluso un nuevo esquema taxonómico basado fundamentalmente en criterios moleculares2.
Marcadores moleculares utilizados en la identificación mediante secuenciación del ADN de hongos patógenos
| Género o grupo fúngico | Marcador molecular |
| Acremonium | ITS |
| Aspergillus | β-tubulina |
| Dermatofitos | ITS |
| Fusarium | EF-1α |
| Levaduras | D1/D2 (28S rRNA) |
| Levaduras negras | ITS |
| Mucorales | ITS |
| Phaeoacremonium | β-tubulina |
| Phialemonium | D1/D2 (28S rRNA) |
| Scedosporium | TUB (β-tubulina) |
| Sporothrix | Calmodulina |
Entre los descubrimientos más importantes que han propiciado los análisis moleculares debemos señalar el reconocimiento de dos parásitos tradicionales, Pneumocystis y Microsporidium, como organismos fúngicos y la exclusión de Pythium y Rhinosporidium del reino Fungi, integrándose en los reinos Chromalveolata y Protozoa, respectivamente. Las especies de Pneumocystis han demostrado ser específicas de huésped, siendo P. jiroveci la especie que infecta a los humanos. Dentro del reino Fungi, los cambios taxonómicos derivados de los diversos estudios filogenéticos han afectado a un gran número de géneros y especies patógenos para el hombre. A su vez, el análisis de secuencias de numerosos aislados clínicos ha incrementado sustancialmente la diversidad de especies capaces de ocasionar micosis1–3.
Aunque la definición de especie sigue siendo un tema todavía no resuelto en micología, el criterio basado en la utilización del concepto phylogenetic species recognition (PSR), consistente en la secuenciación de varios genes y un posterior análisis de sus resultados mediante métodos filogenéticos, ha demostrado ser de gran utilidad en la definición de nuevas especies y en la delimitación de las especies integrantes de algunos géneros complejos4. Estos estudios multigénicos han permitido demostrar que muchas especies, que tradicionalmente habían sido consideradas como simples morfoespecies, constituyen en realidad complejos de especies, en muchas ocasiones solo diferenciables molecularmente. Una consecuencia importante desde un punto de vista clínico radica en el hecho de que muchas de estas nuevas especies que forman parte de un agregado o complejo pueden diferir en su sensibilidad a los antifúngicos utilizados comúnmente en clínica. Ello implica que la correcta identificación de los nuevos patógenos suele ser especialmente importante para el diagnóstico de la infección y para el tratamiento adecuado del paciente. Por desgracia, muchos laboratorios de microbiología clínica no tienen la capacidad o el conocimiento suficiente para identificar muchas de estas nuevas especies filogenéticas, por lo que a menudo deben recurrir al concurso de centros de referencia o laboratorios especializados.
En la actualidad el reino Fungi, se divide en dos subreinos, Dykaria, el cual agrupa las divisiones Ascomycota y Basidiomycota, y el llamado «Hongos Basales» que agrupa al resto de los hongos. Ciñéndonos únicamente a los patógenos, dentro del segundo subreino se ubican aquellas especies que antes pertenecían a la división Zygomycota (zigomicetes) y que se ha demostrado constituye un grupo polifilético, por lo que dicha categoría ha sido eliminada en las nuevas clasificaciones1–3. Dentro de este subreino los hongos de interés clínico se agrupan en dos subdivisiones, Mucoromycotina con el orden Mucorales y Entomophtoramycotina con los géneros Conidiobolus y Basidiobolus, el primero en el orden Entomophthorales y el segundo sin una clara afinidad taxonómica (incertae sedis).
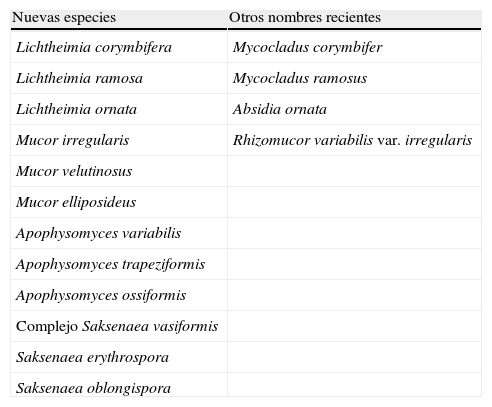
MucoralesDentro del orden Mucorales se encuentran algunos géneros de hongos patógenos importantes. Podemos destacar a Rhizopus con Rhyzopus oryzae y Rhyzopus microsporus entre las especies más frecuentemente aisladas de muestras clínicas5,6. En este género se han producido pocos cambios taxonómicos, pero sí los han experimentado algunos de los géneros que le siguen en orden de importancia clínica como son Lichtheimia y Mucor (tabla 2). Hasta hace poco el primero de ellos se conocía como Absidia, luego pasó a denominarse Mycocladus y más recientemente las especies termotolerantes, entre ellas las patógenas humanas, se incluyeron en Lichtheimia como Lichtheimia corymbifera, Lichtheimia ramosa y Lichtheimia ornata, mientras que las especies mesófilas se mantienen en Absidia7. Dentro de Mucor, la especie Mucor circinelloides es la que presenta una mayor incidencia en clínica6, aunque recientemente se han descrito otras especies como Mucor velutinosus8. Esta especie se ha aislada de muestras clínicas en EE. UU. y recientemente ha sido descrita como causante de una infección diseminada en un paciente hematológico9. Sin embargo, los cambios más importantes se han producido en dos géneros mucho menos frecuentes en clínica, pero capaces de ocasionar infecciones muy agresivas y devastadoras que con frecuencia acaban con la vida del paciente en pocos días. Se trata de los géneros Apophysomyces y Saksenaea, los cuales han demostrado ser, mediante estudios polifásicos, verdaderos complejos de especies10,11 (tabla 2). En el primero de ellos, la especie Apophysomyces variabilis es la que parecía haber ocasionado la mayoría de casos recientes12, aunque Apophysomyces trapeziformis ha estado involucrada en 13 casos de infección debidos a heridas producidas por un tornado que este año afectó al estado de Missouri en EE. UU., falleciendo cinco de los pacientes13. En el caso de Saksenaea parece que las especies predominantes son las que integran el complejo Saksenaea vasiformis, aunque recientemente se ha demostrado que Saksenaea erythrospora, una de las especies recientemente descritas11, provocó una infección fatal en un paciente herido por la explosión de una bomba en la guerra de Irak (datos no publicados).
Cambios taxonómicos recientes en especies de Mucorales aisladas de muestras clínicas
| Nuevas especies | Otros nombres recientes |
| Lichtheimia corymbifera | Mycocladus corymbifer |
| Lichtheimia ramosa | Mycocladus ramosus |
| Lichtheimia ornata | Absidia ornata |
| Mucor irregularis | Rhizomucor variabilis var. irregularis |
| Mucor velutinosus | |
| Mucor elliposideus | |
| Apophysomyces variabilis | |
| Apophysomyces trapeziformis | |
| Apophysomyces ossiformis | |
| Complejo Saksenaea vasiformis | |
| Saksenaea erythrospora | |
| Saksenaea oblongispora |
A la división Ascomycota pertenecen la mayoría de hongos patógenos, tanto los levaduriformes como los filamentosos. Entre los primeros es de destacar en los últimos años el incremento espectacular de las infecciones por Candida (Saccharomycetales), especialmente las fungemias nosocomiales. Cabe destacar también un incremento significativo de infecciones por otras especies diferentes de Candida albicans, especialmente por Candida glabrata, seguida de Candida parapsilosis, Candida tropicalis y Candida krusei, entre otras14. Además, se han publicado un considerable número de especies fenotípicamente similares a alguna de las especies conocidas de Candida, pero que son genéticamente distintas. Entre ellas cabe citar a Candida dubliniensis, una especie muy próxima a C. albicans, de distribución mundial, que se caracteriza por causar, entre otras, infecciones orales y orofaríngeas en pacientes de sida y presentar aislados resistentes al fluconazol14. Otras especies recientes son Candida metapsilosis y Candida orthopsilosis. Dichas especies presentan mínimas diferencias en su respuesta a los antifúngicos y solo se pueden diferenciar de C. parapsilosis a través de métodos moleculares15. Cabe destacar que C. orthopsilosis ha sido implicada en brotes nosocomiales16. Recientemente, también se han descrito Candida nivariensis y Candida bracarensis como especies gemelas de C. glabrata17,18. La primera fue descrita originariamente en nuestro país a partir de muestras clínicas y posteriormente aislada de diferentes tipos de infecciones en Indonesia, Japón e Inglaterra. Dicha especie es menos sensible a los azoles que C. glabrata. Candida bracarensis ha causado diferentes tipos de infecciones en Portugal, Inglaterra y EE. UU., siendo su sensibilidad a los antifúngicos muy parecida a la de C. glabrata.
En el caso de los hongos filamentosos se han producido también importantes novedades taxonómicas, algunas de ellas en géneros ya de por sí complejos. Entre ellos cabe citar el grupo de los dermatofitos y los géneros Aspergillus, Scedosporium y Fusarium.
DermatofitosLos dermatofitos pertenecen al pequeño grupo de microorganismos con los que casi todos los humanos se infectan en algún periodo de su vida19. Los recientes estudios moleculares han demostrado que los cuatro géneros anamórficos tradicionales de la familia Arthrodermataceae (Onygenales): Trichophyton, Microsporum, Epidermophyton y Chrysosporium, no son todos ellos monofiléticos. Por ejemplo, en los árboles filogenéticos de diferentes secuencias de ADN las especies de Trichophyton se acomodan dentro de los clados formados por especies de Microsporum y Epidermophyton. Además, algunas especies de Chrysosporium se agrupan con los Trichophyton geófilos, situados filogenéticamente distantes de la especie tipo de Chrysosporium, Chrysosporium merdarium. Aparte de permitir reconocer nuevas especies como Trichophyton eboreum y su teleomorfo Arthroderma olidum20,21, uno de los aspectos más interesantes que las técnicas moleculares han aportado al estudio de los dermatofitos es el hecho de haber demostrado que algunos biotipos que en base a su morfología y al tipo de infección que producían eran considerados como verdaderas especies, no lo eran en realidad (tabla 3). Dentro del complejo Trichophyton rubrum se incluyen las dos especies antropofílicas, T. rubrum y Trichophyton violaceum, que no presentan fase sexual o teleomorfo y que parece que experimentan un tipo de reproducción clonal. La antigua especie Trichophyton raubitschekii, que según algunos autores presenta características epidemiológicas diferentes de T. rubrum y además es ureasa positiva, se considera en la actualidad sinónima de T. rubrum19. Es de destacar también el hecho de que la especie cosmopolita T. rubrum, responsable de la mayoría de tiñas de las uñas y de los pies, y la especie Trichophyton soudanense, endémica de África y responsable especialmente de Tinea capitis en jóvenes, son la misma especie19. Importantes cambios taxonómicos también se han producido en el complejo Arthroderma vanbreuseghemii. En la actualidad, tres anamorfos de distribución mundial se asocian con este complejo: Trichophyton tonsurans, Trichophyton equinum y Trichophyton interdigitale. Mientras que la primera especie es antropofílica y T. equinum es responsable de infecciones en equinos. T. interdigitale es la única especie de dermatofitos que presenta heterogeneidad desde un punto de vista ecológico ya que incluye tanto cepas antropofílicas como zoofílicas. Fenotípicamente las cepas zoofílicas de T. interdigitale son indistinguibles de las cepas de las antiguas variedades Trichophyton mentagrophytes var. granulosum y Trichophyton mentagrophytes var. mentagrophytes19.
Especies de dermatofitos recientemente sinonimizadas
| Especie aceptada | Sinónimos |
| Arthroderma fulva/Microsporum fulvum | Keratinomyces longifusus, M. boulardii, M. ripariae |
| Arthroderma grubyi/Microsporum gallinae | M. vanbreuseghemii |
| Arthroderma gypseum/Microsporum gypseum | M. appendiculatum |
| Arthroderma uncinata/Trichophyton ajelloi | Todas las variedades de T. ajelloi, Epidermophyton stockdaleae |
| Microsporum audouinii | M. langeronii, M. rivalieri |
| Microsporum canis | M. distortum, M. equinum |
| Trichophyton mentagrophytes | T. mentagrophytes var. quinckeanum, T. langeronii, T. sarkisovii |
| Trichophyton equinum | Todas las variedades de T. equinum |
| Trichophyton erinacei | T. mentagrophytes var. erinacei |
| Trichophyton interdigitale | T. mentagrophytes var. goetzii, interdigitale, mentagrophytes, nodulare, granulosum, T. kradjenii, T. verrucosum var. autotrophicum |
| Trichophyton rubrum | T. fischeri, T. kanei, T. raubitschekii, T. soudanense, T. gourvilii, T. megninii |
| Trichophyton verrucosum | Todas las variedades de T. verrucosum |
| Trichophyton violaceum | Todas las variedades de T. violaceum, T. yaoundei |
El género Aspergillus, perteneciente al orden Eurotiales (clase Eurotiomycetes), incluye más de 250 especies, a 20 de las cuales se les atribuyen infecciones oportunistas en el hombre, aunque algunas de ellas solo ocasionalmente. Las especies de mayor interés clínico son Aspergillus fumigatus, Aspergillus terreus, Aspergillus flavus, Aspergillus niger y Aspergillus ustus. Dentro de la sección Fumigati, a la que pertenece la especie más importante del género, A. fumigatus, se han producido importantes cambios, tales como la reciente publicación de Neosartorya fumigata como estado sexual de A. fumigatus22. Sin embargo, cabe destacar que se trata de una especie heterotálica y que una sola cepa no es capaz de desarrollar en cultivo los cuerpos fructíferos correspondientes al teleomorfo, debiendo ser enfrentadas dos cepas compatibles durante largo tiempo para que los formen. Por el contrario, existen otras especies patógenas del mismo género que usualmente desarrollan su estado sexual en cultivo a partir de un solo aislado, tales como Neosartorya hiratsukae, Neosartorya pseudofischerii y Neosartorya udagawae. Esta última ha sido considerada como una especie emergente en los últimos años, produciendo infecciones invasivas con características diferenciales de las producidas por A. fumigatus23. Aspergillus lentulus es otra especie reciente de la misma sección, también morfológicamente parecida a A. fumigatus, de la que se puede distinguir básicamente por su lenta esporulación en cultivo y por presentar un patrón de resistencia a los antifúngicos diferente, siendo A. lentulus más resistente in vitro a la anfotericina B24,25. A. terreus (sección Terrei) es otro complejo de especies de creciente interés clínico y que presenta también una sensibilidad disminuida a la anfotericina B. Estudios de secuenciación multilocus han demostrado que la nueva especie Aspergillus alabamensis dentro del complejo puede colonizar sujetos inmunocompetentes y presenta una sensibilidad disminuida a la anfotericina B26. Dentro de la sección Usti, A. ustus ha sido tradicionalmente considerada como un patógeno humano aunque poco frecuente. Sin embargo, recientemente se han investigado algunos aislados clínicos pertenecientes a dicha especie demostrando, mediante análisis de secuencias de ADN, que en realidad pertenecían a una nueva especie, que presenta una sensibilidad reducida a los triazoles, a la que se denominó Aspergillus calidoustus27. Además de las citadas, un buen número de especies de Aspergillus, tales como Aspergillus tamarii, Aspergillus nomius, Aspergillus pseudonomius, Aspergillus granulosus, Aspergillus deflectus y Emericella quadrilineata, entre otras, han causado infecciones humanas en los últimos años14,28.
Recientemente, se han publicado algunas recomendaciones para la identificación molecular de cepas clínicas de Aspergillus a nivel de especie. Una primera identificación fenotípica del aislado se considera como un criterio importante para continuar con la secuenciación de la región ITS y de los genes de la β-tubulina o calmodulina29.
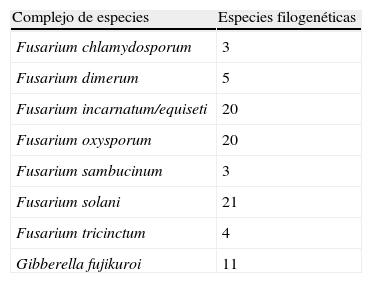
FusariumFusarium es un género anamórfico perteneciente a los ascomicetos del orden Hypocreales (clase Sordariomycetes) que agrupa a un gran número de especies. La mayoría de ellas son saprobias o parásitas de plantas, aunque también existen especies capaces de infectar humanos y animales, habiendo aumentado significativamente el número de fusariosis en pacientes inmunocomprometidos30. Hasta hace poco, y debido a su importancia en agricultura, la taxonomía del género se basaba principalmente en criterios morfológicos31 y en el tipo de planta huésped. Muchas especies presentaban diferentes formae specialis las cuales no siempre se correspondían con grupos naturales. Recientemente, diversos autores han utilizado criterios moleculares en la taxonomía de Fusarium, basados en la secuenciación de diversos genes, lo que les ha permitido demostrar que las clásicas especies patógenas del género, como son F. verticillioides (F. moniliforme), F.oxysporum y F. solani, constituyen en realidad complejos de especies32–36. Así se han podido diferenciar unas 70 especies involucradas en infecciones humanas, la mayoría de las cuales sin nombre específico ya que al no poder ser reconocibles fenotípicamente se ha preferido no asignarles binomios específicos (tabla 4). Considerando la dificultad de identificar morfológicamente muchas de las cepas de especies filogenéticas implicadas en casos clínicos, con el objeto de permitir reconocer dichas cepas y poder realizar estudios epidemiológicos, O’Donnell et al.32 han establecido una nomenclatura particular de secuencias tipos o haplotipos obtenidas mediante la secuenciación de los genes EF-1α, RPB1 y RPB2. Utilizando este procedimiento, la identificación de los aislados clínicos se puede llevar a cabo comparando las secuencias obtenidas con las depositadas en la base de datos Fusarium-ID disponible en http://isolate.fusariumdb.org. La identificación de los aislados clínicos a nivel de especie o de haplotipos sin duda tiene un gran interés científico y epidemiológico, pero desde un punto de vista práctico con respecto al tratamiento del enfermo su interés disminuye ya que se ha demostrado que en general la mayoría de especies filogenéticas suelen ser resistentes a los antifúngicos utilizados en clínica34–36.
Complejos de especies de Fusarium que agrupan especies filogenéticas de interés clínico
| Complejo de especies | Especies filogenéticas |
| Fusarium chlamydosporum | 3 |
| Fusarium dimerum | 5 |
| Fusarium incarnatum/equiseti | 20 |
| Fusarium oxysporum | 20 |
| Fusarium sambucinum | 3 |
| Fusarium solani | 21 |
| Fusarium tricinctum | 4 |
| Gibberella fujikuroi | 11 |
Las especies que integran este grupo de hongos pertenecen al orden Microascales y últimamente han emergido principalmente como causantes de infecciones diseminadas en pacientes neutropénicos. Hasta hace pocos años se conocían únicamente dos especies de Scedosporium, Scedosporium prolificans y Scedosporium apiospermum. Sin embargo, estudios polifásicos recientes han demostrado que la segunda especie constituye en realidad un complejo de especies. Las especies que integran el complejo son Scedosporium boydii (teleomorfo Pseudallescheria boydii), S. apiospermum (teleomorfo Pseudallescheria apiosperma), Pseudallescheria ellipsoidea, Pseudallescheria angusta, Pseudallescheria fusoidea, Pseudallescheria minutispora, Scedosporium dehoogii y Scedosporium aurantiacum37–39. Se ha demostrado también que algunas de estas especies presentan importantes diferencias en su respuesta a los antifúngicos, siendo S. aurantiacum la especie con menor sensibilidad a los mismos39. Esta última especie es la que se identifica fenotípicamente con más facilidad al producir colonias con un reverso anaranjado cuando crecen en agar patata dextrosa28. La diferenciación de las otras especies es más difícil, debiendo recurrir, especialmente los no expertos, a técnicas de secuenciación de ADN.
S. prolificans es otro importante patógeno que ha emergido también en los últimos años. Aunque relacionado con el grupo anterior, está filogenéticamente distanciado y genéticamente más próximo al género teleomórfico Petriella. Dicha especie es más virulenta que las anteriormente citadas, ocasionando infecciones diseminadas con una elevada mortalidad y prácticamente resistentes a todos los antifúngicos disponibles40. Los primeros casos de infección diseminada por S. prolificans en Europa fueron reportados precisamente en nuestro país41.
SporothrixSporothrix schenckii es un hongo dimórfico perteneciente al orden Ophiostomatales, que durante muchos años ha sido considerada como la única especie responsable de esporotricosis, infección subaguda o crónica que afecta a la dermis y al tejido celular subcutáneo y con una distribución mundial. Dicha especie ha sido extensamente estudiada y recientemente se ha demostrado que representa un complejo de especies, siendo las más comunes S. schenckii sensu stricto, Sporothrix globosa y Sporothrix brasiliensis, aunque otras especies tales como Sporothrix mexicana y Sporothrix luriei han sido también descritas42,43. Aunque hacen falta más estudios, los datos disponibles parecen indicar que las nuevas especies del género presentan diferentes distribuciones geográficas44; por ejemplo, S. brasiliensis se ha localizado casi exclusivamente en Brasil, mientras que S. globosa presenta una distribución cosmopolita y es de destacar que la mayoría de cepas aisladas de la India pertenecen a esta última especie (datos no publicados). Solo la correcta identificación de estas nuevas especies, mediante secuenciación o por técnicas fisiológicas, nos permitirá dilucidar si las diferentes manifestaciones clínicas de esporotricosis son producidas por especies diferentes. Hasta la fecha se ha demostrado que las diferentes especies que integran el complejo presentan diferente sensibilidad a los antifúngicos45.
Otros hongos filamentososEn los últimos años se han publicado numerosos casos clínicos causados por una gran diversidad de especies fúngicas diferentes de las tradicionales. Especies consideradas exclusivamente saprobias o meros contaminantes de laboratorio han demostrado también ser capaces de infectar al hombre. Entre ellas cabe citar Acremonium spp., Phialemonium spp., Phaeoacremonium spp. y algunas levaduras negras.
Algunas especies del género Acremonium son capaces de ocasionar una amplia variedad de infecciones en el hombre46, habiéndose descrito diferentes casos en nuestro país47. Por la morfología de los hongos así como por su comportamiento en clínica recuerdan a Fusarium, aunque la taxonomía de Acremonium es más confusa. Es un género muy complejo, claramente polifilético que agrupa a especies que pertenecen a diferentes familias e incluso órdenes48. En un estudio reciente en el que se han identificado molecularmente numerosos aislados de origen clínico procedentes de EE. UU., se ha demostrado la existencia de numerosas posibles nuevas especies. En dicho estudio, sorprendentemente, de las 11 especies tradicionalmente consideradas como patógenas potenciales, tales como Acremonium recifei, Acremonium strictum o Acremonium potronii entre otras, solo fueron identificadas Acremonium kiliense y Acremonium atrogriseum, que conjuntamente con las cepas del complejo Acremonium sclerotigenum-Acremonium egyptiacum y Acremonium implicatum fueron las predominantes49. Recientemente Summerbell et al.48 en una extensa revisión del género, utilizando básicamente criterios moleculares, transfirieron las especies oportunistas A. strictum y A. kiliense al género Sarocladium.
Phialemonium es un género de hongos poco diferenciados morfológicamente que puede confundirse con Acremonium o con Fusarium cuando las especies de este último no producen macroconidios. Phialemonium presenta aparentemente una menor incidencia clínica que los otros dos géneros, habiéndosele relacionado con infecciones invasivas graves50. Recientemente, se ha demostrado que las dos especies de Phialemonium aceptadas, Phialemonium curvatum y Phialemonium obovatum, no deben ubicarse en el mismo género y que algunas especies crípticas, no descritas hasta la fecha, están también involucradas en clínica51.
Phaeoacremonium, perteneciente a los Diaporthales, causa feohifomicosis en el hombre, caracterizadas generalmente por abscesos subcutáneos, quistes, osteoartritis, etc., tanto en pacientes inmunodeprimidos como inmunocompetentes, y suelen ser precedidas de una inoculación traumática, aunque también han sido descritas ocasionalmente como causantes de infecciones diseminadas en individuos inmunodeprimidos. El género contiene actualmente nueve especies que han causado infecciones en el hombre52.
Algunos hongos patógenos que presentan una pigmentación oscura y producen colonias similares a las de las levaduras son las denominadas levaduras negras, la mayoría pertenecen al orden Chaetothyriales (clase Eurotiomycetes). Clínicamente les caracteriza un neurotropismo muy marcado, siendo las encefalitis una de las manifestaciones más graves14. Dentro de este grupo cabe destacar a Rhinocladiella mackenziei, especie marcadamente neurotrópica endémica del Oriente Medio3. Otras especies de interés clínico pertenecen a los géneros Exophiala, Cladophialophora y Fonsecaea. La diferenciación fenotípica de las especies de dichos géneros es difícil, pero el análisis de las secuencias de la región ITS ha demostrado ser muy útil para su identificación53. Estudios moleculares han demostrado que Exophiala jeanselmei, especie tradicionalmente causante de infecciones subcutáneas, contiene dos especies crípticas, Exophiala oligosperma y Exophiala xenobiotica, los cuales son agentes comunes de infecciones cutáneas14. A partir de cepas de Cladophialophora aisladas de muestras clínicas se han podido identificar cuatro nuevas especies en dicho género, Cladophialophora saturnica y Cladophialophora inmunda que causan infecciones cutáneas, Cladophialophora mycetomatis relacionada con infección subcutánea y Cladophialophora samoënsis, un agente endémico de cromoblastomicosis54.
Las especies de Fonsecaea han sido consideradas tradicionalmente como típicos agentes causantes de cromoblastomicosis. Recientemente utilizando técnicas de AFLP y la secuenciación de varios genes se ha demostrado que Fonsecaea compacta es sinónima de Fonsecaea pedrosoi y se han propuesto dos nuevas especies, Fonsecaea monophora y Fonsecaea nubica, las cuales a diferencia de F. pedrosoi, que produce infecciones en América Central y del Sur, tienen una distribución mundial14,28,55.
BasidiomycotaDentro de los basidiomicetos figuran importantes grupos de hongos de interés clínico, especialmente los hongos unicelulares o levaduras, entre los que destacan Cryptococcus, Malassezia y Trichosporon.
CryptococcusDentro del complejo de especies Cryptococcus neoformans-Cryptococcus gattii perteneciente al orden Tremellales de la clase Tremellomycetes, se incluyen dos especies anamórficas, C. neoformans y C. gattii. Ambas especies difieren en su epidemiología y en los nichos ecológicos que ocupan. C. neoformans no suele producir infecciones graves en individuos inmunocompetentes, sin embargo, en pacientes inmunodeprimidos puede causar infecciones sistémicas con un marcado neurotropismo. Estudios moleculares han revelado la existencia en C. neoformans de dos grupos genotípicos que son considerados como variedades, var. grubii (serotipo A) y var. neoformans (serotipo D), así como la existencia de híbridos diploides o aneuploides dentro del complejo. Los híbridos del serotipo AD han mostrado una elevada incidencia en nuestro país14. Las dos variedades son especialmente frecuentes en Europa, sin embargo, la primera de ellas tiene una distribución mundial y es responsable de la mayoría de criptococosis en pacientes con sida. La especie C. gattii comprende 4 linajes filogenéticos que según algunos autores podrían representar verdaderas especies13. Dicha especie infecta principalmente a pacientes inmunocompetentes especialmente en áreas tropicales o subtropicales, aunque ha sido también aislada en Europa en zonas de clima temperado o Mediterráneo.
MalasseziaLas especies de Malassezia (orden Malasseziales, clase Ustilaginomycetes) forman parte de la microbiota de la piel normal, especialmente de aquellas áreas ricas en grasa, pero también pueden provocar infecciones dérmicas más o menos importantes y también se han descrito ocasionalmente brotes nosocomiales en neonatos que reciben alimentación lipídica por vía intravenosa. Antes del 1996 solo existían tres especies en el género, Malassezia sympodialis, Malassezia pachydermatis y Malassezia furfur. En 1996 Guého et al.56 llevaron a cabo un estudio fenotípico y molecular proponiendo 4 nuevas especies: Malassezia globosa, Malassezia obtusa, Malassezia restricta y Malassezia slooffiae. M. globosa, la más común de ellas, está generalmente involucrada en casos de pitiriasis versicolor, mientras que la citada especie y M. restricta predominan en la dermatitis seborreica. Posteriormente, han sido publicadas otras siete especies (tabla 5) aisladas en diferentes tipos de animales, aunque no se ha demostrado que todas ellas sean capaces de producir infección. Todas las especies de Malassezia son lípido dependientes, con la única excepción de M. pachydermatis, siendo necesaria la presencia de ácidos grasos de cadena larga y técnicas especiales para su aislamiento, conservación e identificación.
Recientemente se han publicado los genomas y proteomas de secreción de M. globosa y M. restricta revelando la presencia de múltiples lipasas y la ausencia de un gen para la síntesis de ácidos grasos, lo que explica su dependencia lipídica57.
TrichosporonLas especies de Trichosporon (orden Trichosporonales, clase Tremellomycetes) son levaduras caracterizadas por la formación de artroconidios, conidiación meristemática y apresorios. Algunas de las especies de este género son las típicas causantes de la «piedra blanca», aunque pueden producir también infecciones más graves con una elevada mortalidad, especialmente en pacientes hematológicos. Durante muchos años la única especie del género aceptada fue Trichosporon beigelii. Guého et al. llevaron a cabo una revisión del género en base al estudio de la ultraestructura de los poros septales, contenido de guanina-citosina, perfiles nutricionales y análisis de las secuencias parciales del gen 28S rRNA58. En base a ello, la especie T. beigelii fue sustituida por seis especies Trichosporon asahii, Trichosporon cutaneum, Trichosporon asteroides, Trichosporon mucoides Trichosporon inkin y Trichosporon ovoides que causan infecciones en diferentes localizaciones anatómicas. La primera de ellas es la más importante desde un punto de vista clínico y la causante de la mayoría de infecciones invasoras graves, seguida de T. mucoides o T. asteroides, dependiendo de los autores59, T. ovoides suele estar asociada a la piedra blanca del cuero cabelludo y T. inkin a la del vello púbico14. Se considera que unas 14 especies de las casi 40 aceptadas en el género son potenciales patógenas humanas59 (tabla 6).
Pero también dentro de los basidiomicetos figuran varios hongos filamentosos, que no por menos conocidos son menos relevantes desde un punto de vista clínico. La dificultad en el diagnóstico de las infecciones causadas por dichos hongos radica en que muchos de ellos no esporulan en cultivo y suelen ser considerados como contaminantes. Entre los más conocidos, precisamente porque pueden ser identificados morfológicamente, figuran Schyzophyllum commune, Bjerkandera adusta y varias especies de Hormographiella28. Hormographiella aspergillata ha sido considerada como una especie emergente en pacientes leucémicos60. Cabe también indicar que recientes estudios moleculares que han secuenciado las regiones ITS y D1/D2 de numerosos aislados clínicos, morfológica-y fisiológicamente identificados como pertenecientes a los basidiomicetes, han demostrado que muchas otras especies pueden estar implicadas también infecciones humanas61.
ConclusionesLa biología molecular y las técnicas de secuenciación han revolucionado la taxonomía de los hongos patógenos y han cambiado nuestros conocimientos sobre las relaciones existentes entre ellos. Muchos grupos y especies han demostrado ser artificiales y en la actualidad se tiende hacia la elaboración de esquemas de clasificación más naturales basados en criterios filogenéticos, a la vez que se van descubriendo nuevas especies de hongos patógenos. El conocimiento y aplicación de dichos avances en el laboratorio clínico sin duda va a permitir una sustancial mejora del tratamiento de muchas enfermedades fúngicas ya que fundamentalmente depende de la correcta identificación de las especies implicadas.