Desde su aparición en la década de 1990 la infección Staphylococcus aureus Meticilín-Resistente en pacientes sanos sin ningún contacto con el medio sanitario ha experimentado una diseminación en todo el mundo que la convierte en un problema de salud global.
MétodosSe trata de un estudio observacional prospectivo realizado durante el período del 1 de abril al 1 de noviembre de 2010. Se incluyeron todos los pacientes adultos que acudieron al Servicio de Urgencias con una infección cutánea supurativa adquirida en la comunidad. Se evaluaron características clínicas y microbiológicas, así como datos epidemiológicos.
ResultadosFueron recogidas un total de 59 muestras de 59 pacientes, de las que 13 se identificaron como SARM-AC. La prevalencia de SARM-AC entre todos los pacientes que acuden con infecciones cutáneas supurativas a Urgencias es del 22,03% y entre las infecciones estafilocócicas 33,3%. Clínicamente destaca una mayor necrosis en las lesiones producidas por SARM-AC. Solo 3 pacientes precisaron ingreso. 11 de las 13 cepas eran productoras de Leucocidina de Panton-Valentine, y 5 tenían resistencias antibióticas asociadas. La infección por SARM-AC continúa siendo más frecuente en población no autóctona.
ConclusionesEn España existen muy pocos datos acerca de la prevalencia de infecciones por SARMAC. Este estudio pretende reflejar la importancia actual de este patógeno en nuestro medio. Aproximadamente un tercio de las infecciones supurativas estafilocócicas de piel y partes blandas que acuden al servicio de Urgencias de nuestro hospital son producidas por SARM-AC, constatando una rápida propagación en nuestro país. Algunas características clínicas, como la presencia de necrosis están íntimamente asociadas a SARM-AC.
Since it was first described in the 1990s, Methicillin-Resistant Staphylococcus aureus infection among people with no contact with a hospital setting or with no traditional risk factors, has spread worldwide and is now an important epidemiological and public health problem.
MethodsThe present prospective and observational study was carried out from April to November 2010. All adult patients with community-acquired suppurative skin and soft tissue infection (SSTI) attending the Emergency Department were enrolled. Clinical, microbiological and epidemiological features of the infection were assessed.
ResultsA total of 59 samples were collected from 59 patients and CA-MRSA was isolated in 13 of them. Prevalence of CA-MRSA in patients with suppurative SSTI seen in the emergency department was 22.03%, and was 33.3% in patients with staphylococcal infection. Is worth noting the greater presence of necrosis detected in CA-MRSA lesions. Only 3 patients required hospital admission. Eleven of the 13 strains were Panton-Valentine leucocidin producers, and 5 were resistant to non-betalactam antibiotics. CA MRSA infection is still more frequent in the immigrant population.
ConclusionData on CA-MRSA prevalence in Spain are sparse. This study aims to emphasise the current importance of this emergent pathogen in our area. About one third of suppurative staphylococcal SSTI presenting in our emergency department are caused by this agent, confirming a rapid spread in our country. Some clinical features, such as the high presence of necrosis, are closely related to CA-MRSA.
La epidemiología de las infecciones estafilocócicas comunitarias ha presentado cambios radicales en los últimos 10 años. Anteriormente asociadas siempre al medio sanitario, cepas de Staphylococcus aureus (S. Aureus) resistentes a meticilina (SARM) han emergido y se han diseminado de forma alarmantemente rápida en la comunidad. Estas cepas, molecularmente distintas de las asociadas a cuidados sanitarios1,2, actualmente son endémicas en muchas zonas de Estados Unidos y constituyen la principal causa de infecciones de piel y partes blandas en personas jóvenes y previamente sanas, sin ningún contacto con el medio sanitario. Esto ha obligado a cambiar las recomendaciones del tratamiento antibiótico empírico en ese país3.
Aunque en la mayoría de los casos producen infecciones cutáneas leves como forúnculos o abscesos, se ha documentado una elevada capacidad de destrucción tisular, y se han descrito casos de fascitis y neumonías necrosantes que en algunos casos han sido letales4,5.
Los escasos estudios realizados en Europa sugieren que la prevalencia de S. Aureus resistente a meticilina adquirido en la comunidad (SARM-AC) es todavía baja en la mayoría de los países (alrededor del 5-10%) pero alertan de una incidencia creciente6–10. Posiblemente en España la presencia de SARM-AC esté infravalorada, ya que los estudios existentes son todavía escasos y no están basados en un estudio sistemático de todos los casos potenciales6,11. Los datos más recientes sugieren una mayor diseminación en los últimos años12 por tanto, y considerando también la tendencia epidemiológica proveniente de otras poblaciones, es importante no asumir que las infecciones leves de piel y partes blandas en nuestros pacientes están causadas por S. Aureus sensible a meticilina (SASM). Otro aspecto relevante en la epidemiología de este patógeno es su introducción y diseminación entre pacientes hospitalizados. Esta situación ya se ha producido en hospitales estadounidenses y de forma esporádica en Europa10,13–15. Cabe esperar, por tanto, que cada vez sea más difícil hacer una distinción entre SARM-AC y S. Aureus resistente a meticilina asociado a cuidados sanitarios (SARM-ACS). Tanto en España como en el resto de países europeos el control de la propagación de este patógeno mediante la realización de estudios a nivel nacional e internacional es de vital importancia para impedir que su diseminación alcance las cifras de Estados Unidos1,4,10.
Por este motivo y con la intención de evaluar la incidencia y las características clínicas y epidemiológicas de las infecciones supurativas de piel y partes blandas adquiridas en la comunidad producidas por SARM-AC en adultos atendidos en Urgencias, se diseñó el siguiente estudio.
Material y métodosDiseño y ámbito del EstudioEstudio observacional y prospectivo en el que se incluyeron los pacientes mayores de 18 años que acudieron al Servicio de Urgencias del Hospital Universitario La Paz (HULP) con una infección cutánea supurativa entre el 1 de Abril y el 1 de Noviembre de 2010. El HULP es un hospital terciario perteneciente al Sistema Nacional de Salud que atiende a una población urbana y periurbana del norte de Madrid de aproximadamente 600.000 habitantes. El Servicio de Dermatología del HULP presta atención dermatológica 24 horas en colaboración con el Servicio de Urgencias.
Todo paciente que acudió al Servicio de Urgencias del HULP con una lesión supurativa de piel y partes blandas fue valorado inicialmente por un dermatólogo, quien reclutó a los pacientes del estudio.
Solo se incluyeron los pacientes con infecciones primarias (se excluyen por tanto los quistes epidermoides inflamados y las úlceras crónicas o tumores con presencia de pus) adquiridas en la comunidad. Siguiendo la práctica clínica habitual se realizó drenaje de la lesión en los casos en que fue necesario, se pautó antibioterapia empírica según el criterio de cada facultativo y se evaluó la evolución de cada paciente a las 72 horas de su llegada a Urgencias. De forma adicional se registraron variables epidemiológicas, clínicas y microbiológicas.
Se consideró que una infección supurativa de piel y partes blandas era adquirida en la comunidad cuando no se cumplían ninguno de los siguientes criterios15:
- 1)
Antecedente de infección o colonización por SARM
- 2)
Ingreso hospitalario o en centro sociosanitario de larga estancia en el año previo
- 3)
Antecedente de cirugía en el año previo.
- 4)
Pacientes sometidos a diálisis en el año previo.
- 5)
Portador de dispositivo percutáneo o intravascular.
- 6)
Trabajador sanitario.
- 7)
Convivientes de trabajadores sanitarios.
- 8)
Pacientes que reciben cuidados de forma ambulatoria (por ejemplo: curas de heridas o úlceras crónicas, administración de tratamientos parenterales en Hospitales de Día o Centros de Salud, pacientes sometidos a rehabilitación)
Desde el punto de vista clínico, fueron definidos los siguientes tipos de infección cutánea:
- 1)
Forúnculo o absceso (según aparezcan sobre piel pilosa o no): lesión inflamatoria con colección central de pus de aparición sobre piel previamente sana.
- 2)
Forunculosis: presencia de 2 o más forúnculos al mismo tiempo.
- 3)
Foliculitis: infección superficial del folículo piloso que presenta una pústula central.
- 4)
Ántrax: coalescencia de múltiples forúnculos formando una placa.
- 5)
Celulitis con supuración: placa inflamatoria extensa de límites mal definidos con puntos de supuración o colecciones de pus en algunas zonas.
El estudio fue realizado por un equipo de 8 facultativos pertenecientes al servicio de Dermatología. Además del tipo de lesión se recogieron datos acerca de la afectación sistémica (fiebre, leucocitosis, datos de sepsis), localización, presencia de mayor necrosis de la esperada para el tipo de infección (documentado con fotografías de la lesión), tratamiento antibiótico en curso en el momento de acudir a urgencias y episodios similares en los 6 meses previos. El mismo facultativo que atendió a cada paciente en Urgencias se encargó de su reevaluación a las 72h en Consultas Externas o en la planta de hospitalización, considerándose mejoría la disminución subjetiva del dolor, la disminución de la supuración y del tamaño de la lesión.
Estudio MicrobiológicoSe cultivaron muestras del exudado de todos los pacientes, recogidas mediante aspirado con jeringuilla o torunda estéril según la cantidad de material purulento, previo lavado de la zona con clorhexidina. Las muestras fueron tomadas en las primeras horas tras su llegada a Urgencias. Se realizó tinción de gram en todas las muestras.
Se identificaron los aislamientos bacterianos por técnicas convencionales y se realizó antibiograma mediante microdilución WIDER Soria Melguizo®. En todos los casos de S. aureus se estudió la sensibilidad frente a penicilina, oxacilina, vancomicina, teicoplanina, daptomicina, gentamicina, tobramicina, eritromicina, clindamicina, quinupristina/dalfopristina, linezolid, minociclina, levofloxacino, cotrimoxazol y rifampicina. Se utilizaron puntos de corte Clinical Laboratory Standards Institute (CLSI) 201016. Se realizó también test de difusión D-test con discos de eritromicina y clíndamicina para detectar los fenotipos inducibles MLSb.
Se consideró SARM todo aislado resistente a oxacilina. Dado que ningún paciente incluido en el estudio había tenido contacto alguno con el sistema sanitario todos los aislamientos de SARM se consideran SARM-AC.
El ADN de los aislados de S. aureus se extrajo utilizando el equipo UltraClean Microbial DNA purification (MoBio, Carlsbad, CA). El tipo de cassette cromosómico mec se determinó mediante una PCR múltiplex según el método de Boye et al.17 La presencia de los genes lukS-PV y lukF-PV, que codifican la leucocidina de Panton-Valentine se estudió mediante PCR según el método descrito en Jarraud et al.18 Los productos de PCR se analizaron mediante electroforesis en gel de agarosa
Estudio EpidemiológicoMediante un cuestionario estándar se recogieron los siguientes datos epidemiológicos: nacionalidad, viajes recientes al extranjero (el mes previo), síntomas similares en convivientes o personas con contacto estrecho, presencia de factores de riesgo relacionados en otros estudios previos con brotes de SARM-AC (hacinamiento, deportes de equipo con contacto directo piel con piel, homosexualidad, uso de drogas por vía parenteral, encarcelamiento)
Análisis estadísticoEl análisis estadístico de los datos se realizó utilizando el paquete estadístico informático SPSS 14.0 (SPSS, Chicago, Illinois, USA). Las variables continuas fueron comparadas mediante el test de la t-Student o U-Mann-Whitney según tuvieran o no una distribución normal. Las comparaciones entre variables categóricas se realizaron usando los test de la Chi2 o Fisher según fuese más apropiado.
ResultadosDurante el periodo del estudio se obtuvieron 59 muestras de 59 pacientes con infecciones supurativas agudas de piel y partes blandas adquiridas en la comunidad. En 48 casos se aisló un microorganismo: 39/48 (82,25%) fueron S. aureus, 2/48 E. coli, 2/48 Staphylococcus lugdunensis y 5/48 fueron cultivos polimicrobianos.
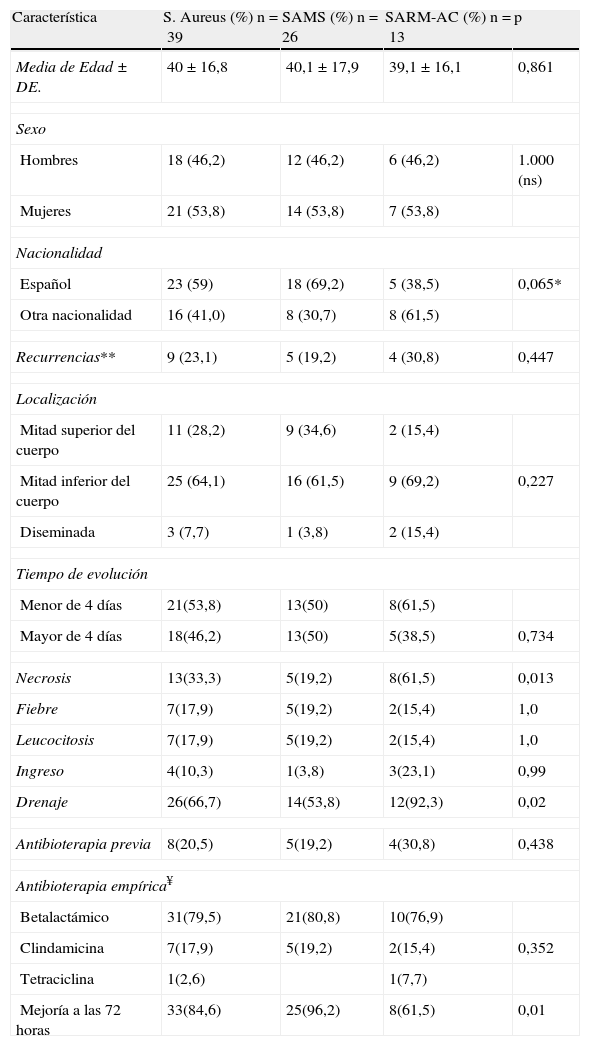
De los cultivos positivos para S.aureus el 33,33% IC95%(19.1-50.2) fueron SARM, que dados los criterios de inclusión fueron considerados SARM-AC. La prevalencia de SARM-AC entre todos los pacientes que acudieron con infecciones cutáneas supurativas al Servicio de Urgencias fue de 22,03% IC (intervalo de confianza) 95%(11,14-32,93) No se encontraron diferencias en cuanto a edad o sexo entre SARM-AC y SASM. Se observó una mayor proporción de pacientes no autóctonos en el grupo SARM-AC aunque la diferencia no fue estadísticamente significativa (tabla 1). De ellos 7 procedían de Sudamérica o Centroamérica (2 de Paraguay, 3 de Ecuador, 1 de Cuba y 1 de República Dominicana) y 1 de India. Además 1 de los pacientes españoles (tabla 2, caso 8) adquirió la infección también durante un viaje a Nepal.
Características de la infección por S. aureus
| Característica | S. Aureus (%) n=39 | SAMS (%) n=26 | SARM-AC (%) n=13 | p |
| Media de Edad±DE. | 40±16,8 | 40,1±17,9 | 39,1±16,1 | 0,861 |
| Sexo | ||||
| Hombres | 18 (46,2) | 12 (46,2) | 6 (46,2) | 1.000 (ns) |
| Mujeres | 21 (53,8) | 14 (53,8) | 7 (53,8) | |
| Nacionalidad | ||||
| Español | 23 (59) | 18 (69,2) | 5 (38,5) | 0,065* |
| Otra nacionalidad | 16 (41,0) | 8 (30,7) | 8 (61,5) | |
| Recurrencias** | 9 (23,1) | 5 (19,2) | 4 (30,8) | 0,447 |
| Localización | ||||
| Mitad superior del cuerpo | 11 (28,2) | 9 (34,6) | 2 (15,4) | |
| Mitad inferior del cuerpo | 25 (64,1) | 16 (61,5) | 9 (69,2) | 0,227 |
| Diseminada | 3 (7,7) | 1 (3,8) | 2 (15,4) | |
| Tiempo de evolución | ||||
| Menor de 4 días | 21(53,8) | 13(50) | 8(61,5) | |
| Mayor de 4 días | 18(46,2) | 13(50) | 5(38,5) | 0,734 |
| Necrosis | 13(33,3) | 5(19,2) | 8(61,5) | 0,013 |
| Fiebre | 7(17,9) | 5(19,2) | 2(15,4) | 1,0 |
| Leucocitosis | 7(17,9) | 5(19,2) | 2(15,4) | 1,0 |
| Ingreso | 4(10,3) | 1(3,8) | 3(23,1) | 0,99 |
| Drenaje | 26(66,7) | 14(53,8) | 12(92,3) | 0,02 |
| Antibioterapia previa | 8(20,5) | 5(19,2) | 4(30,8) | 0,438 |
| Antibioterapia empírica¥ | ||||
| Betalactámico | 31(79,5) | 21(80,8) | 10(76,9) | |
| Clindamicina | 7(17,9) | 5(19,2) | 2(15,4) | 0,352 |
| Tetraciclina | 1(2,6) | 1(7,7) | ||
| Mejoría a las 72 horas | 33(84,6) | 25(96,2) | 8(61,5) | 0,01 |
*Español vs. otra nacionalidad. ** Episodios similares en los 6 meses previos. ¥ instaurada en Urgencias.
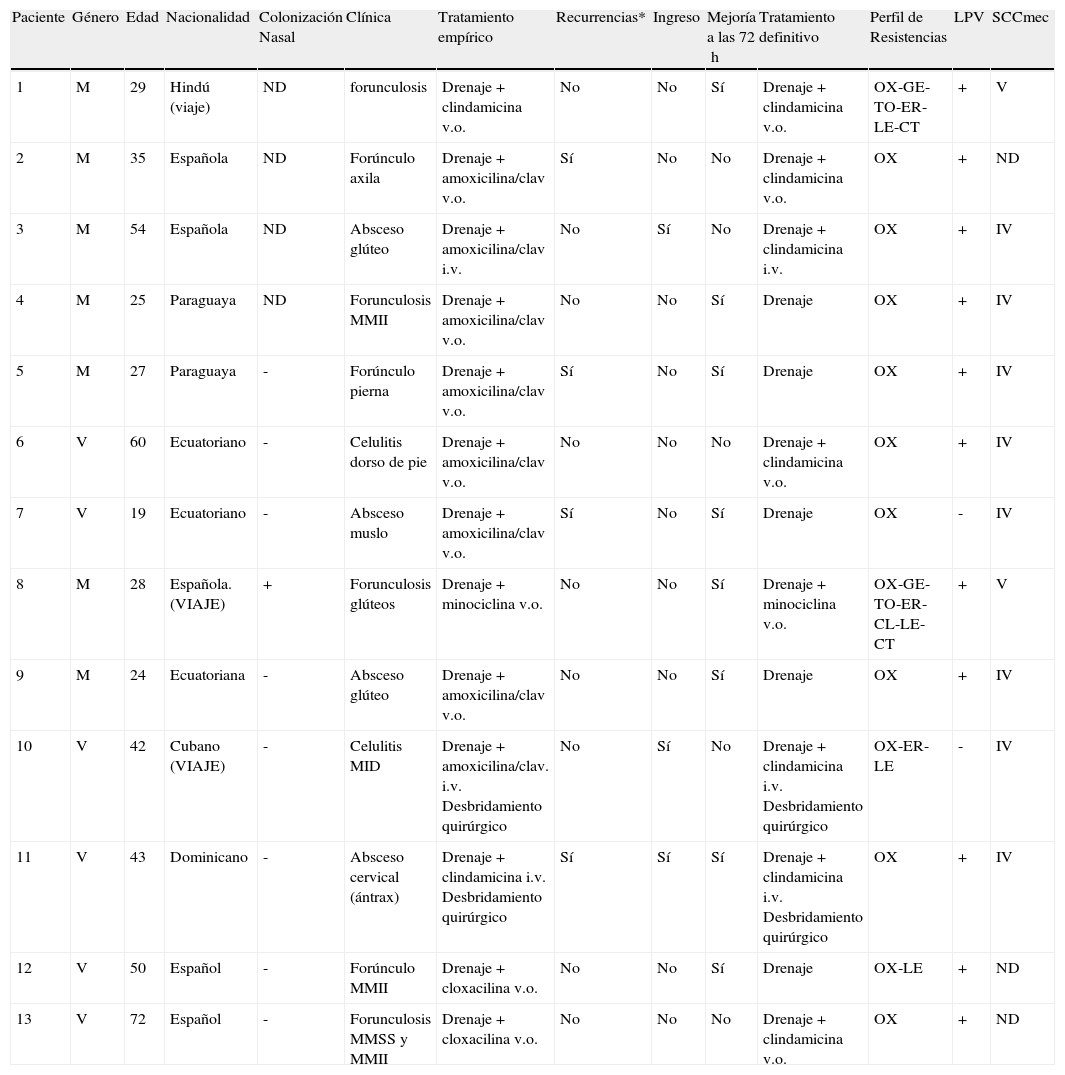
Características de los pacientes con piodermitis por SARM-AC
| Paciente | Género | Edad | Nacionalidad | Colonización Nasal | Clínica | Tratamiento empírico | Recurrencias* | Ingreso | Mejoría a las 72h | Tratamiento definitivo | Perfil de Resistencias | LPV | SCCmec |
| 1 | M | 29 | Hindú (viaje) | ND | forunculosis | Drenaje+clindamicina v.o. | No | No | Sí | Drenaje+clindamicina v.o. | OX-GE-TO-ER-LE-CT | + | V |
| 2 | M | 35 | Española | ND | Forúnculo axila | Drenaje + amoxicilina/clav v.o. | Sí | No | No | Drenaje+clindamicina v.o. | OX | + | ND |
| 3 | M | 54 | Española | ND | Absceso glúteo | Drenaje + amoxicilina/clav i.v. | No | Sí | No | Drenaje+clindamicina i.v. | OX | + | IV |
| 4 | M | 25 | Paraguaya | ND | Forunculosis MMII | Drenaje + amoxicilina/clav v.o. | No | No | Sí | Drenaje | OX | + | IV |
| 5 | M | 27 | Paraguaya | - | Forúnculo pierna | Drenaje + amoxicilina/clav v.o. | Sí | No | Sí | Drenaje | OX | + | IV |
| 6 | V | 60 | Ecuatoriano | - | Celulitis dorso de pie | Drenaje+amoxicilina/clav v.o. | No | No | No | Drenaje+clindamicina v.o. | OX | + | IV |
| 7 | V | 19 | Ecuatoriano | - | Absceso muslo | Drenaje + amoxicilina/clav v.o. | Sí | No | Sí | Drenaje | OX | - | IV |
| 8 | M | 28 | Española. (VIAJE) | + | Forunculosis glúteos | Drenaje+minociclina v.o. | No | No | Sí | Drenaje+minociclina v.o. | OX-GE-TO-ER-CL-LE-CT | + | V |
| 9 | M | 24 | Ecuatoriana | - | Absceso glúteo | Drenaje + amoxicilina/clav v.o. | No | No | Sí | Drenaje | OX | + | IV |
| 10 | V | 42 | Cubano (VIAJE) | - | Celulitis MID | Drenaje+amoxicilina/clav. i.v. Desbridamiento quirúrgico | No | Sí | No | Drenaje+clindamicina i.v. Desbridamiento quirúrgico | OX-ER-LE | - | IV |
| 11 | V | 43 | Dominicano | - | Absceso cervical (ántrax) | Drenaje+clindamicina i.v. Desbridamiento quirúrgico | Sí | Sí | Sí | Drenaje+clindamicina i.v. Desbridamiento quirúrgico | OX | + | IV |
| 12 | V | 50 | Español | - | Forúnculo MMII | Drenaje+cloxacilina v.o. | No | No | Sí | Drenaje | OX-LE | + | ND |
| 13 | V | 72 | Español | - | Forunculosis MMSS y MMII | Drenaje+cloxacilina v.o. | No | No | No | Drenaje+clindamicina v.o. | OX | + | ND |
CL: clindamicina; CT: cotrimoxazol; ER: eritromicina; GE: gentamicina; LE: levofloxacino; OX: oxacilina; TO: tobramicina. *Recurrencias: Al menos 1 episodio similar al actual en los 6 meses previos.
Los tipos de infección más frecuentes entre los SARM-AC fueron los abscesos (30,7%) y los forúnculos (30,7%) seguidos de forunculosis (23%). No se encontraron diferencias estadísticamente significativas entre SARM-AC y SASM. Las características clínicas se muestran en la tabla 1:
No se encontraron diferencias estadísticamente significativas en cuanto a recurrencias, presencia de fiebre o leucocitosis, localización de las lesiones ni tiempo de evolución antes de acudir a Urgencias.
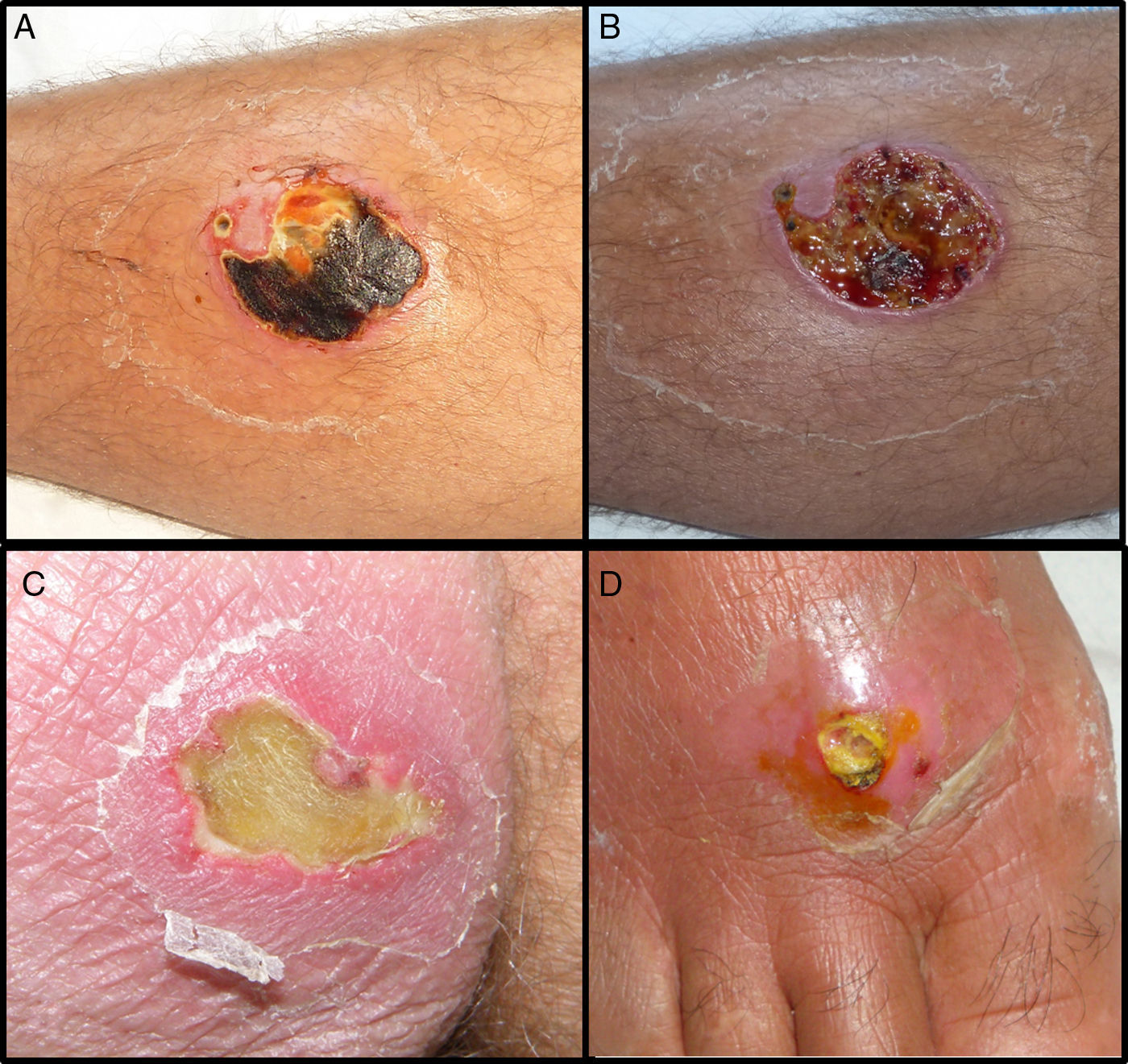
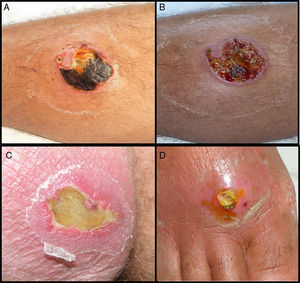
Tres (23%) de los pacientes con infección por SARM-AC requirieron ingreso hospitalario (tabla 2: pac. 3, 10-fig1A y 1B- y 11) Solo el paciente 11, tuvo una complicación a nivel sistémico, por reagudización de su insuficiencia renal crónica, que se resolvió de forma rápida con tratamiento médico. Los hemocultivos fueron negativos en los 3 pacientes. Todos ellos evolucionaron favorablemente con antibioterapia intravenosa y desbridamiento quirúrgico. De los pacientes con infecciones cutáneas por SASM, solo 1 (3,8%) que presentaba un absceso de gran tamaño en pared abdominal, necesitó tratamiento hospitalario.
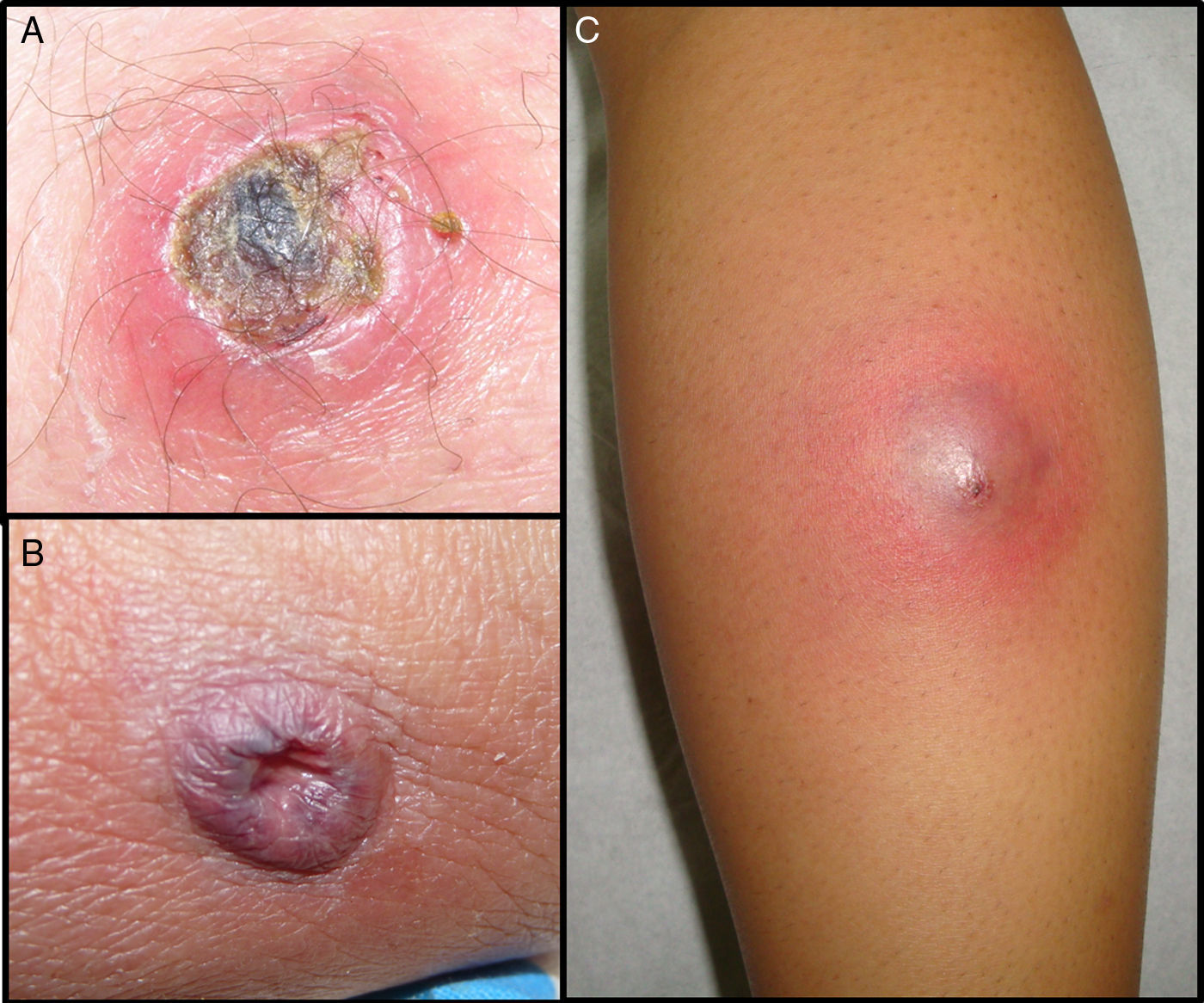
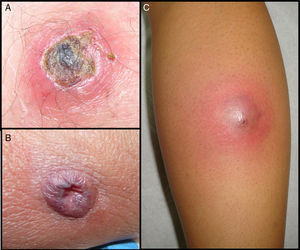
En los pacientes con SARM-AC se observó una llamativa necrosis tisular en casi el 62%. (figs. 1 y 2) Por el contrario las infecciones por SASM presentaron necrosis en tan solo en el 19,2% de los pacientes siendo esta diferencia clínica estadísticamente significativa.
La mayoría de las infecciones por SARM-AC (92%) requirieron drenaje quirúrgico en Urgencias. Dicho procedimiento solo fue necesario en la mitad de los casos producidos por SASM, siendo esta diferencia estadísticamente significativa. No se encontraron diferencias en cuanto a la administración previa de antibióticos entre SASM y SARM-AC. La antibioterapia empírica empleada en Urgencias fue similar en ambos grupos. En un 80% de los pacientes se administraron betalactámicos, siendo la respuesta al tratamiento a las 72 horas superior en los pacientes con SASM. Es destacable que de los 10 pacientes con SARM-AC que recibieron betalactámicos (es decir que fueron tratados únicamente con el drenaje como medida eficaz), solo 5 mejoraron, sin que estos 5 pacientes coincidan con los que presentaron infecciones más leves. (tabla 2).
De los 13 aislamientos de SARM-AC, en 11 se demostró producción de LPV. Además 5 de estas cepas presentaron otras resistencias antibióticas asociadas: Dos de ellas, productoras de LPV (tabla 2: pacientes 1 y 8), fueron multirresistentes (macrólidos, clindamicina, aminoglucósidos, quinolonas y cotrimoxazol). Además estas dos cepas eran las únicas que presentaban SCCmec tipo V. En ambas se descartó el contacto con el medio sanitario y tenían en común viajes recientes a Asia (India y Nepal). Otra cepa también productora de LPV fue resistente a macrólidos y otra a quinolonas. Una cepa no productora de LPV era resistente a quinolonas y macrólidos, con antecedente de viaje a Cuba. (tabla 2)
Desde el punto de vista epidemiológico no se detectó ningún caso en colectivos clásicamente asociados a brotes de SARM-AC, como presos, atletas o militares, y solo se observó agregación de casos entre convivientes en las 2 pacientes infectadas por la cepa multirresistente relacionada con viaje a India y Nepal. Se realizó estudio de colonización mediante frotis nasal, axilar e inguinal en 7 casos de SARM-AC, obteniéndose positividad nasal e inguinal en un único paciente (tabla 2: paciente 8).
DiscusiónLos datos existentes en nuestro país acerca de la incidencia y factores de riesgo de las infecciones por SARM-AC proceden únicamente de estudios retrospectivos basados en características microbiológicas6,11,12. Solo existe un estudio prospectivo realizado en 2007 en el que se estima una prevalencia del 13% de las infecciones estafilocócicas en edad pediátrica19. Nuestro estudio demuestra una prevalencia mayor (33%) de la obtenida en los trabajos publicados previamente en nuestro país2,11,19–21. Al igual que en estos estudios previos continuamos observando que la mayoría de las infecciones por SARM-AC se producen en pacientes que proceden o viajan a países con mayor endemicidad. En cambio observamos una mayor variabilidad en la procedencia geográfica, sin ningún país predominante, a diferencia de los estudios anteriores que apuntan a Ecuador como origen en la mayoría de los casos.
SARM-AC tiene una especial propensión para producir infecciones supurativas de piel y tejidos blandos (90%) la mayoría leves, pero muchos de autores coinciden en que la necrosis es mayor que en las producidas por SASM5,8. La presentación clínica en forma de absceso de rápida evolución con escara necrótica central justifica que estas infecciones sean habitualmente confundidas con picaduras de araña (spider bites22) (fig. 2). Nuestros datos demuestran por primera vez una diferencia estadísticamente significativa entre SASM y SARM-AC en cuanto a esta característica clínica (fig. 1). Este dato, junto con la procedencia del paciente, podría ayudar al clínico a determinar la antibioterapia empírica antes de disponer de resultados microbiológicos definitivos. La mayor virulencia a nivel local de las infecciones por SARM-AC se refleja asimismo en la necesidad de drenaje quirúrgico de las lesiones, decisión que en nuestro estudio se realizó antes de conocer el resultado de los cultivos. Con posterioridad, éstos confirmaron que las lesiones que requirieron drenaje fueron causadas por SARM-AC en una proporción significativamente mayor que las producidas por SASM (92% Vs 53%). El tratamiento quirúrgico es fundamental para la mayoría de estas infecciones y multitud de autores coinciden en que en los casos leves debe ser el único tratamiento, ya que no se han encontrado diferencias en la evolución entre pacientes tratados con antibióticos inactivos frente a SARM-AC y pacientes tratados solo con drenaje2,3,14. En cambio, nosotros observamos que mejoraron solo el 50% de los 10 pacientes con SARM-AC que recibieron betalactámicos además del drenaje. Los 5 que no mejoraron necesitaron añadir un antibiótico activo frente a SARM-AC y en muchos casos la repetición del drenaje, (Tabla 2). Nuestros datos apoyan, por tanto, los obtenidos en otros estudios23,24 en los que se observa que el único factor asociado de forma independiente con el fracaso terapéutico es haber recibido un antibiótico inactivo frente a este patógeno. Desde el punto de vista práctico, a la hora de evaluar la necesidad de drenaje y tratamiento sistémico de las piodermitis con sospecha de SARM-AC, consideramos fundamental la valoración dermatológica del paciente, ya que mientras en los abscesos es mandatorio el drenaje de la colección de pus, el forúnculo es una lesión de naturaleza diferente, y en localizaciones como la cara, siempre precisan antibioterapia sistémica estando contraindicada la manipulación quirúrgica.
En cuanto al tratamiento antibiótico definitivo de las infecciones cutáneas por SARM-AC, la clindamicina es una buena opción en casos sin datos de sepsis ya que, que presenta escasas resistencias en nuestro medio y además disminuye la producción de LPV25. También el cotrimoxazol puede ser una alternativa útil. En casos graves la vancomicina todavía es la primera opción, aunque en recientes estudios controlados y aleatorizados sugieren que en infecciones graves de piel y partes blandas, el linezolid, aunque su coste es mucho mayor, posee una mayor efectividad y mejor perfil de efectos adversos25,26 y también ha probado disminuir la producción de LPV25,27.
Actualmente se discute si la LPV es realmente un factor determinante para la mayor capacidad nectrotizante de SARM-AC28, pero está claro que actúa como un marcador genético, ya que está presente en cerca del 80% de los aislamientos de SARM-AC7,14,29, y en cambio se detecta en <5% de todos los SARM-ACS. No obstante, como se demuestra en este estudio, hay un pequeño porcentaje que no la producen (tabla 2)1,7.
Otra característica de este patógeno emergente es su tendencia a colonizar otras zonas distintas a las fosas nasales, como axilas, ingles y región perianal30. En nuestro estudio únicamente se realizó cultivo nasal, axilar e inguinal en 7 de los 13 pacientes infectados por SARM-AC, de los que solo 1 estaba colonizado (tabla 2: paciente 8). De los datos recogidos en estudios previos se asume que este agente posee una elevada transmisibilidad mediante contacto directo10,31. El estudio de agregación de casos se realizó mediante un cuestionario y no se hizo seguimiento epidemiológico, por lo que los datos obtenidos son menos fiables. De esta manera se detectaron 2 brotes de forunculosis en convivientes. (tabla 2: pacientes 1 y 8).
A pesar de que este estudio tiene limitaciones, algunas de estas son justificables por su realización en condiciones de práctica clínica habitual en un único centro, o por su pequeño tamaño muestral y no impiden obtener algunas conclusiones de importancia para el mejor conocimiento de la epidemiología de la infección por SARM-AC en España: Los resultados demuestran SARM-AC es el origen de una importante proporción de infecciones estafilocócicas de piel y partes blandas en pacientes adultos sanos que acuden a Urgencias de un Hospital de tercer nivel (33%). Dada la posibilidad de que los pacientes atendidos en unas urgencias hospitalarias presenten infecciones potencialmente más graves, para confirmar esta elevada prevalencia en la población general sería necesario estudiar también los pacientes de Atención Primaria.
Además de las limitaciones ya reseñadas, al haber incluido únicamente pacientes sanos sin ningún contacto con el medio sanitario, y haber utilizado criterios epidemiológicos, una parte de posibles casos se ha perdido. Para asegurar un buen control de la infección que evite la diseminación de SARM-AC en los hospitales españoles es necesaria actualmente la realización de estudios más amplios, interhospitalarios, evaluando tanto características epidemiológicas como moleculares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los doctores Rosa Feltes Ochoa, Leticia Sanz Canalejas, Lucero Noguera Morel y Paola Maldonado Cid por su colaboración en la recogida de datos.