El conocimiento de la epidemiología de las enfermedades fúngicas invasoras en el entorno sanitario permite establecer los niveles de actuación necesarios para su prevención. Un primer paso es identificar los grupos de pacientes de mayor riesgo de enfermedad fúngica invasora, establecer los factores de riesgo precisos, observar los periodos de mayor peligro y analizar el perfil epidemiológico propio en géneros y especies así como sus patrones de resistencias. Además, deben programarse los mecanismos para evitar la exposición persistente a los patógenos fúngicos potenciales, determinando las áreas protegidas y las medidas recomendables, tales como el control de la calidad del aire y del agua dentro y fuera del hospital, así como promocionando diseños arquitectónicos adecuados de las instituciones sanitarias. Por último, pese a la correcta implementación de estas medidas, debe considerarse el uso de profilaxis antifúngica en grupos de pacientes seleccionados de muy alto riesgo siguiendo los documentos y guías publicados.
Knowledge of the epidemiology of invasive fungal diseases in health care settings helps to establish the action levels necessary for its prevention. A first step is to identify groups of patients at high risk of invasive fungal diseases, establish accurate risk factors, observing the periods of greatest risk, and analyze the epidemiological profile in genera and species, as well as the patterns of antifungal resistance. Secondly, mechanisms to avoid persistent exposure to potential fungal pathogens must be established, protecting areas and recommending measures, such as the control of the quality of the air and water inside and outside the hospital, and determining and promoting appropriate architectural designs of health institutions. Finally, apart from the correct implementation of these measures, the use of antifungal prophylaxis should be considered in selected patients at very high risk, following the guidelines published.
En las últimas décadas se ha producido un incremento global de las infecciones fúngicas de origen nosocomial (IFON) y de las asociadas a cuidados sanitarios, a consecuencia de los avances en las terapias médicas y quirúrgicas cada vez más eficaces pero también más agresivas1. Las enfermedades fúngicas invasoras (EFI) se asocian a elevadas tasas de morbilidad y mortalidad debidas, en parte, a la dificultad para realizar su diagnóstico precoz, lo que ocasiona el retraso del tratamiento apropiado. Entre los pacientes hospitalizados con mayor riesgo para desarrollar una EFI destacan los huéspedes inmunodeprimidos por quimioterapia, tumores sólidos o cánceres hematológicos (con o sin neutropenia, o disfunción cualitativa de neutrófilos), los receptores de trasplante de progenitores hematopoyéticos (TPH) o de órganos sólidos (TOS), los que reciben dosis altas y prolongadas de corticoides u otros inmunosupresores causantes de disfunción de la inmunidad celular, los pacientes infectados por el VIH en situación avanzada sin tratamiento antirretroviral, los intervenidos de cirugía mayor gastrointestinal o con pancreatitis graves, aquellos con disrupción de la integridad de mucosas, los pacientes con enfermedades inflamatorias crónicas autoinmunes que reciben nuevas terapias biológicas, los prematuros, los pacientes de edad más avanzada y los enfermos en situación crítica2.
Sin lugar a dudas, la infección sistémica por Candida spp., con o sin candidemia asociada, es la EFI más frecuente en todas las latitudes. El uso cada vez mayor de dispositivos biomédicos invasivos, especialmente de catéteres intravasculares (CIV), ha incrementado el número de las fungemias relacionadas con catéteres, así como el de las candidiasis diseminadas3. En menor medida, las EFI por hongos filamentosos, o mohos, también han incrementado su prevalencia, sobre todo en huéspedes inmunodeprimidos. Concretamente, las especies del género Aspergillus son actualmente la principal causa de EFI por mohos en los enfermos receptores de TPH y TOS, seguidas a mayor distancia por otros mohos considerados emergentes, como Fusarium spp., Scedosporium spp. o los mucorales4. La exposición a mohos ambientales vehiculizados por vía aérea dentro (y fuera) del hábitat hospitalario, especialmente durante periodos de obras, ha causado brotes de EFI, principalmente de aspergilosis, en pacientes inmunodeprimidos y de riesgo.
El presente capítulo revisa la actual epidemiología de las IFON, sobre todo de la candidiasis invasora (CI) y de la aspergilosis invasora (AI), y describe las principales medidas de control y prevención de las mismas en función de las guías y recomendaciones recientemente publicadas.
Epidemiología de la enfermedad fúngica invasora nosocomialLa lista de microorganismos patógenos causales de EFI oportunista aumenta día a día, aunque Candida spp., Cryptococcus neoformans, Pneumocystis jirovecii y Aspergillus spp. son los patógenos más habituales. Otros hongos emergentes se aíslan cada vez con más frecuencia, bien sean levaduras (Trichosporon spp., Saccharomyces spp., Rhodotorula spp. o Saprochaete spp. −antes Blastoschizomyces spp.−), hongos hialinos (Fusarium spp., Acremonium spp., Scedosporium spp., Scopulariopsis spp., Paecilomyces spp. o Trichoderma spp.), hongos dematiáceos (Alternaria spp., Bipolaris spp., Curvularia spp., Cladophialophora spp., Exophiala spp. o Exserohilum spp.) o mucorales (Rhizopus spp., Mucor spp., Rhizomucor spp., Lichtheimia spp. —antes Absidia— o Cunninghamella spp.).
Las EFI habitualmente afectan a determinadas poblaciones de riesgo o a pacientes con diversos factores condicionantes. En la tabla 1 se resumen las características individuales actualmente reconocidas que favorecen el desarrollo de CI, así como la población más expuesta a la misma. De manera similar, también se han descrito los factores de riesgo individuales, así como las poblaciones con mayor riesgo de desarrollar una EFI por Aspergillus spp. (tabla 2).
Factores condicionantes y poblaciones de riesgo para desarrollar candidiasis invasora
| Factores de riesgo generales |
| Gravedad de la enfermedad agudaa |
| Edad: <1 año o >65 años |
| Comorbilidades: diabetes mellitus, cirrosis, malnutrición, etc. |
| Cirugía (gastrointestinal) previa |
| Estancia prolongada en la UCI |
| Dispositivos invasivos |
| Transfusiones múltiples |
| Nutrición parenteral |
| Catéter vesical |
| Ventilación mecánica |
| Condicionantes interindividuales o población de mayor riesgo |
| Uso prolongado de catéter venoso centrala |
| Antibióticos de amplio espectroa |
| Colonización previa por Candida spp.a |
| Insuficiencia renal y/o hemodiálisisa |
| Neutropeniaa |
| Quimioterapia, corticoides e inmunosupresores |
| Pancreatitis, perforación visceral, etc. |
| Politraumatismo |
| Gran quemado |
| Neonato con corta edad gestacional, Apgar bajo, uso de anti-H2, malformaciones congénitas, enfermedad gastrointestinal o shock |
Factores condicionantes y poblaciones de riesgo para desarrollar aspergilosis invasora
| Factores de riesgo |
| Neutropenia |
| Déficits de función fagocitaria |
| Alteraciones de la inmunidad celular |
| Uso de corticoides y otros inmunosupresores |
| Rotura de barreras mucocutáneas |
| Exposición ambiental |
| Población de riesgo |
| Neutropénico (<500 neutrófilos/mm3 durante >10 días): LMA/SMD o alo-TPH |
| Pacientes con EICH en tratamiento inmunosupresor |
| Receptor de órgano sólido: pulmón >corazón >intestino >hígado >riñón |
| Infección por VIH-sida sin tratamiento antirretroviral con CD4<100células/μl |
| Enfermedad granulomatosa crónica |
| Uso de terapias biológicas, principalmente anti-CD52 (alemtuzumab), anti-TNFα (infliximab>adalimumab>etanercept) |
| Paciente crítico no hematológico |
| EPOC en tratamiento corticoideo crónico |
| Cirrosis hepática, enfermedad hepática avanzada |
| Post cirugía mayor y/o compleja |
alo-TPH: trasplante alogénico de progenitores hematopoyéticos; EICH: enfermedad del injerto contra el huésped; EPOC: enfermedad pulmonar obstructiva crónica; LMA: leucemia mieloide aguda; SMD: síndrome mielodisplásico; VIH: virus de la inmunodeficiencia humana.
Aunque hay descritas más de cien especies distintas de Candida, el 95-97% de todas las EFI producidas por levaduras de este género están causadas por solo 5 especies: Candida albicans, C.glabrata, C.parapsilosis, C.tropicalis y C.krusei.
La principal fuente de infección por Candida spp. es endógena (previa colonización de la piel o de las mucosas), aunque también puede transmitirse a través de material infectado, personal sanitario o desde otros pacientes5. La supresión de la flora bacteriana habitual del tracto intestinal, por la acción de antibacterianos de amplio espectro, facilita la proliferación de levaduras en el tubo digestivo, y con ella aumenta el riesgo del paso al torrente sanguíneo a través del epitelio intestinal por fenómenos de translocación. La mayoría de los factores de riesgo que favorecen una CI (tabla 1) son muy habituales en los pacientes hospitalizados (diabetes mal controlada, corticoterapia prolongada, alteraciones inmunitarias de los mecanismos básicos de defensa) o alteran la integridad de la piel o de la mucosa digestiva (nutrición parenteral, CIV, fenómenos de isquemia y necrosis, perforación de víscera hueca o pancreatitis necrosante)6. Aparte de los factores de riesgo comunes para todas las especies de Candida, también se han descrito otros específicamente relacionados con ciertas especies: neutropenia y/o el TPH con C.tropicalis y C.krusei, uso previo de fluconazol con C.glabrata y/o C.krusei, nutrición parenteral, CIV y/o paciente neonato con C.parapsilosis.
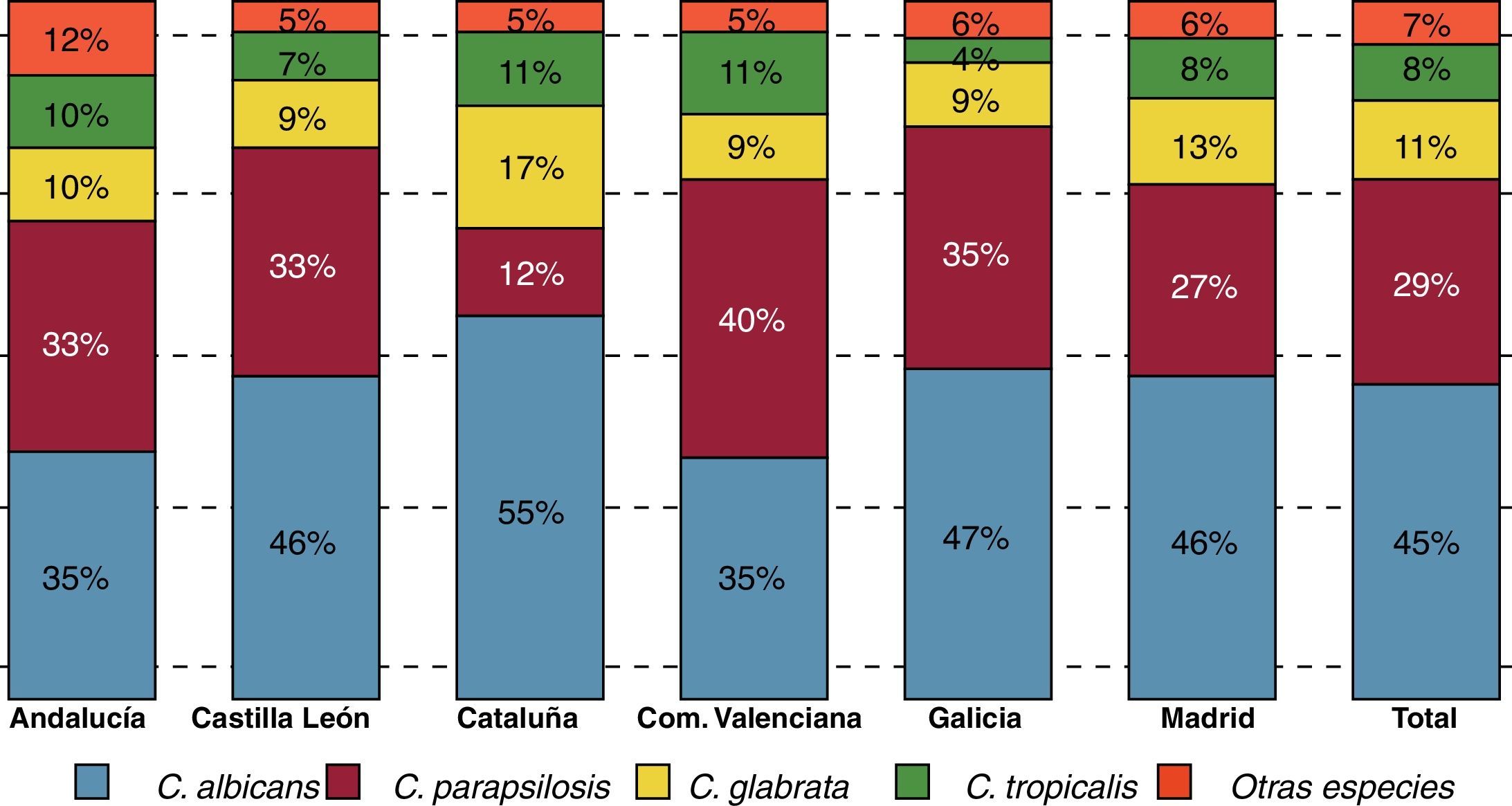
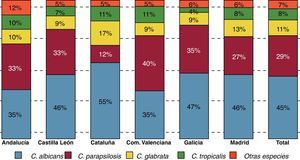
La variabilidad geográfica en la distribución de las especies causantes de candidemia es ampliamente reconocida, y puesto que su sensibilidad a los antifúngicos no es uniforme, es aconsejable conocer la epidemiología del entorno del paciente antes de instaurar un tratamiento empírico. En el estudio epidemiológico multicéntrico FUNGEMYCA realizado en España en 2009, en el que participaron 43 centros hospitalarios y se incluyeron 1.357 episodios de fungemia, la incidencia global fue de 0,925 episodios por cada 1.000 admisiones. En este estudio, C.albicans fue la especie más frecuentemente aislada (44,7%), seguida de C.parapsilosis (26,6%), C.glabrata (11,5%), C.tropicalis (8,2%), C.orthopsilosis (2,2%) y C.krusei (2,0%)7. Estos resultados difieren sensiblemente de los de otros estudios multicéntricos europeos o americanos, donde C.glabrata continúa siendo la segunda especie aislada, después de C.albicans y por delante de C.parapsilosis. También fue llamativa la incidencia de C.orthopsilosis (especie antes incluida dentro del complejo C.parapsilosis) y que en este estudio superó a C.krusei. En el estudio FUNGEMYCA la distribución de las especies aisladas no fue homogénea en todo el país, observándose importantes diferencias según la comunidad autónoma y/o el hospital estudiado (fig. 1). La Comunidad Valenciana y Andalucía fueron las comunidades donde la tasa de aislamientos de C.albicans fue la más baja (35%). Por su parte, C.parapsilosis se aisló de manera más notable en la Comunidad Valenciana (40%) y de forma muy inferior a la media nacional (29%) en Cataluña (12%), donde también se observó un mayor porcentaje de aislamientos de C.glabrata (17%). Cuando se analizó la distribución de las especies causales en función de la unidad de hospitalización se observó que aunque C.albicans, C.parapsilosis y C.glabrata fueron las 3 especies mayoritarias en casi todas las unidades de hospitalización, y en este mismo orden, C.parapsilosis fue la especie predominante en los servicios de neonatología y de pediatría general, aislándose con mayor frecuencia que C.albicans (46 vs. 43% y 59 vs. 19%, respectivamente)8.
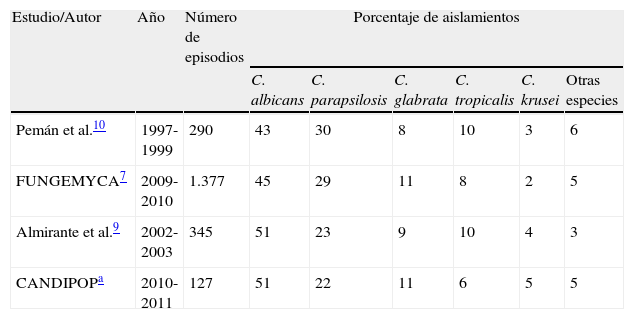
En el último estudio prospectivo poblacional sobre candidemia realizado en 29 hospitales de 5 ciudades españolas en los años 2010 y 2011 (estudio CANDIPOP) se registraron 752 episodios de candidemia en 729 pacientes, lo que supone una incidencia de 10,4 episodios/105 habitantes/año (datos aun no publicados). C.albicans fue la especie más frecuentemente aislada (45,4%), seguida de C.parapsilosis (24,9%), C.glabrata (13,4%), C.tropicalis (7,7%), C.krusei (2,0%) y otras especies (6,5%). En el estudio CANDIPOP también se observaron diferencias en la distribución de las especies causales de candidemia entre los distintos hospitales participantes así como en las diferentes unidades de hospitalización. Al comparar los resultados de la ciudad de Barcelona con los obtenidos hace 8años en un estudio similar en la misma ciudad9 se observa cómo la distribución de las principales especies no ha variado prácticamente a pesar de la incorporación de nuevos antifúngicos en este periodo. Esta misma coincidencia de resultados entre estudios también se observa al comparar la distribución de las especies en el estudio FUNGEMYCA con la de otro estudio de ámbito nacional realizado 10 años antes10 (tabla 3). Estos datos subrayan el escaso o nulo impacto epidemiológico de los nuevos fármacos antifúngicos sobre la distribución de las especies causantes de candidemia en nuestro país.
Comparación de la distribución de especies causales de candidemia en estudios similares en diferentes años
| Estudio/Autor | Año | Número de episodios | Porcentaje de aislamientos | |||||
| C. albicans | C. parapsilosis | C. glabrata | C. tropicalis | C. krusei | Otras especies | |||
| Pemán et al.10 | 1997-1999 | 290 | 43 | 30 | 8 | 10 | 3 | 6 |
| FUNGEMYCA7 | 2009-2010 | 1.377 | 45 | 29 | 11 | 8 | 2 | 5 |
| Almirante et al.9 | 2002-2003 | 345 | 51 | 23 | 9 | 10 | 4 | 3 |
| CANDIPOPa | 2010-2011 | 127 | 51 | 22 | 11 | 6 | 5 | 5 |
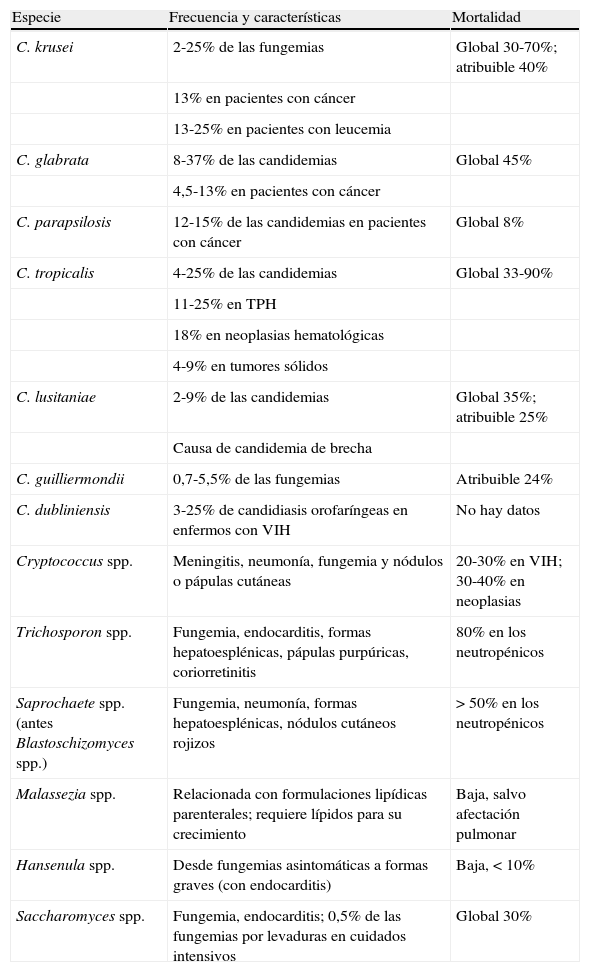
En la tabla 4 se resumen los factores de riesgo y tasas de letalidad asociados a las EFI causadas por levaduras distintas a C.albicans.
Características de las principales especies de Candida distintas de C.albicans y de otras levaduras emergentes causantes de EFI
| Especie | Frecuencia y características | Mortalidad |
| C. krusei | 2-25% de las fungemias | Global 30-70%; atribuible 40% |
| 13% en pacientes con cáncer | ||
| 13-25% en pacientes con leucemia | ||
| C. glabrata | 8-37% de las candidemias | Global 45% |
| 4,5-13% en pacientes con cáncer | ||
| C. parapsilosis | 12-15% de las candidemias en pacientes con cáncer | Global 8% |
| C. tropicalis | 4-25% de las candidemias | Global 33-90% |
| 11-25% en TPH | ||
| 18% en neoplasias hematológicas | ||
| 4-9% en tumores sólidos | ||
| C. lusitaniae | 2-9% de las candidemias | Global 35%; atribuible 25% |
| Causa de candidemia de brecha | ||
| C. guilliermondii | 0,7-5,5% de las fungemias | Atribuible 24% |
| C. dubliniensis | 3-25% de candidiasis orofaríngeas en enfermos con VIH | No hay datos |
| Cryptococcus spp. | Meningitis, neumonía, fungemia y nódulos o pápulas cutáneas | 20-30% en VIH; 30-40% en neoplasias |
| Trichosporon spp. | Fungemia, endocarditis, formas hepatoesplénicas, pápulas purpúricas, coriorretinitis | 80% en los neutropénicos |
| Saprochaete spp. (antes Blastoschizomyces spp.) | Fungemia, neumonía, formas hepatoesplénicas, nódulos cutáneos rojizos | >50% en los neutropénicos |
| Malassezia spp. | Relacionada con formulaciones lipídicas parenterales; requiere lípidos para su crecimiento | Baja, salvo afectación pulmonar |
| Hansenula spp. | Desde fungemias asintomáticas a formas graves (con endocarditis) | Baja, <10% |
| Saccharomyces spp. | Fungemia, endocarditis; 0,5% de las fungemias por levaduras en cuidados intensivos | Global 30% |
EFI: enfermedad fúngica invasora; TPH: trasplante de progenitores hematopoyéticos; VIH: virus de la inmunodeficiencia humana.
Las EFI causadas por levaduras distintas al género Candida se han incrementado en frecuencia y gravedad en las últimas 2décadas, especialmente en los grupos de pacientes más inmunodeprimidos. Las 2 principales especies del género Cryptococcus (C.neoformans y C.gattii) son la segunda causa de EFI por levaduras después de Candida spp., presentando una epidemiología y una morbimortalidad diferenciadas. C.gattii afecta indistintamente tanto a pacientes inmunocompetentes como inmunodeprimidos, con tasas de mortalidad muy bajas. Por su parte, el 90% de las infecciones por C.neoformans (en sus 2 variedades: grubii y neoformans) se observan en inmunodeprimidos (pacientes con sida, receptores de órganos o con corticoterapia, neoplásicos, etc.) y cursan con elevadas tasas de mortalidad2 (tabla 4).
Por su parte, las EFI causadas por otros géneros de levaduras como Trichosporon, Saprochaete, Geotrichum, Malassezia, Saccharomyces, Hansenula y Rhodotorula (habitualmente aislados como colonizadores de piel y mucosas) se observan en pacientes inmunodeprimidos, sobre todo oncohematológicos tratados profilácticamente con azoles o empíricamente con candinas (tabla 4). Aunque estas EFI emergentes son infrecuentes, su importancia reside en la virulencia de su comportamiento, en el grado de inmunosupresión del huésped en el que asientan y en las opciones limitadas del tratamiento antifúngico debido a su amplio perfil de resistencia2.
P.jirovecii es un hongo levaduriforme oportunista atípico de distribución universal que causa graves neumonías (PcP) en huéspedes inmunodeprimidos, sobre todo en los pacientes infectados por el VIH (en los que aún es criterio definitorio de sida). Sin embargo, en los países más desarrollados se ha observado un incremento de las EFI causadas por P.jirovecii en pacientes no-VIH, principalmente receptores de órganos, enfermedades autoinmunes, neoplasias hematológicas o de órgano sólido y, recientemente, en pacientes receptores de terapia corticoidea o con agentes biológicos (fármacos anti-TNF alfa, alemtuzumab, o rituximab). P.jirovecii se transmite de persona a persona, principalmente por vía aérea, actuando como reservorios los pacientes con PcP y también los sujetos colonizados (con o sin inmunosupresión). Las modernas técnicas de detección molecular de P.jirovecii en secreciones respiratorias han demostrado una prevalencia elevada de colonización (10-55%) tanto en población general y personal sanitario, como en pacientes con enfermedad pulmonar crónica, infectados por el VIH o hematológicos11.
Género AspergillusLas especies del género Aspergillus son actualmente la principal causa de EFI por mohos en los enfermos más inmunodeprimidos, particularmente en receptores de TPH y TOS, ocasionando elevadas tasas de mortalidad (40-90%) entre los afectados12. No obstante, las mejoras en los procedimientos diagnósticos, como la determinación del antígeno galactomanano o del beta-D-glucano, junto con el uso de nuevas técnicas de imagen (tomografía computarizada de alta resolución, angio-TC) y la disponibilidad de nuevos antifúngicos más eficaces y mejor tolerados, han mejorado el pronóstico y la supervivencia de estos pacientes13. En la tabla 2 se resumen los factores de riesgo individuales y las poblaciones con mayor riesgo de desarrollar una EFI por Aspergillus spp.
En la actualidad se conocen más de 300 especies de Aspergillus, de las cuales solo un pequeño número causan infecciones oportunistas. A.fumigatus es la especie que con mayor frecuencia causa aspergilosis, originando el 90% de las infecciones por este género. Otras especies, como A.flavus, A.nidulans y A.terreus se aíslan cada vez con más frecuencia, dependiendo de factores geográficos, del tipo de huésped o de la prescripción de antifúngicos. Las formas de presentación clínica pueden variar en función de la especie causal: A.flavus produce un importante número de infecciones otorrinolaringológicas, con claro tropismo por los senos paranasales, mientras que A.nidulans afecta habitualmente a pacientes con enfermedad granulomatosa crónica, aislándose con más frecuencia en población pediátrica. La infección por A.terreus, no muy frecuente, se asocia con elevadas tasas de mortalidad quizás debida a su resistencia a la anfotericina B. En un reciente estudio epidemiológico ambiental de 3 países europeos (Austria, Dinamarca y España) se observó que A.terreus era endémico en el Tirol, y fue casi exclusivamente aislado en hospitales de Austria; por su parte, A.niger fue la especie no-fumigatus más frecuentemente aislada en Madrid14.
La AI en pacientes con EPOC origina tasas de mortalidad cercanas al 100%15. La enfermedad diseminada, la coinfección con otros patógenos oportunistas (como P.jirovecii y/o citomegalovirus) o la presencia de neumonía bacteriana intercurrente se han identificado como factores de mal pronóstico en estos pacientes.
En los pacientes sometidos a TPH, especialmente alogénico, se ha observado una presencia bimodal de la AI, siendo cada vez más frecuentes las formas de inicio tardío16. Los factores de mayor riesgo en estas poblaciones son muy variados: neutropenia, antibioterapia prolongada de amplio espectro, tratamiento con corticoides, quimioterapia citotóxica, otros agentes inmunosupresores, la colonización por Aspergillus, la infección por citomegalovirus o por P.jirovecii, la fuente de progenitores hematopoyéticos, la enfermedad del injerto frente al huésped (EICH), el grado de concordancia en el HLA del TPH, así como el uso de terapias biológicas y/o análogos de nucleósidos17,18.
La EFI por Aspergillus spp. se ha asociado durante décadas a una alta tasa de mortalidad, aunque las tasas de supervivencia han mejorado en los últimos años, al menos en pacientes oncohematológicos y en receptores de TPH, tal vez influidas por los regímenes de acondicionamiento menos mieloablativos, los medios de diagnóstico más precoces o el empleo de regímenes de profilaxis y de tratamiento antifúngico más eficaces19. Aun así, las tasas de mortalidad de la AI son altas (35-95%)20.
En los últimos años se ha observado un incremento de resistencias de Aspergillus a los azoles en zonas del Reino Unido y de Holanda y se han comunicado casos de EFI pulmonares, cerebrales u óseas causadas por aislados de Aspergillus spp. resistentes a azoles21. En España, la tasa de resistencia a los azoles entre los aislados clínicos de A.fumigatus es del 2%, mientras que en Austria es del 0%22. Las razones para explicar este aumento en la resistencia no están todavía dilucidadas, pero podría deberse al uso excesivo de los azoles en medios agrícolas y/o ganaderos23.
Otros hongos filamentososLas EFI causadas por mohos distintos de Aspergillus spp. también han aumentado su frecuencia y gravedad en los últimos años, especialmente en pacientes más inmunodeprimidos. De forma específica y casi en un cierto orden de frecuencia, que puede variar en los distintos huéspedes, destacan los mucorales, como Mucor, Rhizopus o Lichtheimia, otros mohos hialinos como Fusarium, Scedosporium, Acremonium, Penicillium, Paecilomyces o Trichoderma, o incluso dematiáceos como Bipolaris, Exophiala, Alternaria o Cladosporium. Aunque estas EFI son menos frecuentes que las causadas por el género Aspergillus, suelen ser más virulentas y difíciles de tratar debido a su resistencia a la mayoría de los fármacos disponibles y también al tipo de paciente, hematológico o receptor de TOS, a los que generalmente afectan. Por ello, la combinación de varios antifúngicos es el tratamiento más apropiado de estas micosis emergentes.
Entre los mucorales, Rhizopus spp. es la causa más habitual de EFI, pero especies de Mucor, Lichtheimia, Cunninghamella y Saksenaea también pueden originar micosis diseminadas. Aunque en la mayoría de ocasiones la puerta de entrada de estos agentes es la vía inhalatoria, no son infrecuentes las infecciones sistémicas debidas a la ingestión o a la contaminación de heridas por esporangiosporas ambientales24. Además de los receptores de TPH y TOS, los mucorales también pueden causar EFI en pacientes diabéticos, en tratados con quelantes del hierro o en adictos a drogas por vía parenteral. La rapidez para invadir tejidos y diseminarse por los vasos sanguíneos (angioinvasión) es una de las características más relevantes de los mucorales y también la responsable de la alta tasa de mortalidad (>90%) que originan, junto con la resistencia intrínseca a muchos antifúngicos sistémicos.
Tanto Fusarium como Scedosporium son géneros de hongos hialinos ambientales que con relativa frecuencia causan EFI en pacientes inmunodeprimidos, principalmente con hemopatías, receptores de TPH o TOS. Entre las más de 50 especies de Fusarium, F.solani (50%), F.oxysporum (20%), F.verticilliodes (10%) y F.moniliforme (10%) son las más habitualmente aisladas en EFI25. Por su parte, Scedosporium apiospermum y S.prolificans son los representantes más frecuentes de su género. La puerta de entrada habitual de estos mohos suelen ser las vías respiratorias, pero también pueden causar EFI por inoculación a través de la piel o de las mucosas. Una importante característica de las EFI por Fusarium spp. o Scedosporium spp., a diferencia de las de Aspergillus, es su frecuente aislamiento en hemocultivos (hasta el 75% en los casos de fusariosis diseminada y el 40% en los de escedosporiasis diseminada)25,26. Como en otras EFI, la mortalidad asociada a estos patógenos también es elevada, dependiendo del agente causal y del tipo de paciente afectado, llegando a alcanzar hasta el 78% en los pacientes receptores de TOS o TPH infectados por S.prolificans26.
Prevención de la enfermedad fúngica invasora nosocomialEl impacto sanitario de las IFON es muy importante, al incrementar en 3 veces la mortalidad, la estancia hospitalaria y el consumo de recursos, frente a pacientes que no padecen EFI durante su ingreso hospitalario27. Las limitaciones aún existentes en los métodos de diagnóstico precoz y la emergencia de patógenos resistentes hacen que las medidas de prevención de las IFON sean de gran relevancia. Estas estrategias de control deben ser diferentes según vayan dirigidas a prevenir la EFI por hongos levaduriformes o por mohos, aunque en algunos aspectos puedan converger. Las estrategias dirigidas a reducir las IFON por Candida spp., especialmente la candidemia, enfatizan medidas como la higiene de manos28 y la adherencia a las guías de prevención de las infecciones relacionadas con los CIV29. Sin embargo, la prevención de las EFI causadas por Aspergillus spp. y otros mohos radica en la pureza y limpieza del aire, minimizando la exposición aérea a las esporas mediante la implementación de las recomendaciones basadas en el control ambiental30 y en otras medidas de prevención dirigidas a los pacientes receptores de un TPH con alto riesgo de EFI31.
Estrategias de prevención de la enfermedad fúngica invasora por Candida spp. y otras levadurasLas medidas de prevención de las infecciones invasivas localmente o diseminadas causadas por el género Candida, o incluso por otras levaduras, se fundamentan en su fisiopatología. Dependiendo del mecanismo de producción de la IFON, «exógeno» (p.ej., CIV) o «endógeno» (colonización del tracto digestivo), las medidas de prevención pueden variar según los objetivos de control pretendidos, si bien en muchas ocasiones tales medidas se suman o complementan.
Prevención de la candidemia relacionada con catéteres intravascularesSe han publicado diferentes guías con las medidas para la prevención de las IFON relacionadas con CIV29. Sus recomendaciones, basadas en la mejor evidencia posible, resaltan una serie de aspectos: a)educación y formación de los profesionales sanitarios que implantan y realizan el mantenimiento de los CIV; b)empleo correcto de las precauciones de barrera estériles durante la inserción del CIV; c)antisepsia de la piel con clorhexidina al 2%; d)uso preferente de la vía subclavia, retirar los catéteres vasculares no necesarios, evitar recambios rutinarios de los mismos, especialmente de los catéteres vasculares centrales (CVC), y e)empleo de CVC impregnados de antisépticos o antibióticos si existen altas tasas de infección de CIV pese al cumplimiento de las recomendaciones.
La efectividad de estas estrategias para la prevención de las fungemias de origen en CIV ha sido evaluada en un estudio multicéntrico en más de 100 unidades de cuidados intensivos (UCI) en Estados Unidos, observándose una reducción del 66% en las infecciones hematógenas diseminadas después de 18 meses de su puesta en marcha32. En nuestro entorno, la aplicación de «paquetes de medidas» (bundles) específicas con este objetivo en el proyecto nacional de «Bacteriemia Zero» ha conseguido reducciones muy significativas de las bacteriemias y fungemias relacionadas con CIV en adultos33. Sin embargo, estos programas educacionales no están consiguiendo una reducción significativa de su incidencia en UCI pediátricas34.
Prevención de la candidemia y candidiasis invasiva de origen endógenoEn el desarrollo de muchas candidemias «endógenas» confluyen 3 elementos esenciales: la presión selectiva ejercida por el empleo prolongado de antibacterianos de amplio espectro, la colonización por especies de Candida de distintos aparatos y sistemas, especialmente el tracto gastrointestinal, y, por último, la afectación del estado inmunitario del huésped, tanto innato como adquirido, de forma local (cirugía) o general (inmunosupresión).
Por ello, aparte de las medidas de prevención expuestas en relación con el CIV, aquí es determinante la instauración de una profilaxis antifúngica. Sin embargo, la dificultad no radica en elegir «con qué» antifúngico realizar la profilaxis primaria, sino «qué y cuáles» subgrupos de enfermos se verían especialmente beneficiados de esta práctica y «en qué momento o episodio de mayor riesgo». Determinar en qué tipo de pacientes es rentable y coste-efectiva la profilaxis antifúngica no es fácil, y ha sido motivo de controversia en las últimas 2 décadas35,36.
Es obvio que en los pacientes oncohematológicos de más alto riesgo de EFI, la profilaxis antifúngica debe cubrir también a los hongos filamentosos, especialmente Aspergillus spp. Se acepta que los grupos de alto riesgo para realizar profilaxis antifúngica son aquellos con una frecuencia de EFI superior al 10%, y esencialmente están constituidos por pacientes con leucemia mieloide aguda, receptores de alo-TPH, aquellos con episodio previo de EFI, quimioterapias de rescate en pacientes con leucemias agudas o síndromes mielodisplásicos y aquellos con anemias aplásicas graves37. Se consideran grupos de riesgo intermedio los pacientes con leucemias linfoblásticas agudas, los sometidos a auto-TPH y los enfermos con mielomas o linfomas en tratamiento de rescate; en estos, la profilaxis antifúngica es más discutida.
El uso de profilaxis antifúngica también es controvertido en los pacientes receptores de TOS, si bien es ampliamente recomendada en los enfermos con trasplante pulmonar o cardiopulmonar en el periodo postoperatorio y en aquellos momentos o ante presencia de factores que añaden un mayor riesgo de EFI (rechazo agudo, bronquiolitis obliterante, colonización reiterada, EFI previa, presencia de virus inmunomoduladores como CMV)38. Ante el importante riesgo de EFI por hongos filamentosos en los trasplantados pulmonares, la profilaxis antifúngica elegida debe también ser eficaz sobre estos patógenos. En otros tipos de TOS no está indicada la profilaxis universal frente a las IFON, especialmente en trasplante renal y cardiaco, pero se admite una profilaxis en pacientes de mayor riesgo, como pueden ser algunas subpoblaciones de enfermos sometidos a trasplante hepático39, las cuales deben ser bien identificadas (situaciones de retrasplante, indicación de trasplante por fallo hepático fulminante, insuficiencia renal asociada con técnica de reemplazo de función renal, fallo primario del injerto, altos requerimientos transfusionales y uso de determinados anticuerpos monoclonales en la pauta de inmunosupresión).
En pacientes graves que requieren cuidados críticos, médicos o posquirúrgicos, la profilaxis antifúngica también es controvertida y en determinados casos puede reemplazarse por estrategias de tratamiento anticipado o empírico, según la disponibilidad de diferentes biomarcadores o marcadores subrogados40. Aunque generalmente no se recomienda profilaxis antifúngica en pacientes críticos, aquellos con perforación gastrointestinal alta, fístulas digestivas anastomóticas, re-laparotomizados con dehiscencias de sutura o peritonitis terciaria, colonización importante por Candida spp. (densidad alta, multifocal) o con pancreatitis aguda grave podrían beneficiarse de la misma41. En las guías europeas recientemente publicadas sobre diagnóstico y manejo de la EFI causada por Candida spp. en pacientes críticos adultos no neutropénicos, se recomienda la profilaxis antifúngica con fluconazol (grado de recomendación B·I) o caspofungina (C·II) en población con cirugía abdominal reciente y perforación gastrointestinal recurrente o fístulas anastomóticas con el fin de prevenir la infección intraabdominal por Candida spp.42. Con una menor fortaleza en las evidencias, se recomienda la profilaxis con fluconazol en pacientes quirúrgicos con una estancia esperada en la UCI>3 días (C·I) y en pacientes con ventilación mecánica >48h en los que se suponen ventilaciones prolongadas >72h con el fin de prevenir la candidiasis invasiva. Marginalmente, la profilaxis con caspofungina (C·II) se recomienda en pacientes críticos con ventilación mecánica >3 días, CVC y que reciben antibióticos, además de uno de los siguientes factores extra: nutrición parenteral, diálisis, cirugía mayor, pancreatitis, corticoides o inmunosupresión.
Con todo ello, la elección de la familia de antifúngicos con los que llevar a cabo la estrategia de profilaxis primaria en cada grupo de enfermos depende de factores inherentes al huésped, de las características del fármaco, de la epidemiología local y del perfil de resistencias de cada centro.
Prevención de otras levaduras emergentesEstas levaduras más infrecuentes, pero no menos importantes, son causa tanto de episodios esporádicos como de brotes hospitalarios de EFI43. Se han descrito brotes nosocomiales, especialmente en pacientes oncohematológicos, de EFI por Saprochaete capitata (antes denominada Blastoschizomyces capitatus o Trichosporon capitatum) relacionados con leche o derivados lácteos contaminados en los termos o contenedores de distribución44. S.capitata es una levadura ubicua que coloniza la piel y las mucosas y puede causar fungemias o diseminación metastásica con elevada mortalidad (>50%). Aunque no se ha demostrado transmisión directa entre pacientes, ante un brote hospitalario debe determinarse el foco potencial de adquisición, por lo cual es necesario tomar cultivos de vigilancia de todos los pacientes y del entorno ambiental, del aire, de las superficies inanimadas, de las muestras de alimentos y líquidos, de los productos sanguíneos y de los fármacos quimioterápicos.
También se han descrito casos de fungemia causados por Saccharomyces con mortalidad cercana al 35% y relacionados con la administración del fármaco probiótico Ultralevura® (constituido por Saccharomyces boulardii) en pacientes ingresados en UCI con síndromes diarreicos45. Los pacientes recibieron el producto a través de una sonda nasogástrica durante una media de 8días antes del hemocultivo positivo. La transmisión de esta levadura en los pacientes que no recibían el probiótico podría estar relacionada con la posible contaminación del CIV por las manos del personal sanitario. La interrupción del uso del producto y de la manipulación de las cápsulas para introducirlo por la sonda nasogástrica llegó a detener el brote de infección en las unidades afectadas. Por todo ello, es evidente que el uso de agentes probióticos, como S.cerevisiae/S.boulardii, no es inocuo y debe evaluarse cuidadosamente en cada caso y en cada entorno, sobre todo en pacientes inmunodeprimidos o en estado crítico.
Prevención de la pneumocistosisRecientes investigaciones han demostrado que la infección clínica por P.jirovecii, la pneumocistosis, es el resultado de una infección recién adquirida por transmisión aérea de persona a persona y no la reactivación de una infección latente46,47. Además, técnicas moleculares han identificado ADN de P.jirovecii en contactos cercanos de pacientes con infección por VIH y PcP, incluyendo trabajadores sanitarios, y pruebas de tipificación molecular han identificado la transmisión de P.jirovecii de persona a persona como la causa probable de los brotes de PcP, especialmente entre receptores de trasplante renal48. Debe tenerse en cuenta que muchos de estos trasplantados de riñón no reciben profilaxis anti-Pneumocystis49, a diferencia de otros inmunodeprimidos y otros receptores de TOS o TPH. Aunque las guías actuales no recomiendan medidas específicas de aislamiento para los cuidados de pacientes hospitalizados en relación con la PcP, algunos clínicos consideran lógico que los receptores de TPH, por ejemplo, eviten la exposición a pacientes con PcP (C·III). Sin embargo, en muchos centros no se implantan medidas de aislamiento respiratorio en pacientes con PcP, los cuales podrían transmitir la enfermedad a otros pacientes inmunodeprimidos o infectar al personal sanitario, que serviría a su vez de reservorio de Pneumocystis50. Pero no se dispone de recomendaciones basadas en datos que permitan orientar sobre la duración del tiempo en que los pacientes con PcP deberían permanecer aislados51.
No hay duda de que los principales grupos de pacientes con riesgo de pneumocistosis se benefician de la instauración de una profilaxis sencilla, efectiva y habitualmente bien tolerada. La profilaxis anti-Pneumocystis se recomienda en receptores de TPH y de TOS durante los periodos de inmunosupresión de mayor riesgo, especialmente en los primeros 100días tras el trasplante, aunque en algunos alo-TPH se alarga hasta los 6meses. El régimen preferido es la administración de las pautas establecidas con cotrimoxazol (trimetoprim/sulfametoxazol), siendo agentes alternativos la pentamidina nebulizada en aerosol, o la dapsona y la atovacuona, ambas por vía oral31. Los programas de trasplante y los de cribado del riesgo infeccioso en otros huéspedes inmunodeprimidos (terapias biológicas) deberían tener sistemas que aseguren la prescripción de profilaxis frente a la PcP y la adherencia de los pacientes a ella (A·II)52.
Estrategias de prevención de la aspergilosis nosocomial y de otros hongos filamentososLa AI y otras EFI causadas por hongos filamentosos son adquiridas preferentemente por la inhalación de esporas fúngicas, cuya fructificación y posterior desarrollo en el interior del organismo da lugar a las formas invasoras de enfermedad en huéspedes inmunodeprimidos y de alto riesgo. Por ello, la primera estrategia de control de estas IFON debe minimizar la exposición a estas esporas fúngicas ambientales transmitidas por el aire en los centros hospitalarios durante los periodos y episodios de mayor riesgo (neutropenias prolongadas, trasplantes, cirugías mayores, etc.). Aunque muchos de los casos de AI son esporádicos, la información sobre la exposición ambiental y la asociación con EFI ha derivado de la investigación de brotes de aspergilosis en el contexto hospitalario. Una revisión reciente de la aspergilosis nosocomial identificó 53comunicaciones de brotes que afectaron a más de 400pacientes53. De ellos, 33brotes que implicaron a 299pacientes (el 65%) ocurrieron en receptores de TPH o pacientes con neoplasias hematológicas. Hubo 6brotes de infecciones de origen quirúrgico. Además, las muestras de aire con medición volumétrica realizada en 24 de los brotes observó recuentos de esporas que oscilaron de 0 a 100esporas/m3. Los brotes fueron atribuidos principalmente a IFON relacionadas con las obras de construcción o de renovación hospitalaria en cerca del 50% de los casos y por compromiso de la calidad del aire en el 17%. Solo en el 12% el origen del brote fue desconocido. Durante las obras se comprobó el aumento de la concentración de esporas en el aire, y este hecho es importante porque se han descrito brotes asociados a concentraciones muy pequeñas de esporas y, de hecho, parece que concentraciones de Aspergillus spp. <1UFC/m3 podrían ser suficientes para afectar a enfermos de alto riesgo (sobre todo con especies como A.fumigatus y A.flavus).
Los distintos vehículos ambientales implicados en la transmisión de Aspergillus spp. y otros mohos incluyen: funcionamiento inadecuado de los sistemas de ventilación, insuficiente mantenimiento de los filtros de aire, contaminación del material de aislamiento y de los «falsos techos», obras de construcción dentro y en los alrededores del hospital, fugas de agua y humedades en paredes y techos, alimentos contaminados y plantas ornamentales. El foco de origen nosocomial más frecuente de la infección por Aspergillus parece ser el aire contaminado, pero este moho también ha sido recuperado de las fuentes de agua hospitalarias y conducciones de fontanería54. Los recuentos más altos de esporas aéreas de Aspergillus fueron detectados en los baños de los pacientes, lo que sugiere una posible aerosolización de esporas a partir de los dispositivos de ducha. Sin embargo, las implicaciones clínicas de estos hallazgos pertenecientes a un solo grupo investigador muy concreto permanecen sin ser definidas.
También han ocurrido casos de aspergilosis cutánea en heridas de grandes quemados como resultado del uso de apósitos, gasas o vendajes contaminados con esporas de Aspergillus durante las obras de construcción hospitalaria55. Otros casos han aparecido en los puntos de inserción de CIV a causa de los apósitos contaminados utilizados para fijar al brazo las guías o tablillas que sostienen los catéteres en niños tratados por leucemia56.
Tras el alta hospitalaria también se puede producir la exposición a las esporas fúngicas de Aspergillus spp. y de otros mohos patógenos en pacientes de alto riesgo de EFI, sobre todo en los receptores de alo-TPH con EICH que reciben corticoides y en los TOS, especialmente de pulmón, con rechazo del injerto o formas de bronquiolitis obliterante. Por tanto, es muy necesaria la educación de pacientes y familiares para reducir la exposición externa a las esporas fúngicas junto con la quimioprofilaxis mediante antifúngicos con espectro de actividad sobre estos mohos.
Aunque la asociación entre obras de construcción y AI es ampliamente reconocida, existe una pobre correlación de las cepas de Aspergillus spp. recuperadas del ambiente hospitalario y las especies aisladas de pacientes con aspergilosis57. Una posible explicación de esta discordancia entre cepas del entorno sanitario y los aislamientos clínicos podría estar relacionada con la falta de un periodo de incubación claramente definido para la AI y la asociación entre la exposición dentro del ambiente hospitalario con la posterior infección58. Otros factores incluyen los métodos de muestreo del aire usados59, la amplia diversidad de especies de Aspergillus en el ambiente60, así como los distintos métodos utilizados en la tipificación de Aspergillus u otros mohos patógenos61.
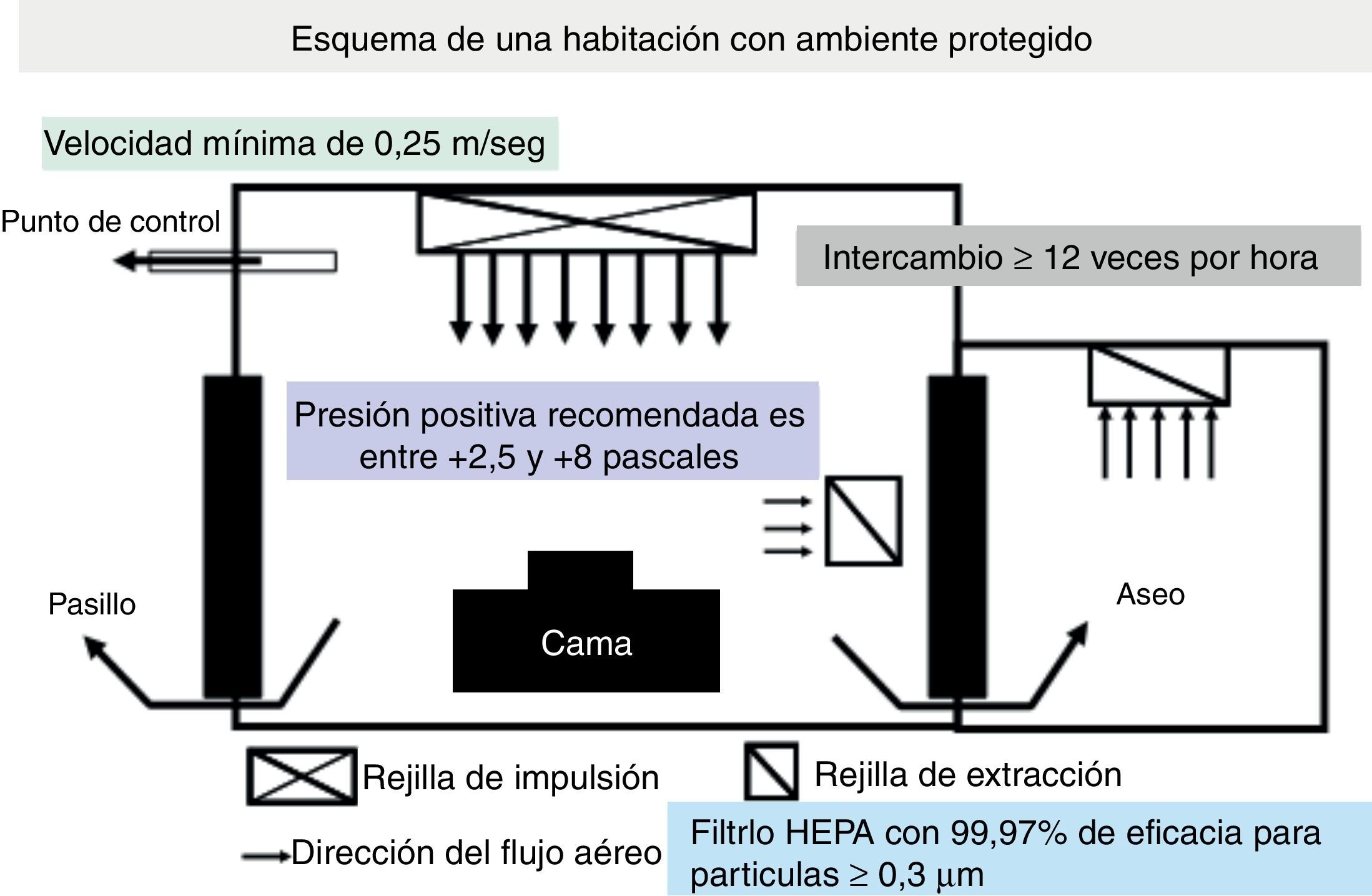
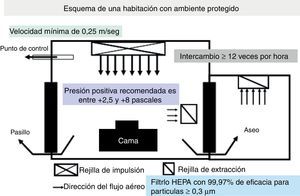
Puesto que las IFON oportunistas causadas por Aspergillus y otros mohos de origen aéreo ocurren preferentemente en pacientes gravemente inmunodeprimidos, como los receptores de TPH, uno de los principales componentes de estas estrategias de prevención es la provisión de un entorno ambiental protegido (EAP) para estos pacientes (fig. 2)62.
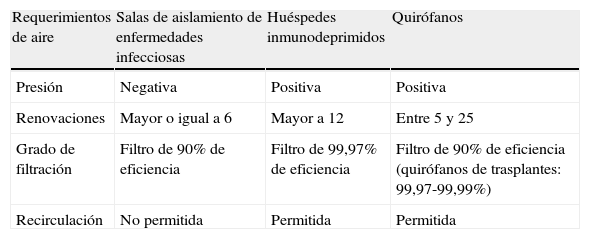
Un ambiente protegido es un entorno especial de cuidados del enfermo implantado en hospitales de asistencia a pacientes «agudos», preferencialmente dirigido al cuidado de receptores de alo-TPH30,31. El beneficio de un EAP para otros pacientes inmunodeprimidos, como auto-TPH o receptores de TOS, no ha sido bien definido63. Un EAP está diseñado para reducir al máximo la exposición ambiental de los pacientes con alto riesgo a las esporas de transmisión aérea de Aspergillus. Las características esenciales de un EAP se muestran en la tabla 5. Las medidas adicionales de control de la infección para los pacientes alojados en un EAP incluyen: a)monitorización y mantenimiento diario de una presión positiva del aire en las áreas de EAP; b)disminución al máximo de las exposiciones a actividades que puedan causar aerosolizaciones de esporas fúngicas (p.ej., pasar aspiradoras); c)reducir la duración del tiempo en que los pacientes se encuentran fuera del EAP para procedimientos diagnósticos, instrumentales o quirúrgicos, y d)suministro de protección respiratoria de alta eficiencia (p.ej., máscaras respiratorias modelo N95) cuando fuera del EAP se realizan obras. La efectividad de estas máscaras respiratorias de alto filtrado de partículas en ausencia de obras de construcción o el uso de máscaras quirúrgicas para prevenir la IFON no ha sido debidamente evaluada.
Requisitos de las habitaciones o salas con «ambiente protegido»
| Uso de filtros de alta eficiencia para partículas del aire (HEPA) |
| 99,97% de eficiencia en la eliminación de partículas de ≥0,3μm |
| Centrales o en el lugar de uso |
| Flujo de aire dirigido-laminado |
| Toma de aire en un lado y escape del mismo en el lado opuesto |
| Presión positiva del aire |
| Diferencial entre habitación y pasillo ≥2,5Pa |
| Recambio aéreo frecuenteé |
| Mantenimiento de ≥12 cambios de aire/h |
| Cierre y sellado eficaz de las habitaciones de los pacientes |
Cualesquiera otras estrategias de control de la infección y recomendaciones de mantenimiento de ingeniería y arquitectura cuyo objetivo sea minimizar la exposición ambiental a las esporas aéreas de Aspergillus y de otros mohos enfatizan la dotación y el abastecimiento de un «aire seguro» durante los cuidados sanitarios de rutina y de forma muy importante durante las obras hospitalarias (tabla 6). Las medidas arquitectónicas de prevención deben vigilar que se doten las salas y habitaciones con sistemas de apertura de seguridad, tanto entre la unidad y el exterior, como entre la habitación y el exterior, que se incluya un perfecto sellado de ventanas y que se utilicen materiales apropiados, lisos y regulares, resistentes a los antisépticos y sin falsos techos.
Medidas de control ambiental de la infecciones fúngicas de origen nosocomial en centros hospitalarios para reducir la exposición a las esporas fúngicas
| Recomendación | Categoría clasificadaa |
| Sistemas de manipulación del aire | |
| Uso de las directrices de los colegios de arquitectos locales o nacionales o de las regulaciones estatales o autonómicas para el diseño y construcción de los sistemas de ventilación | IC |
| Promover la evaluación de control del riesgo de infección y facilitar el número adecuado de habitaciones con EAP para la población con TPH | IA, IC |
| Monitorizar los sistemas de ventilación para la eliminación de partículas y del exceso de humedad:- Ubicación y mantenimiento adecuados de las tomas de aire y salidas de escape (p.ej., eliminación de nidos de aves cerca de los puntos de entrada de aire para evitar la entrada de esporas de hongos)- Apropiada instalación, mantenimiento y recambio de los filtros de ventilación del aire acondicionado caliente- Monitorizar las áreas de EAP para el número de recambios de aire por hora, grado de filtración y presiones diferenciales | IB, IC |
| Desarrollo de un plan de contingencia para capacitar la reserva y el aporte de potencia en caso de corte de energía | IC |
| Coordinar los sistemas de apagado de ventilación de aire acondicionado caliente con el personal de control de la infección para permitir el tratamiento seguro del aire | IC |
| Recomendaciones de los servicios de control ambiental para reducir al mínimo la exposición a las esporas de hongos | |
| Evitar alfombras y muebles tapizados en áreas de estancia de pacientes inmunodeprimidos | IB |
| Evitar métodos de limpieza que dispersen el polvo:- Polvo humedecido de superficies horizontales usando desinfectantes hospitalarios registrados en las agencias de protección ambiental- Equipar los aspiradores con filtros HEPA- Cerrar las puertas de las habitaciones de los pacientes inmunodeprimidos durante los procedimientos de limpieza- Secado inmediato de alfombras si se mojan o humedecen para evitar el crecimiento de hongos, o reemplazarlas a las 72h si permanecen húmedas | IB |
| Evitar flores frescas y plantas en macetas en las áreas de ingreso de pacientes inmunodeprimidos | II |
| Medidas de control de infecciones durante los proyectos de obras y construcción | |
| Formar un equipo multidisciplinar que incluya al personal de control de la infección nosocomial para coordinar medidas de prevención proactivas con el fin de disminuir la exposición a las esporas fúngicas y el cumplimiento de la monitorización | IB, IC |
| Proporcionar educación y formación a los trabajadores sanitarios y al equipo de obras (albañiles) en cuanto a la atención y cuidados en áreas de pacientes inmunodeprimidos en relación con las infecciones de origen aéreo | IB |
| Realizar una evaluación de control de riesgo de infección para analizar la potencial exposición de pacientes de alto riesgo a recuentos altos de esporas de hongos en el aire ambiente | IB, IC |
| Desarrollar y aplicar medidas para mantener las esporas aéreas de las zonas de construcción fuera de las unidades de atención o ingreso de los pacientes:- Medidas de control del polvo (p.ej., barreras contra el polvo, tratamiento seguro del aire, presión negativa en las zonas de trabajo de obras)- Plan de respuesta a los daños causados por el agua para evitar el crecimiento de hongos | IB, IC |
| Mantener la vigilancia de los casos de aspergilosis e infecciones por mohos asociadas a centros hospitalarios en pacientes inmunodeprimidos | IB |
| Llevar a cabo una investigación epidemiológica si se detecta un caso de aspergilosis nosocomial o de infección por otros mohos:- Vigilancia de casos adicionales- Determinar la manipulación apropiada del aire en EAP y en áreas de obras- Llevar a cabo una investigación ambiental que pueda identificar la fuente de origen- Tomar medidas correctoras para mejorar las deficiencias identificadas y eliminar las fuentes de esporas fúngicas | IB |
EAP: entorno ambiental protegido; EFI: enfermedad fúngica invasora; HEPA: alta eficiencia en la extracción de partículas; TPH: trasplante de progenitores hematopoyéticos.
Clasificación de categorías (clasificación de las recomendaciones de las medidas a tomar en la prevención de la EFI según los niveles de evidencia). IA: firme evidencia y sólida recomendación para todos los hospitales que se fundamenta en datos epidemiológicos y clínicos, o estudios experimentales, bien diseñados y que se deberían instaurar siempre; IB: firme evidencia y sólida recomendación para todos los hospitales consideradas efectivas por expertos debido a las teóricas pruebas clínico-epidemiológicas y estudios experimentales, y que deberían ser aplicadas en la mayoría de ocasiones; IC: son requeridas por la regulación o leyes estatales o autonómicas o están incluidas en unos estándares o directrices establecidos a escala nacional o europea; II: evidencia moderada que se fundamenta en sugestivos estudios clínicos o epidemiológicos con una fuerte razón teórica, o en estudios definitivos con conclusiones que deberían ser instauradas en algunos casos determinados, sugiriéndose su implementación en algunos hospitales pero no en todos; NR: sin resolver; prácticas sobre las que no se puede ofrecer una recomendación definitiva, dado que no existe consenso o no se dispone de evidencias suficientes en cuanto a su eficacia.
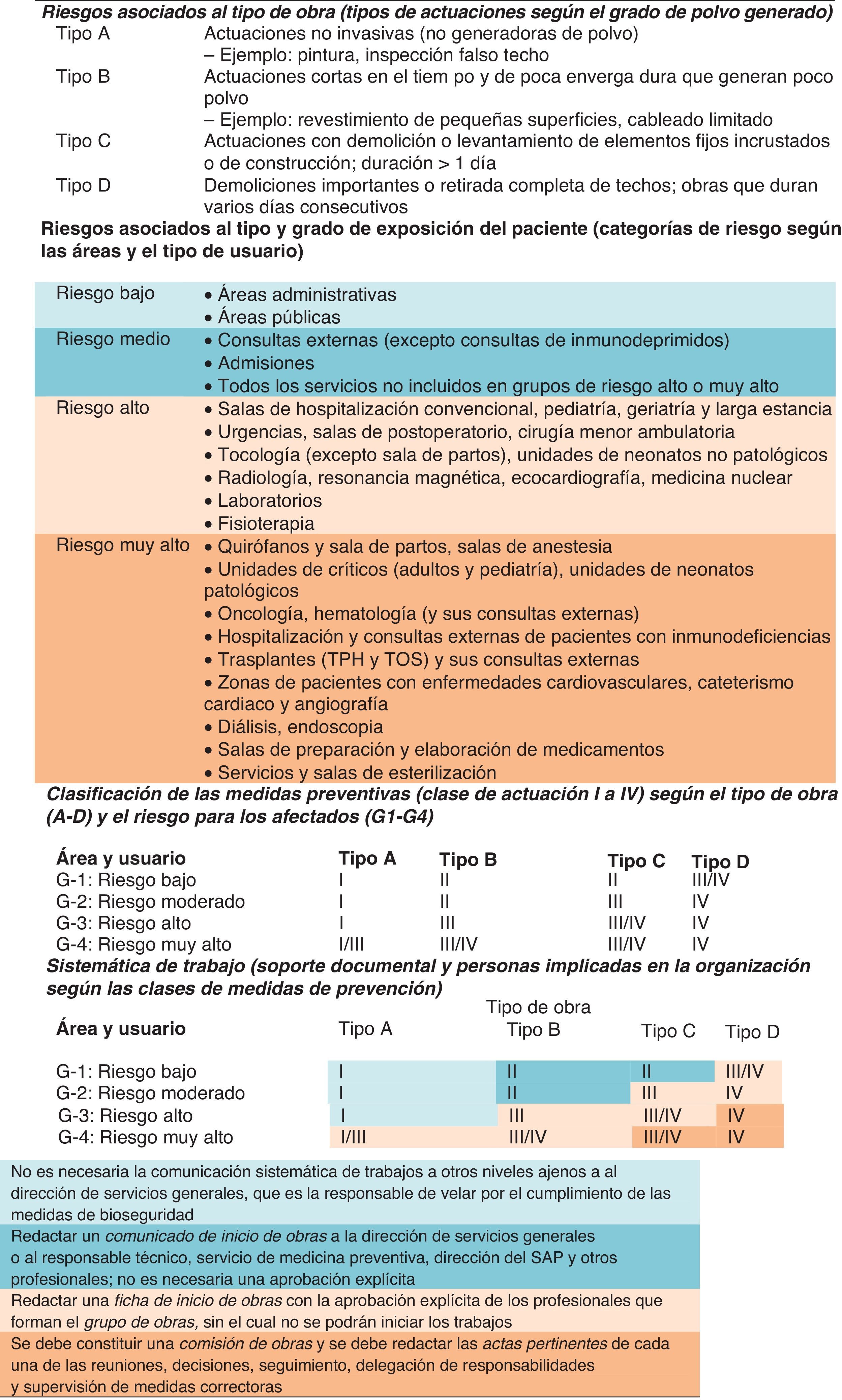
Los sistemas de control de la infección por evaluación del riesgo son procesos escalonados que determinan en un centro hospitalario el efecto potencial de las obras de remodelación o construcción sobre el ambiente y la exposición de los pacientes de riesgo a los agentes infecciosos, particularmente frente a esporas fúngicas64–67. Los miembros que conforman estos procesos gestores incluyen, entre otros, al equipo de control de la infección, a ingenieros y arquitectos, y a la dirección gerente del hospital. Los pasos a seguir antes de iniciar cualquier tipo de obras serían los siguientes (tabla 7): a)categorizar el tipo de actividad de las obras a realizar (tipos A-D) basándose en la gradación de polvo generado, siendo las actividades de tipo A las que no producen polvo (p.ej., trabajos de reparación eléctrica o fontanería menor) y las de tipo D las que generan mayor cantidad de polvo (como construcción mayor o demolición); b)identificar a los pacientes que se verán afectados por las obras y determinar el grado de riesgo de infección, clasificándose en bajo riesgo (p.ej., áreas de oficinas), riesgo medio (p.ej., fisioterapia), alto riesgo (p.ej., servicio de urgencias), muy alto riesgo (p.ej., áreas de pacientes inmunodeprimidos), y c)emparejar el grupo de riesgo de los pacientes con el tipo de actividad de obras y determinar la clase de precauciones de control de infección que serían necesarias, variando estas clases de precauciones desde la clase 1 (mínimas precauciones para control de infección) hasta las de clase 4 (precauciones mayores, incluyendo barreras y tratamiento seguro del aire)68,69.
Aspectos relacionados con los riesgos infecciosos derivados de obras en el entorno hospitalario, medidas de actuación para su prevención y organización de la sistemática de trabajo
SAP: servicio de atención al paciente; TPH: trasplante de progenitores hematopoyéticos; TOS: trasplante de órgano sólido.
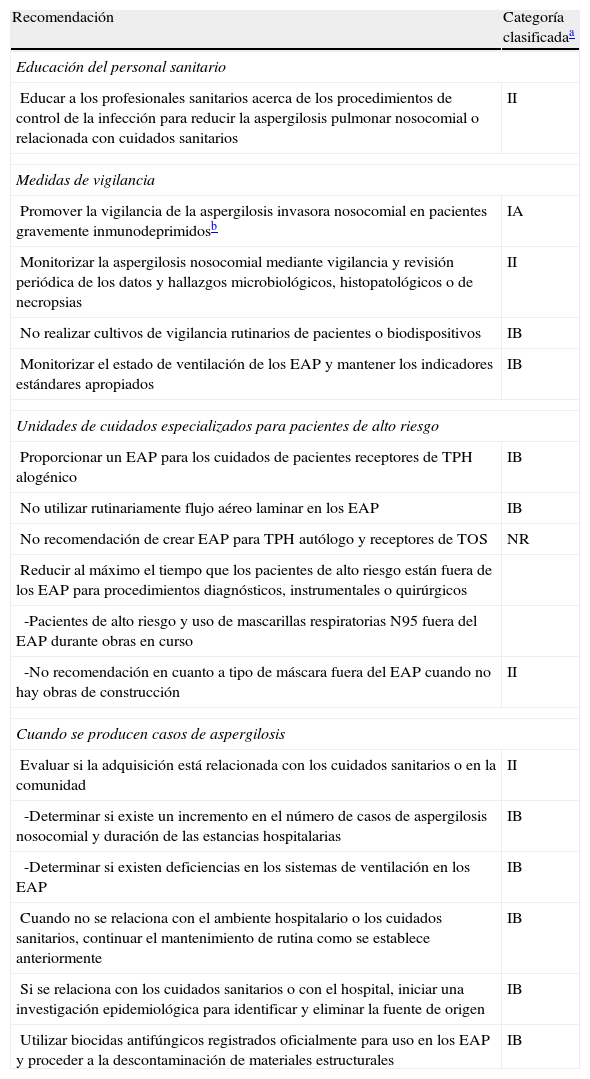
La implementación de estas estrategias durante las obras hospitalarias ha logrado éxitos en la prevención de la contaminación fúngica del aire en áreas de atención sanitaria a pacientes, según han mostrado estudios prospectivos de vigilancia ambiental utilizando cultivos micológicos y métodos de PCR para la detección de hongos aéreos70,71. Por su parte, los nuevos sistemas móviles de tratamiento del aire basados en la no filtración que usan la exposición a campos eléctricos y la nanofiltración electrostática para destruir los microorganismos aéreos también han mostrado eficacia en prevenir la contaminación fúngica ambiental durante las obras de construcción hospitalaria72. En la tabla 8 se incluyen una serie de recomendaciones adicionales para la prevención y el control de la aspergilosis nosocomial. Independientemente de la normativa aceptada en cada centro hospitalario y respetando los criterios establecidos por cada grupo o agencia reguladora, se recomienda realizar muestreos de calidad del aire (con el método que se seleccione) en zonas protegidas del hospital cuando existan obras o demoliciones propias o cercanas, para la detección de problemas concretos (acumulación de casos en un área) y para la caracterización de brotes.
Recomendaciones adicionales en la prevención y control de la aspergilosis pulmonar asociada con cuidados sanitarios
| Recomendación | Categoría clasificadaa |
| Educación del personal sanitario | |
| Educar a los profesionales sanitarios acerca de los procedimientos de control de la infección para reducir la aspergilosis pulmonar nosocomial o relacionada con cuidados sanitarios | II |
| Medidas de vigilancia | |
| Promover la vigilancia de la aspergilosis invasora nosocomial en pacientes gravemente inmunodeprimidosb | IA |
| Monitorizar la aspergilosis nosocomial mediante vigilancia y revisión periódica de los datos y hallazgos microbiológicos, histopatológicos o de necropsias | II |
| No realizar cultivos de vigilancia rutinarios de pacientes o biodispositivos | IB |
| Monitorizar el estado de ventilación de los EAP y mantener los indicadores estándares apropiados | IB |
| Unidades de cuidados especializados para pacientes de alto riesgo | |
| Proporcionar un EAP para los cuidados de pacientes receptores de TPH alogénico | IB |
| No utilizar rutinariamente flujo aéreo laminar en los EAP | IB |
| No recomendación de crear EAP para TPH autólogo y receptores de TOS | NR |
| Reducir al máximo el tiempo que los pacientes de alto riesgo están fuera de los EAP para procedimientos diagnósticos, instrumentales o quirúrgicos | |
| -Pacientes de alto riesgo y uso de mascarillas respiratorias N95 fuera del EAP durante obras en curso | |
| -No recomendación en cuanto a tipo de máscara fuera del EAP cuando no hay obras de construcción | II |
| Cuando se producen casos de aspergilosis | |
| Evaluar si la adquisición está relacionada con los cuidados sanitarios o en la comunidad | II |
| -Determinar si existe un incremento en el número de casos de aspergilosis nosocomial y duración de las estancias hospitalarias | IB |
| -Determinar si existen deficiencias en los sistemas de ventilación en los EAP | IB |
| Cuando no se relaciona con el ambiente hospitalario o los cuidados sanitarios, continuar el mantenimiento de rutina como se establece anteriormente | IB |
| Si se relaciona con los cuidados sanitarios o con el hospital, iniciar una investigación epidemiológica para identificar y eliminar la fuente de origen | IB |
| Utilizar biocidas antifúngicos registrados oficialmente para uso en los EAP y proceder a la descontaminación de materiales estructurales | IB |
EAP: entorno ambiental protegido; EFI, enfermedad fúngica invasora; TOS: trasplante de órganos sólidos; TPH: trasplante de progenitores hematopoyéticos.
Clasificación de categorías (clasificación de las recomendaciones de las medidas a tomar en la prevención de la EFI según los niveles de evidencia). IA: firme evidencia y sólida recomendación para todos los hospitales que se fundamenta en datos epidemiológicos y clínicos, o estudios experimentales, bien diseñados y que se deberían instaurar siempre; IB: firme evidencia y sólida recomendación para todos los hospitales consideradas efectivas por expertos debido a las teóricas pruebas clínico-epidemiológicas y estudios experimentales, y que deberían ser aplicadas en la mayoría de ocasiones; IC: son requeridas por la regulación o leyes estatales o autonómicas o están incluidas en unos estándares o directrices establecidos a escala nacional o europea; II: evidencia moderada que se fundamenta en sugestivos estudios clínicos o epidemiológicos con una fuerte razón teórica, o en estudios definitivos con conclusiones que deberían ser instauradas en algunos casos determinados, sugiriéndose su implementación en algunos hospitales pero no en todos; NR: sin resolver; prácticas sobre las que no se puede ofrecer una recomendación definitiva, dado que no existe consenso o no se dispone de evidencias suficientes en cuanto a su eficacia.
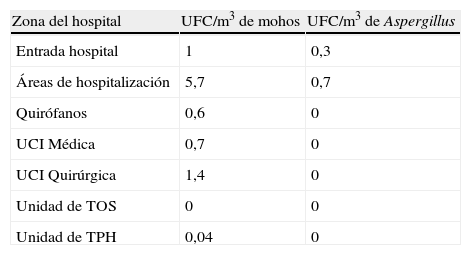
No se pueden olvidar toda una serie de medidas generales que deben ser explicadas y llevadas a cabo, como la recomendación de evitar la ingesta de determinados alimentos para reducir la exposición a hongos, principalmente durante los episodios o periodos de alto riesgo (neutropenia profunda y/o prolongada, terapias de acondicionamiento al TPH)73. Estos alimentos incluyen productos lácteos no pasteurizados, quesos fabricados a partir de cultivos de mohos, carne y pescado o huevos no cocinados, tofu, vegetales y frutas no lavados31. Otros alimentos, como pimienta, especias, frutos secos y semillas, muestran todos ellos importante contaminación con esporas de hongos, aunque no se ha establecido una relación probada con infección fúngica. Puesto que la AI exhibe una curva de distribución bimodal de casos y se han ido incrementando los episodios de enfermedad tardía (>45días post-TPH), al igual que para otras infecciones por mohos (mucormicosis, fusariosis), debido a la inmunosupresión de la EICH crónica, es esencial educar al paciente y a los familiares en actitudes de evitación de exposición a Aspergillus spp. y mohos patógenos fuera del ambiente hospitalario. Sin embargo, ya que el riesgo de exposición tanto dentro del hospital como en la comunidad no puede ser eliminado por completo, en los pacientes de mayor riesgo pueden ser necesarias estrategias de profilaxis antifúngica frente a hongos filamentosos, tal como se describe ampliamente en guías recientes74,75. Como en ellas se indica, la eficacia en la reducción de este tipo de EFI no puede ser atribuida únicamente a las medidas de control ambiental de determinados hongos ni a la profilaxis antifúngica, sino a todo un conjunto de medidas, todas ellas importantes, como son el tipo de requerimientos de ventilación en las distintas áreas del hospital (tabla 9), el tipo y procedimiento del trasplante en caso de TPH o TOS, la técnica quirúrgica y sus complicaciones, el adecuado manejo de la inmunosupresión, el correcto control y vigilancia de la infección hospitalaria y la adecuada cumplimentación y seguimiento de las medidas por parte de los pacientes. Muchas de estas medidas se encuentran incluidas en las últimas recomendaciones del grupo de estudio de micología médica (GEMICOMED) de la SEIMC para la prevención de las EFI por hongos filamentosos publicadas recientemente76. Este importante y completo compendio de recomendaciones constituye una herramienta esencial para ampliar conocimientos generales o buscar respuestas a problemas o interrogantes concretos en esta materia. Tras definir los niveles de clasificación utilizados para las recomendaciones expuestas en una primera tabla, el documento va incluyendo en otras las respuestas a las preguntas planteadas con los niveles de evidencia de las recomendaciones específicas de los expertos, los recuentos aconsejados de UFC/m3 en diferentes zonas del hospital con tratamiento completo del aire mediante filtros HEPA (tabla 10), la clasificación de los quirófanos y unidades de cuidados críticos (según normativa UNE100713) (tabla 11), las características de las instalaciones y procedimientos técnicos para muestreo del aire y establecimiento de recuentos monitorizados, los tipos y características de las obras y las medidas a emprender según su modalidad y grupo de riesgo de infección, y por último, una síntesis de las recomendaciones sobre profilaxis antifúngica primaria en enfermos hematológicos (tabla 12) y en algunos tipos de TOS (pulmonar, hepático de alto riesgo, etc.) u otros inmunosuprimidos (enfermedad granulomatosa crónica). En comparación, estas guías nacionales complementan, e incluso superan en determinados aspectos y apartados, a varias de las ya conocidas procedentes de agencias reguladoras o grupos de expertos norteamericanos, canadienses y europeos, tanto en las recomendaciones de medidas de control ambiental de las IFON (para evitar exposición a las esporas aéreas de Aspergillus y otros mohos) como para prevenir la AI nosocomial mediante el uso de antifúngicos en regímenes de profilaxis30,31,63,77.
Requerimientos de ventilación para las distintas áreas del hospital
| Requerimientos de aire | Salas de aislamiento de enfermedades infecciosas | Huéspedes inmunodeprimidos | Quirófanos |
| Presión | Negativa | Positiva | Positiva |
| Renovaciones | Mayor o igual a 6 | Mayor a 12 | Entre 5 y 25 |
| Grado de filtración | Filtro de 90% de eficiencia | Filtro de 99,97% de eficiencia | Filtro de 90% de eficiencia (quirófanos de trasplantes: 99,97-99,99%) |
| Recirculación | No permitida | Permitida | Permitida |
Recomendaciones de recuento de UFC/m3 en distintas zonas hospitalarias con tratamiento completo del aire (filtros HEPA)
| Zona del hospital | UFC/m3 de mohos | UFC/m3 de Aspergillus |
| Entrada hospital | 1 | 0,3 |
| Áreas de hospitalización | 5,7 | 0,7 |
| Quirófanos | 0,6 | 0 |
| UCI Médica | 0,7 | 0 |
| UCI Quirúrgica | 1,4 | 0 |
| Unidad de TOS | 0 | 0 |
| Unidad de TPH | 0,04 | 0 |
HEPA: filtros de alta eficiencia para partículas aerosolizadas; TOS: trasplante de órgano sólido; TPH: trasplante de progenitores hematopoyéticos; UCI: unidad de cuidados intensivos; UFC: unidades formadoras de colonias.
Nota: los criterios de valoración de resultados de recuento ambiental establecidos por las normas UNE171330-4 del año 2011 (Cualificación y validación de las salas de ambiente controlado en hospitales) aceptan solo como parámetro admisible un valor de 0UFC/m3, es decir, ausencia de hongos filamentosos (Aspergillus, Rhizopus, Mucor, Scedosporium). En áreas de muy alto riesgo y de alto riesgo consideran un nivel «blanco» para mohos el menor de 1UFC/m3, siendo este el nivel definido como objetivo; consideran un nivel de alerta la presencia de 1UFC/m3 de mohos, y este es un nivel señal para seguimiento; por encima de este recuento (>1UFC/m3) se establece el nivel de acción, con toda una serie de intervenciones inmediatas.
Modificado de Ruiz-Camps et al.76.
Clasificación del tipo de quirófanos y sus requerimientos
| Quirófanos clase A |
| Cirugía ortopédica con colocación de prótesis |
| Cirugía cardiaca |
| Cirugía de trasplantes |
| Quirófanos clase B |
| Cirugía convencional |
| Quirófanos clase C |
| Cirugía mayor ambulatoria |
| Sala de partos |
| Fuente | Clase A | Clase B | Clase C |
| Temperatura | 21°C (+3° y –1°C) | 21°C (+3° y –1°C) | 21°C (+3° y –1°C) |
| Humedad relativa | 50% (±10%) | 50% (±10%) | 50% (±10%) |
| Presión diferencial | >+10Pa | >+10Pa | >+5Pa |
| Renovaciones | |||
| Flujo unidireccional | >35 renovaciones/ha | >20 renovaciones/hc | >5 renovaciones/h |
| Flujo turbulento | >20 renovaciones/hb | ||
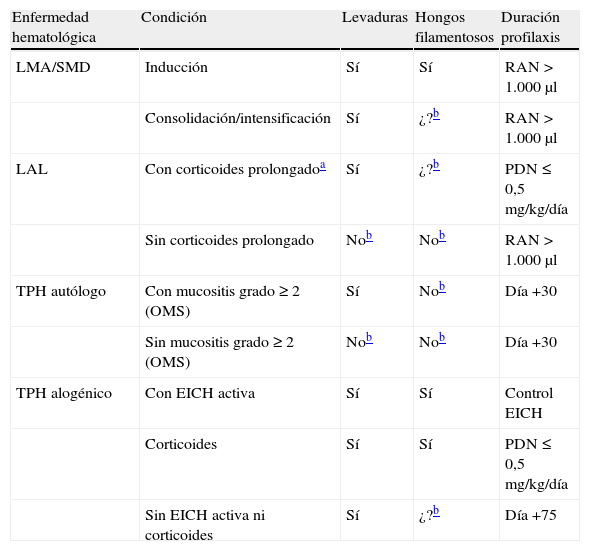
Recomendaciones sobre la profilaxis antifúngica primaria en enfermos hematológicos según GEMICOMED-2009/10 y con elección de fármacos antifúngicos específicos según otros organismos o guías
| Enfermedad hematológica | Condición | Levaduras | Hongos filamentosos | Duración profilaxis |
| LMA/SMD | Inducción | Sí | Sí | RAN >1.000μl |
| Consolidación/intensificación | Sí | ¿?b | RAN >1.000μl | |
| LAL | Con corticoides prolongadoa | Sí | ¿?b | PDN ≤0,5mg/kg/día |
| Sin corticoides prolongado | Nob | Nob | RAN >1.000μl | |
| TPH autólogo | Con mucositis grado ≥2 (OMS) | Sí | Nob | Día +30 |
| Sin mucositis grado ≥2 (OMS) | Nob | Nob | Día +30 | |
| TPH alogénico | Con EICH activa | Sí | Sí | Control EICH |
| Corticoides | Sí | Sí | PDN ≤0,5mg/kg/día | |
| Sin EICH activa ni corticoides | Sí | ¿?b | Día +75 |
| Organización | Recomendaciones basadas en pruebas sólidas |
| ECIL (Maertens, 2010) | • Alo-TPH, fase de neutropenia: fluconazol (400mg vo/vi, QD), voriconazol (200mg vo BID, provisional) |
| • Alo-TPH, fase EICH: posaconazol (200mg vo TID), voriconazol (200mg vo BID, provisional) | |
| • Leucemia aguda, QT inducción: posaconazol (200mg vo TID) | |
| NCCN (2010) | • LMA/SMD en neutropenia: posaconazol |
| • Auto-TPH con mucositis: fluconazol, micafungina | |
| • Alo-TPH con neutropenia: fluconazol, micafungina | |
| • EICH significativa: posaconazol | |
| IDSA (Walsh, 2008) | • Receptores TPH con EICH y LMA/SMD de alto riesgo en neutropenia: posaconazxol |
| ASBMT (Tomblyn, 2009) | • Neutropenia prolongada: micafungina (50mg iv QD) |
| • EICH: posaconazol (200mg vo TID) | |
| SEIMC (Fortún, 2011) | • LMA/SMD en inducción o rescate: posaconazol (A-I), itraconazol (B-I), anfotericina B liposomal (B-I), anfotericina B liposomal nebulizada (B-II) |
| • Alo-TPH con EICH grave: posaconazol (A-I), voriconazol (A-I), micafungina (B-I), itraconazol (A-II) |
ASBMT: American Society for Blood and Marrow Transplantation; ECIL: European Conference on Infections in Leukaemia; EFI, enfermedad fúngica invasora; EICH: enfermedad injerto contra huésped; IDSA: Infectious Diseases Society of America; LAL: leucemia aguda linfoblástica; LMA: leucemia mieloblástica aguda; NCCN: National Comprehensive Cancer Network; OMS: Organización Mundial de la Salud; PDN: prednisona; QT: quimioterapia; RAN: recuento o cifra de neutrófilos en sangre; SEIMC: Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica; SMD: síndromes mileodisplásicos; TPH: trasplante de progenitores hematopoyéticos; ¿?: datos insuficientes.
Una serie de artículos recientes en la literatura alcanzan mayor profundidad y profusión de detalles y pueden poner en mejor perspectiva la visión actual y la complejidad de aspectos tanto conocidos como no resueltos en la prevención de las IFON12,78.
Resumen y conclusionesLas IFON, especialmente las candidemias y las AI, pueden ser reducidas y mitigadas mediante la implantación de estrategias de prevención y medidas de control de la infección. Con la implementación de gran parte de las recomendaciones más avaladas por las evidencias disponibles y por la experiencia contrastada podrían prevenirse muchas de las candidemias relacionadas con los CIV y minimizar en los pacientes de mayor riesgo la exposición a las esporas aéreas de Aspergillus en el ambiente hospitalario. Junto a todo ello, en poblaciones seleccionadas de pacientes graves con cuidados críticos y en enfermos inmunodeprimidos de alto riesgo de EFI debería considerarse la administración de un esquema de profilaxis antifúngica adaptado y escogido de forma óptima a cada momento y contexto.
Las categorías habituales utilizadas para gradación de la evidencia en cuanto a calidad de los estudios y datos disponibles (I, II y III) como respecto a la fuerza y valor de la recomendación (A, B, C, D y E) son similares a las empleadas en las guías y documentos de consenso de la IDSA o de la SEIMC, respectivamente, los cuales están incluidos entre las referencias bibliográficas de este artículo para poder ser consultados.
| Calidad de la evidencia | |
| Grado | Definición |
| I | Evidencia de ≥1 ensayo clínico aleatorizado y controlado |
| II | Evidencia de ≥1 ensayo clínico noaleatorizado, o estudio de cohortes o casos-control, preferiblemente demás de un centro |
| III | Recomendación de expertos basada en la experiencia clínica o la descripción de casos |
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion