La malaria es una de las enfermedades tropicales importadas que con más frecuencia se diagnostican en nuestro país. La mortalidad en viajeros que adquieren la enfermedad oscila alrededor del 2-3%, siendo el principal factor asociado al mal pronóstico el retraso diagnóstico y del inicio del tratamiento antiparasitario. Los casos de malaria importada suelen presentarse con fiebre, cefalea y artromialgias, aunque pueden aparecer otros síntomas. El diagnóstico se debe realizar de forma urgente, a través de gota gruesa o pruebas de diagnóstico rápido, y extensión sanguínea. El tratamiento debe ser instaurado lo antes posible. En los casos de malaria grave, el uso de artemisininas intravenosas ha demostrado ser superior al uso de quinina intravenosa. En este documento se detallan las recomendaciones del grupo de expertos de la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI) para el diagnóstico y tratamiento de la malaria importada.
Malaria is a common parasitic disease diagnosed in the returned traveler. Mortality in travelers with imported malaria is around 2-3%, and one of the main factors associated with poor prognosis is the delay in the diagnosis and treatment. Imported malaria cases usually present with fever, headache and myalgia, but other symptoms may appear. The diagnosis should be performed as soon as possible, using thick smear or rapid diagnostic tests, and a blood smear. Treatment should be initiated urgently. In cases of severe malaria, the use of intravenous artemisinins has proved to be superior to intravenous quinine. This document reviews the recommendations of the expert group of the Spanish Society of Tropical Medicine and International Health (SEMTSI) for the diagnosis and treatment of imported malaria in Spain.
Estas recomendaciones son fruto del trabajo realizado por un grupo de especialistas de la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI) entre junio de 2012 y junio de 2013. El objetivo de este grupo ha sido analizar la evidencia que existe en torno al diagnóstico y tratamiento de la malaria importada, y establecer recomendaciones prácticas para los profesionales sanitarios que trabajan en España. En los casos en los que no existe evidencia suficiente, se han establecido recomendaciones en base al consenso entre los expertos del grupo de trabajo.
Aspectos clínico-epidemiológicos de la malaria importadaLa malaria o paludismo es una enfermedad parasitaria producida por la infección por varias especies del género Plasmodium. En humanos, las 6especies que causan enfermedad son P.falciparum, P.vivax, P.ovale (P.ovale wallikeri y P.ovale curtisi), P.malariae y P.knowlesi, aunque otras infecciones son posibles.
La mortalidad asociada a malaria importada en viajeros en nuestro país se sitúa alrededor del 2-3%, siendo menor en el caso de pacientes semi-inmunes1-3. Se estima que menos del 30% de los viajeros a zonas palúdicas realizan quimioprofilaxis adecuada. Específicamente, en el grupo de VFR (visiting friends and relatives), el empleo de quimioprofilaxis es prácticamente anecdótico. En general, y también en nuestro país, la principal especie causante de malaria importada es P.falciparum4,5.
Los síntomas y signos de la malaria importada no son específicos. Los más frecuentemente detectados son fiebre, cefalea y artromialgias. Un tanto por ciento variable de pacientes, y especialmente en personas semi-inmunes, no presentan fiebre en el momento del estudio, por lo que su ausencia no descarta malaria3,6. El uso generalizado de antipiréticos generalmente impide observar los patrones cíclicos antiguamente descritos de periodicidad febril (fiebres «tercianas» y «cuartanas»). Finalmente, la presencia de diarrea, dolor abdominal, vómitos o tos puede actuar como factor de confusión en el diagnóstico1,3,7.
En la exploración física el dato más frecuente es la esplenomegalia, que aparece entre el 16 y el 33% de los pacientes1,7. En el hemograma, la trombocitopenia es la alteración más habitual (80-85%), siendo la anemia y la leucopenia menos frecuentes (30 y 22%, respectivamente). En el estudio bioquímico sanguíneo las magnitudes que se alteran con mayor frecuencia son la actividad LDH y la concentración de bilirrubina sérica1,7.
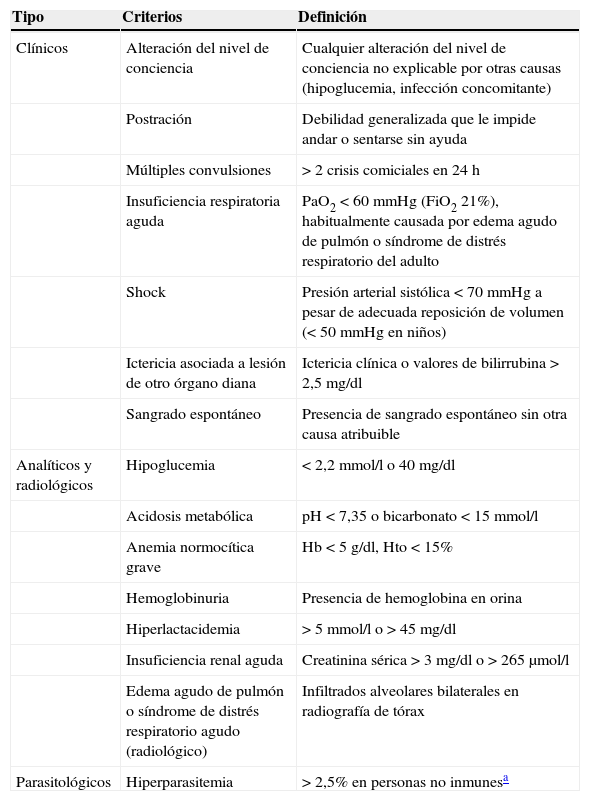
La malaria es una enfermedad potencialmente mortal, y cualquier paciente puede presentar signos y síntomas de gravedad en un momento determinado. Los criterios que definen a la malaria grave según la Organización Mundial de la Salud (OMS) se describen en la tabla 18,9.
Criterios de gravedad de la malaria importada
| Tipo | Criterios | Definición |
|---|---|---|
| Clínicos | Alteración del nivel de conciencia | Cualquier alteración del nivel de conciencia no explicable por otras causas (hipoglucemia, infección concomitante) |
| Postración | Debilidad generalizada que le impide andar o sentarse sin ayuda | |
| Múltiples convulsiones | >2 crisis comiciales en 24h | |
| Insuficiencia respiratoria aguda | PaO2<60mmHg (FiO2 21%), habitualmente causada por edema agudo de pulmón o síndrome de distrés respiratorio del adulto | |
| Shock | Presión arterial sistólica <70mmHg a pesar de adecuada reposición de volumen (<50mmHg en niños) | |
| Ictericia asociada a lesión de otro órgano diana | Ictericia clínica o valores de bilirrubina >2,5mg/dl | |
| Sangrado espontáneo | Presencia de sangrado espontáneo sin otra causa atribuible | |
| Analíticos y radiológicos | Hipoglucemia | <2,2mmol/l o 40mg/dl |
| Acidosis metabólica | pH<7,35 o bicarbonato <15mmol/l | |
| Anemia normocítica grave | Hb<5g/dl, Hto<15% | |
| Hemoglobinuria | Presencia de hemoglobina en orina | |
| Hiperlactacidemia | > 5mmol/l o >45mg/dl | |
| Insuficiencia renal aguda | Creatinina sérica >3mg/dl o >265μmol/l | |
| Edema agudo de pulmón o síndrome de distrés respiratorio agudo (radiológico) | Infiltrados alveolares bilaterales en radiografía de tórax | |
| Parasitológicos | Hiperparasitemia | >2,5% en personas no inmunesa |
Modificada de WHO96.
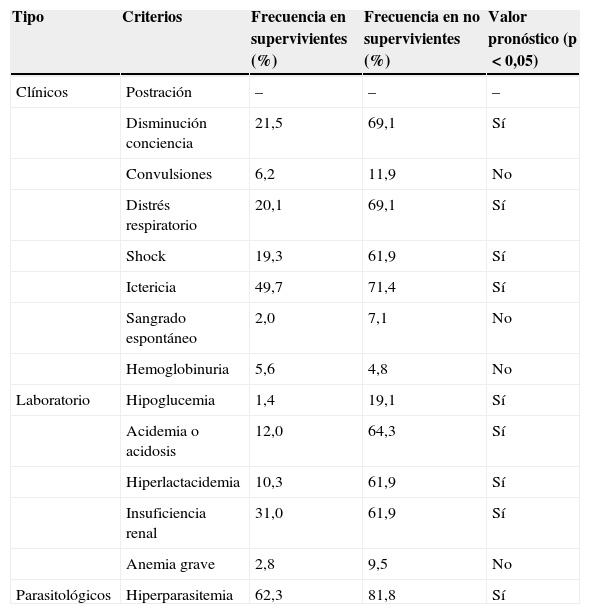
En las series de malaria importada revisadas1-3,5,6,10-25, entre el 3,6 y el 23% de los casos cumplen criterios de gravedad, siendo la frecuencia media en torno al 10%. La mayor parte de los casos de malaria grave están producidos por P.falciparum, y en mucha menor frecuencia por P.vivax y P.knowlesi. La frecuencia y el valor pronóstico de los diferentes criterios de la OMS son diferentes en adultos y niños9. En la tabla 2 se indica la frecuencia relativa de signos y síntomas en adultos basada en la serie más amplia de casos de malaria grave importada26. Como puede observarse, las convulsiones, el sangrado espontáneo, la hemoglobinuria, la anemia y la hipoglucemia son criterios de gravedad poco frecuentes en los casos de malaria importada. Existen escalas validadas que permiten un estadificación de la gravedad del paciente con malaria: OMS score, SAPS-II (simplified acute physiology score), MPS (malaria prediction score) y MSA (malaria score for adults)27, siendo las 2 primeras las más sensibles para predecir la mortalidad.
Frecuencia y valor pronóstico de los criterios de la OMS de malaria grave
| Tipo | Criterios | Frecuencia en supervivientes (%) | Frecuencia en no supervivientes (%) | Valor pronóstico (p<0,05) |
|---|---|---|---|---|
| Clínicos | Postración | – | – | – |
| Disminución conciencia | 21,5 | 69,1 | Sí | |
| Convulsiones | 6,2 | 11,9 | No | |
| Distrés respiratorio | 20,1 | 69,1 | Sí | |
| Shock | 19,3 | 61,9 | Sí | |
| Ictericia | 49,7 | 71,4 | Sí | |
| Sangrado espontáneo | 2,0 | 7,1 | No | |
| Hemoglobinuria | 5,6 | 4,8 | No | |
| Laboratorio | Hipoglucemia | 1,4 | 19,1 | Sí |
| Acidemia o acidosis | 12,0 | 64,3 | Sí | |
| Hiperlactacidemia | 10,3 | 61,9 | Sí | |
| Insuficiencia renal | 31,0 | 61,9 | Sí | |
| Anemia grave | 2,8 | 9,5 | No | |
| Parasitológicos | Hiperparasitemia | 62,3 | 81,8 | Sí |
De Bruneel et al.26.
Además de las formas graves descritas previamente, un paciente con malaria puede tener una evolución fatal por razones diferentes a la propia infección, lo que se ha denominado malaria complicada. En estos casos, las medidas destinadas al control de la parasitemia y sus efectos nocivos no son suficientes para la curación. Las 2causas más frecuentes de malaria complicada son la coinfección bacteriana y, en menor medida, la rotura de bazo. La presencia concomitante de leucocitosis (>15.000/μl), poco frecuente en los casos de malaria, puede alertar de la presencia de complicaciones28.
La presencia de una prueba de biología molecular positiva en un paciente con microscopia negativa se define como malaria submicroscópica. Esta entidad es casi exclusiva de pacientes inmigrantes considerados semi-inmunes, y aunque suele cursar de forma asintomática, se ha asociado a anemia y bajo peso al nacer en varios estudios en embarazadas en países endémicos29-31, aunque estos resultados son objeto de controversia32,33. Puede estar además asociada a astenia, fiebre o dolor musculoesquelético. En más del 10% de los casos puede aparecer leucopenia, linfopenia o trombocitopenia.
Recomendaciones para el diagnósticoEl diagnóstico de la malaria importada es siempre urgente. Las pruebas de diagnóstico de malaria se han de solicitar a cualquier paciente con fiebre procedente de un área endémica4,34,35. La sangre debe extraerse en cuanto se sospeche malaria, haya o no fiebre en ese momento. Puede ser necesario extraer hasta 3muestras para descartar la infección, sobre todo en pacientes que han recibido fármacos antipalúdicos como profilaxis o tratamiento. Es altamente recomendable disponer del resultado de forma urgente (menos de 3h tras la extracción). El retraso en el diagnóstico no debe demorar el inicio de tratamiento antimalárico empírico si la probabilidad de malaria es alta y el paciente está grave4,36,37.
La gota gruesa seguida de la extensión sanguínea sigue siendo el «patrón áureo» para el diagnóstico de la malaria importada. Si no se dispone de la posibilidad de realizar una gota gruesa, se puede utilizar un test de diagnóstico rápido (TDR) como prueba inicial de cribado. No se recomienda sustituir la microscopia por el TDR, ya que este presenta un elevado número de falsos negativos en casos de malaria no-falciparum38. Se informará como mínimo si el paciente tiene o no malaria, y en caso afirmativo si es o no por P.falciparum. Cuando esté disponible el resultado de la microscopia, se añadirá al informe la identificación de especie y el grado de parasitemia expresada como porcentaje de hematíes.
En ausencia de confirmación parasitológica a pesar de una alta sospecha diagnóstica, debe solicitarse la opinión de un especialista en enfermedades tropicales o en enfermedades infecciosas4.
Diagnóstico microscópicoGota gruesaActualmente se considera el «patrón áureo» para el diagnóstico de la malaria. El examen microscópico de la gota gruesa, que requiere microscopistas expertos y un estricto control de calidad, permite detectar densidades de hasta 5-20 parásitos/μl (0,0001%), evaluar el estadio de los parásitos circulantes (trofozoítos, esquizontes, gametocitos) y la respuesta al tratamiento37. La identificación de la especie infectante es difícil en la gota gruesa, por lo que se debe realizar la extensión sanguínea39-42. El diagnóstico de malaria no debe ser excluido solamente con el resultado negativo del examen de un único frotis de sangre periférica39-42.
Frotis/Extensión finaEsta técnica es 30veces menos sensible que la gota gruesa y no debe emplearse de forma aislada en el diagnóstico de la malaria37,39-42. Por el contrario, es más específica que la gota gruesa, ya que permite identificar con más facilidad la especie infectante y las parasitaciones mixtas.
Se recomienda cuantificar la parasitemia (habitualmente expresada como número de parásitos por microlitro de sangre o como porcentaje de hematíes parasitados), ya que es un factor pronóstico importante. En las primeras 24h tras el inicio del tratamiento puede haber un incremento en la densidad parasitaria antes de que la parasitemia comience a disminuir43.
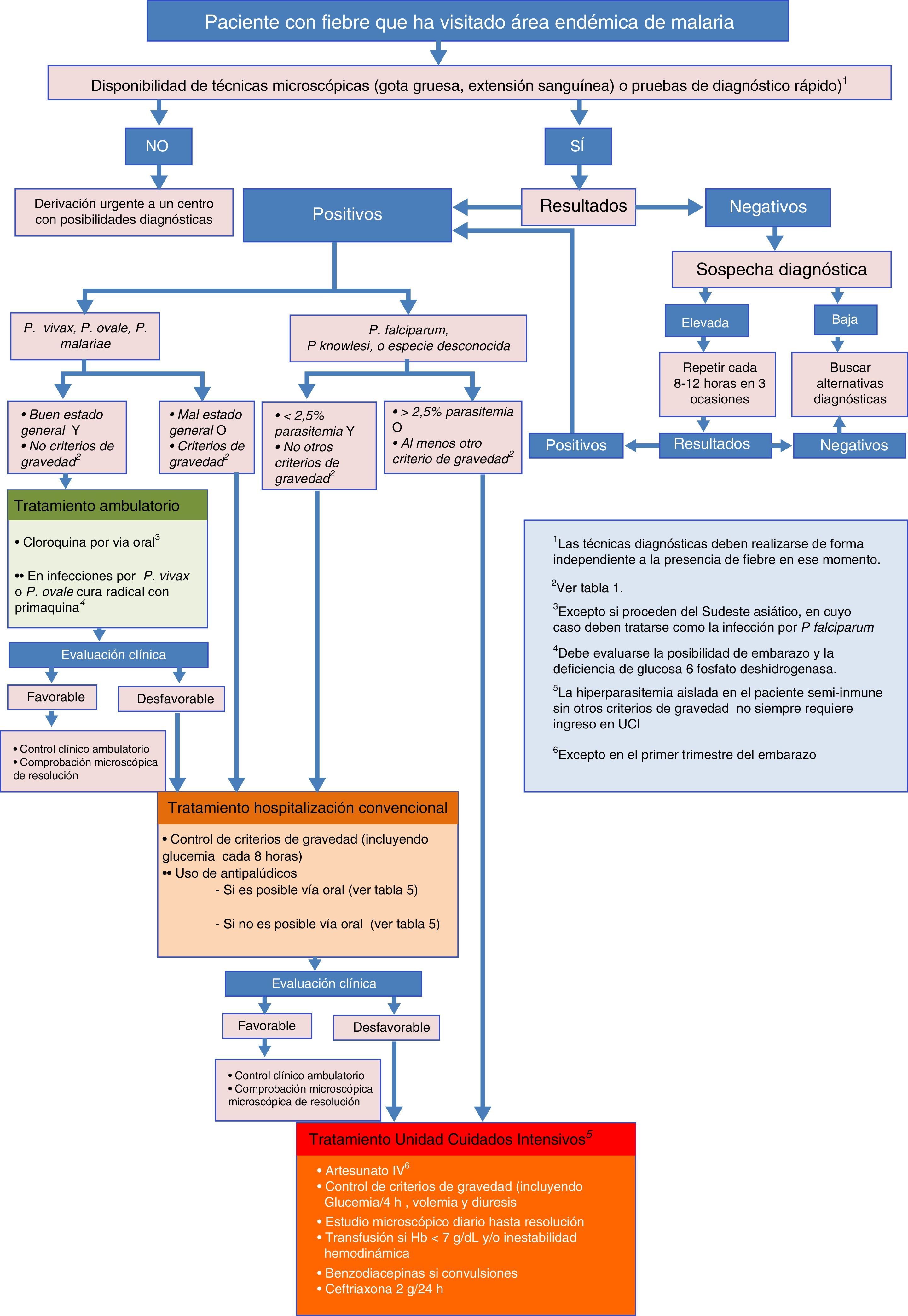
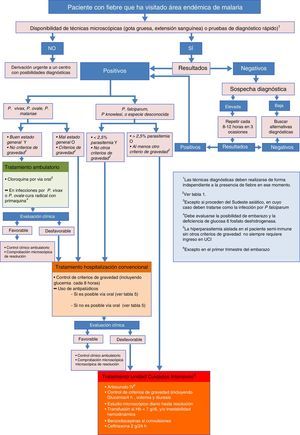
La parasitemia tiene valor pronóstico y es una variable importante, junto con los datos clínicos y de laboratorio, para adoptar decisiones terapéuticas (como la vía de administración y el fármaco más adecuado) y si el tratamiento será ambulatorio u hospitalario (fig. 1). Sin embargo, es importante recordar que una cifra de parasitemia baja no es sinónimo de bajo potencial de gravedad, ya que el fenómeno de citoadherencia y de secuestro periférico puede disminuir la cantidad de parásito circulante en casos graves. El estudio de la parasitemia tras recibir el tratamiento permite monitorizar la respuesta al tratamiento y la aparición de resistencias39-43.
Test de diagnóstico rápidoLos tests de diagnóstico rápido (TDR) se basan en la detección rápida de antígenos parasitarios especie-específicos o comunes a todas las especies de plasmodium (HPR-2 [proteína-2 rica en histidina], aldolasa del Plasmodium o pLDH [LDH del parásito]) en sangre mediante técnicas inmunocromatográficas. Estas técnicas son de utilización sencilla, tienen una alta sensibilidad y especificidad, y no requieren de experiencia previa para interpretar sus resultados, cuya obtención es muy rápida42. No son útiles para evaluar la respuesta al tratamiento ya que pueden permanecer positivos durante varios días, ni permiten tampoco una cuantificación del grado de parasitemia. Los tests de última generación permiten la diferenciación de especie, discriminando adecuadamente entre una infección por P.falciparum o P.vivax, pero no de las otras especies. Su rendimiento disminuye en presencia de bajas parasitemias (más frecuente en malarias no-falciparum). Se han descrito también falsos negativos en los TDR en pacientes con malaria falciparum con alta parasitemia, probablemente debido a un fenómeno de «prozona»44.
Debido a su rápida respuesta, los TDR pueden usarse como cribado inicial en casos de sospecha de malaria si no se dispone de gota gruesa. También en aquellos lugares donde el diagnóstico por microscopia no sea posible, o como método complementario a la microscopia. Sin embargo, su uso no debe sustituir la microscopia. En algunos países se recomienda a ciertos tipos de viajeros que lleven consigo TDR para autodiagnóstico, pero su uso para este fin aún no ha sido debidamente validado.
Pruebas de biología molecularDiferentes trabajos han mostrado que la sensibilidad de las técnicas diagnósticas moleculares basadas en la PCR, en torno a 0,01parásitos/μl de sangre, es mayor que los métodos convencionales basados en microscopia (5-20parásitos/μl) o los métodos basados en detección de antígeno (100parásitos/μl)45,46. Por otro lado, la especificidad también mejora, permitiendo una mejor caracterización de especie y la detección de infecciones mixtas en mayor proporción que otros métodos45,46.
La PCR (multiplex o en tiempo real) es útil como prueba confirmatoria de especie, en el caso de parasitemias mixtas, parasitemias submicroscópicas, o en el caso de sospecha de infección por P.knowlesi.
Sin embargo, estas técnicas conllevan un tiempo de respuesta largo (entre 6 y 24h), su coste es elevado y quedan normalmente restringidas a laboratorios centrales o de referencia.
Técnicas serológicasLas técnicas serológicas para detección de anticuerpos antipalúdicos de inmunofluorescencia indirecta y ELISA no tienen utilidad en el diagnóstico del caso agudo de malaria. El interés en la práctica clínica se limita a la evaluación retrospectiva cuando se desea confirmar el diagnóstico previo en pacientes no inmunes que sufrieron un proceso febril durante un viaje, aunque su baja sensibilidad no permite certificar la ausencia de malaria previa en los casos negativos. También se utilizan como criterio diagnóstico para la esplenomegalia malárica hiperreactiva.
Recomendaciones para el inicio de tratamiento intravenoso y criterios de ingresoEl algoritmo representado en la figura 1 muestra las diferentes situaciones en las que el clínico se enfrenta a un caso de sospecha de malaria importada, y las recomendaciones para cada caso.
Indicaciones para el inicio del tratamientoEn general se recomienda tratar en los siguientes casos:
- a)
Todo paciente sintomático con una prueba diagnóstica positiva.
- b)
Pacientes asintomáticos con gota gruesa o PCR positivas para malaria.
- c)
Paciente sintomático con alta sospecha diagnóstica de malaria grave y dificultades o retrasos para acceder a las pruebas diagnósticas. En estos casos, y debido a la alta morbimortalidad asociada, el tratamiento antipalúdico debe instaurarse de forma urgente sin esperar a la confirmación parasitológica.
Los casos de malaria grave deben tratarse de forma urgente. Es responsabilidad del personal sanitario que atiende al paciente que el tratamiento farmacológico sea instaurado con la mayor rapidez posible. Si no se dispone de tratamiento intravenoso (i.v.) ante un caso de malaria grave se recomienda iniciar tratamiento oral para cubrir P.falciparum y proceder al traslado urgente a una unidad especializada.
Los criterios recomendados para el inicio del tratamiento i.v. son47:
- -
Presencia de al menos uno de los criterios de gravedad, incluyendo una cifra de parasitemia mayor del 2,5% (tabla 1).
- -
Intolerancia oral.
Como norma general, todos los pacientes diagnosticados de malaria deben ser ingresados en un centro hospitalario. Únicamente en centros especializados, dotados de personal con experiencia y fácil acceso a exploraciones diagnósticas y revisiones, sería posible el tratamiento de determinados pacientes en régimen ambulatorio.
Los pacientes con malaria producida por P.falciparum deben ser ingresados en base a la posibilidad de rápido empeoramiento clínico o una evaluación inicial que pudiera ser engañosa48,49. Este hecho es especialmente importante en pacientes no inmunes, donde la malaria puede evolucionar rápidamente, incluso cuando se ha realizado el diagnóstico y se ha instaurado un tratamiento correcto49.
Los pacientes con malaria por P.knowlesi deben ser ingresados para tratamiento hospitalario debido al riesgo de desarrollar malaria grave50.
Los pacientes con malaria por P.vivax pueden ser manejados de forma ambulatoria, teniendo en cuenta que, aunque de forma infrecuente, pueden ocasionar cuadros de gravedad que comprometan la vida del paciente51,52, relacionándose con SDRA, fallo renal, trombocitopenia, CID o malaria cerebral.
Las complicaciones de la malaria por P.ovale y P.malariae son extremadamente infrecuentes, por lo que los pacientes pueden ser tratados de forma ambulatoria si su estado general lo permite y no presenta factores de riesgo como inmunodepresión, esplenectomía o enfermedades crónicas, principalmente cardiovasculares. Sin embargo, los pacientes con diagnóstico de P.malariae provenientes de áreas dónde P.knowlesi sea endémico, deberán ser manejados con prudencia debido a su difícil diferenciación microscópica y a la alta incidencia de complicaciones secundaria a P.knowlesi.
Tratamiento de la malaria no grave en adultosTratamiento de Plasmodium falciparum sin criterios de gravedadEl tratamiento de la malaria no grave por P.falciparum debe incluir fármacos combinados. Son preferibles las pautas más cortas y las combinaciones con dosis fijas porque aseguran una mayor adherencia y reducen la aparición de resistencias4.
El tratamiento puede administrarse por vía oral si no presenta vómitos. Si vomita la medicación repetidamente, debe tratarse con medicación parenteral, aunque no existan otros signos de gravedad (fig. 1).
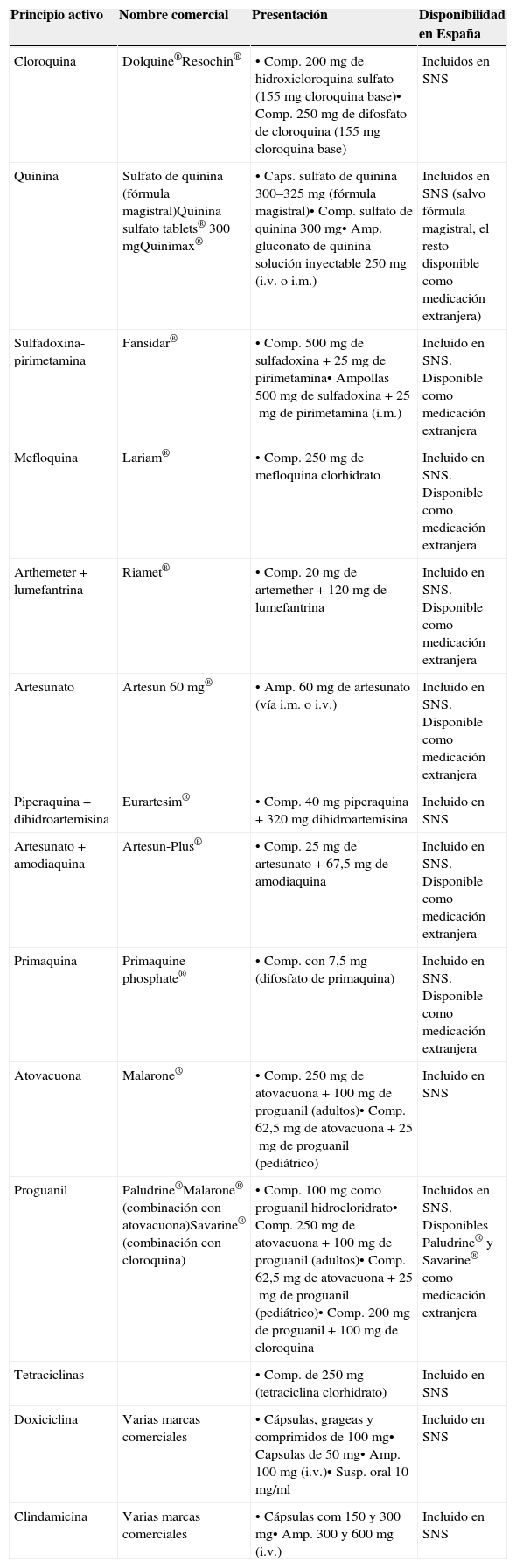
Los fármacos antipalúdicos disponibles en España se describen en la tabla 3, indicando las diferentes presentaciones de los principios activos en el mercado español a fecha del 1 de julio del 2013, así como su disponibilidad.
Fármacos antipalúdicos disponibles en España a fecha 1 de julio de 2013
| Principio activo | Nombre comercial | Presentación | Disponibilidad en España |
|---|---|---|---|
| Cloroquina | Dolquine®Resochin® | • Comp. 200mg de hidroxicloroquina sulfato (155mg cloroquina base)• Comp. 250mg de difosfato de cloroquina (155mg cloroquina base) | Incluidos en SNS |
| Quinina | Sulfato de quinina (fórmula magistral)Quinina sulfato tablets® 300mgQuinimax® | • Caps. sulfato de quinina 300–325mg (fórmula magistral)• Comp. sulfato de quinina 300mg• Amp. gluconato de quinina solución inyectable 250mg (i.v. o i.m.) | Incluidos en SNS (salvo fórmula magistral, el resto disponible como medicación extranjera) |
| Sulfadoxina-pirimetamina | Fansidar® | • Comp. 500mg de sulfadoxina +25mg de pirimetamina• Ampollas 500mg de sulfadoxina +25mg de pirimetamina (i.m.) | Incluido en SNS. Disponible como medicación extranjera |
| Mefloquina | Lariam® | • Comp. 250mg de mefloquina clorhidrato | Incluido en SNS. Disponible como medicación extranjera |
| Arthemeter +lumefantrina | Riamet® | • Comp. 20mg de artemether +120mg de lumefantrina | Incluido en SNS. Disponible como medicación extranjera |
| Artesunato | Artesun 60 mg® | • Amp. 60mg de artesunato (vía i.m. o i.v.) | Incluido en SNS. Disponible como medicación extranjera |
| Piperaquina + dihidroartemisina | Eurartesim® | • Comp. 40mg piperaquina +320mg dihidroartemisina | Incluido en SNS |
| Artesunato + amodiaquina | Artesun-Plus® | • Comp. 25mg de artesunato +67,5mg de amodiaquina | Incluido en SNS. Disponible como medicación extranjera |
| Primaquina | Primaquine phosphate® | • Comp. con 7,5mg (difosfato de primaquina) | Incluido en SNS. Disponible como medicación extranjera |
| Atovacuona | Malarone® | • Comp. 250mg de atovacuona +100mg de proguanil (adultos)• Comp. 62,5mg de atovacuona +25mg de proguanil (pediátrico) | Incluido en SNS |
| Proguanil | Paludrine®Malarone® (combinación con atovacuona)Savarine® (combinación con cloroquina) | • Comp. 100mg como proguanil hidrocloridrato• Comp. 250mg de atovacuona +100mg de proguanil (adultos)• Comp. 62,5mg de atovacuona +25mg de proguanil (pediátrico)• Comp. 200mg de proguanil +100mg de cloroquina | Incluidos en SNS. Disponibles Paludrine® y Savarine® como medicación extranjera |
| Tetraciclinas | • Comp. de 250mg (tetraciclina clorhidrato) | Incluido en SNS | |
| Doxiciclina | Varias marcas comerciales | • Cápsulas, grageas y comprimidos de 100mg• Capsulas de 50mg• Amp. 100mg (i.v.)• Susp. oral 10mg/ml | Incluido en SNS |
| Clindamicina | Varias marcas comerciales | • Cápsulas com 150 y 300mg• Amp. 300 y 600mg (i.v.) | Incluido en SNS |
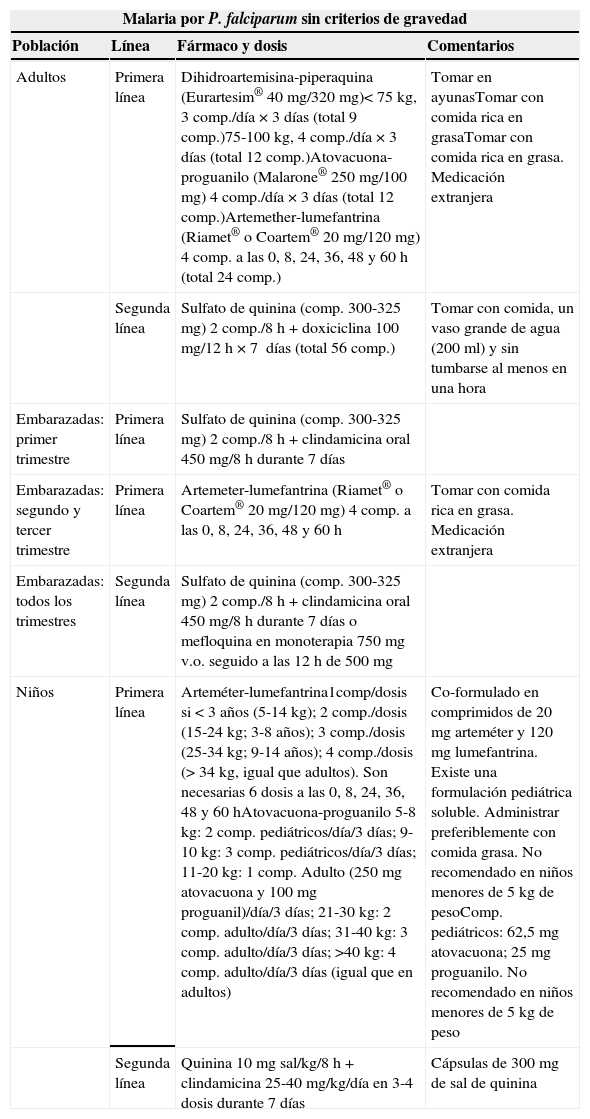
Los fármacos de elección para el tratamiento de P.falciparum tienen eficacia similar y superior al 95%. Se ha de tener en cuenta que las combinaciones con artemisininas han mostrado una mayor rapidez en el aclaramiento de la parasitemia. Los autores de estas guías recomiendan como tratamiento de primera elección en el momento actual el uso de dihidroartemisina-piperaquina o atovacuona-proguanil, en base a su eficacia y a la disponibilidad en el mercado español (tabla 5). Las combinaciones de artesunato-lumefantrina son también eficaces pero no están comercializadas en España, aunque pueden obtenerse a través de la solicitud de medicación extrajera.
Si el paciente ha tomado profilaxis antipalúdica se debe iniciar un tratamiento completo con un antimalárico diferente. Si existen vómitos se recomienda el uso de antieméticos. El uso de quinina oral para el tratamiento de la malaria sin criterios de gravedad ha quedado relegado a última opción, dado que el perfil de seguridad de las otras combinaciones es más adecuado4,53,54.
Tratamiento farmacológico de Plasmodium vivax, P.ovale, P.malariae y P.knowlesi sin criterios de gravedadEl tratamiento de primera elección es la cloroquina, excepto en los casos de P.vivax que provienen del sureste asiático47. Es frecuente que la cloroquina produzca prurito, especialmente en individuos de raza negra, lo que no representa un episodio de hipersensibilidad. Si es necesario puede pautarse un antihistamínico. Si existe cualquier duda sobre la sensibilidad a la cloroquina por el origen geográfico o por la identificación de especie, o presentan alguno de los criterios de gravedad de la tabla 1, debe tratarse con cualquiera de los fármacos disponibles para P.falciparum.
Cura radical de Plasmodium vivax y P.ovaleEn las infecciones importadas por P.vivax o P.ovale siempre hay que realizar un ciclo de tratamiento con primaquina para eliminar los hipnozoítos (formas quiescentes) y evitar recidivas de la infección55,56. Actualmente no existe otro fármaco alternativo disponible. Antes de iniciar el tratamiento siempre hay que determinar los niveles de glucosa-6-fosfato deshidrogenasa (G6PDH) en hematíes (diferentes valores según la técnica utilizada) para evitar hemólisis que pueden ser graves. Si los niveles son normales (actividad >60%) se puede iniciar el tratamiento con primaquina a las dosis habituales. Si existe una deficiencia parcial (10-60%), se recomienda una dosis semanal de 45mg (6comprimidos de Primaquine®) durante 8semanas. Si la deficiencia es grave (<10%), el uso de primaquina está contraindicado y se deben tratar las recidivas posteriores con cualquiera de los fármacos indicados sin descartar el utilizado inicialmente. La primaquina también está contraindicada en el embarazo y no recomendada en menores de 4años. Se recomienda iniciar el tratamiento con primaquina tan pronto se reciban los resultados de la G6PDH, durante el tratamiento de la fase aguda o inmediatamente después. Las infecciones por P.vivax o P.ovale adquiridas por transfusión sanguínea o trasplante, y las infecciones congénitas, no precisan primaquina porque no existen hipnozoítos.
Infecciones mixtasLas infecciones mixtas que incluyen P.falciparum deben recibir tratamiento activo contra esta especie. Si se identifican varios Plasmodium, todos sensibles a cloroquina, es razonable usar únicamente este fármaco. Si la infección mixta incluye P.vivax o P.ovale, siempre hay que añadir primaquina, salvo contraindicaciones.
Tratamiento de soporteLos vómitos son frecuentes en los pacientes con malaria. No hay estudios de eficacia ni comparaciones entre diferentes compuestos antieméticos. El tratamiento simultáneo de atovacuona con metoclopramida se ha asociado con descensos importantes en las concentraciones plasmáticas de atovacuona. En el resto no hay evidencia de que sea perjudicial el uso de metoclopramina (Primperan®) o domperidona (Motilium®). Conviene insistir que si vomita la medicación repetidamente, aunque no existan otros signos de gravedad, debe tratarse con medicación i.v.
No se recomiendan restricciones en la dieta si no existen otras enfermedades asociadas. Hay que asegurar una buena tolerancia oral y mantener una adecuada hidratación con líquidos abundantes y frecuentes por vía oral. Si precisa hidratación i.v. conviene hacerlo con precaución (ver malaria grave) y pasar a la vía oral en cuanto sea posible. Puede ser necesario administrar suplementos de glucosa (sobre todo con quinina) o iones.
Tratamiento de la malaria grave en adultosLa malaria importada grave se define como aquel episodio que presente alguno de los criterios de gravedad que figuran en la tabla 1. En la tabla 4 se resumen las principales acciones a tomar para un correcto tratamiento de la malaria importada con criterios de gravedad. Todo paciente con malaria grave debe ser ingresado en una unidad de cuidados intensivos, excepto casos particulares, como algunos pacientes (en especial aquellos semi-inmunes) cuyo único criterio de gravedad es una parasitemia levemente por encima de la cifra del 2,5%.
Resumen de la actitud terapéutica ante la malaria con criterios de gravedad
| Tratamiento farmacológico inmediato | Ver tabla 5 |
| Control de temperatura, tensión y volemia | Especial cuidado con el aporte de líquidos, ya que los pacientes son susceptibles de edema pulmonar por sobrecarga. Se puede introducir catéter para medir la presión venosa central, aunque la fiabilidad no es del 100% para la detección de la sobrecarga hídrica |
| Control de hipoglucemia | Causa frecuente de complicaciones, en ocasiones simulando malaria cerebral. Monitorización estricta. Embarazadas especialmente sensibles |
| Transfusión sanguínea | En general, indicada si Hb<70g/l o inestabilidad hemodinámica |
| Anticonvulsivantes | Benzodiacepinas o fenitoína para el control de las convulsiones secundarias |
| Antibióticos de amplio espectro | Administrar en caso de malaria grave (excluyendo hiperparasitemia) o ante la sospecha de infección bacteriana concomitante |
| Eritrocitoaféresis o recambio de hematíes | Controvertida. No se ha podido demostrar su utilidad, especialmente cuando se inicia tratamiento i.v. con artemisininas |
La malaria grave suele ser producida por P.falciparum26, y en menor frecuencia por otras especies.
Tratamiento farmacológicoEl tratamiento de la malaria con signos de gravedad debe ser instaurado con la mayor rapidez posible, ya que condicionará el pronóstico del paciente57.
La correcta elección del tratamiento farmacológico en los casos de malaria grave es de vital importancia. Durante décadas el tratamiento de elección en los casos de malaria grave ha sido la asociación de quinina y doxiciclina o clindamicina (esta última en el caso de niños y mujeres embarazadas)47. Sin embargo, ensayos clínicos recientes han demostrado que la administración de artemisininas i.v. en adultos y niños con malaria grave es superior a la quinina i.v. al reducir la mortalidad en niños y en adultos de áreas endémicas58-60. Por tanto, es altamente recomendable que los hospitales que reciben casos de malaria tengan una reserva de artesunato i.v. disponible.
ArtemisininasLos derivados de la artemisinina se han convertido recientemente en la primera opción para el tratamiento de la malaria con criterios de gravedad60. La inyección i.v. de artesunato es más simple que la de la quinina y consigue enseguida niveles elevados del principio activo que reducen rápidamente la parasitemia circulante61.
El artesunato i.v. es considerado en España medicación extranjera. En el momento de publicación de estas guías, el fármaco disponible es Artesun® 60mg (Guilin Pharmaceutical Co., Ltd.).
Cada caja contiene un vial de 60mg de artesunato y un vial de 1ml de reconstituyente (bicarbonato sódico al 5%). Se debe añadir el bicarbonato al vial de artesunato y agitar suavemente durante 2-3min hasta que se disuelva completamente y la solución final sea un líquido claro. Posteriormente se añadirán 5ml de suero salino al 0,9%. La solución resultante tiene una concentración de 10mg/ml de artesunato. Se debe extraer la cantidad necesaria de la solución de artesunato del vial con una jeringa e inyectar por vía i.v. a un ritmo de 3-4ml/min.
La dosis inicial es de 2,4mg/kg i.v. seguido de las mismas dosis a las 12h, a las 24h y posteriormente cada 24h si es necesario hasta que el paciente mejore y se pueda iniciar el tratamiento oral. Debe administrarse medicación i.v. por un mínimo de 24h (3dosis), aunque el paciente tolere medicación oral antes. Se debe completar siempre el tratamiento con una formulación oral de una de las combinaciones con artemisininas orales o de atovacuona/proguanil.
El artesunato i.v. ha mostrado un buen perfil de seguridad comparado con otros fármacos antipalúdicos62,63. Sin embargo, se necesitan más estudios que evalúen la aparición de efectos adversos raros en su uso a gran escala. Los efectos adversos más frecuentes son náuseas, vómitos y diarrea leve. Estos síntomas pueden ser también producidos por la malaria, lo que dificulta su evaluación. También se han descrito casos de elevación de las transaminasas, disminución de los reticulocitos y de los neutrófilos63, y recientemente casos de anemia hemolítica asociados al uso de artesunato i.v., por lo que se recomienda que todas las personas tratadas con este fármaco sean evaluadas clínica y analíticamente hasta 4semanas después del final del tratamiento4,64.
QuininaEl uso de la quinina se ha visto reducido en los últimos años debido principalmente a la aparición de antipalúdicos con mejor perfil de seguridad y eficacia53. La quinina i.v. asociada a doxiciclina o clindamicina está indicada en los casos de malaria grave en los que existe contraindicación para el uso de artesunato, como en el caso de la embarazada en el primer trimestre.
La quinina en España es considerada medicación extranjera. Aunque algunos centros la obtienen a través de formulación magistral de clorhidrato de quinina, es posible obtenerla a través de la importación de Quinimax®. Se administra en perfusión i.v. a dosis de 10mg/kg en suero glucosado al 5 o 10% durante 4h, seguida de 10mg/kg cada 8h (a pasar en 4h), asociada a doxiciclina 100mg/12h en el paciente adulto (clindamicina en niños y embarazadas). La dosis inicial de quinina en los casos de malaria con criterios de gravedad debe ser de 20mg/kg. Esta dosis de carga no debe ser administrada si el paciente ha recibido en las últimas 24h fármacos de la misma familia (mefloquina, cloroquina…) u otra medicación con potencial cardiotóxico. No se recomienda el uso de quinina en pacientes que hayan recibido previamente derivados de aminoquinoleínas.
La perfusión i.v. de quinina deberá monitorizarse en el caso que el paciente presente cardiopatía o un electrocardiograma basal con alteraciones.
La duración total del tratamiento con quinina y doxiciclina o clindamicina es de 7días. Sin embargo, tan pronto como el paciente presente criterios de tratamiento oral, puede sustituirse la quinina i.v. por otro tratamiento oral eficaz de corta duración, como las combinaciones orales con artemisininas o la combinación atovacuona-proguanil (tabla 5).
Esquema de recomendaciones del tratamiento de la malaria importada en España
| Malaria por P. falciparum sin criterios de gravedad | |||
|---|---|---|---|
| Población | Línea | Fármaco y dosis | Comentarios |
| Adultos | Primera línea | Dihidroartemisina-piperaquina (Eurartesim® 40mg/320mg)<75kg, 3comp./día×3días (total 9comp.)75-100kg, 4comp./día×3días (total 12 comp.)Atovacuona-proguanilo (Malarone® 250mg/100mg) 4 comp./día×3días (total 12comp.)Artemether-lumefantrina (Riamet® o Coartem® 20mg/120mg) 4comp. a las 0, 8, 24, 36, 48 y 60h (total 24comp.) | Tomar en ayunasTomar con comida rica en grasaTomar con comida rica en grasa. Medicación extranjera |
| Segunda línea | Sulfato de quinina (comp. 300-325mg) 2 comp./8h+doxiciclina 100mg/12h×7 días (total 56comp.) | Tomar con comida, un vaso grande de agua (200ml) y sin tumbarse al menos en una hora | |
| Embarazadas: primer trimestre | Primera línea | Sulfato de quinina (comp. 300-325mg) 2 comp./8h+clindamicina oral 450mg/8h durante 7días | |
| Embarazadas: segundo y tercer trimestre | Primera línea | Artemeter-lumefantrina (Riamet® o Coartem® 20mg/120mg) 4 comp. a las 0, 8, 24, 36, 48 y 60h | Tomar con comida rica en grasa. Medicación extranjera |
| Embarazadas: todos los trimestres | Segunda línea | Sulfato de quinina (comp. 300-325mg) 2 comp./8h+clindamicina oral 450mg/8h durante 7días o mefloquina en monoterapia 750mg v.o. seguido a las 12h de 500mg | |
| Niños | Primera línea | Arteméter-lumefantrina1comp/dosis si <3años (5-14kg); 2comp./dosis (15-24kg; 3-8años); 3comp./dosis (25-34kg; 9-14 años); 4 comp./dosis (>34kg, igual que adultos). Son necesarias 6 dosis a las 0, 8, 24, 36, 48 y 60hAtovacuona-proguanilo 5-8kg: 2 comp. pediátricos/día/3días; 9-10kg: 3 comp. pediátricos/día/3días; 11-20kg: 1comp. Adulto (250mg atovacuona y 100mg proguanil)/día/3días; 21-30kg: 2comp. adulto/día/3días; 31-40kg: 3comp. adulto/día/3 días; >40kg: 4 comp. adulto/día/3días (igual que en adultos) | Co-formulado en comprimidos de 20mg arteméter y 120mg lumefantrina. Existe una formulación pediátrica soluble. Administrar preferiblemente con comida grasa. No recomendado en niños menores de 5kg de pesoComp. pediátricos: 62,5mg atovacuona; 25mg proguanilo. No recomendado en niños menores de 5kg de peso |
| Segunda línea | Quinina 10mg sal/kg/8h+clindamicina 25-40mg/kg/día en 3-4dosis durante 7días | Cápsulas de 300mg de sal de quinina | |
| Malaria por P. vivax, P. ovale o P. malariae o P. knowlesi sin criterios de gravedad | |||
|---|---|---|---|
| Adultos | Primera línea | Cloroquina oral (Resochin® o Dolquine® 155mg base) 4 comp.+2 comp. a las 6, 24 y 48h (4+2+2+2=10 comp.)Si P. vivax: añadir siempre primaquina (Primaquine® 7,5mg base) 30mg base=4 comp./día×2 semSi P. ovale: añadir siempre primaquina (Primaquine® 7,5mg base) 15mg base=2 comp./día×2 sem | Tomar con comidaP. vivax resistente a cloroquina: Indonesia, Papua Nueva Guinea y sudeste asiático. En estos casos se tratará como P.falciparumMenos frecuente en algunas zonas de Etiopía, Madagascar, Centroamérica y Sudamérica, donde es razonable usar cloroquina inicialmente. El resto se considera sensible a cloroquina |
| Embarazo: todos los trimestres | Primera línea | Cloroquina oral (Resochin® o Dolquine® 155mg base) 4 comp.+2 comp. a las 6, 24 y 48h (4+2+2+2=10 comp.) | La primaquina está contraindicada en el embarazo por riesgo de anemia hemolítica en el feto. Para prevenir las recaídas se dará cloroquina oral 2 comp. (300mg) a la semana hasta el parto |
| Embarazo: segundo y tercer trimestre | Segunda línea | Artemether-lumefantrina (Riamet® o Coartem® 20mg/120mg) 4 comp. a las 0, 8, 24, 36, 48 y 60h (total 24 comp.) | |
| Niños | Primera línea | 25mg/kg de cloroquina base repartida en 3 días (10mg/kg primera dosis, seguida de 5mg/kg a las 12, 24 y 48h) | Comprimidos de 250mg sal equivalen a 150mg base. No existe formulación pediátrica específica |
| Malaria con criterios de gravedad | |||
|---|---|---|---|
| Adultos | Primera línea | Artesunato i.v. 2,4mg/kg iv, y repetir dosis a las 12h, 24h y cada 24h si es necesario hasta que se pueda iniciar el tratamiento oral. Se debe administrar un mínimo de 24h (3 dosis) | Siempre debe administrarse tratamiento secuencial tras la administración de artesunato i.v. (ver apartado de malaria sin criterios de gravedad). El uso de artesunato en monoterapia puede dar lugar a recidivas |
| Segunda línea | Quinina i.v. 20mg/kg dosis inicial a pasar en suero glucosado en 4h (dosis inicial de 10mg/kg si contraindicación), seguido de 10mg/kg en 4h cada 8h durante 7días, o hasta inicio del tratamiento oral. Se debe asociar doxiciclina 100mg/12h | ||
| Embarazadas: primer trimestre | Primera línea | Quinina i.v. 20mg/kg dosis inicial a pasar en suero glucosado en 4h, seguido de 10mg/kg en 4h cada 8h (máximo 1.800mg/día) asociado a clindamicina i.v. 10mg/kg/12h durante 7días | |
| Embarazadas: segundo y tercer trimestre | Primera línea | Artesunato i.v. 2,4mg/kg iv×3días a las 0, 12, 24, 48 y 72h, seguido de Artemeter/lumefrantina oral | |
| Segunda línea | Quinina i.v. 20mg/kg dosis inicial a pasar en suero glucosado en 4h, seguido de 10mg/kg en –4h cada 8h (máximo 1.800mg/día) asociado a clindamicina i.v. 10mg/kg/12h durante 7días | ||
| Niños | Primera línea | Artesunato 2,4mg/kg (i.v. o i.m.) a las 0, 12, 24h, seguido de una dosis cada 24h hasta que sea posible pasar a vía oral | Tratamiento de elección si está disponible. Deberá complementarse siempre con un ciclo completo de otro antimalárico (ver tratamiento de malaria no grave) |
| Segunda línea | Quinina i.v. 10mg sal/kg/8h+clindamicina 25-40mg/kg/día en 3-4dosis durante 7días | ||
La quinina presenta un bajo índice terapéutico y un número considerable de efectos adversos relacionados. El efecto adverso más característico del tratamiento con quinina es el cinconismo, que consiste en la aparición de cefalea, acufenos, trastornos visuales e hipoacusia. La hipoacusia es normalmente un efecto dependiente de la dosis y reversible. Estos efectos suelen desaparecer al suspender el tratamiento con quinina53,65.
La administración de quinina puede producir también hipoglucemia, especialmente en mujeres embarazadas, en las que tiene un difícil manejo. La hipotensión es otro efecto indeseable, especialmente si se produce una perfusión i.v. rápida53,65.
Ocasionalmente aparece un síndrome denominado «fiebre de aguas negras» o blackwater fever, caracterizado por hemólisis intravascular, hemoglobinuria, ictericia, anemia y fiebre. Se asocia a la ingesta de antipalúdicos en pacientes con malaria, y aunque se ha descrito principalmente en relación con la quinina, puede aparecer con otros antipalúdicos66.
Tratamiento de soporteSe deben monitorizar los signos vitales, el nivel de conciencia y la diuresis. La glucosa se debe monitorizar cada 4h en pacientes con malaria grave, en especial en aquellos con afectación neurológica y en las pacientes embarazadas67.
Manejo de fluidosEl manejo de fluidos en los casos de malaria grave difiere del de una sepsis bacteriana grave. El paciente con malaria grave puede presentar con mayor facilidad edema pulmonar no cardiogénico tras la administración excesiva de fluidos, siendo este un error común en el manejo de los pacientes con malaria grave. Se desaconseja el uso de bolos rápidos de fluidos. Por otro lado, la deshidratación empeora la función renal y la acidosis67,68. Puede ser útil para el manejo de fluidos la inserción de un catéter de presión venosa central (PVC) para el control de la presión de llenado cardíaco, siendo conscientes de las limitaciones de este método para la evaluación del volumen intravascular69.
Criterios de transfusión sanguíneaNo hay un criterio definido para la indicación de transfusión en los pacientes con malaria importada. Sin embargo, se aceptan como criterios estándar una concentración de hemoglobina inferior a 7g/dl o la presencia de inestabilidad hemodinámica.
Tratamiento de la malaria cerebralLa definición de malaria cerebral está basada en la clínica, puede confirmarse mediante la visualización por oftalmoscopia de la retinopatía malárica70 y es comúnmente aceptada como la presencia de coma en presencia de parasitemia por P.falciparum. Su tratamiento consiste en aplicar medidas de soporte. La mayoría de las intervenciones que se han ensayado para disminuir la gravedad de la malaria cerebral no han mostrado beneficio, y algunas se han mostrado perjudiciales. Por tanto, el uso de desferroxamina, heparina, N-acetil-cisteína, o pentoxifilina no está indicado68. Los corticoides están contraindicados, ya que incrementan el riesgo de sangrado gastrointestinal y crisis convulsivas67. También está contraindicado el uso de manitol, ya que en un ensayo reciente en casos de adultos con malaria cerebral ha mostrado prolongar el estado de coma71.
Uso de anticonvulsivantesSe deben usar benzodiacepinas i.v. o fenitoína en los pacientes con crisis convulsivas, siempre con adecuado control de la función respiratoria. No está demostrada su utilidad profiláctica.
Uso de antibióticosSe recomienda el uso de antibióticos de amplio espectro en aquellos casos de malaria con criterios de gravedad (síndrome de distrés respiratorio del adulto, shock, acidosis), o en aquellos casos en los que se sospeche sobreinfección bacteriana (leucocitosis o foco infeccioso identificable). Se deben realizar hemocultivos previos al inicio del tratamiento.
Recambio de hematíesEl recambio automático de hematíes es una técnica que separa los hematíes del resto de componentes sanguíneos, sin afectar las plaquetas, los leucocitos o el plasma. Hasta la fecha existen pocos casos publicados, y aunque se ha descrito como una técnica bien tolerada y eficaz para disminuir la parasitemia, no se ha demostrado su eficacia en el tratamiento de la malaria grave, especialmente tras la introducción de las artemisininas i.v. como fármaco de elección72-76.
La exanguinotransfusión, utilizada antiguamente en algunos casos de malaria grave, no está recomendada en la actualidad debido a los efectos adversos y a la falta de evidencia sobre su eficacia73,77.
Malaria en situaciones especialesPacientes obesosLas dosis recomendadas están establecidas para adultos de peso medio. En el caso de dihidroartemisina-piperaquina se recomienda aumentar la dosis a 4comprimidos al día entre 75 y 100kg. No hay datos en más de 100kg. No existen indicaciones claras de aumento de dosis en otras medicaciones.
Diabetes mellitusLos pacientes con diabetes mellitus tipo2 tienen un riesgo mayor de infección por P.falciparum que los no diabéticos78. Los pacientes diabéticos con malaria grave también parecen sufrir un aumento de la mortalidad. En estos pacientes la mayor frecuencia de hipoglucemia, cetoacidosis y ausencia de fiebre podrían justificar el retraso del diagnóstico y tratamiento de la malaria.
Infección por el virus de la inmunodeficiencia humanaLa inmunodepresión producida por el VIH incrementa la frecuencia y la gravedad de los episodios clínicos de malaria en zonas endémicas79. En el caso de la malaria importada, esto ocurre en los pacientes infectados con VIH e inmunosupresión avanzada (CD4 <350/μl)80. También hay datos que apuntan a que la inmunodepresión asociada a la infección por el VIH puede reducir la eficacia del tratamiento antipalúdico. Los pacientes con linfocitos CD4<300/μl con malaria tienen riesgo incrementado de fallo terapéutico al tratamiento con sulfadoxina-pirimetamina y con artemeter-lumefantrina81. Muchos antirretrovirales presentan interacciones con los fármacos antipalúdicos, y por tanto deben ser revisados antes de su prescripción (http://www.hiv-druginteractions.org).
Cuidado de la malaria en la embarazadaLa embarazada presenta mayor riesgo de contraer malaria que la población adulta general, y puede ser más grave. Todas las especies pueden afectar a la salud de la mujer y del feto, pero la infección por P.falciparum está asociada con un aumento de la morbimortalidad materna, fetal y perinatal82.
La malaria durante el embarazo se asocia a un mayor riesgo de anemia materna grave, muerte materna, aborto, parto prematuro, bajo peso al nacer y muerte perinatal. Por tanto, ante una embarazada con malaria es necesario instaurar sin demora un tratamiento eficaz83,84.
El tratamiento de la malaria en la mujer embarazada se resume en la tabla 5.
No existe suficiente información sobre la seguridad y la eficacia de muchos antipalúdicos en el embarazo, en especial durante el primer trimestre. Los únicos fármacos considerados seguros en el primer trimestre son la quinina, la cloroquina, la clindamicina y el proguanil.
Los fármacos derivados de la artemisinina son seguros y eficaces en el segundo y tercer trimestre de embarazo85. El tratamiento de elección de la malaria no grave en el segundo y tercer trimestre es el tratamiento combinado con derivados de la artemisinina (ACT)83. Estos presentan una eficacia similar a la quinina pero con un mejor perfil de tolerancia y seguridad. La combinación artemeter-lumefantrina es medicación extranjera, aunque se puede conseguir a través de la Agencia Española del Medicamento. No se aconseja en estos momentos la administración durante el embarazo de la combinación dihidroartemisina-piperaquina ni de atovacuona-proguanil, por la falta de datos sobre su uso. El tratamiento de la malaria en el primer trimestre del embarazo se realizará con quinina más clindamicina durante 7días.
En caso de infecciones por P.vivax o P.ovale durante el embarazo, no se puede administrar el tratamiento con primaquina. En estos casos las pacientes recibirán cloroquina semanal hasta el parto, y se diferirá el tratamiento hasta 3meses después del alumbramiento.
El riesgo de hipoglucemia está aumentado durante el embarazo, y además puede ser desencadenado por el uso de quinina. La hipoglucemia en embarazadas puede ser grave e incluso letal. El edema pulmonar, la anemia grave o las infecciones bacterianas son más frecuentes y graves en la embarazada con malaria. La anemia grave se asocia con un aumento de la morbimortalidad materna y perinatal, así como riesgo de hemorragia posparto86-90.
Particularidades en pediatríaLa malaria importada pediátrica es una enfermedad más frecuente de lo que habitualmente se considera. Algunas series indican que es la patología pediátrica importada más frecuente, afectando a más del 8% de los niños enfermos después de un viaje a áreas endémicas91. Por otro lado, los niños representan entre el 15-20% de todos los casos importados de malaria92,93. Los VFR pediátricos, es decir, los hijos de familias inmigrantes procedentes de áreas endémicas de malaria y que viajan a sus países de origen a visitar a familiares, son considerados el grupo de riesgo más importante para padecer malaria al regreso de sus viajes.
La malaria congénita94, definida como la infección transmitida de forma vertical de una madre embarazada infectada a su recién nacido (sin posibilidad de adquisición vía picadura del mosquito anophelino) es un problema anecdótico en nuestro entorno95.
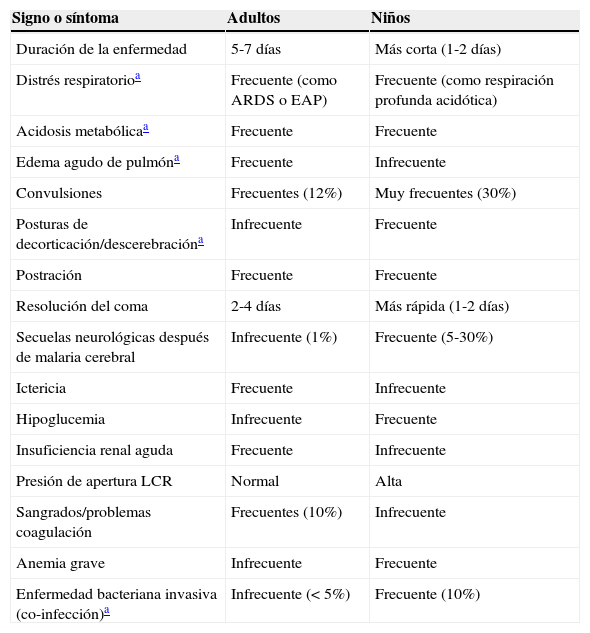
La presentación clínica de la malaria en el niño, y en particular de aquella con síntomas de gravedad, difiere en múltiples aspectos de la del adulto. Asimismo, los factores pronósticos asociados a una mala evolución son diferentes en niños y en adultos.
La tabla 6 resume las principales diferencias clínicas entre adultos y niños, según las más recientes guías del manejo de la malaria publicadas por la OMS96.
Principales diferencias entre adultos y niños en la presentación clínica y la evolución de la malaria grave
| Signo o síntoma | Adultos | Niños |
|---|---|---|
| Duración de la enfermedad | 5-7 días | Más corta (1-2 días) |
| Distrés respiratorioa | Frecuente (como ARDS o EAP) | Frecuente (como respiración profunda acidótica) |
| Acidosis metabólicaa | Frecuente | Frecuente |
| Edema agudo de pulmóna | Frecuente | Infrecuente |
| Convulsiones | Frecuentes (12%) | Muy frecuentes (30%) |
| Posturas de decorticación/descerebracióna | Infrecuente | Frecuente |
| Postración | Frecuente | Frecuente |
| Resolución del coma | 2-4 días | Más rápida (1-2 días) |
| Secuelas neurológicas después de malaria cerebral | Infrecuente (1%) | Frecuente (5-30%) |
| Ictericia | Frecuente | Infrecuente |
| Hipoglucemia | Infrecuente | Frecuente |
| Insuficiencia renal aguda | Frecuente | Infrecuente |
| Presión de apertura LCR | Normal | Alta |
| Sangrados/problemas coagulación | Frecuentes (10%) | Infrecuente |
| Anemia grave | Infrecuente | Frecuente |
| Enfermedad bacteriana invasiva (co-infección)a | Infrecuente (< 5%) | Frecuente (10%) |
ARDS: síndrome del distrés respiratorio del adulto; EAP: edema agudo de pulmón; LCR: líquido cefalorraquídeo.
El pronóstico de los casos de malaria pediátrica importada es generalmente bueno si se diagnostica y trata a tiempo, aunque la poca familiaridad de pediatras y médicos en nuestro entorno con esta enfermedad, así como la poca experiencia en su diagnóstico parasitológico, dificultan su identificación y su tratamiento precoz.
Las consideraciones en el uso de fármacos para la malaria en pediatría se resumen en la tabla 5.
Es importante destacar que las propias guías de tratamiento de la OMS67 no incluyen ningún detalle para el manejo de la malaria importada en pediatría, por lo que las recomendaciones que presentamos se basan en la experiencia a la hora de tratar malaria pediátrica en zonas endémicas.
Las dosis recomendadas en pediatría deben calcularse siempre de forma muy precisa en relación al peso del paciente. Sin embargo, existen en la actualidad muy pocos antimaláricos específicamente formulados para su uso en niños. Muchos de los fármacos utilizados como primera línea para el tratamiento de la malaria en niños solo existen como comprimidos, siendo difícil su uso en niños que no pueden tragar adecuadamente, y siendo complicada también su fragmentación. Sin embargo, recientemente se han comercializado jarabes o formulaciones solubles que permiten una administración más sencilla y un cálculo de la dosis más fino para su administración a niños. Al igual que en los adultos, el artesunato parenteral debe ser la primera línea de elección en casos de malaria grave pediátrica, aunque su limitada disponibilidad en nuestro país implique que la quinina i.v. sea muchas veces una alternativa obligada aunque subóptima.
Algunos fármacos ampliamente usados en el tratamiento de la malaria en adultos, como por ejemplo las tetraciclinas, están contraindicados en niños menores de 8años, debido a sus efectos secundarios en el cartílago de crecimiento y la dentición.
La primaquina, aunque ha demostrado ser segura en niños97, sigue sin estar recomendada por la OMS en niños menores de 4años de edad67. Al igual que en el caso de los adultos, deberá confirmarse previamente que el paciente no es portador de una deficiencia grave de la G6PDH. Cuando no pueda utilizarse la primaquina, deberá explicarse adecuadamente a los familiares del niño que la enfermedad puede recidivar. Finalmente, en los casos de malaria congénita por P.vivax o P.ovale, al ser la transmisión por vía hematógena y por tanto no existir estadios hepáticos en el neonato, no será nunca necesario añadir tratamiento radical con primaquina.
Seguimiento clínico y consejos al altaSe debe realizar un seguimiento clínico, microbiológico y analítico de todos los casos de malaria importada. Una malaria inicialmente no grave puede pasar a presentar criterios de gravedad, especialmente al comienzo del tratamiento y en las infecciones por P.falciparum. Algunas complicaciones en adultos, como el fallo renal o el distrés respiratorio, pueden acontecer varios días tras el inicio del tratamiento, incluso cuando la parasitemia ha disminuido de forma significativa o incluso ha desaparecido. Se debe tener en cuenta que la microscopia es el único método microbiológico fiable para controlar la eficacia del tratamiento. La tabla 7 resume el seguimiento recomendado para pacientes con malaria importada.
Recomendaciones en el seguimiento postratamiento de la malaria importada
| Malaria sin signos de gravedad | El paciente habitualmente presenta una buena evolución clínica y analítica. En líneas generales se recomienda:1. Seguimiento clínico en función de la evolución del paciente2. Examen microscópico de control (gota gruesa) entre el 3.° y el 7.° día. Se recomienda tener al menos una gota gruesa negativa tras el tratamiento. Se considera una malaria resistente al tratamiento si existe persistencia de parásitos a partir del séptimo día tras el inicio del tratamiento3. No existen recomendaciones sobre cuándo realizar otros controles analíticos. Dependerá de la evolución clínica y las alteraciones hematológicas y bioquímicas inicialesLa presencia de gametocitos en la gota gruesa no representa una mala respuesta microbiológica, ya que pueden persistir durante más de un mes después del tratamiento |
| Malaria grave | 1. Seguimiento clínico y analítico diario en una unidad de vigilancia hasta que el paciente presente mejoría clínica, analítica y microbiológica evidente. Control estricto de la glucemia sanguínea2. Microscopia (gota gruesa) diaria hasta que el paciente presente mejoría clínica, analítica y microbiológica evidente |
Si la respuesta clínica y/o microbiológica no es adecuada pero no cumple criterios de malaria grave, se recomienda valorar el cambio de tratamiento a otro con mecanismo de acción diferente y realizar un nuevo ciclo completo o comenzar un tratamiento de malaria grave. También hay que confirmar la correcta administración del tratamiento, interacciones con otros medicamentos o la posibilidad de un diagnóstico incorrecto. En el caso de fracaso terapéutico conviene enviar una muestra microbiológica a centros especializados para estudiar posibles resistencias a los fármacos empleados.
Si reaparece la clínica, especialmente en los primeros 3meses, puede tratarse de una recrudescencia, una recidiva en caso de P.vivax y P.ovale o una infección de otra naturaleza.
En caso de que el paciente haya recibido artesunato i.v., se recomienda hacer un seguimiento de las cifras de hemoglobina hasta las 4semanas del inicio de tratamiento.
Al alta y durante el seguimiento ambulatorio es conveniente insistir en los consejos al viajero para próximos viajes a zonas palúdicas: profilaxis de malaria, protección con repelentes y mosquiteras, actualización de vacunaciones o recomendaciones de alimentación.
FinanciaciónEste trabajo ha recibido financiación de la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI) para las reuniones del grupo de trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos agradecer a la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI) su apoyo en la realización de este trabajo.
En representación del Grupo de Trabajo de Malaria Importada de la Sociedad Española de Medicina Tropical y Salud Internacional (SEMTSI): Edelweiss Aldasoro, Iñaki Alegría, Pilar Aparicio, Quique Bassat, Cristina Carranza, Marta Cereceda, Magda García, Francisco Gimenez, Michele Hernandez, Rogelio Lopez-Velez, María Mallart, Maria Jose Muñoz Vilchez, Jose Muñoz, Israel Molina, Jose Luis Perez Arellano, Jose Antonio Perez Molina, Germán Ramírez-Olivencia, Jose Manuel Ramos Rincon, Gerardo Rojo, Jose Miguel Rubio, Joaquín Salas-Coronas, Diego Torrús Tendero, Begoña Treviño y Pepe Vazquez.