La selección de la fórmula más adecuada en nutrición enteral domiciliaria a largo plazo es un tema controvertido. Nuestro objetivo fue estudiar una fórmula hipercalórica hiperproteica en pacientes con alimentación exclusivamente con sonda a largo plazo (180 días).
MétodosEstudio multicéntrico observacional prospectivo en vida real con fórmula hipercalórica hiperproteica (2kcal/ml y 20% de proteínas). Se recogieron datos generales, antropométricos, analíticos y de calidad de vida mediante escala analógica visual del European Quality of Life-5 Dimensions al inicio, 60, 120 y 180 días. La tolerancia gastrointestinal se evaluó con una escala analógica visual y escala de heces de Bristol y la valoración del riesgo de desnutrición mediante NRS-2002.
ResultadosUn total de 51 pacientes (88,2% varones, edad media de 62,0 años), con patología oncológica en el 72,5%. No hubo diferencias en datos antropométricos, aunque sí se redujo el porcentaje de pacientes con riesgo de desnutrición del 75 al 8,3% (p<0,0001). No se observaron diferencias en albúmina, prealbúmina, transferrina, linfocitos o hematocrito. La calidad de vida mejoró de 3,84 (1,27) a 5,37 (1,12) en la escala analógica visual (p<0,0001). Se observó una reducción de la sintomatología gastrointestinal a lo largo del seguimiento. Tanto el número como el porcentaje de deposiciones consideradas normales según la escala de Bristol se mantuvieron estables.
ConclusiónNuestro estudio apoya que el empleo de fórmulas hipercalóricas hiperproteicas durante un tratamiento nutricional a 6 meses permite una adecuada evolución nutricional sin riesgo de deshidratación y con una buena tolerancia, incluso mejoría de sintomatología gastrointestinal, y puede contribuir a una mejora en la calidad de vida.
The selection of the most appropriate formula in long-term home enteral nutrition is a controversial issue. Our objective was to study a high protein hypercaloric enteral nutrition formula in patients with long-term feeding (180 days).
MethodsProspective observational multicenter real-life study with high-protein hypercaloric formula (2kcal/ml and 20% protein). General, anthropometric, analytical and quality of life data were collected by visual analog scale of the European Quality of Life-5 Dimensions at the beginning, 60, 120 and 180 days. Gastrointestinal tolerance was assessed with a visual analog scale and Bristol Stool Scale and the risk of malnutrition was assessed using NRS-2002.
Results51 patients (88.2% men, mean age 62.0 years), with oncological diseases in 72.5%. No differences in anthropometric data were observed, although the percentage of patients at risk of malnutrition according to NRS 2002 was reduced from 75% to 8.3% (p<0.0001). No differences were observed in albumin, prealbumin, transferrin, lymphocytes or hematocrit. The quality of life improved from 3.84 (1.27) to 5.37 (1.12) on the visual analog scale (p<0.0001). A reduction in gastrointestinal symptoms was observed throughout the period of enteral nutrition. Both the number and percentage of stools considered normal according to the Bristol scale remained stable.
ConclusionOur study supports that the use of high-protein hypercaloric formulas during a 6-month nutritional treatment allows an adequate nutritional evolution without risk of dehydration and with a good tolerance, even improvement of gastrointestinal symptoms, and can contribute to an improvement in the quality of lifetime.
La selección de la fórmula de nutrición enteral más adecuada en nutrición enteral domiciliaria a largo plazo es un tema controvertido. Aunque la mayoría de los pacientes pueden beneficiarse de una fórmula estándar polimérica, normocalórica y normoproteica, preferentemente con fibra, son muchos los estudios que indican que, en situaciones de pacientes críticos, en períodos postoperatorios o en situación de estrés metabólico, las fórmulas hiperproteicas e hipercalóricas mejoran el estado nutricional del paciente, reduciendo el riesgo de desnutrición y mejorando notablemente los parámetros nutricionales y antropométricos1–5. En pacientes pluripatológicos, las actuales recomendaciones nutricionales de 27kcal/kg de peso y más de 1g de proteínas por kg6 pueden ser a veces difíciles de alcanzar con fórmulas estándar. En el caso del paciente en tratamiento nutricional domiciliario a largo plazo podrían existir algunas ventajas del empleo de una fórmula hipercalórica. Por un lado, la mayor concentración de la fórmula podría permitir reducir el volumen administrado y por tanto el tiempo necesario para su administración, lo que facilitaría al paciente y/o cuidador la tarea de la alimentación. Además, el menor volumen podría reducir las molestias gastrointestinales derivadas de la distensión abdominal que podría ser secundaria a un mayor volumen. Sin embargo, el empleo de estas fórmulas podría comprometer una adecuada hidratación del paciente.
Nuestro objetivo fue estudiar la evolución de los parámetros nutricionales y la tolerancia durante el período de consumo de una fórmula de nutrición enteral hipercalórica hiperproteica en pacientes con alimentación exclusivamente con sonda a largo plazo (180 días). Además, como objetivos secundarios nos planteamos analizar la calidad de vida, el efecto sobre el ritmo de deposiciones y la consistencia de las heces.
MetodologíaEstudio multicéntrico observacional prospectivo en vida real de pacientes con prescripción de nutrición enteral de larga duración en domicilio, ya sea a través de sonda de gastrostomía o sonda nasogástrica. Los centros participantes en el estudio recibieron una invitación a participar por parte de la investigadora principal pero no se siguió ningún método de aleatorización al tratarse de un estudio observacional en vida real. A los investigadores colaboradores se les solicitó la inclusión en el estudio de forma consecutiva de todos aquellos pacientes que cumplieran los criterios de inclusión durante el período de estudio (01/04/2016-01/04/2017): mayores de 18 años a los que se prescriba una alimentación vía enteral (por sonda nasogástrica o por gastrostomía) y con una previsión de duración superior a 8 semanas. El paciente o su cuidador principal debía ser capaz de comprender el estudio y tener plena libertad para la participación en este, así como firmar el consentimiento informado. Se excluyeron pacientes embarazadas o con supervivencia estimada inferior a 90 días, presencia de patología intestinal severa, úlcera gástrica, gastritis, diarrea, gastroparesia, vómitos, reflujo gastroesofágico, dolor abdominal, tratamiento con antibióticos en los 7 días anteriores, tratamiento con procinéticos durante la fase de estudio y alergia o intolerancia a alguno de los ingredientes de la fórmula enteral. A cada uno de los pacientes se le prescribió el tratamiento necesario para cubrir sus necesidades energéticas y de macronutrientes según la práctica clínica habitual de los centros participantes. La fórmula hipercalórica hiperproteica empleada para cubrir estas necesidades tenía una densidad calórica de 2kcal/ml y estaba compuesta por un 20% de proteínas (10g/100ml de proteínas lácteas), un 35% de hidratos de carbono (17,5g/100ml dextrinomaltosa) y un 45% de grasas (10g/100ml, aceites vegetales de colza y girasol, MCT y aceite de pescado).
El estudio fue aprobado por el Comité Ético de Investigación Clínica del Complejo Asistencial Universitario de León con fecha 27/10/2015 (número de aprobación 2015/1615) y se solicitó consentimiento informado a todos los participantes o sus responsables legales. Se realizó una predeterminación del tamaño muestral mediante el software Ene3.0. Asumiendo unas pérdidas del 10% de los participantes, se planteó inicialmente el reclutamiento de un total de 30 pacientes.
Se realizó un cuaderno de recogida de datos (CRD) en papel para el registro de los datos. Una vez obtenido el consentimiento informado del participante y comprobados los criterios de inclusión y exclusión, se recogieron en la visita de reclutamiento en el CRD de forma disociada los datos de filiación (edad y sexo), motivo de prescripción de nutrición enteral y dosis y vía de administración, características antropométricas iniciales (talla, peso, cambio de peso en los 3 meses anteriores al reclutamiento, circunferencia braquial y de pantorrilla) e índice de Barthel sobre actividades básicas de la vida diaria7. Se recogieron determinaciones analíticas de albúmina, prealbúmina, transferrina, linfocitos, hemoglobina y hematocrito según las determinaciones habituales de cada centro participante. Para la valoración de la calidad de vida se utilizó la escala analógica visual contenida en el European Quality of Life-5 Dimensions (EQ-5D)8.
Las visitas sucesivas se llevaron a cabo en condiciones de práctica clínica habitual a los 60, 120 y 180 días del inicio del tratamiento. Se recogieron en dichas visitas los mismos datos antropométricos, de calidad de vida y bioquímicos. La tolerancia gastrointestinal se evaluó con una prueba de percepción subjetiva (escala analógica visual) donde se puntúa el grado de sintomatología gastrointestinal de 0 (ausente) a 4 (muy severo) para los siguientes síntomas: náuseas, vómitos, regurgitación, estreñimiento, diarrea, flatulencia, distensión abdominal y dolor abdominal. Se consideraron leves si el síntoma estaba presente pero no era molesto; moderado si el síntoma era frecuentemente molesto, pero no interfería con las actividades cotidianas o el sueño; severo cuando era suficientemente molesto para interferir con las actividades cotidianas o el sueño, y muy severo cuando requería atención médica. Se registró el número y tipo de deposiciones realizadas, clasificadas mediante la Escala de heces de Bristol, considerándose normales los tipos 4 y 59. La valoración del riesgo de desnutrición se realizó mediante la escala NRS-200210.
Todos los datos se registraron en una base de datos creada únicamente para el estudio en ACCESS-SQL 2010. El análisis de datos solo se ha realizado para los datos existentes, sin realizar ninguna sustitución de datos faltantes. El análisis estadístico se llevó a cabo mediante el programa estadístico SPSS versión 24. Se han utilizado los estadísticos de tendencia central para describir las variables (media, desviación típica, intervalos de confianza al 95%, mínimo y máximo) ya que las pruebas de normalidad de los datos han indicado que los datos se distribuyen según una distribución normal (pruebas de Kolmogorov-Smirnov y Shapiro-Wilk). Para evaluar si existían diferencias significativas durante el período de tratamiento (visitas 1, 2, 3 y 4) se ha utilizado un modelo lineal mixto para medidas repetidas. El nivel de significación utilizado ha sido del 5% (p<0,05).
ResultadosSe reclutaron 51 pacientes, 6 mujeres (11,8%) y 45 varones (88,2%), con un índice de Barthel medio inicial de 48,8 (desviación estándar [DE] 46,3). Todos los pacientes reclutados inicialmente finalizaron la totalidad de visitas del estudio. La patología oncológica fue el principal motivo de indicación en el 72,5% de los casos (37 pacientes) y los 14 pacientes restantes presentaban enfermedades neurológicas. Solo 4 pacientes tenían una sonda nasogástrica y en el 92,2% la nutrición se administró a través de una gastrostomía. La fórmula más habitualmente empleada contenía fibra (1,5g/100ml) en el 82,4% de los casos y en 9 pacientes se eligió el equivalente sin fibra, a criterio del médico responsable.
La edad media de los pacientes que recibieron el tratamiento nutricional fue de 62,0 años (DE 13), con un peso inicial de 68,3kg (DE 12,5) e índice de masa corporal medio de 24,0kg/m2 (DE 3,6). La pérdida de peso media en los 3 meses previos había sido de 5,5kg (DE 5,9), lo que significaba un 7,4% del peso inicial (DE 6,0). La circunferencia del brazo fue 27,0cm (DE 6,6) y la de la pantorrilla 33,8cm (DE 8,4).
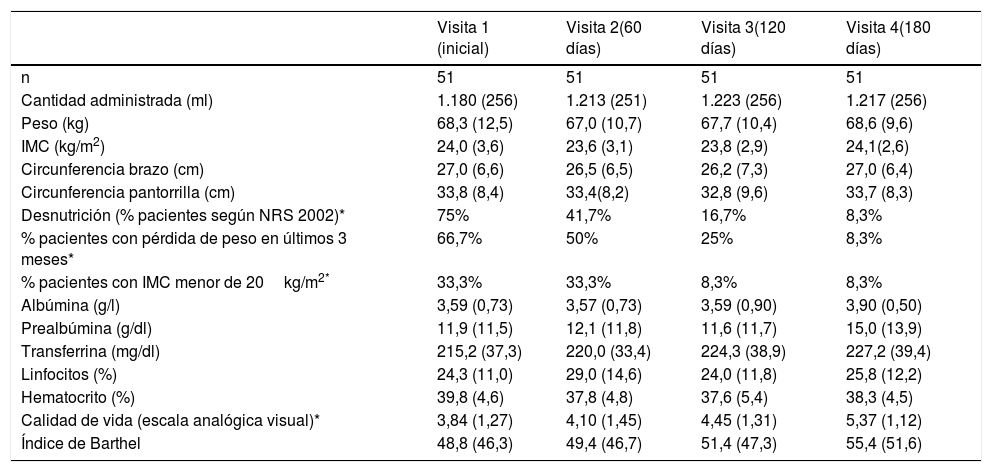
La cantidad de nutrición administrada a lo largo del seguimiento se recoge en la tabla 1. Los pacientes recibieron como media 31,9-32,8-33,1-32,9kcal/kg/día en cada una de las visitas, sin diferencias significativas. No se observaron diferencias estadísticamente significativas y clínicamente relevantes en los datos antropométricos a lo largo del seguimiento (tabla 1), aunque sí se redujo el porcentaje de pacientes con riesgo de desnutrición según la escala NRS 2002 (p<0,0001). En la evolución en parámetros bioquímicos, no se observaron diferencias significativas a lo largo del seguimiento en los datos relativos a albúmina, prealbúmina, transferrina, linfocitos o hematocrito.
Evolución de parámetros clínicos, antropométricos y bioquímicos
| Visita 1 (inicial) | Visita 2(60 días) | Visita 3(120 días) | Visita 4(180 días) | |
|---|---|---|---|---|
| n | 51 | 51 | 51 | 51 |
| Cantidad administrada (ml) | 1.180 (256) | 1.213 (251) | 1.223 (256) | 1.217 (256) |
| Peso (kg) | 68,3 (12,5) | 67,0 (10,7) | 67,7 (10,4) | 68,6 (9,6) |
| IMC (kg/m2) | 24,0 (3,6) | 23,6 (3,1) | 23,8 (2,9) | 24,1(2,6) |
| Circunferencia brazo (cm) | 27,0 (6,6) | 26,5 (6,5) | 26,2 (7,3) | 27,0 (6,4) |
| Circunferencia pantorrilla (cm) | 33,8 (8,4) | 33,4(8,2) | 32,8 (9,6) | 33,7 (8,3) |
| Desnutrición (% pacientes según NRS 2002)* | 75% | 41,7% | 16,7% | 8,3% |
| % pacientes con pérdida de peso en últimos 3 meses* | 66,7% | 50% | 25% | 8,3% |
| % pacientes con IMC menor de 20kg/m2* | 33,3% | 33,3% | 8,3% | 8,3% |
| Albúmina (g/l) | 3,59 (0,73) | 3,57 (0,73) | 3,59 (0,90) | 3,90 (0,50) |
| Prealbúmina (g/dl) | 11,9 (11,5) | 12,1 (11,8) | 11,6 (11,7) | 15,0 (13,9) |
| Transferrina (mg/dl) | 215,2 (37,3) | 220,0 (33,4) | 224,3 (38,9) | 227,2 (39,4) |
| Linfocitos (%) | 24,3 (11,0) | 29,0 (14,6) | 24,0 (11,8) | 25,8 (12,2) |
| Hematocrito (%) | 39,8 (4,6) | 37,8 (4,8) | 37,6 (5,4) | 38,3 (4,5) |
| Calidad de vida (escala analógica visual)* | 3,84 (1,27) | 4,10 (1,45) | 4,45 (1,31) | 5,37 (1,12) |
| Índice de Barthel | 48,8 (46,3) | 49,4 (46,7) | 51,4 (47,3) | 55,4 (51,6) |
* p<0,0001; en el resto de las variables no se encontraron diferencias estadísticamente significativas.
Respecto a la calidad de vida, parece mejorar a lo largo del tratamiento nutricional (tabla 1) según los datos de la puntuación obtenida en la escala analógica visual. La diferencia es estadísticamente significativa entre la visita inicial y la final (p<0,0001).
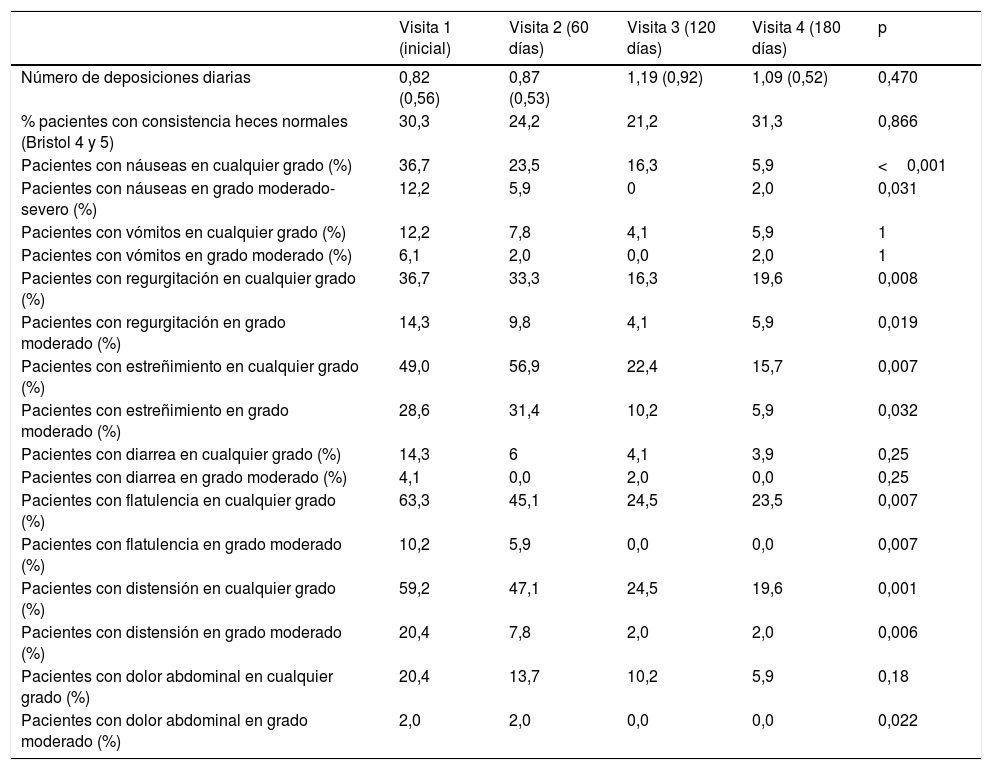
Respecto a la sintomatología gastrointestinal, no se describieron problemas severos ni muy severos en ninguno de los pacientes, y se reseñan en la tabla 2, tanto el porcentaje total de pacientes con síntomas como aquellos con síntomas moderados o moderados-severos. El número de deposiciones diarias se mantuvo estable a lo largo de todo el período de estudio, alrededor de una deposición al día. El porcentaje de pacientes con heces consideradas normales en la escala de Bristol no varió tampoco de forma significativa. Se observó una reducción estadísticamente significativa de la sintomatología gastrointestinal a lo largo del período de nutrición enteral en lo referido a náuseas, regurgitación, estreñimiento, flatulencia, distensión y dolor, pero no se observaron cambios en vómitos ni diarrea. Hubo una tendencia a reducción de dolor abdominal, que fue significativa en aquellos con sintomatología moderada.
Síntomas gastrointestinales
| Visita 1 (inicial) | Visita 2 (60 días) | Visita 3 (120 días) | Visita 4 (180 días) | p | |
|---|---|---|---|---|---|
| Número de deposiciones diarias | 0,82 (0,56) | 0,87 (0,53) | 1,19 (0,92) | 1,09 (0,52) | 0,470 |
| % pacientes con consistencia heces normales (Bristol 4 y 5) | 30,3 | 24,2 | 21,2 | 31,3 | 0,866 |
| Pacientes con náuseas en cualquier grado (%) | 36,7 | 23,5 | 16,3 | 5,9 | <0,001 |
| Pacientes con náuseas en grado moderado-severo (%) | 12,2 | 5,9 | 0 | 2,0 | 0,031 |
| Pacientes con vómitos en cualquier grado (%) | 12,2 | 7,8 | 4,1 | 5,9 | 1 |
| Pacientes con vómitos en grado moderado (%) | 6,1 | 2,0 | 0,0 | 2,0 | 1 |
| Pacientes con regurgitación en cualquier grado (%) | 36,7 | 33,3 | 16,3 | 19,6 | 0,008 |
| Pacientes con regurgitación en grado moderado (%) | 14,3 | 9,8 | 4,1 | 5,9 | 0,019 |
| Pacientes con estreñimiento en cualquier grado (%) | 49,0 | 56,9 | 22,4 | 15,7 | 0,007 |
| Pacientes con estreñimiento en grado moderado (%) | 28,6 | 31,4 | 10,2 | 5,9 | 0,032 |
| Pacientes con diarrea en cualquier grado (%) | 14,3 | 6 | 4,1 | 3,9 | 0,25 |
| Pacientes con diarrea en grado moderado (%) | 4,1 | 0,0 | 2,0 | 0,0 | 0,25 |
| Pacientes con flatulencia en cualquier grado (%) | 63,3 | 45,1 | 24,5 | 23,5 | 0,007 |
| Pacientes con flatulencia en grado moderado (%) | 10,2 | 5,9 | 0,0 | 0,0 | 0,007 |
| Pacientes con distensión en cualquier grado (%) | 59,2 | 47,1 | 24,5 | 19,6 | 0,001 |
| Pacientes con distensión en grado moderado (%) | 20,4 | 7,8 | 2,0 | 2,0 | 0,006 |
| Pacientes con dolor abdominal en cualquier grado (%) | 20,4 | 13,7 | 10,2 | 5,9 | 0,18 |
| Pacientes con dolor abdominal en grado moderado (%) | 2,0 | 2,0 | 0,0 | 0,0 | 0,022 |
Los estudios que valoran la eficacia y la tolerancia de la nutrición enteral a largo plazo en adultos son escasos, por lo que resulta difícil tener datos para hacer una selección de la fórmula enteral a largo plazo basada en la evidencia. Es más, en la práctica clínica real en pacientes con nutrición domiciliaria, las fórmulas hipercalóricas se han visto a menudo con recelo por algunos profesionales por el miedo a una peor tolerancia digestiva y a que pudieran repercutir de forma negativa en el estado de hidratación de los pacientes con nutrición enteral exclusiva a largo plazo.
Aunque la mayoría de los pacientes podría beneficiarse de una fórmula estándar polimérica, normocalórica y normoproteica, preferentemente con fibra, las fórmulas hipercalóricas hiperproteicas podrían ayudar a cubrir de forma más adecuada los requerimientos nutricionales de los pacientes. En pacientes pluripatológicos, las actuales recomendaciones nutricionales de 27kcal/kg de peso y más de 1g de proteínas por kg6 pueden ser a veces difíciles de alcanzar con fórmulas estándar. Además, la mayor concentración de la fórmula podría permitir reducir el volumen administrado y por tanto el tiempo necesario para su administración, lo que facilitaría al paciente y/o cuidador la tarea de la alimentación. Por otra parte, el menor volumen podría reducir las molestias gastrointestinales derivadas de la distensión abdominal que pudiera ser secundaria a un mayor volumen.
El objetivo de nuestro estudio fue valorar en condiciones de práctica clínica real tanto la efectividad de una fórmula hipercalórica hiperproteica, en lo referido a la evolución de los parámetros nutricionales y de resolución de la desnutrición, como la seguridad, valorando la tolerancia durante el período de consumo y el riesgo de deshidratación valorado por los cambios en el hematocrito. Los pacientes incluidos fueron aquellos con alimentación enteral exclusivamente con sonda a largo plazo (180 días).
Los datos más recientes de nutrición enteral domiciliaria en nuestro país, correspondientes al registro NADYA11, recogen una población algo más anciana que la nuestra (71 vs. 62 años). La causa de nutrición enteral más frecuente en NADYA fue la enfermedad neurológica que cursa con afagia o disfagia severa (59%), a diferencia de nuestra serie, en la que patología oncológica fue el principal motivo de indicación en el 72,5% de los casos. Esta diferencia en indicación podría explicar una menor edad de nuestros pacientes. El dato más relevante en nuestra serie en lo referente a la efectividad de la nutrición enteral es que se observa una reducción estadísticamente significativa y clínicamente muy relevante del porcentaje de pacientes que se consideran en riesgo de desnutrición según NRS 2002, con un descenso del 75 al 8,3%. Este dato se corresponde con una reducción paralela en el porcentaje de pacientes con pérdida de peso en los 3 meses anteriores y de IMC inferior a 20kg/m2. Estos puntos son los recogidos como criterios fenotípicos, junto con la pérdida de masa muscular, en el reciente consenso GLIM de diagnóstico de desnutrición12, aunque nuestro estudio no ha podido recoger diagnóstico de desnutrición según GLIM puesto que los datos se recogieron con anterioridad al consenso y no se valoró la masa muscular.
Los parámetros bioquímicos estudiados se mantuvieron estables a lo largo del seguimiento, con discreto aumento no significativo de los niveles de prealbúmina que podrían orientar también a una mejoría nutricional. Consideramos muy relevante la estabilidad en los niveles de hematocrito de los pacientes, ya que fue el parámetro elegido para valorar una posible deshidratación. Aunque los datos sobre deshidratación en pacientes con nutrición enteral a largo plazo son escasos, una publicación americana13 ha detectado que un 37% de pacientes requieren ingreso por deshidratación o desnutrición durante el tratamiento con nutrición enteral, lo que no se corresponde con nuestras observaciones. Podemos decir por tanto que en nuestra serie el uso de una fórmula hipercalórica no favorece la deshidratación de los pacientes, pero sí contribuye a la mejoría de su situación nutricional y a evitar la desnutrición.
El hecho de que los pacientes mejoren su estatus nutricional con una nutrición enteral exclusiva y que no hayamos tenido ninguna pérdida de pacientes por discontinuación de la fórmula nos orienta a que la tolerancia global a lo largo de los 6 meses de seguimiento ha tenido que ser necesariamente buena. La valoración realizada de la sintomatología gastrointestinal confirma esta favorable impresión. No se describieron problemas severos ni muy severos en ninguno de los pacientes y hubo una reducción estadísticamente significativa de la sintomatología gastrointestinal a lo largo del período de 6 meses de nutrición enteral en lo referido a náuseas, regurgitación, estreñimiento, flatulencia, distensión y dolor. La incidencia de diarrea también se redujo, aunque sin alcanzar significación estadística. Tanto el número como el porcentaje de deposiciones consideradas normales según la escala de Bristol se mantuvieron estables al inicio y a los 6 meses del tratamiento nutricional.
La valoración de la calidad de vida de los pacientes durante el tratamiento con nutrición enteral nos parece un dato relevante de nuestro estudio. La escala analógica visual evidenció una mejoría significativa, y aunque los datos globales no son buenos, como podríamos esperarnos en pacientes con estas características, mayoritariamente oncológicos y sin posibilidad de ingesta oral, la puntuación aumentó de un 3,84 a un «aprobado» de 5,37 puntos sobre 10.
La limitación más importante de nuestro estudio es que se trata de un diseño observacional prospectivo sin grupo control. Sería interesante haber podido comparar si la mejoría nutricional y la tolerancia hubieran sido similares o no empleando una fórmula estándar. Otra limitación relacionada con la valoración de la calidad de vida tiene que ver con el hecho de haber utilizado una herramienta general, como la escala analógica visual del EuroQol. Aunque el empleo de cuestionarios específicos como NutriQoL14 podría haber sido interesante, se consideró que hubiera requerido de mayor tiempo en la consulta, por lo que se optó por una alternativa más rápida, dado que no era el objetivo primario de nuestro estudio. Por otra parte, consideramos fortalezas el hecho de haber sido realizado de forma multicéntrica y en condiciones de vida real y que todos los pacientes que iniciaron el tratamiento nutricional lo mantuvieron a lo largo de los 6 meses de observación. En nuestro conocimiento, es el único estudio de estas características publicado en la literatura, puesto que el único estudio similar encontrado se realizó con mucho menor tiempo de seguimiento (8 semanas)15, incluyó tanto pacientes ambulatorios como hospitalizados, y no valoró la calidad de vida.
En conclusión, nuestro estudio apoya que el empleo de fórmulas hipercalóricas hiperproteicas, mayoritariamente con fibra, durante un tratamiento nutricional a 6 meses permite una adecuada evolución nutricional sin riesgo de deshidratación y con una buena tolerancia, incluso mejoría de sintomatología gastrointestinal, y puede contribuir a una mejora en la calidad de vida.
FinanciaciónEl presente estudio ha sido financiado por Fresenius Kabi España para el análisis estadístico de los datos y el coste de publicación.
Conflicto de interesesMaría D. Ballesteros Pomar ha recibido honorarios por conferencias, consultoría o estudios de investigación de Fresenius Kabi, Nestlé Health Science, Abbot Nutrition, Nutricia y Vegenat. Patricia Sorribes Carreras ha recibido honorarios por ponencias de Fresenius Kabi en disfagia. No tiene conflicto de intereses en Nutrición. María Amparo Rodríguez Piñera ha recibido honorarios por estudios clínicos promovidos por Fresenius Kabi España. Antonio José Blanco Orenes ha participado en conferencias con Novartis Farnaceutica SA, Laboratorios Rovi SA, Pfizer, Fresenius Kabi España. Laura Calles Romero ha recibido honorarios por realización de charlas, colaboraciones y proyectos de investigación de Abbott, Fresenius Kabi España, Nestlé Healths Science, Nutricia, Persan y Adventia. Natalia C. Iglesias Hernández ha recibido honorarios por ponencias de Nestlé Healths Science, Takeda (antigua Shire), Fresenius Kabi España y Nutricia. Además, ha participado como consultora y colaboradora en estudios de las casas anteriormente mencionadas y de Abbott Nutrición y Persan Farma. M. Teresa Olivan Usieto no tiene conflicto de intereses en Nutrición. Francisca Payeras Mas ha recibido honorarios por ponencias de Astra Zeneca, Boehringer Ingelheim,Fresenius Kabi, Lilly, NovoNordisk, Sanofi; Testimonio de experto remunerado NovoNordisk y una beca de Astra Zeneca. Margarita Viñuela Benéitez ha participado en ensayos clínicos y ha realizado artículos de revisión financiados por Fresenius-Kabi. También ha asistido a actividades formativas organizadas por Abbott. Ha participado como ponente en actividades formativas y asistido a eventos científicos internacionales financiados por Nestlé. María Merino Viveros ha participado como colaboradora en estudios para Fresenius Kabi España. Cristina Navea Aguilera ha participado en estudios financiados por Fresenius-Kabi y como ponente en actividades formativas financiadas por Nestlé. Josefina Olivares ha participado en ensayos clínicos para NovoNordisk, Lilly, Boringher (Diabetes).