La pancreatitis crónica ha mantenido durante muchos años una categorización excesivamente simplificada atendiendo a su etiología alcohólica (60-80% de los casos según las series publicadas) o no alcohólica (20-40% restante). El reconocimiento del tabaco como un importante factor de riesgo y la creciente identificación de factores de susceptibilidad genética han obligado a variar los anteriores porcentajes y han hecho entender la enfermedad como un complejo proceso multifactorial. Mutaciones en los genes PRSS1, SPINK1 y CFTR se han confirmado como importantes factores de riesgo, mientras que mutaciones en CTRC y CASR se consideran factores de menor riesgo para el desarrollo de pancreatitis crónica. Estas variantes genéticas se expresan en pacientes con pancreatitis crónica en una proporción mucho mayor que la ocurrida por azar. La combinación transheterocigota multiplica el riesgo de pancreatitis crónica y demuestra el grado de complejidad de los mecanismos etiopatogénicos de la enfermedad. La obstrucción ductal y la autoinmunidad son otras causas importantes de pancreatitis crónica que precisan otra revisión aparte. Este artículo revisa los últimos estudios que evalúan la participación del alcohol y el tabaco en la pancreatitis crónica y los hallazgos genéticos más significativos.
For many years, the classification of chronic pancreatitis has been oversimplified according to whether the cause is alcoholic (60-70% of cases according to published series) or non-alcoholic (20-40% of the remaining cases). Recognition of smoking as an important risk factor and increasing identification of factors of genetic susceptibility have placed these percentages in doubt and have led to a reconceptualization of the disease as a multifactorial process. Mutations in the PRSS1, SPINK1 and CFTR genes have been confirmed as major risk factors, while mutations in the CTRC and CASR genes are considered lesser risk factors for the development of chronic pancreatitis. These genetic variants are expressed in a much higher percentage of patients with chronic pancreatitis than could be expected by chance. The trans-heterozygous combination multiplies the risk of chronic pancreatitis and demonstrates the degree of complexity of the etiopathogenic mechanisms of the disease. Ductal obstruction and autoimmunity are other important etiologic factors of chronic pancreatitis that need a specific review. The present article reviews the latest studies evaluating the role of alcohol and smoking in chronic pancreatitis and the most significant genetic factors.
La pancreatitis crónica es un proceso inflamatorio del páncreas que conduce a una destrucción morfológica y funcional progresiva de la glándula. El dolor abdominal es el síntoma principal, el cual puede ser de intensidad, frecuencia y duración muy variable. La esteatorrea y la diabetes mellitus son consecuencias clínicas de estadios más avanzados. En un número reducido de pacientes la enfermedad se presenta como un proceso indoloro con manifestaciones propias de una fase tardía. Es de gran importancia identificar factores asociados al desarrollo de la pancreatitis crónica, ya que la etiología puede ser determinante en el curso de la enfermedad. La clasificación TIGAR-O1 (tabla 1) se estableció como sistema para facilitar una búsqueda de factores asociados mediante la siguiente categorización: 1) Tóxico-metabólicos; 2) Idiopáticos; 3) Genéticos; 4) Autoinmunes; 5) pancreatitis Recurrentes, y 6) Obstructivos. Entre todos ellos, el alcohol ha sido considerado durante mucho tiempo el factor etiológico más importante. Sin embargo, los estudios actuales demuestran que el alcohol por sí solo supone un riesgo marginal para desarrollar pancreatitis crónica, y que es necesaria la combinación de factores ambientales y/o genéticos para que la enfermedad se desarrolle. La pancreatitis autoinmune y la neoplasia papilar mucinosa intraductal son entidades que pueden evolucionar a pancreatitis crónica y cuya identificación puede ser compleja y a menudo no sospechada. La revisión de estas 2 enfermedades merece sin embargo un capítulo aparte. En este artículo revisaremos las novedades en torno al alcohol, el tabaco y los aspectos genéticos en la pancreatitis crónica. (fig. 1)
Factores de riesgo etiológicos asociados a la pancreatitis crónica: sistema de clasificación TIGAR-O
| Tóxico-metabólicos |
| Alcohol |
| Tabaco |
| Hipercalcemia |
| Hiperlipidemia (controvertido) |
| Insuficiencia renal crónica |
| Fármacos |
| Tóxicos |
| Idiopáticos |
| Inicio precoz |
| Inicio tardío |
| Tropical |
| Otros |
| Genéticos |
| PRSS1, PRSS2 |
| SPINK1 |
| CFTR |
| CASR |
| CTRC |
| Autoinmune |
| Pancreatitis autoimmune tipos I y II |
| Recurrente y pancreatitis aguda grave |
| Pancreatitis aguda posnecrótica |
| Pancreatitis aguda recurrente |
| Enfermedad vascular/isquemia |
| Post-irradiación |
| Obstructiva |
| Páncreas divisum |
| Disfunción del esfínter de Oddi (controvertido) |
| Obstrucción ductal (por ejemplo, tumor) |
| Lesiones periampulares |
| Lesiones postraumáticas |
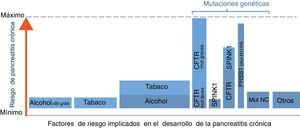
Implicación de diferentes factores de riesgo en la pancreatitis crónica (PC). Este gráfico ilustra una aproximación de la contribución relativa de los principales factores de riesgo conocidos en el desarrollo de la PC. El ancho de las columnas refleja la proporción de pacientes con PC que presenta el factor de riesgo indicado, y la altura el riesgo de desarrollar PC. Por ejemplo, la combinación de alcohol y tabaco es la causa más frecuente en estos enfermos, aunque la probabilidad de desarrollar PC en pacientes que fuman y beben alcohol es baja (1-3% de alcohólicos desarrollan PC). En el extremo contrario está la mutación R117H, las cual es muy poco prevalente en pacientes con PC en nuestro medio pero su existencia determina el desarrollo de la enfermedad en la mayoría de casos. Mut: mutaciones; NC: no conocidas. *Otros: neoplasias quísticas, pancreatitis autoimmune, fármacos, etc. (véase tabla 1).
Tradicionalmente se ha trazado una división elemental entre pancreatitis crónica alcohólica y no alcohólica. La mayoría de estudios epidemiológicos llevados a cabo entre 1960 y 20002–6 situaron al alcohol como la principal causa de esta enfermedad al concluir que el 70-80% de los pacientes eran consumidores de bebidas alcohólicas. Los casos restantes (pancreatitis no alcohólicas) son en su mayoría catalogados de idiopáticos (20-30% de las pancreatitis crónicas) y en un pequeño porcentaje (5-6% de las pancreatitis) distribuidos entre causas minoritarias, como fármacos, hiperlipidemia, páncreas divisum, etc. Durante las 2 últimas décadas ha habido aportaciones científicas decisivas que han causado una redistribución de los porcentajes etiológicos de la pancreatitis crónica. El tabaco7 y las alteraciones genéticas8–10 se han incorporado como factores de riesgo cardinales en la pancreatitis crónica, lo cual ha restado protagonismo al alcohol y ha permitido reducir la proporción de pancreatitis idiopáticas. Por otro lado, la simplificación dicotómica de la pancreatitis crónica entre alcohólica y no alcohólica se ha visto desplazada por una noción más compleja de la enfermedad basada en necesidad de la interacción de varios factores de riesgo para que la enfermedad progrese11–14. Esta interpretación plurifactorial podría dar respuesta a cuestiones intrigantes, como por qué solo una minoría de sujetos enólicos desarrollan pancreatitis crónica o por qué la mayoría de pacientes con páncreas divisum no presentan pancreatitis. En verdad, la pancreatitis crónica enólica es una enfermedad poco frecuente, si se tiene en cuenta que solo entre el 1 y el 3% de los sujetos alcohólicos desarrollarán pancreatitis crónica15–17. Este riesgo aumenta con la adición del tabaco18 y posiblemente con factores genéticos predisponentes todavía no identificados.
En esta última década se han publicado estudios epidemiológicos que han sido determinantes en la redistribución etiológica de la pancreatitis crónica. En 2008 y 2009, 3 estudios17,19,20 que incluyeron un gran número de casos concluyeron que el alcohol es la causa del 34-44% de los casos de pancreatitis crónica (a diferencia del 70-90% descrito clásicamente). Estos trabajos establecen que es necesario un consumo diario mínimo de 4 o 5 bebidas alcohólicas (> 60g alcohol al día) para poder considerarlo un factor etiológico. El estudio North American Pancreatic Study 2 (NAPS2)19 evaluó 540 pacientes con pancreatitis crónica procedentes de 20 centros entre 2000 y 2006 e identificó el alcohol como factor etiológico (único o asociado a otro factor) en el 44% de los pacientes. En este estudio el análisis de regresión logística demostró que el alcohol es un factor de riesgo independiente de la edad, sexo, índice de masa corporal y tabaco únicamente cuando el consumo es superior a 5 bebidas de alcohol (unos 12g por bebida) al día. En 2008 un estudio danés publicó datos similares a los del estudio NAPS217. Este trabajo realizado en 17.905 individuos seguidos durante 20 años demuestra que existe una asociación lineal entre el consumo de alcohol y pancreatitis (aguda o crónica), y establece la necesidad de un consumo≥35 bebidas alcohólicas a la semana (igual a las 5 bebidas al día del estudio NAPS). El estudio italiano20 seleccionó 893 pacientes con pancreatitis crónica procedentes de 21 centros y llegó a la conclusión que el alcohol es el factor etiológico único en el 34% de los casos.
Según estos estudios el consumo de alcohol entre los pacientes con pancreatitis crónica es mucho más variable de lo que hasta ahora se había considerado. Ello traduce que hay muchos casos de pancreatitis catalogada de enólica aun cuando el consumo de alcohol no llega a niveles de riesgo. Por ello, la idea no debe ser si el paciente bebe o no bebe alcohol, sino cuánto bebe. Si aplicamos los 60g de alcohol como el umbral mínimo necesario para desarrollar pancreatitis, la etiología enólica de la pancreatitis será en muchos casos cuestionada. Sin embargo, la interpretación se hace más compleja si consideramos que tabaco y otros factores de riesgo pueden estar disminuyendo el umbral de riesgo del alcohol. Una manera simplificada para interpretar qué valor tiene el alcohol en la pancreatitis crónica es estratificar su consumo en nulo o bajo, medio o importante7. Con esta regla, el alcohol puede ser considerado el factor dominante cuando su consumo excede 35 bebidas alcohólicas semanales (o 60g de alcohol al día), en tanto que no tiene ningún papel en los pacientes con un consumo bajo. Si el consumo es intermedio el alcohol debería contemplarse en relación con otros factores ambientales (por ejemplo, tabaco) y/o genéticos.
TabacoEl hecho de que la mayoría de sujetos bebedores sean también fumadores ha supuesto una limitación para determinar la representación del tabaco en la pancreatitis crónica y para definir una cifra de pancreatitis crónica causada por el tabaco. No obstante, diversos trabajos han demostrado que el tabaco es una causa mayor de pancreatitis crónica18,19,21–24. Algunos autores han definido que el riesgo atribuible del tabaco en la pancreatitis aguda se sitúa en el 25-41%21,24 aunque son necesarios más estudios para poder definir esta cifra con seguridad. El consumo de tabaco representa un factor de riesgo independiente y dosis dependiente para el desarrollo de pancreatitis crónica y acelera la progresión de la pancreatitis crónica alcohólica18. Un estudio realizado en una serie de casos y controles (540 pacientes con pancreatitis crónica, 460 con pancreatitis aguda recurrente y 695 controles sanos) demostró que la odds ratio (OR) de pancreatitis crónica en fumadores de<12, 12-35 y>35 paquetes/año es de 1,34, 2,15 y 4,45, respectivamente, en comparación con los individuos que nunca han fumado19. Un estudio prospectivo que incluyó 17.905 participantes seguidos durante 20,2 años observó que el riesgo de pancreatitis se correlaciona con la cantidad de tabaco consumida (riesgo × 2,5 en fumadores de 15-24g/día y de × 3,3 en fumadores de≥25g/día, respecto a los individuos no fumadores)21. A pesar de que la asociación de pancreatitis crónica en fumadores es un hecho confirmado, cabe destacar que todavía existe una clara tendencia a infravalorar el tabaco en la anamnesis de estos pacientes25.
Aspectos genéticos de la pancreatitis crónicaLa genética se ha establecido como un pilar fundamental en la interpretación de la pancreatitis aguda recurrente y de la pancreatitis crónica (2 procesos por cierto difíciles de separar). A lo largo de estos últimos años se han reconocido diversas mutaciones y polimorfismos genéticos asociados a un riesgo variable de pancreatitis. Las mutaciones que confieren mayor peligro de pancreatitis se han identificado en los genes del tripsinógeno catiónico (PRSS1)26, en el inhibidor de la tripsina pancreática (SPINK1, serin protease inhibitor Kazal type 1)27 y en el gen de la fibrosis quística (CFTR, cystic fibrosis transmembrane conductance regulator)28,29. Las mutaciones descritas en los genes del quimiotripsinógeno C (CTRC, chymotrypsin C)30 y en el receptor sensor del calcio (CASR, calcium sensing receptor)31 corresponden a variantes de menor riesgo. Se han descrito otros candidatos genéticos cuya participación real en la pancreatitis no se ha llegado a confirmar.
La búsqueda de mutaciones ha permitido identificar una base genética alterada en una proporción importante de pacientes con pancreatitis crónica etiquetada de «idiopática». En términos globales, el 30-45% de pacientes con pancreatitis idiopática (crónica o recurrente) son portadores de al menos una variante genética de riesgo, que por orden de más a menos frecuentes corresponden en nuestro medio a mutaciones del CFTR, SPINK1 y PRSS132–35. Es muy posible que el resto de pancreatitis idiopáticas sean portadores de otras modificaciones genéticas aún no conocidas.
El componente genético de la pancreatitis crónica muestra un patrón de herencia muy variable que en pocos casos se ajusta a normas mendelianas. En el extremo de máxima asociación genotípica-fenotípica se sitúan las mutaciones más comunes del PRSS1, cuya herencia autosómica dominante con penetrancia casi completa es la causa mayoritaria de pancreatitis hereditaria. En el rango intermedio se hallan las mutaciones de CFTR, con un patrón de herencia no mendeliano y un riesgo asociado de pancreatitis moderado. En el extremo con menor representación fenotípica se encuentran las asociaciones de riesgo sutil y polimorfismos genéticos modificadores, como son las mutaciones del CTRC (chymotrypsinC), del CASR (calcium sensing receptor) y del PRSS2 (tripsinógeno aniónico), las cuales es posible que actúen en combinación con factores medioambientales o con otras alteraciones genéticas aun no identificadas. Las mutaciones de SPINK1 se situarían en la transición entre riesgo moderado y factor modificador.
PRSS1La mutación p.R122H en el gen del tripsinógeno catiónico (PRSS1) fue descrita en 1996 como la primera variante genética asociada a pancreatitis crónica26. Esta mutación se identificó en todos los miembros afectados de 5 familias con pancreatitis hereditaria y no en los 141 sujetos controles. La pancreatitis hereditaria es una condición autosómica dominante que representa el 2-3% de las pancreatitis crónicas y cuyo diagnóstico requiere la existencia de pancreatitis recurrente o pancreatitis crónica en al menos 2 familiares de primer grado o en 3 o más familiares de segundo grado, en 2 o más generaciones, sin evidencia de otros factores precipitantes. Si no se cumplen estos criterios, pero existe más de un familiar afectado, se clasifica como pancreatitis familiar. Sin embargo, algunos autores aceptan criterios menos estrictos y establecen el diagnóstico de pancreatitis hereditaria cuando en ausencia de otras causas el paciente tiene un familiar de primer o segundo grado con pancreatitis crónica.
La mutación p.N29I es la segunda mutación en frecuencia después de la p.R122H. Se han identificado más de 20 mutaciones en el gen del PRSS1 (disponibles en www.uni-leipzig.de/pancreasmutation) tanto en familias con sospecha de pancreatitis hereditaria como en pacientes sin historia familiar de pancreatitis crónica. La repercusión clínica de las variantes identificadas es en muchos casos desconocida y en algunos casos se sabe que está en función del grado de penetrancia y de sus consecuencias sobre la actividad de la tripsina. Aquellas que condicionan una ganancia en la función del tripsinógeno (como p.R112H, P.N29I, p.A16V) comportan un riesgo aumentado de pancreatitis y se hallan presentes en el 80% de los pacientes con pancreatitis hereditaria, en tanto que las mutaciones del PRSS1 que causan una pérdida de función del tripsinógeno tienen un efecto protector contra la pancreatitis36,37.
A pesar de que las mutaciones en PRSS1 se hallan mayoritariamente en miembros de familias con pancreatitis hereditaria, también se han descrito en pacientes sin historia familiar (tabla 2). Sin embargo, estos trabajos son escasos y la mayoría concluyen que las mutaciones del PRSS1 son infrecuentes tanto en la pancreatitis crónica idiopática37–39 como en la alcohólica38,40.
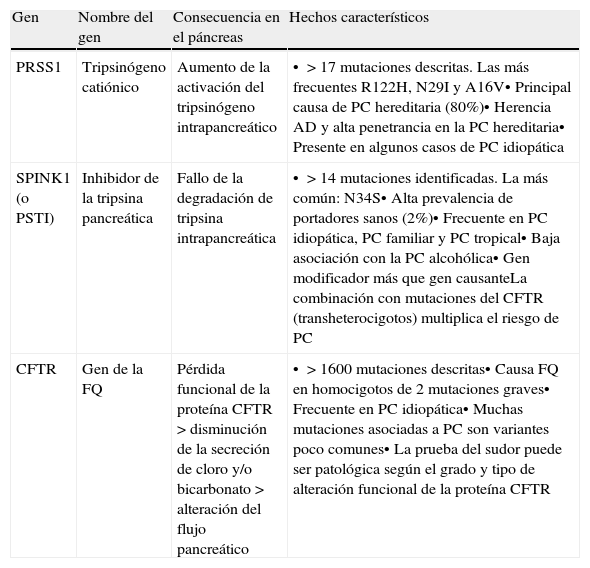
Principales características de las mutaciones en PRSS1, SPINK1 y CFTR asociadas a la pancreatitis crónica
| Gen | Nombre del gen | Consecuencia en el páncreas | Hechos característicos |
| PRSS1 | Tripsinógeno catiónico | Aumento de la activación del tripsinógeno intrapancreático | • >17 mutaciones descritas. Las más frecuentes R122H, N29I y A16V• Principal causa de PC hereditaria (80%)• Herencia AD y alta penetrancia en la PC hereditaria• Presente en algunos casos de PC idiopática |
| SPINK1 (o PSTI) | Inhibidor de la tripsina pancreática | Fallo de la degradación de tripsina intrapancreática | • >14 mutaciones identificadas. La más común: N34S• Alta prevalencia de portadores sanos (2%)• Frecuente en PC idiopática, PC familiar y PC tropical• Baja asociación con la PC alcohólica• Gen modificador más que gen causanteLa combinación con mutaciones del CFTR (transheterocigotos) multiplica el riesgo de PC |
| CFTR | Gen de la FQ | Pérdida funcional de la proteína CFTR>disminución de la secreción de cloro y/o bicarbonato>alteración del flujo pancreático | • >1600 mutaciones descritas• Causa FQ en homocigotos de 2 mutaciones graves• Frecuente en PC idiopática• Muchas mutaciones asociadas a PC son variantes poco comunes• La prueba del sudor puede ser patológica según el grado y tipo de alteración funcional de la proteína CFTR |
AD: autosómica dominante; FQ: Fibrosis quística; PC: pancreatitis crónica.
La SPINK1 es una potente antiproteasa que actúa como mecanismo de defensa pancreático inactivando la tripsina que se activa de manera prematura dentro de la célula acinar. La primera mutación (p.N34S) fue descrita en el año 2000 en niños con pancreatitis crónica27. Estudios posteriores confirmaron la existencia de mutaciones en SPINK1 en el 8-40% de pacientes con pancreatitis crónica idiopática38,41–44, en un alto porcentaje (60-80%) de pacientes con pancreatitis crónica familiar (definida por varios miembros afectados sin evidencia de un patrón de herencia dominante)41,45, y en casi la mitad de pacientes con pancreatitis crónica tropical46,47, comparado con el 1-2% en sujetos controles41,42,44. En la pancreatitis crónica enólica la mayoría de estudios coinciden en que el 5-6% de los pacientes tiene alguna mutación en SPINK141,44,48. Sin embargo, aunque esta cifra es estadísticamente superior al 1-2% observado en la población control, la mayoría de estudios concluyen que SPINK1 no es un gen de susceptibilidad determinante en la pancreatitis crónica alcohólica. En este sentido, un modelo estadístico aplicado en múltiples metanálisis sobre 24 estudios casos y controles demostró una alta asociación de la mutación p.N34S con la pancreatitis crónica idiopática (OR 15) y con la pancreatitis crónica tropical (OR 19) y una baja, aunque consistente, relación con la pancreatitis crónica enólica (OR 5)49.
Actualmente las mutaciones en SPINK1 se contemplan como factores modificadores más que como causantes41,42, disminuyendo el umbral de riesgo de otros factores genéticos predisponentes (por ejemplo, CFTR45,50,51) y/o ambientales. Por ejemplo, la existencia de la mutación de p.N34S en SPINK1 incrementa 40 veces el riesgo de pancreatitis crónica, y 900 veces si se combina con alguna mutación en el gen del CFTR50. Otro ejemplo es la combinación de mutaciones en SPINK1 con la mutación CFTR p.R75Q la cual multiplica el riesgo de pancreatitis crónica (OD 25,1) respecto a los portadores heterocigotos de p.R75Q sin SPINK1 mutado (OR 3,4)45. Por otro lado se ha observado que la existencia de mutaciones en SPINK1 acelera el curso de la pancreatitis crónica idiopática, adelantando en unos 1043-2045 años el inicio de la enfermedad y aumentando el número de episodios recurrentes43. Con estas evidencias una recomendación razonable sería investigar la existencia de mutaciones de SPINK1 en pacientes con pancreatitis crónica idiopática (dada la elevada frecuencia en este subgrupo), en aquellos en que el alcohol y tabaco sean cuestionables como factores etiológicos de la enfermedad y posiblemente en pacientes con mutaciones en el gen del CFTR, dada la mayor prevalencia de mutaciones en ambos genes en pacientes con pancreatitis crónica que en individuos sanos45. Debido a la alta prevalencia de mutaciones en SPINK1 en la población sana y su baja penetrancia, el análisis de SPINK1 no está indicado en la población general como marcador de riesgo de desarrollar pancreatitis crónica.
CFTREl CFTR (cystic fibrosis transmembrane conductance regulator) es un canal iónico presente en las células epiteliales del intestino, tracto respiratorio, árbol biliar, páncreas y glándulas sudoríparas. En el páncreas se halla en las células ductales, donde a través de la membrana apical promueve el paso de cloro y de bicarbonato hacia la luz ductal. Este mecanismo es crucial para alcalinizar el jugo pancreático y favorecer su flujo. La existencia de mutaciones en el gen del CFTR tiene una traducción fenotípica muy heterogénea, que va desde la fibrosis quística (FQ) clásica con afectación pluriorgánica grave, la FQ con afectación clínica más leve, las formas monosintomáticas conocidas como «trastornos asociados al CFTR» y los portadores sanos52.
El tipo y la gravedad del trastorno depende en gran parte del grado de afectación funcional de la proteína CFTR, lo cual está condicionado por la gravedad de las mutaciones, por factores ambientales y por otros determinantes genéticos. En función de la buena correlación genotípica-fenotípica descrita, las mutaciones del CFTR se han categorizado en «graves» (clases 1-3), las cuales se traducen en una función residual del CFTR casi nula, y «leves» (clases 4 y 5), cuya repercusión funcional sobre la proteína es menor53. La prueba del sudor representa una forma indirecta de evaluar la función del CFTR. Una concentración de cloro en el sudor>60mmol/l se considera patológica y refleja una función residual del CFTR muy baja. Cuando el valor está entre 30-60mmol/l el resultado es borderline y revela una alteración funcional del CFTR más leve.
Entre los diferentes órganos diana, el páncreas es el barómetro más veraz de la función del CFTR. La mayoría de pacientes con FQ (85%) son portadores de 2 mutaciones graves (en el 50% de casos homocigotos de la mutación ΔF508), lo cual condiciona una función del CFTR muy reducida (<2%) y una afectación pancreática grave con inicio en la etapa intrauterina en forma de pancreatitis crónica e insuficiencia exocrina54. El 15% restante de FQ presentan mutaciones menos graves que originan una pérdida funcional del CFTR menor (función residual 5%). Estos pacientes suelen tener una función exocrina conservada y algunos de ellos presentarán pancreatitis aguda a menudo recurrente en la infancia o edad adulta. De hecho, la pancreatitis aguda es poco frecuente en los pacientes con FQ (<2% en término globales) y guarda una correlación inversa con el grado de insuficiencia pancreática, habiéndose descrito una incidencia de 0,5% cuando existe insuficiencia exocrina y del 10-22% en los pacientes con una función exocrina preservada55,56. Mirado de otro modo, los pacientes con FQ portadores de mutaciones menos graves del CFTR presentan una función exocrina más preservada y un índice de riesgo de pancreatitis aguda 2,4 superior a los portadores de mutaciones moderadas y graves e insuficiencia exocrina56.
Las mutaciones del CFTR pueden manifestarse de forma aislada en un solo órgano ocasionando infertilidad masculina, rinosinusitis crónica, bronquiectasias diseminadas y pancreatitis crónica. Estas alteraciones no cumplen los criterios diagnósticos de FQ (manifestaciones clínicas de FQ más test del sudor patológico y/o portador homocigoto de 2 mutaciones causantes de FQ) y se identifican como «trastornos asociados al CFTR»52. En estos pacientes la función residual del CFTR está más conservada que en la FQ y ello les protege de la afectación pulmonar, que es la que marca el mal pronóstico de la FQ. La prueba del sudor en pacientes con pancreatitis crónica asociada a mutaciones del CFTR puede ser patológico o borderline, según el grado de función residual de la proteína. Sin embargo, el hecho de que la prueba del sudor sea normal no descarta la existencia de mutaciones en el gen del CFTR, ya que puede ser que la función del CFTR no esté muy alterada o que el tipo de mutación afecte exclusivamente a la secreción de cloro pero no a la de bicarbonato, como es el caso de la mutación p.R75Q45. Por tanto, una prueba del sudor patológico en un paciente con pancreatitis crónica ayuda a sospechar la existencia de mutaciones del CFTR pero un test del sudor normal no descarta mutaciones en este gen. La tabla 3 resume las principales características genotípicas y fenotípicas que diferencian la pancreatitis asociada a la FQ y la pancreatitis como manifestación aislada de un trastorno del CFTR.
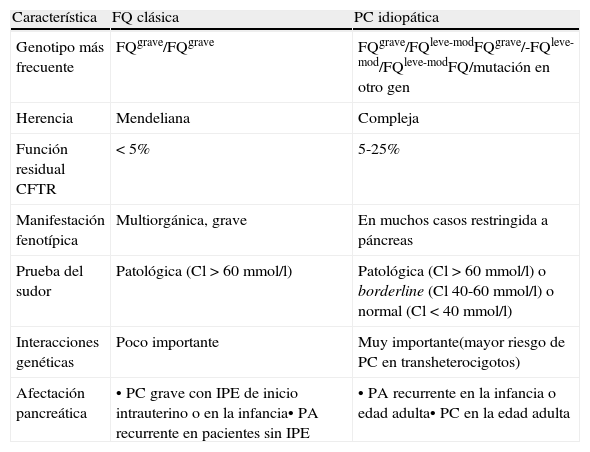
Características diferenciales entre la pancreatitis crónica asociada a fibrosis quística y la asociada a trastorno del CFTR
| Característica | FQ clásica | PC idiopática |
| Genotipo más frecuente | FQgrave/FQgrave | FQgrave/FQleve-modFQgrave/-FQleve-mod/FQleve-modFQ/mutación en otro gen |
| Herencia | Mendeliana | Compleja |
| Función residual CFTR | < 5% | 5-25% |
| Manifestación fenotípica | Multiorgánica, grave | En muchos casos restringida a páncreas |
| Prueba del sudor | Patológica (Cl>60mmol/l) | Patológica (Cl>60mmol/l) o borderline (Cl 40-60mmol/l) o normal (Cl<40mmol/l) |
| Interacciones genéticas | Poco importante | Muy importante(mayor riesgo de PC en transheterocigotos) |
| Afectación pancreática | • PC grave con IPE de inicio intrauterino o en la infancia• PA recurrente en pacientes sin IPE | • PA recurrente en la infancia o edad adulta• PC en la edad adulta |
FQ: Mutación en el gen de la fibrosis quística; PA: pancreatitis aguda; PC: pancreatitis crónica; IP: insuficiencia pancreática exocrina.
Las mutaciones del CFTR son un claro factor de riesgo en la pancreatitis crónica idiopática. En estos pacientes la detección de diversas mutaciones del CFTR es muy elevada (15-45% de los casos)28,29,32–35,45,57. El tipo y combinación de mutaciones en estos individuos es muy variable. En muchos casos son heterocigotos compuestos de una mutaciones clásica de FQ y de otra variante poco frecuente, aunque también existen portadores de mutaciones en un solo gen u homocigotos de 2 mutaciones leves28,29,32,45. En pacientes con pancreatitis crónica idiopática, la existencia de una mutación grave aumenta 6,3 veces el riesgo de desarrollar la enfermedad, 2,4 veces en casos de ser portadores de la mutación leve 5T, y 37 veces sin son compuestos heterocigotos28,29. La frecuencia de variantes poco comunes es muy elevada en la pancreatitis crónica idiopática, lo cual hace que las técnicas de rutina utilizadas en el cribado de FQ sean capaces de identificar solo el 10-18% de las mutaciones presentes en estos pacientes34. Ello hace necesaria la secuenciación del gen para obtener la información adecuada. Sin embargo, cabe hacer la consideración de que la interpretación es compleja, ya que son más de 1.600 las mutaciones descritas del gen del CFTR (disponibles en www.genet.sickkids.on.ca/cftr) de las cuales se desconocen las consecuencias funcionales en un alto porcentaje (∼ 40%). No obstante, cada vez son más los estudios que incorporan variantes consideradas clásicamente benignas como destacados factores de riesgo de pancreatitis, como es el caso de la mutación p.R75Q45.
Otro factor importante que determina la repercusión clínica de las mutaciones del CFTR es el efecto modificador de otros genes. En pacientes con pancreatitis crónica idiopática la existencia de transheterocigotos portadores de 2 mutaciones (CFTR y SPINK1 o CFTR y PRSS1) es mucho mayor que la esperada por azar29,33,37,45,50. La consecuencia clínica es clara en el caso de portadores de mutaciones del CFTR y SPINK1, ya que su combinación multiplica significativamente el riesgo de pancreatitis crónica29,45.
En cuanto a la pancreatitis crónica enólica, diversos estudios han analizado si las mutaciones del CFTR son un factor de susceptibilidad en estos sujetos. Sin embargo, los datos disponibles son variados y no concluyentes y parecen indicar que las mutaciones del CFTR no son un factor de susceptibilidad genética en la pancreatitis crónica enólica58.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.