La hemorragia digestiva baja (HDB) se define como la pérdida de sangre por el tubo digestivo de origen distal al ángulo de Treitz. Afecta generalmente a individuos de edad avanzada y a menudo con comorbilidades graves. La HDB cede espontáneamente en la mayoría de los casos (80-90%). Su mortalidad es relativamente baja (2-4%) y se relaciona más con descompensaciones de enfermedades de base que con la propia hemorragia1–3. Las causas más frecuentes de HDB a cualquier edad son la fisura anal y el sangrado hemorroidal. Sin embargo, las presentes recomendaciones se centran en las formas de HDB graves y que suelen originar ingreso hospitalario; en estos casos la hemorragia es de origen diverticular, por lesiones vasculares o tumores o por isquemia intestinal. En pacientes jóvenes, las causas más frecuentes de HDB grave son la enfermedad inflamatoria intestinal y las colitis infecciosas1–3.
El signo guía de la HDB es la emisión de sangre por el recto que recibe distintas denominaciones (por ejemplo, rectorragia, hematoquecia, sangrado rectal, etc.). En este documento utilizaremos exclusivamente el término rectorragia para cualquier forma de HDB.
La prevalencia de la HDB ha aumentado marcadamente en los últimos años. En la actualidad es, probablemente, la causa más frecuente de hemorragia digestiva1,2. A pesar de ello, la evidencia científica sobre su manejo es muy limitada. No se disponen de estudios terapéuticos comparativos y se han publicado pocas recomendaciones o guías clínicas, ninguna en nuestro medio4,5. El objetivo del presente artículo es establecer unas recomendaciones para el manejo de la HDB según la evidencia disponible.
Evaluación inicial de la hemorragia digestiva bajaLos 2 objetivos principales son determinar la gravedad y el pronóstico de la hemorragia y orientar sobre la localización de la lesión. Ha de incluir6–9:
Anamnesis- a)
Interrogar sobre la forma de presentación. Color y características de la hemorragia que contribuirán a la estimación clínica de la zona de origen y del volumen de la pérdida de sangre10:
- -
Sangre de color rojo vivo, que recubre las heces o aparece tras la defecación de heces de aspecto normal. Aparece característicamente al final de la deposición, se manifiesta a menudo como goteo o mancha en el papel higiénico al limpiarse. Sugiere un origen anorrectal.
- -
Sangre de color rojo oscuro o granate, mezclada con las heces o como único componente de la defecación. Indica HDB de origen no hemorroidal.
- -
Heces negras, alquitranadas (melenas), sugieren HDA aunque pueden ser la forma de presentación de una hemorragia originada en el intestino delgado o el colon derecho.
- -
- b)
Deberán considerarse la edad, presencia de coagulopatía, enfermedad o factores de riesgo cardiovascular, uso de AINE, antiagregantes o anticoagulantes; episodios previos de hemorragia, radioterapia pélvica, endoscopia, polipectomía o cirugía previa; signos vegetativos acompañantes; síntomas anales; fiebre, dolor abdominal, síndrome tóxico, cambio del ritmo intestinal reciente, etc.
- a)
Evaluar el estado hemodinámico: presión arterial sistólica (PAS), frecuencia cardíaca (FC), signos de hipoperfusión periférica y ortostatismo.
- b)
Confirmar la HDB y evaluar sus características (la evaluación subjetiva del paciente no siempre es fiable10). Realizar tacto rectal y exploración anal.
- c)
Colocar sonda nasogástrica (SNG): en pacientes con hemorragia grave y con sospecha de HDA7–9. La HDA masiva con tránsito rápido se presenta a menudo en forma de rectorragia, el 85% de las hemorragias digestivas con repercusión hemodinámica son HDA y el 10-15% de las rectorragias son de origen alto. Un aspirado hemático o en poso de café indicará HDA. Por el contrario, un aspirado claro no descarta hemorragia de origen duodenal con un píloro cerrado. Si el contenido del aspirado es bilioso, se considera que la posibilidad de HDA es baja. Se recomienda retirar la SNG una vez comprobado el aspecto del aspirado.
- d)
Exploración física completa: cardiorrespiratoria, nivel de conciencia y exploración abdominal.
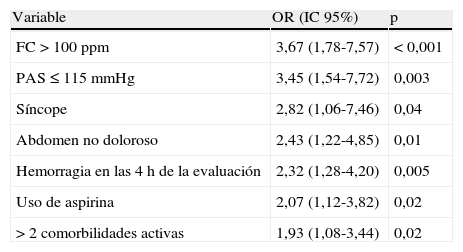
La gravedad de la HDB depende de su repercusión hemodinámica11–13. A pesar de que se ha intentado estandarizar la evaluación de la gravedad en la HDB, no existe una clasificación pronóstica aceptada de forma universal4,13–18. Una propuesta bien conocida es la de Strate et al.14 (tabla 1). En la presente guía se considera HDB grave aquella que cursa con persistencia de la rectorragia (rectorragia presente en las primeras horas de ingreso) asociada a alguna de las siguientes características: PAS < 100mmHg, FC > 100 pulsaciones por minuto, síncope no explicado por otras causas, hemoglobina < 9g/dl en ausencia de anemia crónica previa o descenso de la Hb > 2g/dl.
Factores de riesgo independientes predictivas de hemorragia digestiva baja grave
| Variable | OR (IC 95%) | p |
| FC > 100ppm | 3,67 (1,78-7,57) | < 0,001 |
| PAS ≤ 115mmHg | 3,45 (1,54-7,72) | 0,003 |
| Síncope | 2,82 (1,06-7,46) | 0,04 |
| Abdomen no doloroso | 2,43 (1,22-4,85) | 0,01 |
| Hemorragia en las 4 h de la evaluación | 2,32 (1,28-4,20) | 0,005 |
| Uso de aspirina | 2,07 (1,12-3,82) | 0,02 |
| > 2 comorbilidades activas | 1,93 (1,08-3,44) | 0,02 |
Fuente: Strate et al.14.
En la HDB grave con persistencia de la inestabilidad hemodinámica deberá evaluarse el traslado a un centro con disponibilidad de endoscopia y arteriografía urgente. En estos casos es preciso tener en cuenta la comorbilidad del paciente puesto que esta puede desaconsejar o incluso contraindicar la realización de técnicas diagnósticas y/o terapéuticas agresivas y, por tanto, el traslado.
Medidas inicialesLos pacientes con rectorragia leve autolimitada, sin inestabilidad hemodinámica ni anemia y con enfermedad anal evidente o en los que no se confirma la presencia de restos hemáticos en el tacto rectal pueden ser dados de alta, iniciando tratamiento tópico si es preciso. Se evaluará la colonoscopia diferida y el seguimiento ambulatorio en función de las características del paciente y de la hemorragia. En el resto de pacientes, las medidas iniciales se exponen a continuación.
Pacientes sin hemorragia digestiva baja grave- -
Canalizar una vena periférica para analítica y dejar un catéter corto y de calibre medio a grueso que permita, si se precisa, la infusión rápida de líquidos o sangre.
- -
Analítica urgente que incluya hemograma, coagulación, función renal y hepática.
- -
Considerar la reserva de concentrados de hematíes (CdH).
- -
Dieta sin residuos en previsión de una colonoscopia.
- -
En función de los resultados analíticos evaluar la necesidad de ingreso o la posibilidad de manejo ambulatorio.
- -
Colocación de 2 vías periféricas de calibre grueso que permitan una reposición rápida de la volemia o transfusión si es preciso.
- -
Analítica urgente que incluya hemograma, coagulación, función renal y hepática.
- -
Sangre en reserva (al menos 2 CdH) en función de la gravedad.
- -
Dieta absoluta las primeras 24 h; si el paciente se mantiene estable, puede iniciarse la solución evacuante para la colonoscopia.
- -
Reposición de la volemia. Se utilizarán cristaloides (suero fisiológico). Los coloides no son superiores en cuanto a la supervivencia y pueden aumentar la tasa de complicaciones19,20. Se recomienda la administración de un bolo inicial de 1.000 a 2.000 ml en presencia de signos de hipovolemia. El volumen total a infundir y la velocidad de infusión dependerán de la gravedad de la hemorragia y la comorbilidad.
- -
Si hay inestabilidad hemodinámica persistente debe evaluarse la necesidad de oxigenoterapia, vía central, sonda urinaria y fármacos vasoactivos, así como intubación e ingreso en una unidad de curas intensivas. En esta situación, en pacientes con comorbilidad grave, será preciso considerar la limitación terapéutica y, si es necesario, la aplicación de medidas de confortabilidad.
- -
En la hemorragia masiva (> 4 CdH en 1 h), la reposición de factores de la coagulación se realizará en función de los valores de fibrinógeno y plaquetas. Deben corregirse valores de fibrinógeno < 1,5g/l con plasma fresco congelado (PFC) y la trombocitopenia < 50.000 plaquetas/mm3 con transfusión de plaquetas. Si la monitorización es compleja, puede utilizarse una pauta 4:2:1 (por cada 4 CdH, 2 unidades de PFC y una de plaquetas), con determinación de fibrinógeno y plaquetas con la mayor frecuencia posible21,22.
La transfusión se llevará a cabo mediante CdH. Los CdH tienen que utilizarse exclusivamente para la corrección de la anemia y nunca para corregir la hipovolemia. Un CdH aumenta el hematocrito un 3% y la Hb en 1g/dl, aproximadamente23. Se recomienda una política de transfusión restrictiva (cuando la Hb sea < 7-8g/dl) ya que es más beneficiosa que la política de transfusión liberal1,24–27. La decisión de transfundir debe basarse en la situación clínica del paciente además de su Hb. Los factores que se deben considerar serán28–32:
- -
Comorbilidad: riesgo de complicaciones por oxigenación inadecuada en pacientes con reserva cardiopulmonar baja o consumo de oxígeno alto (por ejemplo, en situación de sepsis).
- -
Sintomatología asociada a isquemia de algún órgano.
- -
Riesgo de recidiva de la hemorragia (véase «Estratificación pronóstica postendoscopia»).
- -
Hemorragia activa.
- -
Velocidad de la pérdida hemorrágica (estado hemodinámico)33.
Como conceptos generales:
- -
Solo excepcionalmente se transfundirá con Hb > 10g/dl.
- -
Se transfundirá en pacientes estables si la Hb < 6-7g/dl.
- -
Se transfundirá con Hb > 8g/dl en pacientes postoperados o sintomáticos (dolor torácico, hipotensión ortostática, taquicardia que no responde a fluidoterapia o insuficiencia cardíaca) o en pacientes con enfermedad cardiovascular preexistente.
- -
En pacientes hemodinámicamente estables, la decisión de transfundir debe guiarse más por su sintomatología que por la cifra de Hb. Así, en pacientes con cardiopatía isquémica puede ser preciso mantener una Hb > 10g/dl; los pacientes con anemia sintomática mal tolerada deben transfundirse con independencia de la cifra de Hb34–36.
El grado de evidencia sobre el manejo de la HDB en pacientes con tratamiento anticoagulante o antiagregante es limitado. No hay estudios comparativos y la mayoría de los datos provienen de series cortas, de estudios en HDA, de otros ámbitos como la cirugía o de otros tipos de hemorragia.
Las series de HDA muestran que la mortalidad causada por el sangrado es muy baja y que la mayoría de los pacientes que fallecen lo hacen por complicaciones de origen trombótico o tromboembólico de su enfermedad de base33,37 o por enfermedad tromboembólica venosa (ETEV). El reinicio precoz del tratamiento anticoagulante o antiagregante, aunque aumenta las tasas de recidiva hemorrágica, disminuye la mortalidad de la hemorragia digestiva debido a una importante reducción de las complicaciones cardiovasculares38.
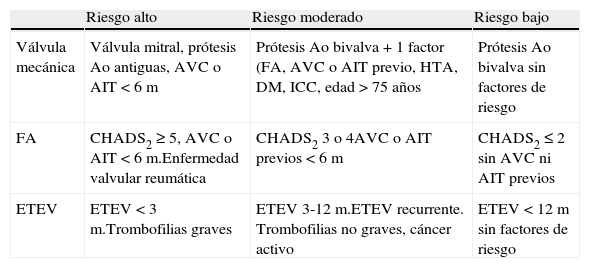
Se debe evaluar individualmente en cada paciente el riesgo trombótico asociado a la reversión de la anticoagulación y/o suspensión del tratamiento antiagregante así como el riesgo inherente de la hemorragia. En pacientes con alto riesgo tromboembólico (tablas 2–4) se recomienda no suspender el tratamiento anticoagulante o antiagregante si no existe riesgo vital. Si el tratamiento se suspende, debe reiniciarse lo más precozmente posible tras la obtención de la hemostasia, preferentemente antes de las 72 h.
Riesgo de trombosis si se suspende el tratamiento anticoagulante en función de la enfermedad de base
| Riesgo alto | Riesgo moderado | Riesgo bajo | |
| Válvula mecánica | Válvula mitral, prótesis Ao antiguas, AVC o AIT < 6 m | Prótesis Ao bivalva + 1 factor (FA, AVC o AIT previo, HTA, DM, ICC, edad > 75 años | Prótesis Ao bivalva sin factores de riesgo |
| FA | CHADS2 ≥ 5, AVC o AIT < 6 m.Enfermedad valvular reumática | CHADS2 3 o 4AVC o AIT previos < 6 m | CHADS2 ≤ 2 sin AVC ni AIT previos |
| ETEV | ETEV < 3 m.Trombofilias graves | ETEV 3-12 m.ETEV recurrente. Trombofilias no graves, cáncer activo | ETEV < 12 m sin factores de riesgo |
AIT: accidente vascular transitorio; Ao: aórtica; AVC: accidente vascular cerebral; DM: diabetes mellitus; ETEV: enfermedad tromboembólica venosa; FA: fibrilación auricular; HTA: hipertensión arterial; ICC: insuficiencia cardíaca congestiva; a: años, m: meses.
Fuente: Douketis et al.114.
CHADS2 score
| Condición | Puntos | |
| C | Insuficiencia cardíaca congestiva | 1 |
| H | Hipertensión: PA > 140/90mmHg o tratamiento anti-HTA | 1 |
| A | Edad ≥ 75 años | 1 |
| D | Diabetes mellitus | 1 |
| S2 | AVC o AIT o tromboembolia previa | 2 |
AIT: accidente vascular transitorio; AVC: accidente vascular cerebral; HTA: hipertensión arterial; PA: presión arterial.
Fuente: Gage et al.115.
Riesgo de trombosis si se suspende el tratamiento antiagregante en función de la enfermedad de base
| Riesgo alto | Riesgo moderado | Riesgo bajo |
| Stents farmacoactivos insertados ≤ 6-12 mesesStents metálicos insertados ≤ 6 semanasIAM o AVC ≤ 3 meses | Stents farmacoactivos insertados > 6-12 mesesStents metálicos insertados > 6 semanasIAM o AVC > 3 meses | Prevención primaria de enfermedad cardiovascular, cerebrovascular o enfermedad vascular periférica |
Debemos considerar el estado hemodinámico y el INR del paciente.
Pacientes con hemorragia digestiva baja graveLa reversión de la anticoagulación debe realizarse preferentemente con concentrado de factores de la protrombina (CCP) porque su preparación y administración es más rápida que el plasma fresco congelado (PFC); los CCP requieren, además, un menor volumen de infusión39 (tabla 5). El PFC sería una alternativa si no se dispone de CCP. Además, se debe asociar vitamina K por vía intravenosa.
Antídotos de dicumarínicos
| Antídoto | Dosis | Comentarios |
| Vitamina K | 10mg i.v. | Administrar en 20-30min. Tarda ∼ 4-6 h |
| PFC | 10-30ml/kg | 1 U=∼250ml ↑ Volumen. ↑ Tiempo preparación |
| CCPa | 25-50U/kg i.v. | ↓ Volumen. Rapidez |
CCP: concentrado de factores de protrombina; PFC: plasma fresco congelado.
La vitamina K aislada no es útil en la hemorragia grave porque la corrección de la coagulación tarda 4 h como mínimo y puede no ser completa.
Se recomienda reiniciar la anticoagulación con heparina de bajo peso molecular (HBPM) lo más precozmente posible cuando se valore que el riesgo trombótico supera el riesgo de hemorragia. Se considera de elección la enoxaparina (1mg/kg cada 12 h por vía subcutánea). En pacientes ancianos y/o con insuficiencia renal avanzada se recomienda ajustar cuidadosamente la dosis; raramente se deberán superar los 40-60mg cada 12 h. En pacientes con alto riesgo de recidiva hemorrágica se puede considerar el uso de heparina sódica en perfusión porque permite un control más estrecho del rango de anticoagulación, tiene una vida media corta y cuenta con un antídoto eficaz (sulfato de protamina).
Pacientes sin hemorragia digestiva baja grave- -
Anticoagulación supraterapéutica: se recomienda corregir la coagulación con vitamina K intravenosa y diferir las exploraciones diagnósticas hasta la corrección del INR a niveles terapéuticos.
- -
Anticoagulación en niveles terapéuticos: en pacientes de alto riesgo tromboembólico (tabla 2) la reversión de la anticoagulación puede aumentar el riesgo de trombosis o embolia, incluso iniciando inmediatamente el tratamiento con heparina. Por ello, es necesario valorar si debe revertirse con vitamina K o se puede mantener el dicumarínico en un rango terapéutico bajo (INR 2-2,5). Si se suspende, y especialmente en aquellos pacientes de alto riesgo tromboembólico, se recomienda iniciar lo más precozmente posible el tratamiento con HBPM, si es posible, de forma inmediata.
Hay pocos datos publicados sobre cómo debe realizarse la reversión de la coagulación con los nuevos anticoagulantes orales inhibidores de la trombina y del factor Xa (apixabán, dabigatrán, rivaroxabán). Además, los datos habituales del laboratorio como el INR no son buenos indicadores del grado de anticoagulación. Pueden ser útiles los CCP, pero la evidencia sobre su eficacia es limitada. Dabigatrán es el único dializable. En caso de ingesta reciente puede ser eficaz la administración de carbón activado40.
Manejo de los antiagregantesSi se suspende totalmente el tratamiento antiagregante, el riesgo de una complicación cardiovascular y muerte aumenta de forma significativa41; así, por ejemplo, en pacientes portadores de un stent fármaco-activo el riesgo de complicaciones puede aumentar hasta 80 veces42,43.
En pacientes de alto riesgo tromboembólico (tabla 4) se recomienda no suspender la antiagregación si no existe inestabilidad hemodinámica con riesgo vital. En caso de doble antiagregación el clopidogrel es el fármaco con más riesgo de hemorragia y es el que debe suspenderse en primer lugar. Las dosis altas de AAS se pueden sustituir por AAS de 100mg44. Es crítico no parar totalmente la antiagregación en pacientes portadores de un stent coronario durante los primeros 6 meses tras su inserción. Datos recientes indican que, en pacientes con doble antiagregación, si se mantiene el AAS, se puede suspender el clopidogrel durante un periodo corto sin que aumente el riesgo de complicaciones cardiovasculares45.
En pacientes de bajo riesgo tromboembólico es posible suspender la antiagregación durante un período máximo de 3 días. Se recomienda reiniciar la antiagregación en cuanto se obtenga la hemostasia y dentro del período crítico de 72h.
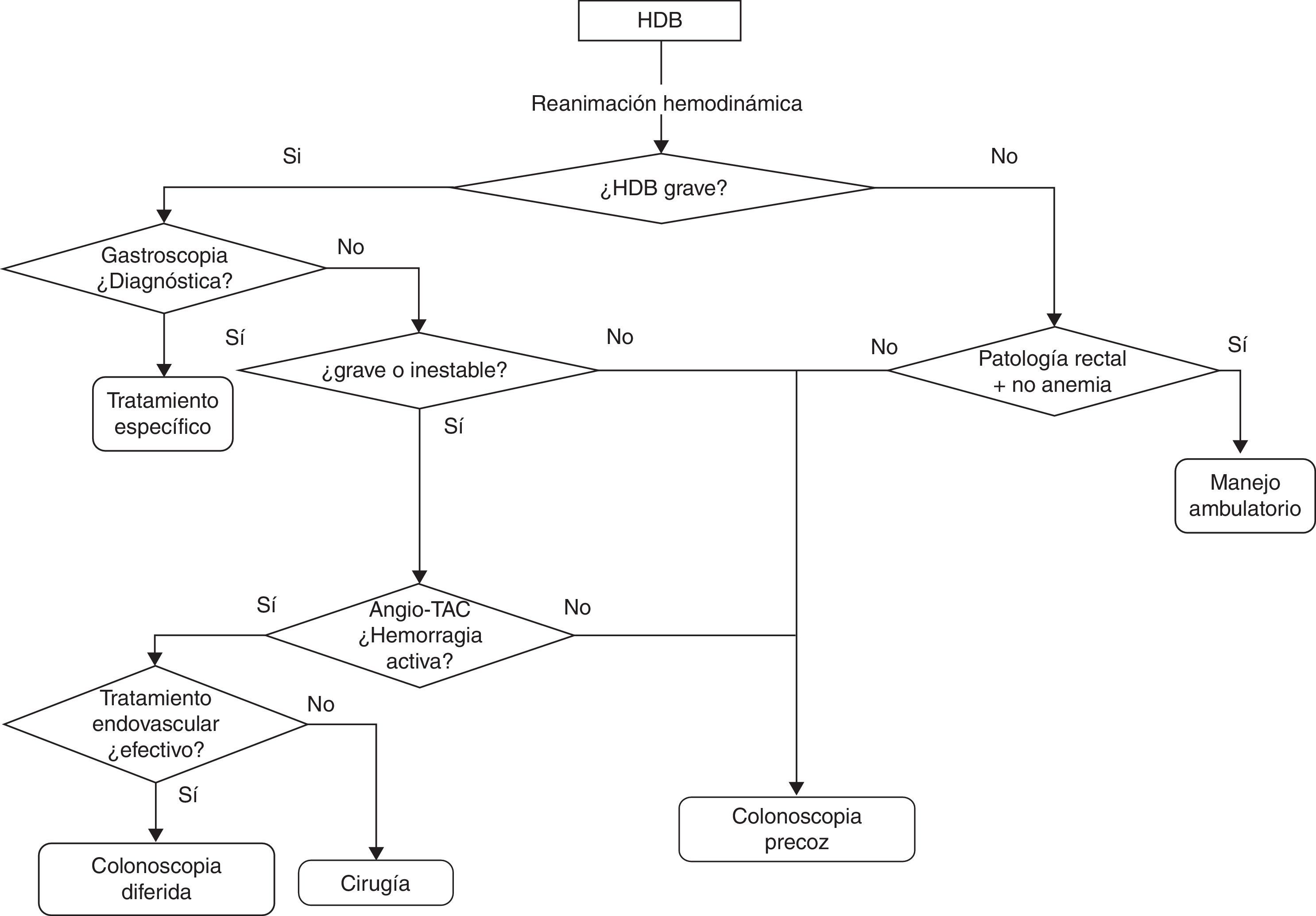
Evaluación diagnósticaLa estrategia diagnóstica variará en función de la gravedad de la hemorragia, definida por la presencia de HDB grave (fig. 1).
Pacientes con hemorragia digestiva baja graveEndoscopia digestiva altaDe un 10 a un 20% de los pacientes con rectorragia e inestabilidad hemodinámica (PAS < 100mmHg y/o FC > 100ppm y/o síncope) presentan realmente una HDA8,46 y se identificarán con una endoscopia alta. Por ello, en pacientes con rectorragia e inestabilidad hemodinámica se recomienda una endoscopia alta como primera exploración diagnóstica8,46 tras la reanimación hemodinámica si se constata que el paciente se halla en condiciones de recibir dicha exploración. Debemos sospechar la existencia de una HDA ante la presencia de melenas, un aspirado nasogástrico hemático o en poso de café, la historia previa de HDA y/o un cociente urea/creatinina > 30. Los antecedentes de cirrosis hepática o neoplasia gastrointestinal alta y una hemoglobina < 8g/dl identifican las HDA graves47.
Angiotomografía computarizadaLa angio-TC es la exploración de elección en la HDB activa con inestabilidad hemodinámica si no es posible la realización de una endoscopia alta o si esta es normal48–56. Se realiza con una TC multidetector (TCMD) y la administración de contraste yodado intravenoso. No necesita preparación y la exploración dura pocos minutos. La única contraindicación absoluta es el antecedente de reacción adversa grave al contraste yodado. Se recomienda realizar una fase arterial, una fase portal y una fase retardada, que sustituirá a la adquisición de imágenes sin contraste. En hemorragias masivas, la sensibilidad y especificidad es del 90 y 99%, respectivamente.
La angio-TC es diagnóstica cuando objetiva extravasación de contraste en el interior de la luz intestinal. Además, puede detectar la repleción precoz típica de las lesiones vasculares, neovascularización indicativa de neoplasia u otras imágenes sospechosas de lesiones potencialmente sangrantes. En caso de observarse extravasación de contraste está indicada la realización de una arteriografía terapéutica (embolización). Si durante la realización de la angio-TC no se encuentra hemorragia activa, se desaconseja la embolización y se recomienda iniciar la preparación para la colonoscopia (tabla 6).
Preparación para la colonoscopia
| Premedicación (opcional) | Metoclopramida 10mg vía intravenosa |
| Solución evacuante | Polietilenglicol estándar: preparar de 3-6 l de solución y administrar 250ml cada 15 min (por ejemplo: solución evacuante Bohm®, Casenglicol®, EvacuantLainco®, GoLYTELY®) |
| Alternativas | Polietilenglicol de volumen reducido. Preparar 2 l de solución (Movicol®, Moviprep®). |
| Solución con citrato magnésico: preparar 2 l de solución (por ejemplo: Citrafleet®) | |
| Administración | Inicio: se puede iniciar durante su permanencia en urgencias en condiciones de estabilidad hemodinámica. En caso de mala tolerancia se puede administrar por sonda nasogástrica. |
| Final: como mínimo, 3 h antes de la exploración para poder realizar sedación farmacológica |
Será el grupo más numeroso de pacientes con HDB. Se recomienda la realización de una colonoscopia como primera exploración diagnóstica57. La colonoscopia nos permitirá establecer un diagnóstico de seguridad cuando se observe una lesión con hemorragia activa o la presencia de un estigma de hemorragia reciente (vaso visible, coágulo adherido, úlcera con fibrina, neoplasia) o un diagnóstico de presunción si se identifica una lesión potencialmente sangrante (por ejemplo, divertículos o angiodisplasia) sin estigmas de hemorragia reciente. Además, con frecuencia la colonoscopia nos permitirá realizar un tratamiento hemostático.
La precisión diagnóstica de la colonoscopia depende del momento en el que se realiza. Dentro de las primeras 24-48 h tiene una sensibilidad del 67 al 88%. Más allá de este período de tiempo la sensibilidad se reduce significativamente (48-22%)14,58. Por ello y, siempre que sea posible, se recomienda la realización de una colonoscopia precoz, dentro de las primeras 48 h desde el ingreso14,59,60. Esta estrategia, además de mejorar la precisión diagnóstica, aumenta la posibilidad de realizar un tratamiento endoscópico y reduce la estancia hospitalaria.
La colonoscopia se debe realizar en condiciones de estabilidad hemodinámica y tras una preparación adecuada (tabla 6)57,61. Esta es necesaria para obtener un rendimiento diagnóstico adecuado y evitar complicaciones por una visión insuficiente. Se pueden administrar procinéticos como la metoclopramida (10mg por vía intravenosa) para reducir las náuseas y vómitos originados por la toma de la preparación62,63. En el caso de que la endoscopia inicial no sea diagnóstica por una mala preparación, esta debe repetirse tras una preparación adecuada.
La endoscopia debe estar asistida por un personal de enfermería experto en endoscopia digestiva y bajo sedación farmacológica. En pacientes con comorbilidad grave se debe evaluar la necesidad de un control por anestesia o en una unidad de cuidados intensivos.
Estratificación pronóstica postendoscopiaLa colonoscopia nos permite evaluar la presencia de sangre y determinar cuál es la lesión sangrante y su localización. En función de estos parámetros se puede establecer una estratificación pronóstica. Así, los factores endoscópicos de alto riesgo de recidiva o de persistencia de la hemorragia son:
- a)
Presencia de estigmas de hemorragia reciente en la endoscopia (vaso visible, coágulo adherido o úlcera con fibrina).
- b)
Sangrado de origen vascular (angiodisplasia), diverticular o colonoscopia no diagnóstica.
- c)
Presencia de sangre roja en la colonoscopia.
En cambio, son factores endoscópicos de bajo riesgo de recidiva las lesiones ulceradas sin estigmas de hemorragia reciente (por ejemplo, la colitis isquémica), las neoplasias y el origen proctológico58,63.
Los resultados de la colonoscopia guiarán las decisiones diagnósticas y terapéuticas posteriores. Así, en los pacientes sin ningún factor de alto riesgo endoscópico se recomienda valorar alta en 24h. Se evaluará también si se requiere completar estudio o tratamiento de forma ambulatoria.
Estudio en pacientes con colonoscopia no diagnósticaSe recomienda completar el estudio solamente en aquellos pacientes sin comorbilidad grave en los que las medidas diagnósticas y de tratamiento adicionales pueden tener un impacto significativo en la supervivencia. La primera exploración en estos casos es la gastroscopia. Si esta es negativa se recomienda:
Cápsula endoscópicaEs la exploración de elección en el caso de hemorragia digestiva de origen incierto visible (HDOIV) –hemorragia objetivada en la que la endoscopia alta y baja han sido negativas– en ausencia de inestabilidad hemodinámica64. Siempre que sea posible se realizará durante el ingreso y en un tiempo lo más próximo posible al episodio de sangrado (idealmente < de 48h)65. Puede realizarse sin preparación, aunque se recomienda la administración previa de solución evacuante, habitualmente 2 l de solución de polietilenglicol.
La cápsula endoscópica está contraindicada en el caso de sospecha de estenosis intestinal. En estos casos es necesaria la administración previa de la cápsula Patency para descartar la presencia de una estenosis intestinal. Si esta no se elimina intacta en las primeras 72h, la cápsula endoscópica está contraindicada.
El rendimiento diagnóstico de la cápsula endoscópica en la HDOIV es superior a la enteroscopia de pulsión66 y al TC67 para identificar lesiones clínicamente significativas. El rendimiento diagnóstico es aproximadamente del 55%. Su realización en < 48 h en el caso de la HDOIV aumenta el rendimiento hasta un 91,9%67.
Enterotomografía computarizada o enterorresonancia magnéticaLa TC-enterografía está indicada en pacientes en los que la cápsula endoscópica está contraindicada o ha sido incompleta, dudosa o negativa68,69. Consiste en la realización de un TCMD multifásico tras la distensión del intestino delgado con agua y Manitol® 5%. Está contraindicada en pacientes con reacciones adversas graves al contraste yodado y en el caso de colectomía previa. La RM-enterografía es una posible alternativa, especialmente en pacientes jóvenes para evitar las radiaciones ionizantes o si existen antecedentes de reacción alérgica grave al contraste yodado. Como inconvenientes destaca su menor disponibilidad, tiene una peor resolución y requiere más tiempo para su realización69.
EnteroscopiaEn casos seleccionados de HDOIV y con una alta probabilidad de hallar lesiones en el intestino delgado con sangrado activo (por ejemplo, hemorragia recidivante por una lesión ya conocida) la enteroscopia puede ser la exploración de primera elección. En general, y dado que es una prueba invasiva, se reserva para la realización de biopsias o tratamiento de lesiones en el intestino delgado visualizadas previamente por la cápsula endoscópica o entero-TC64,70–72. Los enteroscopios con uno o 2 balones permiten la exploración de gran parte del intestino delgado. Se puede realizar enteroscopia por vía anal u oral. Su rendimiento diagnóstico es superior al del enteroscopio de pulsión. Se debe realizar en situación de estabilidad hemodinámica y no requiere preparación.
En el caso de que todas las exploraciones sean negativas y recidive la hemorragia se considerará repetir dichas exploraciones (endoscopia alta, colonoscopia, cápsula endoscópica)64.
TratamientoMedidas generales y tratamiento médico del paciente con hemorragia digestiva baja (fig. 1)Los pacientes con HDB son a menudo de edad avanzada y tienen una elevada comorbilidad por lo que se debe extremar el cuidado para evitar la iatrogenia asociada a la hospitalización. Los aspectos concretos a evaluar son los siguientes.
NutriciónEl ayuno solo se justifica como preparación para intervenciones diagnósticas o terapéuticas. En la mayoría de los pacientes se podrá reiniciar la dieta en menos de 24 h una vez realizadas las exploraciones necesarias. Con ello evitaremos, por un lado, la desnutrición que aparece rápidamente en los pacientes de edad avanzada y, por otro, la sobrecarga de líquidos debido a la sueroterapia en pacientes con enfermedad cardiovascular.
MovilizaciónLa inmovilización (encamamiento, sondas urinarias, sueroterapia) se asocia a un rápido deterioro de las capacidades motoras en los pacientes frágiles e incrementa el riesgo de enfermedad venosa tromboembólica (trombosis venosa profunda y tromboembolia pulmonar). Se recomienda realizar profilaxis de la enfermedad venosa tromboembólica con heparina de bajo peso molecular desde el inicio del ingreso así como movilización precoz, evitando al máximo el encamamiento prolongado.
Enfermedad de baseSe recomienda un control estricto de las comorbilidades del paciente, manteniendo su tratamiento de base o reiniciándolo lo antes posible.
Tratamiento farmacológicoNo hay evidencia suficiente para recomendar ningún tratamiento médico específico en pacientes con HDB aguda. El octeótrido y la somatostatina son útiles en el tratamiento de la hemorragia recurrente o en las pérdidas crónicas secundarias a angiodisplasia73–75 pero, en el caso de la HDB aguda, los datos disponibles sobre su eficacia son muy limitados76,77.
Radiología intervencionistaEl tratamiento mediante arteriografía es el tratamiento de elección en pacientes con HDB con inestabilidad hemodinámica cuando la angio-TC observa extravasación de contraste a la luz intestinal4,5,78,79.
La técnica de elección es la embolización superselectiva. Tiene un efecto inmediato en el control de la hemorragia. Debe realizarse mediante microcatéteres coaxiales, lo más próximo posible al lugar del sangrado, idealmente a nivel de los vasos rectos y, si ello no es posible, a nivel de la arteria marginal. La elección del material de embolización dependerá del operador, que tendrá en consideración el territorio a embolizar, la selectividad de la posición del catéter y la experiencia del radiólogo. La técnica consigue la hemostasia hasta en el 90% de los casos en series recientes80–82. Una vez obtenida la hemostasia, se recomienda una colonoscopia para establecer un diagnóstico etiológico definitivo.
Ocasionalmente, la cateterización arterial no llega a ser suficientemente selectiva como para proceder a una embolización. Las causas más frecuentes son la presencia de arterioesclerosis, el vasoespasmo o la tortuosidad vascular. En estos casos y, si está indicada la cirugía, la colocación de coils o la inyección de azul de metileno permitirán la localización del segmento afectado, sea por escopia o por visión directa. Estas técnicas permiten limitar la extensión de la resección y son especialmente útiles en el intestino delgado83,84.
Si la arteriografía no detecta el punto de sangrado, se recomienda dejar el introductor arterial en el lugar de la punción durante 24 a 48h para evitar punciones repetidas y poder realizar rápidamente el procedimiento en caso de recidiva de la HDB.
La tasa de complicaciones de la embolización en series recientes es baja. Con las técnicas actuales, la tasa de complicaciones isquémicas mayores (infarto intestinal) se ha reducido de un 5% a prácticamente cero. Las reacciones al contraste y las complicaciones relacionadas con la punción arterial (hematoma, embolia o disección), todas ellas muy infrecuentes, son otras posibles complicaciones85.
Tratamiento endoscópico de la hemorragia digestiva bajaEntre el 10 y el 40% de las exploraciones por HDB requerirán un tratamiento endoscópico4,57,58,60,86. Existe una gran variedad de lesiones potencialmente tratables. Las más habituales son las de origen diverticular, la secundaria a lesiones vasculares (angiodisplasia, Dieulafoy, proctitis rádica) y la hemorragia pospolipectomía. Además, existe una larga lista de lesiones más infrecuentes tratables mediante endoscopia (las varices rectales, la úlcera rectal idiopática, por manipulación con objetos o cánulas de enemas o iatrogénica tras biopsia prostática).
La evidencia de la eficacia del tratamiento endoscópico es muy limitada y se basa en extrapolaciones de lo que sucede en la HDA y en series cortas de pacientes.
Las técnicas disponibles son la inyección de adrenalina (1/10.000-1/20.000), la coagulación (en nuestro medio, habitualmente con argón plasma) y las mecánicas (clips, bandas elásticas y endo-loops). No hay estudios comparativos para determinar qué técnica es mejor, por lo que la elección de la misma se hará en función de la lesión sangrante, la presencia de alteraciones de la coagulación (en cuyo caso se preferirá un sistema mecánico a la inyección) y la experiencia del endoscopista. A menudo, es necesario asociar más de una técnica (generalmente, la inyección y un método mecánico) para conseguir la hemostasia.
La tasa global de complicaciones es baja, alrededor del 1,3%4,58. Las más frecuentes son la perforación (0,3%), más frecuente en las técnicas de coagulación, y la intensificación del sangrado (0,1%). Se han descrito casos aislados de enfisema submucoso, neumoperitoneo o, incluso, la explosión del colon por argón plasma, especialmente en el contexto de una mala preparación.
En el caso de una hemorragia activa sin posibilidad de tratamiento endoscópico o sin respuesta al mismo, la colocación de un clip metálico adyacente a la lesión hemorrágica permitirá al radiólogo vascular identificar con mayor facilidad el origen del sangrado con el fin de intentar un tratamiento intravascular. Las técnicas recomendadas según la etiología de la hemorragia son las siguientes:
Hemorragia diverticularSe recomienda la colocación de un clip. Puede asociarse, si se considera necesario, la inyección de adrenalina alrededor y sobre el punto sangrante4,58,60,64,86–88. El clip parece tan eficaz como la electrocoagulación o la inyección con adrenalina y no tiene el riesgo de perforación asociado a la electrocoagulación87,88. Además, en caso de recidiva, el clip facilita al radiólogo vascular o al cirujano la localización del origen del sangrado.
La colocación de bandas elásticas también puede ser útil89. Se pueden colocar si se utiliza una baja presión de aspiración (< 50mmHg). Sin embargo, existe riesgo de perforación si la banda llega a incluir todo el grosor de la pared del colon. Otro inconveniente es que debe retirarse el endoscopio para colocar el dispositivo de bandas y reintroducirlo con el dispositivo cargado90. Por ello, no se aconseja su uso si no es por endoscopistas experimentados en esta técnica.
Lesiones vascularesLas técnicas de coagulación son útiles. En el colon derecho, sin embargo, la tasa de recidiva es del 50% y el riesgo de perforación de hasta el 2,5%91,92. Por ello, se recomienda utilizar potencias bajas y pulsaciones cortas de 1 a 3 s. Se prefiere el uso de argón plasma porque es más rápido, fácil de aplicar y tiene un menor riesgo de perforación y de recidiva (menor del 10%) y es aplicable en el caso de lesiones extensas, como puede ser la enteritis rádica. Ocasionalmente, se han utilizado clips con éxito. Se recomienda su uso en el colon derecho y en pacientes anticoagulados o con trastornos de la coagulación92.
Hemorragia pospolipectomíaEn el caso de una hemorragia inmediata después de la resección de un pólipo pediculado, si el pedículo restante lo permite, es eficaz hacer compresión con la misma asa de polipectomía durante 5 a 10min93. Esta maniobra suele ser suficiente, si bien se recomienda asociar un segundo método, que puede ser la inyección de adrenalina, coagulación o la compresión mecánica del pedículo por debajo del corte con un clip o un endo-loop. En pólipos sésiles, debe aplicarse inyección, coagulación o clip sobre el punto del sangrado. Se puede valorar la colocación de bandas, especialmente en el colon izquierdo o en el recto93–99.
En el caso de una hemorragia diferida se puede utilizar la adrenalina la coagulación, clips o endo-loops, en función de la lesión y la experiencia del endoscopista93–99.
Profilaxis de la hemorragia pospolipectomíaEn resecciones de alto riesgo (pólipos de > 20mm, trastornos de la coagulación o tratamiento anticoagulante) se recomienda el uso de técnicas de hemostasia profiláctica97,100. Todos los métodos (inyección, coagulación, clip y endo-loop) son eficaces para prevenir a corto plazo la HDB pospolipectomía101–105. La adrenalina y el argón plasma no son eficaces para prevenir la hemorragia diferida. Por otro lado, la eficacia de los métodos mecánicos no está totalmente establecida106,107. Por ello, se recomienda la combinación de diferentes métodos, estrategia que parece ser más eficaz106,107.
Tratamiento quirúrgico de la hemorragia digestiva bajaHemorragia digestiva baja de origen conocidoLa necesidad de cirugía como tratamiento de la HDB ha disminuido progresivamente en pacientes con HDB aguda y se utiliza exclusivamente como terapia de rescate108, cuando la hemorragia no ha podido ser controlada con el tratamiento endoscópico o angiográfico109. La decisión de operar ha de ser individualizada en función del estado del paciente y la etiología del sangrado. La localización preoperatoria del origen de la hemorragia es fundamental para realizar una cirugía dirigida. Si no, hay que intentar su localización mediante una enteroscopia y/o colonoscopia intraoperatoria. La técnica de elección será la resección segmentaria del área donde se localiza el sangrado. Estas resecciones se pueden realizar con poca morbilidad y con una baja tasa de recidiva110. Se realizará una anastomosis primaria excepto que esta se considere contraindicada por la comorbilidad previa o la existencia de shock intraoperatorio.
Hemorragia digestiva baja de origen desconocidoLa colectomía subtotal es el último recurso en pacientes con hemorragia persistente. Debe haberse descartado una HDA mediante una endoscopia digestiva alta; la arteriografía, la colonoscopia y la cápsula endoscópica (repetidas si es necesario) deben haber resultado no diagnósticas. Estudios recientes han mostrado que esta aproximación tiene una morbimortalidad aceptables, con tasas de resangrado del 2% y una mortalidad alrededor del 20%. Por contra, no se recomienda la realización de colectomías segmentarias, por el elevado índice de recidiva y necesidad de reintervención (< 40%), que se asocia a una muy elevada morbilidad (83%) y mortalidad (57%)111–113.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.