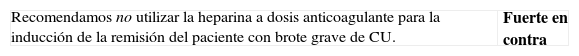La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica intestinal, de etiología multifactorial, que afecta principalmente al colon. No existe un criterio único patognomónico para su definición, por lo que su diagnóstico se basa en una serie de criterios clínicos, endoscópicos e histológicos, así como en la exclusión de enfermedades infecciosas con manifestaciones similares1. Tanto su extensión como su gravedad son variables en cada paciente a lo largo del tiempo. La definición de un escenario clínico concreto exige, por tanto, tener en cuenta tanto la gravedad como la extensión de la enfermedad de acuerdo con las definiciones indicadas por la Organización Mundial de Gastroenterología (OMGE) en la Clasificación de Montreal2. La enfermedad puede permanecer, además, en situación de remisión clínica, lo que obliga a distinguir estrategias de tratamiento diferentes en situación de actividad o de remisión. Se ha observado que determinados tratamientos de mantenimiento disminuyen muy significativamente la probabilidad de nuevos brotes de actividad3. Aunque fue descrita a finales del siglo xix, su frecuencia en las diversas poblaciones ha cambiado llamativamente, sobre todo durante la segunda mitad del siglo xx, en paralelo a otras enfermedades inmunológicas y con una clara tendencia mantenida al aumento con el desarrollo económico y social. Dado que a menudo comienza en la juventud o incluso en la infancia y su mortalidad es escasa, su prevalencia es considerablemente superior (al menos 20 a 30 veces la incidencia)4. En España los datos epidemiológicos señalaban hasta los años ochenta del siglo pasado que se trataba de una enfermedad infrecuente. Sin embargo, en los últimos 30 años se han llegado a alcanzar cifras de incidencia muy similares a las descritas previamente en los países del norte de Europa, y, de hecho, en los estudios más recientes los datos son completamente asimilables5.
El tratamiento de esta enfermedad se ha llevado a cabo con fármacos, cirugía o ambos. En la primera mitad del siglo xx, los procedimientos de tratamiento, como la sulfasalazina, se introdujeron de forma empírica, pero ya en 1955 se publicó el primer ensayo clínico controlado y aleatorizado que demostró que la hidrocortisona es superior al placebo en el tratamiento del brote moderado o grave de CU6. Hasta 1980 predominaron los estudios observacionales de calidad muy variable. A partir de entonces se han realizado numerosos ensayos clínicos controlados, análisis epidemiológicos, evaluaciones de métodos diagnósticos e incluso complejos estudios genéticos7 con un peso cada vez mayor de la metodología científica. En estos momentos, se dispone de alternativas nutricionales, farmacológicas, quirúrgicas y de vigilancia y seguimiento ya numerosas8,9. Su aplicación en la amplia variedad posible de escenarios clínicos con circunstancias personales y sociales tan diversas no siempre es fácil y es una de las justificaciones para elaborar esta guía.
2Necesidad de una guíaTratándose de una enfermedad crónica frecuente que afecta mayoritariamente a población joven y con prevalencia creciente, las repercusiones sanitaria, económica y social justifican perfectamente la necesidad de herramientas para sistematizar el tratamiento de la CU. No obstante, vamos a señalar con más detalle otras razones para su elaboración.
En primer lugar, los profesionales implicados en esta entidad son muy numerosos. Una lista parcial incluiría a gastroenterólogo, cirujano, médico de atención primaria, nutricionista, psicólogo, enfermero, estomaterapeuta, reumatólogo, oftalmólogo y dermatólogo. La necesidad de coordinación entre estos profesionales y el paciente también justifica la necesidad de una guía de práctica clínica (GPC).
Existen numerosas pruebas10 de que la variabilidad habitual de la práctica clínica afecta de forma muy importante a los pacientes con enfermedad inflamatoria intestinal (EII), con importantes repercusiones clínicas y sociales. De hecho, un reciente estudio cooperativo europeo reflejaba enormes diferencias en el coste total del manejo de la enfermedad, independientemente de la renta per cápita del país. Y, lo que es clínicamente más significativo, grandes diferencias en la distribución de este coste: la proporción de pacientes intervenidos quirúrgicamente era muy variable (en la CU entre 10 y 40%)11. Esta variabilidad también justifica la necesidad de una GPC.
Se dispone ya de varias publicaciones que llevan la palabra «guía» en su título, destacando entre ellas por su rigor y difusión las guías británica (British Society of Gastroenterology)12, norteamericana13(American College of Gastroenterology), de la Organización Mundial de Gastroenterología14, la del grupo de consenso Asia pacífico15 y la europea16,17 (European Crohn and Colitis Organization [ECCO]). Si bien estas publicaciones, y muy especialmente la última, son de gran calidad y se basan en la evidencia científica disponible, en realidad son documentos de consenso más o menos elaborados. Que sepamos, no se dispone en el mundo de ninguna GPC elaborada con metodología estructurada y sistemática18.
El Grupo Español de Trabajo sobre Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) tiene como uno de sus objetivos prioritarios mejorar la atención a los pacientes con enfermedad inflamatoria intestinal, y ha establecido como una línea estratégica la elaboración de una GPC que sirva de ayuda a profesionales médicos, pacientes, investigadores y gestores. En la primera fase del proyecto nos centramos en el tratamiento de las enfermedades inflamatorias intestinales.
3Definiciones- -
Población diana: pacientes de cualquier sexo y edad con diagnóstico de CU de acuerdo con los criterios internacionalmente aceptados de Lennard-Jones (tabla 1). Estos criterios se aceptan tanto por la OMGE14 como por la ECCO16.
- ∘
Se desarrollarán en el futuro guías complementarias para especificar los aspectos independientes y relevantes para la población pediátrica y situaciones clínicas especiales.
Tabla 1.Criterios diagnósticos de Lennard-Jones
Criterios clínicos • Rectorragia• Diarrea crónica (aunque en un 10% de los casos puede haber estreñimiento)• Dolor abdominal• Manifestaciones extraintestinales Criterios radiológicos • Cambios mucosos: mucosa granular, úlceras espiculares o en botón de camisa, seudopólipos• Cambios del calibre: estrechamiento de la luz (aumento del espacio recto-sacro), acortamiento del colon, pérdida de haustración Criterios endoscópicos • Mucosa eritematosa, granular, edematosa y/o friable• Exudado o ulceraciones• Hemorragia al roce o espontánea• Seudopólipos y pólipos• Lesiones característicamente continuas y con afectación prácticamente constante de recto Criterios anatomopatológicos • Mayores: inflamación exclusiva de la mucosa, úlceras superficiales, distorsión de la criptas, microabscesos, depleción de células caliciformes• Menores: infiltrado inflamatorio crónico difuso, aumento de la vascularización mucosa, metaplasia de las células de Paneth, atrofia mucosa, hiperplasia linfoide Fuente: Lennard-Jonnes1.
- ∘
- -
Colitis ulcerosa (CU):
- ∘
Criterios de gravedad: los definidos en la Clasificación de Montreal2, criterios cuya validez ha sido refrendada recientemente por un grupo de expertos19 (tabla 2):
▪Colitis ulcerosa.
- •
Remisión.
- •
Leve.
- •
Moderada.
- •
Grave.
- •
▪Se evitarán términos confusos como colitis fulminante o «muy grave».
▪Las diferencias entre brote moderado-grave en los estudios publicados en la literatura médica, sobre todo con los fármacos biológicos, no siempre están bien establecidas (caja 1).
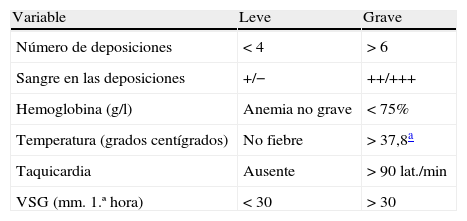
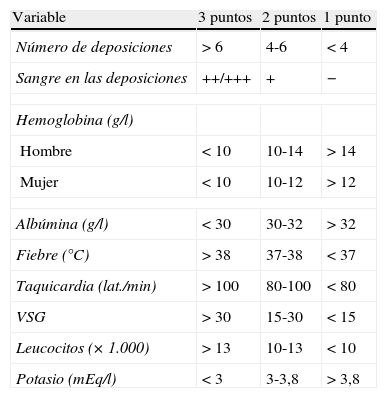
▪Se utilizará la escala de gravedad utilizada en la Clasificación de Montreal2, que en realidad está extrapolada del índice utilizado desde hace más tiempo, el índice de Truelove-Witts6 (tabla 3) que en algunas publicaciones, particularmente españolas, se ha modificado de forma semicuantitativa (tabla 4). En realidad, este índice no ha sido validado formalmente en ningún estudio, y su utilización puede resultar controvertida20 (caja 2). De hecho, no se dispone de ningún índice clínico de actividad de referencia, por lo que es preciso conocer varios para interpretar los resultados de los estudios20,21. Facilitamos los más importantes:
- -
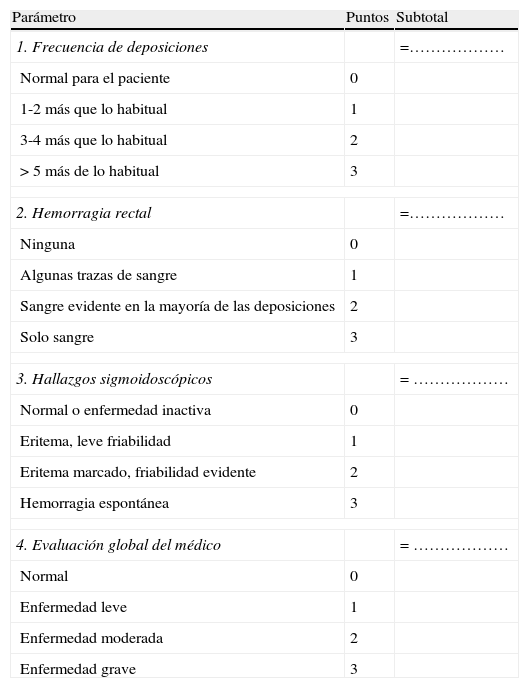
Índice de Mayo (DAI)22 (tabla 5).
Tabla 5.Índice de Mayo
Parámetro Puntos Subtotal 1. Frecuencia de deposiciones =……………… Normal para el paciente 0 1-2 más que lo habitual 1 3-4 más que lo habitual 2 >5 más de lo habitual 3 2. Hemorragia rectal =……………… Ninguna 0 Algunas trazas de sangre 1 Sangre evidente en la mayoría de las deposiciones 2 Solo sangre 3 3. Hallazgos sigmoidoscópicos = ……………… Normal o enfermedad inactiva 0 Eritema, leve friabilidad 1 Eritema marcado, friabilidad evidente 2 Hemorragia espontánea 3 4. Evaluación global del médico = ……………… Normal 0 Enfermedad leve 1 Enfermedad moderada 2 Enfermedad grave 3 Valoración global del índice de Mayo Síntomas Endoscopia Médico Suma total Leve 1-3 1 1 3 a 5 Moderado 3-6 1-2 2 6 a 10 Grave >6 >2 3 >10 - -Tabla 6.
Índice de Seo
Variable Valoración N.° de deposiciones × 13= ≤4=1 5-7=2 ≥8=3 Sangre en heces ×60= No o poca=0 Presente=1 VSG (mm/h) ×0,5= Total A (sumatorio previos) = Hemoglobina (g/dl) ×4= Albúmina (g/dl) ×15= Total B (sumatorio previos) = Índice de actividad Seo; total A− total B+200 = …………………. Valoración índice de Seo Puntuación Remisión o actividad leve <150 Moderado-grave 150-220 Grave >220 Fuente: Seo et al.23.
- -
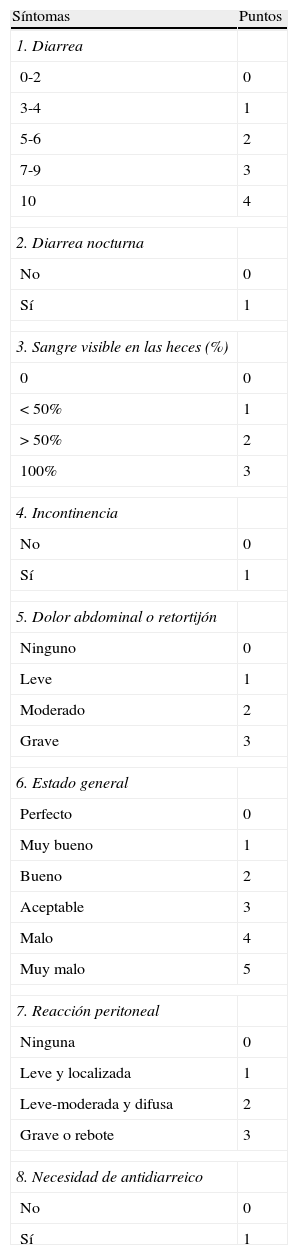
Índice de Lichtiger24 (tabla 7).
Tabla 7.Índice de Lichtiger
Síntomas Puntos 1. Diarrea 0-2 0 3-4 1 5-6 2 7-9 3 10 4 2. Diarrea nocturna No 0 Sí 1 3. Sangre visible en las heces (%) 0 0 <50% 1 >50% 2 100% 3 4. Incontinencia No 0 Sí 1 5. Dolor abdominal o retortijón Ninguno 0 Leve 1 Moderado 2 Grave 3 6. Estado general Perfecto 0 Muy bueno 1 Bueno 2 Aceptable 3 Malo 4 Muy malo 5 7. Reacción peritoneal Ninguna 0 Leve y localizada 1 Leve-moderada y difusa 2 Grave o rebote 3 8. Necesidad de antidiarreico No 0 Sí 1 Valoración índice:
Máxima puntuación: 21 puntos.
Puntuación <10 durante 2 días consecutivos, indica respuesta clínica (en la referencia original a ciclosporina, brote grave resistente).
Fuente: Lichtiger et al.24.
- -
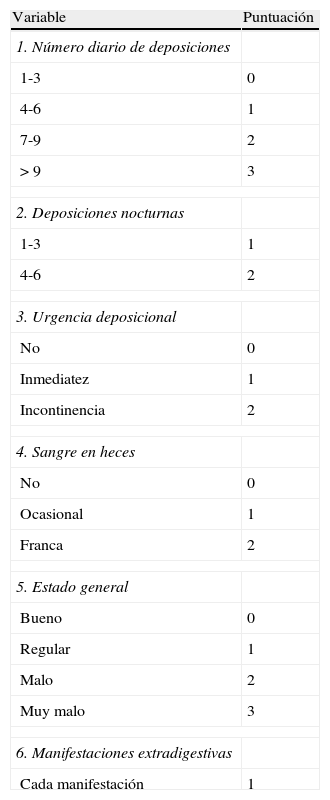
Índice de Walmsley, conocido como Simple Activity Index25 (tabla 8).
Tabla 8.Simple Activity Index (índice de Walmsley)
Variable Puntuación 1. Número diario de deposiciones 1-3 0 4-6 1 7-9 2 >9 3 2. Deposiciones nocturnas 1-3 1 4-6 2 3. Urgencia deposicional No 0 Inmediatez 1 Incontinencia 2 4. Sangre en heces No 0 Ocasional 1 Franca 2 5. Estado general Bueno 0 Regular 1 Malo 2 Muy malo 3 6. Manifestaciones extradigestivas Cada manifestación 1 Valoración del índice:
Indice sencillo, clínico, cuya interpretación y correlación con índices más complejos como Power-Tuck es adecuada.
Fuente: Walmsley et al.25.
- -
Pediatric Ulcerative Colitis Activity Index (PUCAI)26 (tabla 9). En realidad este es el único índice con una validación metodológica correcta, pero solo se ha utilizado en población pediátrica.
Tabla 9.Índice Pediatric Ulcerative Colitis Activity Index (PUCAI)
Variable Puntuación 1. Dolor abdominal No 0 Puede ser ignorado 5 No puede ser ignorado 10 2. Rectorragia No 0 Pequeña cantidad en <50% deposiciones 10 Pequeña cantidad en casi todas las deposiciones abundantes (> 50% contenido deposiciones) 2.030 3. Consistencia de la mayoría de las deposiciones Formada 0 Parcialmente formada 5 No formada 10 4. Número de deposiciones cada 24 h 0-2 0 3-5 5 6-8 10 >8 15 5. Deposición nocturna (cualquier episodio que despierte al niño) No 0 Sí 10 6. Actividad diaria No limitación de actividad 0 Limitación ocasional 5 Limitación total 10 Valoración del índice:
Brote grave ≥ 65 puntos
Brote moderado: 35-64 puntos
Brote leve: 10-34 puntos
Remisión (sin actividad): <10
Fuente: Turner et al.26
Tabla 3.Índice de Truelove-Witts original
Variable Leve Grave Número de deposiciones <4 >6 Sangre en las deposiciones +/− ++/+++ Hemoglobina (g/l) Anemia no grave <75% Temperatura (grados centígrados) No fiebre >37,8a Taquicardia Ausente >90 lat./min VSG (mm. 1.ª hora) <30 >30 Valoración del índice:
Brote leve: cuando todas las variables se encuentran en la categoría de «leve».
Brote grave: cuando todas se encuentran en «grave».
Cuando hay variables en ambas categorías, se trata de un brote moderado.
Tabla 4.Índice de Truelove-Witts modificado
Variable 3 puntos 2 puntos 1 punto Número de deposiciones >6 4-6 <4 Sangre en las deposiciones ++/+++ + − Hemoglobina (g/l) Hombre <10 10-14 >14 Mujer <10 10-12 >12 Albúmina (g/l) <30 30-32 >32 Fiebre (°C) >38 37-38 <37 Taquicardia (lat./min) >100 80-100 <80 VSG >30 15-30 <15 Leucocitos (× 1.000) >13 10-13 <10 Potasio (mEq/l) <3 3-3,8 >3,8 Valoración del índice:
Inactivo: <11
Brote leve: 11-15
Brote moderado: 16-21
Brote grave: 22-27
- -
Tabla 2.Clasificación de Montreal para la colitis ulcerosa
Extensión (E) E1) Proctitis ulcerosa: afección limitada al recto (el límite superior de la inflamación no supera la unión rectosigmoidea) E2) Colitis izquierda: afección limitada al colon izquierdo (el límite superior de la inflamación no supera el ángulo esplénico) E3) Colitis extensa (pancolitis): afección que se extiende más allá del ángulo esplénico Gravedad (S) S0) Colitis en remisión (colitis silente): no hay síntomas de la enfermedad. S1) Colitis leve: 4 o menos deposiciones al día con sangre, sin fiebre, leucocitosis, taquicardia, anemia ni aumento de la VSG S2) Colitis moderada: criterios intermedios entre leve y grave, siempre con signos de afección sistémica leves (véase índice de Truelove-Witts, tablas 3 y 4) S3) Colitis grave: 6 o más deposiciones diarias con sangre, fiebre (> 37,5) o taquicardia (> 90 lat./min) o anemia (Hb<10,5 g/dl) o aumento de la VSG (> 30 mm/h), a menudo con signos de afección («toxicidad») sistémica grave Hb: hemoglobina.
Fuente: Silverberg et al.2.
- ∘
Criterios de extensión: los definidos en la clasificación de Montreal2. Debemos admitir el límite fundamental de esta clasificación: la extensión puede cambiar con el tiempo y, de hecho, una parte variable de las proctitis pasarán a colitis más extensas19, sin embargo, para el análisis del efecto terapéutico esto es de importancia menor, porque se analiza la colitis en la extensión que tiene en el momento del estudio:
▪CU extensa: afecta desde el recto hasta más allá del ángulo esplénico.
▪CU izquierda: hasta el ángulo esplénico.
▪Proctitis ulcerosa: afección limitada al recto (el límite superior de la inflamación no supera la unión rectosigmoidea).
- ∘
Además de las definiciones fundamentales es preciso conocer otros términos de uso habitual en la literatura médica sobre CU. Al ser de definición arbitraria, probablemente lo más adecuado es seguir un consenso, y el más aceptado internacionalmente es el de la ECCO16:
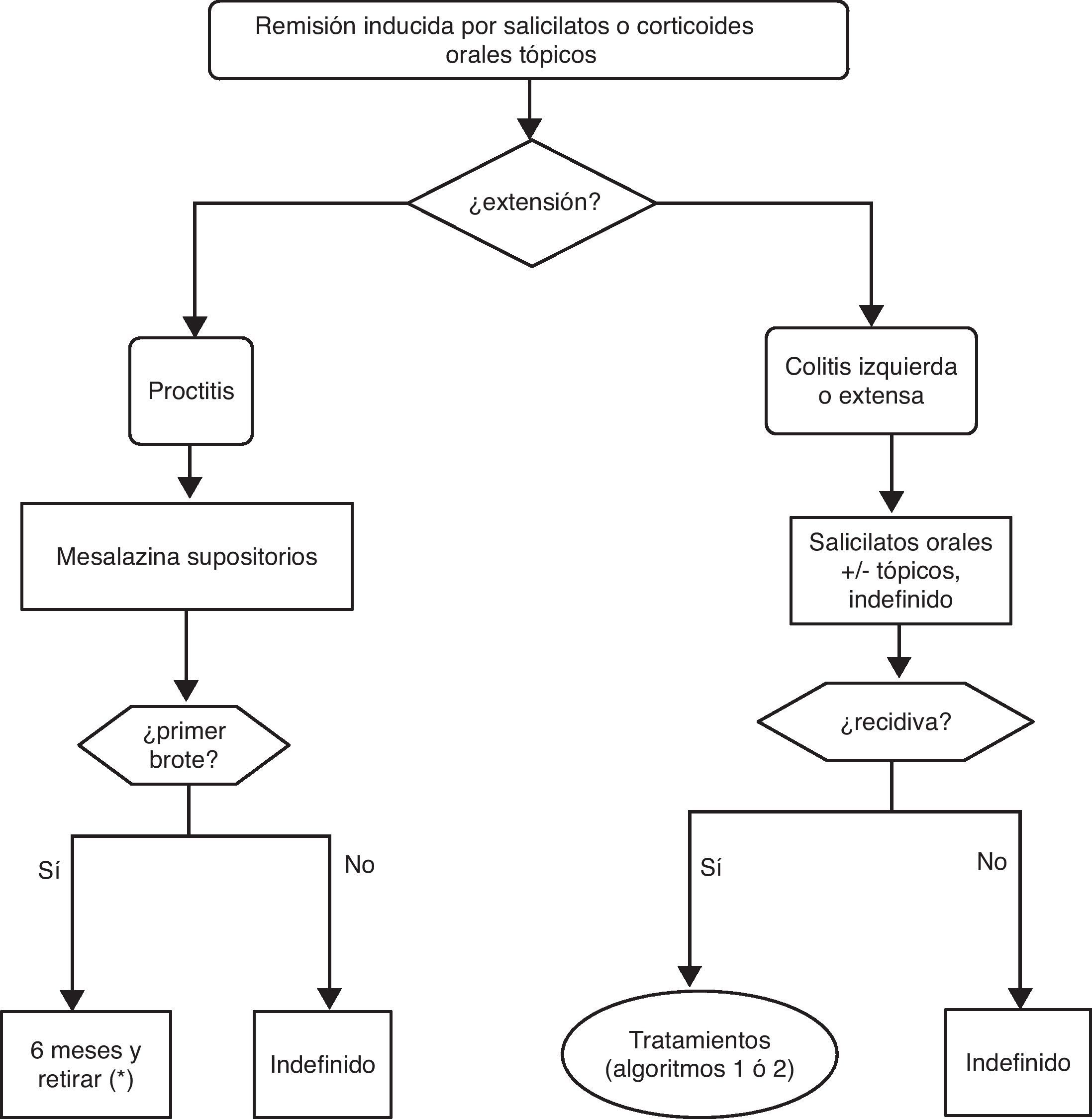
▪Remisión: resolución completa de los síntomas, acompañada de cicatrización mucosa (aspecto este que no se evalúa en muchos trabajos). No todos los ensayos utilizan exactamente la misma definición de remisión y cuando esto sea relevante lo señalaremos en el texto específicamente (caja 1).
▪Respuesta: mejoría significativa de la situación clínica y/o endoscópica (grave a moderada, grave a leve, moderada a leve) sin alcanzar la remisión.
▪Recidiva: nuevo brote en un paciente con CU establecida tras haberse producido anteriormente una remisión bien espontáneamente o tras el tratamiento médico.
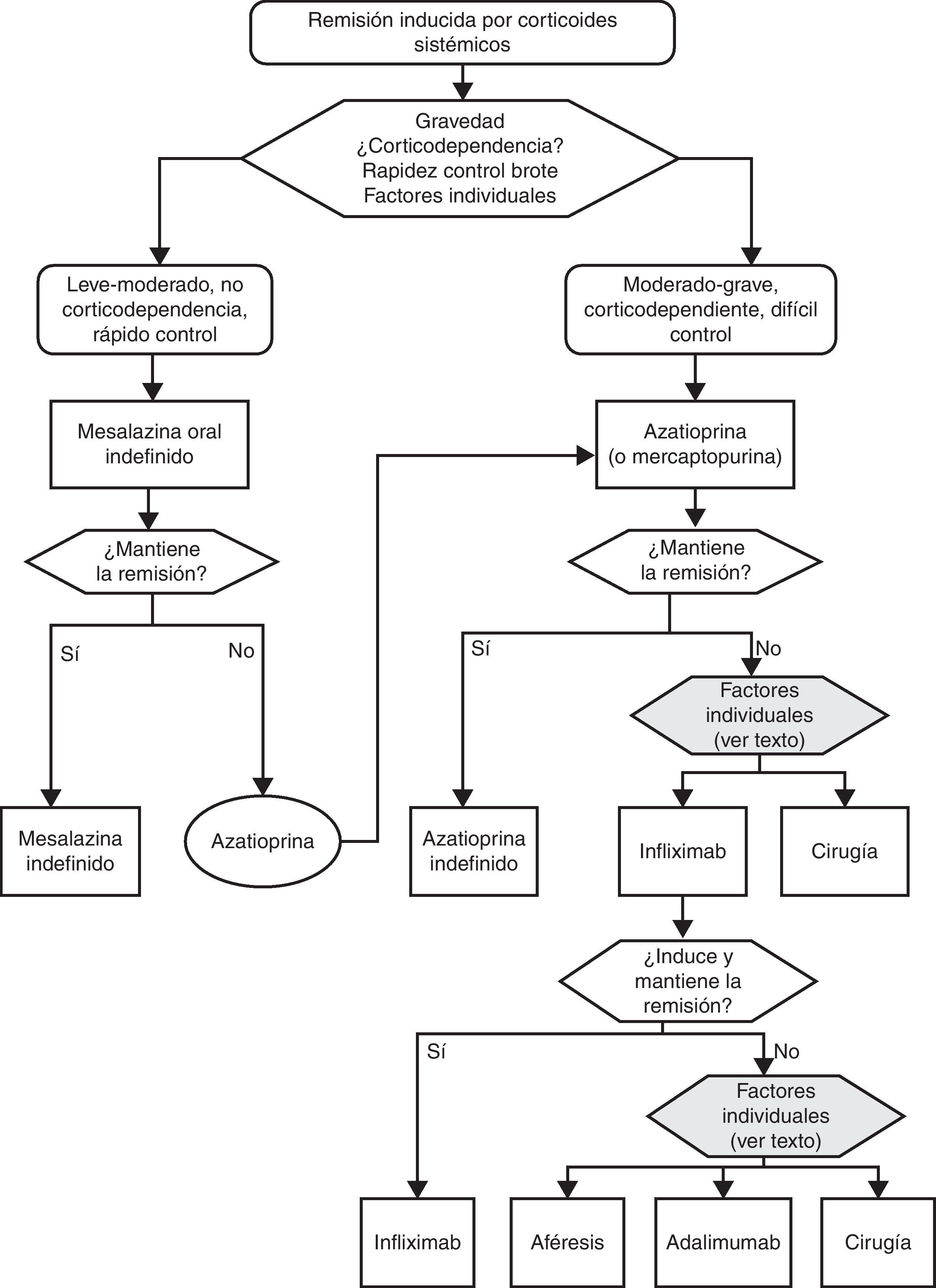
▪Corticodependencia:
- -
imposibilidad de disminuir la dosis de corticoides por debajo de 10mg/día de prednisona (o equivalente) tras 3 meses de inicio del tratamiento corticoideo
- -
recidiva dentro de los primeros 3 meses de haber suspendido los corticoides.
- -
▪Corticorresistencia: situación de actividad clínica a pesar de tratamiento durante 4 semanas con dosis plenas (0,75mg/kg/día de prednisolona o 1mg/kg/día de prednisona, o equivalente). Esta definición es muy controvertida, y con toda probabilidad será modificada en el futuro. De hecho, en el contexto de un brote grave la gran mayoría de los clínicos definirían la corticorresistencia como la falta de respuesta clínica tras la administración de corticoides a dosis plena por vía intravenosa durante 7 días. Es más, hay una tendencia creciente a situar la definición en 5 o incluso 3 días. A los efectos de esta GPC utilizaremos el concepto de un mes para los brotes leves o moderados, y de 7 días para los graves.
▪Reservoritis: inflamación del reservorio ileal creado para mantener la continuidad intestino-ano tras una colectomía total (en la literatura médica anglosajona, pouchitis). En muchos pacientes se comporta como una enfermedad crónica.
▪«Cuffitis»: inflamación del manguito de mucosa rectal que se conserva en la zona anal en algunas anastomosis ileoanales.
- ∘
- -
Índice farmacológico:
- ∘
Fármacos sistémicos:
▪Salicilatos: sulfasalazina, mesalazina.
▪Corticoides orales:
- -
Sistémicos: hidrocortisona, prednisona, metilprednisolona, deflazacort, betametasona y dexametasona.
- -
Acción tópica: beclometasona dipropionato (BDP) y budesonida.
- -
▪Fármacos inmunomoduladores (inmunosupresores):
- -
Tiopurínicos: azatioprina, mercaptopurina y tioguanina.
- -
Metotrexato.
- -
Calcineurínicos: ciclosporina y tacrolimus.
▪Fármacos biológicos: infliximab y adalimumab.
▪Heparina.
- -
- ∘
Fármacos de acción tópica:
▪Mesalazina.
▪Corticoides:
- -
Administración oral: beclometasona y budesonida.
- -
Administración rectal:
- •
Alta biodisponibilidad sistémica: hidrocortisona, prednisolona, triamcinolona, metilprednisolona y betametasona.
- •
Baja biodisponibilidad sistémica: budesonida, beclometasona y prednisolona-metasulfobenzoato.
- •
- -
- ∘
Otras técnicas de tratamiento:
▪Aféresis: leucocitoaféresis y granulocitoaféresis.
- ∘
Los objetivos se definieron por el comité de elaboración (véanse anexos) siguiendo la metodología GRADE de trabajo27. En resumen, tras escoger los 3 escenarios clínicos a los que se pueden dirigir las recomendaciones (inducción de la remisión en la colitis grave, inducción de la remisión en la colitis leve a moderada, y mantenimiento de la remisión), en cada uno de los escenarios se explicitaron las posibles variables de resultado y fueron puntuadas en una escala numérica de 1 a 9 (1-3: no se incluyen; 4-6: importantes pero no críticas; 7 a 9: críticas para la toma de decisiones) por los 9 miembros del comité de elaboración. Tras clasificarse en orden de importancia, se incluyeron como variables de resultado aquellas con una puntuación media superior a 4. En todas las variables críticas el grado de acuerdo interno del comité fue excelente, con unanimidad en la puntuación o bien con una variabilidad máxima de un punto. Tras este proceso previo, se definieron como objetivos de la GPC los siguientes:
▪Establecer recomendaciones basadas en las pruebas disponibles, para el tratamiento de inducción en el brote grave de CU priorizando las siguientes variables de evaluación:
▪Establecer recomendaciones para el tratamiento de inducción en el brote leve- moderado de CU priorizando las siguientes variables de evaluación:
▪Establecer recomendaciones para el tratamiento de mantenimiento de la CU en remisión priorizando las siguientes variables de evaluación:
- ∘
Para la elaboración de la GPC se ha seguido la metodología AGREE, que está descrita en detalle en la página web: www.agreecollaboration.org. Brevemente, se formó un equipo de trabajo interdisciplinario, estructurado en un comité de diseño (general para las diversas GPC promovidas por GETECCU), un comité de elaboración (para las 3 primeras GPC), un comité de trabajo (específico para esta GPC), un comité de revisión interno (para las 3 primeras GPC) y un comité de revisión externo (específico para esta GPC). El comité de revisión externo incluía a gastroenterólogos, cirujanos, médicos de atención primaria, enfermeros y pacientes. La composición más detallada de todos estos comités figura en el anexo 1. En todo el proceso, tanto en la formación del equipo como en las áreas que se ha necesitado, se ha contado con el apoyo metodológico de personal especializado de la Colaboración Cochrane. Tras la definición de los objetivos por parte del comité de elaboración, el comité de trabajo llevó a cabo una revisión sistemática de la literatura, dirigida específicamente a responder las preguntas clave planteadas previamente. Tras la obtención de la información, esta fue sometida a un proceso de evaluación siguiendo la metodología GRADE28,29. De esta forma se evaluaba la calidad de los estudios considerando el diseño y la calidad del estudio, la consistencia y la evidencia directa e indirecta. Considerando una combinación de los 4 componentes se definía la calidad como: alta (muy poco probable que nuevos estudios cambien la estimación); moderada (es probable que nuevos estudios cambien la confianza que tenemos en el resultado); baja (es muy probable que nuevos estudios tengan impacto en la confianza que tenemos en el resultado y puedan modificarlo) y muy baja (cualquier resultado estimado es muy dudoso). Además de los factores fundamentales citados, para la estimación global de la calidad de la evidencia se tienen en cuenta otros factores como el número de pacientes estudiado, la fuerza de las asociaciones encontradas, la presencia de gradientes dosis-respuesta (en los estudios farmacológicos) y el reconocimiento o no de posibles factores de confusión identificados por los evaluadores. En cualquier caso, todos estos factores se consideran de forma acumulativa, y con una metodología específica que puede consultarse en las referencias. Para el establecimiento de recomendaciones no solo se tiene en cuenta la calidad de la evidencia, sino que se efectúa una ponderación entre los beneficios potenciales de la intervención, sus riesgos, su aplicabilidad en la población a tratar y, finalmente, sus costes. Aunque sin realizarse análisis formales de coste-efectividad, los costes se consideran siempre desde una perspectiva global y comparada, no considerando únicamente los costes directos, sino los indirectos y el contexto (en relación con los costes de las alternativas). Las recomendaciones emitidas se clasifican en 4 grados: fuerte a favor, que significa aconsejar al clínico hazlo; débil a favor, que significa aconsejar al clínico probablemente hazlo; débil en contra, que indica lo mismo que probablemente no lo hagas, y fuerte en contra, que claramente quiere indicar no lo hagas. Este tipo de clasificación es a la vez fácilmente comprensible y flexible, porque se puede adaptar a los muy diversos escenarios clínicos posibles.
- ∘
La revisión sistemática de la literatura se ha llevado a cabo con búsquedas libres y condicionadas en las bases de datos PubMed, Embase, Tripdatabase y Colaboración Cochrane, y en libros de texto, y mediante el cruce de referencias de los diversos estudios. Se ha llevado a cabo una revisión por cada una de las preguntas formuladas. Además se han cruzado referencias procedentes de los textos de la especialidad, y de todas las revisiones recientes. En todas las ocasiones en las que ya se disponía de una revisión sistemática publicada, se ha utilizado si su metodología se ha considerado la adecuada por el comité de trabajo, siguiendo los criterios de la Fundación Cochrane. En caso de existir dudas sobre la metodología, se han revisado los datos fuente, y en caso de existir varias revisiones sistemáticas se ha elegido primero con criterios metodológicos y luego con criterios temporales (prefiriendo las más recientes en caso de equivalencia metodológica). Solo se evalúan documentos publicados en forma completa. No obstante, en el momento de la redacción final de la guía, el comité de redacción ha tenido en cuenta algunos resultados comunicados formalmente en los últimos congresos nacionales e internacionales en algunos puntos concretos que se especificarán en el texto. El límite para la inclusión de trabajos es febrero de 2011. En el listado de referencias solo se incluyen los estudios clave, las revisiones sistemáticas y las citas posteriores a estas.
- ∘
Esta GPC será de acceso libre universal. Se publicará en diversos formatos (papel y electrónicos), y estará disponible de forma libre en la red (Internet) para acceso de cualquier profesional y/o paciente.
- ∘
La información se presentará respondiendo a las preguntas generales planteadas en 3 formatos: revisión de la evidencia, texto explicativo resumido y algoritmos de decisión. El resumen de la evidencia se presenta respondiendo a cada una de las preguntas planteadas, mientras que los textos explicativos se articulan alrededor de los 6 algoritmos específicos que se han elaborado.
- ∘
Las decisiones estratégicas sobre la GPC las tomará GETECCU representado por su junta directiva, y por el comité de elaboración de guías nombrado al efecto.
- ∘
Los costes de elaboración corren a cargo de GETECCU que ha obtenido una BECA (sin ninguna restricción) para la elaboración de este proyecto de MSD.
- ∘
Los conflictos de intereses de los autores de la guía se explicitan en el anexo.
Se considera una colitis activa cualquier situación en la que el paciente tenga síntomas y/o signos indicativos de actividad. En caso de duda, la endoscopia e histología son las técnicas de referencia para la definición del cuadro. Para gravedad y extensión utilizamos la clasificación de Montreal2 (tabla 2). La información clave necesaria para el clínico se resume en los algoritmos 1 y 2 y su correspondiente texto explicativo. La revisión de la evidencia se presenta respondiendo a las preguntas elaboradas por el grupo de trabajo.
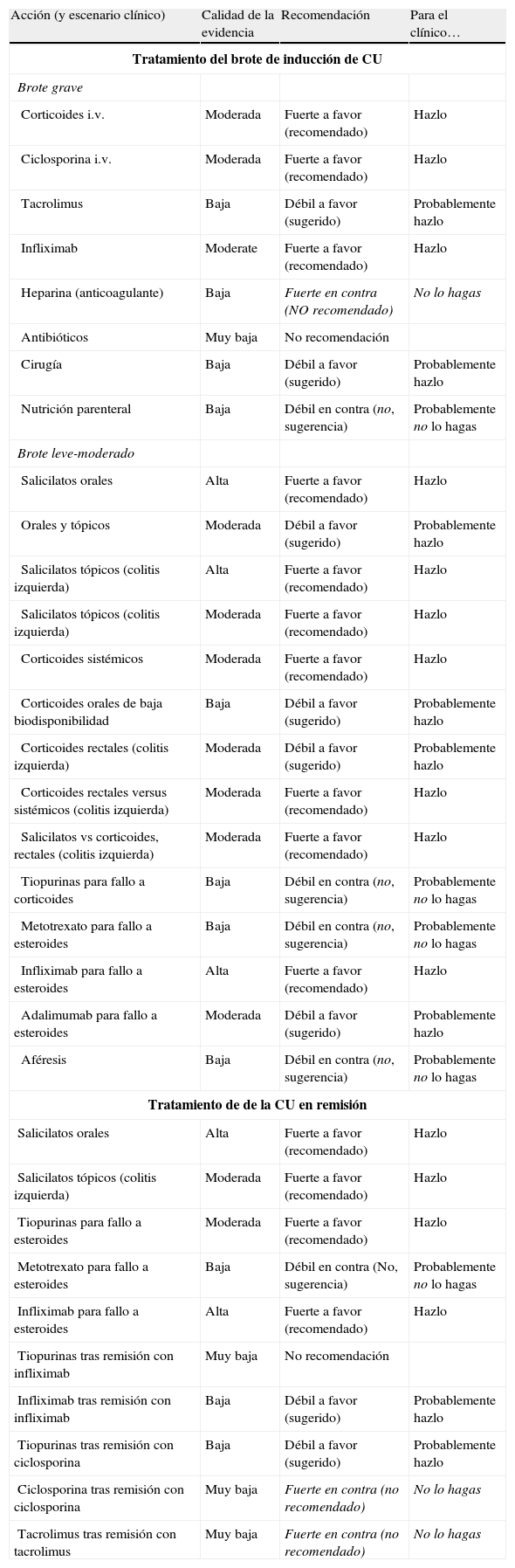
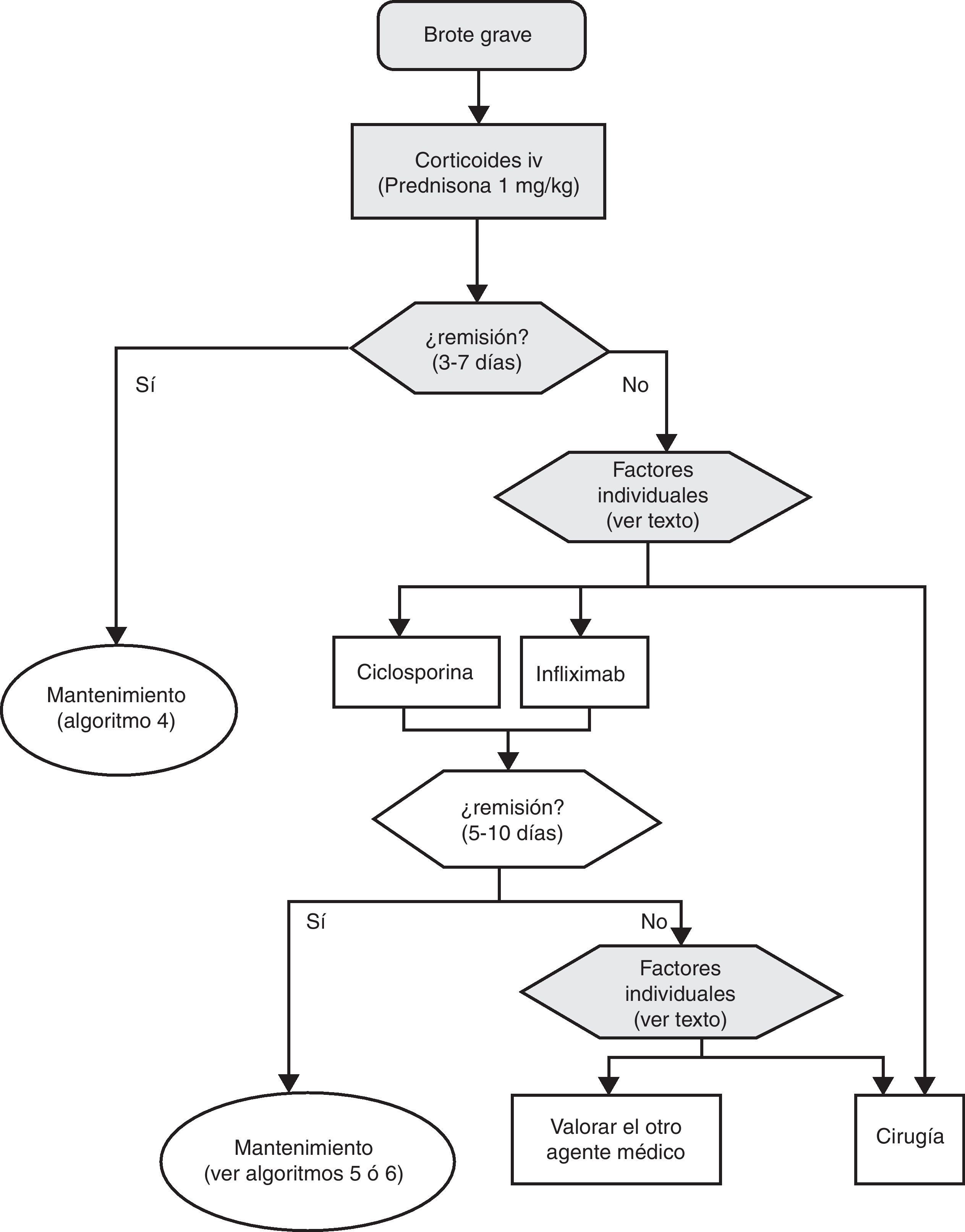
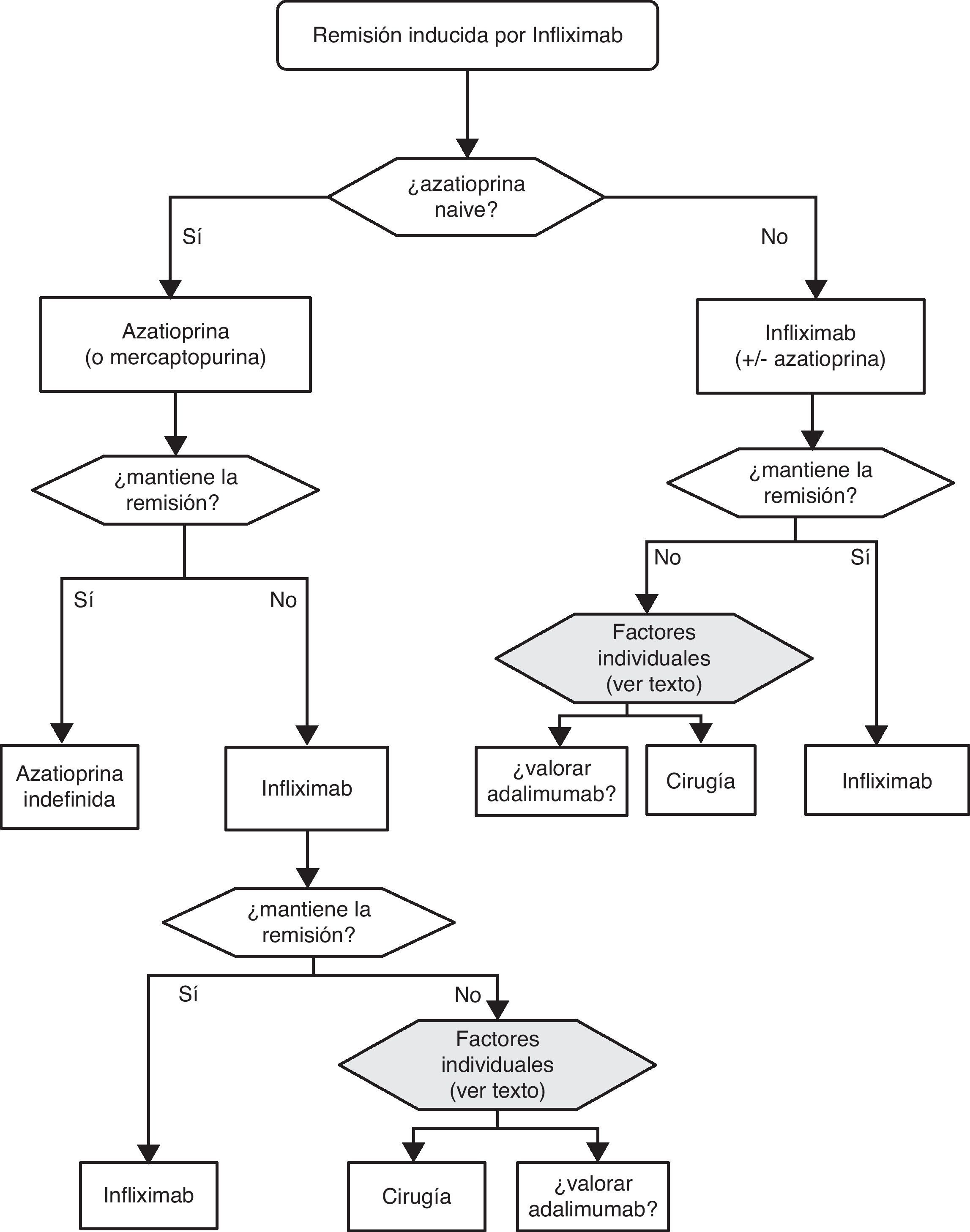
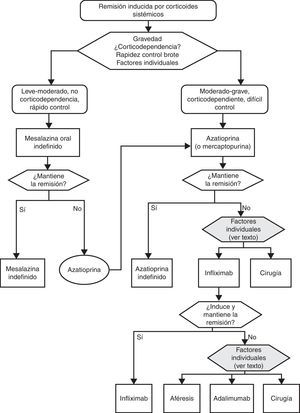
6.1Brote grave de colitis ulcerosa (de cualquier extensión anatómica) (algoritmo 1)6.1.1Corticoides«¿Son eficaces los corticoides en la inducción de la remisión del paciente con brote grave de CU?»
Texto de la guía:
| Disponemos de una revisión sistemática30 de gran calidad metodológica, en la que se revisan los 5 ECA disponibles con un total de 149 pacientes, junto con diversos estudios observacionales sobre un total de 1.991 pacientes. Solo hemos identificado un estudio relevante posterior31, que compara la administración en perfusión continua frente a la administración en bolus sin encontrar diferencias relevantes. Siendo los grupos de pacientes muy heterogéneos, llama poderosamente la atención que el resultado final del tratamiento con corticoides es muy homogéneo. Son eficaces en inducir la remisión, con una dosis media de 68 ± 13 mg/día de prednisona (o equivalente) (caja 3) (rango 40 a 100, con solo un estudio por debajo de 60 mg/día) y una tasa de remisión próxima al 70%. Visto desde otra perspectiva, a pesar del uso de corticoides alrededor de un 30% de los pacientes precisa una colectomía (44/149 [IC 95%: 23-37%] en ECA y 537/1.842 (IC 95%: 27-31%) en los estudios observacionales. | Calidad moderada |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Los datos disponibles se han obtenido a partir de estudios muy heterogéneos. Sin embargo, los resultados son extraordinariamente coherentes. Un gran número de estudios observacionales llevados a cabo en diferentes países y momentos coinciden con la experiencia clínica de los grandes centros y de los expertos. Todo ello confirma de forma independiente la conclusión final del primer ensayo clínico ya publicado en 1955: los corticoides reducen claramente (de >20% a<2%) la mortalidad del brote grave de CU. Tomados conjuntamente, los datos nos permiten establecer la recomendación de forma contundente. Es más, por motivos éticos, creemos muy improbable que se lleven a cabo nuevos ensayos con una rama placebo en este grupo de pacientes. |
| Por el conjunto de datos disponibles parece más importante la dosis total que la forma de administrar el fármaco (en bolus único diario, en perfusión continua o en dosis repartidas). No obstante, no hay suficientes datos comparativos, por lo que se podrá decidir en cada escenario en función del corticoide utilizado, los datos farmacocinéticos, y la experiencia local. |
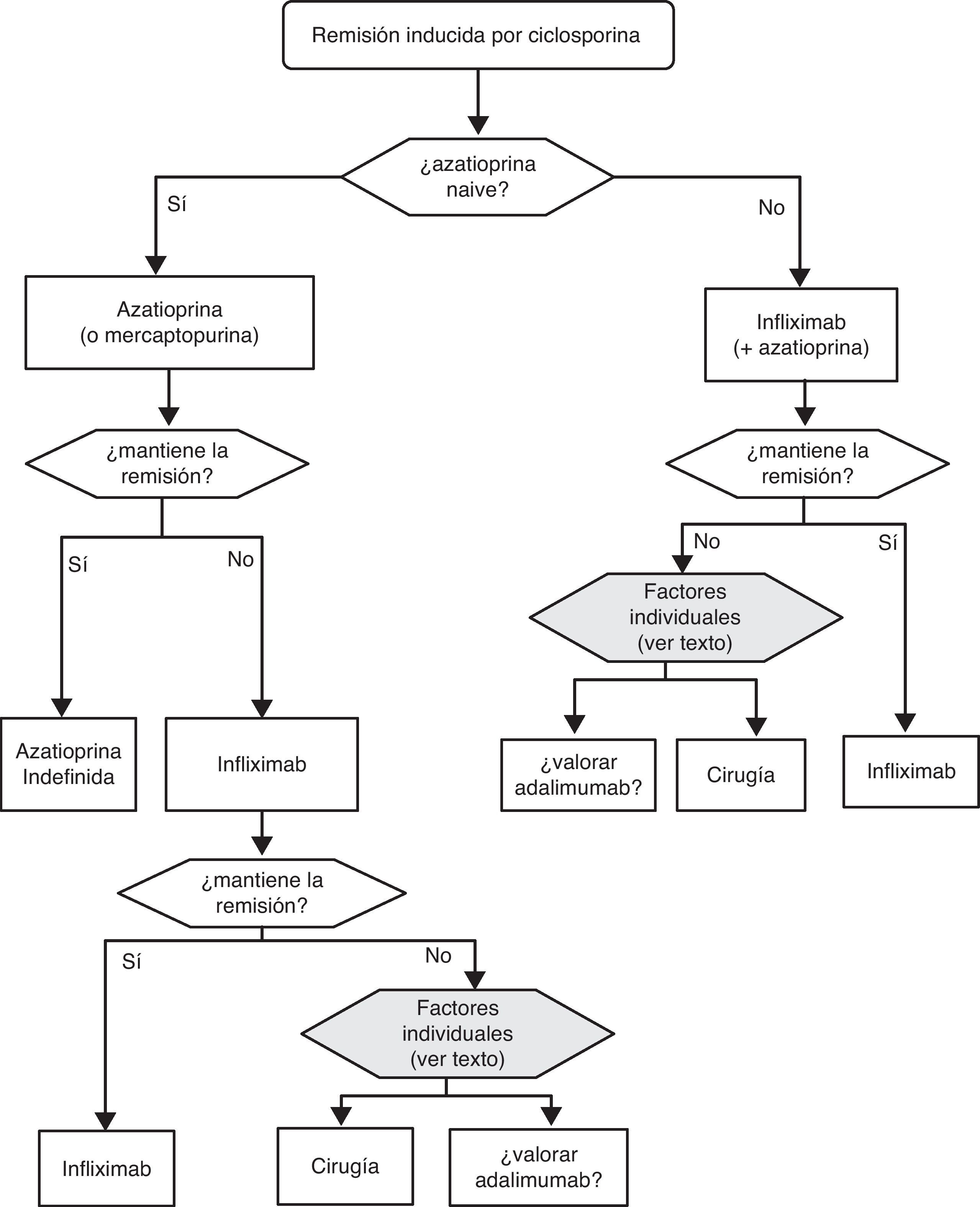
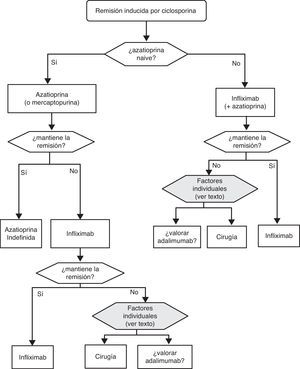
«¿Es eficaz la ciclosporina en la inducción de la remisión del paciente con brote grave de CU? ¿ Y en situación de corticorresistencia?»
Texto de la guía:
| Hay 2 revisiones sistemáticas que evalúan el efecto de la ciclosporina en la CU. Una revisión Cochrane32 incluye solo 2 ensayos controlados con un total de solo 50 pacientes, uno frente a corticoides en pacientes no resistentes a estos fármacos33 y el otro frente a placebo tras el fracaso de los corticoides24. Sin embargo, la otra revisión34 incluye además otros 2 estudios controlados (el primero comparando 4 mg/kg/día versus 2 mg/kg/día35 y el segundo comparando ciclosporina sola versus ciclosporina y corticoides36 con un total de 153 pacientes entre los 2 estudios), y un total de 27 estudios observacionales con 574 pacientes tratados con ciclosporina. Posteriormente a estas revisiones se ha publicado una serie retrospectiva relevante37. | Calidad moderada |
| Los estudios son considerablemente heterogéneos tanto en la definición de los pacientes a incluir, como en los objetivos primarios. No todos los parámetros definidos como claves en esta GPC (mortalidad, necesidad de colectomía) son fáciles de analizar globalmente, y solo uno de los estudios con un número pequeño de pacientes proporciona una comparación directa con el placebo24. Por tanto, la calidad de la evidencia la calificamos como de moderada. Sin embargo, la diferencia de riesgo absoluto con placebo fue tan grande (81%), y el resultado en el resto de los estudios tan homogéneo (se observa una respuesta clínica perfectamente definida entre el 60 y 80% de los casos), que la eficacia de esta alternativa terapéutica parece clara, máxime cuando la gran mayoría de los pacientes incluidos mostraban un fracaso previo tras el tratamiento con corticoides. Datos recientes comunicados en forma de resumen confirman que la ciclosporina es tan útil como el infliximab en el brote grave de colitis corticorresistente (estudio CYSIF, comunicado en la ECCO 2011). En este estudio, además, la tasa de colectomías a los 3 meses fue de solo el 20% en un grupo de pacientes con resistencia a corticoides, muy seleccionado por su gravedad. | |
| Los diferentes protocolos hacen también difícil evaluar la seguridad. No obstante, y de forma poco sorprendente (pacientes graves, con hospitalizaciones prolongadas, sometidos a inmunosupresión compleja) sí son comunes los efectos adversos graves, que aunque afectan a menos del 10% del total pueden resultar en mortalidad (aproximadamente el 1%), a pesar del uso de protocolos dentro de estudios clínicos (un escenario generalmente más favorable para los pacientes que la práctica real). | |
| Respecto a la dosis, 2 mg/kg/día administrados por vía intravenosa resultaron tener una eficacia similar a la dosis utilizada previamente de 4 mg/kg/día y con menos efectos secundarios, aunque en ambos grupos estudiados las dosis se ajustaban según los niveles sanguíneos, siendo las cantidades finales recibidas muy parecidas35 (caja 3). |
Síntesis de la evidencia:
Formulación de la recomendación:
| Recomendamos el uso de ciclosporina en la inducción de la remisión del paciente con brote grave de CU resistente a corticoides en dosis inicial de 2 mg/kg/día i.v., dosis que puede adaptarse al paciente individual hasta un máximo de 4 mg/kg/día i.v. en función de los niveles obtenidos y la toxicidad. | Fuerte a favor |
Comentario del grupo elaborador:
| En un brote de CU resistente a corticoides hay que considerar siempre posibles infecciones como causa real de la resistencia (infección por citomegalovirus (CMV), infección por Clostridium difficile). Además, hay siempre diferentes opciones de tratamiento disponibles, y se debe definir el escenario de la forma más precisa posible antes de recomendar una decisión. Las características individuales del paciente influirán en la elección del tratamiento: así, el tratamiento previo o no con inmunomoduladores es un aspecto muy importante. Si el paciente ya los recibía cuando presentó el brote grave resistente la probabilidad de mantener la remisión con estos mismos fármacos, tras obtener la remisión con ciclosporina es, presumiblemente, baja. Dado que la ciclosporina puede administrarse un tiempo limitado en una entidad benigna, por el riesgo de toxicidad renal irreversible, no parece razonable utilizarla en este contexto. La opción de uso de ciclosporina debe evaluarse siempre junto con la posibilidad de cirugía, o del uso de infliximab. |
| La seguridad es el condicionante más importante en el uso de ciclosporina, por lo que es recomendable seguir un protocolo de seguimiento preestablecido38. Algunos de los efectos adversos son más probables en tratamientos prolongados, por lo que se debe considerar cuidadosamente la duración de la prescripción. Otro de los factores más importantes en la aparición de efectos adversos es el cotratamiento con otros inmunomoduladores, especialmente los corticoides. La experiencia del centro en el uso del fármaco también puede ser determinante a la hora de utilizar o no ciclosporina (se debe disponer de facilidades para la determinación de niveles sanguíneos, por ejemplo). |
«¿Es eficaz el tacrolimus en la inducción de la remisión del paciente con brote grave de CU? ¿ Y en situación de corticorresistencia?»
Texto de la guía:
| Se dispone de un único ensayo controlado39 en pacientes con CU activa entre moderada y grave (sobre todo moderada), hospitalizados, corticorresistentes o corticodependientes, y aleatorizados en 3 grupos: placebo (n=20) o tacrolimus oral en dosis baja (n=22) o alta (n=21) (concentración objetivo de 5-10 y 10-15 ng/ml en sangre, respectivamente). Se evaluó la eficacia en la semana 2, mediante el índice de Mayo22 (DAI), siendo el objetivo primario la inducción de mejoría (respuesta parcial o remisión). En el análisis por intención de tratar, se obtuvo respuesta clínica (respuesta parcial o remisión) en 2/20 (10%), 8/22 (36%) y 13/21 (62%) respectivamente. La OR para respuesta de tacrolimus versus placebo fue 8,66 (IC 95%: 1,79-42) con una reducción absoluta de riesgo de 0,39, y una NNT de 3. Solo a dosis alta es significativamente superior frente a placebo, y los datos señalan un efecto dosis-respuesta. Si nos centramos solo en analizar la remisión, las diferencias entre tacrolimus y placebo no alcanzaron la significación estadística: tacrolimus altas dosis 19% (4/21), bajas dosis 9% (2/22) y placebo 5% (1/20), con un OR de 2,27 (IC 95%: 0,35-14,75). Si analizamos la eficacia en función de la gravedad del brote, tacrolimus fue eficaz tanto en los brotes moderados como en los graves. Si analizamos la respuesta en función de la indicación (corticorresistencia o corticodependencia), en ambos casos tacrolimus es eficaz y de forma similar. No hubo colectomías ni mortalidad y tampoco efectos adversos graves. | Calidad baja |
| Una revisión sistemática40 recogió las diversas series observacionales disponibles. Sin poder definir cuántos pacientes eran graves y/o resistentes a los corticoides, el 53% de pacientes tratados alcanzó «respuesta completa o remisión». Una serie posterior41 tampoco permitía definir la gravedad, pero incluía 40 pacientes con CU, 14 de ellos dependientes y 26 resistentes a corticoides tratados con tacrolimus oral. La tasa de respuesta inicial (definida a los 30 días) fue del 77,5% y la de remisión del 18%. En el seguimiento posterior (hasta 44 meses) 9 pacientes (22,5%) son colectomizados. La duración del tratamiento con tacrolimus fue muy variable y el 77% de los pacientes recibieron azatioprina de forma concomitante (ninguno recibió otro inmunomodulador), sin efectos adversos graves frecuentes. Una revisión sistemática Cochrane recoge estos mismos datos42. | |
| No hemos encontrado ningún estudio controlado que haya comparado el uso de tacrolimus frente a sus alternativas, ciclosporina o infliximab. Los datos prácticos sobre tacrolimus se resumen en la caja 3. |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Aunque el mecanismo de acción es muy similar a ciclosporina, y ambos fármacos muestran eficacias similares en otros escenarios clínicos (trasplantes); los datos publicados son claramente menos numerosos y de menor calidad metodológica. Es más, los resultados del único ensayo clínico controlado disponible son decepcionantes cuando se comparan con los estudios observacionales. Por supuesto, en ambos fármacos es absolutamente esencial la experiencia del equipo médico en su uso para minimizar la toxicidad, como se ha demostrado extensamente en el contexto del trasplante. Solo la experiencia del equipo podría llevar a preferir tacrolimus, teniendo en cuenta los datos publicados hasta la fecha. Son totalmente aplicables, por otra parte, la mayoría de los comentarios previamente desarrollados en el apartado de ciclosporina. |
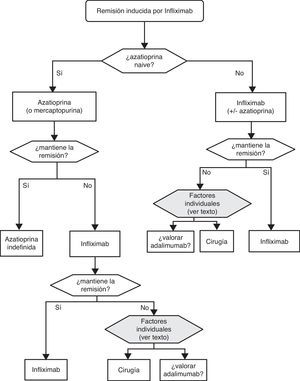
«¿Es eficaz el infliximab en la inducción de la remisión del paciente con brote grave de CU? ¿ Y en situación de corticorresistencia?»
Texto de la guía:
| Aunque disponemos de una revisión sistemática Cochrane43, la publicada posteriormente por Gisbert et al. 44 incluye tanto los ECA (7 ECA: 5 frente a placebo, 2 frente a corticoides, incluyendo en total 555 pacientes) como los estudios no controlados (27 estudios, 341 pacientes), por lo que la utilizamos como base de nuestro análisis. En la mayoría de los ECA se mezclan pacientes graves y moderados. De hecho, solo en 322 de los 896 pacientes se define claramente la intensidad del brote, siendo 207 casos (64,2%) graves. En los 2 estudios con más pacientes incluidos45 la mayoría de los pacientes son ambulatorios, lo que indica que se trata sobre todo de brotes moderados. La información sobre la corticorresistencia o corticodependencia es también limitada en los estudios citados: solo se comunica el porcentaje de pacientes que está recibiendo tratamiento con corticoides. | Calidad moderada |
| Hay 2 ECA, sin embargo, que incluyen exclusivamente pacientes en brote grave46,47 con corticorresistencia. Los resultados son contradictorios, puesto que el infliximab resulta muy superior al placebo46 en uno e ineficaz en el otro47, aunque este estudio incluye pocos pacientes y tiene un riesgo de error beta muy elevado. El estudio escandinavo46 es el más completo e incluye análisis de la mortalidad (ausente en ambos grupos) y de la necesidad de colectomía a corto y largo plazo. Se observa una reducción significativa del riesgo (RR 0,44; [IC 95%: 0,22-0,87]) en la tasa de colectomía a los 13 meses, algo muy relevante desde el punto de vista clínico. Recientemente se ha demostrado que el efecto de esta única intervención en la fase aguda persiste a los 36 meses48. El análisis conjunto de los 4 ECA sobre la eficacia demuestra la superioridad de infliximab frente a placebo, tanto para inducir respuesta (OR 3,60 [2,67-4,85]) como para inducir remisión (OR 4,56 [1,98-10,52]) (solo en 2 ECA tenemos el dato de remisión). La comparación de infliximab frente a corticoides se analiza en 2 ECA abiertos con poblaciones pequeñas, sin encontrar diferencias estadísticamente significativas. | |
| Aunque los efectos adversos graves son infrecuentes (< 5%), hay una mayor incidencia de infecciones, especialmente oportunistas, que pueden resultar en mortalidad (< 1%). Los riesgos parecen mayores si el infliximab se asocia a otros inmunomoduladores. | |
| Resumiendo, infliximab es superior a placebo en el tratamiento del brote grave de CU, con un riesgo de efectos adversos graves aceptable, pero que se asocia ocasionalmente con mortalidad. Recientemente se han dado a conocer en varias comunicaciones los resultados del estudio europeo CYSIF, en el que se compara de forma aleatorizada infliximab con ciclosporina en el brote grave de CU resistente a corticoides. No hay diferencias entre ambos, y ambos fármacos parecen ser muy eficaces con una tasa de colectomía a los 90 días de un 20%, y un buen perfil de seguridad. No hay datos de comparación directa con cirugía. A pesar del número importante de pacientes y de estudios, tenemos que calificar la calidad de la evidencia como moderada por la heterogeneidad, la falta de definición del escenario clínico exacto en muchos casos, y el número relativamente bajo de brotes graves analizado, aunque cada vez se dispone de más datos observacionales que confirman lo descrito en los estudios citados49. |
Síntesis de la evidencia:
| Aunque los datos son muy heterogéneos, infliximab es más eficaz que placebo en el brote grave de CU, y concretamente en los brotes graves resistentes a corticoides, siendo además aparentemente igual de eficaz que ciclosporina. Aumenta la tasa de remisión clínica y disminuye la tasa de colectomías, persistiendo la significación estadística de este efecto en el medio plazo. Los estudios observacionales apoyan estos resultados. No disponemos de datos definitivos que demuestren su superioridad en el brote grave frente a corticoides o menos aún frente a ciclosporina. Los efectos secundarios son posibles, potencialmente graves, siendo su perfil de seguridad bien conocido, análogo al descrito en la enfermedad de Crohn (EC), aunque grabados por el contexto de gravedad de esta situación. | Calidad moderada |
Formulación de la recomendación:
Comentario del grupo elaborador:
| Además de las consideraciones de los apartados anteriores, tenemos que añadir que se acaban de conocer (verano de 2011) los resultados de un estudio comparativo entre ciclosporina e infliximab en los brotes graves de CU, aunque no disponemos de la información completa publicada. En cualquier caso, ambas opciones mostraron un comportamiento similar en el brote grave resistente a corticoides, y solo uno de cada 5 pacientes requirió una colectomía a los 90 días. La falta de diferencias entre ambas opciones obliga a decidir una recomendación en función de las circunstancias de cada paciente y de los condicionantes locales del centro. Además, el seguimiento a largo plazo de los pacientes del estudio del grupo escandinavo confirma algo muy importante: una intervención con éxito en la fase aguda puede evitar la colectomía a medio y largo plazo48. |
«¿Es eficaz la heparina (a dosis anticoagulante) en la inducción de la remisión del paciente con brote grave de CU?»
Texto de la guía:
| Se dispone de una revisión Cochrane50 basada en 2 ensayos controlados comparando la heparina de bajo peso molecular (HBPM) con el placebo en el brote de actividad de CU. No se encontró diferencia con respecto al placebo en la inducción de la remisión (OR 1,09; IC 95%: 0,26-4,23). Tampoco se encontró ninguna evidencia en otros estudios de que añadir la HBPM a otros tratamientos mejorara la respuesta. Es más, un estudio que comparaba la heparina no fraccionada (heparina sódica intravenosa) con los corticoides51 (como tratamiento estándar del brote grave de CU, véase punto 6.1.1) mostró una clara inferioridad de la heparina con una OR de 0,02 (IC 95%: 0-0,4; p=0,01) en cuanto al punto de análisis de respuesta clínica, con más efectos adversos (hemorragia) en el grupo de heparina. | Calidad baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Todo lo anterior se refiere a la heparina como agente terapéutico primario, utilizada a dosis anticoagulante. Aunque no se dispone de datos controlados, una serie de pruebas indirectas sugieren fuertemente que el uso de heparina de bajo peso molecular a dosis antitrombóticas es recomendable en prácticamente todos los pacientes con un brote grave de CU. El riesgo basal de fenómenos tromboembólicos en esta situación clínica es muy alto y, de hecho, son una de las causas más importantes de mortalidad52,53. |
«¿Son eficaces los antibióticos en la inducción de la remisión del paciente con brote grave de CU?»
Texto de la guía:
| Disponemos de una revisión sistemática54 en la que se incluyen 10 ECA en los que se compara el tratamiento antibiótico frente a placebo con CU activa en 509 pacientes: 263 antibiótico versus 267 placebo más tratamiento habitual, pero no se detalla la gravedad de los brotes. El momento de valoración de la respuesta se realiza precozmente (1-14 días) en todos los estudios excepto en uno de ellos en que se evalúa a los 180 días. Los estudios incluidos utilizan diferentes tipos de antibióticos a diferentes dosis, por diferentes vías, e incluso asociaciones: vancomicina 7%, metronidazol 7%, tobramicina 31%, ciprofloxacino 38,5%, rifaximina 5,5%, metronidazol más tobramicina 7%, metronidazol más amoxicilina más tetraciclina 4%. El RR hallado es de 1,30 [1,14-1,49] traduciendo un posible beneficio del uso de antibióticos en estos pacientes (siempre asociados a corticoides). Si analizamos solamente la respuesta precoz, excluyendo el estudio a largo plazo, el OR sigue manteniéndose en 2,02 (1,36-3.00). No se evalúan los efectos adversos. Un ensayo clínico muy reciente55 con una combinación de amoxicilina, tetraciclina y metronidazol no mostró diferencias en la remisión a corto plazo, pero sí mejoró la respuesta y la remisión a los 12 meses. Por el tipo de estudio, la mayor parte de los pacientes incluidos sufrían un brote leve o moderado. | Calidad muy baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Si bien como agentes primarios no se puede establecer una recomendación, en los casos graves con alto riesgo de perforación y especialmente en los casos de megacolon, prácticamente todos los expertos recomiendan utilizar un tratamiento antibiótico dirigido a gérmenes gramnegativos y anaerobios. En dependencia de las tasas locales de resistencias se recomiendan: cefotaxima más metronidazol, ciprofloxacino más metronidazol, imipenem, meropenem o piperacilina-tazobactam. Estas recomendaciones no difieren de las emitidas en otros escenarios clínicos de infección intraabdominal grave. |
«¿Son eficaces los antibióticos en la inducción de la remisión del paciente con brote grave de CU?»
La colectomía se estableció como tratamiento de la CU cuando las alternativas médicas eran inexistentes. Poco a poco, con los avances técnicos, anestésicos y de control del post-operatorio, la colectomía alcanzó tasas de mortalidad claramente inferiores a la de la evolución espontánea del brote. La ausencia de estudios controlados en este campo es uno de los ejemplos más claros de aquellas situaciones evidentes por sí mismas, pero imposibles de demostrar. No hay ninguna duda razonable de que la colectomía es un tratamiento muy eficaz en el brote grave de CU, un escenario en el que, en ausencia de tratamiento médico, se describían mortalidades del 22 al 77%. Aunque tampoco disponemos de estudios controlados, son muy convincentes los resultados de las series de Oxford de los años 1960 y 1970, en estudios dirigidos por Sidney Truelove56 en la era de los corticoides. Los mejores resultados se obtenían cuando se señalaba a priori un día fijo en el que aquel paciente sin respuesta a los corticoides era intervenido (en las series de Oxford ello se decidía el quinto día de tratamiento, en las series escandinavas se decidía un poco más tarde pero con resultados muy similares57). Resulta curioso cómo tras la introducción de nuevas alternativas médicas, como la ciclosporina o el infliximab, la mayor parte de los expertos ponen un énfasis especial en recomendar una toma de decisión precoz (tercer, quinto, séptimo o décimo día, según los autores). En algunas ocasiones la cirugía es la mejor alternativa: perforación, hemorragia grave que no se controla con tratamiento endoscópico o megacolon tóxico de más de 72 h de duración. En otras es, probablemente, la alternativa preferente: colitis grave con una historia clínica muy prolongada y/o diagnóstico previo de displasia, por ejemplo. En la mayoría, es solo una alternativa de reserva y solo se indica si ha fracasado el tratamiento médico previo. En cualquier caso, la experiencia indica que en el tratamiento de un brote grave de CU la colaboración de un equipo quirúrgico desde el mismo ingreso del paciente ayuda a tomar decisiones más coherentes en todos los momentos con una disyuntiva terapéutica.
Síntesis de la evidencia:
Formulación de la recomendación:
| Recomendamos la cirugía como una alternativa en el brote grave de CU corticorresistente, aunque en la mayoría de los casos se debe intentar un tratamiento de rescate con infliximab o ciclosporina previamente. En algunos escenarios clínicos la indicación es absoluta (perforación, hemorragia masiva o megacolon tóxico de más de 3 días de evolución). | Débil a favor |
Comentario del grupo elaborador:
| La cirugía es una alternativa para el tratamiento del paciente en brote grave de CU, y en algunas circunstancias clínicas (perforación libre, hemorragia masiva, megacolon tóxico resistente) es la única alternativa. Las decisiones en estos escenarios clínicos pueden ser muy difíciles, y deben resultar de la interacción fluida y abierta entre el equipo médico, el equipo quirúrgico, los familiares o personas vinculadas y, fundamentalmente, un paciente bien informado. Reconociendo que en ocasiones la indicación del tratamiento es prácticamente absoluta, el grado de recomendación general tiene que ser débil a favor por la ausencia de estudios comparativos con el resto de opciones terapéuticas. |
«¿Son eficaces los antibióticos en la inducción de la remisión del paciente con brote grave de CU?»
Tampoco en el caso de la nutrición parenteral disponemos de estudios suficientes para la elaboración de una tabla GRADE. Sin embargo, sí podemos enunciar varios principios básicos, bien por la existencia de estudios controlados, bien por datos indirectos y/o experimentales58:
- •
Frente a lo sugerido en la primera mitad del siglo xx, la dieta absoluta no tiene ninguna efectividad terapéutica primaria y por tanto, salvo en casos de intolerancia oral absoluta, obstrucción intestinal, o extrema gravedad, no debe suspenderse la alimentación oral.
- •
La nutrición parenteral no tiene eficacia primaria en el tratamiento de la CU, y en general debe preferirse la nutrición enteral59. Además, es más cara, y supone un mayor riesgo de infección y fenómenos tromboembólicos cuando se compara con la nutrición enteral.
- •
En caso de no poder asegurar un aporte calórico y nutricional completo, se debe utilizar la nutrición enteral, bien como suplemento o incluso como fuente única de alimentación.
- •
En casos de brotes graves cabe prever un ingreso hospitalario relativamente prolongado. Existen estudios de los años 198060, corroborados en fechas tan recientes como 200861 que demuestran que a los pacientes hospitalizados se les da el alta (por término medio) en peor situación nutricional que la que presentaban a su ingreso. Asimismo, numerosas pruebas, experimentales y clínicas, confirman que una nutrición adecuada es necesaria para un funcionamiento correcto del sistema inmunológico. En el paciente con CU grave, el riesgo de infecciones nosocomiales, oportunistas o no, es muy alto por diversos factores: la hospitalización, la utilización de sondas y catéteres, el aumento de la permeabilidad intestinal (rotura de la barrera mucosa), la desnutrición y el uso de fármacos inmunomoduladores son los más importantes. Las medidas de control de infecciones ayudarán a disminuir el riesgo, pero es seguro que podemos incidir médicamente asegurando una buena nutrición. Colateralmente, podemos disminuir los efectos negativos de algunos fármacos manteniendo un buen estado nutricional (calcio y vitamina D para la prevención de la osteoporosis; prevención de hipocolesterolemia e hipomagnesemia para el uso de ciclosporina).
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| No hay duda de que una nutrición adecuada es esencial en el tratamiento del brote grave de CU. Sin embargo, no hay evidencia de un efecto primario sobre la actividad de la enfermedad, y la nutrición parenteral está gravada con costes y riesgos. Por tanto, lo recomendable es nutrir a cada paciente como precise, bien sea con dieta normal (los menos), con nutrición enteral (la mayoría) o con nutrición parenteral (una minoría). Se observa a veces en la práctica clínica que se espera un posible efecto beneficioso primario de la nutrición parenteral, lo que puede retrasar innecesariamente la toma de decisiones terapéuticas clave. |
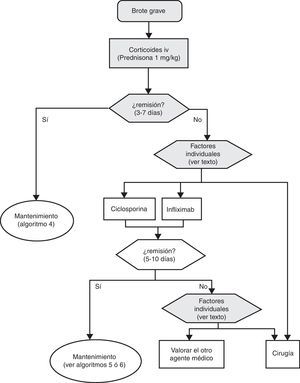
Tratamiento del brote grave
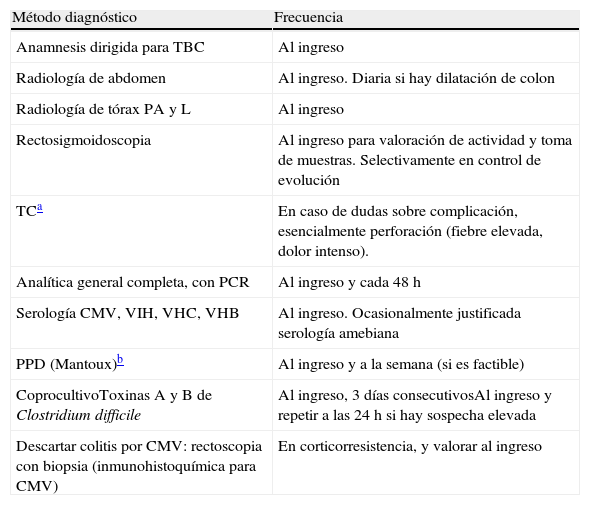
El tratamiento del brote grave se resume en el algoritmo 1. Cuando se establece el diagnóstico de brote grave de CU en la gran mayoría de los casos resulta prudente la hospitalización8,13,17,62. Desde el primer momento, hay que plantear una estrategia que incluya las medidas inmediatas, las opciones si estas fracasan, y también el tratamiento posible a medio y largo plazo. Para ello es clave revisar toda la información diagnóstica (tabla 10), reevaluando todos aquellos datos que puedan ser de interés en la toma de decisiones en cada caso concreto62.
Revisión de la información diagnóstica previa al tratamiento del brote grave
| Método diagnóstico | Frecuencia |
| Anamnesis dirigida para TBC | Al ingreso |
| Radiología de abdomen | Al ingreso. Diaria si hay dilatación de colon |
| Radiología de tórax PA y L | Al ingreso |
| Rectosigmoidoscopia | Al ingreso para valoración de actividad y toma de muestras. Selectivamente en control de evolución |
| TCa | En caso de dudas sobre complicación, esencialmente perforación (fiebre elevada, dolor intenso). |
| Analítica general completa, con PCR | Al ingreso y cada 48 h |
| Serología CMV, VIH, VHC, VHB | Al ingreso. Ocasionalmente justificada serología amebiana |
| PPD (Mantoux)b | Al ingreso y a la semana (si es factible) |
| CoprocultivoToxinas A y B de Clostridium difficile | Al ingreso, 3 días consecutivosAl ingreso y repetir a las 24 h si hay sospecha elevada |
| Descartar colitis por CMV: rectoscopia con biopsia (inmunohistoquímica para CMV) | En corticorresistencia, y valorar al ingreso |
El tratamiento inicial se basará en la mayoría de los casos (salvo contraindicación absoluta por toxicidad grave previa o situación de urgencia quirúrgica) en la administración de corticoides intravenosos, a una dosis equivalente a 1mg/kg de prednisona por día. Se puede administrar en una dosis única o fragmentada, o incluso en perfusión continua. Además se debe completar el tratamiento con otras medidas, como prevenir la tromboembolia, obtener una nutrición adecuada y, en casos seleccionados, administrar antibióticos (tabla 11). El seguimiento clínico debe ser como mínimo diario, y preferiblemente conjunto con el cirujano. Resulta práctico incluir en los procedimientos de evaluación diagnóstica aquellos que nos informan sobre los riesgos de efectos adversos de infliximab, ciclosporina o azatioprina, puesto que podrán permitir iniciar los tratamientos con mayor seguridad en caso de ser necesarios, instituyendo en su caso las medidas preventivas necesarias.
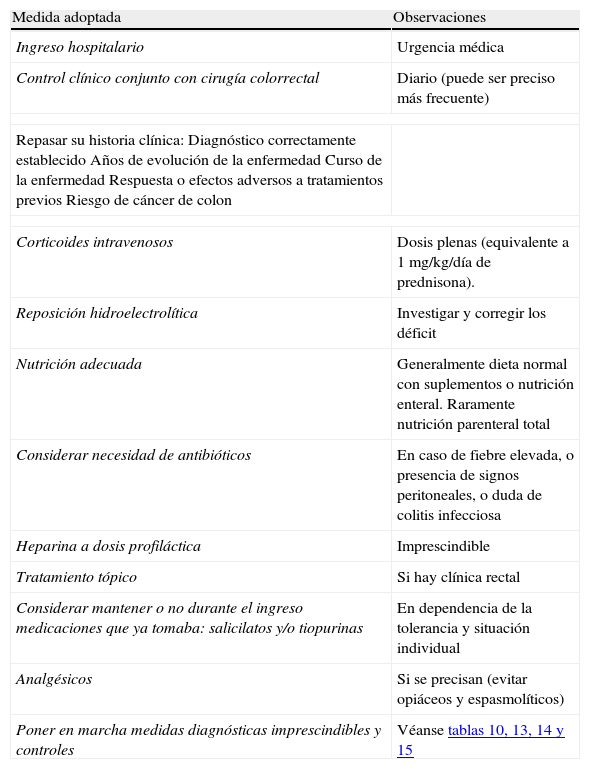
Resumen del tratamiento general del brote grave
| Medida adoptada | Observaciones |
| Ingreso hospitalario | Urgencia médica |
| Control clínico conjunto con cirugía colorrectal | Diario (puede ser preciso más frecuente) |
| Repasar su historia clínica:Diagnóstico correctamente establecidoAños de evolución de la enfermedadCurso de la enfermedadRespuesta o efectos adversos a tratamientos previosRiesgo de cáncer de colon | |
| Corticoides intravenosos | Dosis plenas (equivalente a 1 mg/kg/día de prednisona). |
| Reposición hidroelectrolítica | Investigar y corregir los déficit |
| Nutrición adecuada | Generalmente dieta normal con suplementos o nutrición enteral. Raramente nutrición parenteral total |
| Considerar necesidad de antibióticos | En caso de fiebre elevada, o presencia de signos peritoneales, o duda de colitis infecciosa |
| Heparina a dosis profiláctica | Imprescindible |
| Tratamiento tópico | Si hay clínica rectal |
| Considerar mantener o no durante el ingreso medicaciones que ya tomaba: salicilatos y/o tiopurinas | En dependencia de la tolerancia y situación individual |
| Analgésicos | Si se precisan (evitar opiáceos y espasmolíticos) |
| Poner en marcha medidas diagnósticas imprescindibles y controles | Véanse tablas 10, 13, 14 y 15 |
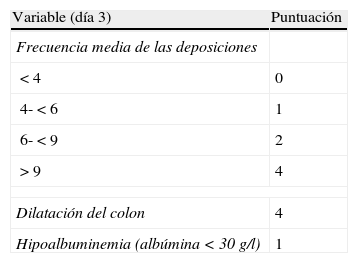
Es recomendable fijar desde el primer día un momento para evaluar la respuesta, y lo más adecuado es hacerlo entre el tercer y el quinto día tras iniciar el tratamiento, tendiendo la mayoría de los autores a recomendar una evaluación inicial a las 72 h62. En ese momento, el paciente puede haber alcanzado la remisión (en cuyo caso se pasará progresivamente de la fase de tratamiento a la de mantenimiento) o no. Si no se ha obtenido la remisión, disponemos de diversos índices (por ejemplo el de Ho et al.63, tabla 12) que permiten predecir la probabilidad de respuesta si el tratamiento corticoideo se prolongase. Un reciente modelo sencillo, evaluado prospectivamente en un hospital, señala que con 4 parámetros (rectorragia, PCR, recuento de plaquetas y número de deposiciones) evaluados al tercer día se puede decidir con bastante precisión si el paciente precisa cambiar o no de tratamiento. De confirmarse en otros centros, este modelo permitirá tomar decisiones con datos disponibles en cualquier centro con gran facilidad64. En ocasiones la situación es muy clara, y se propone un nuevo tratamiento médico (infliximab o ciclosporina) a iniciar entre el tercer y el quinto día. En otros pacientes la situación no es tan clara, y se prefiere hacer una reevaluación entre los días quinto y séptimo tras iniciar los corticoides. Si en el séptimo día no se ha alcanzado la remisión, lo mejor es iniciar ya el tratamiento alternativo.
Probabilidad de respuesta a los corticoides (índice de Ho)
| Variable (día 3) | Puntuación |
| Frecuencia media de las deposiciones | |
| <4 | 0 |
| 4-<6 | 1 |
| 6-<9 | 2 |
| >9 | 4 |
| Dilatación del colon | 4 |
| Hipoalbuminemia (albúmina <30 g/l) | 1 |
Valoración del índice (probabilidad estimada de fallo con el tratamiento médico):
Puntuación índice. Probabilidad de no respuesta al tratamiento médico:
0-1 = 11%.
2-3 = 43%.
≥ 4 = 85%.
Fuente: Ho et al.63.
Cuando fracasan los corticoides disponemos de 3 alternativas: ciclosporina, infliximab o cirugía. La falta de estudios comparativos impide ser taxativos. En este nodo de decisión es muy importante la opinión del paciente bien asesorado, con la colaboración de los familiares y personas vinculadas, y es absolutamente preciso descartar otras causas de resistencia, especialmente una infección cólica por CMV65 y por C. difficile (mediante el estudio de signos de infección por CMV en una biopsia rectal y mediante determinación de toxina en heces, respectivamente). Favorecen la cirugía una historia prolongada de la enfermedad y/o la presencia de displasia en controles previos, así como 2 situaciones clínicas: megacolon tóxico y hemorragia masiva. En casi todos los casos, no obstante, se debe intentar una opción médica. Si el paciente ha sufrido el brote grave mientras ya estaba en tratamiento con tiopurinas (fármacos que serían necesarios en el tratamiento de mantenimiento posciclosporina) lo más indicado es, probablemente, utilizar infliximab. En el resto de casos, se puede escoger entre infliximab44 o ciclosporina38, decisión en la que la experiencia del equipo y otros factores locales (posibilidad de determinación de niveles sanguíneos de ciclosporina, por ejemplo) son determinantes. Se deben seguir las recomendaciones generales para el uso de infliximab66 (tabla 13) o ciclosporina38 (tablas 14–16).
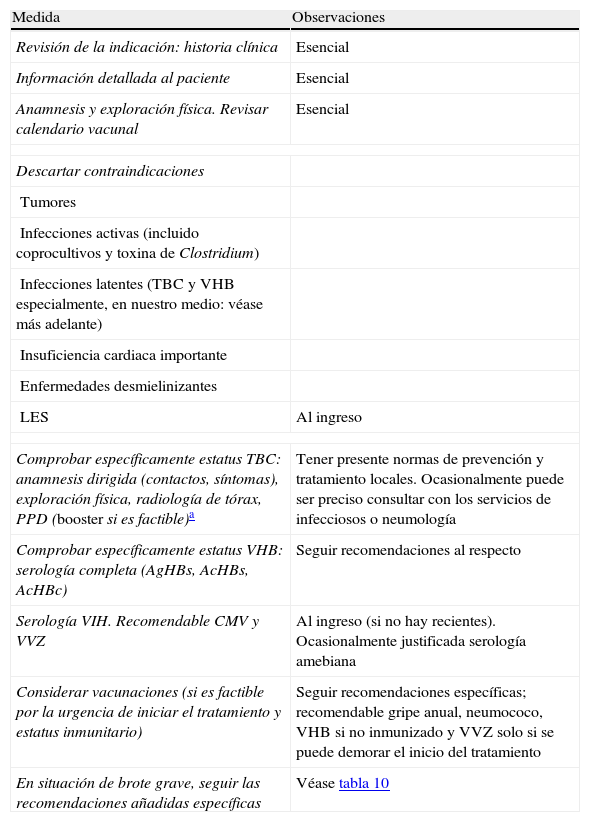
Medidas previas a iniciar tratamiento con infliximab
| Medida | Observaciones |
| Revisión de la indicación: historia clínica | Esencial |
| Información detallada al paciente | Esencial |
| Anamnesis y exploración física. Revisar calendario vacunal | Esencial |
| Descartar contraindicaciones | |
| Tumores | |
| Infecciones activas (incluido coprocultivos y toxina de Clostridium) | |
| Infecciones latentes (TBC y VHB especialmente, en nuestro medio: véase más adelante) | |
| Insuficiencia cardiaca importante | |
| Enfermedades desmielinizantes | |
| LES | Al ingreso |
| Comprobar específicamente estatus TBC: anamnesis dirigida (contactos, síntomas), exploración física, radiología de tórax, PPD (booster si es factible)a | Tener presente normas de prevención y tratamiento locales. Ocasionalmente puede ser preciso consultar con los servicios de infecciosos o neumología |
| Comprobar específicamente estatus VHB: serología completa (AgHBs, AcHBs, AcHBc) | Seguir recomendaciones al respecto |
| Serología VIH. Recomendable CMV y VVZ | Al ingreso (si no hay recientes). Ocasionalmente justificada serología amebiana |
| Considerar vacunaciones (si es factible por la urgencia de iniciar el tratamiento y estatus inmunitario) | Seguir recomendaciones específicas; recomendable gripe anual, neumococo, VHB si no inmunizado y VVZ solo si se puede demorar el inicio del tratamiento |
| En situación de brote grave, seguir las recomendaciones añadidas específicas | Véase tabla 10 |
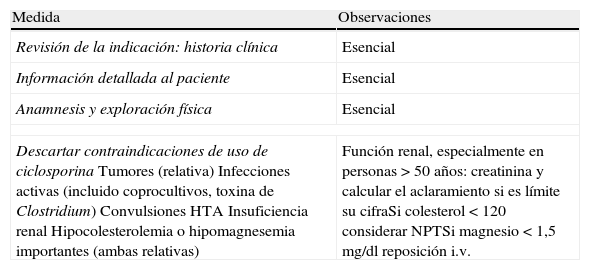
Medidas previas a iniciar tratamiento con ciclosporina
| Medida | Observaciones |
| Revisión de la indicación: historia clínica | Esencial |
| Información detallada al paciente | Esencial |
| Anamnesis y exploración física | Esencial |
| Descartar contraindicaciones de uso de ciclosporinaTumores (relativa)Infecciones activas (incluido coprocultivos, toxina de Clostridium)ConvulsionesHTAInsuficiencia renalHipocolesterolemia o hipomagnesemia importantes (ambas relativas) | Función renal, especialmente en personas >50 años: creatinina y calcular el aclaramiento si es límite su cifraSi colesterol<120 considerar NPTSi magnesio<1,5 mg/dl reposición i.v. |
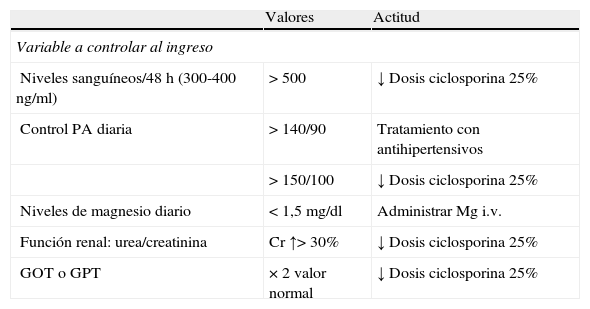
Medidas de seguimiento del tratamiento con ciclosporina
| Valores | Actitud | |
| Variable a controlar al ingreso | ||
| Niveles sanguíneos/48 h (300-400 ng/ml) | >500 | ↓ Dosis ciclosporina 25% |
| Control PA diaria | >140/90 | Tratamiento con antihipertensivos |
| >150/100 | ↓ Dosis ciclosporina 25% | |
| Niveles de magnesio diario | <1,5 mg/dl | Administrar Mg i.v. |
| Función renal: urea/creatinina | Cr ↑>30% | ↓ Dosis ciclosporina 25% |
| GOT o GPT | × 2 valor normal | ↓ Dosis ciclosporina 25% |
| Variables a controlar ambulatoriamente | |
| Triple inmunodepresión | Asociar trimetropima-sulfametoxazol |
| Analítica sanguínea completa, semanal al primer mes | ↓ Dosis corticoide progresiva e iniciar azatioprina/mercaptopurina |
| Analítica sanguínea completa, cada 15 días 2.° mes | |
| Analítica sanguínea completa, posteriormente mensual |
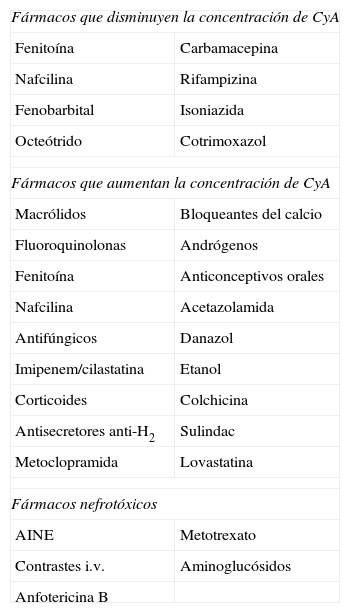
Interacciones farmacológicas de la ciclosporina
| Fármacos que disminuyen la concentración de CyA | |
| Fenitoína | Carbamacepina |
| Nafcilina | Rifampizina |
| Fenobarbital | Isoniazida |
| Octeótrido | Cotrimoxazol |
| Fármacos que aumentan la concentración de CyA | |
| Macrólidos | Bloqueantes del calcio |
| Fluoroquinolonas | Andrógenos |
| Fenitoína | Anticonceptivos orales |
| Nafcilina | Acetazolamida |
| Antifúngicos | Danazol |
| Imipenem/cilastatina | Etanol |
| Corticoides | Colchicina |
| Antisecretores anti-H2 | Sulindac |
| Metoclopramida | Lovastatina |
| Fármacos nefrotóxicos | |
| AINE | Metotrexato |
| Contrastes i.v. | Aminoglucósidos |
| Anfotericina B | |
Sea cual sea la opción médica escogida, hay que planificar un nuevo momento de evaluación, y probablemente lo más razonable sea evaluar a los 7 días de iniciado el nuevo tratamiento. En este punto no hay normas fijas. Si bien si hay un empeoramiento o una falta absoluta de mejoría, lo más razonable será en la mayoría de los casos la cirugía, y si hay una remisión podemos pasar al esquema de mantenimiento; es bastante común que se produzcan situaciones intermedias, en las que hay que valorar todas las posibilidades. Así, se ha descrito que a pesar del fracaso de la ciclosporina algunos pacientes pueden evitar la cirugía mediante el uso de infliximab67, y también en menos ocasiones se ha seguido el camino contrario.
En todos los nodos de decisión se debe contar con la opinión del paciente, de sus familiares o personas vinculadas, del cirujano y del gastroenterólogo. No podemos dejar de recalcar lo suficiente lo relevante que es compartir toda la información con el paciente desde el principio.
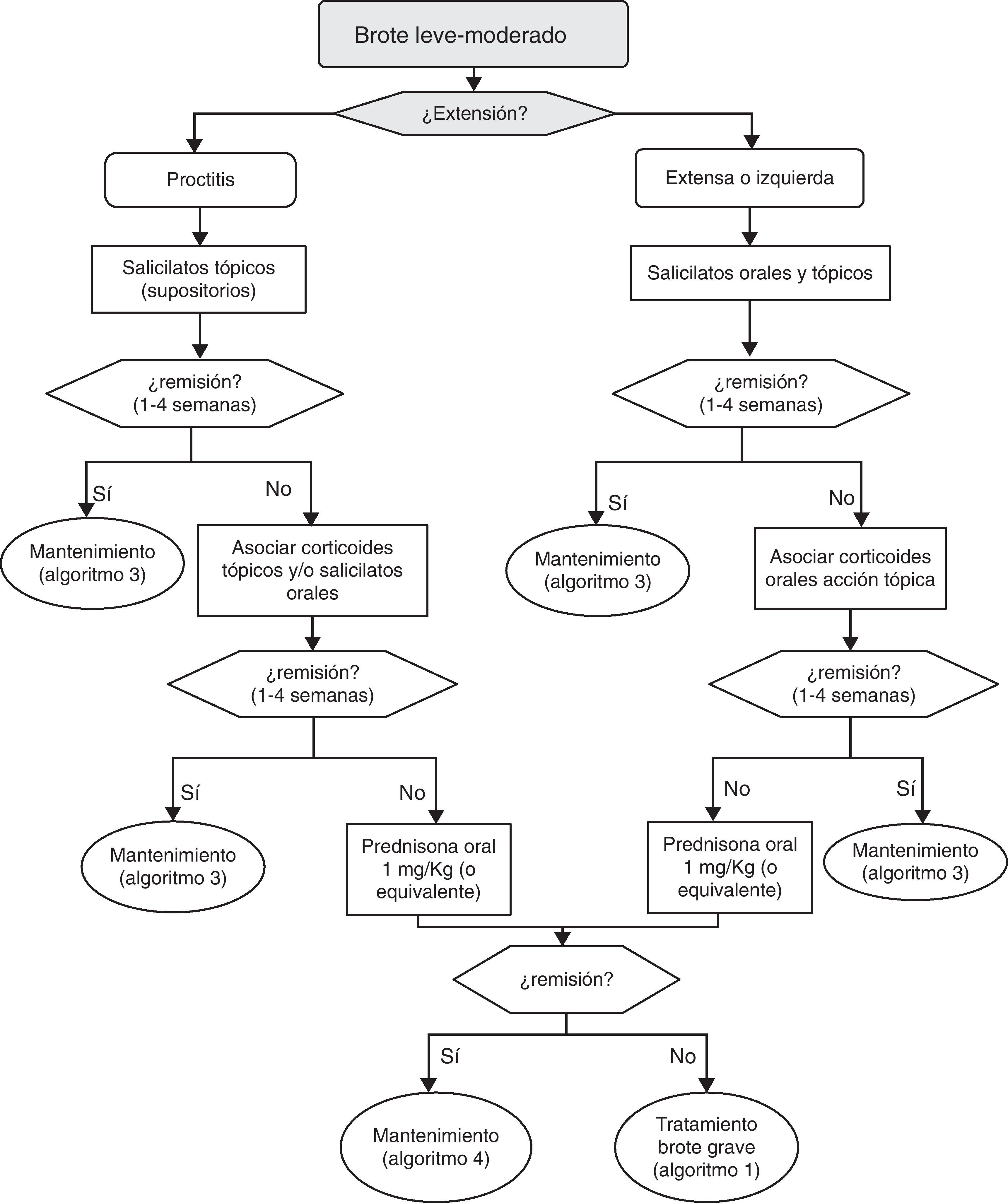
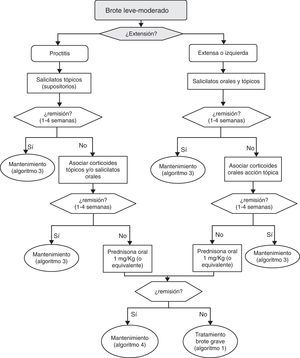
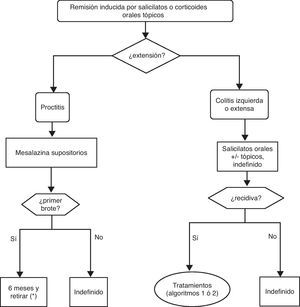
6.2Brote leve y moderado de colitis ulcerosa (algoritmo 2)6.2.1Salicilatos«¿Es eficaz el tratamiento con salicilatos orales en la inducción de la remisión del paciente con brote leve-moderado de CU?»
Texto de la guía:
| En salicilatos orales el objetivo a valorar es la remisión clínica tras 4 semanas de tratamiento. No son evaluables ni la respuesta ni la remisión a las 2 semanas por no disponer de estos datos en un número suficiente de estudios. Hemos identificado en la literatura médica 11 ECA de alta calidad que comparan mesalazina frente a placebo en el tratamiento del brote leve-moderado de CU: 9 incluidos en una revisión Cochrane68 y 2 posteriores con la nueva formulación MMX69,70. Además se dispone de un metaanálisis reciente en el que se incluyen 20 ECA y se compara la eficacia y seguridad de la sulfasalazina frente a otros salicilatos71. | Calidad alta |
| En la revisión Cochrane68 se incluyen 9 ECA (1.495 pacientes) comparando inducción de la remisión mesalazina-placebo y 12 ECA comparando mesalazina-sulfasalazina que valoran la remisión obtenida entre la cuarta y duodécima semana de tratamiento. Además, un estudio con mesalazina MMX70 comparó 2,4 g/día frente a 4,8 g/día y placebo siendo más efectivas que placebo ambas dosis sin diferencias entre ellas. Globalmente el RR calculado global de remisión fue de 1,92 (1,50-2,47) indicando un beneficio de la utilización de mesalazina en estos pacientes. Sulfasalazina es igual de eficaz que los diferentes salicilatos utilizados en inducción de la remisión, si bien hay un mayor porcentaje de efectos secundarios que motivan la salida de los ECA de sulfasalazina frente a balsalazida71. | |
| Cuando se analiza la tasa de remisión en relación con la dosis, hay una tendencia de que a mayor dosis mayor tasa de remisión (p=0,002), y cuando la variable analizada es la remisión endoscópica, las dosis de 3 g/día o más son más eficaces. Es interesante que en todos los estudios en que se utiliza una dosis única de mesalazina en 24 h, esta resulta cuando menos tan eficaz como las dosis repartidas72,73, actitud avalada por datos de biodisponibilidad provenientes de estudios farmacocinéticos. | |
| En el conjunto de estudios disponibles, muy numeroso, no se observaron diferencias significativas en los efectos adversos entre los grupos placebo y los tratados con diversas dosis de mesalazina. |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Aunque en una reciente revisión74 se evalúan los estudios comparativos de diferentes dosis de mesalazina y no parece haber diferencias en la inducción de la remisión clínica a partir de 2,4g, creemos que estos resultados deben interpretarse con precaución porque: a) los números son más pequeños cuando se reducen los grupos para comparar las dosis, y por lo tanto las conclusiones más débiles; b) las dosis de 3 g/día o más no son significativamente más tóxicas; c) en algunos estudios las dosis más altas obtienen remisión antes, lo que de confirmarse sería de gran importancia para el paciente, y d) no necesariamente las comparaciones hechas con una formulación galénica son completamente extrapolables al resto. Esta opinión se apoya a su vez en un reciente estudio de alta calidad metodológica (ASCEND III)75 (con 772 pacientes en el que una dosis de 4,8 g/día es superior a 2,4 g/día. Por ello, en opinión del grupo elaborador la dosis estándar en la inducción de la remisión debe ser 3 g diarios (o superior). Lo que parece muy claro, hoy en día, es que una dosis única diaria es al menos tan eficaz como las dosis repartidas, y por mayor facilidad de cumplimiento será probablemente más efectiva76. |
«¿Es el tratamiento combinado de salicilatos orales y tópicos más eficaz que el oral aislado en la inducción de la remisión del paciente con brote leve-moderado de CU?»
Texto de la guía:
| Se dispone de 3 ECA incluidos en las revisiones de Regueiro77 y Bergman78 en los que se compara el tratamiento oral con el combinado (oral y rectal) en la CU aguda, existiendo además una revisión sistemática que incluye información observacional79. En el primer estudio80 incluyeron 60 pacientes con CU izquierda, tratados con mesalazina rectal, mesalazina oral (2,4 g/día) o su combinación. No se evaluó la remisión, pero la rectorragia había desaparecido a las 6 semanas en 18/20 (89%) pacientes en tratamiento combinado frente a 10/22 (46%) en tratamiento oral (p<0,05); además, la rectorragia cesó más rápido (p<0,002) y los efectos adversos fueron similares. En otro estudio81 se evaluaron 130 pacientes con CU izquierda, aleatorizados a tratamiento oral (4 g de mesalazina y enema de placebo) frente a tratamiento combinado (2 g de mesalazina oral y 2 g en enema). A la sexta semana la remisión clínica y endoscópica fue casi idéntica en ambos grupos y la velocidad de la respuesta fue similar, sin diferencias en los efectos secundarios. Finalmente Marteau et al.82 compararon en 127 pacientes con colitis extensa un tratamiento oral con 4 g de mesalazina (y un enema de placebo) frente a idéntico tratamiento oral y un enema de 1 g de mesalazina. A las 4 semanas habían remitido el 34% en el grupo oral y el 44% (p=0,3) en el combinado; y a las 8 semanas el 43% frente al 64% (p=0,0256) en el combinado; sin diferencias en los efectos adversos. | Calidad moderada |
| Al combinar el RR de todos los estudios que comparan tratamiento combinado versus oral el RR es de 1,18 (0,99-1,40). |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Las diferencias no alcanzan diferencias estadísticas, pero puede ser debido al diseño de los estudios. Los resultados están muy condicionados por el estudio de Vecchi, en el que los grupos no son homogéneos: el grupo tratado por vía rectal recibe una dosis oral de mesalazina menor que el otro grupo. El estudio de Marteau, metodológicamente el mejor planteado, demuestra que la terapia rectal acelera la respuesta. Con estos datos creemos que el tratamiento combinado se le debe ofrecer al paciente, sobre todo si los síntomas rectales son intensos. Es importante resaltar que los efectos adversos no son en absoluto importantes. Sin embargo, dada la especial incomodidad de la vía de tratamiento, y la escasa evidencia, la opinión de cada paciente es decisiva. |
¿Es eficaz el tratamiento con salicilatos tópicos aislados en la inducción de la remisión del paciente con brote leve-moderado de CU izquierda?
Texto de la guía:
| Los resultados disponibles en una revisión sistemática83 muestran un claro beneficio de la utilización de mesalazina tópica en inducción a remisión frente a placebo con un OR de 7,71 (4,84-–12,3]. Un único estudio no incluido84 confirma que la espuma de mesalazina a dosis de 2 g/día es superior al placebo en obtener la remisión.Las dosis utilizadas en los estudios con supositorios varían de entre 0,5 a 1,5g, mientras que con espuma o enemas oscilan entre 1 y 4 g de mesalazina. No hay una clara evidencia de efecto dosis-respuesta, y en un único estudio comparativo un enema de 1 g resultó tan eficaz como el de 2 o 4 gramos85.No hay diferencias relevantes en cuanto a los efectos secundarios83. | Calidad alta |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Existen diversas formulaciones de los salicilatos rectales (supositorios, espuma, enema), que varían en cuanto a su densidad (sólida a líquida) y volumen. La elección de una u otra formulación depende de la extensión y de la aceptación por el paciente de una u otra forma galénica. En general se estima que los supositorios son útiles en lesiones de menos de 15cm de longitud, la espuma en lesiones de<40cm, y el enema en lesiones que abarquen hasta el ángulo esplénico. |
¿Es el tratamiento con salicilatos tópicos más eficaz que el oral en la inducción de la remisión del paciente con CU izquierda?
Texto de la guía:
| Se dispone de 3 ECA incluidos en las diferentes revisiones sistemáticas77–79,83 con un total de 155 pacientes, que en su conjunto demuestran que el tratamiento tópico es claramente superior al oral en la colitis izquierda más distal (proctitis). El OR global es de 4,1 (IC 95%: 1,5-10,9). Los efectos adversos son similares, excepto en un estudio en el que el fármaco oral es la sulfasalazina, que se asocia con un número relativamente importante de efectos adversos. En solo uno de los estudios se define claramente la remisión86, el número total de pacientes incluido no es grande, pero en todos los estudios la administración rectal es claramente más eficaz que la oral. No obstante, hay un estudio que utiliza mesalazina MMX oral y parece al menos tan eficaz como la tópica en la colitis izquierda87.La dosis utilizada en un ECA en el que incluyen proctitis fue de 0,4g86 y en los otros 2 ECA utilizan enemas de 4g sin hallar un claro efecto dosis-respuesta. | Calidad moderada |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Tanto los estudios observacionales como la experiencia clínica señalan fuertemente que los salicilatos rectales son más eficaces que los orales en la colitis izquierda. Además, en estudios básicos se ha comprobado que la concentración mucosa que se alcanza del fármaco es mucho más alta al aplicarla por vía tópica. Por ello, y aunque no siempre es posible, el médico debe tratar de vencer las reticencias que muchos pacientes tienen ante un tratamiento rectal. No es nada fácil recomendar una dosis concreta, porque los estudios son escasos, y lo más importante es, con toda probabilidad, conseguir un buen cumplimiento por parte del paciente. Se dispone de supositorios (de 500mg y de 1 g), enemas (de 1 y 4 g) y espuma (de 1 g), y por el momento no es posible establecer recomendaciones generales.Algunos datos recientes señalan que la nueva forma galénica MMX podría obtener mejores resultados en las colitis izquierdas, pero solo disponemos de un estudio y necesitamos que se confirme antes de poder establecer una preferencia de esa forma galénica en la colitis izquierda. |
¿Son eficaces los corticoides orales sistémicos en la inducción de la remisión del paciente con brote leve-moderado de CU?
Texto de la guía:
| El único ECA disponible es el de Truelove y Witts6, en el que las diferencias a favor de los corticoides (hidrocortisona en este caso) son muy claras. En cuanto a alcanzar la remisión tanto en todo el grupo (2,61 [1,58-4,31]) como excluyendo a los pacientes graves (RR 2,16). Las diferencias se mantenían, en parte en una evaluación posterior a los 9 meses. En cuanto a los efectos adversos, tanto la mortalidad como la morbilidad resultaron mayores en términos absolutos (aunque sin alcanzar significación estadística) en el grupo placebo.La dosis utilizada por Truelove y Witts fue hidrocortisona 100mg oral (tabla 17: equivalencias en las dosis de corticoides). | Calidad moderada |
Síntesis de la evidencia:
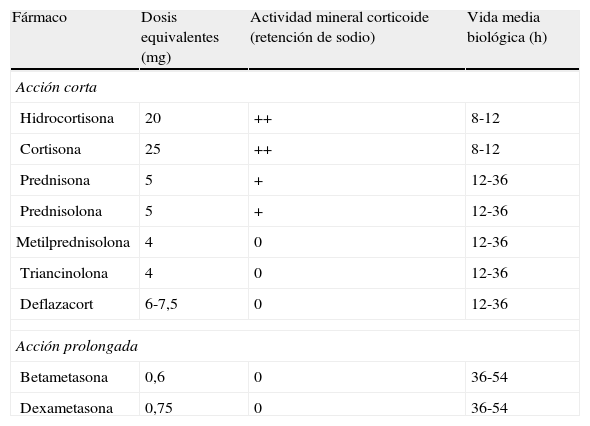
Equivalencias en las dosis de corticoides sistémicos
| Fármaco | Dosis equivalentes (mg) | Actividad mineral corticoide (retención de sodio) | Vida media biológica (h) |
| Acción corta | |||
| Hidrocortisona | 20 | ++ | 8-12 |
| Cortisona | 25 | ++ | 8-12 |
| Prednisona | 5 | + | 12-36 |
| Prednisolona | 5 | + | 12-36 |
| Metilprednisolona | 4 | 0 | 12-36 |
| Triancinolona | 4 | 0 | 12-36 |
| Deflazacort | 6-7,5 | 0 | 12-36 |
| Acción prolongada | |||
| Betametasona | 0,6 | 0 | 36-54 |
| Dexametasona | 0,75 | 0 | 36-54 |
Nota: Por ejemplo, la prednisona es 4 veces más potente que la hidrocortisona (o lo que es lo mismo, 5mg de prednisona equivalen a 20 de hidrocortisona) y metilprednisolona un poco más potente que prednisona (4mg de la primera equivalen a 5 de la segunda).
Fuente: Gasull et al.150.
Formulación de la recomendación:
Comentario del grupo elaborador:
| Aunque solo dispongamos de un estudio comparando corticoides con placebo, las diferencias observadas son suficientemente potentes (RR >2) como para no ser posible plantear una nueva comparación de corticoides versus placebo, por motivos éticos. Por otra parte, existen numerosas pruebas clínicas de la utilidad de los corticoides en los brotes graves, en otros estudios comparativos con otros fármacos en brotes moderados y en estudios experimentales en varios modelos. La eficacia está, por tanto, claramente demostrada. Lo que no es tan sencillo es definir el escenario clínico (brotes leves versus moderados) o el momento exacto (al principio versus tras el fracaso de la mesalazina) de su utilización. Considerando tanto la eficacia como los efectos adversos (el coste es muy bajo), cuanto más intenso sea el brote, más precozmente se debe plantear el uso de corticoides. Probablemente en el extremo más leve, los salicilatos son los fármacos de elección y se puede esperar entre 4 y 8 semanas antes de plantear un cambio de actitud. En el extremo opuesto, aquellos brotes moderados que rozan los criterios de brote grave, el uso de corticoides puede plantearse incluso al principio. |
¿Son eficaces los nuevos corticoides orales de baja biodisponibilidad en la inducción de la remisión del paciente con brote leve-moderado de CU?
Texto de la guía:
| Existe evidencia sobre el tratamiento con corticoides orales de baja disponibilidad tanto con beclometasona dipropionato (BDP) en 3 ECA88–90, budesonida de liberación retardada en un ECA91 y metasulfobenzoato de prednisolona en un ECA92. | Calidad baja |
| Con BDP se incluyeron un total de 329 pacientes, aleatorizados a mesalazina y placebo versus mesalazina y BDP a dosis de 5o 10mg sin diferencias entre ambas. A la cuarta semana no había diferencias en las tasas de remisión (RR 1,15 [IC 95%: 0,94-1,42]). La tasa de efectos adversos fue similar (RR: 0,98 [IC 95%: 0,29-3,31]). Algunos subanálisis posteriores señalan una eficacia mayor de la beclometasona, y en otros estudios es al menos similar a la mesalazina. | |
| La budesonida (10 mg/oral/día) fue similar en eficacia a 40 mg/día de prednisona con menos efectos secundarios en un ensayo, pero la formulación no fue desarrollada para su uso en clínica. El metasulfobenzoato de prednisolona fue similar en eficacia clínica con menos efectos adversos a una dosis de 40 mg/día de prednisolona oral (dosis inicial, con descenso rápido durante el estudio). Sin embargo, la eficacia endoscópica fue menor y solo se dispone de un estudio. |
Síntesis de la evidencia:
| La evidencia disponible indica que añadir BDP a mesalazina podría mejorar la respuesta clínica en los brotes leves-moderados. No obstante, los datos son limitados y no se han demostrado diferencias en la evolución de las lesiones endoscópicas ni histológicas. Gran parte de los estudios no son a doble ciego. La budesonida y el metasulfobenzoato de prednisolona podrían ser una alternativa a la prednisolona, pero los datos publicados son demasiado limitados. | Calidad baja |
Formulación de la recomendación:
Comentario del grupo elaborador:
| La eficacia de los corticoides rectales, la experiencia en la enfermedad de Crohn y los datos de los estudios disponibles señalan muy fuertemente que los corticoides orales de baja biodisponibilidad (el único accesible en el mercado es la beclometasona) pueden ser en el futuro una alternativa en el tratamiento de los brotes leves de CU. Específicamente, serían la primera opción en el fracaso de la mesalazina, antes de pasar a los corticoides de acción sistémica, especialmente en brotes leves. No obstante, las pruebas son limitadas en calidad metodológica, y en número de pacientes evaluados. Además se echa en falta una validación externa por otros grupos no implicados directamente en el desarrollo del fármaco. Teniendo en cuenta todos los datos disponibles a fecha de hoy (que incluyen una extensa experiencia observacional de GETECCU)93 creemos que se puede recomendar su uso especialmente en aquellos pacientes con brotes leves que no presentan respuesta completa a mesalazina. En cualquier caso, recomendamos una evaluación precoz de la respuesta (2 a 4 semanas) y, en caso de fracaso, considerar la introducción de corticoides sistémicos. Por otra parte, la dosis más utilizada es de 5 mg/día, pero algunos (no todos) estudios indican que 10 mg/día podría ser una alternativa más eficaz y con toxicidad similar. |
¿Es eficaz el tratamiento con corticoides rectales en la inducción de la remisión del paciente con brote leve-moderado de CU izquierda?
Texto de la guía:
| Dividimos los corticoides rectales en 2 grupos:– Corticoides de alta biodisponibilidad: hidrocortisona, prednisolona, metilprednisolona y betametasona.– Corticoides de baja biodisponibilidad: budesonida, beclometasona y prednisolona metasulfobenzoato. | Calidad moderada |
| Aunque solo disponemos de 2 estudios ya antiguos94,95, los corticoides de alta biodisponibilidad son claramente más eficaces que el placebo (OR 0,21 [0,07-0,71]). Con corticoides de baja biodisponibilidad hemos evaluado un estudio en el que fue superior a placebo96, y otro en el que no se observaron diferencias significativas en todas las dosis, pero se confirmó que el enema de 2mg es claramente superior al placebo97. |
Formulación de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Aunque se dispone de pocos estudios comparativos con placebo, la información procedente de estudios comparativos con mesalazina es mucho más importante (véase más abajo) y confirma la efectividad de los corticoides en este contexto clínico, además de la evidencia indirecta proporcionada por los estudios de corticoides orales. Siendo la mesalazina al menos tan eficaz y probablemente menos tóxica y más barata, los corticoides rectales constituyen una opción de segunda elección, solos o en asociación con la mesalazina. |
¿Son más eficaces los corticoides rectales de baja biodisponibilidad que los de alta biodisponibilidad en la inducción de la remisión del brote leve-moderado de CU?
Texto de la guía:
| En una revisión sistemática98 se incluyeron 5 ECA en los que se comparan corticoides rectales de alta biodisponibilidad con corticoides de baja biodisponibilidad: 3 ECA comparan enemas de budesonida a dosis de 2-2,5mg con enemas de prednisolona, un ECA compara enemas de budesonida con metilprednisolona, y un ECA compara enemas de budesonida con enemas de hidrocortisona. El OR para remisión clínica de estos 5 ECA fue de 0,85 (IC al 95%: 0,44-1,63), sin diferencias entre ambos grupos. Tampoco los datos para remisión endoscópica (1,14 [0,69-1,88]) o histológica (0,68 [IC 95%: 0,28-1,67]) fueron significativos. La supresión del eje suprarrenal (el efecto adverso más relevante en la comparación) fue menor al utilizar corticoides de baja biodisponibilidad. Otros ensayos posteriores99–101 confirman estos resultados utilizando beclometasona, fosfato de prednisolona, budesonida e hidrocortisona. | Calidad moderada |
Formulación de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| No ha sido posible la evaluación mediante una tabla GRADE por la enorme heterogeneidad de los estudios, con fármacos y dosis muy diferentes. Aunque probablemente las diferencias entre los diversos corticoides de baja biodisponibilidad serán muy sutiles, los enemas de budesonida son los únicos que se han comparado con placebo, con corticoides de alta biodisponibilidad y con otros de baja biodisponibilidad (además de con mesalazina) y es el fármaco con mayor evidencia científica de los analizados, con varios estudios de alta calidad publicados, por lo que puede considerarse el corticoide rectal de referencia en este momento. |
¿Son más eficaces los salicilatos tópicos que los corticoides rectales en la inducción de la remisión del paciente con brote leve-moderado de CU?
Texto de la guía:
| Mesalazina frente a corticoides rectales de alta biodisponibilidadCon un total de 9 ECA disponibles incluidos en una revisión sistemática98 comparando corticoides rectales (100-356mg de hidrocortisona) frente a mesalazina rectal (1-4 g) los preparados de mesalazina son más eficaces en obtener la remisión clínica con un OR de 2,42 (IC 95%: 1,72-3,41). Lo mismo se observó en las remisiones endoscópica e histológica. Hay 2 ECA comparando con el ácido paraaminosalícilico (4-ASA) con resultados similares. | Calidad alta |
| Mesalazina frente a corticoides rectales de baja biodisponibilidadEn 2 ECA de alta calidad incluidos en la revisión de Marshall98 comparando budesonida con mesalazina no se encuentran diferencias (OR 0,95 [IC 95%: 0,43-2,10]).En una revisión102 de ensayos clínicos con mesalazina versus beclometasona, metodológicamente de muy baja calidad, no se observaron diferencias significativas, aunque la mesalazina se aproximaba a la superioridad (RR: 0,89 [IC 95%: 0,78-1,01]).Hay un ECA de buena calidad, pero con un número de pacientes muy limitado, que señala que la combinación de corticoides (beclometasona) y mesalazina podría tener efectos sinérgicos103. | Calidad baja |
Formulación de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| La mesalazina tópica es al menos tan eficaz como los corticoides rectales, tiene menor potencial de toxicidad, es más barata y existe en diversas formulaciones galénicas que permiten su adaptación a casi todos los escenarios clínicos. Sin embargo, no es tolerada por todos los pacientes, ni tiene una eficacia absoluta. En estos casos, los corticoides rectales solos o en combinación con la mesalazina son la alternativa adecuada. Si se utilizan corticoides, son claramente preferibles los de baja biodisponibilidad, y entre ellos el que cuenta con más evidencia científica a su favor es la budesonida. |
¿Son eficaces los inmunomoduladores tiopurínicos en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente?
Texto de la guía:
| En un reciente metanálisis104 que incluye 4 ECA en el que se compara la eficacia de azatioprina/mercaptopurina frente a placebo y/o salicilatos, no se alcanzan diferencias significativas y además los estudios son heterogéneos entre sí.No obstante, existen numerosos estudios observacionales que obtienen tasas de remisión del 65% (IC 95%: 55-75%) lo que señala una posible eficacia en esta indicación. | Calidad baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Numerosos estudios demuestran que las tiopurinas son fármacos cuya eficacia en las enfermedades inflamatorias intestinales requiere un tiempo mínimo de administración para obtener eficacia105 (al menos un mes, probablemente en la mayoría de los casos más de 2 meses).Sin poder descartar un error de tipo beta (el número de pacientes incluido en estos estudios es muy escaso), la poca duración de la observación podría explicar la ineficacia. En cualquier caso, un tiempo de latencia tan largo es inaceptable cuando el paciente presenta síntomas agudos, por lo que las tiopurinas no son fármacos que se puedan utilizar en la inducción de la respuesta. |
¿Es eficaz el metotrexato en la inducción de la remisión del paciente con brote moderado de CU corticodependiente?
Texto de la guía:
| Encontramos en la literatura médica varios estudios que intentan analizar la eficacia del metotrexato para la inducción de la remisión de los pacientes con CU, y que se han descrito en una reciente revisión Cochrane106. De los 17 estudios localizados, tan solo 3 eran aleatorizados; de estos 3 solo incluyen el realizado por Oren et al.107 siendo excluidos el resto por serias deficiencias metodológicas. En dicho ensayo se incluyen 67 pacientes con CU activa (Mayo>7), de los cuales un 70% recibían corticoides a dosis variables, y se aleatorizaron a metotrexato oral 12,5 mg/semana (n=30) o placebo (n=37) durante 9 meses. No hubo diferencias ni en la tasa de remisión (OR 0,92; IC 95%: 0,35-2,42); ni en el tiempo hasta obtener la remisión, ni en la tasa de efectos adversos graves. En los estudios excluidos tampoco se observó una diferencia relevante. | Calidad baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Realmente, las pruebas disponibles con metotrexato en la CU son de ínfima calidad. No están bien definidos los subgrupos de pacientes, que son heterogéneos en cuanto a la corticodependencia, y la dosis de metotrexato utilizada (si se extrapola desde lo conocido en la enfermedad de Crohn) es insuficiente. Por tanto, solo podemos concluir que es poco probable que el metotrexato oral a dosis bajas sea eficaz en el tratamiento de la CU aguda. No puede descartarse un efecto con dosis mayores, similares a las utilizadas en la enfermedad de Crohn. Siendo un fármaco barato y con una importante experiencia acumulada en otras enfermedades, resulta claro que debería ser un área preferente de estudio. |
¿Es eficaz el infliximab en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente?
Texto de la guía:
| Véase en la sección 6.1.3 lo referido a brote grave. La revisión sistemática de Gisbert et al.44 es también la base fundamental de este resumen. Analizaremos por separado las 2 situaciones más comunes y problemáticas en la práctica clínica: corticorresistencia y corticodependencia. | Calidad alta |
| Corticorresistencia: disponemos de bastantes datos en esta situación clínica que demuestran que infliximab es eficaz para inducir la remisión y respuesta clínicas. Así, en la revisión citada44, el 52% de 877 pacientes fueron clasificados como corticorresistentes con una tasa de respuesta del 70% a infliximab versus un 68% en los no corticorresistentes. Específicamente en los estudios ACT en los que se utiliza una definición específica de resistencia a corticoides (falta de respuesta clínica tras 40 mg/día de prednisona oral 2 semanas, o la misma dosis intravenosa durante una semana) se observó respuesta a infliximab en 8 semanas en el 73% de los resistentes versus el 63% de los no resistentes (NS). | |
| Corticodependencia: aunque también con algunas limitaciones (esencialmente derivadas de la dificultad de aplicar estrictamente las diversas definiciones), en los estudios ACT se demuestra un claro efecto ahorrador de corticoides. Al evaluar a los pacientes en la semana 30 tras el inicio del tratamiento se había conseguido retirar los corticoides en el 22% de los tratados con infliximab versus un 7,1% de los tratados con placebo (p<0,05)45. Otro ECA108, aunque con muchos menos pacientes, también comunica resultados similares. |
Síntesis de la evidencia:
| Disponemos de evidencia firme que demuestra que infliximab es eficaz en inducir remisión y respuesta en el brote moderado de colitis, en la corticorresistencia o corticodependencia. Obtiene la remisión clínica y disminuye la tasa de colectomías. No obstante, la tasa de remisión alcanzada en los estudios controlados no supera el 50%. La seguridad del fármaco es superponible a la ya conocida para la enfermedad de Crohn. | Calidad alta |
Formulación de la recomendación:
Comentario del grupo elaborador:
| Si bien creemos que podemos establecer una recomendación de fuerte a favor, consideramos que hay 3 factores de gran importancia que nos obligan a ser muy prudentes. En primer lugar, la tasa global de respuesta está en torno al 50%, por lo que la eficacia dista mucho de ser la deseable. En segundo lugar esta eficacia se obtiene a expensas de un riesgo de efectos adversos graves relevante (escasos numéricamente, pero muy graves en algunos casos). Además, el coste es muy elevado. Por todo ello, resulta esencial avanzar en la definición de factores individuales predictivos de respuesta a infliximab49, cuya aplicación en la clínica mejoraría considerablemente la efectividad.No se elaboran tablas GRADE específicas, por falta de datos concretos diferenciados, en este escenario específico. |
¿Es eficaz el adalimumab en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente?
Texto de la guía:
| Los datos disponibles derivan de un único ensayo clínico controlado109 que compara adalimumab frente a placebo en pacientes con CU moderada a grave sin respuesta a corticoides o inmunomoduladores concomitantes o intolerancia previa a estos fármacos. Incluyó>500 pacientes, ambulantes, con brote moderado a grave, definido como un índice de Mayo ≥ 6 y un subíndice endoscópico ≥ 2. Se excluyó específicamente a los pacientes que hubieran recibido previamente infliximab u otro agente biológico, anticalcineurínicos en los 30 días previos o corticoides intravenosos en los 14 días anteriores. No es posible analizar los datos específicamente en pacientes corticodependientes o corticorresistentes, aunque el 67% de los pacientes recibían al inicio del estudio corticoides. Se utilizaron 2 pautas diferentes de adalimumab para la inducción (160/80 y 80/40) que se compararon con placebo. El objetivo primario del ensayo fue la remisión clínica en la semana 8 (índice de Mayo ≤ 2 sin ningún subíndice>1). En ese momento, la tasa de remisión era del 18,5% en el grupo tratado con adalimumab 160/80 (p = 0,031 versus placebo), del 10,0% en el grupo adalimumab 80/40 (p = 0,833 versus placebo) y del 9,2% en el grupo placebo. No hubo fallecimientos en ninguno de los grupos. La tasa de colectomías no se refleja en el estudio. Adalimumab fue bien tolerado, con un perfil de efectos adversos similar al de los ensayos clínicos previos. No hubo fallecimientos. Resumiendo, los resultados muestran una eficacia de adalimumab significativa, aunque solo discretamente superior a placebo y exclusiva para la dosis de 160/80. En cualquier caso, llama la atención la alta respuesta obtenida con placebo, que incluso alcanzó un 40% de cicatrización mucosa. | Calidad moderada |
| Además de estos datos derivados del único ensayo clínico disponible, existen varios estudios observacionales cuyos resultados son consistentes y que apoyan la eficacia de adalimumab en la CU, si bien la gran mayoría de ellos se centran en pacientes controlados con infliximab que han perdido la respuesta o presentado reacciones infusionales. |
Síntesis de la evidencia:
| Solo disponemos de un ensayo clínico publicado sobre adalimumab en la CU109, aunque hay disponibles también algunos datos observacionales y se han comunicado en congresos resultados de otro estudio. Aunque los resultados disponibles son aún a corto plazo y las diferencias obtenidas frente a placebo son pequeñas, adalimumab se mostró más eficaz para obtener la remisión clínica en el brote moderado a grave sin respuesta a corticoides ni inmunomoduladores. No disponemos de datos en el brote grave. Los efectos secundarios son posibles y potencialmente graves, siendo su perfil de seguridad bien conocido, análogo al descrito en la enfermedad de Crohn. Los estudios observacionales apoyan su eficacia, especialmente en los pacientes con respuesta previa a infliximab y pérdida de la misma o desarrollo de intolerancia. | Calidad moderada |
Formulación de la recomendación:
Comentario del grupo elaborador:
| Se necesitan nuevos datos controlados sobre adalimumab en CU. Además, los resultados a 52 semanas del ensayo publicado y comentado permitirán analizarlos con mayor perspectiva. El incremento de dosis de adalimumab podría optimizar su eficacia, como señalan los subanálisis de los resultados del ensayo controlado existente y deberán ser contemplados. |
¿Es eficaz el tratamiento con aféresis en la inducción de la remisión del paciente con brote moderado de CU corticodependiente?
Texto de la guía:
| Existen numerosos estudios con aféresis, pero la mayoría de ellos son de baja calidad, con medidas de la respuesta muy heterogéneas, asignación no ciega a los grupos de tratamiento o tratamientos concomitantes que hacen muy difícil la valoración del estudio. Los datos procedentes del único estudio aleatorizado ciego110 no confirman la eficacia de la aféresis. Sin embargo, otros estudios no ciegos, pero aleatorizados, y observacionales 111,112 señalan que en pacientes corticodependientes, el añadir aféresis puede seguirse de una respuesta clínica. La coherencia de los resultados de varios estudios independientes en el porcentaje de respuesta (alrededor de dos terceras partes de los pacientes), y en el momento de la respuesta (casi todos los estudios muestran respuesta a partir de la tercera sesión) indican que puede haber un efecto terapéutico real del procedimiento113. No obstante, faltan datos comparativos ciegos. Es una técnica de coste elevado, pero efectos adversos escasos. No se han descrito efectos adversos graves frecuentes en los estudios disponibles. | Calidad baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| La eficacia de la aféresis en la CU corticodependiente es un tema extraordinariamente polémico en estos momentos. Algunos clínicos, basándose en su gran experiencia personal, defienden este método como un sistema inocuo y eficaz. Sin embargo, los datos científicos disponibles no avalan la eficacia del procedimiento, puesto que los estudios observacionales carecen a menudo de rigor y los únicos datos procedentes de estudios aleatorizados ciegos son claramente negativos. Bien es verdad que algunos estudios observacionales definen muy bien tanto la población como el sistema de evaluación y señalan fuertemente su eficacia. No podemos olvidar, por otra parte, que existen otras alternativas eficaces en estos pacientes como el infliximab y los inmunomoduladores. Por ello, creemos que no es posible recomendar su uso con carácter general. Sí que creemos que, en caso de utilizarse, deben recogerse los datos sistemáticamente.En resumen, no recomendamos la aféresis como primer tratamiento en los casos de corticodependencia; sin embargo, en pacientes seleccionados en los que por contraindicación, toxicidad y/o ineficacia no se consideren adecuados los inmunomoduladores, el infliximab ni la cirugía podría ser adecuado valorar la aféresis.Este escenario clínico concreto es objeto en estos momentos de un ensayo clínico aleatorizado que podría cambiar estas recomendaciones. |
Tratamiento del brote leve a moderado
Hemos tenido que agrupar así a los pacientes dado que los ensayos clínicos utilizan este sistema de clasificación. Por supuesto, dentro de la misma definición global se incluyen un número casi infinito de posibles escenarios clínicos (caja 1). El clínico recomendará actuaciones muy diferentes ante situaciones muy leves o casi graves: todas ellas caben en la definición. Además de la gravedad, el clínico necesita información sobre la extensión de la enfermedad y (fundamental) sobre la respuesta y tolerancia a los tratamientos del paciente concreto en brotes previos. Así, hay pacientes que toleran muy mal la terapia tópica, o pacientes en los que la mesalazina provoca una reacción paradójica con aumento de la diarrea. Una vez más, nos vemos obligados a recalcar la extraordinaria importancia práctica de una buena historia clínica. Siendo el brote leve o moderado, la actitud será completamente diferente en las proctitis, en las que el tratamiento local será el básico; y el resto de colitis en las que un tratamiento combinado local y oral será la regla. Por supuesto, lo mismo que entre el brote más leve y el moderado más intenso hay todo un continuo, los límites del tratamiento en cuanto a la extensión no son absolutamente rígidos: puede ser aceptable tratar una proctosigmoiditis exclusivamente con tratamiento tópico, lo mismo que puede ser aceptable tratar una colitis extensa exclusivamente con medicación oral.
Como hemos revisado en detalle, el clínico dispone de una variedad de medidas terapéuticas que, en general, utiliza de una forma escalonada: medidas más sencillas y con menos riesgos en los brotes más leves que va ampliando si no obtiene respuesta. Una estrategia de utilizar primero las opciones menos agresivasa solo es aceptable si desde el principio se ha planificado una estrategia a medio y largo plazo, que implique conocer la respuesta del paciente al tratamiento en un plazo razonable. En realidad, es imposible definir exactamente un plazo uniforme, por la enorme variabilidad interindividual. En general, cuanto más leve sea el cuadro, mayor podrá ser el intervalo antes de conocer la respuesta del paciente, pero no debe superar en ningún caso el mes, para poder escoger otros sistemas de tratamiento si el que hemos recomendado fracasa. Hoy en día tenemos que tener en cuenta algunos factores que pueden facilitar el seguimiento. En primer lugar la comunicación con el paciente no tiene por qué ser siempre presencial, puesto que el teléfono y la red pueden servir perfectamente para mantener un contacto mucho más fluido, rápido y sencillo. En segundo lugar, dentro de las unidades de enfermedad inflamatoria los profesionales de enfermería desempeñan cada vez un papel más importante, y entre sus misiones puede incluirse el seguir más estrechamente la situación de los pacientes. Se han desarrollado, de hecho, herramientas informáticas que han probado en estudios controlados ser de ayuda en un mejor control. En todo el proceso, la participación del paciente es fundamental, y por tanto no deben escatimarse esfuerzos en transmitir la información y en escuchar el punto de vista del paciente.
Las herramientas terapéuticas que se manejan en la mayor parte de los brotes leves a moderados activos son los salicilatos, los corticoides de baja biodisponibilidad y los corticoides sistémicos. Además, se puede escoger entre la vía rectal, la vía oral y una combinación de ambas. El algoritmo indica un camino razonable, especialmente si partimos de un brote leve, con la adopción de medidas terapéuticas más agresivas progresivamente, en forma secuencial. Sin embargo, en dependencia de los antecedentes clínicos del paciente y de la gravedad del brote, el clínico puede recomendar iniciar directamente el esquema terapéutico en un punto mucho más avanzado. Así, por ejemplo, si acude un paciente que está recibiendo 3 g diarios de mesalazina oral de mantenimiento, con una colitis extensa, y que presenta desde hace una semana un brote de CU con 5 deposiciones diarias con sangre, fiebre y astenia, tras descartar la infección, lo razonable es comenzar directamente con corticoides orales, completando el tratamiento con salicilatos tópicos si hubiera mucha sintomatología rectal. Por supuesto, además, en este caso el seguimiento se llevará a cabo en solo una semana de tiempo, además de dejar canales de comunicación abiertos con el paciente por si hay un empeoramiento previo. Es decir, en dependencia del escenario clínico, y los antecedentes y experiencias concretas del paciente, este y los profesionales sanitarios deben llegar a un acuerdo que module las recomendaciones del algoritmo general.
7Tratamiento de mantenimiento del paciente con colitis ulcerosa en remisiónSe considera una colitis en remisión aquella en la que el paciente presente una completa resolución de los síntomas acompañada de cicatrización mucosa definido con índices clínicos y endoscópicos. En la práctica clínica diaria, no se suele considerar necesaria la valoración endoscópica, ya que la valoración clínica de los pacientes tiene una sensibilidad del 86% y una especificidad del 76%, y vendría definida como la presencia de menos de 3 deposiciones/día o quizá, mejor aún, como la recuperación del ritmo intestinal normal previo del paciente, sin rectorragia ni urgencia defecatoria.
7.1Mantenimiento de la remisión obtenida tras brote leve-moderado7.1.1Colitis ulcerosa no tratada con corticoides (algoritmo 3)¿Es eficaz el tratamiento con salicilatos orales en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU tratado con salicilatos?
Texto de la guía:
| Se dispone de ECA que comparan diversos aminosalicilatos (sulfasalazina, mesalazina, olsalazina) con placebo, de hasta 2 años de duración, así como de numerosos ECA que comparan mesalazina con sulfasalazina, de duración variable, hasta de un año, todos ellos recogidos en revisiones sistemáticas71,79 y en una excelente revisión Cochrane114. Asimismo, se dispone de 2 ECA que comparan a lo largo de un año la misma dosis de mesalazina en una única toma diaria o repartida en dos115,116. También se han realizado varios estudios clínicos que analizan la relación entre el cumplimiento del tratamiento y la eficacia de los salicilatos117. De los resultados de estos ensayos se puede concluir que: | Calidad alta |
| a) Tanto la sulfasalazina como la mesalazina y la olsalazina son claramente más eficaces que el placebo en evitar las recidivas de la CU sin diferencias significativas entre ellas. | |
| b) La toxicidad es poco frecuente y con carácter general leve. Se puede exceptuar que la sulfasalazina se asocia frecuentemente y de forma dependiente de la dosis con intolerancia gastrointestinal, y que la olsalazina provoca diarrea con mucha frecuencia (superior al 10% en la mayoría de los estudios)118. | |
| c) La dosis ideal de sulfasalazina para el mantenimiento es de 2 g al día. No se ha probado que dosis más altas de 2 g/día de mesalazina sean más eficaces, aunque el número de pacientes estudiado con dosis más altas es muy limitado. | |
| d) Aunque la toxicidad de mesalazina y sulfasalazina no es diferente en los ensayos comparativos publicados hay un sesgo clave: el de la no inclusión de pacientes previamente intolerantes a sulfasalazina. | |
| e) El cumplimiento es esencial en evitar las recaídas, lo que representa una prueba más, si bien indirecta, de la eficacia del tratamiento119. | |
| f) Una dosis única diaria es al menos tan eficaz como dosis repartidas. |
Formulación de la evidencia:
| Los salicilatos son eficaces en el tratamiento de mantenimiento a largo plazo de la CU en la que se ha obtenido la remisión con salicilatos. En pacientes que toleran la sulfasalazina esta es al menos equivalente a la mesalazina, aunque su efecto sobre la espermatogénesis podría limitar sus indicaciones. Una dosis única diaria es tan útil como dosis repartidas. | Calidad alta |
Formulación de la recomendación:
Comentario del grupo elaborador:
| La evidencia a favor de uso de salicilatos en el tratamiento de mantenimiento de la CU es incontrovertible. Se podría añadir que es posible (aunque muy discutido) que los salicilatos tengan efecto quimiopreventivo, disminuyendo la tasa de carcinoma de colon en estos pacientes. La mayor parte de los expertos recomendarían el tratamiento indefinido, y la mayor controversia se sitúa en la dosis. Si se utiliza sulfasalazina la dosis total es de 2 g al día, y para evitar intolerancias hay que fragmentar las dosis en al menos 2. En el caso de la mesalazina una dosis mínima de 1,5 g/día es la recomendable, aunque hay muchos datos que señalan que una dosis mayor podría ser más eficaz, y en realidad no hay argumentos para disminuir la dosis que ha sido eficaz en el tratamiento agudo. En cualquier caso, se debe administrar una dosis única diaria. Se ha demostrado la eficacia en estudios de hasta 2 años, pero un cúmulo de datos observacionales señalan que lo mejor es el tratamiento indefinido. |
¿Es eficaz el tratamiento con salicilatos tópicos en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU izquierda tratada con salicilatos?
Texto de la guía:
| Son varios los ECA que demuestran que los salicilatos tópicos son más eficaces que el placebo en el tratamiento de mantenimiento de la colitis izquierda, especialmente en la proctitis, resumidos en varias revisiones sistemáticas77,79,120. En la revisión sistemática de Marshall e Irvine83, que incluye 4 ECA, el OR global es 5,6 (IC 95%: 3-10,5) y en un estudio más reciente121 se muestra un RR a favor de mesalazina de 5,21 (IC 95%: 1,99-13,6). La tasa de efectos adversos es, además, la misma que con placebo. En los estudios de comparación de dosis los resultados son menos claros, con datos de una eficacia similar entre 500 mg/día y 1 g/día122 frente a otros que señalan una superioridad de la dosis mayor123. | Calidad moderada |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| El mayor problema del tratamiento tópico es la aceptación por parte del paciente de una vía de administración que es incómoda, especialmente a largo plazo. Es importante llegar a un acuerdo en cada caso con el paciente, porque tanto la formulación como la frecuencia de administración pueden ser variables, y adaptarse a cada paciente es necesario para conseguir un buen cumplimiento. El esfuerzo de comunicación debe corroborarse en cada visita. Inicialmente es recomendable la dosificación diaria, pero posteriormente se puede pasar a una dosis cada 2 días, e incluso en algunos casos a 2 o 3 dosis semanales, que han probado ser superiores a placebo, y son claramente más aceptables para la mayoría de los pacientes. |
Mantenimiento tras inducción de remisión con mesalazina (o corticoides orales tópicos)
En aquellos pacientes en los que no ha sido preciso utilizar corticoides sistémicos para controlar la enfermedad, siempre se debe intentar el tratamiento de mantenimiento con salicilatos como primera opción. La sulfasalazina acumula muchos años de experiencia y es un fármaco perfectamente útil, siempre que no se trate de un varón que está intentando tener hijos. No obstante, por seguridad y comodidad la mayor parte de los pacientes reciben tratamiento con mesalazina. Al tratarse de un tratamiento a largo plazo, el punto esencial es tratar de conseguir un buen cumplimiento, y para ello resulta absolutamente esencial usar una dosis única diaria, sea cual sea la formulación galénica que se escoja. Afortunadamente se dispone hoy en España de varias formulaciones: comprimidos de 400mg, comprimidos de 500mg, saquitos de microgránulos de 1g, comprimidos de 1,2g y saquitos de microgránulos de 1,5g. Las preferencias del paciente son muy importantes en la elección de una u otra forma, con el objeto de facilitar el cumplimiento. También hay diferencias de coste que pueden ser sustanciales, e inclinar al clínico a recomendar una u otra forma.
En las formas distales las pruebas sobre la eficacia del tratamiento de mantenimiento son algo más débiles, y no siempre es fácil conseguir un buen cumplimiento. De hecho, dada la escasa evidencia disponible en estudios a largo plazo, la mayoría de los autores recomiendan mantener el tratamiento solo durante 6 meses si se trata del primer episodio de proctitis y este ha sido leve; ampliando su duración en casos de resistencia o recidivas frecuentes. Hay que tener en cuenta lo difícil que es para el paciente la adherencia permanente a un tratamiento tópico, que es siempre, como mínimo, incómodo. La adaptación a cada circunstancia resulta clave en este caso, y la información bien transmitida al paciente es fundamental para consensuar un sistema en cada caso.
7.1.2Colitis ulcerosa corticodependiente/corticorresistente (algoritmo 4)¿Es eficaz el tratamiento con inmunomoduladores tiopurínicos en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente?
Texto de la guía:
| Hay 2 metaanálisis104,124 que analizan la eficacia de los fármacos tiopurínicos en el mantenimiento de la remisión del paciente tras un brote leve-moderado de CU corticodependiente o corticorresistente. En el metaanálisis de la Cochrane124 se demuestra la superioridad de la azatioprina frente al placebo o la mesalazina en mantener la remisión con un OR de 1,56 (1,19-2,05). En cualquier caso, los estudios eran heterogéneos y de baja calidad. En el metaanálisis realizado por Gisbert et al.104 se incluyen 6 ECA que comparan azatioprina/mercaptopurina con placebo o mesalazina, observando un OR global de 2,56 (IC 95%: 1,51-5,3), que confirma los hallazgos de un cúmulo de estudios observacionales, que demuestran que la azatioprina es un fármaco eficaz a largo plazo en mantener la remisión en el paciente con CU tras brotes graves o moderados con un porcentaje de eficacia del 76%. El único ensayo clínico disponible de alta calidad125 incluido en el último metaanálisis y realizado en pacientes tratados con corticoides demuestra que la azatioprina es muy superior a la mesalazina en mantener la remisión en los primeros 6 meses tras el brote (OR 4,78 [1,57-14,5]). Este resultado tan claro se obtuvo a pesar de la duración limitada de la observación (6 meses, un tiempo limitado teniendo en cuenta que la azatioprina tarda a menudo meses en ser efectiva) y del uso de una dosis fija de 2 mg/kg/día muy probablemente subóptima en algunos pacientes. En este estudio destaca, además, la escasísima eficacia de la mesalazina en este grupo de pacientes. Nuevos datos señalan, además, que al igual que en la EC cuando se retira la azatioprina en pacientes que la reciben crónicamente la probabilidad de recaída es muy alta126.La contrapartida reside en los efectos adversos relevantes, que son más frecuentes en la rama de la azatioprina (OR 1,65 [1,22-2,23]), lo que hace que el tratamiento no sea aplicable en todos los pacientes. | Calidad moderada |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Está claro que hay muchos más ECA con tiopurinas en la enfermedad de Crohn que en la CU; lo que a menudo hace que muchas revisiones de expertos indiquen que la evidencia para el uso de tiopurinas en la CU es insuficiente, y puede retraer de su utilización. Sin embargo, numerosos estudios observacionales de muy buena calidad, que incluyen muchos pacientes seguidos a lo largo de períodos muy prolongados127 confirman que las tiopurinas son globalmente incluso más eficaces en la CU que en la EC. Curiosamente, las tiopurinas parecen ser más eficaces en la EC de colon que en la de intestino delgado. Aunque ello fuera aplicable a todos los pacientes con CU, los efectos adversos de las tiopurinas y la eficacia y seguridad de la mesalazina hacen que ésta sea preferible en muchos pacientes. Sin embargo, en el subgrupo especial de pacientes con corticodependencia la superioridad de las tiopurinas es manifiesta, como se demuestra en el estudio de Ardizzone et al.125; un ejemplo de un estudio clínico independiente bien planteado. Otra ventaja de las tiopurinas que nos lleva a una recomendación tan evidente es su bajo coste (150mg al día de azatioprina cuesta un 60% de lo que cuestan 1.500mg de la mesalazina más barata en España). Si añadiéramos este dato a los resultados del estudio de Ardizzone et al., en la población corticodependiente la superioridad de las tiopurinas es clarísima. Teniendo en cuenta que los resultados del estudio probablemente pueden optimizarse con una individualización de la dosis, parece que ante una situación de dependencia de corticoides en la CU el facultativo siempre debe valorar las tiopurinas como la primera opción. Su efectividad real se verá limitada, no obstante, por los efectos adversos. Estos obligan a retirar el tratamiento en uno de cada 5 pacientes, y es en ellos donde el clínico debe valorar otros métodos como la mesalazina, el infliximab o la cirugía, dependiendo de la gravedad, los antecedentes del caso, la duración de la enfermedad y otros factores individuales. |
¿Es eficaz el metotrexato en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente/resistente?
Texto de la guía:
| En la revisión publicada recientemente por la Cochrane128 se incluye únicamente un ECA107 que compara 12,5mg oral de metotrexato frente a placebo para el mantenimiento de la remisión de los pacientes con CU con un seguimiento de 9 meses sin observar diferencias (OR 2,25; IC 95%: 0,54 a 9,45; p=0,27).Otro ECA129 más complejo, con 3 brazos de aleatorización y serias deficiencias metodológicas, tampoco encontró diferencias en el mantenimiento de la CU. | Calidad baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
¿Es eficaz el tratamiento con infliximab en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente/resistente?
Texto de la guía:
| Los datos disponibles sobre infliximab en el tratamiento de mantenimiento de la CU están perfectamente sintetizados en una revisión sistemática44, que hemos citado previamente. De todos los pacientes incluidos en los ECA, solo los ACT dan datos de seguimiento prolongado. Estos estudios incluyen pacientes con brote de moderado a grave, ambulatorios, muchos de ellos corticodependientes o corticorresistentes, que son tratados con placebo o infliximab en la fase aguda, y los que responden, en mantenimiento. Ofrecen datos a medio-largo plazo (resultados a 30 y 54 semanas). En ellos infliximab es significativamente superior al placebo para mantener la remisión o respuesta. Así, en los pacientes en mantenimiento con infliximab la tasa de remisión supera en un 20% a los tratados con placebo (OR 2,72; IC 95%: 1,92-3,86). La tasa de respuesta es superior con infliximab en un 30% frente a placebo (OR 3,4; IC 95%: 2,52-4,59). Los datos sobre eficacia en prevenir colectomía no se mencionan en la publicación inicial, pero sí en un subanálisis posterior130. Así, requieren colectomía el 17% de los pacientes tratados con placebo y el 10% de los tratados con infliximab (p=0,02, reducción absoluta del riesgo del 7%). También se han publicado datos que señalan que infliximab disminuye significativamente el uso de recursos hospitalarios y mejoran la calidad de vida.En cuanto a la seguridad, los datos son similares a los descritos en la EC y a lo referido en apartados anteriores de esta guía. En la revisión de Gisbert et al.44 se pone de manifiesto que analizar los efectos adversos de todas las series no es sencillo porque en algunos de los ECA pone solo el número total de efectos adversos y no el de pacientes con efectos adversos (un mismo paciente puede tener más de un efecto adverso). En esta revisión se refleja que hay efectos adversos en el 83% (IC 95%: 80-86) de pacientes tratados con infliximab y en el 75% (IC 95%: 70-81) de los tratados con placebo, con un OR de 1,52 y un NNT de 14 (IC 5-25, IC 95%). Concretamente en los ACT (ACT 1 hasta 54 semanas, ACT 2 hasta 30 semanas) fue similar entre placebo e infliximab en las 2 dosis empleadas (proporción enfermos con efectos adversos en ACT 1: placebo 25,6%, 5 mg/kg 21,5%, y 10 mg/kg 23,8%; ACT 2: 19; 10,7, y 9,2%, respectivamente). Sin embargo, sí que se registraron algunas infecciones graves en pacientes tratados con infliximab, y reacciones infusionales precoces (8-12% de los pacientes) y tardías en algunos casos. Algunos estudios observacionales posteriores y evaluaciones a más largo plazo de alguno de los ensayos incluidos en esta revisión48,130 corroboran completamente las conclusiones, añadiendo información. Además, se ha comunicado a congresos un estudio a 16 semanas de inducción comparando 3 ramas: infliximab y azatioprina, infliximab y placebo, placebo y azatioprina; en el que se confirma la eficacia del infliximab en el tratamiento de la CU. No disponemos de detalles del estudio, por lo que tenemos que ser cautos en su interpretación. | Calidad alta |
Síntesis de la evidencia:
| Infliximab es más eficaz que placebo en el tratamiento de mantenimiento de la CU tras brote moderado, corticorresistente o corticodependiente. Los datos disponibles se refieren a pacientes tratados ya inicialmente con infliximab para inducir la respuesta. Aunque las diferencias con placebo son muy claras, entre un 20 y un 50% de los pacientes no responden al tratamiento con infliximab. | Calidad alta |
Formulación de la recomendación:
Comentario del grupo elaborador:
| Todavía quedan muchos interrogantes sobre su papel exacto, la necesidad o no de combinación con inmunomoduladores, la duración del tratamiento, y los controles necesarios, algo que varios ensayos observacionales y controlados en marcha aclararán en los próximos años.Los estudios demuestran claramente que infliximab es superior a placebo globalmente. Sin embargo, la heterogeneidad de los pacientes incluidos en los grandes estudios controlados, la falta de datos comparativos con otros fármacos, y el coste y el riesgo del infliximab deben tenerse en cuenta. Por ello, antes de indicar el infliximab como tratamiento de mantenimiento, debemos considerar cuidadosamente las circunstancias de cada paciente y las alternativas disponibles. La experiencia de más de un año de duración es limitada. |
Mantenimiento tras inducción de remisión con corticoides sistémicos
Si se trata de un primer brote, y el control se ha obtenido sin dificultad excesiva (no ha sido precisa la hospitalización, la respuesta a los corticoides se ha obtenido con rapidez) cabe intentar un tratamiento de mantenimiento basado en la utilización de mesalazina (oral, y en algunos casos oral y rectal). Sin embargo, si el brote ha requerido hospitalización o si el control ha sido lento y laborioso, o si el paciente ya reúne criterios de corticodependencia, la alternativa más razonable es utilizar tiopurinas (azatioprina o mercaptopurina). De nuevo, es esencial concienciar al paciente de la importancia del cumplimiento. Además, se deben instituir controles periódicos para vigilar la aparición de posible toxicidad. En caso de que las tiopurinas fracasen, bien sea por toxicidad, bien por ineficacia, caben fundamentalmente 2 alternativas. Hasta hace relativamente poco tiempo, la preeminente era recomendar al paciente la cirugía electiva. Sin embargo, desde hace unos años disponemos de infliximab, que obtiene una tasa significativa de respuestas en este subgrupo de pacientes. Escoger entre ambas alternativas requiere conocer las circunstancias de cada paciente, puesto que los escenarios clínicos son muy variables. Hoy por hoy, en la mayoría de los casos se intenta primero el tratamiento con infliximab y solo en algunas circunstancias (por ejemplo, una historia clínica larga con displasia de bajo grado en la última colonoscopia) se preferiría de entrada la cirugía. El uso de agentes biológicos ha representado un clarísimo avance en estos pacientes, pero todavía quedan numerosas incertidumbres que el clínico debe resolver en cada caso: ¿debemos administrar inmunomoduladores simultáneamente? ¿si es así, durante cuánto tiempo? ¿hay algún momento en el que debamos suprimir el agente biológico? Solo en los próximos años se irá acumulando información útil para responder a estos interrogantes.
En algunos de estos pacientes no hay respuesta a los inmunomoduladores ni a los biológicos y tanto el clínico como el propio paciente son reticentes a la cirugía porque el cuadro no es muy grave. Con los datos disponibles actualmente, este es probablemente el nicho en el que la aféresis tiene un papel. Si se utiliza, se recomienda hacerlo dentro de ensayos clínicos o al menos estudios observacionales, con el fin de contribuir a recopilar información que vaya aclarando el papel exacto de la aféresis en estos pacientes. También sería una alternativa, en respondedores iniciales a infliximab pero que pierden la respuesta posteriormente, intentar el uso de adalimumab. Los estudios observacionales así lo indican.
7.2Mantenimiento de la remisión obtenida tras brote grave (algoritmos 5 y 6)¿Es eficaz el tratamiento de mantenimiento con inmunomoduladores tiopurínicos en el paciente con CU grave que ha obtenido la remisión con infliximab? (algoritmo 5)
Texto de la guía:
| No hay ensayos clínicos que analicen específicamente la eficacia de los inmunomoduladores tras brote grave controlado con infliximab (no hay datos sobre su uso aislado o asociado a infliximab en esta situación clínica). Tampoco disponemos apenas de datos observacionales. Sí sabemos que azatioprina mantiene la remisión en una serie de escenarios concretos en los que se utiliza infliximab en la CU (por ejemplo, corticodependencia o en brote moderado corticorresistente). También sabemos que el uso de los tiopurínicos junto al tratamiento con infliximab en la EC, mantenido durante los primeros meses, parece mejorar algunos aspectos del tratamiento. | Calidad muy baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Aunque creemos que, muy probablemente, los inmunomoduladores tiopurínicos serán eficaces en un grupo significativo de pacientes en los que se ha inducido la remisión con infliximab (especialmente si se trata de pacientes naïve para el uso de inmunomoduladores) no podemos establecer una recomendación general basada en las pruebas. Si se nos permitiera extrapolar de la evidencia y experiencia disponibles en la CU cuando ha sido tratada con corticoides y/o anticalcineurínicos (ciclosporina o tacrolimus) podríamos suponer que las tiopurinas son una alternativa muy razonable en estos pacientes. |
¿Es eficaz el tratamiento de mantenimiento con infliximab en el paciente con CU grave que ha obtenido la remisión con infliximab? (algoritmo 5)
Texto de la guía:
| En este escenario clínico los datos son muy limitados (la mayoría de los pacientes incluidos en los ACT sufrían brotes moderados; por lo que los resultados no tienen porque ser aplicables al brote grave).Así, no disponemos de ensayos controlados que analicen la eficacia de infliximab como terapia de mantenimiento tras el brote grave controlado con este agente. De los ensayos incluidos en las revisiones sistemáticas43,44, los trabajos sobre brote grave no ofrecen datos acerca de la evolución a medio plazo de los pacientes tras el control del brote, con la excepción de los resultados publicados de la serie de Gusstavson et al.48. Las tasas de colectomía a 3 años del brote grave eran del 50 y 76% en los grupos infliximab y placebo, respectivamente (12/24 frente a 16/21 pacientes, p=0,012). El seguimiento de los estudios ACT indica que la tasa de colectomía se reduce claramente cuando el tratamiento se mantiene130. Hay también datos retrospectivos, que sí señalan una eficacia del tratamiento de mantenimiento, aunque son difíciles de interpretar en algunos puntos49. | Calidad baja |
Síntesis de la evidencia:
Recomendación:
Comentario del grupo elaborador:
| Como hemos señalado en el caso de las tiopurinas, estrictamente no disponemos de información en el subgrupo específico de pacientes con brote grave. Sin embargo, todos los datos que provienen de estudios realizados en pacientes con brote moderado indican que con gran probabilidad lo adecuado sería utilizar el infliximab como fármaco de mantenimiento en estos pacientes. De hecho, esta es la práctica clínica habitual de la gran mayoría de los expertos. |
Mantenimiento tras inducción de remisión con infliximab
Cuando la remisión se ha obtenido con infliximab, nos encontramos con 2 escenarios diferentes según el paciente hubiera o no tomado antes tiopurinas. Si no las había recibido lo razonable parece utilizar la combinación infliximab y tiopurinas durante un período de tiempo (quizás de 6 meses o un año) y a continuación intentar retirar el infliximab. No hay suficientes datos publicados, pero algunos expertos advierten en contra de esta posibilidad porque cuando se producen recaídas, al intentar controlarlas de nuevo reintroduciendo infliximab el fracaso podría ser frecuente. Si el paciente ya había sido tratado con tiopurinas deberá seguir tratamiento con infliximab como mantenimiento. Aunque no viene reflejado en el algoritmo, podríamos distinguir también 2 situaciones diferentes en este escenario. La primera sería cuando las tiopurinas se habían retirado por toxicidad grave previa. En ese caso resulta claro que el mantenimiento debe hacerse con infliximab en monoterapia. Podría discutirse si se debe o no combinar mesalazina, ya que aunque no hay un inconveniente específico para la asociación, tampoco se han demostrado ventajas. La segunda situación sería aquellos pacientes en los que las tiopurinas hubieran fracasado. En este caso también requieren un mantenimiento con infliximab, pero parece razonable mantener la asociación con tiopurinas al menos 6 meses para disminuir la inmunogenicidad del agente anti-TNF. A largo plazo habría que sopesar en cada caso las desventajas reales (coste) o posibles (riesgos) de los agentes biológicos frente a sus ventajas (tal vez mayor tasa de respuesta). No hay datos que nos permitan establecer una recomendación uniforme en estos pacientes. En cualquier caso, todos los cambios deben intentar hacerse con el paciente en remisión, y muy probablemente a la hora de tomar decisiones en un subgrupo de pacientes que requiere de estas medicaciones complejas para el control, la remisión debe definirse clínica, analítica, endoscópica y quizá incluso histológicamente.
Si en la evolución de estos enfermos se produce un fracaso del infliximab a pesar de su «intensificación» (bien por toxicidad, bien por pérdida de respuesta), hay que plantear la cirugía. Cabe intentar el tratamiento con adalimumab, de momento bajo uso compasivo, porque una serie de estudios observacionales señalan que esta alternativa es eficaz hasta en dos terceras partes de los pacientes.
¿Es eficaz el tratamiento de mantenimiento con azatioprina en el paciente con CU grave que ha obtenido la remisión con ciclosporina? (algoritmo 6)
Texto de la guía:
| La evidencia que analiza la eficacia de las tiopurinas en el mantenimiento de la remisión inducida por ciclosporina procede en su totalidad de series observacionales. Hemos identificado 7 series131–137 con seguimientos variables pero a veces muy prolongados (hasta 7 años). En la mayoría se informó de tasas elevadas de colectomía a medio plazo. Al año se situaron entre el 33 y el 69%. En la mayoría de las series se utilizan tiopurínicos para mantener la remisión a largo plazo y, aunque hay diferencias, en general señalan su utilidad. Hay 2 estrategias muy diferentes tras obtener la remisión con ciclosporina endovenosa: a) paso de ciclosporina intravenosa a oral durante unos meses e inicio simultáneo de azatioprina para mantenerla posteriormente de forma continuada, y b) al finalizar la ciclosporina intravenosa iniciar solo la azatioprina, sin ciclosporina oral. En ambos casos se desciende progresivamente la dosis de corticoides. Los resultados de estas series muestran en general (una única excepción) que la azatioprina mejora la evolución en este escenario. Incluso parece razonable evitar el uso de ciclosporina oral asociada, ante los resultados equivalentes de ambas estrategias y el mayor riesgo del uso de triple inmunomoduladores. | Calidad baja |
| Una serie reciente138 señala que, si el paciente ya estaba en tratamiento con azatioprina cuando presentó el brote grave que se controla con ciclosporina, el mantenimiento posterior con azatioprina es muy poco eficaz a medio plazo. |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| La calidad de la evidencia publicada no es muy grande, aunque ello es debido en gran parte a que en realidad la frecuencia de brotes graves que requieren ciclosporina o tacrolimus es relativamente baja (4 a 10 casos anuales en los grandes hospitales). Si bien los datos publicados son relativamente pocos, lo cierto es que prácticamente de forma uniforme todos los clínicos experimentados en el tratamiento de la CU mantienen el tratamiento con tiopurinas si se ha inducido una remisión con ciclosporina y/o tacrolimus. No obstante, la tasa de colectomía observada es muy elevada (mínimo de 33% al año) lo que indica que podría plantearse una estrategia más agresiva utilizando infliximab con o sin tiopurinas en este subgrupo específico de pacientes, con el fin de reducir al máximo la tasa de colectomías. |
¿Es eficaz el tratamiento de mantenimiento con ciclosporina en el paciente con CU grave que ha obtenido la remisión con ciclosporina? (algoritmo 6)
Texto de la guía:
| Debido a su nefrotoxicidad (que puede ser grave e irreversible) no parece recomendable el empleo de ciclosporina a largo plazo en una enfermedad tratable quirúrgicamente. No disponemos de ningún estudio controlado en esta situación. En la mayoría de las series132,133,137 que analizan la evolución de los pacientes tras el control del brote con ciclosporina se mantiene esta por vía oral durante unos meses, a la vez que se introduce la azatioprina (véase apartado previo). El sentido teórico de esta estrategia es mantener la remisión hasta que la azatioprina, fármaco de acción lenta, comience a hacer su efecto. Por el contrario, en otras series, tras el control del brote con ciclosporina no se mantiene esta por vía oral y se pasa directamente a azatioprina. Las tasas de respuesta en esta estrategia no parecen diferentes a las obtenidas con la otra. Finalmente, en algunas series aisladas se mantiene ciclosporina como único tratamiento durante unos meses, no añadiendo azatioprina. Uno de los factores importantes en cuanto a la tasa de respuesta a largo plazo tras el control de un brote grave con ciclosporina parece ser si el paciente estaba ya tomando o no azatioprina. | Calidad muy baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| Los datos disponibles no nos permiten establecer una recomendación con carácter general, pero sabiendo que la CU es una enfermedad que puede tratarse quirúrgicamente, la alternativa de utilizar de forma crónica tratamientos con el espectro de efectos adversos de los anticalcineurínicos no parece razonable, salvo casos excepcionales (ligados fundamentalmente a un riesgo quirúrgico muy alto). |
¿Es eficaz el tratamiento de mantenimiento con tacrolimus en el paciente con CU grave que ha obtenido la remisión con tacrolimus? (algoritmo 6)
Texto de la guía:
| Los datos disponibles, escasos y todos no controlados se han recopilado en una revisión sistemática40 con una serie importante posterior41, así como una revisión Cochrane42 que básicamente obtiene las mismas conclusiones que la revisión sistemática citada.En la revisión sistemática40 se resume que no es posible evaluar adecuadamente la eficacia de mantenimiento a largo plazo, dado que en 40 pacientes (más del 60% de los pacientes) el tacrolimus se utilizó como «puente» al mantenimiento con otros fármacos; aunque aparentemente la seguridad fue satisfactoria con escasos efectos adversos relevantes.En la serie posterior41, con un seguimiento medio de 39 ± 4,1 meses (5-164 meses), se evaluaron 40 pacientes con CU (14 corticodependientes, 26 corticorresistentes), y se obtuvo remisión en 27/40 (67,5%). La tasa de colectomía fue del 22,5% (9/40), practicada entre 1,6 y 41 meses tras el inicio del tratamiento. A los 4 años el 43,5% de los pacientes había sido colectomizado (fracaso del tratamiento). Se consiguió retirar o disminuir los corticoides en el 91% de los casos (33/36). Los efectos secundarios globales en esta serie fueron infrecuentes y habitualmente leves. | Calidad muy baja |
Síntesis de la evidencia:
Formulación de la recomendación:
Comentario del grupo elaborador:
| La recomendación puede parecer contradictoria con los resultados del estudio de Baumgart. Sin embargo, hemos de considerar que se trata de una serie heterogénea de pacientes, algunos de ellos recibiendo otros tratamientos, y evaluados cuando no se disponía de infliximab (y por tanto tampoco de la asociación entre infliximab y tiopurinas). Si bien no podemos descartar que en casos muy seleccionados, con muy alto riesgo quirúrgico, se puedan asumir los riesgos de una remisión prolongada con tacrolimus, la falta de datos comparativos con otras estrategias y los riesgos del tratamiento nos hacen establecer esta recomendación. |
Mantenimiento tras inducción de remisión con ciclosporina
Aunque ocasionalmente se han utilizado en otras circunstancias, en la gran mayoría de los casos el uso de ciclosporina o tacrolimus (en adelante nos referiremos solo a la ciclosporina) se limita a los brotes graves resistentes a corticoides, y a algunos casos excepcionales en los que los corticoides están contraindicados. Si se consigue la remisión, la ciclosporina no puede mantenerse de forma indefinida, puesto que se corre el riesgo de inducir toxicidad renal irreversible. La alternativa más utilizada ha sido mantener la ciclosporina durante un tiempo limitado (la mayoría de los grupos recomiendan 3 meses, aunque en España varios centros la mantienen solo 4 semanas), asociada a corticoides en pauta descendente, y a tiopurinas. El conjunto de datos disponible señala que las tiopurinas disminuyen la necesidad de colectomía a medio y largo plazo en este subgrupo de enfermos, con una toxicidad razonable. Sin embargo, en ocasiones el brote grave se ha producido en un paciente ya bajo tratamiento con tiopurinas. En este caso concreto, le quedan al clínico 3 opciones: recomendar directamente la cirugía programada (alternativa que ya se habrá valorado antes, en el control del brote grave resistente controlado con ciclosporina), iniciar tratamiento de mantenimiento con infliximab o bien intentar de nuevo las tiopurinas. Desde luego, mantener solo las tiopurinas no parece lo más lógico, aunque sea posible que en alguna circunstancia concreta, al cambiar el patrón de la inflamación, puedan recuperar su eficacia. En la mayor parte de los casos el paciente y los profesionales tendrán que escoger entre el infliximab y la cirugía, tomándose la decisión dependiendo de las circunstancias individuales (duración de la enfermedad, toxicidad previa de los fármacos), de las expectativas de cada paciente (miedo a la cirugía, accesibilidad al control médico), y de la experiencia local del grupo de trabajo. Cuando optemos por infliximab, decisión muy razonable en muchos casos, es muy razonable mantener las tiopurinas, al menos durante un tiempo mínimo que podría ser de 6-12 meses.
8Otros tratamientos8.1Posibles tratamientos8.1.1ProbióticosLa literatura médica sobre probióticos y CU es muy difícil de interpretar, puesto que: a) el tipo y la formulación de los diversos probióticos utilizados en los diversos estudios es muy variable; b) escasean las comparaciones con placebo, y en muchos de los estudios la rama de probióticos recibe a la vez tratamiento con otros fármacos (particularmente aminosalicilatos), y c) los resultados publicados son tremendamente heterogéneos. Por tanto, en el momento actual no existe evidencia firme a favor o en contra de la utilización de probióticos en la CU, excepción hecha de la reservoritis (entidad que no es objeto de esta GPC). Algunos datos recientes indican que el VSL#3 puede ser de utilidad en la CU139 en situaciones de brote leve-moderado, tanto como tratamiento aislado como complementario a la mesalazina, pero deben confirmarse antes de pasar a formar parte del esquema terapéutico básico.
8.2Tratamientos complementarios8.2.1AnemiaEl tratamiento de la anemia y de la ferropenia sin anemia forman parte fundamental del manejo de la CU. Existe una guía de consenso internacional140, a la que remitimos al lector. Nunca es normal que el paciente tenga anemia o ferropenia, y uno de nuestros objetivos ha de ser la normalización de los parámetros hematológicos, mediante el uso juicioso de las transfusiones, hierro intravenoso o hierro oral según las circunstancias.
8.2.2OtrosEn el tratamiento de la CU se pueden dar algunas circunstancias especiales no detalladas en esta GPC. En la gran mayoría de estos escenarios la evidencia disponible es escasa o de baja calidad, aunque en ocasiones hay datos más que suficientes para establecer una recomendación. No siendo el objeto de esta guía, recomendamos a los lectores referirse al consenso de la ECCO, en su capítulo de situaciones especiales en CU141. También puede ser útil consultar la guía de prevención de complicaciones infecciosas de la ECCO142. Si se considera el uso de agentes biológicos hay otro documento reciente de referencia143. Asimismo, la información sobre la fertilidad, el embarazo y el parto en los pacientes con enfermedad inflamatoria intestinal se ha examinado críticamente en otro documento de consenso muy reciente144.
9PerspectivasEn el momento actual parece poco probable que en un plazo razonable (quizá hasta el 2013 al menos) el clínico práctico vaya a disponer de más alternativas en el tratamiento de la CU. Ello no quiere decir que no se puedan producir mejoras directamente aplicables a los pacientes. En nuestra opinion, estas pueden venir dadas por:
- •
La aplicación en la práctica diaria de las recomendaciones contenidas en las GPC, como la presente.
- •
El reconocimiento de la importancia del tratamiento de mantenimiento como forma de evitar la aparición de brotes y de mejorar sustancialmente la calidad de vida de los pacientes.
- •
El estudio de las barreras para un buen cumplimiento del tratamiento, problema que está en la raíz de muchos de los fracasos terapéuticos, para poder enfrentar directamente este problema. Este punto es importantísimo en el conjunto de pacientes con CU, pero todavía lo es más cuando son precisos tratamientos tópicos.
- •
La educación permanente del paciente para adquirir progresivamente una corresponsabilidad en el manejo a largo plazo de su problema. Siendo una entidad crónica, el paciente es el mejor situado para controlar el problema, y solo un conocimiento de la enfermedad y de las posibilidades terapéuticas le permitirán hacerlo.
- •
Nuevos estudios controlados y observacionales proporcionarán información crítica sobre el uso de los medios terapéuticos ya disponibles. En concreto, en este momento están ya avanzados como mínimo 3 estudios clave: un estudio sobre ciclosporina versus infliximab en el brote grave de CU solo pendiente de publicación (aunque ya comunicado en congresos, como hemos señalado anteriormente); otro estudio sobre la eficacia de la combinación de infliximab y tiopurinas en la inducción y mantenimiento de la remisión de la CU, también solo pendiente de publicación, y un estudio sobre la eficacia de la granulocitoaféresis en la situación de corticodependencia, este todavía en la fase de selección de pacientes. Además, esperamos la publicación de un número indeterminado de estudios observacionales, especialmente en lo que se refiere a la experiencia acumulada con infliximab que proporcionarán información sobre duración de la respuesta, posibilidades de intensificación, y toxicidad a largo plazo. El conjunto de todos estos datos hará necesaria una revisión de esta guía en un plazo máximo de 3 años. Creemos que, sobre todo, estos datos nos permitirán avanzar en la individualización del tratamiento, al permitir estratificar a los pacientes no solo por el escenario clínico global, sino por otras circunstancias.
- •
Por supuesto la investigación básica y clínica permitirán definir cada vez mejor diferentes subgrupos de pacientes, lo que también facilitará la aplicación personalizada de los tratamientos.
Caja 1. Gravedad y extensión, definiciones problemáticas
Pocos de nosotros tendríamos dificultades en distinguir un ser vivo de un ser no vivo, y sin embargo enunciar una definición exacta de la vida entraña no poca dificultad145. Una paradoja parecida se produce prácticamente cada vez que nos enfrentamos a un paciente con una CU. Para el paciente resulta fácil saber si se encuentra bien, regular, mal o muy mal; y para el clínico experto no resultaría muy difícil saber –al menos aparentemente– si el paciente está bien, regular, mal o muy mal. Sin embargo, el problema surge cuando para poder comparar entre 2 pacientes o entre 2 momentos del mismo paciente tenemos que utilizar algún tipo de índice objetivo. La CU es una enfermedad compleja, con sintomatología muy variada, intestinal y extraintestinal, y con repercusiones analíticas y/o endoscópicas también muy diversas y cambiantes. Además, es frecuente encontrar serias discrepancias entre los datos clínicos, analíticos y/o endoscópicos. La primera aproximación técnica a este problema la llevaron a cabo Sidney Truelove y Lloyd Witts en el ya clásico ensayo clínico sobre hidrocortisona en la colitis146. A partir de ese momento se han utilizado numerosos índices clínicos, biológicos, endoscópicos e histológicos. Curiosamente, pocos han sido validados formalmente, y en su gran mayoría carecen de reproducibilidad suficiente. Existe, además, una importante limitación para el uso diario de estas clasificaciones: las clasificaciones complejas no le gustan al cerebro humano147. Para elaborar esta GPC nos hemos visto obligados a clasificar a los pacientes en 2 grandes situaciones de gravedad: leve a moderado versus grave. Es la única manera de sistematizar la información disponible en la literatura médica en estos momentos. Especialmente problemática es la amplitud del concepto leve-moderado que abarca desde aquel paciente que tiene 3 deposiciones al día y un leve malestar abdominal (si su situación normal es de una deposición al día sin malestar), hasta aquel que tiene 5 deposiciones con sangre, que le obligan a levantarse una vez por la noche, y una importante astenia ligada a una anemia con 11,2g/dl de hemoglobina. Es más, es posible que el primero tenga síntomas leves y no esté tomando ningún tratamiento, y el último tenga síntomas intensos a pesar de estar ya recibiendo una combinación de mesalazina oral, mesalazina rectal y corticoides orales. Para su inclusión en el ensayo clínico ambos pacientes estarían en el mismo grupo, para el clínico es obvio que al primero le administraría mesalazina oral, le tranquilizaría y le citaría para un mes después, y sin embargo es probable que para el segundo considerara seriamente recomendar el uso de infliximab. No es factible recoger todas estas posibilidades en unos simples algoritmos, ni todas las circunstancias caben en las tablas GRADE por complejas que estas sean. La guía pretende facilitar el trabajo, pero desde luego no puede sustituir al clínico.
Fuentes: Luisi145, Truelove y Witts146 y Gilbert147.
Caja 2. Índices de actividad
El curso clínico variable de las enfermedades inflamatorias intestinales hace imprescindible el concepto de actividad de la enfermedad. Sin embargo, no hay una única definición de actividad ya que hay puntos de vista diferentes (por ejemplo, paciente versus clínico versus investigador) y diferentes consecuencias de la enfermedad a medir: cambios bioquímicos, lesión histológica, lesión radiológica, lesión endoscópica, síntomas clínicos, calidad de vida, repercusión económica, morbilidad, mortalidad y otras. Cuando se creó la necesidad de disponer de una definición práctica fue en el ensayo clínico de hidrocortisona frente a placebo, que llevaron a cabo Sidney Truelove y Lloyd Witts entre 1952 y 19556. Para poder evaluar el resultado del tratamiento idearon una clasificación muy simple que distinguía los extremos (leve versus grave), con una categoría intermedia, con parámetros todos ellos clínicos o analíticos. La sencillez de la clasificación, y el hecho de ser la primera llevó a que se impusiera tanto en la práctica clínica como en muchos estudios. Sin embargo, nunca ha sido validada con metodología formal (se desconoce su fiabilidad interna, reproducibilidad y fiabilidad externa). Durante los 56 años que han transcurrido han aparecido numerosos índices clínicos, clínicos biológicos, endoscópicos, histológicos, de calidad de vida, de repercusión laboral y otros que se han utilizado en muy diversos estudios. De hecho, es a menudo muy difícil comparar los resultados de diversos trabajos porque utilizan sistemas de medida diferentes, y porque incluso cuando usan los mismos, no siempre se escogen los mismos puntos de corte para las definiciones. Cuando las diversas alternativas se analizan con rigor metodológico los resultados son descorazonadores: no hay correlación entre la analítica y la endoscopia, entre la endoscopia y la clínica, entre la histología y la analítica, entre la visión del paciente y la del médico, etc. Curiosamente, los últimos en llegar al problema, los gastroenterólogos pediátricos expertos en enfermedad inflamatoria intestinal, han aplicado desde el principio una metodología más rigurosa, y han desarrollado el Pediatric Ulcerative Colitis Activity Index (PUCAI)148, probablemente el primer índice correctamente validado. Para el propósito de esta guía hay un problema más: aunque quisiéramos ser rigurosos con los índices no podríamos, porque los estudios están hechos antes que los índices en muchos casos. Por ello, hemos decidido utilizar la clasificación de Montreal, que divide las posibles situaciones de actividad en 4: remisión, leve, moderada y grave. Los datos de la mayoría de los estudios se pueden extrapolar a este tipo de clasificación. Por supuesto, se producirá cierta confusión, especialmente en los límites (véase caja 1). En muchos estudios se analizan no solo índices clínicos, sino también endoscópicos y a veces histológicos. También en este caso nos hemos visto obligados a simplificar algunas veces, asumiendo una posible pérdida de calidad de los datos, compensada en muchas ocasiones por el gran número de pacientes incluidos. Aunque admitimos que en el futuro los conceptos de remisión (por ejemplo, recientemente se ha propuesto definir remisión como ausencia completa de síntomas clínicos y cicatrización mucosa demostrada en la colonosocopia149) incluirán siempre parámetros objetivos (endoscópicos, histológicos o biológicos), las definiciones de respuesta y remisión son casi siempre clínicas, porque los estudios analizados no permiten en muchos casos otra aproximación. Hemos de señalar, finalmente, que en el caso del brote grave las variables que se escogieron por el comité son claramente definibles: mortalidad o necesidad de colectomía, lo que hace más fácilmente comparables los estudios.
Fuentes: Truelove y Witts6, Turner et al.148 y Travis et al.149.
Caja 3. Consideraciones prácticas sobre las dosis de los fármacos inmunomoduladores
Corticoides. Los corticoides sistémicos se han utilizado por diversas vías (oral, intravenosa, rectal) y en muy diferentes formulaciones y productos. Si consideramos la prednisona como el corticoide de referencia (es el más utilizado), la dosis estándar de inicio de tratamiento es de 1 miligramo por kilogramo por día, por vía oral. Para ajustar las dosis de otros corticoides, tenemos que tener en cuenta las equivalencias de potencia entre ellos, la vía de administración que puede hacer variar la biodisponibilidad muy significativamente, y que pueden existir diferencias en la toxicidad y los efectos individuales de los diferentes productos. El corticoide más utilizado por vía intravenosa es la metilprednisolona, que es más potente que la prednisona (4mg de metilprednisolona equivalen a 5mg de prednisona). La dosis inicial se mantiene habitualmente 2 semanas, aunque en dependencia de la respuesta puede ser aceptable desde una semana hasta cuatro. Cuando se reduce la dosis, hay diversas pautas de descenso paulatino. Lo más habitual es quitar 10mg de la dosis diaria de prednisona cada semana hasta llegar a 20mg/día, y a partir de ahí quitar 5mg de la dosis diaria hasta suspenderla. No está justificado, habitualmente, mantener el tratamiento más de 3 meses sin haber iniciado un tratamiento alternativo.
Ciclosporina. La ciclosporina se utiliza de forma exclusiva en el brote grave o moderado resistente a corticoides, y no debe prolongarse su administración más de 3 meses por el riesgo de toxicidad irreversible, particularmente renal. Aunque no faltan defensores de la vía oral, los estudios que justifican su uso se han realizado casi todos utilizando inicialmente la vía intravenosa. Se escogió inicialmente una dosis de 4mg/kg/día, aunque luego se requiere un ajuste individual en dependencia de los niveles sanguíneos obtenidos, y de la toxicidad. En un estudio aleatorizado se demostró que 2mg/kg/día eran tan eficaces como 4, aunque en realidad en ambos grupos la dosis media final administrada fue muy similar debido a que se permitían ajustes por niveles y toxicidad. Con los datos disponibles parece prudente empezar con 2mg/kg/día y ajustar al alza si no se produce toxicidad y no se alcanzan niveles considerados terapéuticos.
Tacrolimus. Las dosis utilizadas son de 0,01 a 0,02mg/kg cuando se utiliza por vía intravenosa, y de 0,1 a 0,2mg/kg cuando se utiliza por vía oral, ajustándose individualmente según los niveles obtenidos en sangre, la toxicidad y la respuesta.
Azatioprina y mercaptopurina. La dosis media de azatioprina es de 2,5mg/kg/día y de mercaptopurina de 1 a 1,5mg/kg/día. Sin embargo, hay bastante variabilidad individual en la respuesta y toxicidad, por lo que las dosis pueden ajustarse en dependencia de la efectividad y la toxicidad. Si se dispone de ellos, se pueden utilizar como guía, al menos en pacientes seleccionados, los niveles de metabolitos. Sin embargo, en la mayoría de los centros los ajustes hay que llevarlos a cabo teniendo en cuenta la clínica, los leucocitos totales, las transaminasas y otros parámetros analíticos. No se puede descartar completamente su utilidad si se han mantenido durante un período inferior a 6 meses.
11Conflicto de interesesEsta guía ha sido posible en parte gracias a una beca no restrictiva de MSD. MSD no ha participado en ninguna parte del desarrollo ni influido en ningún aspecto científico de esta guía.
F. Gomollón ha recibido apoyo para asistir a reuniones científicas de Abbott y MSD. También ha recibido honorarios por consultoría de FAES-FARMA, Abbott y MSD. Asimismo, ha recibido soporte para investigación de MSD.
S. García-López ha recibido apoyo para asistir a reuniones científicas de Abbott, MSD, FAES-FARMA, Ferring y Shire. También ha recibido honorarios por consultoría de Abbott y MSD.
B. Sicilia ha recibido apoyo para asistir a reuniones científicas de Abbott, MSD, FAES-FARMA, Ferring y Shire.
Javier P Gisbert ha recibido apoyo para asistir a reuniones científicas de Abbott y MSD. También ha recibido honorarios por consultoría de FAES-FARMA, Abbott y MSD.
Joaquin Hinojosa ha recibido apoyo para asistir a reuniones científicas de Abbott y MSD. También ha recibido honorarios por consultoría de FAES-FARMA, Abbott y MSD.
El resto de los autores de la guía no declaran conflicto de intereses.
Presidente: Joaquín Hinojosa
Vicepresidente: Fernando Gomollón
Secretario: Valle García
Tesorero: Francesc Casellas
Coordinador de la web: Pilar Nos Mateu
Vocales: José Luis Cabriada Nuño, Eugeni Doménech Morral, Fernando Muñoz, Daniel Ginard, Pilar Nos Mateu, Julián Panés, Javier P. Gisbert, Cristina Saro
Joaquín Hinojosa
Fernando Gomollón
Javier P. Gisbert
Fernando Gomollón
Santiago García-López
Beatriz Sicilia
Javier P. Gisbert
Joaquín Hinojosa
Montserrat Aceituno
Manuel Barreiro
Fernando Bermejo
Isabel Bernal
Xavier Calvet
Eugeni Domènech
María Esteve
Daniel Ginard
Esther García Planella
Joaquín Hinojosa
Antonio Lopez Sanromán
Ignacio Marín
Fernando Muñoz
Pilar Nos
Julián Panés
Elena Ricart
Malola Ruiz
Miquel Sans
Cristina Saro
Iván Sola
Federico Argüelles (gastroenterólogo)
Guillermo Bastida (gastroenterólogo)
Belén Beltrán (gastroenterólogo)
Eduard Cabré (gastroenterólogo)
Ignacio Catalán (gastroenterólogo)
María Chaparro (gastroenterólogo)
Javier de Oca (cirujano)
Ana Echarri (cirujano)
Eloy Espín (cirujano)
Orlando García-Bosch (gastroenterólogo)
Ana Gutiérrez (gastroenterólogo)
Elena María Gutiérrez (paciente)
Isabel Iborra (gastroenterólogo)
Laureano López Rivas (gastroenterólogo)
Olga Merino (gastroenterólogo)
Amelia Nogueiras (enfermera)
Lorena Oltra (enfermera)
Maite Ortega (paciente)
Michel Papo (gastroenterólogo)
Ildefonso Pérez (paciente)
Sabino Riestra (gastroenterólogo)
Toni Torrejón (enfermera)
Concha Thomson (gastroenterólogo)
Manuel VanDomselar (gastroenterólogo)
José Antonio Velázquez (paciente)
| Inducción de la remisión en el brote grave de colitis ulcerosa |
| ¿Son los esteroides eficaces en la inducción de la remission en los pacientes con brote grave de CU? |
| ¿Es eficaz la ciclosporina en la inducción de la remisión del paciente con brote grave de CU? ¿Y en situación de corticorresistencia? |
| ¿Es eficaz el tacrolimus en la inducción de la remisión del paciente con brote grave de CU? ¿Y en situación de corticorresistencia? |
| ¿Es eficaz el infliximab en la inducción de la remisión del paciente con brote grave de CU? ¿Y en situación de corticorresistencia? |
| ¿Es eficaz la heparina (a dosis anticoagulante) en la inducción de la remisión del paciente con brote grave de CU? |
| ¿Son eficaces los antibióticos en la inducción de la remisión del paciente con brote grave de CU? |
| ¿Es eficaz la cirugía en la inducción de la remisión del paciente con brote grave de CU? |
| ¿Es eficaz la nutrición parenteral en la inducción de la remisión del paciente con brote grave de CU? |
| Inducción de la remisión en el brote leve a moderado de colitis ulcerosa |
| ¿Es eficaz el tratamiento con salicilatos orales en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Es el tratamiento combinado de salicilatos orales y tópicos más eficaz que el oral aislado en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Es eficaz el tratamiento con salicilatos tópicos aislados en la inducción de la remisión del paciente con brote leve-moderado de CU izquierda? |
| ¿Es el tratamiento con salicilatos tópicos más eficaz que el oral en la inducción de la remisión del paciente con CU izquierda? |
| ¿Son eficaces los corticoides orales sistémicos en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Son eficaces los nuevos corticoides orales de baja biodisponibilidad en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Es eficaz el tratamiento con corticoides rectales en la inducción de la remission del paciente con brote leve-moderado de CU izquierda? |
| ¿Son más eficaces los corticoides rectales de baja biodisponibilidad que los de alta biodisponibilidad en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Son más eficaces los salicilatos tópicos que los corticoides rectales en la inducción de la remisión del paciente con brote leve-moderado de CU? |
| ¿Son eficaces los inmunomoduladores tiopurínicos en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente? |
| ¿Es eficaz el metotrexato en la inducción de la remisión del paciente con brote moderado de CU corticodependiente? |
| ¿Es eficaz el infliximab en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente? |
| ¿Es eficaz el adalimumab en la inducción de la remisión del paciente con brote moderado de CU corticodependiente y/o corticorresistente? |
| ¿Es eficaz el tratamiento con aféresis en la inducción de la remisión del paciente con brote moderado de CU corticodependiente? |
| Tratamiento de mantenimiento del paciente con colitis ulcerosa en remisión |
| ¿Es eficaz el tratamiento con salicilatos orales en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU tratado con salicilatos? |
| ¿Es eficaz el tratamiento con salicilatos tópicos en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU izquierda tratada con salicilatos? |
| ¿Es eficaz el tratamiento con inmunomoduladores tiopurínicos en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente? |
| ¿Es eficaz el metotrexato en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente/corticorresistente? |
| ¿Es eficaz el tratamiento con infliximab en el mantenimiento de la remisión del paciente tras brote leve-moderado de CU corticodependiente/corticorresistente? |
| ¿Es eficaz el tratamiento de mantenimiento con inmunomoduladores tiopurínicos en el paciente con CU grave que ha obtenido la remisión con infliximab? |
| ¿Es eficaz el tratamiento de mantenimiento con infliximab en el paciente con CU grave que ha obtenido la remisión con infliximab? |
| ¿Es eficaz el tratamiento de mantenimiento con azatioprina en el paciente con CU grave que ha obtenido la remisión con ciclosporina? |
| ¿Es eficaz el tratamiento de mantenimiento con ciclosporina en el paciente con CU grave que ha obtenido la remisión con ciclosporina? |
| ¿Es eficaz el tratamiento de mantenimiento con tacrolimus en el paciente con CU grave que ha obtenido la remisión con tacrolimus? |
| Acción (y escenario clínico) | Calidad de la evidencia | Recomendación | Para el clínico… |
| Tratamiento del brote de inducción de CU | |||
| Brote grave | |||
| Corticoides i.v. | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Ciclosporina i.v. | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Tacrolimus | Baja | Débil a favor (sugerido) | Probablemente hazlo |
| Infliximab | Moderate | Fuerte a favor (recomendado) | Hazlo |
| Heparina (anticoagulante) | Baja | Fuerte en contra (NO recomendado) | No lo hagas |
| Antibióticos | Muy baja | No recomendación | |
| Cirugía | Baja | Débil a favor (sugerido) | Probablemente hazlo |
| Nutrición parenteral | Baja | Débil en contra (no, sugerencia) | Probablemente no lo hagas |
| Brote leve-moderado | |||
| Salicilatos orales | Alta | Fuerte a favor (recomendado) | Hazlo |
| Orales y tópicos | Moderada | Débil a favor (sugerido) | Probablemente hazlo |
| Salicilatos tópicos (colitis izquierda) | Alta | Fuerte a favor (recomendado) | Hazlo |
| Salicilatos tópicos (colitis izquierda) | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Corticoides sistémicos | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Corticoides orales de baja biodisponibilidad | Baja | Débil a favor (sugerido) | Probablemente hazlo |
| Corticoides rectales (colitis izquierda) | Moderada | Débil a favor (sugerido) | Probablemente hazlo |
| Corticoides rectales versus sistémicos (colitis izquierda) | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Salicilatos vs corticoides, rectales (colitis izquierda) | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Tiopurinas para fallo a corticoides | Baja | Débil en contra (no, sugerencia) | Probablemente no lo hagas |
| Metotrexato para fallo a esteroides | Baja | Débil en contra (no, sugerencia) | Probablemente no lo hagas |
| Infliximab para fallo a esteroides | Alta | Fuerte a favor (recomendado) | Hazlo |
| Adalimumab para fallo a esteroides | Moderada | Débil a favor (sugerido) | Probablemente hazlo |
| Aféresis | Baja | Débil en contra (no, sugerencia) | Probablemente no lo hagas |
| Tratamiento de de la CU en remisión | |||
| Salicilatos orales | Alta | Fuerte a favor (recomendado) | Hazlo |
| Salicilatos tópicos (colitis izquierda) | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Tiopurinas para fallo a esteroides | Moderada | Fuerte a favor (recomendado) | Hazlo |
| Metotrexato para fallo a esteroides | Baja | Débil en contra (No, sugerencia) | Probablemente no lo hagas |
| Infliximab para fallo a esteroides | Alta | Fuerte a favor (recomendado) | Hazlo |
| Tiopurinas tras remisión con infliximab | Muy baja | No recomendación | |
| Infliximab tras remisión con infliximab | Baja | Débil a favor (sugerido) | Probablemente hazlo |
| Tiopurinas tras remisión con ciclosporina | Baja | Débil a favor (sugerido) | Probablemente hazlo |
| Ciclosporina tras remisión con ciclosporina | Muy baja | Fuerte en contra (no recomendado) | No lo hagas |
| Tacrolimus tras remisión con tacrolimus | Muy baja | Fuerte en contra (no recomendado) | No lo hagas |
El término agresivo no es el más adecuado al referirnos a un tratamiento: lo que debe primar es el balance beneficio-riesgo, y en muchas ocasiones el tratamiento más eficaz e incluso más eficiente puede ser el aparentemente más agresivo.