Aproximadamente dos tercios de los pacientes con síndrome del intestino irritable (SII) relacionan sus síntomas con algún alimento. Revisamos aquellos factores dietéticos que pueden influir. La fibra soluble puede mejorar el estreñimiento pero frecuentemente aumenta la distensión y el dolor abdominal. La malabsorción de hidratos de carbono parece más frecuente en los pacientes con SII. Se ha planteado así una dieta exenta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP), obteniéndose una mejoría significativa, lo que la plantea como una opción terapéutica. Se aconseja realizar cribado de la enfermedad celiaca mediante serología en pacientes que no padezcan estreñimiento. También puede existir una sensibilidad al gluten no-celiaca, definida como una forma de intolerancia al gluten cuando se han excluido la enfermedad celiaca y la alergia al trigo. Aunque no existe una dieta específica sí que puede ser beneficioso realizar comidas pequeñas y frecuentes, y evitar alimentos grasos, lácteos, muchos hidratos de carbono, cafeína y alcohol.
About two-thirds of irritable bowel syndrome (IBS) patients associate their symptoms with certain foods. We reviewed food-related factors putatively associated with manifestations of IBS. Soluble fiber may improve constipation but frequently increases bloating and abdominal pain. Carbohydrate malabsorption seems to be more frequent in IBS. A low FODMAP (fermentable oligosaccharides, disaccharides, monosaccharides and polyols) diet significantly reduces IBS symptoms and has been suggested as a therapeutic option. Serological screening for celiac disease should be done in patients without constipation. Moreover, non-celiac disease gluten sensitivity, defined as gluten intolerance once celiac disease and wheat allergy have been ruled out, should be considered in these patients. There is no specific diet for IBS patients but small and frequent meals, avoiding greasy foods, dairy products, many carbohydrates, caffeine and alcohol, is recommended.
El síndrome del intestino irritable (SII) es un trastorno funcional digestivo -es decir, sin causa orgánica ni bioquímica claramente conocida - que se caracteriza clínicamente por la asociación de dolor/molestia abdominal y alteraciones en el hábito deposicional1. Curiosamente unos pacientes pueden tener diarrea, otros estreñimiento, y otros periodos en los que se alternan ambas cosas. Así, dentro del SII se reconocen 4 subtipos: 1. SII con predominio de estreñimiento (SII-E); 2. SII con predominio de diarrea (SII-D); 3. SII con patrón mixto (SII-M); y 4. SII con patrón indefinido (SII-I). Algunos síntomas como la urgencia defecatoria, la sensación de evacuación incompleta, la hinchazón abdominal, la emisión de moco en la deposición, o el esfuerzo excesivo al defecar, apoyan el diagnóstico pero no son imprescindibles para establecerlo.
Con frecuencia el SII se asocia a otros trastornos funcionales, de manera que la probabilidad de que un paciente tenga además enfermedad por reflujo gastroesofágico (ERGE) o dispepsia alcanza el 47% y el 40%, respectivamente2,3. Un estudio realizado en la población general comprobó que entre el 4-9% de las personas presentan síntomas de al menos 2 trastornos funcionales digestivos, y que de el 1-4% manifiestan clínica de al menos 3; ello hace pensar en una base patogénica común en estos trastornos4.
La presencia de otros síntomas extraintestinales también es más común entre los pacientes con SII, incluyendo la fibromialgia, la fatiga crónica y la cefalea tensional5.
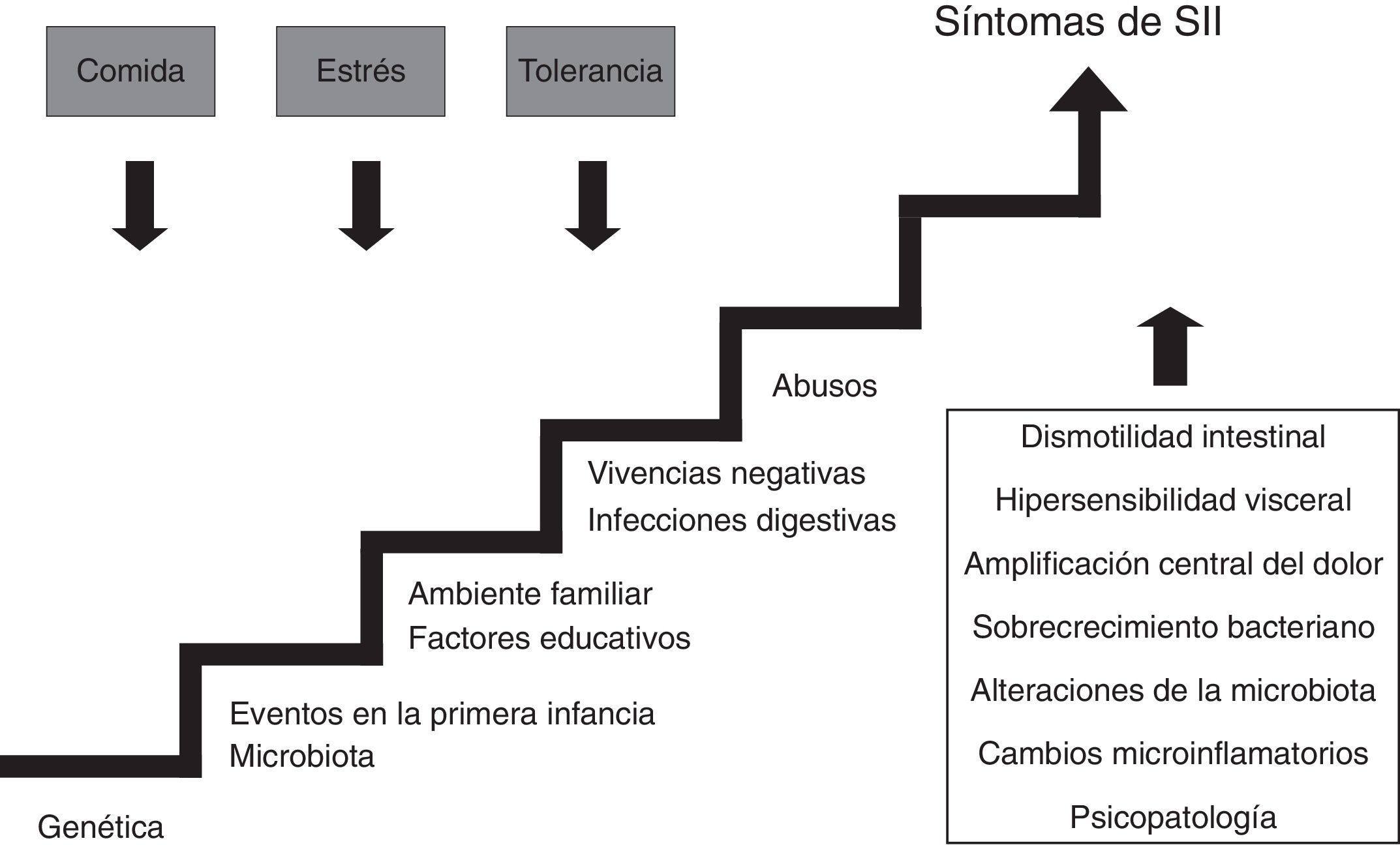
¿Cuál es la causa del síndrome del intestino irritable?En la actualidad se cree que el SII es causado por anomalías de la función digestiva, especialmente de la motilidad y de la sensibilidad, aunque cada vez son más los datos que apoyan la existencia de fenómenos microinflamatorios6. En la mayoría de los casos no existe un motivo conocido que origine el SII aunque puede estar relacionado con antecedentes estresantes, como el maltrato, o con haber padecido una gastroenteritis aguda; también existen datos que apoyan la influencia tanto de factores genéticos como ambientales familiares7,8.
Se han comunicado diversas alteraciones de la motilidad en el SII incluyendo una aceleración del tránsito, tanto en el intestino delgado como en el colon, en el SII-D, y un enlentecimiento en el SII-E. Sin embargo, estas alteraciones no están presentes en todos los pacientes y su correlación con los síntomas es pobre9.
Numerosas evidencias han demostrado que algunos enfermos con SII tienen una sensibilidad incrementada a ciertos estímulos (hiperalgesia visceral). La hipersensibilidad puede ser la consecuencia de fenómenos de sensibilización de las neuronas del asta posterior medular o de un procesamiento anormal de la información transmitida por las vías aferentes en el sistema nervioso central10. Además, algunas investigaciones han demostrado la existencia de fenómenos de disfunción autonómica (predominio de tono simpático en el SII-D y predominio de tono vagal en el SII-E) que persisten durante el sueño, sugiriendo que se trata de un fenómeno intrínseco asociado a la enfermedad y no una consecuencia de la misma11.
En los últimos años se ha postulado la hipótesis de que alteraciones en la microbiota intestinal pueden desempeñar un papel relevante en la patogénesis del SII, ya sea debido a cambios en la composición de la «flora» colónica12 o a sobrecrecimiento bacteriano intestinal13.
Tampoco hay que olvidar que los pacientes con SII padecen con mayor frecuencia trastornos psicológicos, incluyendo síndromes de ansiedad generalizada, pánico, neuroticismo, alteraciones del estado de ánimo (distimia, depresión) y diversos trastornos somatomorfos14.
En la figura 1 puede observarse esquemáticamente la compleja etiopatogenia del SII.
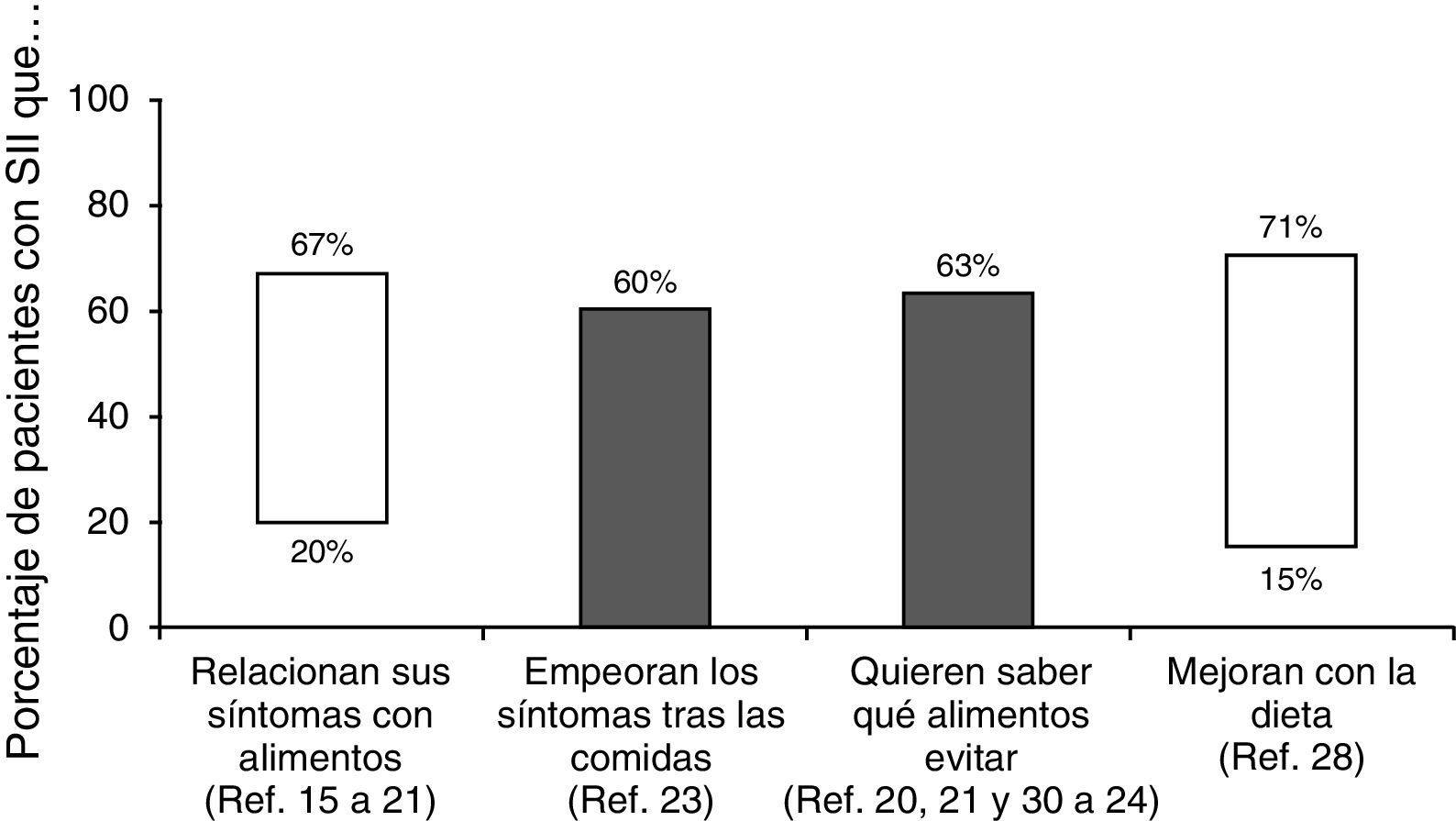
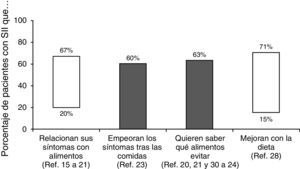
¿Qué importancia tiene la dieta en el síndrome del intestino irritable?Aproximadamente dos tercios de los pacientes con SII creen que sus síntomas son desencadenados por algún alimento. De hecho, se ha publicado que la prevalencia de percepción de intolerancias alimentarias es 2 veces superior que en la población que no padece SII15,16. Sin embargo, dichas intolerancias solo pueden demostrarse en una pequeña proporción16–22. Así, cuando se supone que existe una «alergia alimentaria» se suele comprobar que en el 50-90% de los casos no es una verdadera alergia sino una intolerancia o aversión a ciertos alimentos. En cualquier caso, más del 60% de los pacientes con SII describen un empeoramiento de los síntomas después de las comidas23: 28% unos 15 minutos después de comer y el 93% en las 3 primeras horas24. En otro estudio reciente el 84% de los pacientes con SII relacionaron sus síntomas y la intensidad de los mismos con algún tipo de alimento, especialmente hidratos de carbono o grasas25. De hecho, en sujetos sanos se ha podido establecer una relación entre el aporte de lípidos intraduodenales y un aumento de la sensibilidad intestinal26. Esta misma relación se ha demostrado en pacientes con SII independientemente del subtipo al que pertenezcan27; este mecanismo podría explicar el aumento de los síntomas tras la ingesta de alimentos ricos en grasas.
Aún más, la importancia de la dieta en el SII se constató en una encuesta realizada a más de 1.200 pacientes en la que se comprobó que el 63% estaban interesados en saber qué alimentos debían evitar28. En este sentido, los cambios alimentarios que se han considerado beneficiosos incluyen: comidas pequeñas (69%), evitar alimentos grasos (64%), mayor consumo de fibra (58%), evitar productos lácteos (54%), hidratos de carbono (43%), cafeína (41%), alcohol (27%) y alimentos ricos en proteínas como la carne (21%)28. Sin embargo, aunque algunos pacientes identifican alimentos específicos que desencadenan sus síntomas («alimentos gatillo») hay pocas evidencias científicas de que el SII sea consecuencia de una verdadera intolerancia alimentaria29. En realidad, la respuesta beneficiosa a la exclusión de ciertos alimentos es muy variable (del 15-71%), siendo más frecuente para los lácteos, el trigo y los huevos. Alimentos ricos en salicilatos o aminas también se han considerado problemáticos en pacientes con SII20,21,25,30–34 (fig. 2).
Debido a que la relación causal entre alimentos específicos y síntomas es difícil de probar, muchos pacientes limitan y excluyen alimentos de su dieta de forma indiscriminada, y ello conduce a una dieta inadecuada. Aun así, la desnutrición es poco frecuente en pacientes con SII, aunque en algunas ocasiones las dietas restrictivas y desequilibradas pueden llevar a deficiencias de micronutrientes, e incluso a desnutrición calórico-proteica.
¿La fibra es buena o mala en el síndrome del intestino irritable?La recomendación dietética de realizar una dieta rica en fibra, o añadir suplementos de fibra, en pacientes con SII (especialmente si hay estreñimiento) es más que discutible. Además, no todos los tipos de fibra son iguales ni funcionan del mismo modo en todos los pacientes.
En un metaanálisis publicado por Ford et al.35 se analizaron 5 estudios, con un total de 221 pacientes, llegando a la conclusión de que no existen diferencias en la mejoría sintomática al comparar los que tomaban fibra insoluble frente a los que hacían una dieta baja en fibra o recibían placebo, (RR 1,02; 95% IC, 0,82-1,27). En el análisis de otros 6 estudios, con un total de 321 pacientes, se comparó la toma de fibra soluble (ispaghula/psyllium) contra placebo, comprobándose que la ispaghulla fue más eficaz en la prevención de los síntomas del SII (RR de síntomas persistentes de 0,78; 95% IC, 0,63-0,96), con un NNT para la ispaghulla de 6 pacientes para prevenir un episodio (IC 3-50)35. Sin embargo, otros estudios han evidenciado que el suplemento de fibra sólo mejora el ritmo deposicional en el 10% de los casos mientras que con frecuencia empeoraron síntomas tales como los borborigmos, la distensión y el dolor abdominal36.
Por tanto, puede concluirse que actualmente no hay evidencias científicas claras para la recomendación de aumentar la fibra en pacientes con SII, si bien en caso de adoptarla, es recomendable utilizar las fibras solubles por ser mejor toleradas. Además, para minimizar sus posibles efectos adversos (en especial distensión y dolor abdominal) se aconseja comenzar con dosis bajas y aumentarla progresivamente hasta llegar a cantidades de 20-30g/día20,36–38.
¿La lactosa es perjudicial en los pacientes con síndrome del intestino irritable?En primer lugar es importante destacar la diferencia entre malabsorción e intolerancia a la lactosa. La intolerancia alimentaria es una reacción adversa mediada por factores no inmunológicos. Por su parte, la malabsorción es una alteración de la absorción mucosa de los nutrientes.
En una revisión sistemática publicada en el año 2009 se analizaron los resultados de 7 estudios en los que se había realizado test de hidrógeno espirado con lactosa en pacientes con SII; el resultado fue que más de un tercio tenían malabsorción de lactosa y que la intolerancia a la misma también era más común en los pacientes que en los controles39. No obstante, son muchos los pacientes que asocian síntomas gastrointestinales con la ingestión de productos lácteos en los que no se evidencia malabsorción de lactosa40.
Por otra parte, datos obtenidos de estudios no controlados indican que el 40-85% de los pacientes con SII y malabsorción de lactosa mejoran al restringirla41–43.
¿Es frecuente la malabsorción de fructosa en el síndrome del intestino irritable?La fructosa es un hidrato de carbono que se ingiere en forma de sacarosa (azúcar de mesa) y, tras hidrolizarse en el intestino delgado, se convierte en fructosa y glucosa. Es de uso frecuente como edulcorante artificial. La fructosa se encuentra en multitud de alimentos tales como la miel o las frutas; también es un componente habitual en otros productos como bebidas light, comidas preparadas y algunos fármacos, sobre todo jarabes. Se ha demostrado que en sujetos sanos existe un déficit de absorción de fructosa en un porcentaje no desdeñable (37-90%), junto con la aparición de síntomas abdominales tales como diarrea o dolor abdominal44. Esta malabsorción es dependiente de la dosis y de la concentración, existiendo además una gran variabilidad interpersonal. Hay que destacar que la ingesta de fructosa en forma de sacarosa no se acompaña de malabsorción, y que la adición de glucosa a las soluciones de fructosa facilita su absorción45.
En lo que respecta al SII, los estudios existentes ofrecen conclusiones muy dispares. Si bien unos sugieren que la prevalencia de malabsorción de fructosa en el SII es similar a la de los sujetos sanos otros abogan que existe una relación entre la presencia y evolución de los síntomas gastrointestinales y la existencia de dicha malabsorción46–49.
En un estudio piloto, prospectivo, aleatorizado y controlado, se planteó la hipótesis de que una dieta pobre en hidratos de carbono podría mejorar los síntomas de los pacientes con SII. Se comprobó que 10 de los 13 pacientes con SII que se sometieron a una dieta baja en hidratos de carbono mejoraron a las 4 semanas50. No obstante, hay que tener en cuenta que cuando se realiza durante mucho tiempo una dieta muy escasa en hidratos de carbono y se incrementan los alimentos de origen animal (grasas y proteínas), se elevaba el riesgo de muerte por causas cardiovasculares y aparición de cáncer51.
¿Es frecuente la malabsorción de sorbitol en el síndrome del intestino irritable?El sorbitol es un polialcohol utilizado de forma común como edulcorante artificial en muchos productos «sin azúcar». Se usa como aditivo alimentario y en la preparación de fármacos por sus propiedades estabilizantes, control de la viscosidad y retención de la humedad. La toma continuada de determinados edulcorantes como el sorbitol o el manitol puede desencadenar síntomas gastrointestinales similares a los de la malabsorción de fructosa. Por otra parte, también pueden empeorar los síntomas de los pacientes con SII con predominio de diarrea. El sorbitol interfiere en la absorción de fructosa, de manera que si se ingieren juntos la malabsorción de estos azúcares es mayor que cuando se hace por separado.
Fernández-Bañares et al.52 investigaron pacientes con diarrea crónica acuosa, que cumplían criterios de Roma II para SII en busca de malabsorción de azúcares, malabsorción de ácidos biliares idiopática (MABI) y enteropatía sensible al gluten; en todos los casos se descartó inicialmente el diagnóstico de colitis microscópica y la serología de celiaquía era negativa. Los resultados demostraron la presencia de diarrea secundaria a malabsorción de azúcares (con buena respuesta a la dieta de exclusión) en el 16% de los casos, MABI (con buena respuesta al tratamiento con colestiramina) en el 45%, y enteropatía sensible al gluten - en forma de enteritis linfocítica con estudio genético positivo- (y buena respuesta a la dieta sin gluten) en el 16%. El 20% restante, en los que todas las pruebas fueron normales, se catalogaron de diarrea funcional/SII. No obstante, cabe decir aquí que la diarrea acuosa (con escaso dolor abdominal), no es uno de los síntomas más típicos del SII y que, de hecho, su presencia debe hacer buscar otras posibles causas.
¿Cuál es la importancia de los FODMAP en el síndrome del intestino irritable?Una extensión de la hipótesis de las intolerancias de azúcar/hidratos de carbono en el SII ha llevado a plantear una dieta exenta de oligosacáridos, disacáridos, monosacáridos y polioles fermentables (FODMAP).Los FODMAP representan una familia de hidratos de carbono de cadena corta pobremente absorbibles que sufren una importante fermentación por las bacterias intestinales.
Ong et al.53 han investigado el efecto de este tipo de dieta en la producción de hidrógeno y metano, así como en la inducción de síntomas. Realizaron un estudio aleatorizado y cruzado en 15 voluntarios sanos y 15 pacientes con SII que consumieron una dieta con muchos o pocos FODMAP durante 2 días. La dieta con FODMAP indujo más síntomas en los pacientes; además, las concentraciones de hidrógeno, pero no las de metano, fueron superiores en los sujetos con SII que en los controles. Hay que decir también que la dieta con FODMAP produjo una mayor excreción de hidrógeno en el aliento tanto en los controles como en los pacientes.
A su vez, la comprobación de que en pacientes con SII la mezcla de fructosa y fructano produce más síntomas que la toma aislada de fructosa sugiere que la exclusión de ambos es fundamental en los beneficios obtenidos con las dietas bajas en FODMAP54.
Estos beneficios han quedado bien establecidos por varios estudios aleatorizados que demuestran una importante mejoría de los pacientes con SII cuando realizan una dieta baja en FODMAP, de forma que incluso plantean este tratamiento como una opción terapéutica de primera línea55–57.
En cualquier caso, hay que ser prudentes antes de indicar una dieta sin FODMAP ya que de mantenerse prolongadamente puede conducir a malnutrición por disminución del aporte de proteínas, lípidos y fibra y a déficits de minerales y vitaminas como: sodio, potasio, calcio, fósforo, magnesio, hierro, vitamina A y tiamina58.
¿Qué relación hay entre síndrome del intestino irritable y la enfermedad celiaca?Durante muchos años se ha considerado que el SII y la enfermedad celiaca (EC) eran 2 entidades completamente diferentes: la segunda relacionada con una intolerancia a la ingesta de gluten y la primera sin ninguna relación con este. Sin embargo, durante la última década diversos estudios han comprobado que esta separación no es tan clara59. Puede haber pacientes que habiendo sido diagnosticados de SII en realidad sufren una EC. Aún más, parece existir un grupo de enfermos que sin tener una EC padecen una sensibilidad al gluten con manifestaciones digestivas semejantes al SII.
Por tanto, es necesario establecer qué sujetos se podrán beneficiar de una dieta sin gluten. En aquellos con EC demostrada la dieta es ineludible con el fin de mejorar los síntomas y prevenir complicaciones futuras. En los que tienen síntomas semejantes al SII es imprescindible determinar si esta dieta de exclusión está o no justificada, y si aporta algún beneficio. De hecho, actualmente un considerable número de pacientes con SII siguen una dieta sin gluten, en muchos casos sin que exista un motivo claro ni se hayan realizado los estudios necesarios para tomar esta decisión.
Tanto el SII como la EC son muy frecuentes. La prevalencia de EC en la población general de Europa y EE. UU. es del 0,5-1%60,61. Por otra parte, la prevalencia del SII puede llegar hasta el 5-15%62,63. Por tanto, dado que ambas son frecuentes, sería posible que coincidiesen en un mismo individuo sólo por casualidad. Sin embargo, cada vez son más los estudios que apoyan que la relación entre la EC, la ingesta de gluten y algunos de los síntomas que sugieren un SII son más que un hallazgo estadístico.
El problema estriba en que los síntomas del SII y la EC pueden ser indistinguibles, en especial cuando predominan la diarrea, la hinchazón o el dolor abdominal. En una encuesta realizada a más de 1.000 miembros de la Celiac Disease Foundation se comprobó que los pacientes con EC frecuentemente aquejan síntomas similares a los del SII y que, en muchos casos, este había sido el diagnóstico inicial hasta descubrirse la EC64.
En un metaanálisis publicado en el año 2009, que incluía 4.202 pacientes, la prevalencia de EC en individuos con sospecha de SII fue 4 veces superior a la encontrada en una población control65. Por contra, otros investigadores consideran que la prevalencia de EC no está aumentada en los pacientes con síntomas de SII66. En cualquier caso, y hasta que haya datos más concluyentes, actualmente se aconseja realizar cribado de la EC mediante serología, y en caso positivo, biopsia duodenal, en pacientes con síntomas de SII que no padezcan estreñimiento.
¿Es malo comer gluten si se padece síndrome del intestino irritable?Seguir una dieta sin gluten no es fácil ni barato. Obviamente merece la pena cuando es necesario, pero no debe recomendarse sin haber evaluado a cada paciente de manera individual teniendo en cuenta pros y contras.
En la clínica diaria no es raro encontrar pacientes que refieren que toleran mal el gluten y en los que no se demuestra una EC. De hecho, en un estudio prospectivo de 94 personas adultas que aquejaban síntomas abdominales tras comer cereales se comprobó, tras realizarles un estudio exhaustivo, que el 63% no sufrían EC ni alergia a los cereales; no obstante, mejoraron tras una dieta sin gluten67. Aún más, en un ensayo clínico doble ciego, controlado contra placebo, y cruzado, se ha demostrado la existencia de sensibilidad al trigo en ausencia de EC; se investigaron 920 pacientes con síntomas de SII y se evidenció que un tercio de los sujetos empeoró al ingerir trigo pero no placebo: aumentó el dolor abdominal, la hinchazón y la diarrea68.
A partir de estas observaciones en el año 2012 se reunió un panel de expertos internacionales para establecer una nueva clasificación y nomenclatura de los trastornos digestivos relacionados con el gluten69. Se consideró la existencia de 3 entidades: EC, alergia al trigo y sensibilidad al gluten no-celiaca. La alergia al trigo se define como una reacción inmunológica a las proteínas del trigo mediada por IgE; su estudio debe incluir determinación de IgE específica en suero y/o «prick test». La sensibilidad al gluten no-celiaca es una forma de intolerancia al gluten cuando se han excluido tanto la EC como la alergia al trigo. Quedará aquí por determinar cuál es el papel real de esta sensibilidad al gluten no-celiaca ya que en un reciente estudio realizado en pacientes diagnosticados de esta entidad que además reunían criterios de SII, se comprobó que la administración aleatorizada y ciega de gluten en distintas concentraciones o de placebo no fue identificada por los pacientes, de manera que no eran capaces de distinguir de acuerdo a la sintomatología cuál era la dieta empleada70.
En resumen, hay un considerable número de personas que no cumplen criterios para ser diagnosticados de EC pero que aquejan una mala tolerancia al gluten. De hecho, el número de sujetos que consumen dieta sin gluten es muy superior al de pacientes diagnosticados de EC. Así, en EE. UU. hasta el 15-25% de la población sigue esta dieta71 y en Nueva Zelanda - donde la prevalencia de EC en niños es del 1% - hasta en el 5% se evita el gluten72. Hay que decir que estas cifras parecen exageradas y posiblemente están favorecidas por aquellas industrias especializadas en comidas exentas de gliadina. No hay duda de que este es un nuevo y gran negocio.
¿Qué utilidad tienen las pruebas de «intolerancia alimentaría» en sangre?Con la intención de establecer una relación entre ciertos alimentos y la aparición de síntomas digestivos se han desarrollado pruebas de muchos tipos. Se postula que mediante estos test se puede identificar cuáles son los alimentos causantes de una intolerancia alimentaria para excluirlos de la dieta. Estas pruebas se basan en la hipotética respuesta anómala de las células sanguíneas hacia el alimento en concreto. Su aplicación inicial en pacientes con SII se apoyaba en la presencia de fenómenos microinflamatorios observados en algunos pacientes, así como en los estudios que comprueban una mejoría clínica tras la retirada de ciertos alimentos en la dieta y su agravamiento tras la reintroducción73,74.
De hecho, Zar et al.75 observaron la presencia de autoanticuerpos IgG4 en el 60% de los pacientes con SII, comparado con el 27% de los controles. Otro estudio valoró el efecto de la restricción alimentaria basándose en la presencia en sangre de estos autoanticuerpos IgG para determinados alimentos. Esta dieta se comparaba con otra en la que se eliminaban el mismo número de alimentos negativos para autoanticuerpos IgG en otra rama de pacientes. Los pacientes con IgG positivas que siguieron la dieta de exclusión presentaron una mejoría sintomática solo un 10% superior al otro grupo. Posteriormente, tras la reintroducción de los alimentos, los síntomas empeoraron en el 83% de los pacientes con IgG positivas frente al 31% del grupo de control. Estos hechos, aunque en parte marginales, sugerían un mecanismo de autoinmunidad frente a alimentos específicos en pacientes afectos de SII76. No obstante, estos resultados no han sido comprobados por ningún estudio posterior, no existiendo correlación entre el resultado de la prueba de provocación doble ciego alimento/placebo (estándar de oro) y los niveles de cualquier IgG para alimentos específicos45.
En resumen, el llamado «perfil de intolerancias alimentaria» realizado mediante la determinación de IgG no resulta, a la vista de los resultados, ni útil para el diagnóstico ni económico; además, puede conducir a consejos dietéticos engañosos o incorrectos77. En la actualidad son numerosas las sociedades científicas de alergia e inmunología de todo el mundo, con la Organización Mundial de Alergia a la cabeza, que coinciden en advertir que dichas pruebas son ineficaces, ya que sus resultados no son reproducibles ni se correlacionan con la clínica del paciente78–82.
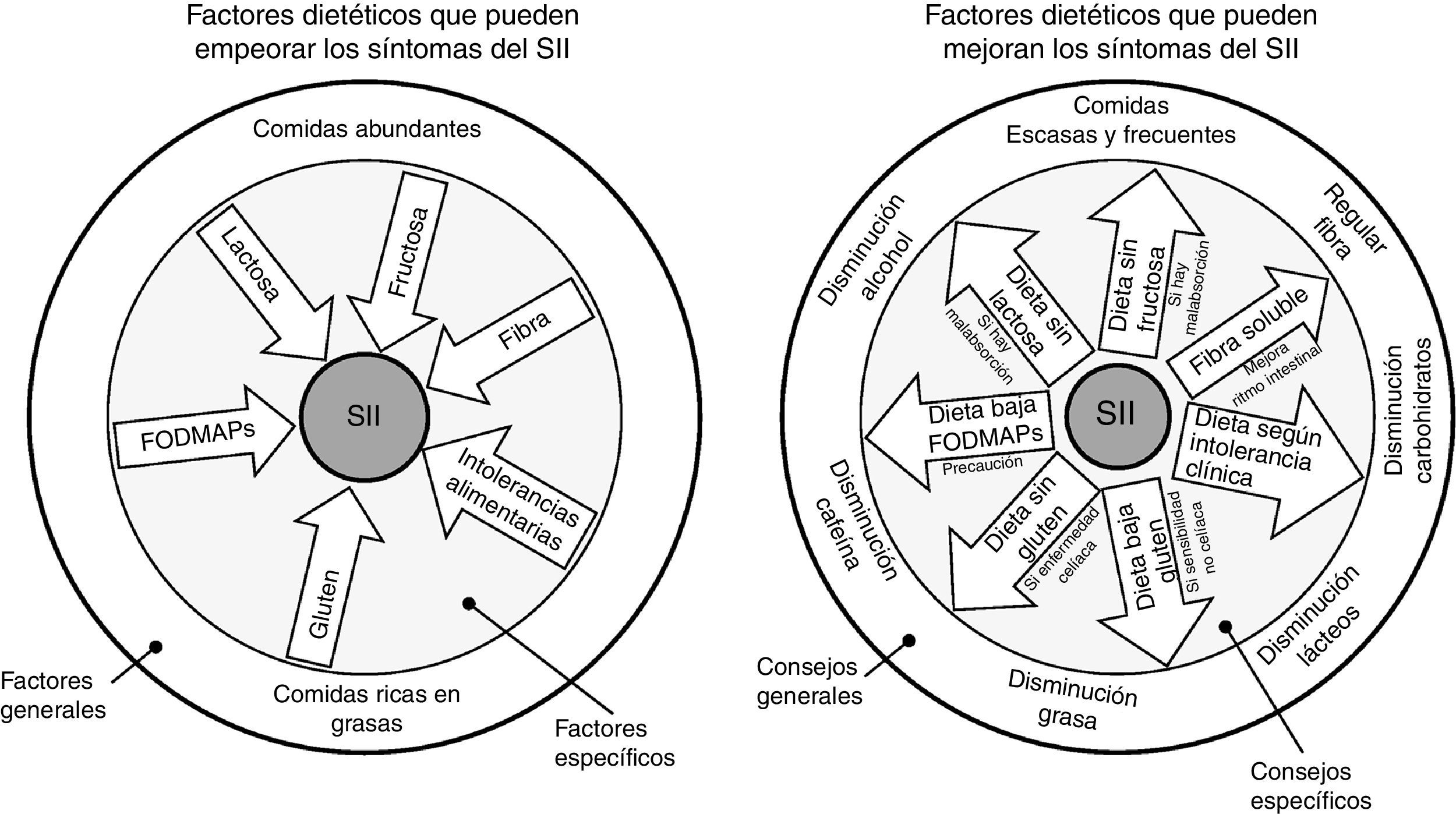
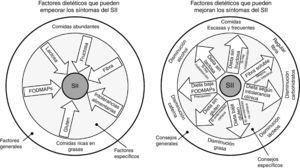
¿Hay una dieta específica para los pacientes con síndrome del intestino irritable?Como ya se ha comentado anteriormente, no existe una dieta específica para pacientes con SII. Lo ideal es mantener una dieta equilibrada y sin muchas restricciones. Se deben evitar dietas exageradas para impedir el déficit de micronutrientes y desnutrición calórico-proteica. Pueden ser beneficios algunos cambios en la dieta y en el estilo de vida, incluyendo realizar comidas frecuentes y pequeñas, y evitar de manera controlada alimentos grasos, productos lácteos, hidratos de carbono, cafeína y alcohol (fig. 3)22.
En el círculo de la izquierda se representa un resumen gráfico de los distintos factores dietéticos que pueden empeorar los síntomas de pacientes con síndrome del intestino irritable (SII), mientras que en el círculo de la derecha se representan las recomendaciones dietéticas que han demostrado mejorar la sintomatología. En la parte externa de los círculos se agrupan factores más generales y los consejos a aplicar. En la parte interna de los círculos se agrupan factores más específicos, así como los consejos a seguir en aquellos pacientes en los que estén indicados.
Si lo que sospechamos es una alergia alimentaria (respuesta inmune anormal o exagerada a un antígeno alimentario) es necesario realizar análisis de sangre específicos y, frecuentemente «prick test». No obstante, como ya se ha mencionado, muchos estudios demuestran que con frecuencia no son verdaderas alergias alimentarias sino intolerancias o aversión a ciertos alimentos. Cuando por la anamnesis se piensa que el paciente padece una malabsorción alimentaria, la prueba más eficaz y sencilla para su diagnóstico es el test del aliento con el hidrato de carbono a estudiar (lactosa, fructosa, sorbitol,…). Si lo que parece existir es una intolerancia alimentaria, no existe ninguna prueba verdaderamente útil para establecer su diagnóstico. Tan solo la dieta de exclusión puede ser de ayuda. No existen datos científicos suficientes que demuestren que los análisis en sangre para IgG sean útiles.
Conflicto de interesesCon el patrocinio de Boehringer Ingelheim.