La infección por el virus de la hepatitis C supone un problema de salud relevante a nivel mundial. Actualmente, el tratamiento estándar en la hepatitis crónica C genotipo 1 consiste en la combinación de interferón pegilado, ribavirina y un inhibidor de proteasa de primera generación: telaprevir o boceprevir. No obstante, a pesar de la mejoría en cuanto a eficacia de esta terapia triple, se ha visto incrementada la complejidad del régimen terapéutico, el coste y el número de efectos adversos (predominantemente hematológicos y cutáneos). Desafortunadamente, las tasas de respuesta virológica son todavía subóptimas en pacientes con cirrosis, y especialmente en aquellos con respuesta nula previa. Además, estudios en la práctica clínica han demostrado que la presencia de fibrosis avanzada supone un alto riesgo de desarrollar efectos adversos graves durante el tratamiento (infección, descompensación e incluso muerte), por lo que resulta esencial seleccionar los pacientes candidatos a recibir triple terapia en función del riesgo de complicaciones y las posibilidades de curación. En este contexto, las combinaciones libres de interferón (y ribavirina) se presentan como tratamientos de primera línea muy seguros y bien tolerados.
En la presente revisión se describe la situación actual del tratamiento de la hepatitis C, así como los últimos resultados de los estudios que combinan diferentes agentes antivirales directos sin interferón. Se espera que estos fármacos estén disponibles en un corto periodo de tiempo, aunque es posible que el coste de estas terapias sea elevado. Por todo ello, es fundamental identificar a aquellos pacientes que se puedan beneficiar en mayor medida de estos tratamientos.
The hepatitis C virus is an important health problem worldwide. Currently, the standard treatment of genotype 1 chronic hepatitis C is the combination of pegylated interferon, ribavirin and a first-generation protease inhibitor: telaprevir or boceprevir. This triple therapy has improved the efficacy of treatment but has also increased regimen complexity, costs, and the number of adverse effects (mainly hematological and cutaneous). Unfortunately, viral response rates are still suboptimal in patients with cirrhosis, particularly those with a prior null response. Moreover, studies carried out in clinical practice have shown that the presence of advanced fibrosis confers a high risk of developing severe adverse effects during treatment (infection, decompensation and even death). It is therefore essential to select candidates for triple therapy according to their risk of complications and possibilities for cure. In this scenario, interferon (and ribavirin)-free combinations are very safe and well tolerated first-line treatments.
This review describes the current treatment of hepatitis C as well as the latest results of studies combining distinct direct antiviral agents without interferon. It is hoped that these drugs will be available shortly, although their cost may be high. Consequently, it is essential to identify those patients who could derive the greatest benefit from these treatments.
La infección crónica por el virus de la hepatitis C (VHC) es la causa principal de disfunción hepática, desarrollo de carcinoma hepatocelular (CHC) y la principal indicación de trasplante hepático (TH) en nuestro medio. Aproximadamente un 3% de la población mundial se encuentra infectada por este virus (170 millones de personas)1. Se han descrito 6 genotipos (g) con diferente distribución geográfica: el g1 es el más frecuente, siendo el subtipo 1b predominante en Europa, y el 1a, en Norteamérica2,3.
Hasta un 75-80% de las personas que entran en contacto con el VHC desarrollarán una infección crónica, y entre un 5-25% evolucionarán a cirrosis en décadas4. La velocidad de la progresión de la fibrosis es variable, pero se ha visto relacionada con algunos factores: el consumo elevado de alcohol, el sexo masculino, la presencia de factores metabólicos como la diabetes y la obesidad, una edad avanzada en el momento de la infección, y la coinfección con otros virus (virus de la hepatitis B, virus de la inmunodeficiencia humana [VIH])5. En este contexto, se espera que el número de pacientes (sin tratamiento) que desarrollará cirrosis en los próximos 20 años aumente considerablemente. Una vez establecida la cirrosis hepática existe un mayor riesgo de carcinoma hepatocelular, con una incidencia anual del 1-5% por año. Tanto la presencia de cirrosis como de CHC suponen una mayor tasa de mortalidad6, por lo que todos los esfuerzos por lograr erradicar la infección están justificados, siendo indispensable realizar una evaluación exhaustiva de los factores virológicos y del huésped para escoger el mejor régimen terapéutico.
Tratamiento antiviralLa erradicación de la infección tiene como objetivo fundamental frenar la progresión de la enfermedad y evitar el desarrollo de complicaciones derivadas de la misma. Varios estudios han demostrado que la respuesta virológica sostenida (RVS: negativización del ARN-VHC al menos 6 meses tras la finalización del tratamiento) se asocia a una disminución de la morbimortalidad de los pacientes con infección crónica por VHC, presentando un mayor impacto en los pacientes con enfermedad hepática avanzada7–9.
La combinación de interferón pegilado alfa 2a o 2b (peg-IFN) con ribavirina (RBV) ha sido, hasta hace poco, el tratamiento antiviral estándar para los pacientes con hepatitis crónica C. No obstante, las tasas de RVS con la combinación de peg-IFN y RBV se sitúan tan solo en torno al ≈50% en pacientes con g1 y ≈80% en pacientes g2/310,11.
En 2011 se aprobaron los primeros agentes antivirales directos (AAD) para el tratamiento de la hepatitis crónica g1: telaprevir (TVR) y boceprevir (BOC). La triple terapia, que combina uno de estos inhibidores de la proteasa (IP) de primera generación con peg-IFN y RBV, se ha convertido en el tratamiento estándar actual de la infección crónica por VHC g1. Con la introducción de estos fármacos se ha incrementado la tasa de RVS en un 30% en los pacientes naive y en un 20-50% en aquellos previamente tratados, siendo los pacientes recaedores los que presentan mayores posibilidades de curación12–15. En este contexto se han podido identificar varios marcadores predictivos positivos de RVS relacionados tanto con el virus como con el huésped: subgenotipo 1b, cinética viral (caída carga viral en fase de lead-in>1 log o la adquisición de respuesta virológica rápida), ausencia de fibrosis avanzada, polimorfismo favorable de IL28, raza asiática o caucásica, y tipo de respuesta previa16.
Los estudios de registro mostraron que además de incrementar la eficacia, la combinación de estos IP suponía un mayor número de efectos adversos, predominantemente hematológicos y cutáneos17. No obstante, estudios en la práctica clínica han demostrado que los efectos adversos derivados de esta terapia pueden suponer, además, un mayor riesgo para aquellos pacientes con hepatopatía avanzada, en los que se ha descrito un incremento del número de infecciones severas (4-6%), descompensaciones clínicas (3-4%), e incluso muerte18. Estos graves efectos adversos no fueron reportados en los estudios de registro, probablemente debido al número relativamente bajo de cirróticos incluidos y a la excelente función hepática de los pacientes con cirrosis, que no presentaban hipertensión portal significativa. Los factores predictivos asociados a una mayor incidencia de efectos adversos graves en pacientes cirróticos bajo triple terapia son la presencia de trombocitopenia<100.000/mm3 e hipoalbuminemia<35g/l. El riesgo de complicaciones es de hasta un 44% en el caso de que estén presentes ambos factores, mientras que desciende hasta un 3,4% en caso de que ambos estén ausentes19. Otros estudios han confirmado estos hallazgos y han determinado que la presencia de un gradiente de presión portal clínicamente significativo (>10mmHg) supone en sí mismo un factor de riesgo para desarrollar complicaciones durante el tratamiento20. Por este motivo, es de vital importancia individualizar en cada caso el riesgo del tratamiento y las posibilidades de curación en función de la presencia o no de factores predictivos positivos de respuesta.
Desde un punto de vista farmacológico la triple terapia implica, además, una posología compleja (6 y 12 comprimidos diarios en caso de TVR y BOC, respectivamente), por lo que es importante reforzar la adherencia durante el tratamiento para evitar el desarrollo de resistencias. Otro problema crucial de la mayoría de los IP es el metabolismo hepático a través del CYP3A4, lo que implica un número no despreciable de interacciones farmacológicas con medicamentos habitualmente pautados en la práctica clínica. Este punto es esencial también en el campo del TH, pues los niveles de los principales fármacos inmunosupresores (tacrolimus y ciclosporina) se ven aumentados en gran medida al inicio del tratamiento con TVR y BOC, lo que supone un alto riesgo de toxicidad farmacológica. En el momento de la suspensión del antiviral puede producirse una caída brusca en los niveles séricos del fármaco inmunosupresor, incrementándose así la posibilidad de desarrollo de rechazo21,22.
Todos estos factores hacen que sea fundamental encontrar otras alternativas terapéuticas en los grupos de mayor riesgo de complicaciones con la triple terapia actual, principalmente los pacientes con cirrosis hepática y los trasplantados hepáticos.
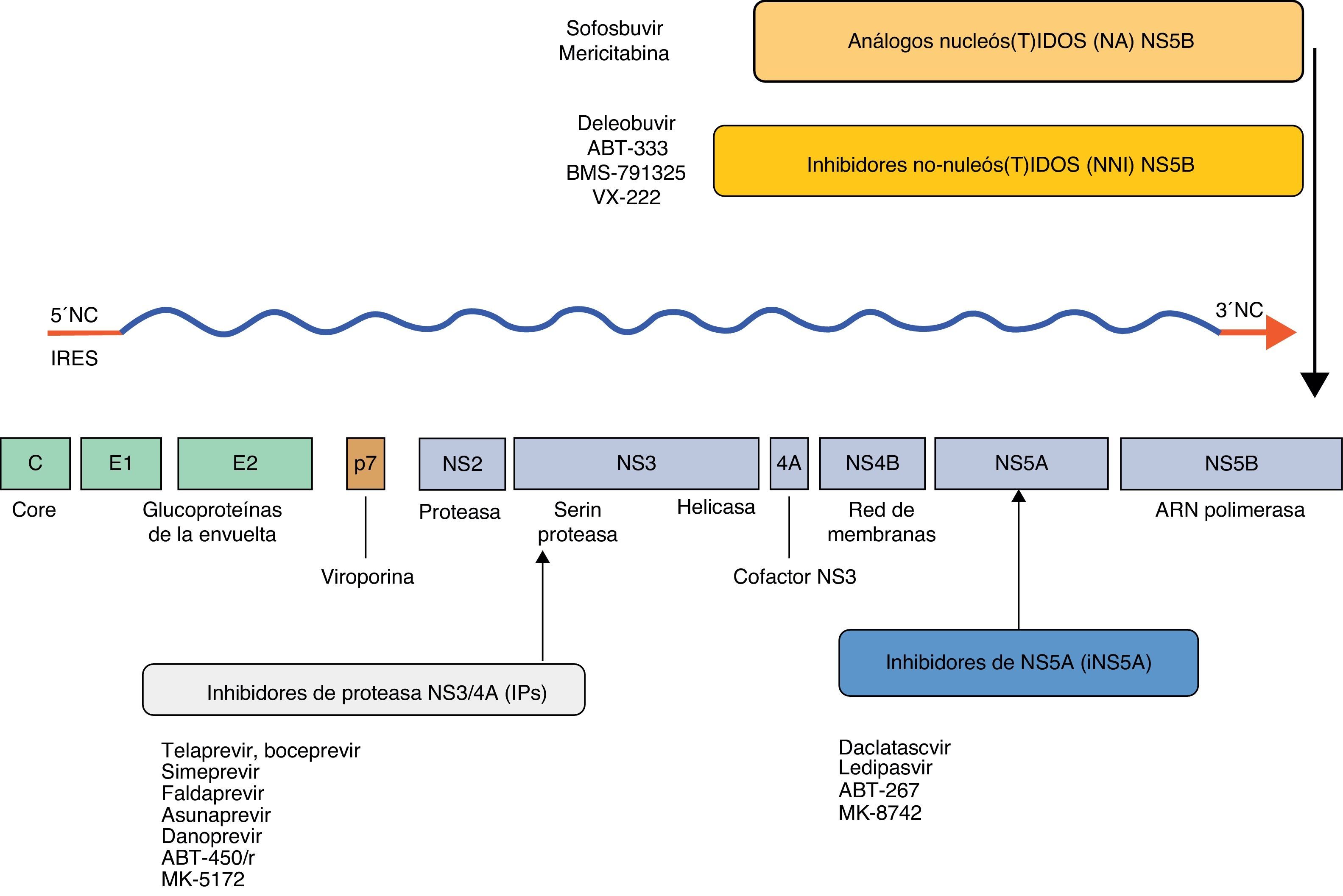
Potenciales dianas terapéuticas en la hepatitis CA raíz del mayor conocimiento del ciclo vital del VHC se han desarrollado nuevos fármacos que bloquean diferentes vías imprescindibles en la replicación y ensamblaje del virus (fig. 1). No obstante, existen algunos factores que deben tenerse en cuenta, pues intervienen en el desarrollo de resistencias durante el tratamiento con los nuevos AAD: la exposición al fármaco in vivo, la barrera genética (número de sustituciones de aminoácidos que precisa el virus para hacerse resistente al fármaco) y la capacidad de replicación de la población mutante23.
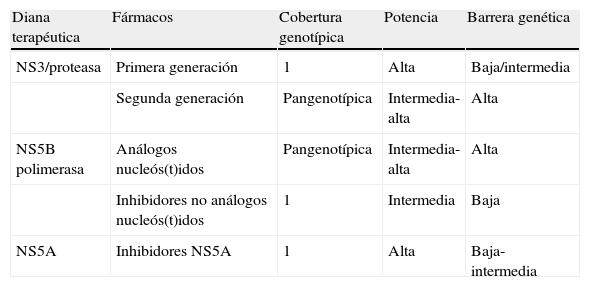
Los principales grupos terapéuticos con sus características propias se definen a continuación y se resumen en la tabla 1.
Diferencias entre los antivirales directos aprobados para el tratamiento de la hepatitis crónica C
| Diana terapéutica | Fármacos | Cobertura genotípica | Potencia | Barrera genética |
| NS3/proteasa | Primera generación | 1 | Alta | Baja/intermedia |
| Segunda generación | Pangenotípica | Intermedia-alta | Alta | |
| NS5B polimerasa | Análogos nucleós(t)idos | Pangenotípica | Intermedia-alta | Alta |
| Inhibidores no análogos nucleós(t)idos | 1 | Intermedia | Baja | |
| NS5A | Inhibidores NS5A | 1 | Alta | Baja-intermedia |
Los AAD mejor estudiados son los que inhiben la enzima NS3/4. Existen 2 tipos bien diferenciados: los derivados lineales del tetrapéptido α-ketoamida (como TVR y BOC) y los inhibidores macrocíclicos. Ambos interaccionan en el dominio catalítico de la proteína, pero mientras los primeros lo hacen de forma reversible, la inhibición covalente del segundo grupo hace que presenten un mejor perfil de resistencias (TVR y BOC se unen de forma covalente, aunque no son macrocíclicos)24. Los IP exhiben una importante actividad antiviral, pero también una baja barrera genética. Además, la mayoría mantienen actividad selectiva contra el g1. Actualmente, se encuentran en fase de desarrollo IP de segunda y tercera generación con mejores perfiles de seguridad y farmacocinético, así como más amplia cobertura genotípica. Entre algunos de los nuevos IP se incluyen: simeprevir (TMC435), faldaprevir (BI-201335), danoprevir (R7227), asunaprevir (BMS-650032), vaniprevir (MK-7009), ABT-450, MK-5172, GS-9256 y GS-9451. Estos IP de segunda y tercera generación son mejor tolerados, con posología sencilla (simeprevir y faldaprevir se administran una vez al día), y algunos ya presentan actividad pangenotípica y alta barrera genética, como el MK-517225.
Inhibidores de polimerasa NS5BExisten 2 clases de inhibidores de polimerasa (IPol), los análogos de nucleós(t)idos (NA) y los inhibidores no-nucleós(t)idos (NNI). Los NA, como la mericitibina (R7128) y el sofosbuvir (GS-7977), imitan el sustrato natural de la polimerasa, por lo que al unirse al lugar catalítico activo de la enzima interrumpen la construcción de la hebra de ARN. Dado que este lugar catalítico es una región muy conservada del genoma del virus, los NA presentan una elevada barrera genética y son activos frente a diferentes genotipos. Cuando los NNI, como deleobuvir (BI-207127), tegobuvir (GS-9256), VX-222, ABT-333 e IDX-375, se unen a la polimerasa, producen un cambio conformacional en su estructura, alterando la actividad enzimática de la misma. Dado que esta unión se produce en un lugar distante del centro enzimático, este grupo farmacológico presenta una potencia y barrera genética bajas y generalmente no son activos frente a varios genotipos26,27. Por este motivo, son fármacos ideales en combinación con otros AAD, pero no como triple terapia.
Inhibidores de NS5ALa proteína viral NS5A es fundamental en el proceso de replicación y de ensamblaje del virus. Los principales inhibidores de NS5A, como daclatasvir (BMS-790052), ledipasvir (GS-5885), ABT-267 y BMS-824393, son fármacos bien tolerados y muy eficaces contra todos los genotipos. Sin embargo, presentan una baja barrera genética, por lo que deben ser administrados en combinación con otros AAD para evitar la aparición de mutantes resistentes28.
Antivirales dirigidos al huéspedLos factores del huésped necesarios para completar la replicación del VHC son también potenciales dianas terapéuticas, que se pueden combinar con otros AAD. Los 2 grupos principales son los inhibidores de la ciclofilina (alisporivir o Debio 025)29 y los antagonistas del miR-122 (miravirsen)30. Alisporivir presenta una alta actividad contra todos los g del VHC, así como una alta barrera genética, siendo muy eficaz en combinación con peg-IFN y RBV31. En las primeras fases del estudio se describieron algunos efectos adversos graves durante su administración, no obstante, en mayo de 2013, y tras revisar nuevos datos preclínicos de seguridad, la FDA autorizó el reinicio del desarrollo de alisporivir.
Numerosas moléculas con capacidad de inhibir el ciclo del VHC se encuentran en fase clínica o preclínica (silibilina, inhibidores de entrada, inhibidores NS4B, etc.). No obstante, dado que estos fármacos se encuentran en fases menos avanzadas de desarrollo será necesario esperar a los resultados de los estudios para definir su papel en las futuras terapias contra la infección crónica por VHC.
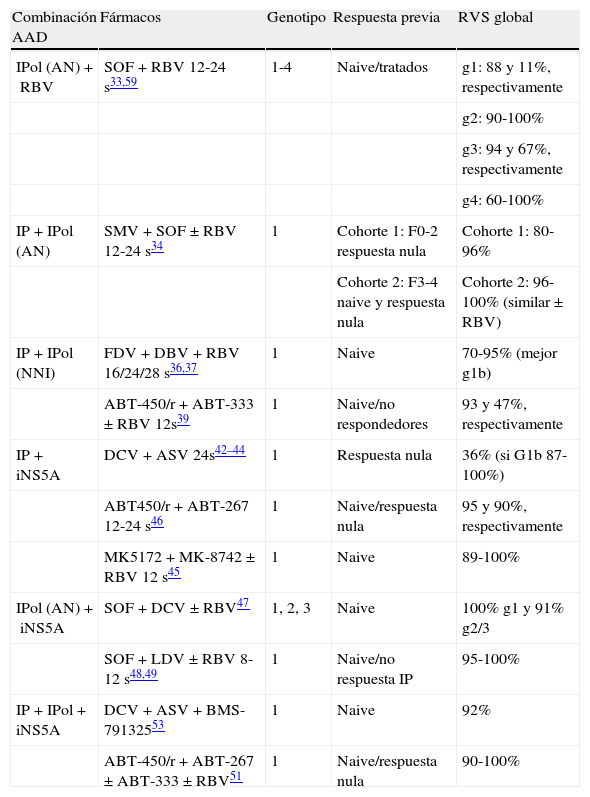
Combinaciones sin interferón (y ribavirina)Como se ha descrito anteriormente, los IPol tipo NA o los antivirales dirigidos a moléculas del huésped presentan una alta barrera genética y pueden ser claves en una combinación de AAD eficaz. En contrapartida, los IP o los inhibidores de NS5A presentan una barrera genética inferior, pero dado que su potencia antiviral es muy alta, son fármacos prometedores cuando se combinan en regímenes orales. A continuación, se describen algunas de las combinaciones terapéuticas libres de interferón y, en algún caso, también de RBV de mayor relevancia en el momento actual. Los principales estudios se encuentran resumidos en la tabla 2.
Principales estudios sin interferón en hepatitis crónica C
| Combinación AAD | Fármacos | Genotipo | Respuesta previa | RVS global |
| IPol (AN)+RBV | SOF+RBV 12-24s33,59 | 1-4 | Naive/tratados | g1: 88 y 11%, respectivamente |
| g2: 90-100% | ||||
| g3: 94 y 67%, respectivamente | ||||
| g4: 60-100% | ||||
| IP+IPol (AN) | SMV+SOF±RBV 12-24s34 | 1 | Cohorte 1: F0-2 respuesta nula | Cohorte 1: 80-96% |
| Cohorte 2: F3-4 naive y respuesta nula | Cohorte 2: 96-100% (similar±RBV) | |||
| IP+IPol (NNI) | FDV+DBV+RBV 16/24/28s36,37 | 1 | Naive | 70-95% (mejor g1b) |
| ABT-450/r+ABT-333±RBV 12s39 | 1 | Naive/no respondedores | 93 y 47%, respectivamente | |
| IP+iNS5A | DCV+ASV 24s42–44 | 1 | Respuesta nula | 36% (si G1b 87-100%) |
| ABT450/r+ABT-267 12-24s46 | 1 | Naive/respuesta nula | 95 y 90%, respectivamente | |
| MK5172+MK-8742±RBV 12s45 | 1 | Naive | 89-100% | |
| IPol (AN)+iNS5A | SOF+DCV±RBV47 | 1, 2, 3 | Naive | 100% g1 y 91% g2/3 |
| SOF+LDV±RBV 8-12s48,49 | 1 | Naive/no respuesta IP | 95-100% | |
| IP+IPol+iNS5A | DCV+ASV+BMS-79132553 | 1 | Naive | 92% |
| ABT-450/r+ABT-267±ABT-333±RBV51 | 1 | Naive/respuesta nula | 90-100% |
AAD: agentes antivirales directos; AN: inhibidor de polimerasa NS5B análogo de nucleós(t)ido; ASV: asunaprevir; DBV: deleobuvir; DCV: daclatasvir; F: grado de fibrosis (METAVIR F0-F4); FDV: faldaprevir; g: genotipo; IP: inhibidor de proteasa; IPol: inhibidor de polimerasa NS5B; LDV: ledipasvir; NNI: inhibidor de polimerasa NS5B no análogo de nucleós(t)ido; iNS5A: inhibidor de NS5A; RBV: ribavirina; RVS: respuesta virológica sostenida; SMV: simeprevir; SOF: sofosbuvir.
Uno de los primeros estudios que exploró la combinación de un IP y de un IPol sin interferón fue el INFORM (mericitabina más danoprevir con o sin RBV durante 12-24 semanas). En pacientes naive, esta combinación logró una tasa de RVS del 26 y 71% en g1b y g1a, respectivamente, siendo claramente inferior en aquellos brazos de tratamiento sin RBV32.
Varios estudios de fase 2 analizaron la eficacia de la combinación de sofosbuvir y RBV. En los estudios QUANTUM y ELECTRON, el 56 y 88%, respectivamente33, de los pacientes g1 que completaron 12 semanas de tratamiento lograron RVS. Este resultado difiere de las excelentes tasas de RVS alcanzadas en otros g (g2-3) en los mismos estudios. Dado que prolongar el tiempo de tratamiento a 24 semanas no incrementó significativamente la tasa de RVS, combinar sofosbuvir con un segundo AAD se ha convertido en la mejor estrategia en g1. Por ejemplo, los recientes resultados del estudio COSMOS, presentados en el reciente congreso de la Asociación Americana para el Estudio del Hígado (AASLD 2013), han demostrado altas tasas de RVS al combinar sofosbuvir y simeprevir (con o sin RBV) durante 12-24 semanas, tanto en pacientes naive (100% RVS) como en respondedores nulos (93-100%). Es de destacar que un 47% de la población del estudio eran pacientes cirróticos, lo que añade una especial relevancia a los resultados obtenidos34.
Combinación de inhibidores de proteasa e inhibidores de polimerasa (no análogos de nucleós[t]sidos)El estudio SOUND-C2 analizó la eficacia de la combinación de faldaprevir y deleobuvir con o sin RBV durante 16-24 semanas en unos 360 pacientes naive. Se observaron tasas de RVS de en torno al 56-68%, y si no se utilizaba la RBV, del 39%35,36. En todos los brazos de tratamiento los pacientes con g1b y/o con IL28B favorable presentaron mayores tasas de RVS. Por este motivo, en el estudio SOUND-C3 en pacientes con g1b o g1a e IL28B favorable, la tasa de RVS alcanzada aumentó hasta un 95% tras 16 semanas de tratamiento con los 3 fármacos37. La combinación de tegobuvir, GS-9252 y RBV mostró tasas de respuesta virológica rápida de un 38%, mientras que en ausencia de RBV descendían a 7%, evidenciando que en esta combinación la RBV también era una pieza fundamental38. Los resultados presentados del estudio COPILOT mostraron que 12 semanas de tratamiento combinado de ABT-450/r con ABT-333 y RBV lograban un 93 y un 47% de RVS en pacientes naive y respondedores nulos, respectivamente39,40. El estudio ZENITH demostró resultados decepcionantes al combinar TVR+VX-222 debido a las altas tasas de breakthrough, mientras que la adición de RBV asociada o no a peg-IFN lograba incrementar las tasas de RVS, superando el 80% tras tan solo 12 semanas de tratamiento cuádruple41.
Estos resultados, sumados a los decepcionantes de sofosbuvir en monoterapia33 indicaban a priori que el uso de RBV podía ser un elemento clave en las nuevas combinaciones de AAD para evitar la aparición de mutantes resistentes. No obstante, estudios posteriores determinaron que esto no siempre era así.
Combinación de inhibidor de proteasa e inhibidor de NS5ALa combinación de asunaprevir y daclatasvir durante 24 semanas en 10 pacientes con respuesta nula previa a peg-IFN y RBV fue la primera que demostró la posibilidad de obtener RVS (36%) en ausencia de interferón y RBV, siendo los pacientes con subtipo 1b los que presentaban mejor respuesta al tratamiento42. Estos resultados se confirmaron con una tasa de RVS del 67-100% en 2 estudios realizados en Japón restringidos a pacientes con g1b43,44. Es importante resaltar que la adición de peg-IFN y RBV lograba incrementar las tasas de RVS hasta el 100% tanto en g1b como en g1a, por lo que en poblaciones difíciles de tratar como esta, el interferón y la RBV siguen teniendo un rol relevante en muchos casos.
En el reciente congreso AASLD 2013 se presentaron los estudios preliminares de la combinación MK-5172+MK-8742±RBV durante 12 semanas en pacientes naive sin fibrosis avanzada (estudio C-WORTHY). Esta combinación resulta muy potente, logrando la negativización de la carga viral tras tan solo 2 semanas de tratamiento en el 91% de los pacientes. Las tasas de RVS fueron del 89-100%, con muy buena tolerancia clínica45. Otra combinación muy prometedora es ABT-450/r+ABT-267 durante 12 semanas (estudio PEARL-I); tanto en pacientes naive como en respondedores nulos a un tratamiento previo logró unas tasas de RVS 4 semanas tras la finalización del tratamiento superiores al 90% en ambos grupos46.
Combinación de inhibidores de polimerasa e inhibidores NS5ALa combinación de sofosbuvir y daclatasvir con o sin RBV durante 24 semanas obtuvo resultados impresionantes, con una alta tasa de RVS (84% en g1 y 100% en g2-3) tanto en pacientes naive como en los previamente tratados no cirróticos. Además, esta combinación resulta eficaz contra todos los g (g1-6), con una tolerancia percibida excelente. La adición de RBV no supuso un incremento en las tasa de respuesta virológica, pero sí una mayor incidencia de anemia en una proporción de pacientes47.
En los estudios ELECTRON48 y LONESTAR49 se evaluó la combinación de sofosbuvir y ledipasvir asociados o no a RBV durante 8-12 semanas. Es especialmente relevante el hecho de que en el estudio LONESTAR, además de incluir pacientes con cirrosis (55%), se incluyeron pacientes no respondedores a triple terapia con los IP TVR y BOC49. A pesar del pequeño tamaño muestral, los resultados fueron excelentes: 100% RVS 12 semanas tras la finalización del tratamiento en ambos estudios (con RBV) y 70 (ELECTRON) y 95% (LONESTAR), respectivamente, en los brazos sin RBV. Actualmente, la combinación de sofosbuvir y ledipasvir se encuentra en estudio en pacientes con cirrosis avanzada (Child B-C) dentro de un ensayo clínico (NCT01938430)50.
Combinación de inhibidores de proteasa, de polimerasa y de NS5AEl estudio QUAD fue el primero en combinar múltiples AAD (GS-5885, GS-9451, tegobuvir y RBV), logrando unas tasas de de RVS del 77 y 89% en g1a y g1b, respectivamente. Posteriormente, el estudio AVIATOR combinó ABT-450/r+ABT-267±ABT-333±RBV durante 12-24 semanas en 247 pacientes naive o con respuesta nula previa, obteniendo tasas de RVS similares en todos los grupos (>90%), independientemente del subgenotipo viral, del grado de fibrosis y de la presencia de RBV51. Actualmente se encuentra en fase de desarrollo el estudio TURQUOISE, diseñado para evaluar la eficacia y seguridad de la combinación de ABT-450/r, ABT-267 y ABT-333 con o sin RBV en pacientes con fibrosis avanzada naive o previamente tratados52. En el último congreso americano (AASLD 2013) también se presentaron los resultados preliminares de la prometedora combinación de asunaprevir, daclatasvir y BMS-791325, que mostró unas tasas de RVS superior al 90%, a pesar de la alta prevalencia de g1a, fibrosis avanzada e IL28B desfavorable53.
Otros genotiposA pesar de que el tratamiento estándar con peg-IFN y RBV logra tasas de en torno al 80% de RVS en g2/3, existe una población no despreciable de pacientes que no han presentado respuesta y en los que la enfermedad continúa progresando. TVR muestra cierta actividad contra el g2, pero sin lograr aumentar la tasa de RVS comparado con el tratamiento estándar54. Ni el TVR ni el BOC presentan actividad contra los g3-6.
Sofosbuvir, un IPol con cobertura pangenotípica (tabla 1), ha sido estudiado en la infección por VHC por diferentes genotipos (tabla 2). En el estudio ELECTRON, la combinación de sofosbuvir y RBV con o sin peg-IFN durante 12 semanas lograba tasas de RVS similares, proporcionando evidencia de que el interferón no es imprescindible en este grupo de pacientes55. Posteriormente, otros estudios (FISSION, FUSION, POSITRON y VALENCE) exploraron la combinación de sofosbuvir y RBV en diferentes escenarios con el objetivo de determinar la duración óptima del tratamiento33,56,57. En estos estudios se pudo observar que pacientes con g3 presentan menores tasas de RVS, especialmente en caso de fibrosis avanzada y respuesta fallida a un tratamiento previo con peg-IFN y RBV. En el estudio VALENCE58, la tasa de RVS en la semana 12 postratamiento con sofosbuvir y RBV durante 24 semanas en pacientes g3 fue del 94 y 92% en pacientes naive (sin y con cirrosis, respectivamente), y del 87 y 60% en pacientes previamente tratados (sin y con cirrosis, respectivamente). Por este motivo, actualmente se recomiendan 24 semanas de tratamiento combinado de sofosbuvir y RBV en g3 naive, mientras que en pacientes previamente tratados, especialmente si presentan fibrosis avanzada, lo ideal es añadir peg-IFN u otro AAD para incrementar la tasa de respuesta. Los excelentes resultados en los estudios previos hacen que en g2 se mantengan 12 semanas de sofosbuvir y RBV, independientemente del grado de fibrosis y del tipo de respuesta previa.
Otra combinación que ha mostrado actividad frente a g2 y 3 es sofosbuvir y daclatasvir47, que ha mostrado tasas de RVS superiores al 95% en pacientes naive con o sin RBV. Ensayos clínicos que estudian otras combinaciones de AAD en g2 y 3 se encuentran actualmente en fase de desarrollo.
En relación con g4, 5 y 6 todavía existe poca información. En el estudio fase 3 que combinaba sofosbuvir, peg-IFN y RBV (NEUTRINO) se incluyeron 35 pacientes con g4-6, lo que suponía tan solo un 11% de la cohorte del estudio. Las tasas de RVS fueron del 96% en g4 y del 100% en los 7 pacientes con g5 y 657. En pacientes con g4, se presentaron los datos de un estudio realizado en Egipto con sofosbuvir y RBV durante 12 o 24 semanas. Se incluyeron 28 pacientes naive y 32 tratados previamente; un 23% presentaban cirrosis. Los datos son preliminares, pero en el brazo de 12 semanas de tratamiento, las tasas de RVS a las 12 semanas de finalización del tratamiento fueron del 79 y 59% en pacientes naive y previamente tratados, respectivamente. En aquellos pacientes que completaron 24 semanas de tratamiento, la tasa de RVS a las 4 semanas fue del 100% en pacientes naive y del 93% en pacientes tratados, independientemente del grado de fibrosis59.
Situaciones especiales en la hepatitis CTrasplante hepáticoEl TH es la situación en la que las terapias libres de interferón supondrán un mayor impacto, dado que tras una reinfección severa por el VHC, y en el contexto de un estado de inmunodepresión, la fibrosis hepática puede avanzar a gran velocidad, ocasionando cirrosis en tan solo 5 años60,61. Además, en este periodo existen varios factores específicos a tener en cuenta en el momento de decidir iniciar un tratamiento antiviral. Muchos pacientes ya presentan un grado de alteración hepática y renal avanzada que puede limitar el uso de algunos fármacos antivirales. Se trata de pacientes polimedicados en la mayoría de los casos, por lo que las interacciones farmacológicas pueden suponer un factor limitante a la hora de elegir un antiviral u otro. Por último, dado que se trata de un contexto de inmunosupresión severa, especialmente en los primeros meses postrasplante, existen pocos datos todavía sobre la posibilidad de selección de mutantes resistentes en caso de no presentar respuesta al tratamiento antiviral. Lo óptimo sería, por tanto, erradicar la infección antes del trasplante para prevenir la infección del injerto.
Pacientes en lista de esperaLos regímenes que contienen interferón están indicados únicamente en aquellos pacientes con cirrosis hepática compensada, generalmente pacientes Child-Pugh A con CHC en lista de espera o con altas probabilidades de curación (IL28CC, recaedores previos), lo que ocurre tan solo en un pequeño número de pacientes incluidos en lista de espera de TH62. Un estudio que combina sofosbuvir con RBV ya ha demostrado que el tratamiento en lista de espera logra prevenir la infección del injerto postrasplante63. Aunque los resultados finales del estudio todavía no están disponibles, los datos preliminares son excelentes. Cuarenta de los 61 pacientes tratados habían sido trasplantados, de los que 37 (92%) presentaban carga viral indetectable en el momento del TH. Al realizar el análisis, 26 pacientes ya habían alcanzado la semana 12 postrasplante y 18 (69%) continuaban con ARN negativo. A pesar de que se trata de una cohorte pequeña, tanto los resultados como la buena tolerancia en estos pacientes difíciles de tratar son alentadores. Es probable que una mayor duración del tratamiento pretrasplante (en ocasiones, difícil de prever) o la adición de un segundo antiviral pudiera haber evitado alguna de las recaídas posteriores.
Reinfección severa del injerto tras el trasplante hepáticoLa presencia de daño histológico (F≥2 en la escala METAVIR), de hipertensión portal (≥6mmHg) o de un valor de elastografía hepática superior a 8,6kPa al año del trasplante permite identificar a aquellos pacientes con mayor riesgo de descompensación hepática y, por tanto, candidatos a recibir tratamiento antiviral para erradicar la infección64,65. El tratamiento estándar con peg-IFN y RBV lograba tan solo tasas de RVS de en torno al 30%66. En cuanto al tratamiento con triple terapia, disponemos de los resultados de varias series diferentes que han evaluado la seguridad y eficacia de esta combinación en unos 300 trasplantados hepáticos67–71. Las tasas de RVS alcanzadas han sido de entre un 48 y 62%. Sin embargo, a pesar del claro incremento en la eficacia, se han descrito un gran número de efectos adversos, que en muchos casos provocaron la discontinuación del tratamiento.
La primera combinación libre de interferón usada en el periodo postrasplante ha sido sofosbuvir y RBV durante 24 semanas. En un ensayo clínico, se incluyeron 40 pacientes durante al menos 6 meses postrasplante, con recurrencia del VHC (cualquier g) y diferentes grados de fibrosis hepática (40% cirróticos). El estudio incluyó tanto pacientes naive como tratados previamente, incluso 9 pacientes tratados con triple terapia. De los 35 pacientes que finalizaron el tratamiento, el 77% continuaban con ARN indetectable 4 semanas después. Desde el punto de vista de la seguridad, el tratamiento fue bien tolerado y sin efectos adversos graves relacionados con la medicación72.
Los datos preliminares del uso de sofosbuvir en el programa compasivo postrasplante se presentaron en el último congreso americano (AASLD 2013)73. Esta cohorte supone un reto clínico, pues se trata de pacientes graves en su mayoría, con hepatitis colestásica o en fase de cirrosis ya descompensada. Aunque todavía no se dispone de datos finales, la mejoría analítica y de la función hepática fue evidente en la mayoría de los pacientes (71%), obteniéndose una tasa de RVS aproximada del 50% en esta población especialmente difícil de tratar. A pesar de que 7 pacientes (16%) murieron debido a la progresión de la enfermedad, ya en fase avanzada al inicio del tratamiento, no hubo efectos adversos severos claramente relacionados con la medicación.
Otros estudios con terapias libres de interferón se encuentran actualmente en desarrollo en pacientes trasplantados, con buenos resultados preliminares74,75.
Coinfección por el virus de la inmunodeficiencia humanaDesde la introducción y amplio uso de tratamientos antirretrovirales en el marco de la infección por el VIH en los países desarrollados, el VHC se ha convertido en una de las principales causas de morbimortalidad en esta población. Las personas coinfectadas presentan una progresión de la fibrosis acelerada y, por tanto, un mayor riesgo de presentar complicaciones derivadas de la cirrosis76. La erradicación del VHC se asocia a una regresión de la fibrosis y una mejor supervivencia también en el marco de la coinfección VHC-VIH77,78. No obstante, la supresión medular producida por el interferón puede verse acentuada en pacientes con VIH, lo que puede dificultar el tratamiento. Por otro lado, las interacciones entre los AAD y los antirretrovirales, sumadas a la complejidad del tratamiento en pacientes que ya reciben otros medicamentos, son los principales retos en esta población.
Datos clínicos ya publicados apoyan el uso de la triple terapia (TVR y BOC) en pacientes coinfectados con recuento de CD4 correcto y en caso de recibir tratamiento con antirretrovirales en los que ya existen datos de seguridad79. Actualmente, existen estudios en fase 3 con otros AAD (simeprevir, daclatasvir, faldaprevir) en combinación con peg-IFN y RBV en pacientes coinfectados, pero no existen datos hasta la fecha de combinaciones libres de interferón en esta población. Un estudio que combina sofosbuvir y RBV en pacientes coinfectados con diferentes genotipos se encuentra actualmente en desarrollo (NCT01783678)80.
ConclusionesLa combinación de peg-IFN, RBV y TVR/BOC se ha convertido en el tratamiento estándar en la infección crónica por VHC g1. No obstante, a pesar de lograr un incremento en las tasas de RVS, también ha supuesto una mayor complejidad del régimen terapéutico y un elevado número de efectos adversos, sobre todo en los pacientes con fibrosis avanzada. Estudios recientes muestran que aquellos pacientes con trombocitopenia (<100.000/mm3) e hipoalbuminemia (<35g/l) o hipertensión portal significativa presentan alto riesgo de desarrollar complicaciones durante el tratamiento. Por este motivo es crucial realizar una cuidadosa selección de los pacientes candidatos a recibir este tratamiento.
Las combinaciones libres de interferón (y RBV) son especialmente esperadas en aquellos pacientes en los que la triple terapia esté contraindicada o suponga un alto riesgo. En base a los resultados de varios estudios de registro presentados en las últimas reuniones científicas, en breve tendremos disponibles los primeros fármacos eficaces en regímenes sin interferón (sofosbuvir, simeprevir, daclatasvir). No obstante, la duración y la dosis óptima todavía están por definir en algunas situaciones, sobre todo en aquellos pacientes más difíciles de tratar, lo que es fundamental para asegurar un alto nivel de eficacia y minimizar la aparición de resistencias. Así pues, a la hora de escoger un tratamiento antiviral deberemos tener en consideración variables como la potencia, la barrera genética, la cobertura genotípica y las interacciones farmacológicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.