La actividad física tiene beneficios conocidos para numerosas enfermedades crónicas, incluyendo las demencias y las enfermedades relacionadas. Sin embargo, la evidencia disponible relacionada a la asociación con el desempeño cognitivo o la tasa de declinación cognitiva o conversión a demencia es contradictoria. El objetivo del presente trabajo fue realizar una revisión sistemática del papel de la actividad física en la prevención del deterioro cognitivo o demencia en adultos mayores.
MétodosSe realizó una búsqueda en las bases de datos Medline, PsycINFO y SciELO desde enero del año 2000 hasta diciembre del 2018. La búsqueda se focalizó en estudios que incluyeran datos de la temática antes planteada en adultos mayores de 50 años o más cognitivamente normales, con deterioro cognitivo leve o demencia.
ResultadosCuarenta artículos cumplieron con los criterios de inclusión. De acuerdo con su análisis, se puede inferir que existe evidencia científica de resultados positivos con respecto a la actividad física en el funcionamiento cognitivo, especialmente en cognición global, memoria, atención y funciones ejecutivas. La mayoría de los estudios incluidos demostraron una mejoría en las medidas cognitivas evaluadas. Sin embargo, se observó una gran heterogeneidad en el diseño de los estudios.
ConclusionesEn general, los hallazgos de nuestra revisión sugieren que el ejercicio físico puede proporcionar una estrategia ampliamente disponible para mejorar el funcionamiento cognitivo, especialmente de las funciones ejecutivas y memoria, y retrasar la aparición de la demencia. La heterogeneidad de los estudios publicados hasta el momento no permite definir una recomendación formal definitiva acerca de cuáles serían las mejores propuestas en la práctica clínica habitual. Sin embargo, un abordaje personalizado para cada paciente, teniendo en cuenta sus antecedentes clínicos y físicos, como así también sus preferencias y posibilidades, conjuntamente a una actividad física regular y sostenida, podría ser una recomendación altamente aceptable hasta contar con nuevas y mejores evidencias.
Physical activity has well-known benefits for several chronic disorders, including dementias and related disorders. However, the available evidence on the prevention of cognitive impairment and/or dementia is contradictory. The aim of this study was to conduct a systematic review of the role of physical activity in the prevention of cognitive impairment and/or dementia in older adults.
MethodsA systematic search was conducted for the Medline, PsycINFO and SciELO databases. The search was focused on older adults over the age of 50, cognitively normal, mild cognitive impairment or dementia.
Results40 articles met our inclusion criteria. There is evidence to suggest that physical activity positively affects cognitive functioning, such as global cognition, memory, attention, executive functions. The majority of the included studies resulted in improvements of the assessed cognitive outcome measures. However, there is heterogeneity in the studies design.
ConclusionsIn general, the findings of our review suggest that physical exercise can provide a widely available strategy to improve cognitive functioning, especially of executive functions and memory, and delay the onset of dementia. The heterogeneity of the studies published so far does not allow us to define a formal recommendation about which would be the best proposals for approach in routine clinical practice.
La Organización Mundial de la Salud (OMS) ha reportado que la inactividad física representa el cuarto factor de riesgo de mortalidad más importante en todo el mundo, siendo responsable del 6% de las muertes a nivel global. La inactividad física aumenta en muchos países y ello influye considerablemente en la prevalencia de enfermedades no transmisibles (ENT) y en la salud general de la población mundial. Con el fin de mejorar las funciones cardiorrespiratorias, musculares y la salud ósea y funcional, reducir el riesgo de ENT, depresión y deterioro cognitivo, la OMS recomienda que los adultos de 65 años en adelante dediquen 150 min semanales a realizar actividades físicas moderadas aeróbicas, o bien algún tipo de actividad física vigorosa aeróbica durante 75 min, o una combinación equivalente de actividades moderadas y vigorosas1. Estas recomendaciones han sido adoptadas en Norteamérica, Europa y Reino Unido2-4. En nuestro país, fueron incorporadas en el año 20135.
Si bien existe una clara evidencia de que la actividad física, si se realiza de forma segura, puede contribuir a un envejecimiento saludable y reducir la morbimortalidad, incluso cuando se realiza a edades avanzadas6,7, el verdadero papel en la prevención en deterioro cognitivo o demencia en el adulto mayor es contradictoria. Resultados de recientes estudios longitudinales y estudios aleatorizados sugieren que el ejercicio físico mejora las funciones cognitivas en adultos mayores6,8-17, mientras que otros estudios no pudieron demostrar dicho beneficio18-21.
El objetivo del presente trabajo fue realizar una revisión sistemática del papel de la actividad física en la prevención del deterioro cognitivo o demencia en adultos mayores.
MétodosCriterios de elegibilidadSe consideraron aquellos estudios que evaluaban el papel de la actividad física en la prevención de deterioro cognitivo o demencia en adultos mayores de 50 o más años según criterios consensuados por el equipo revisor de selección e inclusión. Los criterios de inclusión se encuentran resumidos en la tabla 1.
Lista de criterios de inclusión
| Área | Criterios de Inclusión |
|---|---|
| Población | Adultos mayores de 50 años o más, cognitivamente normales, con deterioro cognitivo leve o demencia |
| Tipo de estudio | Ensayos clínicos aleatorizados, estudios descriptivos longitudinales y estudios descriptivos transversales |
| Intervención | Ejercicio físico o ejercicio físico más rehabilitación cognitiva |
| Resultados | Efecto de la actividad física en función cognitiva en general, dominios cognitivos específicos, funcionalidad, conversión a deterioro cognitivo o demencia |
Se realizó una búsqueda en las bases de datos Medline, PsycINFO y SciELO desde enero del año 2000 hasta diciembre del 2018, utilizando los siguientes términos (tabla 2): («physical exercise») AND («dementia» OR «cognitive impairment» OR «aging») AND («cognition» OR «learning» OR «attention» OR «executive functions») AND («prevention»). La estrategia de búsqueda se llevó a cabo inicialmente en Medline/Premedline y luego se adaptó a los requisitos de formato de búsqueda de las otras bases de datos incluidos en esta revisión. Los resultados de la búsqueda se complementaron con la búsqueda manual de artículos utilizando las listas de referencias de los estudios identificados de los archivos personales de los autores. Se analizaron estudios en inglés o en español únicamente.
Número de artículos encontrados en la búsqueda bibliográfica por palabras clave de las bases de datos
| Palabras clave | Medline | SciELO | PsycINFO |
|---|---|---|---|
| «Physical exercise» | 13.233 | 1.205 | 91 |
| «Physical exercise» AND «aging» | 1.004 | 94 | 46 |
| «Physical exercise» AND «dementia» | 240 | 13 | 25 |
| «Physical exercise» AND «cognitive impairment» | 156 | 1 | 16 |
| «Physical exercise» AND «aging» AND «prevention» | 223 | 10 | 28 |
| «Physical exercise» AND «dementia” AND «prevention» | 83 | 4 | 17 |
| «Physical exercise» AND «cognitive impairment” AND «prevention» | 51 | 0 | 13 |
Se emplearon palabras clave que sobrestimaran la búsqueda por su mayor sensibilidad. Se buscaron en título, resumen y palabras clave durante el mes de enero del 2019. Los resultados se exportaron al gestor bibliográfico Mendeley y se creó una base de datos con los resultados obtenidos.
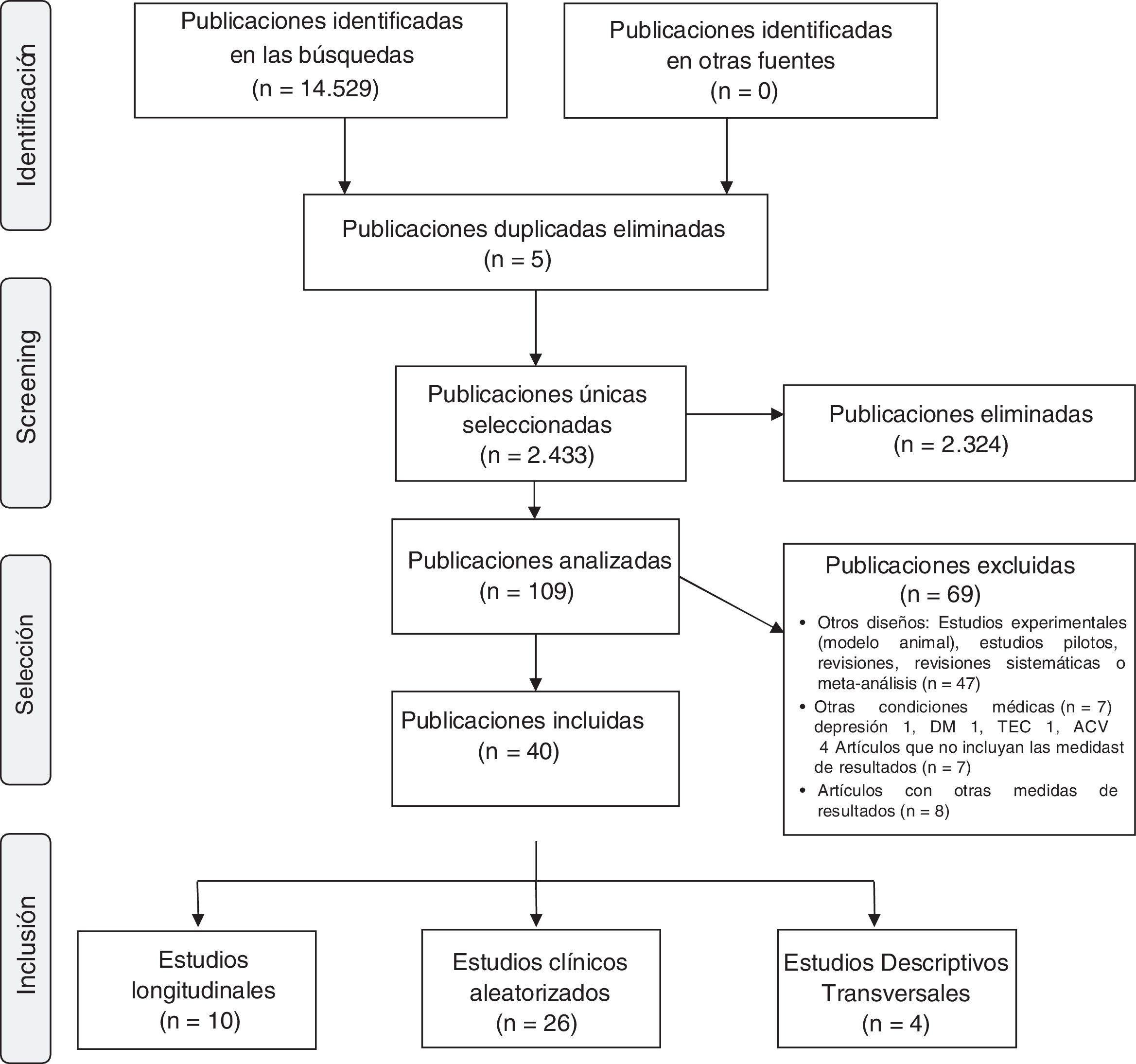
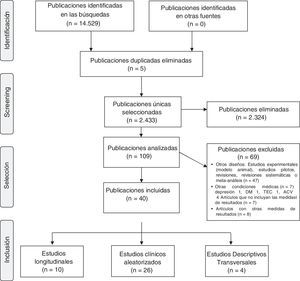
El inicio de la búsqueda dio un total de 14.529 artículos y se realizó una primera selección en la que se eliminaron aquellos artículos que no fueran ensayos clínicos o estudios observacionales, y que no trataran la actividad física. Se obtuvieron así 109 artículos. El segundo análisis se llevó a cabo tras la lectura de los resúmenes y se realizó una selección siguiendo los criterios de exclusión que se muestran en la figura 1. Finalmente, se revisaron a texto completo aquellos artículos que fueron seleccionados o de los que había dudas sobre su inclusión en esta revisión.
Proceso de extracción de datos y síntesis de informaciónLos siguientes datos fueron extraídos de los estudios: 1) características de la población estudiada: número de participantes, enfermedad y la edad; 2) las características de las intervenciones: el diseño, la frecuencia y duración de la intervención, cointervenciones, y la intervención de control, 3) características de las medidas de resultado: medidas de resultado y los resultados.
Debido a que esperábamos que las intervenciones y las medidas de resultado informadas sean variadas y heterogéneas, la síntesis de datos fue un paso crucial en el proceso de revisión. Focalizamos en la descripción de los estudios y sus resultados, y en la síntesis cualitativa de la información en lugar de realizar un metaanálisis. La descripción de los estudios incluidos en la revisión se presenta en función del tipo de estudio: 4 estudios transversales, 10 estudios longitudinales y 26 estudios aleatorizados. Los estudios seleccionados que cumplieron con los criterios de inclusión fueron resumidos con el objetivo de formular los resultados de la revisión sistemática. La síntesis de los datos se logró a través de un sistema de clasificación general en el que los estudios primarios se dividieron en subgrupos que proporcionaron un orden lógico para el análisis. Esta clasificación de subgrupos se basó en los tipos de estudio, objetivo, entorno y características de la muestra. El siguiente paso en el proceso de síntesis de la información fue codificar y extraer los datos en un marco de referencia manejable. La combinación de resultados, como se hace habitualmente en un metaanálisis, no fue apropiada en esta revisión debido a la heterogeneidad de diseño (tipo de actividad, duración y frecuencia de la misma, forma de implementación, consideraciones de la actividad física basal de todos los participantes, actividad física del grupo control, entre otras) y resultados (efectos sobre diferentes variables neuropsicológicas, tasas de conversión a demencia desde la normalidad o el deterioro cognitivo mínimo, incidencias o prevalencias de deterioro cognitivo en las poblaciones, entre otros). En su lugar, identificamos temas para sintetizar hallazgos. Incluimos tablas que resumen la evidencia generada de cada estudio.
Los resultados principales del efecto de la actividad física sobre el rendimiento cognitivo o sobre la tasa de conversión/declinación cognitiva se clasificaron como positivos, negativos o mixtos según un sistema propuesto en otro estudio22. Los resultados positivos se referían a estudios en los que las medidas de resultados mejoraron en su rendimiento cognitivo o mostraron menor tasa de conversión/declinación cognitiva para todos los participantes. Los resultados negativos se refieren a estudios en los que no se observó ningún efecto de la intervención física. Los resultados mixtos se referían a estudios en los que algunos participantes evidenciaron mejoras y otros no.
La etapa final en el análisis de datos fue extraer conclusiones. Finalmente, todos los autores comentaron los principales hallazgos, fortalezas y limitaciones de los estudios incluidos.
ResultadosCaracterísticas de los estudios incluidosFueron incluidos 40 estudios para la presente revisión. Las fechas de publicación estuvieron comprendidas entre el año 2001 y 2018. En los estudios seleccionados los participantes tuvieron 50 años o más de edad. Veintiséis estudios incluyeron a 63.698 voluntarios sanos6,8,10-15,18-20,23-37, 13 estudios incluyeron un total de 2.681 sujetos con diagnóstico clínico de deterioro cognitivo leve6,15,17,21,30,38-45 y 7 estudios incluyeron además 1.030 sujetos con demencia30,43,46-50. Un solo estudio no especificó el estado cognitivo de la muestra51. Según el tipo de estudio, se analizaron 26 estudios clínicos aleatorizados7,8,10-15,17-19,23,34,35,37,38,40,45-50,52,53, 10 estudios longitudinales24,25,28-30,33,36,44,51,54 y 4 estudios descriptivos transversales21,32,39,43.
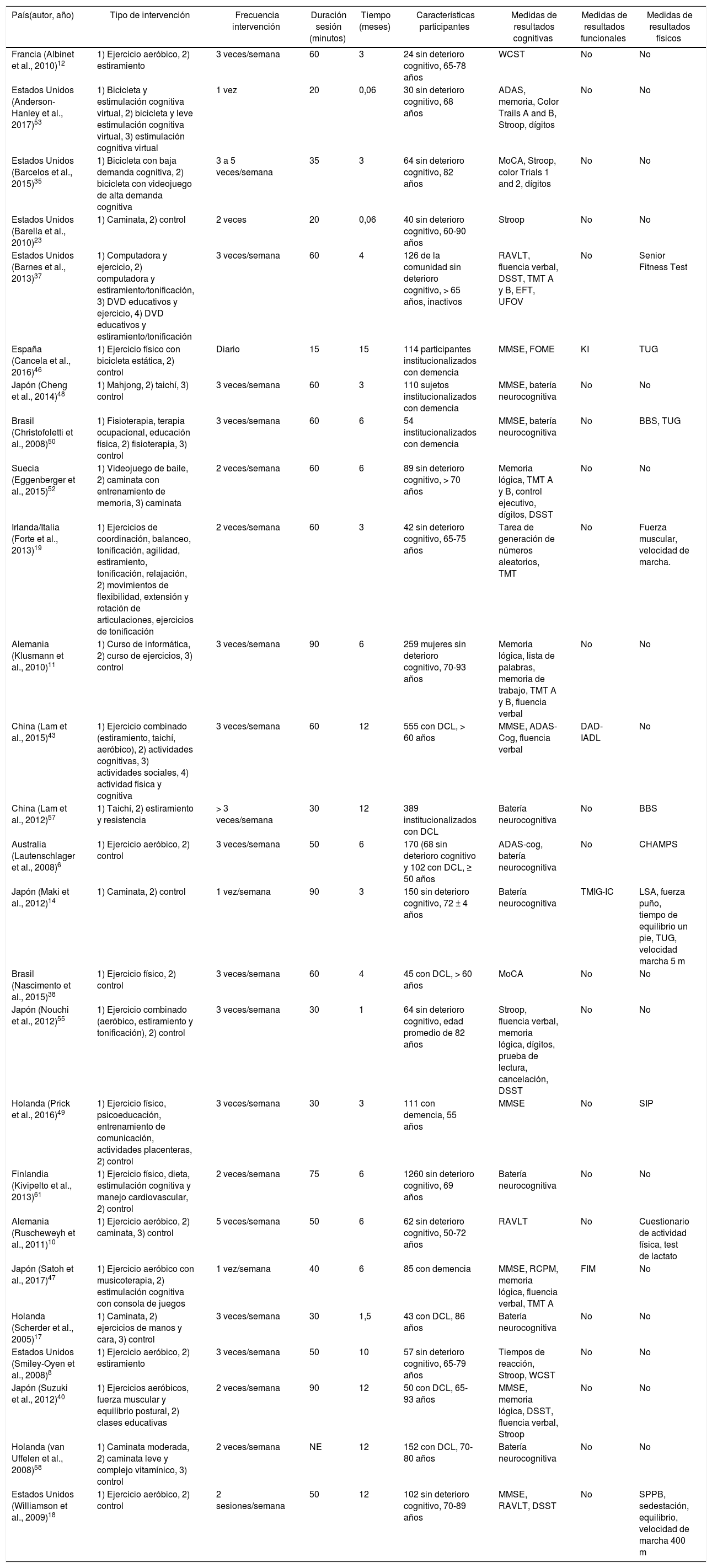
Estudios clínicos aleatorizadosLa tabla 3 presenta los datos recopilados de todos los estudios clínicos aleatorizados analizados. Quince estudios fueron diseñados para una población mayor sana6,8,10-14,18,19,23,34,35,37,52,53, 6 estudios para sujetos con deterioro cognitivo leve6,15,17,38,40,45 y 5 estudios para sujetos con demencia46-50. El tiempo de duración promedio de los estudios fue de 5,86 ± 4,22 meses (rango: 1-15 meses). La duración promedio de la intervención fue de 49,76 ± 20,58 min (rango: 15-90 min). La frecuencia promedio fue de 2,8 ± 0,86 veces por semana (rango: 1-7). Con respecto al grupo control, 16/26 estudios incluyeron un grupo control sin intervención física6,10,11,13,14,17,18,23,34,38,40,46,48-50,53, 4/26 estudios consideraron como grupo control ejercicios de estiramiento y tonificación8,12,15,19 y el resto estimulación cognitiva35,37,45,47,52.
Ensayos clínicos aleatorizados
| País(autor, año) | Tipo de intervención | Frecuencia intervención | Duración sesión (minutos) | Tiempo (meses) | Características participantes | Medidas de resultados cognitivas | Medidas de resultados funcionales | Medidas de resultados físicos |
|---|---|---|---|---|---|---|---|---|
| Francia (Albinet et al., 2010)12 | 1) Ejercicio aeróbico, 2) estiramiento | 3 veces/semana | 60 | 3 | 24 sin deterioro cognitivo, 65-78 años | WCST | No | No |
| Estados Unidos (Anderson-Hanley et al., 2017)53 | 1) Bicicleta y estimulación cognitiva virtual, 2) bicicleta y leve estimulación cognitiva virtual, 3) estimulación cognitiva virtual | 1 vez | 20 | 0,06 | 30 sin deterioro cognitivo, 68 años | ADAS, memoria, Color Trails A and B, Stroop, dígitos | No | No |
| Estados Unidos (Barcelos et al., 2015)35 | 1) Bicicleta con baja demanda cognitiva, 2) bicicleta con videojuego de alta demanda cognitiva | 3 a 5 veces/semana | 35 | 3 | 64 sin deterioro cognitivo, 82 años | MoCA, Stroop, color Trials 1 and 2, dígitos | No | No |
| Estados Unidos (Barella et al., 2010)23 | 1) Caminata, 2) control | 2 veces | 20 | 0,06 | 40 sin deterioro cognitivo, 60-90 años | Stroop | No | No |
| Estados Unidos (Barnes et al., 2013)37 | 1) Computadora y ejercicio, 2) computadora y estiramiento/tonificación, 3) DVD educativos y ejercicio, 4) DVD educativos y estiramiento/tonificación | 3 veces/semana | 60 | 4 | 126 de la comunidad sin deterioro cognitivo, > 65 años, inactivos | RAVLT, fluencia verbal, DSST, TMT A y B, EFT, UFOV | No | Senior Fitness Test |
| España (Cancela et al., 2016)46 | 1) Ejercicio físico con bicicleta estática, 2) control | Diario | 15 | 15 | 114 participantes institucionalizados con demencia | MMSE, FOME | KI | TUG |
| Japón (Cheng et al., 2014)48 | 1) Mahjong, 2) taichí, 3) control | 3 veces/semana | 60 | 3 | 110 sujetos institucionalizados con demencia | MMSE, batería neurocognitiva | No | No |
| Brasil (Christofoletti et al., 2008)50 | 1) Fisioterapia, terapia ocupacional, educación física, 2) fisioterapia, 3) control | 3 veces/semana | 60 | 6 | 54 institucionalizados con demencia | MMSE, batería neurocognitiva | No | BBS, TUG |
| Suecia (Eggenberger et al., 2015)52 | 1) Videojuego de baile, 2) caminata con entrenamiento de memoria, 3) caminata | 2 veces/semana | 60 | 6 | 89 sin deterioro cognitivo, > 70 años | Memoria lógica, TMT A y B, control ejecutivo, dígitos, DSST | No | No |
| Irlanda/Italia (Forte et al., 2013)19 | 1) Ejercicios de coordinación, balanceo, tonificación, agilidad, estiramiento, tonificación, relajación, 2) movimientos de flexibilidad, extensión y rotación de articulaciones, ejercicios de tonificación | 2 veces/semana | 60 | 3 | 42 sin deterioro cognitivo, 65-75 años | Tarea de generación de números aleatorios, TMT | No | Fuerza muscular, velocidad de marcha. |
| Alemania (Klusmann et al., 2010)11 | 1) Curso de informática, 2) curso de ejercicios, 3) control | 3 veces/semana | 90 | 6 | 259 mujeres sin deterioro cognitivo, 70-93 años | Memoria lógica, lista de palabras, memoria de trabajo, TMT A y B, fluencia verbal | No | No |
| China (Lam et al., 2015)43 | 1) Ejercicio combinado (estiramiento, taichí, aeróbico), 2) actividades cognitivas, 3) actividades sociales, 4) actividad física y cognitiva | 3 veces/semana | 60 | 12 | 555 con DCL, > 60 años | MMSE, ADAS-Cog, fluencia verbal | DAD-IADL | No |
| China (Lam et al., 2012)57 | 1) Taichí, 2) estiramiento y resistencia | > 3 veces/semana | 30 | 12 | 389 institucionalizados con DCL | Batería neurocognitiva | No | BBS |
| Australia (Lautenschlager et al., 2008)6 | 1) Ejercicio aeróbico, 2) control | 3 veces/semana | 50 | 6 | 170 (68 sin deterioro cognitivo y 102 con DCL, ≥ 50 años | ADAS-cog, batería neurocognitiva | No | CHAMPS |
| Japón (Maki et al., 2012)14 | 1) Caminata, 2) control | 1 vez/semana | 90 | 3 | 150 sin deterioro cognitivo, 72 ± 4 años | Batería neurocognitiva | TMIG-IC | LSA, fuerza puño, tiempo de equilibrio un pie, TUG, velocidad marcha 5 m |
| Brasil (Nascimento et al., 2015)38 | 1) Ejercicio físico, 2) control | 3 veces/semana | 60 | 4 | 45 con DCL, > 60 años | MoCA | No | No |
| Japón (Nouchi et al., 2012)55 | 1) Ejercicio combinado (aeróbico, estiramiento y tonificación), 2) control | 3 veces/semana | 30 | 1 | 64 sin deterioro cognitivo, edad promedio de 82 años | Stroop, fluencia verbal, memoria lógica, dígitos, prueba de lectura, cancelación, DSST | No | No |
| Holanda (Prick et al., 2016)49 | 1) Ejercicio físico, psicoeducación, entrenamiento de comunicación, actividades placenteras, 2) control | 3 veces/semana | 30 | 3 | 111 con demencia, 55 años | MMSE | No | SIP |
| Finlandia (Kivipelto et al., 2013)61 | 1) Ejercicio físico, dieta, estimulación cognitiva y manejo cardiovascular, 2) control | 2 veces/semana | 75 | 6 | 1260 sin deterioro cognitivo, 69 años | Batería neurocognitiva | No | No |
| Alemania (Ruscheweyh et al., 2011)10 | 1) Ejercicio aeróbico, 2) caminata, 3) control | 5 veces/semana | 50 | 6 | 62 sin deterioro cognitivo, 50-72 años | RAVLT | No | Cuestionario de actividad física, test de lactato |
| Japón (Satoh et al., 2017)47 | 1) Ejercicio aeróbico con musicoterapia, 2) estimulación cognitiva con consola de juegos | 1 vez/semana | 40 | 6 | 85 con demencia | MMSE, RCPM, memoria lógica, fluencia verbal, TMT A | FIM | No |
| Holanda (Scherder et al., 2005)17 | 1) Caminata, 2) ejercicios de manos y cara, 3) control | 3 veces/semana | 30 | 1,5 | 43 con DCL, 86 años | Batería neurocognitiva | No | No |
| Estados Unidos (Smiley-Oyen et al., 2008)8 | 1) Ejercicio aeróbico, 2) estiramiento | 3 veces/semana | 50 | 10 | 57 sin deterioro cognitivo, 65-79 años | Tiempos de reacción, Stroop, WCST | No | No |
| Japón (Suzuki et al., 2012)40 | 1) Ejercicios aeróbicos, fuerza muscular y equilibrio postural, 2) clases educativas | 2 veces/semana | 90 | 12 | 50 con DCL, 65-93 años | MMSE, memoria lógica, DSST, fluencia verbal, Stroop | No | No |
| Holanda (van Uffelen et al., 2008)58 | 1) Caminata moderada, 2) caminata leve y complejo vitamínico, 3) control | 2 veces/semana | NE | 12 | 152 con DCL, 70-80 años | Batería neurocognitiva | No | No |
| Estados Unidos (Williamson et al., 2009)18 | 1) Ejercicio aeróbico, 2) control | 2 sesiones/semana | 50 | 12 | 102 sin deterioro cognitivo, 70-89 años | MMSE, RAVLT, DSST | No | SPPB, sedestación, equilibrio, velocidad de marcha 400 m |
ADAS: Alzheimer's Disease Assessment Scale; BBS: Berg Balance Scale; CHAMPS: Community Healthy Activities Program for Seniors; DAD-IADL: Disability Assessment for Dementia-Instrumental-Activities of Daily Living; DCL: deterioro cognitivo leve; DSST: Digit Symbol Substitution Test; EFT Eriksen Flanker Test; FIM: Functional Independence Measure; FOME: The Fuld Object Memory Evaluation; KI: Katz Index; LSA: Life-Space Assessment; MMSE: Mini Mental Status Examination; MoCA: Montreal Cognitive Assessment; NE: no especificado; RAVLT: Rey Auditory Verbal Learning Test; RCPM: Japanese Raven's Colored Progressive Matrices; SIP: Sickness Impact Profile; SPPB: Short Physical Performance Battery; TMIG-IC: Tokyo Metropolitan Institute of Gerontology Index of Competence; TMT A y B: Trail Making Test parte A y B; TUG: Timed Up and Go test; UFOV: Useful Field of View; WCST: Wisconsin Card Sorting Test.
Con respecto a la intervención física, la mayoría de los estudios incluyeron un programa de actividad física aeróbica6,8,10-12,18,19,34,37,38,40,41,45,47,49,50,55, 2 estudios un programa de taichí15,48, 3 estudios un programa de bicicletas35,46,53 y 4 estudios un programa de caminata14,17,23,52.
La medida de pesquisa de deterioro cognitivo más utilizada fue el Mini Mental State Examination (MMSE)18,40,45-50 y el Montreal Cognitive Assessment9,10. También se utilizaron otras medidas globales, como el Alzheimer's Disease Assessment Scale-Cognitive Subscale (ADAS-cog)11,12, pruebas que midieron funciones específicas, como la atención selectiva, funciones ejecutivas y la memoria de trabajo1,4,6,8,9,12-21 o baterías neurocognitivas completas2,3,11,22-25. Solo 4/26 estudios incluyeron medidas funcionales4,6,7,22 y 8/26 incluyeron medidas de resultados físicos1,2,5,7,11,14,21,22,24,26.
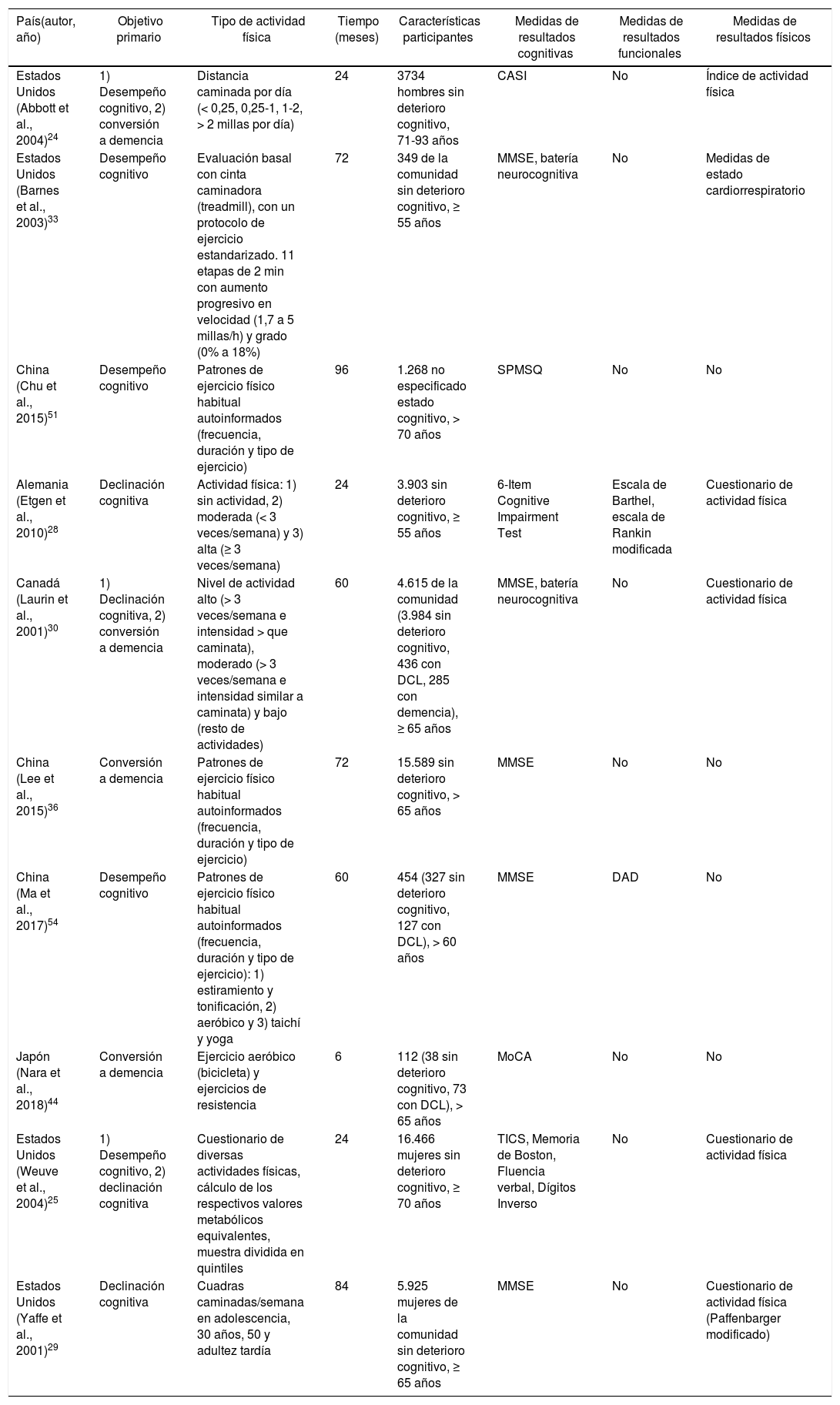
Estudios de cohortes longitudinalesTodos los estudios analizados (tabla 4) incluyeron cohortes grandes de participantes, con un promedio de sujetos incluidos de 5.242 ± 6.027,17 (rango= 112-16.466)1-7. El tiempo de duración promedio de los estudios analizados fue de 52,20 ± 30,47 meses (rango: 6-96 meses). El objetivo primario fue determinar el cambio en el desempeño cognitivo en los test neuropsicológicos utilizados27,28,34-37,56, la tasa de declinación cognitiva28,31-33 o la tasa de conversión a deterioro cognitivo leve o demencia27,33,38,39 en el periodo de seguimiento de dichas cohortes de participantes.
Estudios longitudinales
| País(autor, año) | Objetivo primario | Tipo de actividad física | Tiempo (meses) | Características participantes | Medidas de resultados cognitivas | Medidas de resultados funcionales | Medidas de resultados físicos |
|---|---|---|---|---|---|---|---|
| Estados Unidos (Abbott et al., 2004)24 | 1) Desempeño cognitivo, 2) conversión a demencia | Distancia caminada por día (< 0,25, 0,25-1, 1-2, > 2 millas por día) | 24 | 3734 hombres sin deterioro cognitivo, 71-93 años | CASI | No | Índice de actividad física |
| Estados Unidos (Barnes et al., 2003)33 | Desempeño cognitivo | Evaluación basal con cinta caminadora (treadmill), con un protocolo de ejercicio estandarizado. 11 etapas de 2 min con aumento progresivo en velocidad (1,7 a 5 millas/h) y grado (0% a 18%) | 72 | 349 de la comunidad sin deterioro cognitivo, ≥ 55 años | MMSE, batería neurocognitiva | No | Medidas de estado cardiorrespiratorio |
| China (Chu et al., 2015)51 | Desempeño cognitivo | Patrones de ejercicio físico habitual autoinformados (frecuencia, duración y tipo de ejercicio) | 96 | 1.268 no especificado estado cognitivo, > 70 años | SPMSQ | No | No |
| Alemania (Etgen et al., 2010)28 | Declinación cognitiva | Actividad física: 1) sin actividad, 2) moderada (< 3 veces/semana) y 3) alta (≥ 3 veces/semana) | 24 | 3.903 sin deterioro cognitivo, ≥ 55 años | 6-Item Cognitive Impairment Test | Escala de Barthel, escala de Rankin modificada | Cuestionario de actividad física |
| Canadá (Laurin et al., 2001)30 | 1) Declinación cognitiva, 2) conversión a demencia | Nivel de actividad alto (> 3 veces/semana e intensidad > que caminata), moderado (> 3 veces/semana e intensidad similar a caminata) y bajo (resto de actividades) | 60 | 4.615 de la comunidad (3.984 sin deterioro cognitivo, 436 con DCL, 285 con demencia), ≥ 65 años | MMSE, batería neurocognitiva | No | Cuestionario de actividad física |
| China (Lee et al., 2015)36 | Conversión a demencia | Patrones de ejercicio físico habitual autoinformados (frecuencia, duración y tipo de ejercicio) | 72 | 15.589 sin deterioro cognitivo, > 65 años | MMSE | No | No |
| China (Ma et al., 2017)54 | Desempeño cognitivo | Patrones de ejercicio físico habitual autoinformados (frecuencia, duración y tipo de ejercicio): 1) estiramiento y tonificación, 2) aeróbico y 3) taichí y yoga | 60 | 454 (327 sin deterioro cognitivo, 127 con DCL), > 60 años | MMSE | DAD | No |
| Japón (Nara et al., 2018)44 | Conversión a demencia | Ejercicio aeróbico (bicicleta) y ejercicios de resistencia | 6 | 112 (38 sin deterioro cognitivo, 73 con DCL), > 65 años | MoCA | No | No |
| Estados Unidos (Weuve et al., 2004)25 | 1) Desempeño cognitivo, 2) declinación cognitiva | Cuestionario de diversas actividades físicas, cálculo de los respectivos valores metabólicos equivalentes, muestra dividida en quintiles | 24 | 16.466 mujeres sin deterioro cognitivo, ≥ 70 años | TICS, Memoria de Boston, Fluencia verbal, Dígitos Inverso | No | Cuestionario de actividad física |
| Estados Unidos (Yaffe et al., 2001)29 | Declinación cognitiva | Cuadras caminadas/semana en adolescencia, 30 años, 50 y adultez tardía | 84 | 5.925 mujeres de la comunidad sin deterioro cognitivo, ≥ 65 años | MMSE | No | Cuestionario de actividad física (Paffenbarger modificado) |
CASI: Cognitive Ability Screening Instrument; DAD: Disability Assessment in Dementia; DCL: deterioro cognitivo leve; MMSE: Mini Mental State Examination; MoCA, Montreal Cognitive Assessment; SPMSQ: Short Portable Mental Status Questionnaire; TICS: Telephone Interview for Cognitive Status.
La medida más utilizada para evaluar la función cognitiva fue el MMSE4,6-8,10,11. También se utilizaron cuestionarios específicos para determinar el estado cognitivo de los participantes1,2,5,12. Un estudio valoró la funcionalidad de los participantes mediante las escalas de Barthel y de Rankin modificada5, y otro estudio utilizó el cuestionario de Evaluación de discapacidad en demencias11.
La valoración del ejercicio físico de los participantes se llevó a cabo mediante un cuestionario autoaplicado, en el que informaron de la cantidad de ejercicio que realizaron en su vida diaria1,2,5-7 y medidas de estado cardiorrespiratorio10. No se midieron los resultados físicos en 4 de 10 estudios longitudinales8,9,11,12.
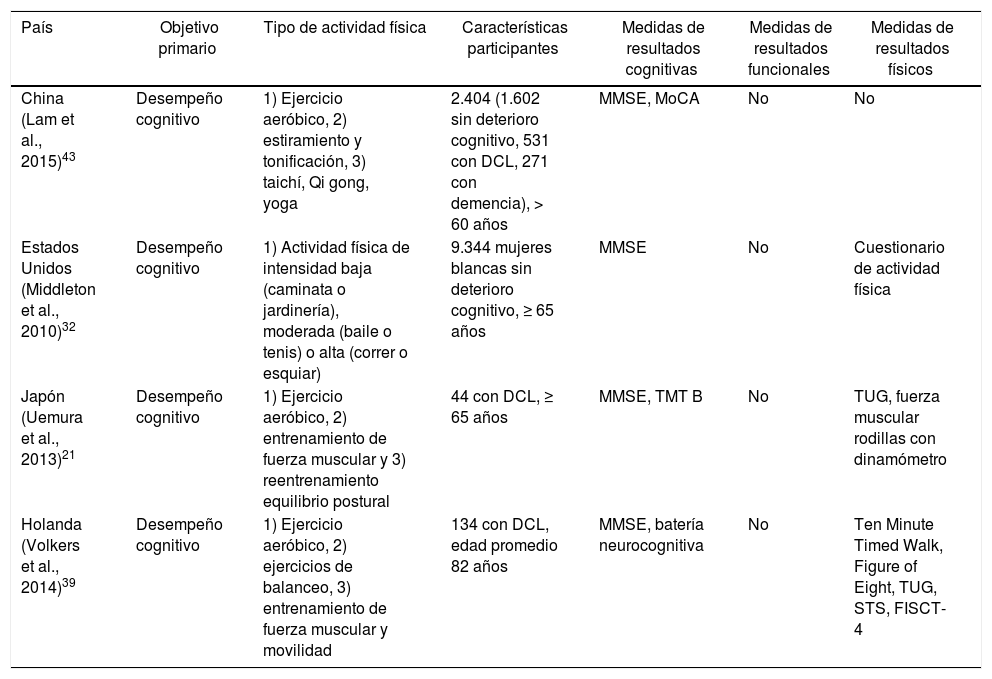
Estudios descriptivos transversalesSe incluyeron en el análisis 4estudios descriptivos de corte transversal (tabla 5). Fueron incluidos un total de 11.926 sujetos13-16, de los cuales 10.946 eran cognitivamente normales, 709 cumplían criterios de deterioro cognitivo leve y el resto criterios de demencia. El objetivo primario en todos los estudios fue determinar la correlación del desempeño cognitivo en los test neuropsicológicos utilizados con los indicadores de actividad física13-16.
Estudios transversales
| País | Objetivo primario | Tipo de actividad física | Características participantes | Medidas de resultados cognitivas | Medidas de resultados funcionales | Medidas de resultados físicos |
|---|---|---|---|---|---|---|
| China (Lam et al., 2015)43 | Desempeño cognitivo | 1) Ejercicio aeróbico, 2) estiramiento y tonificación, 3) taichí, Qi gong, yoga | 2.404 (1.602 sin deterioro cognitivo, 531 con DCL, 271 con demencia), > 60 años | MMSE, MoCA | No | No |
| Estados Unidos (Middleton et al., 2010)32 | Desempeño cognitivo | 1) Actividad física de intensidad baja (caminata o jardinería), moderada (baile o tenis) o alta (correr o esquiar) | 9.344 mujeres blancas sin deterioro cognitivo, ≥ 65 años | MMSE | No | Cuestionario de actividad física |
| Japón (Uemura et al., 2013)21 | Desempeño cognitivo | 1) Ejercicio aeróbico, 2) entrenamiento de fuerza muscular y 3) reentrenamiento equilibrio postural | 44 con DCL, ≥ 65 años | MMSE, TMT B | No | TUG, fuerza muscular rodillas con dinamómetro |
| Holanda (Volkers et al., 2014)39 | Desempeño cognitivo | 1) Ejercicio aeróbico, 2) ejercicios de balanceo, 3) entrenamiento de fuerza muscular y movilidad | 134 con DCL, edad promedio 82 años | MMSE, batería neurocognitiva | No | Ten Minute Timed Walk, Figure of Eight, TUG, STS, FISCT-4 |
DCL: deterioro cognitivo leve; FISCT-4: Cooperative Studies of Intervention Techniques; MMSE: Mini Mental State Examination; MoCA: Montreal Cognitive Assessment; TMT: Trail Making Test; TUG: Timed Up and Go test; STS: Sit To Stand.
La medida más utilizada para evaluar la función cognitiva fue el MMSE13-16 y un solo estudio incluyó una batería neurocognitiva completa16. Ningún estudio utilizó medidas de resultados funcionales.
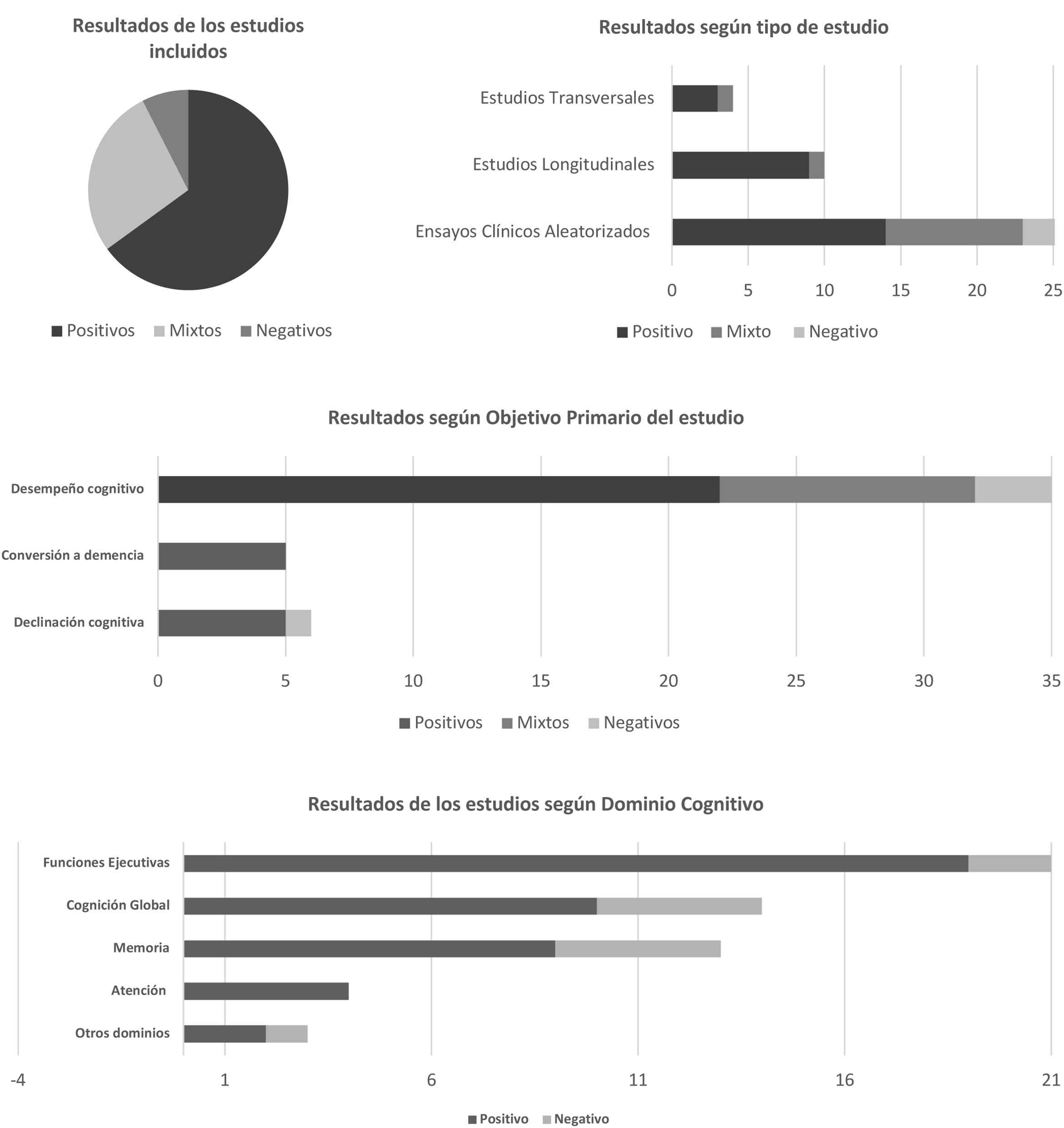
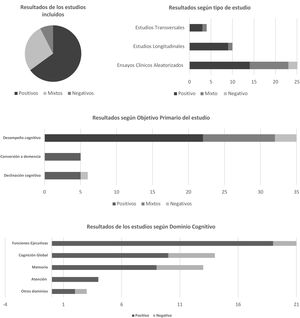
Análisis de los resultadosLos resultados principales del efecto de la actividad física sobre el desempeño cognitivo o sobre la tasa de conversión/declinación cognitiva (fig. 2) se clasificaron como positivos, negativos o mixtos, según un sistema propuesto en otro estudio17. Si bien se observó una gran heterogeneidad en el diseño de los estudios analizados, el 65% (26/40) de los resultados obtenidos fueron positivos, mientras que el 27% (11/40) fueron mixtos y el 8% (3/40) negativos. Por lo tanto, la mayoría de los estudios mostraron que la actividad física favorece un mejor rendimiento cognitivo o disminuye la tasa de conversión/declinación cognitiva en el tiempo en todos los participantes evaluados.
Resultados de los estudios analizados según sistema propuesto por Rispoli et al.22.
Teniendo en cuenta el tipo de estudio, los ensayos clínicos aleatorizados presentaron 14 resultados positivos18-31, 9 mixtos32-40 y 3 negativos41-43. En los estudios longitudinales se observaron 9 resultados positivos1,2,5-8,10-12 y uno mixto9, sin resultados negativos. Y con respecto a los estudios transversales, 3 resultados fueron positivos13-15 y uno fue mixto16.
Al constatar los resultados según los objetivos primarios de los estudios, es decir, la valoración del efecto o la relación de la actividad física sobre el desempeño cognitivo o la tasa de conversión a demencia o declinación cognitiva, se observaron que los mismos fueron favorables. Existe evidencia científica de resultados positivos de la relación entre el grado de actividad física y el funcionamiento cognitivo, especialmente en las funciones ejecutivas, las cuales mostraron mejorías significativas con respecto a otros dominios en 19 estudios2,10,12,16,18,20,24-32,34,37-39. No obstante, tanto la cognición global1,2,11,13-15,18,19,33,34 como la memoria2,18,19,22,23,27,28,33,35 y la atención10,29,36,40 han mostrado también resultados beneficiosos relacionados a la actividad física; sin embargo, fueron dominios cognitivos evaluados en menor proporción en los estudios considerados.
Los resultados negativos se refieren a estudios en los que no se observó ningún efecto de la intervención física. Los resultados mixtos se referían a estudios en los que algunos participantes evidenciaron mejoras y otros no.
DiscusiónExiste evidencia científica de que la actividad física es beneficiosa para la función cognitiva en las personas mayores sanas sin deterioro cognitivo y en personas con deterioro cognitivo leve o demencia, con efectos estadísticamente significativos en el desempeño en pruebas que miden funciones ejecutivas2,10,12,16,18,20,24-32,34,37-39, funcionamiento cognitivo global1,2,11,13-15,18,19,33,34, memoria2,18,19,22,23,27,28,33,35 y atención10,29,36,40.
Un dato interesante a analizar es el hecho de que los estudios longitudinales con cohortes grandes de participantes y de mayor duración muestran que la actividad física podría reducir la tasa de declinación cognitiva o de conversión a demencia en el tiempo, indicando que las intervenciones de ejercicio físico deben ser exploradas como una estrategia potencial para retrasar o prevenir el inicio de la enfermedad1,2,5-7. Incluso un estudio transversal44 demostró que los sujetos sanos sedentarios tienen mayor depósito amiloide a nivel cerebral que aquellos sujetos activos físicamente.
Si bien los datos son insuficientes para indicar el mecanismo fisiopatológico y neurobiológico por el cual la actividad física tiene un efecto beneficioso en la esfera cognitiva en adultos mayores, la evidencia analizada en la presente revisión sugiere la necesidad de estudios más amplios y homogéneos desde el punto de vista metodológico para confirmar el verdadero papel de la actividad física en la prevención de las enfermedades cognitivas.
Las principales diferencias entre el diseño y los parámetros de los estudios halladas en el análisis fueron: 1) inclusión de poblaciones restringidas por sexo (hombres1 o mujeres2,4,15,28) o por diferentes rangos de edad37,41; 2) inclusión de poblaciones con pocos participantes36,41; 3) intervalos cortos de seguimiento13,20,22,30,37,41,45,46; 4) evaluación del estado cognitivo por teléfono2 o con test de cribado únicamente4-6,15,47,59, y 5) evaluación de la actividad física mediante escalas autoadministradas1,2,5-7,15,35,44,46 o mediante métodos cuantificables y objetivables13,22,31,39,41.
El análisis cualitativo de todos los trabajos, incluidos en esta revisión, nos permiten concluir que no hay un consenso definido a la hora de determinar el tipo de actividad física, la duración ni el tiempo que debe ser implementada la misma para obtener beneficios en el área cognitiva. Sin embargo, cabe destacar una revisión sistemática de Gomes-Osman et al.60, recientemente publicada, en la cual los investigadores concluyen que entre los adultos mayores con y sin deterioro cognitivo, al menos 52h totales de ejercicio, en sesiones que duraban aproximadamente 1 h, se asoció con un mejor rendimiento cognitivo. Ellos mencionan además que este es el tiempo total mínimo como para observar beneficios pero creen que adicionar actividad física a largo plazo seguramente puede seguir ampliando la generación de efectos beneficiosos. En cuanto al tipo de ejercicio, el mismo artículo refiere que los modos de ejercicio apoyados por la evidencia son: los aeróbicos, entrenamiento de resistencia muscular, ejercicios de mente y cuerpo (mind-body, en inglés) o las combinaciones de estas intervenciones.
Nuestra revisión proporciona información importante con el fin de fomentar el desarrollo de nuevos estudios, de preferencia con un diseño de control aleatorizado. En este sentido, merece mencionarse un estudio escandinavo, el cual ha proporcionado evidencia interesante de que los cambios en el estilo de vida pueden retrasar el deterioro cognitivo en personas mayores con riesgo de enfermedad de Alzheimer. El estudio Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER, de sus siglas en inglés)49 mostró que las personas con riesgo de desarrollar deterioro cognitivo y demencia mostraron mejoras en la memoria y otras habilidades de pensamiento después de solo 2años de un cambio en que incluía una dieta más saludable, mayor ejercicio, aumento de la estimulación intelectual y social, y mejor manejo de la salud cardíaca y vascular. Los hallazgos brindan la indicación más convincente hasta la fecha de que podemos prevenir el Alzheimer y otras demencias al adoptar hábitos de vida más saludables. Un estudio en curso denominado U.S. Study to Protect Brain Health through Lifestyle Intervention to Reduce Risk (U.S. POINTER, de sus siglas en inglés), financiado por la Asociación Americana de Alzheimer en colaboración con un panel internacional de investigadores, incluida Miia Kivipelto, MD, Ph.D., investigadora principal de FINGER, probará las mismas intervenciones no farmacológicas en una población más grande y más diversa de Estados Unidos. Se espera que los resultados de este proyecto de investigación amplíen las lecciones aprendidas en Finlandia. Los investigadores planean evaluar si el ejercicio físico, el asesoramiento nutricional, una mejor autogestión de la salud y otros factores pueden beneficiar la cognición entre 2.500 voluntarios estadounidenses de una amplia gama de antecedentes raciales, étnicos, socioeconómicos y geográficos en un ensayo clínico de 2 años de duración para probar la efectividad de las intervenciones de estilo de vida en 2.50062.
Para finalizar debemos enfatizar que los hallazgos de nuestra revisión, en consonancia de múltiples otros restudios, sugieren que el ejercicio físico puede proporcionar una estrategia ampliamente disponible para mejorar el funcionamiento cognitivo, especialmente de las funciones ejecutivas y memoria, y retrasar la aparición de la demencia.
La heterogeneidad de los estudios publicados hasta el momento no permite definir una recomendación formal y definitiva acerca de cuáles serían las mejores propuestas de abordaje en la práctica clínica habitual. Al respecto creemos que una prescripción de actividad física personalizada a cada paciente, teniendo en cuenta sus antecedentes clínicos y físicos como así también sus preferencias y posibilidades conjuntamente con los datos previamente aportados (actividad física variable, regular y sostenida) podría ser una recomendación altamente aceptable hasta contar con nuevas y mejores evidencias.
Conflicto de interesesTodos los miembros involucrados en la adaptación de este protocolo han llenado el formulario de conflictos de interés relacionados con los contenidos de la misma.