La yuca, cassava o mandioca (Manihot esculenta Crantz) constituye uno de los alimentos básicos en regiones tropicales y subtropicales, por ser fuente importante de hidratos de carbono. No obstante, contiene compuestos cianogénicos, como linamarina y lotaustralina, que a nivel experimental se ha encontrado que afectan a estructuras cerebrales como el tálamo, la corteza piriforme y el hipocampo, entre otras, lo cual podría explicar algunas enfermedades neurológicas, como el konzo y la neuropatía atáxica tropical. Sin embargo, la participación del hipocampo en las alteraciones neurológicas asociadas a los componentes químicos de la yuca aún no ha sido identificada.
MétodoSe incluyeron ratas macho de 3 meses de edad (cepa Wistar), distribuidas en 4 grupos (n=8 cada grupo): un grupo vehículo (1μl de solución inyectable) y 3 grupos con linamarina (10, 15 y 20mM). Las sustancias fueron microinyectadas intrahipocampalmente (CA1) durante siete días consecutivos (cada 24h) y los efectos fueron evaluados diariamente en las pruebas de actividad locomotora, rota-rod y nado.
ResultadosLa microinyección de linamarina en el hipocampo dorsal produjo hiperactividad e incoordinación motora que fue acentuándose con los días de tratamiento. En la prueba de nado desplegaron la conducta de giro sobre su propio eje, a partir del cuarto día de microinyección.
ConclusiónLa microinyección de linamarina en el hipocampo dorsal de la rata se asocia a alteraciones en la coordinación motora, lo cual indica la participación del hipocampo dorsal, entre otras estructuras cerebrales, en las alteraciones neurológicas asociadas al consumo inapropiado de la yuca en el ser humano.
Cassava, also known as yuca or manioc (Manihot esculenta Crantz), is a staple food in tropical and subtropical regions since it is an important source of carbohydrates. Nevertheless, it contains cyanogenic compounds including lotaustralin and linamarin, which have been shown by experimental models to affect brain structures such as the thalamus, the piriform cortex, the hippocampus, and others. These findings may explain the presence of such neurological diseases as konzo and tropical ataxic neuropathy. However, hippocampal involvement in the neurological alterations associated with the chemical compounds in cassava has yet to be explored.
MethodMale Wistar rats (3 months old), were assigned to 4 groups (n = 8 per group) as follows: a vehicle-control group (receiving injectable solution 1μl) and three groups receiving linamarin (10, 15, and 20mM). The substances were microinjected intrahippocampally (CA1) every 24hours for 7 consecutive days, and their effects on locomotor activity, rotarod, and swim tests were assessed daily.
ResultsLinamarin microinjected into the dorsal hippocampus produced hyperactivity and loss of motor coordination which became more evident as treatment time increased. In the swim test, rats treated with linamarin displayed lateral rotation beginning on the fourth day of microinjection.
ConclusionsMicroinjection of linamarin into the dorsal hippocampus of the rat is associated with impaired motor coordination, suggesting that the dorsal hippocampus, among other brain structures, may be affected by the neurological changes associated with inappropriate consumption of cassava in humans.
La yuca, cassava o mandioca (Manihot esculenta Crantz) es uno de los alimentos básicos de origen vegetal en diversas regiones tropicales y subtropicales alrededor del mundo. Su cultivo es relativamente fácil y sus raíces son una fuente importante de hidratos de carbono y algunos micronutrientes indispensables para la nutrición1. Desafortunadamente, también contiene heterósidos cianogénicos, como la linamarina (en un 90%) y la lotaustralina (en un 10%)2, cuyo consumo en altas concentraciones se relaciona con enfermedades neurológicas caracterizadas por alteraciones en la motricidad y la cognición, principalmente3.
El consumo excesivo o inapropiado de yuca ha sido asociado con 2 enfermedades neurológicas: la neuropatía atáxica tropical (TAN) y la paraparesia epidémica espástica (konzo). La TAN es un síndrome de polineuropatía sensorial, ataxia sensorial, atrofia óptica bilateral y sordera bilateral descrito en Tanzania4, Sierra Leona5, Nigeria6,7 y en la India8. El konzo es una alteración neurológica caracterizada por daño en las motoneuronas superiores. Inicialmente, se produce una paratetraparesia espástica irreversible, no progresiva y simétrica9, caracterizada por espasticidad y debilidad progresiva de los miembros inferiores, produciendo incoordinación motora. Estas alteraciones neurológicas también han sido asociadas al consumo constante e inadecuado de yuca10. La toxicidad de los componentes cianogénicos de la yuca afectan principalmente a estructuras cerebrales involucradas en el procesamiento y la integración de la memoria, las emociones, el control de las funciones viscerales, la olfacción y la motricidad, tales como el tálamo, la corteza piriforme, el hipotálamo y el hipocampo, entre otras11.
El hipocampo es una estructura involucrada en la mayoría de las enfermedades neurodegenerativas; por pertenecer al sistema de memoria emocional, parece tener una participación importante en la integración de respuestas motoras asociadas a eventos motivados12,13. En este sentido, estudios en ratas han reportado que el consumo de semillas de la cícada Dioon spinulosum14,15 o la microinyección intrahipocampal de uno de sus metabolitos neurotóxicos (metilazoximetanol) inducen alteraciones motoras caracterizadas por el hundimiento y el giro sobre su propio eje en la prueba de nado15,16. Similarmente, las ratas que recibieron un tratamiento con el jugo de la raíz de yuca (con un contenido de linamarina de 0,30mg/2ml) también desarrollaron alteraciones motoras, tales como incoordinación motora y nado lateral17, lo cual, al parecer, estuvo asociado, al menos parcialmente, con la disminución del número de neuronas en el área CA1 del hipocampo18. Sin embargo, el efecto de la microinyección de linamarina en el hipocampo dorsal sobre la actividad y la coordinación motora aún no ha sido explorado, por lo que en el presente trabajo se determinó el efecto de la microinyección intrahipocampal de linamarina sobre la actividad motora espontánea (prueba de actividad locomotora) y la coordinación motora (pruebas de rota-rod y nado) en la rata Wistar.
MétodosSujetosSe utilizaron 32 ratas macho de 3 meses de edad de la cepa Wistar, con un peso entre 250-300g al inicio de los experimentos. Se alojaron en cajas de acrílico translúcidas en un bioterio de estancia con temperatura ambiente (25±2°C) y ciclo de luz oscuridad de 12/12 h (la luz se encendió a las 7:00 am). El acceso al agua y al alimento fue ad libitum. Todas las manipulaciones experimentales se realizaron de acuerdo con los estándares éticos internacionales basados en la Guide for Care and Use of Laboratory Animals19 y nacionales basados en las Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio20.
Cirugía estereotáxicaEl implante unilateral de la cánula guía se realizó bajo anestesia profunda de acuerdo con estudios previos21. La cabeza de la rata fue fijada en un aparato estereotáxico (Stoelting, Wood Dale, Illinois, EE. UU.) y se procedió a realizar una incisión longitudinal en la piel para dejar al descubierto el cráneo. Tomando como referencia la sutura bregma, y de acuerdo con las coordenadas estereotáxicas del atlas de Paxinos y Watson22, se realizó un trépano en el cráneo con un taladro dental (Saeshin Dental Lab 35000 RPM, Corea del Sur) para implantar la cánula en el hipocampo dorsal (Ap=–3,8mm, L= –2mm, y H= –2mm), área CA1. Después se descendió una cánula guía de acero inoxidable (8mm de longitud, 0,7mm de diámetro), la cual fue fijada al cráneo con acrílico dental (Arias Distribuidora Dental, Tlalnepantla, México). Después del implante de la cánula transcurrieron 4 días de recuperación y se procedió a la microinyección intrahipocampal del vehículo o linamarina para evaluar su efecto en las pruebas conductuales.
Grupos experimentales y tratamientosLas ratas fueron asignadas aleatoriamente a 4 grupos (n=8, cada grupo): un grupo que recibió el vehículo (solución inyectable) y 3 grupos más que recibieron las diferentes concentraciones de linamarina (10, 15 y 20mM), las cuales fueron calculadas considerando los estudios de Soler-Martín et al.2. El vehículo o la linamarina fueron microinyectados durante 7 días consecutivos, cada 24 h, mediante una cánula guía (10mm de longitud, 0,7mm de Ø) construida a partir de una aguja calibre 32×7 (0,7×32mm) 22 G×1 1/4′’ de acero inoxidable, conectada a una jeringa Hamilton de 10μl por medio de un tubo de polietileno. Mediante una bomba de infusión automatizada (KD Scientific, Holliston, Massachusetts, EE. UU.), se microinyectó un volumen de 1μl a una velocidad constante de 0,1μl/min, durante 10min; bajo este procedimiento, las ratas se mantuvieron en libre movimiento. Al concluir la microinyección, se dejó reposar la cánula inyectora durante 5 min más para permitir la difusión de la sustancia microinyectada y evitar que regresara por capilaridad. Inmediatamente, las ratas fueron evaluadas en las pruebas de actividad locomotora, rota-rod o nado, según correspondiera.
Actividad locomotoraConsistió en colocar a la rata en una caja de acrílico opaco (44×33×20cm), cuya base está dividida en cuadros de 11×11cm. Se evaluaron: a) número de cuadros cruzados durante los 5min de prueba. Se consideró como cuadro cruzado cuando la rata pasó al menos 3 cuartas partes de su cuerpo de un cuadro a otro, y b) número de conducta vertical, definida como los periodos en los que la rata adquiere una postura vertical con respecto al piso, apoyada en sus extremidades posteriores. Los cuadros cruzados se tomaron como un indicador de actividad motora espontánea, mientras que la conducta vertical se utilizó además para detectar posibles alteraciones en la coordinación motora.
Rota-rodLas ratas fueron entrenadas en un rota-rod (LE 8300, LSI Letica, Panlab Scientic Instruments, Barcelona, España), durante 5 días, previos a la microinyección de los tratamientos, a una velocidad de 18rpm. El día de la microinyección los animales fueron colocados en el rota-rod, donde se evaluó la latencia a la caída, que es el periodo que transcurre desde que la rata fue colocada en el rota-rod hasta que cayó del aparato. Esta variable permite identificar alteraciones en la coordinación motora y el equilibrio.
Prueba de nadoConsistió en colocar a la rata en un estanque de vidrio (26×29cm de base, por 50cm de altura) con agua a una temperatura de 25°C (± 1). El nivel de agua se ajustó de manera que la rata pudiera tocar el fondo del estanque con las extremidades posteriores y la cola. En esta prueba se evaluó el número de giros, definidos como los periodos en los cuales la rata no tiene desplazamiento y nadó girando sobre su propio eje14,16.
Todas las sesiones de prueba en actividad locomotora y nado fueron videograbadas. La cuantificación de las variables en campo abierto fue realizada por 2 observadores independientes hasta llegar a una concordancia de al menos el 95%. La cuantificación de la variable en la prueba de nado se realizó mediante un software (ANY-maze 4.73. Stoelting, Wood Dale, Illinois, EE. UU.), en el cual se analizaron los vídeos.
Verificación del sitio de microinyecciónAl finalizar las pruebas conductuales, todos los animales fueron eutanizados por sobredosis de pentobarbital (PISA-Agropecuaria, Guadalajara, México). Fueron perfundidos por vía intracardiaca con 100ml de solución salina fisiológica (NaCl al 0,9%), seguido de 100ml de formaldehído al 30% (J.T. Baker, Ecatepec, México). Se marcó el sitio de microinyección con azul de Evans; se extrajeron los cerebros y se realizaron cortes gruesos para verificar el sitio de microinyección bajo microscopio de luz y tomando como referencia el atlas estereotáxico de Paxinos y Watson22. Solo los datos obtenidos de las ratas en las que se identificó el correcto implante de las cánulas en CA1 de hipocampo fueron incluidos para el análisis estadístico.
Análisis estadísticoLos datos fueron analizados mediante ANOVA de 2 vías para muestras repetidas tomando como factores el tratamiento y los días de tratamiento. Cuando se alcanzaron valores de p ≤ 0,05, se aplicó la prueba post hoc de Student-Newman-Keuls. Los resultados son presentados como la media±el error estándar.
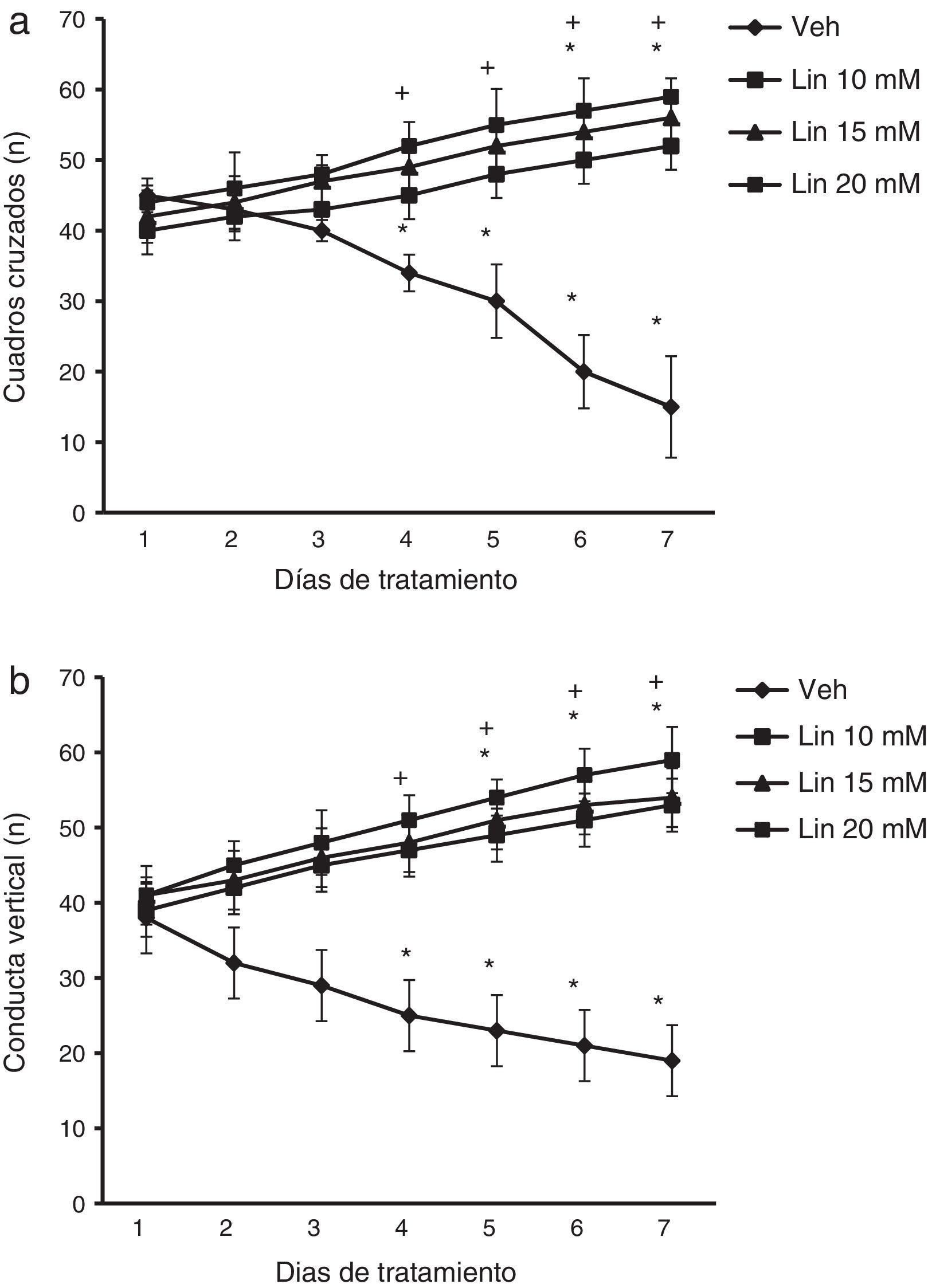
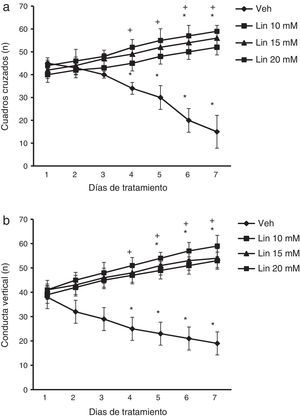
ResultadosActividad locomotoraEl análisis del número de cuadros cruzados reveló diferencias significativas de acuerdo con el tratamiento (F [3,168]= 2,735, p < 0,010), días de tratamiento (F [6,168] = 1,687, p < 0,050) y en la interacción de factores (F [18,168]= 4,835, p < 0,010). La prueba post hoc reveló que las diferentes concentraciones de linamarina incrementaron significativamente (p < 0,05) el número de cuadros cruzados a partir del día 4 de tratamiento respecto al día uno y al grupo vehículo en la sesión correspondiente. El grupo vehículo redujo significativamente esta variable a partir del día 4 y se mantuvo así hasta el final del experimento (fig. 1a).
Actividad locomotora. Independientemente de la concentración de linamarina (Lin), a partir del cuarto día de tratamiento incrementó el número de cuadros cruzados (a) y el número de conducta vertical (b), un efecto contrario al observado en el grupo vehículo (Veh).
* p< 0,05 vs. primer día de tratamiento del mismo grupo.
** p < 0,05 vs. sesión respectiva del grupo vehículo. ANOVA de 2 vías para muestras repetidas, post hoc Student-Newman-Keuls.
Por otro lado, el análisis del número de conducta vertical reveló diferencias significativas de acuerdo al tratamiento (F [3,168] = 3,618, p < 0,015), días de tratamiento (F (6,168) = 2,367, p < 0,050) y en la interacción de factores (F [18,168] = 15,689, p < 0,001). La prueba post hoc mostró, que independientemente de la concentración de linamarina, significativamente (p < 0,05) se incrementó el número de conducta vertical a partir del día 4 de tratamiento respecto al grupo vehículo en la sesión correspondiente, mientras que en los días 5 a 7 también lo fue respecto al día uno del mismo grupo. El grupo vehículo redujo significativamente esta variable a partir del día 4 y se mantuvo así hasta el día 7 (fig. 1b).
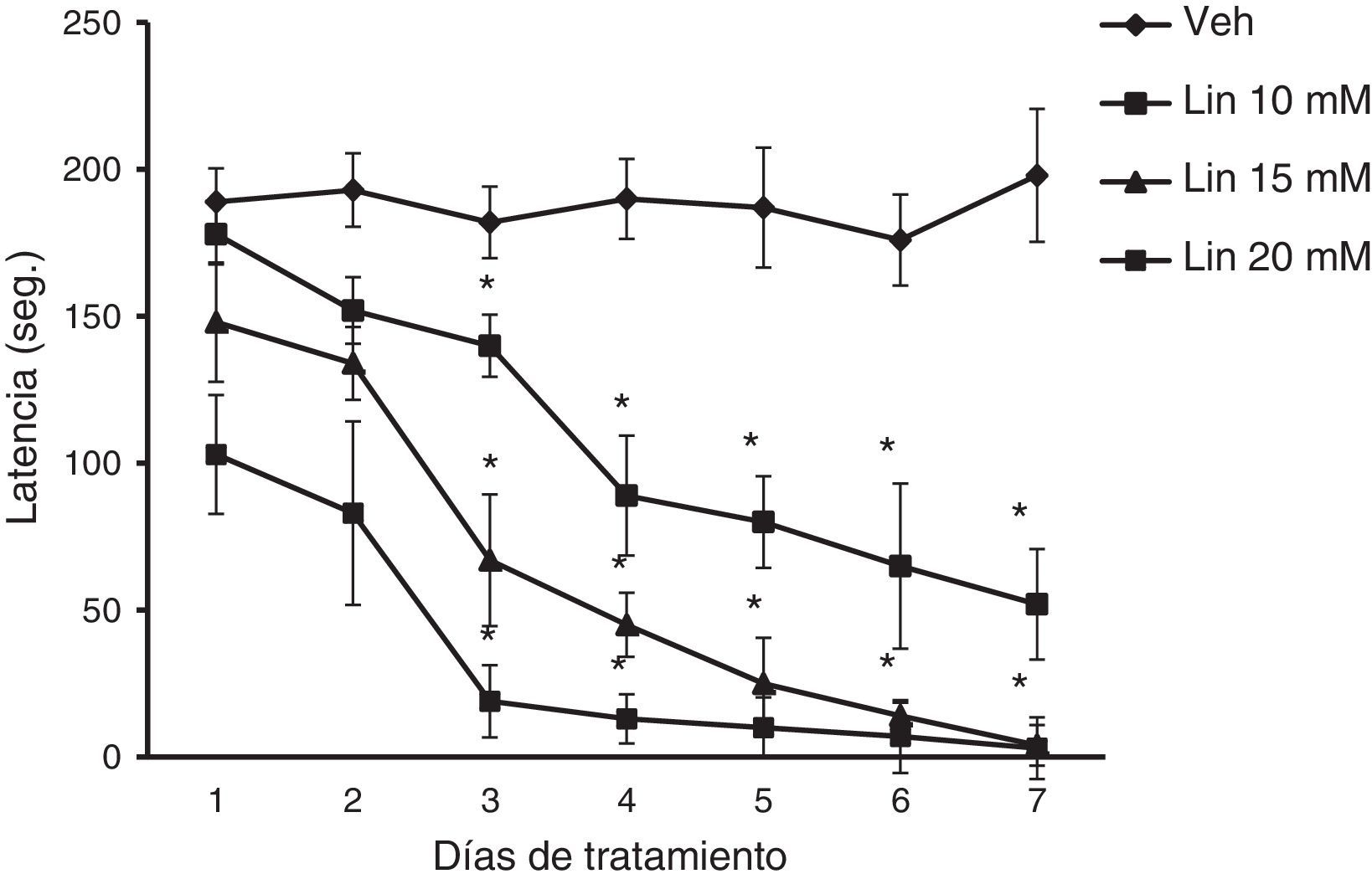
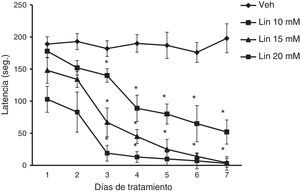
Rota-rodEl análisis de la latencia a la caída del rota-rod reveló diferencias significativas de acuerdo al tratamiento (F [3,168] = 28,585, p < 0,001), los días de tratamiento (F [6,168] = 3,162, p < 0,050] y a la interacción de factores (F [18,168] = 2735, p < 0,011). La prueba post hoc reveló que, independiente de la concentración de linamarina, la latencia a la caída del rota-rod se acortó significativamente (p < 0,05) a partir del día 3 con respecto al día uno de tratamiento y del grupo vehículo en la sesión correspondiente, un efecto que se acentuó con los días de tratamiento. El grupo vehículo no modificó esta variable durante los 7 días de tratamiento (fig. 2).
Rota-rod. Independientemente de la concentración de linamarina (Lin) microinyectada en el hipocampo dorsal, la latencia a la caída del rota-rod se acortó gradualmente a lo largo del estudio, un efecto que no ocurrió en el grupo vehículo (Veh).
* p < 0,05 vs. grupo vehículo en la sesión correspondiente y el día uno de cada grupo experimental. ANOVA de 2 vías para muestras repetidas, post hoc Student-Newman-Keuls.
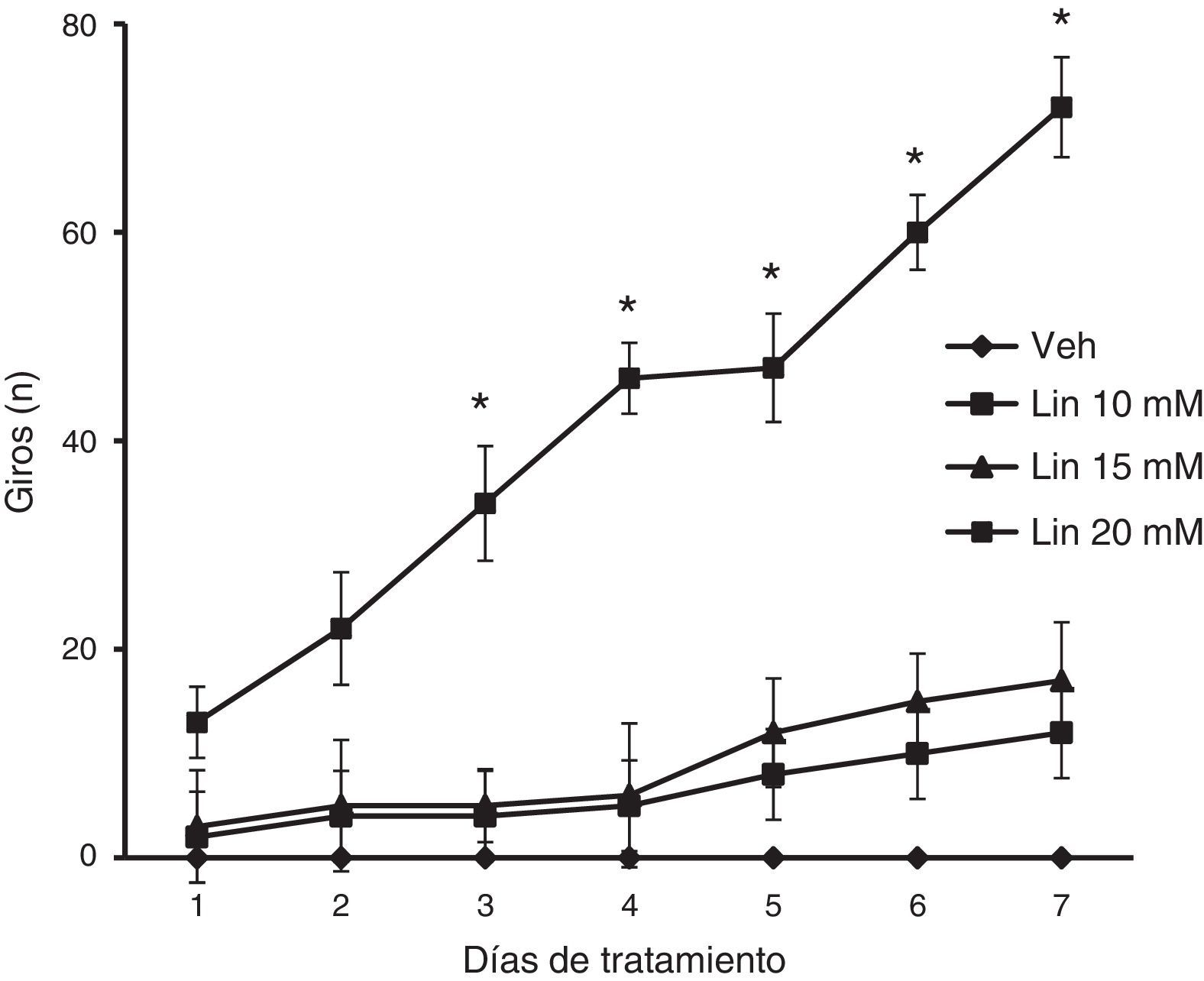
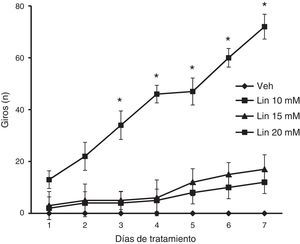
El análisis del número de giros sobre el propio eje en la prueba de nado reveló diferencias significativas de acuerdo al tratamiento (F [3,168] = 2,793, p < 0,040) y días de tratamiento (F 6,168] = 12,566, p < 0,050), así como en la interacción de factores (F [18,168] = 2,370, p < 0,025). La prueba post hoc reveló que solo la concentración de 20mM de linamarina incrementó gradual y significativamente (p < 0,05) la conducta de giro a partir del día 3 de tratamiento respecto al día uno del mismo grupo y al resto de los grupos en la sesión correspondiente. El grupo vehículo no desplegó la conducta de giro a lo largo del estudio (fig. 3).
Prueba de nado. Solo la concentración de linamarina (Lin) 20mM incrementó significativa y gradualmente la conducta de giro, siendo significativo a partir del día 3 de tratamiento. El grupo vehículo (Veh) no desplegó esta conducta a lo largo del estudio.
* p < 0,05 vs. día uno de tratamiento del mismo grupo y de la sesión respectiva del grupo vehículo. ANOVA de 2 vías para muestras repetidas, post hoc Student-Newman-Keuls.
En el presente estudio, la administración intrahipocampal de linamarina produjo deterioro de la actividad y la coordinación motora, lo cual podría estar reproduciendo a nivel experimental las alteraciones motoras identificadas en el ser humano que ha desarrollado enfermedades neurológicas asociadas al consumo inadecuado de la yuca. La actividad motora es utilizada frecuentemente para cuantificar el desplazamiento, la exploración y la ansiedad, bajo ciertas circunstancias experimentales23,24. En el presente estudio, el uso de la prueba de actividad motora permitió identificar un estado de hiperactividad en las ratas, caracterizado por el incremento en el número de cuadros cruzados y en el número de conducta vertical. Estas modificaciones conductuales fueron producidas por la microinyección de linamarina en el hipocampo dorsal, un efecto que no estuvo relacionado con la manipulación quirúrgica o la microinyección, puesto que el grupo vehículo no presentó estas alteraciones; lo que concuerda con estudios previos16,21. El aumento de estas 2 conductas indica que la microinyección de linamarina en el hipocampo dorsal produjo daño neuronal que impide posiblemente la consolidación de la memoria visuoespacial, lo cual podría relacionarse con el aparente estado de «hiperactividad motora»; lo anterior puede sustentarse en el hecho de que los animales intactos o tratados con vehículo y evaluados repetidamente en la prueba de actividad locomotora gradualmente reducen la actividad motora y la conducta vertical25, como ocurrió en el grupo vehículo del presente trabajo. Esto ha sido explicado como un proceso de aprendizaje y adaptación de la rata a las condiciones de la caja, por lo que deja de ser novedosa, disminuye la exploración y, por lo tanto, la actividad motora espontánea26. Sin embargo, es posible que las ratas tratadas con linamarina, al tener daño neuronal en el hipocampo, deterioren la capacidad de aprendizaje y la consolidación de la memoria. De ser el caso, la rata no reconocería las condiciones de la caja de prueba y la exploraría como si fuera un ambiente novedoso o desconocido. Cabe señalar que el incremento de la actividad locomotora en sesiones repetidas en la prueba de locomoción también ha sido identificado en ratas microinyectadas en el hipocampo dorsal con neurotóxicos derivados de las cícadas o con la administración oral del jugo de yuca que contiene linamarina15–17,27. Estas observaciones en la rata podrían coincidir con los reportes clínicos en pacientes que han desarrollado enfermedades neurológicas asociadas al consumo inadecuado de yuca, que, además de presentar alteraciones motoras, también desarrollan deterioro del aprendizaje y la memoria3,28.
Como se mencionó anteriormente, los pacientes con neuropatías asociadas al consumo de yuca desarrollan problemas de coordinación motriz29,30, entre otras cosas. En el presente estudio las ratas tratadas con las diferentes concentraciones de linamarina tuvieron una corta latencia a la caída del rota-rod, lo cual fue dependiente del tiempo de tratamiento. En esta prueba se evalúan la coordinación motora y el equilibrio de las ratas. Se acepta que un animal intacto (sano) permanecerá más tiempo sobre el rodillo al mantener la coordinación de sus extremidades y el equilibrio31. Es por ello que esta prueba es usada para medir el grado de lesiones en el sistema nervioso central y del efecto que producen las sustancias que interfieren en la coordinación motora y el equilibrio32. En este caso, un animal con alguna lesión del sistema nervioso central o tratado con neurotóxicos o sedantes, que interfieren en la actividad motora, tendrán una corta latencia a la caída del rota-rod33,34, como ocurrió en el presente estudio. En efecto, cuando las ratas recibieron las diferentes microinyecciones de linamarina en el hipocampo dorsal, desarrollaron la conducta de giro en la prueba de nado. Esta conducta ha sido propuesta como un indicador de incoordinación motriz en la cual el animal no puede controlar sus extremidades para nadar normalmente, como lo hace una rata control14. Cabe señalar que la conducta de giro sobre su propio eje también es detectada cuando se microinyectan en el hipocampo dorsal neurotóxicos derivados de las cícadas, como el metilazoximetanol15,16. Es importante comentar que la conducta de giro en la prueba de nado no estuvo relacionada con algún daño en el sistema vestibular, debido a que cuando ocurre este daño se puede detectar la conducta de giro en la prueba de nado, pero también en la prueba de actividad locomotriz, donde las ratas caminan en círculos12,35, lo cual no ocurrió en el presente estudio. Este hecho indica que la alteración conductual identificada en el nado está relacionada con algún daño a nivel motor y no vestibular. La conducta de giro ha sido asociada a alteraciones en la coordinación motora de las extremidades posteriores de la rata35, por lo que los datos encontrados en el presente trabajo podrían estar reproduciendo las alteraciones motoras que presentan los pacientes con TAN y konzo inducidos, aparentemente, por el consumo inadecuado de yuca3,10,30.
Finalmente, aunque en el presente estudio no se identificó el mecanismo por el cual ocurren las alteraciones motoras tras la microinyección de linamarina en el hipocampo dorsal, es factible ofrecer una posible explicación. La linamarina y otros compuestos cianogénicos tienen la capacidad de producir una sobreexcitación neuronal en hipocampo producida por este neurotóxico, ya que sobreestimula al hipocampo, lo que a su vez sobreactiva los receptores NMDA de tipo ionotrópico, conduciendo a la excitotoxicidad y, por lo tanto, a la muerte neuronal, lo que podría explicar parcialmente lo que ocurre en humanos con las patologías de TAN y konzo36–38. Estas observaciones abren nuevas perspectivas de estudio que permitan identificar los mecanismos neuronales que subyacen a las alteraciones neurológicas producidas por los componentes químicos de la yuca y sus derivados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio fue apoyado parcialmente por el Cuerpo Académico Biología, Química y Funcionalidad Molecular de Metabolitos Vegetales (UV-GC-235) de la Universidad Veracruzana.