La talla baja idiopática (TBI) se define como talla ≤2 desviaciones estándar (DE) sin causa precisada. El uso de la hormona de crecimiento (GH) en TBI es controvertido y no existen resultados de talla final (TF) en pacientes chilenos. El objetivo de este trabajo es comparar la TF de pacientes con TBI tratados con GH con la predicción de talla adulta al inicio de tratamiento.
Pacientes y método18/47 pacientes con TBI tratados con GH y que alcanzaron su TF. Se definió TF con edad ósea (EO) ≥17 años en hombres y ≥15 años en mujeres. Para comparar se consideró la DE de la talla según curvas NCHS al inicio y final de tratamiento. El pronóstico de talla adulta (PTA) se calculó utilizando la EO mediante el método de Bayley-Pinneau.
ResultadosLa talla inicial fue 133,1±6,8cm (–2,1±0,85DE) y el PTA de –1,94±0,86DE. Los pacientes se trataron desde los 11,6±1,2 años durante un tiempo de 1,56±0,65 años. Al año de tratamiento su talla fue –1,64±0,69DE y la talla final fue –1,28±0,62 DE (163,76±7,22cm). Se obtuvo un aumento en la TF de 2,67±5,88cm (equivalente a 0,67±0,9DE).
ConclusiónNuestros resultados demuestran que el tratamiento con GH fue eficaz para incrementar TF en pacientes con TBI, con una duración mayor a un año de tratamiento. Hasta donde sabemos este constituye el primer reporte de talla final en pacientes chilenos con TBI tratados con GH.
Idiopathic short stature (ISS) is defined as a height of<- 2 standard deviations (SD) from the mean for age. The use of Growth Hormone (GH) in ISS is controversial, and there are not results for adult height (AH) in Chilean patients with ISS treated with GH. The objective of the study is to compare AH in patients treated with GH with the height prediction at beginning of treatment.
Patients and MethodAH was considered with bone age ≥ 17 in males and ≥15 in females. The height SD according to the NCHS curves at beginning and ending of treatment were used for the comparison. Height prediction (HP) was calculated by Bayley-Pinneau method.
ResultsAH was reached by 18/47 patients with ISS treated with GH. Initial height -2.1±0.85 SD (133.1±6.8cm) and HP -1.94±0.86 SD, and were treated since 11.6 ±1.2 years old. After one year of treatment their height was -1.64 ±0.69 SD, and AH was -1.28+-0.62 SD (163.76 +-7.22cm).
ConclusionIt is suggested that treatment with GH for ISS is effective to increase AH. Although with wide individual variability, a mean increase of 0.67±0.9 SD (+2.67cm) was obtained in the AH. This is the first report on Adult Height in Chilean patients.
La talla baja idiopática (TBI) se define como un retraso del crecimiento de etiología no precisada luego de una evaluación completa que permita descartar todas las causas conocidas de talla baja. La definición incluye un grupo heterogéneo de individuos cuya estatura está por debajo de –2 desviaciones estándar (DE) con respecto a la población de referencia de la misma edad y sexo, con preservación de la proporción entre los segmentos corporales, y cuyas expectativas o pronóstico de talla adulta son también inferiores a –2 DE al continuar con su crecimiento espontáneo1,2.
El uso de la hormona de crecimiento (GH) en el tratamiento de la TBI fue aprobado por la FDA en EE. UU. en el año 2003, basado en criterios auxológicos (talla ≤−2,25DE, equivalente a percentil 1), con dosis iniciales que varían entre 33 a 50μg/kg/día, y que podrían aumentarse después del primer año si la respuesta al tratamiento se considera inadecuada (ganancia<0,3DE de talla)3,4. Sin embargo, la sociedad europea aón no aprueba este tratamiento para la TBI; entre las razones está su alto costo, su menor beneficio en comparación con otras enfermedades para las que está indicada y probables efectos adversos metabólicos a largo plazo.
Si bien es cierto que aún no se llega a un consenso sobre el uso de GH en TBI, los estudios muestran un alto porcentaje de respuesta positiva (90%), aunque con resultados variables5. Las experiencias reportadas hasta ahora muestran un aumento en la velocidad de crecimiento de 1-3cm por año4, pero no existen datos de pacientes chilenos que hayan seguido o mantenido esta terapia por un período mayor a un año. Además, existen escasos datos de estudios realizados en pacientes que alcanzaron la talla final (TF).
La necesidad real de ganar estos centímetros de estatura final puede relativizarse en una sociedad como la nuestra, incluso existen numerosos aspectos éticos involucrados en esta decisión que se recomienda considerar. Visser-van Balen et al. realizaron cuestionarios y entrevistas estructuradas a padres de adolescentes con TBI, demostrando que si bien los pacientes referían un funcionamiento psicosocial normal y altas expectativas en cuanto al tratamiento, los padres reportaban que sus hijos presentaban problemas conductuales, de atención, ansiedad y depresión; además, la mayoría de los padres mostró preocupación por el futuro de sus hijos, especialmente en cuanto a encontrar trabajo y matrimonio6.
El objetivo de nuestro trabajo es analizar la TF de pacientes diagnosticados de TBI y tratados con GH en comparación con el pronóstico de talla adulta (PTA) efectuado al inicio de tratamiento, para evaluar la utilidad del tratamiento con GH en esta condición.
Pacientes y métodoSe utilizó como base de datos para la búsqueda de pacientes las fichas clínicas electrónicas y en papel del autor para la correspondencia (HG). Se seleccionaron 47 pacientes con TBI tratados con GH entre los años 2000 y 2009, de los cuales se logró contactar vía telefónica y/o electrónica con 40 de ellos. En 11 de estos no se pudo recolectar todos los datos necesarios, 8 rechazaron participar en el estudio y 3 se encontraban fuera del país, lo que dejó un universo de 18 pacientes que cumplían los criterios de inclusión, todos los cuales lograron completar el estudio, 13 hombres y 5 mujeres.
Criterios de inclusión de los pacientesHaber alcanzado TF, definiéndose esta como crecimiento<1cm durante el último año de control u hombres con EO>17 años y mujeres con EO>15 años; haberse mantenido en tratamiento con GH durante al menos un año; tener ficha clínica completa; encontrarse localizables por vía telefónica o electrónica; y aceptar participar en el estudio.
Recolección de datosLos pacientes fueron citados a una consulta sin costo, en donde se realizó medición de peso y talla en las dependencias del centro de especialidades médicas de la Universidad Católica (UC). La talla se midió con un estadiómetro de pared, con el paciente en posición erecta, con los maléolos internos enfrentándose, el talón tocando la pared y ángulo de Frankel en 90° con respecto a la vertical (método con variación intraensayo de 0,1cm). Se realizaron 3 mediciones consecutivas calculando el promedio de las 3 determinaciones. Se pesó con balanza de precisión marca SECA, con variación intraensayo de 50g. Dos pacientes no pudieron asistir por encontrarse fuera de la región metropolitana. En estos casos se solicitó la medición en casa del peso y la talla con ayuda de un familiar adulto responsable. Se asesoró y explicó por vía telefónica el procedimiento de medición de la talla con una huincha metálica contra la pared, en piso duro y liso, en posición erecta, con el talón tocando la pared y los maleólos internos enfrentados. Se solicitó realizar 3 mediciones y se calculó el promedio de estas, con una diferencia menor a 0,2mm entre ellas. La edad ósea fue determinada por el mismo observador (investigador HG) utilizando el Atlas de Greulich and Pyle. La talla objetivo genética se determinó según la fórmula: talla padre o madre (cm)±13/2.
Análisis de datosLas variables analizadas fueron: talla en desviaciones estándar (DE) a través de EpiNut-CDC 2000 Microsoft®; talla y pronóstico de talla adulta por EO (Bayley-Pinneau) al inició del tratamiento con GH; talla al año de tratamiento con GH y talla final, tanto en cm como DE de la media (puntuación z score) de las curvas National Center HealthStadistics (NCHS) del año 2000. Los datos se tabularon en el programa Excel Microsoft® y el análisis estadístico se realizó en Prism 6.0 para Mac®. Asumiendo variables sin una distribución normal, se utilizaron pruebas no paramétricas para variables pareadas en su análisis. Todas las variables no pareadas se compararon a través de la prueba Kruskal-Wallis, luego se utilizó la comparación múltiple de Dunn para determinar los grupos estadísticamente diferentes. Para comparar las diferencias estadísticas entre 2 grupos pareados se utilizó la prueba de Wilcoxon.
Comité de éticaA los pacientes que aceptaron participar en el estudio se les explicó en qué consistía el estudio y se les hizo firmar un consentimiento informado. El proyecto cuenta con la aprobación del Comité de Ética de Investigación de la Pontificia Universidad Católica de Chile.
ResultadosSe estudiaron 18 pacientes de ambos sexos (13 hombres y 5 mujeres) con edad actual de 22,17±1,98 años, con diagnóstico de TBI, cuyo promedio de edad de inicio de tratamiento fue 11,6±1,2 años y cuya talla objetivo genética fue de –1,43±0,88DE. Todos los pacientes fueron tratados con la misma dosis de GH correspondientes a 0,33μg/kg/día durante un tiempo de 1,56±0,65 años.
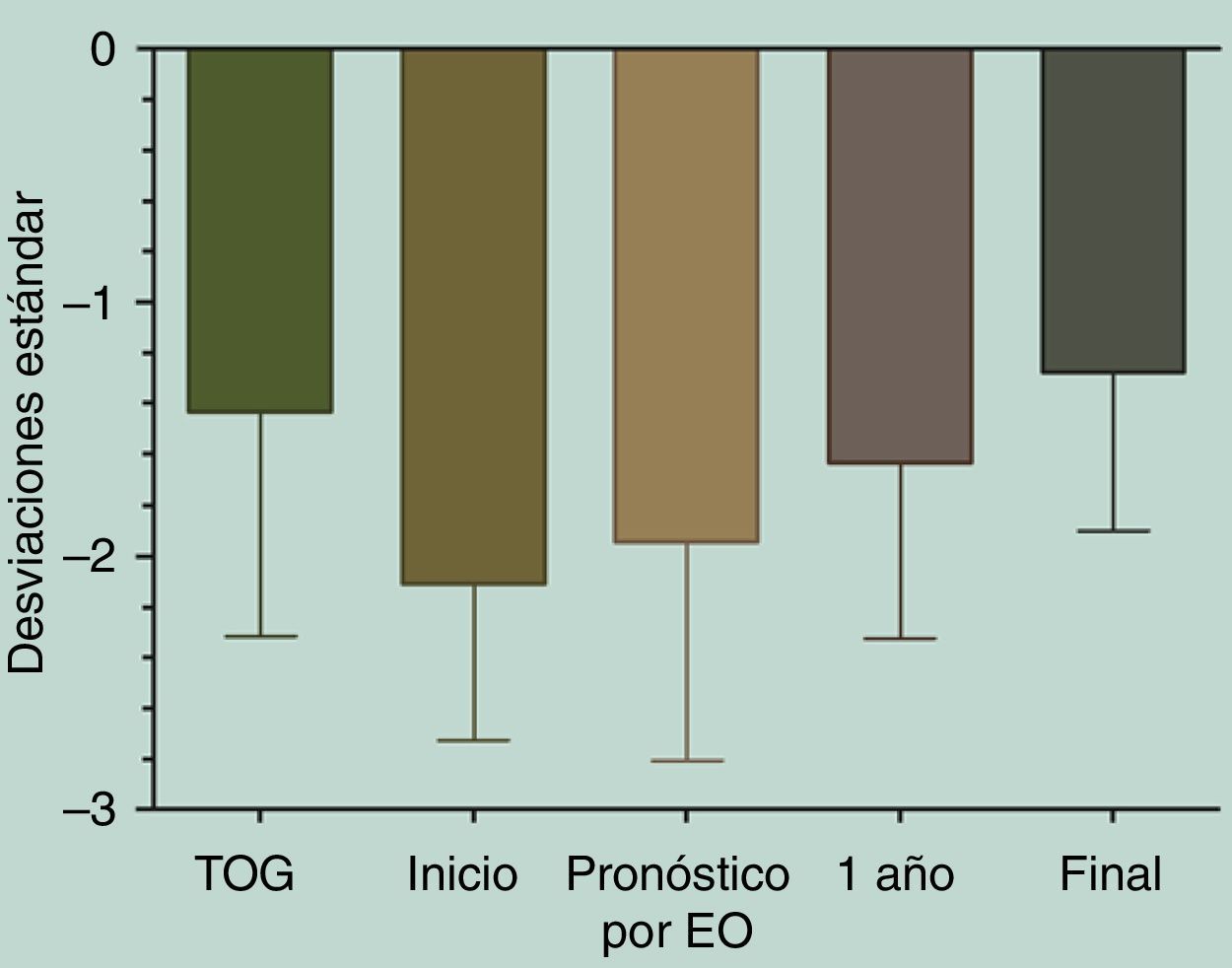
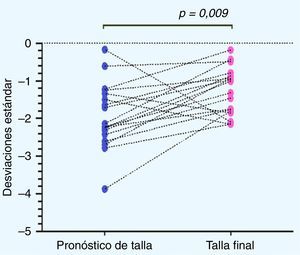
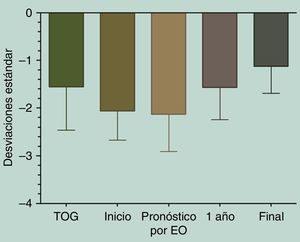
La talla al inicio de tratamiento fue de –2,11±0,62DE (equivalente a 133,15±6,82cm), y su PTA por EO fue de –1,94±0,86DE (equivalente a 161,09±8,95cm). Al cumplir un año de tratamiento con GH se había mejorado la talla a –1,64±0,69DE (equivalente a 140,33±7,66cm). Los participantes alcanzaron una TF de –1.28±0,62DE (equivalente a 163,76±7,22cm), logrando un aumento significativo entre la talla de inicio de tratamiento y la TF (p=0,0075) (fig. 1).
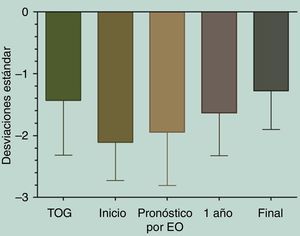
Diferencias entre las tallas.
Kruskal-Wallis test/Dunn's multiple comparisons test
Talla expresada en DE. 1 año: talla al completar primer año de tratamiento; Final: talla al terminar de crecer; Inicio: talla al iniciar tratamiento con GH; Pronóstico por EO: talla pronosticada al inicio de acuerdo con Bayley Pinneau; TOG: talla objetivo genético.
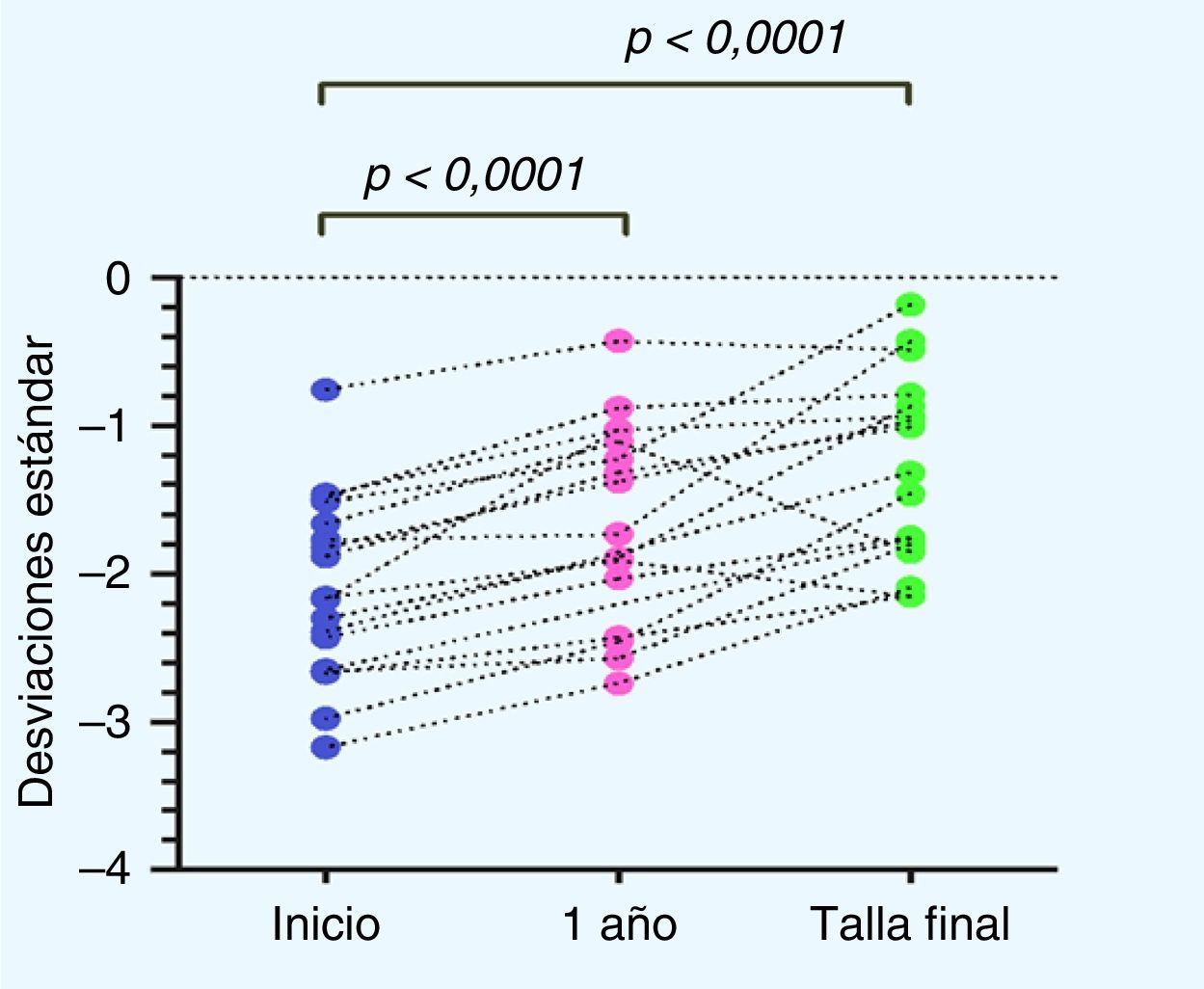
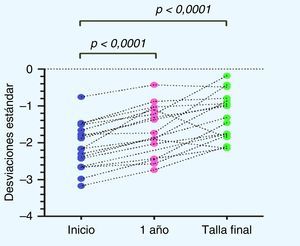
En cuanto a la distribución de la talla (DE) durante el tratamiento con GH, si bien existió una alta variabilidad en la respuesta individual, en la respuesta grupal se observa un aumento significativo de la talla al año de tratamiento con respecto a la talla al inicio de tratamiento (p<0,0001), así como también de la TF con respecto a la talla al inicio de tratamiento (p<0,0001) (fig. 2).
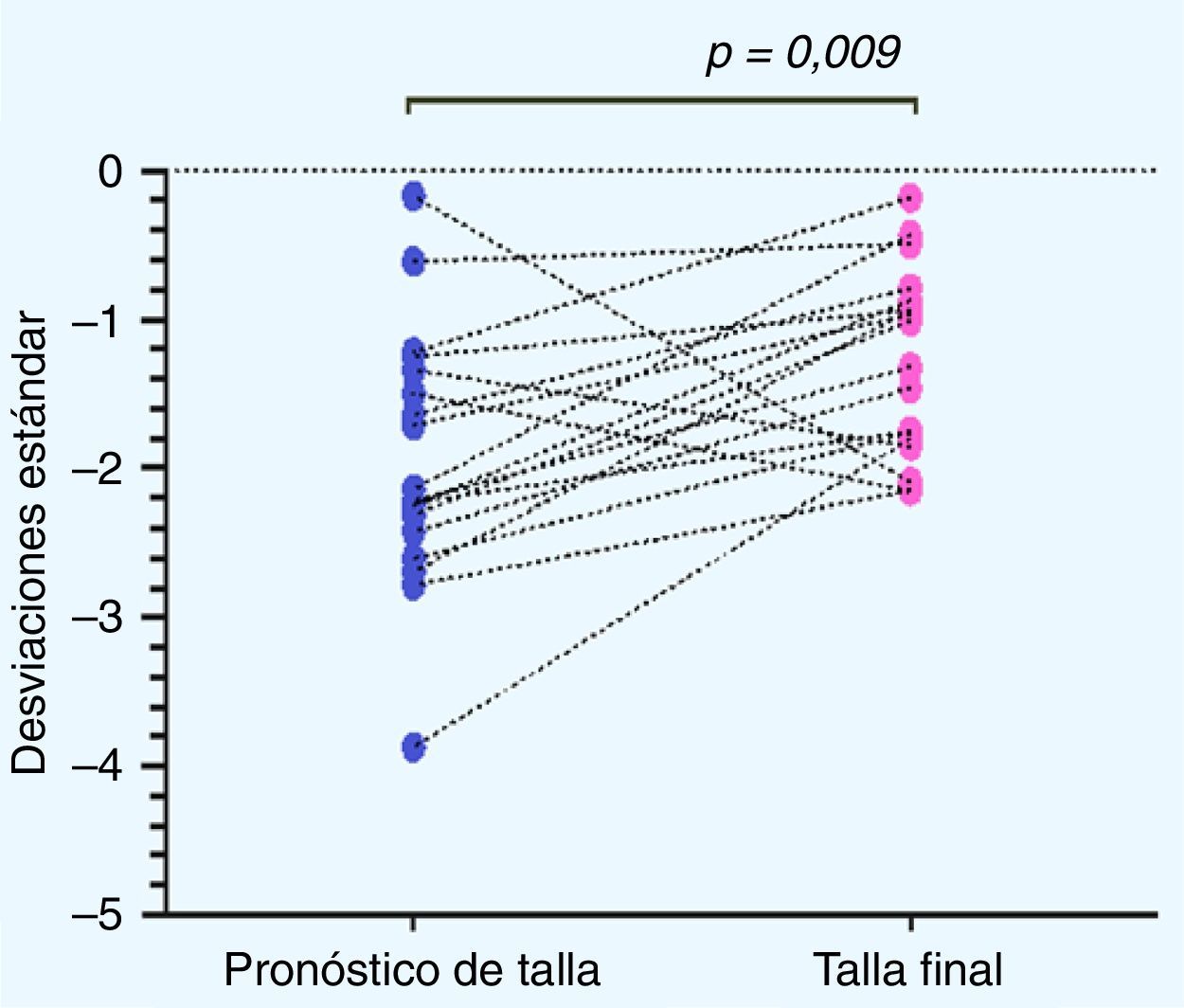
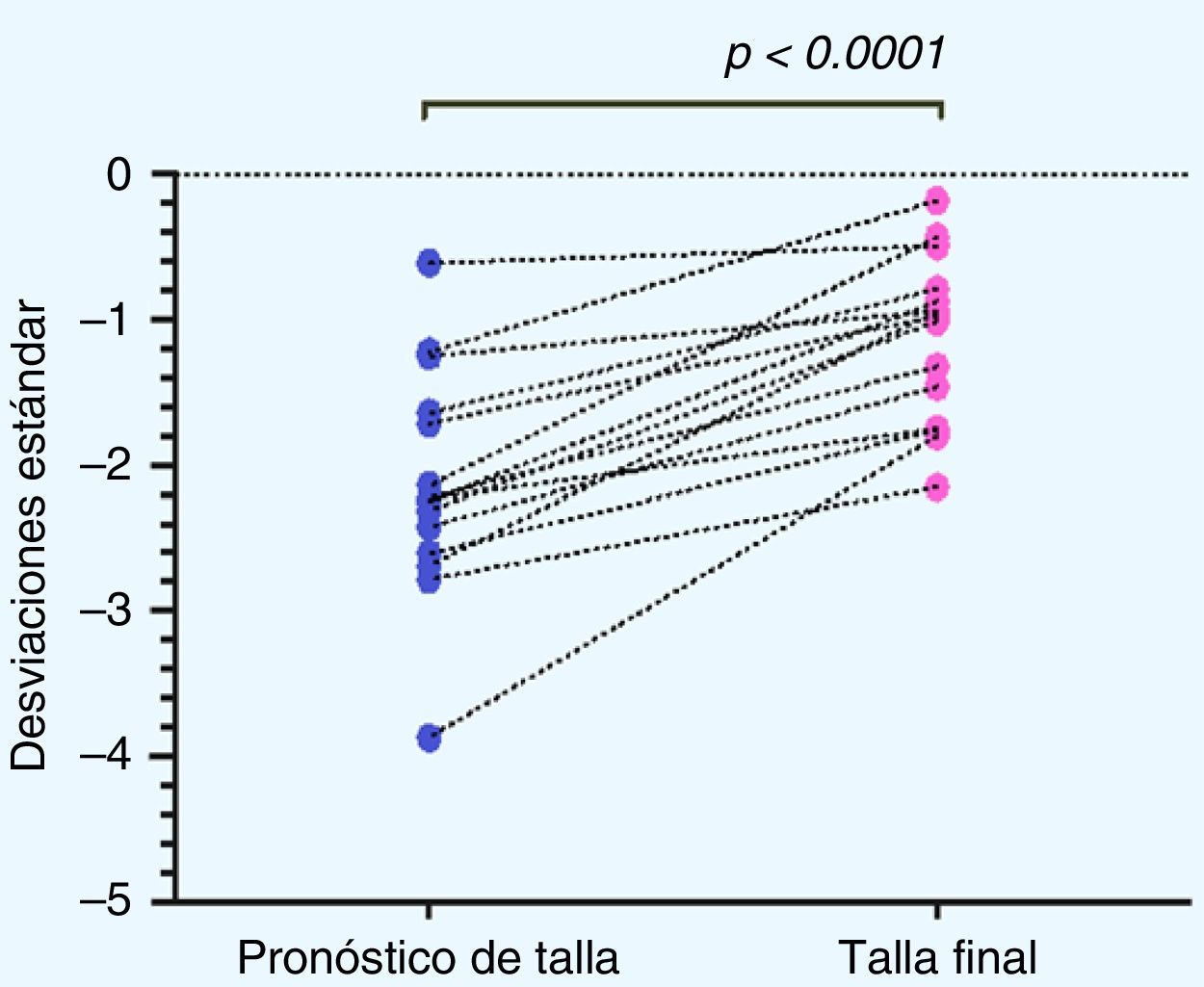
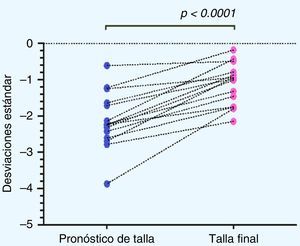
Al analizar la distribución de la TF obtenida con respecto al PTA al inicio del tratamiento se obtuvo un aumento en la TF de 0,67±0,9 DE, equivalente a un aumento de 2,67±5,88cm (p=0,009). Se observó un grupo de 3 pacientes (pacientesn.° 5, 7 y 14) en los cuales se obtiene una disminución de la TF con respecto al PTA, los que denominaremos en adelante como «no respondedores» (fig. 3).
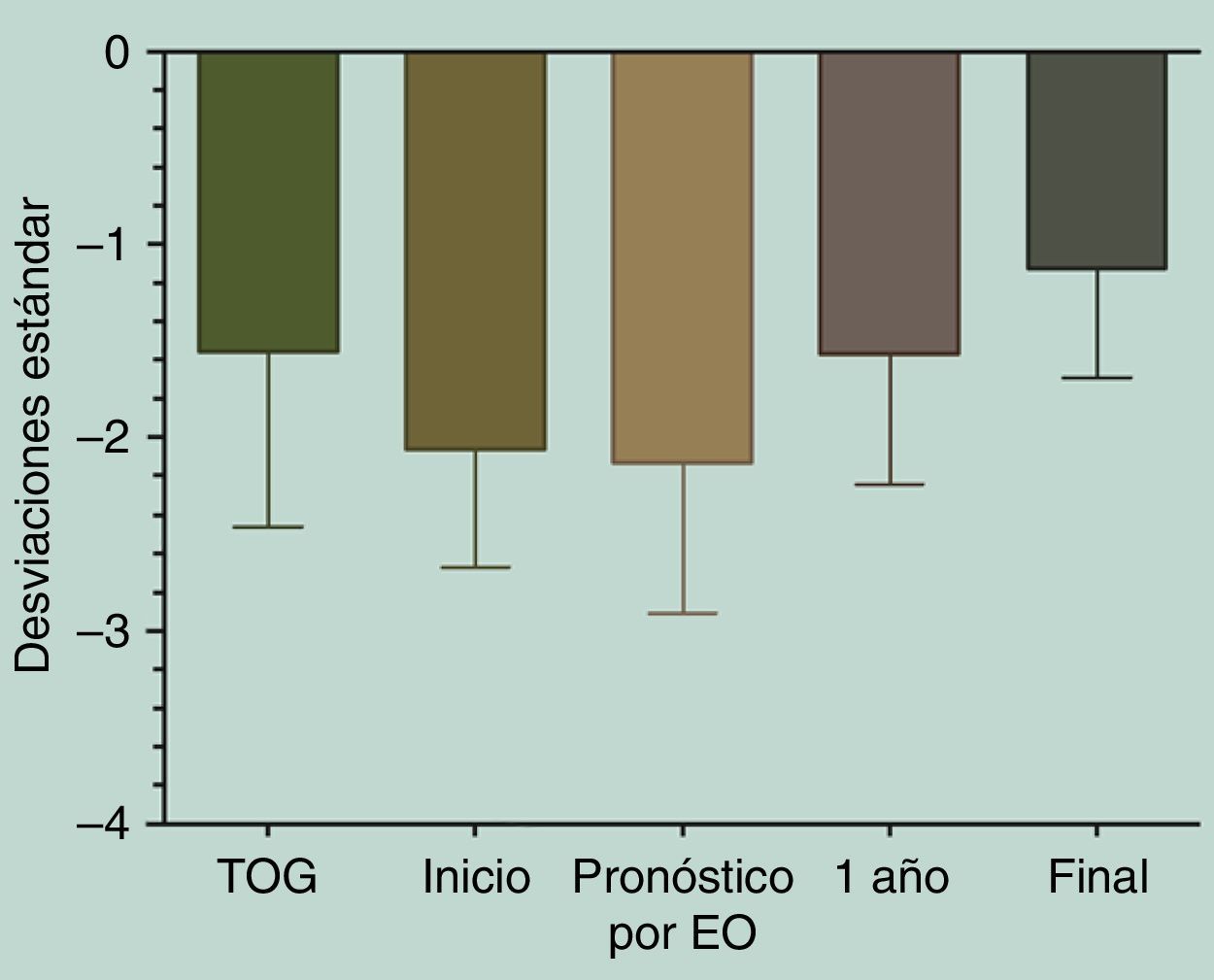
Al volver a analizar los resultados excluyendo a los pacientes no respondedores de la población en estudio, se obtiene una talla al inicio de tratamiento de –2,06±0,6DE (equivalente a 133,99±6,94cm), y un PTA por EO de –2,13±0,78DE (equivalente a 159,22±8,47cm). Al cumplir un año de tratamiento con GH se había mejorado la talla a –1,57±0,67DE (equivalente a 141,48±7,75cm) y alcanzaron una TF de –1,12±0,57DE (equivalente a 163,96±7,94cm), lográndose un aumento aún más significativo entre la talla de inicio de tratamiento y la TF (p=0,0034), y entre el PTA por EO y la TF (p=0,004) (fig. 4).
Al analizar la distribución de la TF obtenida con respecto al PTA al inicio del tratamiento, excluyendo a los pacientes no respondedores de la población en estudio, se obtuvo un aumento en la TF de 1,01±0,55DE, equivalente a un aumento de 4,73±3,33cm (p<0,0001) (fig. 5).
En cuanto a la relación entre la edad de inicio del tratamiento y la ganancia de TF, se obtuvo una correlación no significativa, con un valor r=0,04853 (IC 95%, –0,4403 a 0,5152; p=0,8484).
Discusión y conclusionesLos datos de nuestro estudio indican que la utilización de GH en el tratamiento de la TBI es efectiva para mejorar la talla final en relación con el PTA calculado al inicio del tratamiento, con un aumento en la TF de 0,67±0,9DE (equivalente a 2,67±5,88cm). Estos resultados mejoran aún más al excluir del análisis a los 3 individuos que se consideran no respondedores, alcanzando en los 15 restantes una ganancia de 1,01±0,55DE (equivalente a 4,73±3,33cm).
Creemos que en la interpretación de nuestro trabajo se debe tener en cuenta algunas características que lo diferencian de las otras publicaciones. La muestra estudiada no es representativa de la población general de niños con diagnósticos de TBI tratados con GH, pues existe un sesgo de selección al ser pacientes asintomáticos que consultan espontáneamente en centros de salud UC. La población estudiada es de predominio masculino, no se realizó distinción por sexo ni por desarrollo puberal, debido al reducido número de participantes. La edad de inicio de tratamiento de nuestros pacientes (11,6±1,2 años) fue más tardía que lo reportado, que se acerca a los 10 años en promedio. Además la duración del tratamiento (1,56±0,65 años) fue más breve que los más de 2-10 años reportados en la mayor parte de los estudios internacionales. Ambos factores conocidamente deterioran la respuesta final a GH. En cuanto a la dosis de GH es similar a la utilizada en otros estudios7–11.
Deodati et al. obtienen una TF, luego del tratamiento con GH, entre –1,1 y –1,77 DE, rango que si bien es bastante amplio resulta similar a la TF obtenida en nuestra población de 1,28 DE7. Por otro lado, Hintz et al. realizan una comparación con la talla pronosticada al inicio del tratamiento, utilizando el mismo método que en nuestro estudio, con una talla inicial de –2,6DE, logrando una talla final de –1,6DE, siendo nuestros resultados bastante mejores, sobre todo al quitar el grupo de pacientes no respondedores de la muestra se obtiene una talla aún más significativa de –1,12DE10. El aumento de la talla descrito es de 4-5cm en 5 años de tratamiento. En nuestro estudio se pudo observar un aumento de 2,6cm en 1,56 años de tratamiento. Sin embargo, al quitar los pacientes no respondedores, el aumento en cm llega a 4,7cm, acercándose aún más a los valores entregados por otros estudios con menor tiempo de tratamiento7,10.
La falta de correlación entre la edad de inicio del tratamiento y la ganancia de TF, observada en nuestro estudio, posiblemente se deba al reducido tamaño muestral y a que los tiempos de tratamiento fueron relativamente cortos respecto de lo reportado en la literatura. En estudios internacionales se ha visto una clara relación entre el inicio precoz de tratamiento y aumento de TF11,12.
En cuanto a los pacientes no respondedores se realizó revisión de ficha clínica, encontrándose en 2 de ellos una posible resistencia a GH, el primero con padres bajos (–1,57DE) y una respuesta peak a GH de 32,2ng/ml y el segundo con padres normales (–0,33DE) y una respuesta peak a GH de 30,1ng/ml. En el tercer paciente no respondedor no se logró encontrar el factor influyente en su mala respuesta al tratamiento con GH, ya que tiene padres no tan bajos (–0,78DE) y una respuesta peak a GH de 8,3ng/ml. Es objetivo de estudios posteriores determinar las variables que permiten predecir a aquellos pacientes catalogados como TBI que tendrán una pobre respuesta al tratamiento con GH. Se han observado algunos avances en esta área; Vásquez et al. hallaron una mutación en el gen del receptor del péptido natriurético en el 6% de la población con TBI estudiada (47 pacientes), que presentó una pobre respuesta al tratamiento con GH, aunque aún hacen falta estudios con una mayor cantidad de pacientes13. El identificar a los no respondedores permitiría ahorrar recursos económicos y humanos asociados a este tratamiento, así como evitar las repercusiones psicosociales de los pobres resultados a obtener en estos casos.
La mayor parte de las veces la TBI ha incluido una mala velocidad de crecimiento, observada por los mismos investigadores, previa al inicio del tratamiento, lo que puede traducir alteraciones del eje somatotrófico aún no detectadas por el estudio convencional del mismo. Esto ha sido descrito, por ejemplo, en casos de mutación del gen SHOX, que reúne sujetos con escaso fenotipo, respondedores a GH, que se presentan como TBI: en muchos de estos casos solo el estudio genético permite hacer el diagnóstico, el cual estaría presente en 1-2% de los pacientes con TBI1,14. Existen otras alteraciones genéticas, inicialmente diagnosticadas como TBI, que resultan ser alteraciones del eje somatotropo, o alteración del metabolismo óseo (por ejemplo gen del receptor del péptido natriurético) luego del estudio genético. Estas mutaciones determinan diferentes respuestas al tratamiento con GH. A medida que se vayan dilucidando las diferentes mutaciones se podrán crear tratamientos más dirigidos según la enfermedad.
Si bien nuestro estudio corresponde a un estudio retrospectivo realizado en un número reducido de pacientes y no se cuenta con grupo control dado que no se tiene registro, en nuestro centro o nacional, de los pacientes con TBI que no fueron tratados con GH, tiene la fortaleza de haber logrado por primera vez seleccionar y medir la talla final de pacientes chilenos tratados con GH después de varios años de finalizado el tratamiento, y determinar la talla final, con un resultado positivo para el uso de GH en TBI, al igual que lo descrito por otros investigadores7.
Posteriores estudios con la misma rigurosidad en la inclusión de pacientes, pero con un número mayor de ellos, con tratamiento más prolongado y de inicio más precoz serán necesarios para establecer tanto la utilidad como la edad y el tiempo óptimo del tratamiento en talla baja idiopática.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.