Fazer revisão dos estudos que avaliaram a variação da contagem de folículos antrais ovarianos durante o ciclo menstrual de mulheres eumenorreicas.
MétodoFoi feita revisão sistemática de trabalhos que tiveram como objetivo avaliar a variação da contagem de folículos antrais ovarianos no ciclo menstrual publicados nos últimos 16 anos e disponíveis nas bases de dados científicas Medline, Lilacs e Scielo. Os descritores de busca foram reserva ovariana, contagem de folículos antrais, ciclo menstrual e variação intraciclo.
ResultadosVerificou‐se a existência de 920 artigos. Foram selecionados sete publicados de 2002 a 2013. Quatro eram estudos prospectivos, um tratava‐se de uma revisão sistemática e dois eram estudos experimentais.
ConclusãoA contagem de folículos antrais ovarianos parece não sofrer variação significativa no ciclo menstrual, principalmente quando se medem folículos antrais pequenos (2‐6mm).
To make a review of studies that assessed the variation in ovarian antral follicle count during menstrual cycle eumenorrheic women.
MethodA systematic review of studies that aimed to evaluate the variation of antral follicle count in the menstrual cycle from the last 16 years and that were available in scientific databases Medline, Lilacs and Scielo was performed. The descriptors searched were ovarian reserve, antral follicle count, menstrual cycle and intra‐cycle variation.
Results920 articles were found. From these, four of the 7 studies published in the years 2002 to 2013 were prospective studies, 1 was a systematic review and 2 were experimental studies.
ConclusionThe ovarian antral follicle count does not seem to suffer significant variation in the menstrual cycle, especially when measuring small antral follicles (2‐6mm).
Os testes de reserva ovariana têm o objetivo de prever a resposta dos ovários nos ciclos de fertilização in vitro.1 Métodos clínicos que avaliam essa função têm sido estudados e dentre eles destacam‐se a contagem de folículos antrais (CFA) e o hormônio anti‐Mülleriano (HAM).2,3 Vários estudos sugerem a estabilidade dos níveis do HAM ao longo dos ciclos menstruais,1,4–6 enquanto outros trabalhos mostram uma variação significativa nos níveis desse hormônio.7–9 Outros estudos mostram que o HAM tem forte correlação com a contagem de folículos antrais pequenos.10
Embora a CFA e o HAM pareçam ser igualmente preditivos da resposta ovariana durante os ciclos de reprodução assistida,11,12 a CFA é comumente feita por causa da disponibilidade de aparelhos de ultrassom em clínicas especializadas e da relativa facilidade com que pode ser executada.10 Atualmente, ela é feita com a contagem dos folículos de 2 a 10mm em ambos os ovários durante a fase folicular precoce do ciclo menstrual, fase essa definida como do segundo ao quinto dia.13–17
Não há consenso sobre o tamanho dos folículos que devem ser incluídos na contagem total dos folículos antrais.18 Estudos atuais têm usado folículos que medem de 5 a 8mm,13,19 2 a 6mm,20,21 2 a 8 mm22 e 2 a 10 mm23,24 de diâmetro. A contagem dos folículos antrais subdividida em grupos de acordo com o tamanho dos folículos mostra que os grupos de menor tamanho podem melhorar o valor preditivo da CFA.10
A medição manual do número e do diâmetro de cada folículo, especialmente dos menores, é trabalhosa. Existe uma variação intra e interobservador na contagem de folículos antrais que se torna ainda mais evidente quando o diâmetro do folículo é incluído.10 O ultrassom tridimensional com suas várias opções de visualização melhora a confiabilidade da CFA e sua validade para prever o número de oócitos que podem ser recrutados para o tratamento de reprodução assistida.25–27
Foi introduzido um software, chamado SonoAVC, que calcula automaticamente as medidas e o volume dos folículos.28,29 Um trabalho recente mostrou que o SonoAVC com pós‐processamento proporciona um alto grau de confiabilidade na CFA quando feita por dois examinadores diferentes ou pelo mesmo observador em dois momentos distintos. É superior tanto à técnica convencional bidimensional quanto à técnica manual de ultrassom tridimensional.30
Estudos sobre confiabilidade e validade desses testes de reserva ovariana são baseados em testes feitos durante a fase folicular precoce do ciclo menstrual. Essa janela de oportunidade relativamente pequena é restrita tanto para as pacientes quanto para as clínicas que executam os testes. Um teste ideal de reserva ovariana, além de confiável, deve ser independente do momento em que é feito no ciclo menstrual. Acredita‐se que a CFA pode ser considerada como o teste de primeira escolha para avaliar pacientes com baixa reserva ovariana,1 principalmente quando considerados folículos de menor diâmetro.
Este trabalho teve como objetivo fazer uma revisão sistemática dos estudos que avaliaram a variação da contagem de folículos antrais ovarianos durante o ciclo menstrual de mulheres eumenorreicas.
MétodoRevisão sistemática de trabalhos publicados de 1998 a 2013. As bases de dados consultadas foram Medical Literature Analysis and Retrieval Systen Online (Medline), Literatura Latino‐Americana e do Caribe (Lilacs) e Scientific Eletronic Library Online (Scielo). Os descritores usados foram reserva ovariana, contagem de folículos antrais, ciclo menstrual e variação intraciclo.
Foram incluídos todos os estudos que avaliaram a variação da contagem de folículos antrais ovarianos no ciclo menstrual. Foram excluídos os trabalhos que incluíram mulheres com ciclos menstruais irregulares, cirurgia pélvica prévia, malformações do aparelho reprodutor, doenças ovarianas e doenças uterinas. A seleção dos estudos foi feita por dois autores de forma independente e cega. Nos casos em que houve discordância entre os dois autores, a opinião de um terceiro autor foi empregada.
Identificaram‐se 920 artigos publicados a partir dos descritores e filtros usados. Procedeu‐se à leitura dos resumos e foram selecionados 49 artigos que relacionavam a variação da contagem de folículos antrais durante o ciclo menstrual. A partir desses 49 artigos foram selecionados três que obedeciam ao critério de inclusão definido para este estudo. Após análise das listas de referências dos artigos selecionados verificou‐se a possibilidade de inclusão de mais artigos que abordavam o tema. Foram incluídos mais quatro artigos que obedeciam aos critérios de inclusão propostos e totalizaram‐se sete analisados no estudo (fig. 1).
Para a análise dos dados fez‐se a tabulação dos estudos encontrados com a distribuição de artigos por ano e por resultados. Como se trata de revisão de dados da literatura, não foi necessária aprovação de Comitê de Ética em Pesquisa.
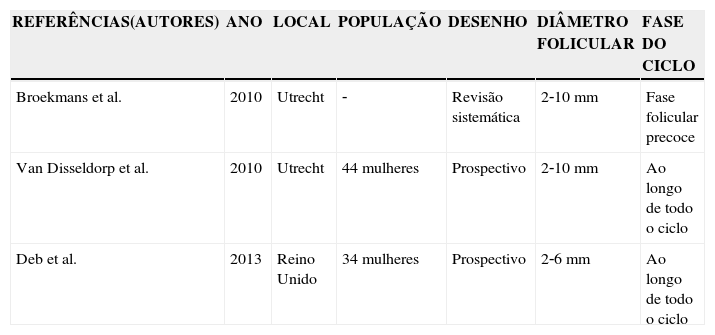
ResultadosA partir dos dados dos artigos foi construída a tabela 1 para análise comparativa. Pode‐se observar que dos sete artigos analisados, quatro usaram desenho prospectivo, um se tratava de revisão sistemática e dois consistiam em estudos experimentais. Não foram incluídos na tabela 1 os dois estudos experimentais, assim como os dois prospectivos, por não fornecerem dados para análise comparativa.
Síntese dos dados encontrados na revisão sistemática
| REFERÊNCIAS(AUTORES) | ANO | LOCAL | POPULAÇÃO | DESENHO | DIÂMETRO FOLICULAR | FASE DO CICLO |
|---|---|---|---|---|---|---|
| Broekmans et al. | 2010 | Utrecht | ‐ | Revisão sistemática | 2‐10 mm | Fase folicular precoce |
| Van Disseldorp et al. | 2010 | Utrecht | 44 mulheres | Prospectivo | 2‐10 mm | Ao longo de todo o ciclo |
| Deb et al. | 2013 | Reino Unido | 34 mulheres | Prospectivo | 2‐6 mm | Ao longo de todo o ciclo |
O estudo mais antigo data de 2002 e foi feito por Luca et al.,31 na Espanha, enquanto o mais atual foi publicado em Nottingham por Deb et al.,32 em 2013. A maior população estudada foi na Holanda, por Haadsma et al.,21 que avaliaram 474 pacientes. A menor, com 36 mulheres, foi estudada nos EUA por Deb et al., em 2013.32
DiscussãoNo estudo de Broekmans et al.,33 especialistas em medicina reprodutiva, médicos e cientistas se reuniram para fazer uma revisão sistemática da literatura sobre folículos antrais, a fim de padronizar a medição e a contagem de folículos antrais na prática clínica. Os autores concordaram que durante a fase folicular precoce os folículos antrais saudáveis tendem a ser de 4 a 6mm de diâmetro. É possível que a contagem exclusiva desses folículos evite a inclusão de folículos atrésicos e a contagem superestimada de folículos antrais. O estudo comenta que a contagem de folículos antrais pequenos (2‐5mm) tem forte correlação com a contagem de folículos antrais maiores (2‐10mm) e que apenas alguns folículos de 6 a 10mm são encontrados na fase folicular precoce. Portanto, para evitar o processo moroso de medição de cada folículo, foi recomendado que a contagem de folículos antrais de 2‐10mm de diâmetro proporcionaria um método mais prático para a avaliação da CFA na prática clínica.
Eles verificaram ainda que, mesmo quando os resultados da CFA são categorizados por tamanho, houve flutuações na contagem ao longo do ciclo menstrual. Esse achado contraindica a CFA em qualquer fase do ciclo menstrual. Por isso, a recomendação dos autores foi que a CFA fosse feita na fase folicular precoce para minimizar o efeito da flutuação intraciclo e reduzir a probabilidade de incluir incorretamente cistos ovarianos ou corpos lúteos coexistentes na CFA.
Em 2010, van Disseldorp et al.1 fizeram estudo prospectivo com 44 mulheres que comparou a CFA e o HAM quanto à sua estabilidade ao longo de um ciclo ovariano completo. Segundo os autores, a CFA de 2‐5mm mostrou maior flutuação ao longo do ciclo do que a CFA de 2‐10mm. Dessa forma, caso a CFA seja usada para o rastreio da reserva ovariana, defende‐se a contagem de folículos de 2‐10mm, dada sua maior estabilidade ao longo do ciclo.
Essa padronização vai ao encontro do estudo de Broekmans et al.,33 que defenderam a tese de que a CFA seja feita em folículos de 2‐10mm de diâmetro. Porém, no trabalho de Broekmans et al. essa contagem deve ser feita na fase folicular precoce do ciclo menstrual. Já no trabalho de van Disseldorp et al.,1 ela pode ser feita em qualquer fase do ciclo.
O estudo prospectivo de Jayaprakasan et al.,10 feito com 113 mulheres, examinou a relação entre os folículos antrais, estratificados de acordo com o tamanho de cada folículo, e o HAM. A estratificação dos folículos antrais de acordo com o tamanho foi feita dividindo‐os em grupos de 2‐4mm, 2‐5mm, 2‐8mm e 2‐10mm. Os dados desse estudo mostraram que os folículos menores, que medem 2‐3mm, > 3‐4mm, > 4‐5mm e > 5‐6mm, não só se correlacionam com níveis séricos de HAM, mas também com o número de oócitos maduros recuperados após a estimulação ovariana controlada. Por outro lado, o número de folículos antrais maiores que medem > 6‐10mm demonstrou uma fraca correlação com HAM e a resposta ovariana.
A correlação positiva entre a contagem de folículos antrais menores (2‐6mm) e o HAM, encontrada no artigo de Jayaprakasan et al.,10 corrobora os achados do estudo de Weenen et al.,34 feito com tecido ovariano de 12 mulheres submetidas à ooforectomia. Nesse estudo, foi avaliada a expressão do HMA pela imuno‐histoquímica e não foi detectado HAM em folículos primordiais. Já em folículos na fase primária, o HAM foi detectado. Quanto à fase secundária, em aproximadamente 75% dos folículos com quatro a seis camadas de células da granulosa foi positiva ou fortemente positiva para presença do HAM. A coloração mais forte, que indica grande presença de HAM, foi notada em folículos pré‐antrais (mais de seis camadas de células da granulosa) e folículos antrais com menos de 4mm. Dessa forma, desde a fase primária os folículos expressam HAM, porém essa expressão desaparece em folículos antrais de grande porte (6‐8mm) que serão submetidos ao recrutamento cíclico.
Assim como nos estudos de Jayaprakasan et al.10 e Weenen et al.,34 no trabalho de Haadsma et al.21 foi reforçada a hipótese de que a população de folículos antrais menores representa o quantitativo da reserva ovariana funcional. Nesse estudo, feito com 474 pacientes inférteis, observou‐se que a idade esteve associada a uma constante diminuição no número de folículos de 2‐6mm, enquanto que o número de folículos de 7‐10mm permanecia constante. Na população estudada, o número de folículos de 2‐6mm declinou com a idade, enquanto o número de folículos grandes (7‐10mm) foi baixo e manteve‐se relativamente constante com a idade.
É provável que a maioria desses folículos antrais maiores seja atrésica, como foi mostrado no estudo de Luca et al.,31 e não reflita verdadeiramente a reserva ovariana funcional. Esses achados sugerem que o número total de folículos que medem 2‐6mm seja o grupo mais apropriado a ser considerado na CFA total, em detrimento dos outros grupos de 2‐5mm, de 2‐8mm e de 2‐10mm, e pode melhorar a capacidade da CFA de predizer a má resposta ovariana durante o tratamento de fertilização in vitro (FIV).
Deb et al.32 fizeram estudo prospectivo para quantificar as variações intraciclo na contagem de folículos antrais estratificados por grupos de diferentes tamanhos, volume ovariano, HAM, FSH, LH e estradiol em 34 mulheres voluntárias saudáveis com ciclos ovulatórios normais. Houve uma variação intraciclo significativa do FSH, LH, estradiol e volume ovariano, com uma acurácia aumentada quando essas variáveis foram medidas na fase folicular precoce. Por outro lado, a contagem de folículos antrais e o HAM mantiveram‐se mais estáveis ao longo do ciclo. Houve apenas uma pequena, mas significativa, variação no HAM, principalmente na metade da fase lútea. Na estratificação dos folículos antrais em grupos pelo tamanho – os pequenos compreenderam os de 2‐4mm até os > 4 a 6mm e os maiores os > 6 a 10mm – constatou‐se que não houve variação intraciclo nos folículos antrais pequenos que mediram até 6mm, mas houve uma variação significativa nos folículos antrais grandes, com dimensão maior do que 6mm.
Dessa forma, o estudo de Deb et al.32 está em consonância com os estudos de Jayaprakasan et al.,10 Weenen et al.34 e Haadsma et al.21 Eles concluíram que a reserva ovariana medida pela contagem de folículos antrais pequenos (2‐6mm) mostrou menor variação intraciclo. De acordo com os três primeiros autores há uma correlação positiva entre o HAM e a contagem de folículos antrais pequenos.
Deb et al.32 notaram um pequeno aumento nos níveis do HAM, principalmente na metade da fase lútea, que sugeriu um novo recrutamento de folículos pré‐antrais e antrais precoces. Portanto, esses níveis aumentados poderiam prever de forma mais adequada a real resposta ovariana, mas não necessariamente a resposta à estimulação do ovário quando comparados com a contagem de folículos antrais pequenos. Futuros estudos destinados a avaliar a capacidade de previsão de resposta ovariana para o tratamento de reprodução assistida devem considerar a feitura desses testes em diferentes fases do ciclo menstrual.
A diferença entre os estudos de van Disseldorp et al.1 e Deb et al.32 pode ser devida à diferença na metodologia dos trabalhos. No trabalho de Deb et al.32 foi usado o método de ultrassom 3D (SonoAVC), em que é feita a contagem automatizada dos folículos antrais seguida de um pós‐processamento. No trabalho de van Disseldorp et al.1 foi usado o método manual de ultrassom 2D, que pode superestimar o tamanho dos folículos.30,35
No trabalho de Broekmans et al.,33 um dos motivos pelos quais os especialistas indicaram a medição de folículos de 2‐10mm, além da correlação de folículos antrais pequenos (2‐5mm) com folículos antrais maiores (2‐10mm), foi a praticidade e a redução da morosidade proporcionadas pela medição de folículos antrais maiores. O surgimento de novas técnicas de ultrassom, como o SonoAVC, pode ser um facilitador para a contagem de folículos de menor diâmetro, já que torna a medição menos trabalhosa.
A maioria dos dados bibliográficos levantados concorda com que a reserva ovariana medida pela contagem de folículos antrais pequenos (2‐6mm) e HAM apresenta menor variação intraciclo. É consenso entre os artigos que o HAM não sofre flutuação ao longo do ciclo menstrual, mesmo no estudo de Deb et al.,32 em que houve uma variação pequena, mas significativa, na metade da fase lútea. Concluiu‐se que isso não altera a confiabilidade do teste de prever a resposta ovariana. Em alguns artigos houve uma correlação positiva entre o HAM e a contagem de folículos antrais, especialmente os folículos pequenos (< 6mm), o que indica que a contagem de folículos antrais menores do que 6mm pode ser feita em qualquer fase do ciclo menstrual.
ConclusãoA CFA parece não sofrer variação significativa em um ciclo menstrual, principalmente quando contados apenas os folículos antrais pequenos (2‐6mm). Todavia, ainda não há consenso sobre a estabilidade da CFA ao longo do ciclo. Dessa forma, mais estudos são necessários para esclarecer se a CFA deve ser feita apenas na fase folicular precoce ou se pode ser feita em qualquer fase do ciclo menstrual. Novas técnicas de ultrassom com o uso do modo tridimensional demonstraram maior sensibilidade na detecção de folículos antrais menores, o que pode aumentar a confiabilidade dos estudos que envolvem a CFA.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Trabalho desenvolvido no Ambulatório de Infertilidade da Faculdade de Medicina da Pontifícia Universidade Católica de Goiás, Goiânia, GO, Brasil.