La reparación del manguito rotador tiene una alta tasa de fracaso. Se investiga si la aplicación de células troncales derivadas de lipoaspirado mejorará la resistencia de la reparación y recreará la entesis original.
Material y métodosEstudio experimental en 44 ratas BDIX con sección y reparación con sutura del tendón supraespinoso y asignación aleatoria a uno de 3 grupos: grupo A, nada (control); grupo B, aplicación local de vehículo de fibrina; y grupo C, aplicación de 2x106 células troncales derivadas de lipoaspirado. Se realiza estudio mecánico en célula de carga y estudio histológico en hematoxilina-eosina.
ResultadosEn el estudio mecánico no hubo diferencias entre grupos. La carga hasta el fracaso aumentó de los grupos de 4-8 semanas. En el estudio histológico se observó la unión hueso-tendón mediante un tejido fibrovascular desorganizado. En el grupo C se observó un aumento de células plasmáticas a las 4 y 8 semanas.
ConclusiónLa utilización de células troncales derivadas de lipoaspirado no recrea la organización celular de la entesis ni mejoran las propiedades biomecánicas de la misma. Son necesarios más estudios para investigar técnicas que mejoren la cicatrización del tendón.
Rotator cuff repairs have shown a high level of re-ruptures. We hypothesized that the use of adipose-derived stem cells (ASC) could improve the biomechanical and histological properties of the repair.
Material and methodsControlled experimental study conducted on 44 BDIX rats with section and repair of the supraspinatus tendon and randomization to one of three groups: group A, no intervention (control); group B, local applications of a fibrin sealant; and group C, application of the fibrin sealant with 2x106 ASC. At 4 and 8 weeks a biomechanical and histological analysis was performed.
ResultsThere were no differences in load-to-failure at 4 and 8 weeks between groups. The load-to-failure did increase between week 4 and week 8. Histologically the tendon-to bone union showed a disorganized fibrovascular tissue. Group C showed a different inflammatory pattern, with less presence of neutrophils and more presence of plasma cells.
ConclusionThe use of ASC does not improve the biomechanical or histological properties of the repair site. More studies are needed to improve techniques that enhance the healing site of the repair.
La existencia de nuevas re-roturas después de la reparación del manguito rotador continúa siendo un problema frecuente. Algunos estudios señalan una incidencia de hasta el 94% en roturas masivas1,2. Además, los resultados funcionales de los pacientes con una reparación íntegra son mejores que aquellos en los que la reparación fracasa3.
La mayor parte de las roturas demuestran cambios degenerativos en la biología local de los tendones que incluyen, entre otros, un incremento en la apoptosis celular y modificaciones en los niveles de metaloproteasas de la matriz y de los distintos factores de crecimiento. La reparación del manguito rotador no consigue recrear la estructura nativa de la entesis ni su resistencia biomecánica original4,5.
Los 2 factores que influyen en la curación de la entesis incluyen la resistencia mecánica de la reparación y el ambiente biológico que influye en la cicatrización. Se ha realizado mucho esfuerzo en aumentar la resistencia mecánica de las reparaciones, sin embargo, existe menos información sobre la modificación del ambiente biológico local mediante el uso de terapias que mejore la cicatrización6. El uso de células troncales de origen mesenquimal ha sido una de las estrategias que se ha explorado para aumentar biológicamente estas reparaciones7. Las células troncales son células de tipo fibroblástico que son capaces de diferenciarse hacia múltiples tipos celulares incluyendo osteoblastos y condrocitos. Las 2 fuentes principales son la médula ósea y el tejido adiposo, que es más accesible y de mayor poder proliferativo8.
Nuestra hipótesis es que la aplicación local de células troncales derivados de lipoaspirado (CTDL) en un modelo animal de manguito rotador mejoraría la resistencia mecánica de la reparación y la estructura histológica de la entesis.
Material y métodosPara el estudio de las uniones tendón-hueso del modelo de manguito rotador se han empleado un total de 24 ratas singénicas BDIX con una edad comprendida entre 6-8 semanas para el estudio biomecánico y 18 animales para el estudio histológico. El estudio fue aprobado por el Comité Ético de Experimentación animal y se siguieron todas las normas de la legislación internacional para la experimentación animal (86/609/CEE).
Obtención de las células troncales derivadas de lipoaspirado (Apéndice A)El método para obtener células troncales derivadas de lipoaspirado ha sido publicado previamente9. Brevemente, las células fueron extraídas del epiplón y grasa subcutánea 2 animales y se les practicó un método de disgregación mecánica y digestión celular enzimática. Seguidamente se seleccionó la fase celular, aislándose las células troncales. Se comprobó la estirpe celular mediante la diferenciación de las células a adipocitos, condrocitos y osteocitos y mediante estudios de citometría de flujo de los marcadores de membrana (CD 90, CD 73 y CD 105 positivas y CD 34, CD 44 negativas). Con posterioridad se expandió las células en un medio adecuado y se realizó el recuento celular previamente a la aplicación.
Técnica quirúrgicaLa técnica quirúrgica ha sido descrita con anterioridad10. Brevemente, a los animales se les practicó una incisión longitudinal sobre la parte proximal de la pata delantera con una sección horizontal del deltoides, exponiendo el manguito rotador de la rata. Se les practicó la sección del tendón del supraespinoso del troquíter y se aleatorizó a uno de 3 grupos por un sistema generado electrónicamente (Excel, Microsoft, Redmond, VA, EE. UU.). El primer grupo consistió en la reparación del tendón supraespinoso al troquíter a través de un túnel óseo anteroposterior utilizando una sutura irreabsorbible monofilamento de 5/0. El segundo grupo consistió en una reparación idéntica con un vehículo de fibrina aplicado sobre la zona de reparación (Tissucol, Baxter, Deerfield, IL, EE. UU.). El tercer grupo consistió en la reparación tendinosa y aplicación de 2x106 células troncales embebidas en el vehículo de fibrina. Después de la asignación al tipo del grupo experimental se realizó el cierre del deltoides con sutura reabsorbible y el cierre de la piel con sutura de seda 3/0.
Estudio histológico y biomecánico (Apéndice B)Los animales fueron sacrificados a las 4 y las 8 semanas después de la reparación. Para preparar los especímenes para el estudio biomecánico se individualizó la escápula, la unidad miotendinosa supraespinosa y el húmero y se introdujo en una jeringa de 2ml en un medio de cemento óseo de polimetilmetacrilato (PMMA) (CMW-1, De-Puy, Johnson & Johnson,Warsaw, IN, EE. UU.) para poder incluirla en una célula de carga electrohidráulica lineal (ControlTest, Servosis, Madrid, España). Los especímenes se precargaban a 0,1N y se probaban hasta el fracaso a una velocidad de 14 micras/s. Se recogió la carga máxima hasta el fracaso y el sitio de fracaso. La rigidez de la muestra se calculó determinando la parte lineal de la pendiente ascendente de la curva de carga-desplazamiento7.
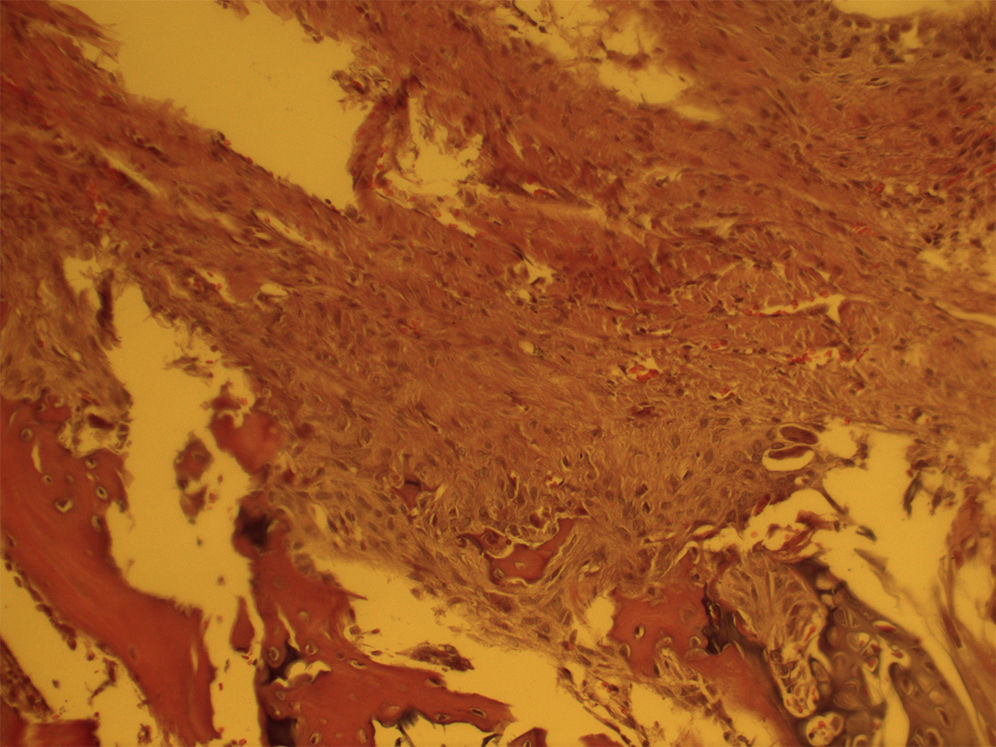
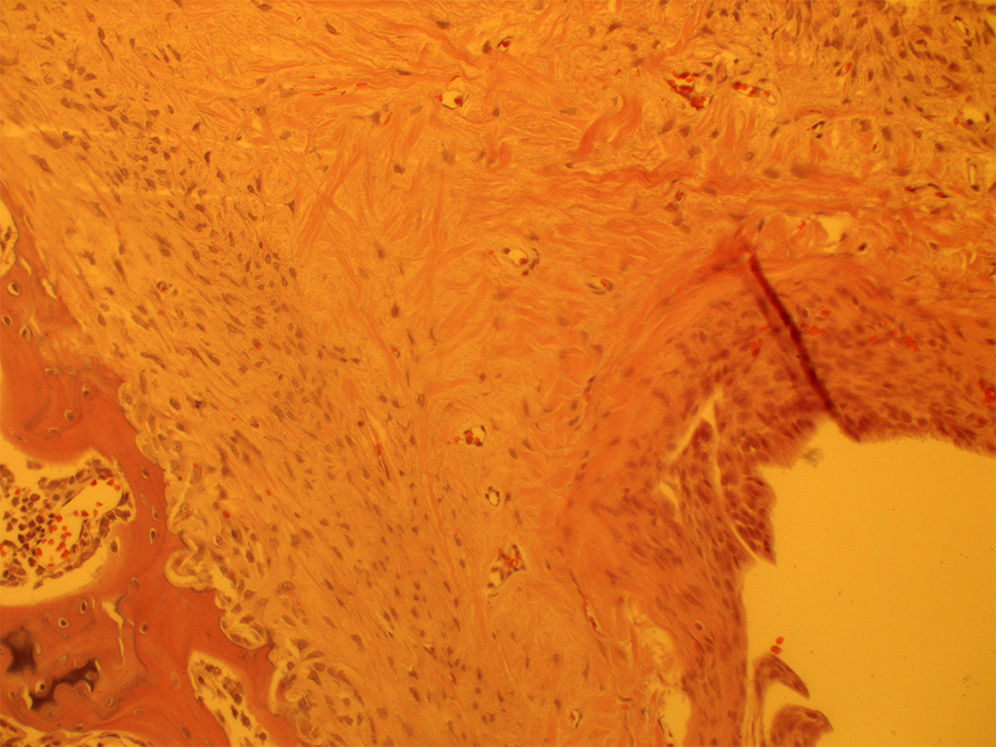
Para el estudio histológico se individualizó la escápula y miembro superior hasta el codo y se fijó en una solución de formalina al 10%, se descalcificó con una solución decalcificante (EDTA) y se embebió en parafina para la realización de los cortes histológicos. Se realizaron cortes de 5 micras en el plano coronal y se tiñeron con hematoxilina y eosina. El estudio histológico se realizó por un patólogo que desconocía el grupo experimental al que pertenecía la muestra. Se realizó el estudio en 2 momentos diferentes para dar mayor homogeneidad al estudio. Cuando hubo discrepancias se realizó una tercera lectura del estudio. Se prestó especial interés el troquíter, la inserción de la reparación tendón-hueso y el tendón supraespinoso per se utilizando un microscopio óptico. Se procedió al estudio de las cualidades histológicas microscópicas como infiltrado infla matorio, vascularización y organización celular y fibrilar de la entesis.
ResultadosDos animales fallecieron a consecuencia de complicaciones anestésicas y fueron repuestos para completar el número experimental predeterminado. Todos los animales habían conseguido una marcha normal a los 7 días de la intervención. No hubo otras complicaciones postoperatorias.
En el estudio biomecánico no hubo diferencias significativas entre ninguno de los grupos para ninguna de las variables estudiadas. La carga hasta el fracaso media fue de 12,83N para el grupo 1, 11,57N para el grupo 2 y 11,72 para el grupo 3 a las 4 semanas (p=0,67) (tabla 1). En el grupo analizado a las 8 semanas la carga hasta el fracaso fue de 15,11N para el grupo 1, 15,94N para el grupo 2 y 14,35N para el grupo 3 (p=0,88) (tabla 2).
Resultados biomecánicos de la reparación del tendón del supraespinoso a las 4 semanas
| Grupo | Carga hasta el fracaso (n) | Deformidad máxima (mm) | Rigidez (n/mm) | Energía absorbida (J) |
|---|---|---|---|---|
| Control | 12,83±3,79 | 3,99±2,11 | 5,27±3,11 | 0,069±0,035 |
| Fibrina | 11,57±2,08 | 4,21±1,72 | 3,50±1,68 | 0,051±0,019 |
| CMDL | 11,72±3,98 | 5,13±1,78 | 2,93±1,07 | 0,080±0,080 |
| p | 0,67 | 0,41 | 0,11 | 0,47 |
Resultados biomecánicos de la reparación del tendón del supraespinoso a las 8 semanas
| Grupo | Carga hasta el fracaso (n) | Deformidad máxima (mm) | Rigidez (n/mm) | Energía absorbida (J) |
|---|---|---|---|---|
| Control | 15,11±5,75 | 8,32±4,83 | 4,10±1,90 | 0,120±0,051 |
| Fibrina | 15,94±5,50 | 5,09±3,10 | 4,30±1,94 | 0,079±0,067 |
| CMDL | 14,35±4,16 | 6,46±1,69 | 3,53±1,61 | 0,096±0,37 |
| p | 0,88 | 0,23 | 0,79 | 0,33 |
El examen de necropsia no reveló diferencias significativas entre los grupos de estudio, si bien se apreciaba una mayor robustez del tejido en los grupos sacrificados a las 8 semanas comparados con los de 4 semanas de evolución.
En el estudio histológico se observó una entesis inmadura en los grupos de 4 semanas de evolución con una estructura más desorganizada y altamente celular con abundancia de células inflamatorias, en comparación con los grupos de 8 semanas de evolución que presentaban una estructura algo más organizada con una mejor alineación de las fibras de colágeno sin diferencias entre grupos (fig. 1). Las muestras analizadas con células mesenquimales únicamente presentaban una menor respuesta inflamatoria a las 4 semanas aunque no realizamos ningún estudio adicional para cuantificar esa diferencia. Esta diferencia desaparecía en los grupos a las 8 semanas (fig. 2). Se observó la presencia de células marcadas con proteína verde fluorescente a las 4 semanas.
La alta tasa de fracaso tras la reparación quirúrgica ha planteado la existencia de un problema biológico intrínseco del tendón. La entesis no se regenera con la reparación quirúrgica sino que es sustituida por un tejido cicatricial con menor resistencia mecánica que el tejido nativo lo cual puede predisponer al mismo a sufrir nuevas roturas5. El objetivo de las terapias biológicas es mejorar el entorno biológico alrededor de la reparación para restaurar la estructura microscópica de la inserción nativa. Se han utilizado factores de crecimiento y matrices extracelulares con resultados modestos11–15. La terapia celular podría desempeñar un papel importante en el tratamiento de lesiones de los tendones del manguito rotador7,16,17.
El presente trabajo planteaba la hipótesis de que la aplicación local de células troncales derivadas de lipoaspirado mejoraría la resistencia biomecánica de la reparación como consecuencia de una organización celular mejorada. Sin embargo, los resultados del estudio no apoyan esta hipótesis.
Las células madre mesenquimales provenientes de médula ósea han mejorado la cicatrización de tendón al hueso en modelos experimentales previos de ligamento cruzado de rodilla y de flexor hallucislongus en conejos16,17. El uso aislado de células madre derivadas de médula ósea aisladas no mejoraba la histología ni las propiedades biomecánicas de una reparación del manguito rotador en ratas. Las posibles causas aducidas incluían la existencia de un área de contacto pequeña entre el tendón y el hueso, la no existencia de una inmovilización postoperatoria y la posible insuficiente señalización molecular necesaria para lograr la cicatrización de un área tan compleja, lo cual señala la complejidad biológica de la reparación de estas lesiones. La utilización de varias terapias biológicas combinadas parecen mejorar los resultados biomecánicos e histológicos7,18,19.
Las CTDL son accesibles fácilmente mediante una lipoaspiración, genéticamente estables, con un potencial proliferativo casi ilimitado e inmunoprivilegiadas al carecer del haplotipo HLA-DR. Guilak et al. han demostrado que estas células son capaces de reducir la inflamación, de diferenciarse y de inducir la revascularización20. En estudios en humanos han demostrado ser seguras y eficaces en el tratamiento de fístulas perianales y traqueoesofágicas21,22. No hemos observado complicaciones derivadas del uso de las células troncales y confirma la experiencia de otros autores23,24. Asumiendo una igualdad de resultados con las células madre derivadas de médula ósea, estas ventajas las hacen atractivas para su uso en la reparación del manguito rotador.
Las CTDL en nuestro modelo experimental no han mejorado la resistencia mecánica de la reparación ni la apariencia histológica de las mismas. A pesar de que algunos autores sugerían la posible influencia de las células mesenquimales a las 8 semanas de evolución, nosotros no hemos sido capaces de demostrar ninguna diferencia7. Tampoco encontramos diferencias significativas a las 4 semanas. Quizá un análisis a las 2 semanas demostrara una diferencia que nosotros no hemos podido detectar. El número de células utilizado ha sido igual a otros modelos utilizados y validados previamente pero existe la posibilidad de que el número de células sea insuficiente o bien que el sitio de reparación carezca de las señales moleculares necesarias para inducir la diferenciación de las células que aplicamos7,13,16. Otros autores han señalado la dificultad en conocer la dosis correcta y el vehículo adecuado para conseguir una verdadera regeneración tendinosa y no una cicatrización de la entesis25. Es posible que la dispersión de las células en un vehículo de fibrina no sea capaz de contener a las células localmente o que la dosis utilizada sea insuficiente o bien, que la complejidad de las señales moleculares necesarias para la reparación sin cicatriz no pueda ser reproducida con la adición de células aisladamente.
Son necesarios más estudios dedicados a combinar distintos inductores de la diferenciación celular para aumentar nuestro conocimiento actual sobre las particularidades de la cicatrización del manguito rotador.
Nivel de evidenciaNivel de evidencia I.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste proyecto ha sido financiado con una beca de la Sociedad Española de Cirugía Ortopédica y Traumatología (Beca N.° BE67322009).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Las células fueron obtenidas del tejido graso de 2 ratas adicionales de acuerdo a un protocolo descrito en humanos con modificaciones mínimas24. Brevemente, el lipoaspirado se lavó con suero salino tamponado con fosfato (PBS; Gibco, Invitrogen, Paisley, Reino Unido) y expuestas a 37°C durante 30 minutos a colágenas (tipo I; Gibco, Invitrogen). La actividad enzimática se neutralizó con la adición de suero bovino fetal al 10% (FBS; Gibco) y la mezcla obtenida se centrifugó a 300G durante 10 minutos. El remanente celular se trató con 160mM clorhidrato de amonio durante 10 minutos para provocar la lisis de cualquier eritrocito restante. Las células se lavaron y se suspendieron en un medio Eagle modificado por Dulbecco (DMEM) y un 10% de suero bovino fetal. Se llevó a cabo una tercera centrifugación y la suspensión celular resultante se filtró por un malla de nylon de 70μm. Posteriormente, el material obtenido se suspendía en un medio DMEM con glucosa y piruvato, suero bovino fetal al 10%, 2mM de glutamina al 1%, estreptomicina 10μm /ml y penicilina 1UI/ml. El producto obtenido se denominó fracción estromal vascular (VSF). Estas células fueron cultivadas en bandejas de 100mm con una concentración de 10-15cels/ml a una temperatura de 37°C en una atmósfera húmeda con un 5% de dióxido de carbono en un medio de DMEM con FBS al 10% y estreptomicina/penicilina al 1% (Gibco, BRL). El medio se cambió para retirar células no adheridas 24 horas después de la incorporación en la bandeja y luego cada 4 días. Par cultivos derivados las células se disgregaban con tripsina (v7v) al 0,05% en un salino tamponado con fosfato cuando se lograba una confluencia celular del 70-80%. Se realizaban estudios de caracterización celular por citometría de flujo analizando la expresión de los marcadores de superficie CD90, CD29, CD45 y CD11b para confirmar el fenotipo de ASC de las células cultivadas.
Se realizó un marcaje celular con proteína verde fluorescente (GFP) para el marcaje celular siguiendo las indicaciones del fabricante.
En los tiempos predeterminados se realizó la eutanasia con una inyección intracardiaca de potasio clorhídrico bajo anestesia general y se obtenían los especímenes para el estudio histológico. El espécimen consistía en la articulación glenohumeral completa incluyendo el músculo deltoides. Se fijaba mediante una solución de formaldehído al 4% y se descalcificaba en una solución EDTA durante 14-21 días y se embebía en parafina. Las muestras se analizaban en un microscopio óptico convencional. Las muestras marcadas con proteína verde fluorescente se analizaron con un microscopio invertido Leyca DMI 6000.
- 1.
Preparación de las muestras. Existían 3 grupos comparables en peso preoperatoriamente y en el momento del sacrificio. A las 4 y 8 semanas se practicó la eutanasia con una inyección intracardiaca de potasio clorhídrico bajo anestesia general y se obtenían los especímenes para el estudio biomecánico. Cada muestra se disecó para aislar la escápula el húmero y el tendón supraespinoso. El húmero se colocaba en una jeringa de 2mL y se fijaba con cemento de polimetilmetacrilato. Durante la polimerización del cemento y para evitar el daño producido por los efectos exotérmicos de dicha reacción el tendón era protegido en una solución salina. Los especímenes fueron congelados a una temperatura de -80°C en el momento del análisis biomecánico y se descongelaban a temperatura ambiente doce horas antes del ensayo.
- 2.
Ensayo biomecánico. El ensayo biomecánico se realizó en un aparato electromecánico específico consistente en un codificador lineal con un sensor de posición y 2 células de carga de 20N y 200N calibrado para la detección de pequeñas cargas. Los datos se registraban en el programa de software específico (PCD-2K) diseñado para Windows 7 obteniendo curvas de tensión-deformación, y realizando cálculos de la carga máxima hasta el fracaso (N), rigidez (N/mm2), energía absorbida (J) y deformación máxima (mm). La escápula se aseguraba en una de las células de carga con un soporte para permitir alinear el tendón con la dirección de carga apropiada. Los especímenes se precargaban a 0,10N y luego se cargaban hasta el fracaso del tendón a una tasa de 14μs-1.