: La traqueobronquitis aspergilar es una forma poco frecuente de aspergilosis pulmonar que afecta de forma casi exclusiva a los receptores de trasplante pulmonar. Se localiza únicamente a nivel bron-quial, sin afectación parenquimatosa concomitante. Es importante realizar un diagnóstico precoz para ini-ciar tratamiento médico y evitar las complicaciones de la vía aérea. Las estrategias actualmente empleadas en la profilaxis y el tratamiento disminuyen la incidencia y mejoran el pronóstico.
Caso clínico: Varón de 56 años sometido a trasplante pulmonar bilateral por enfermedad pulmonar obstruc-tiva crónica que en el trasplante inmediato desarrolló una traqueobronquitis aspergilar, a pesar de la profilaxis habitual con anfotericina B liposomal nebulizada. El diagnóstico se realizó mediante la broncoscopia de control, donde se observó una necrosis de la sutura bronquial derecha con estenosis de más del 50% de la luz bronquial por fibrina y material necrótico. Tanto en el broncoaspirado, como en la biopsia bronquial se aisló Aspergillus fumigatus, y se inició tratamiento médico con voriconazol y desbridamiento bronquial por broncoscopia. La broncoscopia de control a las 10 semanas de trasplante mostró resolución de las lesio-nes endobronquiales. Los cultivos del broncoaspirado también fueron negativos.
Conclusiones: La traqueobronquitis aspergilar es una forma de infección aspergilar característica del receptor de trasplante pulmonar. El diagnóstico y el tratamiento precoz son importantes, y el tratamiento de elección es el voriconazol y el desbridamiento local. © 2011 Revista Iberoamericana de Micología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
: Aspergillus tracheobronchitis is an uncommon cause of pulmonary aspergillosis and almost exclusively affects lung transplant recipients. There is no lung tissue involvement, thus the tracheobron-chial tree is only affected. Patients are asymptomatic, so it is important to make an early diagnosis to prevent progression of the infection and airway complications. Several prophylaxis and treatment strategies have proven to improve the prognosis.
Clinical case: This is the case of a 56 year-old man who underwent bilateral lung transplant for chronic obstructive pulmonary disease (COPD) and developed Aspergillus tracheobronchitis. He received the usual prophylaxis with nebulized liposomal amphotericin B every 48h. Routine bronchoscopy performed 2 weeks after transplantation showed inflammation with the presence of pseudomembranes that produced a 50% stenosis of the right bronchial anastomosis. Biopsy of the pseudomembranes and bronchial aspirate yielded Aspergillus fumigatus. The patient started treatment with voriconazole twice a day, bronchial debride-ment through bronchoscopy was carried out, and the treatment with nebulized liposomal amphotericin B was continued every other day. Ten weeks later, there were no endobronchial lesions and the bronchial aspirate cultures were negative.
Conclusions: Aspergillus tracheobronchitis is a complication of the lung transplant recipient. Early diagnosis and prompt antifungal therapy, including new antifungal agents and local debridement, may significantly improve the outcome.
La traqueobronquitis aspergilar (TA) es una forma poco frecuente de aspergilosis pulmonar (AP) que afecta casi de forma exclusiva a los receptores de trasplante pulmonar. La localización de las lesiones es únicamente bronquial, sin afectación parenquimatosa concomitante, por lo que la mortalidad es menor que en la AP invasiva (API). Sin embargo, para evitar la progresión de la enfermedad y complicacio-nes en la vía aérea, es importante realizar un diagnóstico precoz para iniciar el tratamiento en fases iniciales de la enfermedad, en las que el paciente se encuentra con frecuencia asintomático. Existen dife-rentes estrategias de profilaxis y tratamiento que han demostrado disminuir su incidencia y mejorar el pronóstico. Presentamos el caso de un paciente sometido a trasplante bilateral por enfermedad pulmonar obstructiva crónica (EPOC) que desarrolló TA en el posopera-torio inmediato.
1Caso clínicoVarón de 56 años de raza blanca, sometido a trasplante pulmonar bilateral por EPOC en noviembre de 2009. Como antecedentes personales previos al trasplante destaca una historia de tabaquismo y alcoholismo moderado. En los cultivos de esputo de la valoración pretrasplante, se aisló exclusivamente microbiota habitual de vías al-tas. La intervención quirúrgica se realizó sin complicaciones y desde el postrasplante inmediato recibió tratamiento inmunosupresor con tacrolimus (concentraciones séricas de 13-18 ng/ml), micofenolato (concentraciones séricas de 3-5μg/ml) y corticoides en pauta des-cendente hasta 0,1mg/kg/día, complementado con inducción con dos dosis de basiliximax el primer y el cuarto día.
En el broncoaspirado (BAS) realizado el día del trasplante se aisló Candida albicans y Aspergillus fumigatus, por lo que, además de la profilaxis habitual con anfotericina B liposomal nebulizada (25mg cada 48h), se añadió al tratamiento voriconazol (200mg por vía in-travenosa cada 12h).
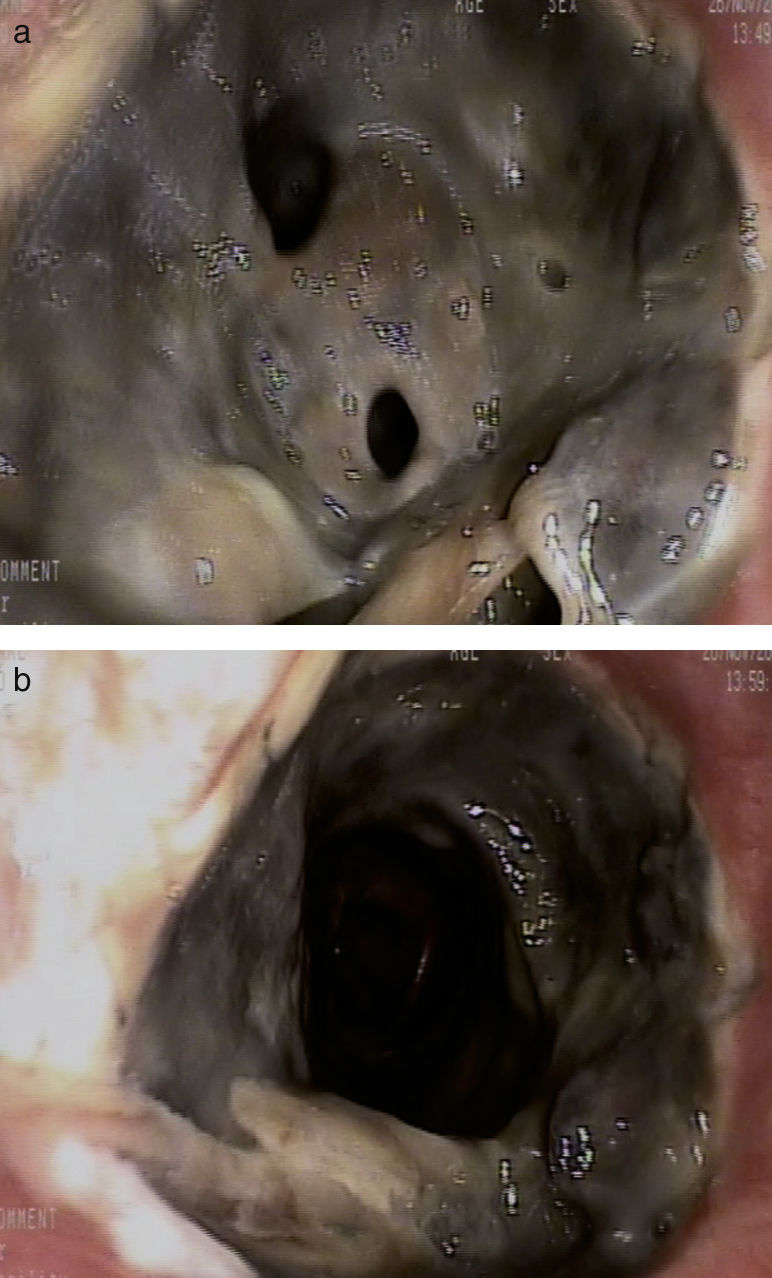
La evolución clínica del paciente fue favorable. Sin embargo, en la fibrobroncoscopia de control realizada 13 días después del trasplante, se observó una necrosis de la sutura bronquial derecha con estenosis de más del 50% de la luz bronquial por fibrina y material necrótico, que fue desbridado durante la exploración (fig. 1 ay 1b).
En el BAS obtenido en esa exploración se aisló nuevamente A. fumigatus, por lo que se continuó tratamiento de forma mantenida con voriconazol oral.
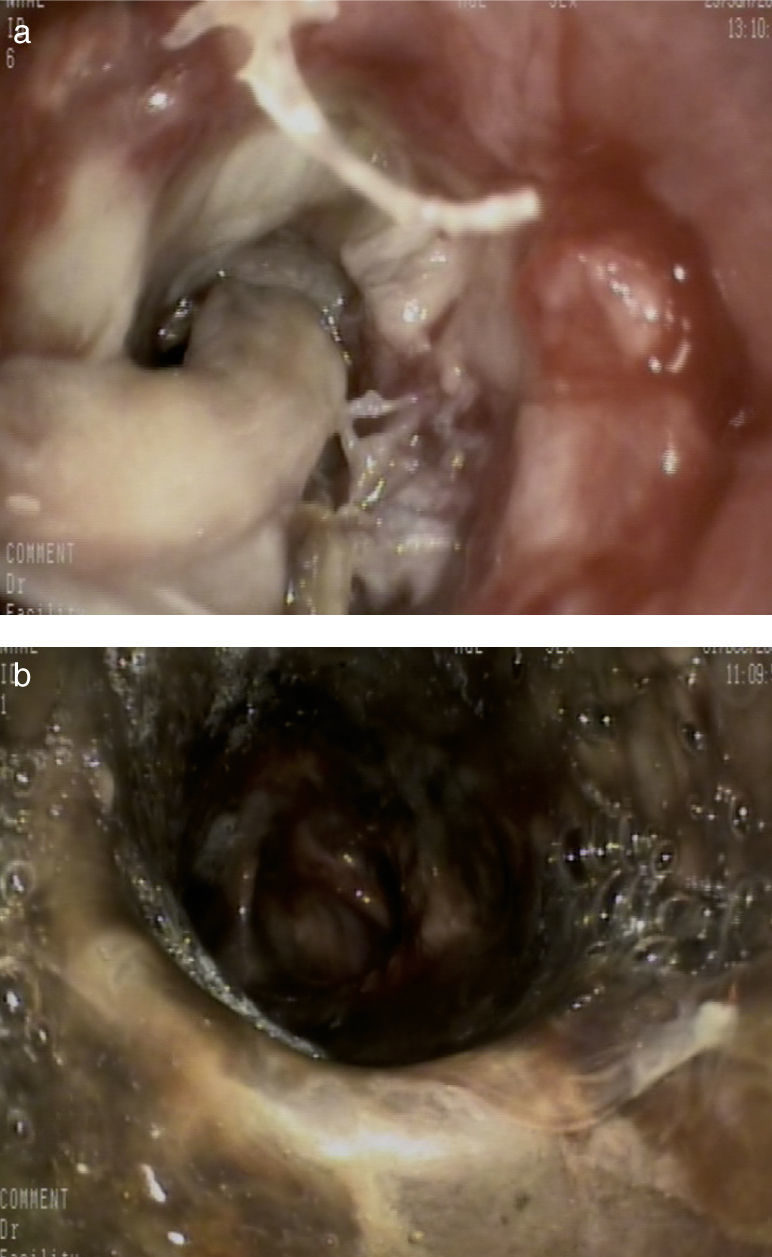
Además del tratamiento médico, se realizaron broncoscopias de repetición para vigilancia del aspecto de la vía aérea y desbridamien-to repetido, y en los días posteriores se observó abundante material blanquecino que cerraba completamente la luz del bronquio principal derecho (fig. 2a). Tras la limpieza de dicho material, se visualizó una necrosis bronquial que se extendía hacia el bronquio interme-diario (fig. 2b).
Se realizó una tomografía computarizada (TC) de tórax que mos-tró un pequeño derrame pleural del lado derecho, con una pequeña atelectasia subsegmentaria en el lóbulo inferior derecho y bron-quiectasias cilíndricas en el segmento anterior del lóbulo superior derecho (fig. 3).
El hemograma realizado en ese momento mostraba 4,2 x 103 leu-cocitos/μl, 228.000 x 103 plaquetas/μl y cifras de hemoglobina de 13,7g/dl. El paciente no presentaba insuficiencia renal ni alteración del perfil hepático y los valores de tacrolimus eran de 13,4 ng/ml y de micofenolato de 4,6 ng/ml.
La determinación del antígeno de galactomanano realizado de forma repetida fue negativa.
Tras un mes de tratamiento, el paciente evolucionó de forma favorable y fue dado de alta con voriconazol oral a dosis de 200mg cada 12h.
La broncoscopia de control a las 10 semanas de trasplante mostró resolución de las lesiones de la mucosa del bronquio principal derecho e intermediario, persistiendo a nivel de la sutura pequeñas placas
La imagen endoscópica observada en nuestro paciente era de una TA obstructiva con necrosis de la sutura y material endobronquial que obstruía completamente la entrada del bronquio principal de-recho (fig. 2).
El paciente estaba asintomático en el momento del diagnóstico. Esto es lo más frecuente, por lo que en muchas ocasiones el diagnóstico se realiza durante la broncoscopia protocolizada que se indica a las 2 o 3 semanas del trasplante [7].
Cuando existen síntomas, lo más frecuente es que el paciente pre-sente tos y disnea por la estenosis que se produce en la vía aérea y, en los casos más graves, hemoptisis que puede ser masiva por el desa-rrollo de fístulas broncoarteriales. También es habitual que no exista alteración radiológica, ya que la afectación es sólo endobronquial.
Durante las fases más precoces de la enfermedad, la radiografía de tórax suele ser normal. Es poco frecuente que aparezcan signos de estrechamiento de la luz bronquial. En nuestro caso, la afectación bronquial era muy llamativa con obstrucción completa del bronquio principal.
La determinación de galactomano en suero como signo indirec-to de infección por Aspergillus no se ha demostrado útil ya que, al igual que en otros tipos de AI, tiene una sensibilidad menor que en pacientes neutropénicos y su negatividad, como ocurrió en nuestro paciente, en ningún caso excluye el diagnóstico [12,13].
El diagnóstico de confirmación se realiza mediante fibrobron-coscopia. Esta técnica permite visualizar las lesiones características en el árbol bronquial (úlceras, necrosis o seudomembranas a partir de la sutura bronquial), así como la toma de muestras (BAS, lavado broncoalveolar [BAL] y biopsia) con aislamiento del hongo en los cultivos de las muestras de tejido o secreciones endobronquiales, así como la evidencia histopatológica de invasión tisular. En muchas ocasiones, la broncoscopia se realiza de forma protocolizada, estando el paciente asintomático. La realización de estas broncos-copias permite el diagnóstico precoz de la enfermedad y el inicio del tratamiento en fases iniciales. Portanto, muchos autores reco-miendan realizar broncoscopias protocolizadas en estos pacientes, especialmente durante las primeras semanas postrasplante [2]. También debe realizarse broncoscopia siempre que se aísle Aspergillus en el esputo durante los primeros 6-9 meses postrasplante para descartar la existencia de TA, por la asociación que existe entre la colonización de Aspergillus y el desarrollo de complicaciones de la vía aérea [3,11].
La profilaxis antifúngica universal en los receptores de trasplante pulmonar ha demostrado disminuir la incidencia y la mortali-dad de la AI [6]. Se han propuesto numerosas estrategias, sin que en la actualidad exista uniformidad ni en el fármaco utilizado ni en la duración de la profilaxis. Una de las más utilizadas en la actualidad es la anfotericina B liposomal nebulizada. Se considera una forma de profilaxis segura y eficaz, ya que se distribuye hasta las zonas más distales del árbol bronquial sin provocar nefrotoxicidad y consiguiendo concentraciones en el tracto respiratorio suficien-temente elevadas para inhibir el crecimiento de Aspergillus hasta 2 semanas después de su administración [8,9]. Además, dicho tratamiento podría ser más eficaz que los fármacos sistémicos, ya que actúa directamente en el ámbito endobronquial y disminuye el riesgo de colonización por Aspergillus, que como ya se ha comentado ante-riormente podría ser un factor de riesgo para el desarrollo de TA. El voriconazol se considera menos eficaz para evitar esta colonización [5]. Además, interfiere en el metabolismo de los inhibidores de la calcineurina y tiene una elevada hepatotoxicidad, por lo que es menos utilizado para la profilaxis.
Otros autores han propuesto diferentes pautas de profilaxis con azoles, solos o en combinación con anfotericina B nebulizada [5,6].
En nuestro centro, la profilaxis se realiza de forma universal con anfotericina B liposomal. Se administra cada 48h en el posoperatorio inmediato, en el que el riesgo de colonización y desarrollo de alte-raciones de la sutura es más elevado, para posteriormente adminis-
trarlo durante todo el seguimiento del paciente con una frecuencia quincenal, aumentando la frecuencia cuando se considera que hay riesgo elevado de desarrollo de AI.
Al igual que en la AI, el tratamiento de elección de la TA es el vo-riconazol [13]. Se ha propuesto realizar tratamiento combinado desde el principio con diferentes fármacos antifúngicos, combinando una equinocandina con un azol o con anfotericina B [4]. Sin embargo, to-davía no hay evidencia suficiente para recomendarlo de forma ge-neralizada en todos los pacientes. Dada la afectación endobronquial estricta que existe en la TA, la administración de antifúngicos de forma nebulizada también podría mejorar la evolución del paciente. Además, es muy importante realizar un desbridamiento endoscópico mediante broncoscopio flexible o rígido y, en ocasiones, llega incluso a precisarse tratamiento quirúrgico.
En nuestro caso, el paciente recibió tratamiento antifúngico desde el inicio, manteniendo la anfotericina B nebulizada cada 48h. Además se realizó desbridamiento mediante broncoscopia flexible, que se realizó de forma repetida durante los días siguientes al diagnós-tico, extrayendo abundante material que obstruía completamente la luz del bronquio principal derecho.
Debido a la elevada mortalidad de la AI y el posible retraso en el diagnóstico, se recomienda iniciar el tratamiento antifúngico en los pacientes con lesiones sospechosas de TA mientras se confirma el diagnóstico mediante el cultivo o el estudio anatomopatológico de las muestras obtenidas en la broncoscopia.
El tratamiento antifúngico debe ser prologado y mantenerse durante meses y, al menos, hasta 2 semanas después de la desaparición de las lesiones endobronquiales.
Además, deben realizarse broncoscopias de seguimiento tanto para desbridamiento de todo el material que obstruye la luz bron-quial, como para ver la resolución de las lesiones y la toma de muestras que demuestren la erradicación de Aspergillus en las secreciones o en la mucosa bronquial.
2ConclusionesLa TA es una forma de infección aspergilar característica del receptor de trasplante pulmonar. La ubicuidad de las esporas de Aspergillus y la colonización previa del donante o el receptor favorecen el desarrollo de la enfermedad. La coexistencia de factores locales predisponentes y la máxima inmunosupresión en el postrasplante inmediato favorecen el desarrollo de la enfermedad, a pesar del em-pleo de profilaxis universal.
Uncited references