La candidiasis vulvovaginal es una antigua enfermedad que aún en el mundo moderno continúa presentando una elevada incidencia. A pesar de los avances terapéuticos no existen siempre tratamientos efectivos y nuestro conocimiento sobre la patogenia de esta micosis es todavía incompleto. El presente artículo discute los avances más sobresalientes relacionados con los factores de virulencia del hongo, el papel de los mecanismos inmunológicos involucrados en la protección vaginal y los defectos genéticos responsables de la recurrencia de esta micosis. Los tratamientos actuales, el uso de nuevos agentes con actividad antifúngica y el desarrollo de estrategias como la vacunación son abordados en el contexto del complejo escenario que rigen las interacciones entre Candida y su hospedador.
Vulvovaginal candidiasis is an old disease that, even in a modern world, continues to have a high incidence. Despite the therapeutic advances, treatments are not always effective, and our understanding of the pathogenesis of this fungal infection is still incomplete. A discussion is presented in this article on the most significant developments related to the fungal virulence factors, the role of the immunological mechanisms involved in the vaginal protection, and the genetic alterations that confer susceptibility to the recurrent form of this mycosis. Current treatments, the use of new agents with antifungal activity, as well as the development of strategies, such as vaccination, are approached in the context of the complex scenario that governs the interactions between Candida and its host.
La infección vaginal por especies de Candida, conocida como candidiasis vulvovaginal (CVV), constituye una enfermedad inflamatoria aguda y una razón frecuente de consulta ginecológica. Afecta al 75% de las mujeres en edad reproductiva al menos una vez en su vida9. Esta enfermedad es la segunda causa más común de infecciones vaginales, precedida por las vaginosis bacterianas57. La forma recurrente de esta micosis, conocida como CVV recurrente (CVVR) se define por la presencia de al menos cuatro episodios sintomáticos en un periodo de doce meses9,56,57. En un estudio reciente que incluyó a 6.000 mujeres provenientes de Alemania, Francia, Italia, Reino Unido y Estados Unidos, Foxman et al.24 determinaron que la prevalencia de CVVR fue del 9% y la probabilidad de que la CVV progresase a su forma recurrente fue alta. Los datos globales permiten estimar que esta forma de micosis afecta aproximadamente a 138 millones de mujeres en el mundo56. Debido a sus características, esta enfermedad es preocupante por la recurrencia de los síntomas y su naturaleza refractaria a los tratamientos convencionales. Las mujeres que la presentan tienen una calidad de vida disminuida, pues impacta de manera negativa en su desempeño social y laboral9. Los síntomas clínicos no son específicos y pueden ser asociados a una gran variedad de infecciones vaginales. Los más frecuentes son prurito y quemazón vulvar, acompañados de enrojecimiento, irritación y secreción vaginal similar al queso cottage1.
Distribución de especiesGeneralmente suele estar implicada en la enfermedad una sola especie de Candida, pero en una minoría de cultivos vaginales (2-5%) se han aislado dos o más especies1. Entre un 85 y un 95% de los aislamientos corresponden a Candida albicans21,57, y los aislamientos restantes pertenecen a otras especies del género, dentro de las cuales la más común es Candida glabrata. Las mujeres con diabetes mellitus de tipo II son más propensas a estar colonizadas por esta última especie. Pese a ser poco frecuentes, Candida parapsilosis, Candida tropicalis y Candida krusei también han sido identificadas como agentes etiológicos de esta infección. La CVV producida por estas especies es clínicamente indistinguible de la causada por C. albicans57.
Factores predisponentesUna variedad de factores de riesgo, propios del huésped o asociados a su comportamiento, están claramente relacionados con la aparición de CVV. Los episodios sintomáticos son causados por el sobrecrecimiento de Candida en los tractos gastrointestinal, genitourinario o por transmisión sexual1.
En el tracto genital femenino el crecimiento de este hongo oportunista se encuentra regulado por la microbiota residente, principalmente compuesta por bacilos grampositivos del género Lactobacillus. Dentro de los mecanismos por los cuales Lactobacillus mantiene estable la composición de la microbiota vaginal se encuentran la producción de compuestos antimicrobianos (peróxido de hidrógeno, acido láctico y sustancias tipo bacteriocinas) y la competencia que establecen por los sitios de adhesión al epitelio vaginal7. Recientemente Parolin et al.46 demostraron que diferentes especies de Lactobacillus aisladas de mujeres sin síntomas de CVV presentaban actividad fungicida y fungistática contra C. albicans y además tenían la capacidad de disminuir la adhesión del hongo a la línea celular HeLa. Por lo tanto, los cambios que comprometen el normal equilibrio de la microbiota local favorecen el establecimiento de la infección. Los episodios de CVV generalmente ocurren tras el uso de antibióticos de amplio espectro por el impacto de estos fármacos sobre la microbiota normal del tracto vaginal57.
Además de la competencia biológica por la ocupación de este nicho mucoso, la disponibilidad de nutrientes constituye un factor relevante. En pacientes diabéticas, los altos contenidos en glucosa favorecen la colonización del tracto genital. Por otra parte, los altos niveles de hormonas reproductivas también constituyen una causa predisponente importante, ya que incrementan el contenido de glucógeno en las células epiteliales vaginales, lo que proporciona una abundante fuente de carbono para Candida. También se ha demostrado que el estrógeno aumenta la adherencia del hongo a la superficie de las células que conforman este tracto mucoso. Es por ello que el uso de anticonceptivos orales con alto contenido de estrógenos y la condición de embarazo son factores que predisponen al sobrecrecimiento del patógeno17,57. Otro hecho que muestra la importancia de las hormonas reproductivas en la presentación de la enfermedad es que la aparición de la CVV rara vez ocurre antes de la menarquia o posteriormente a la menopausia1.
Los factores que determinan qué mujer sufrirá la transición de CVV esporádica a CVVR no son aún del todo conocidos. En la mayoría de los casos las mujeres no presentan ninguno de los factores de riesgo descritos, lo que indica una posible predisposición genética9. En los últimos años han sido numerosas las investigaciones que han intentado asociar la CVVR con mutaciones o defectos en el sistema inmune de estas pacientes; las evidencias señalan un predominio en los receptores de la inmunidad innata y en sus vías de señalización. Las mutaciones puntuales en el receptor tipo Toll 2 (TLR2) y los polimorfismos en el gen del inflamasoma NLRP3 parecen estar involucrados en la predisposición a la CVVR36,53. Estos conceptos serán profundizados más adelante.
Candida albicans: un patógeno particularUna de las características distintivas de C. albicans la constituye su naturaleza saprofita y su habilidad de sobrevivir en el hospedero. Es un comensal habitual de las superficies mucosas y, debido a ello, la transición entre su estado comensal a patogénico ocurre en la interfaz entre el hongo y las células epiteliales del tejido mucoso29. En los últimos años el avance del conocimiento sobre las características de este patógeno, sus factores de virulencia y la respuesta protectora han dado lugar a un cambio significativo en la comprensión de la interacción patógeno-hospedero en esta micosis12,44,45. En el caso de este patógeno, que posee la capacidad de colonizar diferentes tejidos, cobran importancia las características del sitio infectado y los mecanismos de respuesta locales. Durante los procesos de invasión e infección ocurren numerosos eventos transcripcionales relacionados con la morfogénesis, la expresión de moléculas y la manifestación de factores de virulencia. La evidencia experimental también indica que C. albicans posee la capacidad de regular diferencialmente sus genes en un proceso de adaptación al nicho biológico que coloniza34,60 y de exhibir un perfil particular de factores de virulencia según la infección tenga lugar en la mucosa oral, la gástrica o la vaginal.
La transición de la faz levaduriforme a la faz hifal ha sido considerada el mayor factor de virulencia de C. albicans35. Este cambio morfotípico se encuentra regulado por una compleja red de elementos sensores que detectan cambios en el microambiente y que regulan factores de transcripción que codifican para la formación de la hifa, producción de adhesinas, generación de enzimas hidrolíticas y factores asociados a la formación de biopelícula65. El mayor conocimiento deriva de experiencias realizadas con cepas que presentan mutaciones por deleción o reinserción. Estos estudios demostraron que las adhesinas, en particular la Als3 (agglutinin-like sequence) desempeña un rol importante en la patogenia de la CVV al facilitar la adherencia del hongo al epitelio vaginal35.
Durante la infección vaginal en modelos in vivo y ex vivo es frecuente observar pseudohifas e hifas del hongo fuertemente adheridas a las capas superficiales del epitelio vaginal e incluso que infiltran el estrato subepitelial16,35,54. En un trabajo con modelos animales y con cepas de C. albicans con deleciones en reguladores transcripcionales que participan en la transición de levadura a hifa (bcr1Δ/Δ, efg1Δ/Δ, cph1Δ/Δ y efg1Δ/Δ cph1Δ/Δ), Peters et al.47 determinaron el rol crucial de Efg1 durante la morfogénesis y una menor participación de la vía de Bcr1 en este fenómeno. La sobreexpresión de factores de transcripción responsables del mantenimiento de los distintos morfotipos como NRG1 (levadura) y UME6 (hifa) corroboraron la importancia de los cambios morfogénicos en la activación de los mecanismos inmunes que participan en la patogénesis de la infección y pusieron en evidencia la relevancia de la transición de levadura a hifa como un importante factor de virulencia en la CVV.
La formación de biopelícula confiere a Candida diferentes características que aumentan su patogenicidad: a) el crecimiento del hongo incrustado en una matriz rica en exopolisacáridos dificulta la penetración de los fármacos antifúngicos, lo que le proporciona resistencia; b) modifica la interacción entre el hongo y la célula epitelial, hecho que impide el adecuado reconocimiento y activación de los mecanismos innatos y la respuesta inflamatoria del hospedero, y c) torna ineficientes los mecanismos inmunes de defensa y evade así la respuesta del hospedero. La formación de biopelícula sobre la mucosa vaginal ha sido observada en modelos in vivo de CVV, en modelos ex vivo de tejido vaginal reconstituido y en cultivos in vitro de líneas de células epiteliales y del hongo14,30. En nuestro laboratorio observamos que aislamientos clínicos de pacientes con CVVR son capaces de formar una biopelícula in vitro, si bien su actividad fue significativamente menor cuando fue comparada con aislamientos de Candida procedentes de hemocultivo. Actualmente, y a diferencia de lo que ocurre con Gardnerella vaginalis, no existen estudios concluyentes realizados en biopsias de tejidos de pacientes con CVV y CVVR que evidencien la formación in vivo de biopelícula por parte de Candida41,56. A pesar del avance de los conocimientos en esta cuestión, el papel de las biopelículas en la patogenia de la CVVR constituye aún una desafiante área de trabajo.
Dentro de los factores de virulencia de este hongo, la producción de enzimas hidrolíticas, su regulación y los mecanismos por los cuales ejercen su función han sido objeto de estudio desde hace mucho tiempo. La evidencia clínica y experimental demuestra que las secretory aspartyl proteinases (Sap) desempeñan múltiples roles en la vaginitis por Candida14. Al menos son diez los genes que codifican para esta familia de exoenzimas (Sap1-Sap10), y su expresión puede ser diferencialmente regulada por cambios en el microambiente como el pH, la presencia de un determinado morfotipo y la etapa del proceso infeccioso55. Se ha observado que el fluido vaginal de mujeres con CVV y CVVR presenta mayor concentración de una o varias Sap6. En ensayos in vitro, los aislamientos clínicos de estas pacientes también produjeron mayor cantidad de estas enzimas en comparación con los aislamientos provenientes de pacientes asintomáticas. Respecto a los mecanismos por los cuales las Sap participan en la patogenia de la CVV y la CVVR, el consenso indica que dos mecanismos no necesariamente excluyentes pueden estar actuando: uno está relacionado directamente con la actividad enzimática de las Sap y su capacidad de degradar tanto elementos importantes en la estabilidad de las células epiteliales del tracto mucoso como diferentes mediadores inmunes solubles; el otro mecanismo recientemente descrito es la activación en el hospedero del inflamasoma NLRP3, estructura multimérica fundamental en la producción de IL-1β, una citocina clave en la patogenia de la vaginitis por Candida48,61. Gabrielli et al.25 reportaron que las enzimas Sap2 y Sap6 de C. albicans participan en la activación del inflamasoma NLRP3. Ambos mecanismos convergen en la inducción y producción de mediadores inmunes como alarminas, péptidos antimicrobianos y reclutamiento de poblaciones celulares, actores esenciales en el proceso que conlleva la inflamación local. Diferentes estudios que han propuesto el uso de anticuerpos específicos para la neutralización de Sap2 en modelos animales de CVV han descrito la actividad protectora de dichos anticuerpos, mientras que el uso de fragmentos de la proteína Sap2 recombinante incorporados a diferentes formulaciones se encuentra en etapas avanzadas de estudio y aplicación como vacuna8,10.
Respuesta inmune a C. albicans en el tracto genital femeninoEl papel de la inmunidad mediada por células en la protección frente a infecciones por Candida en la mucosa oral, gastrointestinal y en la candidiasis mucocutánea crónica (CMC)22 motivó la presunción de que este tipo de respuesta era también crucial en la protección durante la infección vaginal. Sin embargo, la evidencia clínica demostró que mujeres con CVVR no presentaban defectos en esta rama de la respuesta inmune21,47 y numerosos estudios en la actualidad avalan la relevante contribución de las células y los mediadores inmunes innatos en la respuesta local durante la vaginitis por Candida.
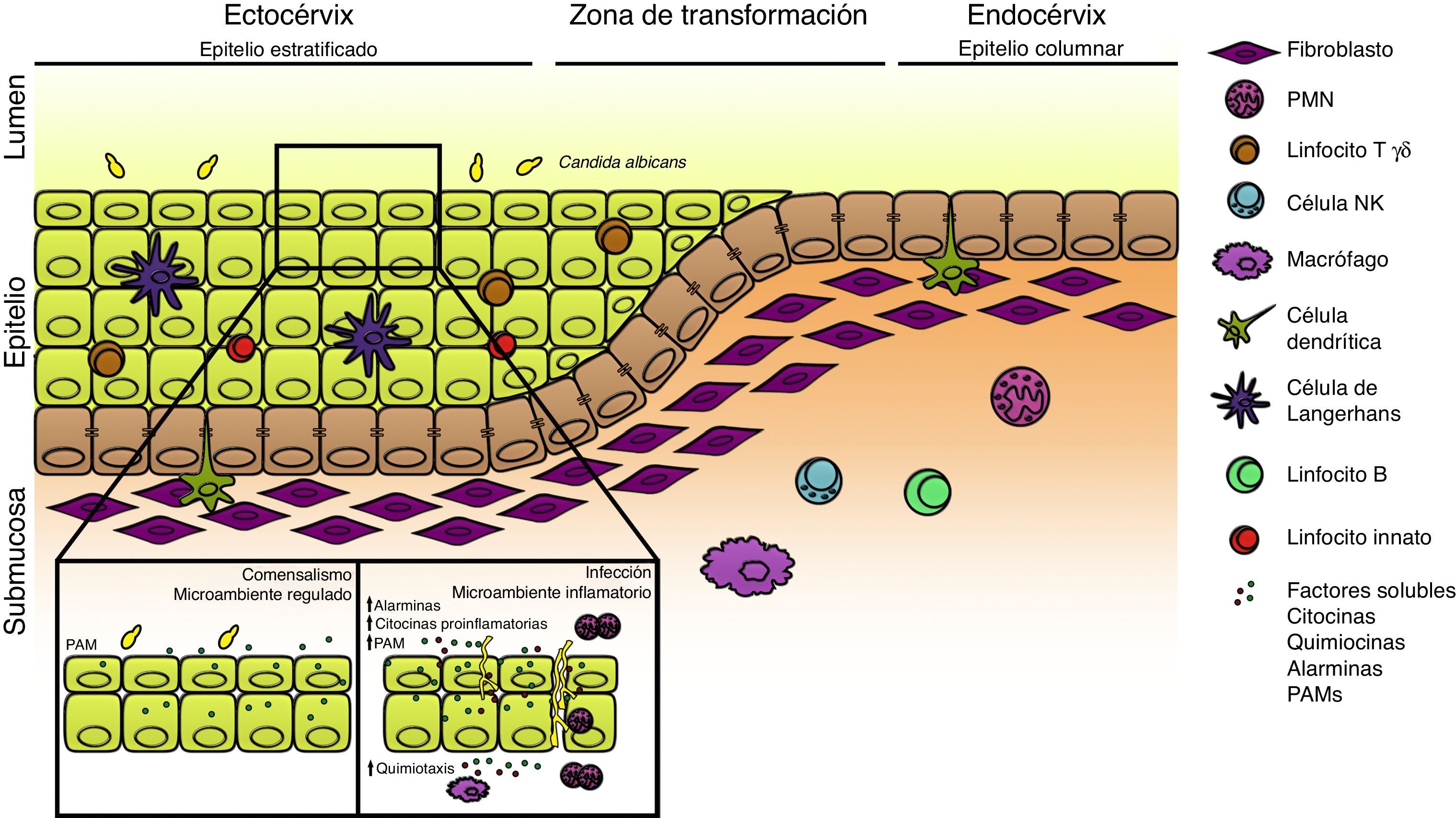
Varios mecanismos responsables de la inmunidad innata poseen localizaciones claves en el tracto genital femenino y son importantes en el mantenimiento de la vigilancia inmunológica frente a los microorganismos, en los acuerdos básicos del comensalismo y en la protección durante la invasión. Diferentes poblaciones celulares como los polimorfonucleares neutrófilos (PMN), macrófagos, células dendríticas, células NK, linfocitos T γδ y las recientemente clasificadas como linfocitos innatos, contribuyen activamente en la respuesta antifúngica local (fig. 1). Algunos de estos tipos celulares poseen carácter de residentes, mientras otros son reclutados en respuesta a los estímulos locales; el mecanismo de acción incluye un efecto directo sobre el hongo que provoca su muerte, o de manera indirecta, a través de la producción de mediadores inmunes29.
Respuesta inmune innata local en el tracto genital femenino. Esquema del tracto genital femenino que ilustra la ubicación de las diferentes poblaciones celulares. En condiciones de homeostasis el microambiente local se encuentra finamente regulado con concentraciones aumentadas de citocinas antiinflamatorias y péptidos antimicrobianos (PAM) de expresión constitutiva; Candida albicans se encuentra en su estado comensal. La ruptura de este estado de equilibrio debido a la presencia de factores predisponentes o defectos genéticos favorece la morfogénesis fúngica, la expresión de factores de virulencia y el establecimiento de la infección. La liberación de alarminas, PAM, sustancias quimiotácticas y citocinas generan un microambiente inflamatorio con infiltrado celular que, en su conjunto, determinan la aparición de los síntomas de la enfermedad.
De todas las superficies mucosas del organismo, el tracto reproductor femenino tiene requerimientos especiales para su inmunorregulación, donde los elevados niveles de la citocina antiinflamatoria transforming growth factor β (TGFβ) desempeña un papel fundamental66. Las células epiteliales (CE) conforman una barrera ininterrumpida en la mucosa vaginal que protege el tracto reproductor femenino de la infección por microorganismos patógenos y oportunistas. Por lo tanto, no es sorprendente el hecho de que estas células expresen receptores de la inmunidad innata o pattern recognition receptors (PRR), capaces de detectar la presencia de microorganismos y enviar señales de activación para la secreción de mediadores inmunes32. Las CE producen un amplio espectro de péptidos antimicrobianos que están presentes en forma constitutiva en las superficies mucosas, y responden rápidamente a la exposición de estímulos inflamatorios o patogénicos aumentando su concentración y variedad. La secreción de mediadores solubles como alarminas, péptidos antimicrobianos, quimiocinas y citocinas como la IL-1β, IL-6, IL-8, y el tumor necrosis factor α (TNFα) están involucrados activamente en la fase inicial de la respuesta y contribuyen al reclutamiento de otras poblaciones celulares. Las CE poseen además la capacidad de discriminar entre la forma saprofítica de C. albicans y su transición a la fase hifal; de esta manera, el morfotipo levaduriforme es tolerado y la emisión de la pseudohifa es considerada una señal de peligro ante la cual la CE inicia la respuesta inflamatoria local. La liberación de alarminas e IL-8 favorecen el infiltrado de PMN y contribuyen a la aparición de síntomas en la CVV. De esta manera la colonización asintomática vaginal ocurre en ausencia de respuesta inflamatoria, mientras que la forma sintomática está acompañada de un abundante infiltrado de PMN (fig. 1). La evidencia acumulada hasta el presente señala que la susceptibilidad a la infección está asociada a una respuesta inflamatoria agresiva, mientras que la resistencia lo está a la activación de un perfil antiinflamatorio47,51,57. En estudios efectuados en pacientes con CVV en los que se estableció un score de inflamación, se observó una correlación positiva entre la presencia de PMN y la carga fúngica vaginal47. En este escenario, la contribución del PMN está relacionada con la respuesta inflamatoria local más que con su rol de célula efectora fungicida. Experiencias in vitro demostraron que los lavados vaginales en pacientes sintomáticas poseen una elevada actividad quimiotáctica sobre PMN; recientemente, las alarminas S100A8 y S100A9 liberadas por las CE han sido involucradas en este proceso67. La ausencia de estas moléculas y la depleción de PMN en modelos murinos no provoca un aumento de la carga fúngica intravaginal, sin embargo, disminuye la evidencia histológica de inflamación vaginal. En la generación de este proceso, la transición de levadura a hifa y la producción de factores de virulencia causan la disrupción epitelial, lo que provoca como respuesta el reclutamiento de PMN, que contribuyen a la exacerbación del fenómeno23.
Tres son las familias de PRR involucradas en el reconocimiento de los pathogen associated molecular patterns (PAMP) de Candida. Es importante destacar que los PRR no actúan solos, y es frecuente encontrar asociaciones, acoplamientos y redundancia en las vías de activación. Dentro de la familia de los receptores de lectina tipo C, el receptor más estudiado es el llamado dectina-1, que posee como ligando los β-glucanos de la pared del hongo. Los demás miembros de la familia, como el receptor de manosa, dectina-2, DC-SIGN, mincle, entre otros, reconocen otras estructuras glucídicas como la manosa y la fucosa presentes en la pared de Candida.
El reconocimiento fúngico por los receptores toll-like receptor (TLR) ha sido ampliamente estudiado. Esta familia está compuesta por diez miembros que reconocen diversos ligandos. Los TLR pueden estar ubicados en la superficie celular o en la membrana de endosomas en el citosol. Cuando contactan con sus ligandos promueven la fagocitosis y la producción de citocinas proinflamatorias5,18. Diferentes PAMP de Candida spp. son reconocidos por estos PRR: TLR2 reconoce fosfolipomananos, TLR4 estructuras ricas en O-manósidos, TLR7 reconoce el ARN del hongo y TLR9 el ADN de Candida.
Los receptores tipo NOD (NLR) se encuentran en el citosol celular. El receptor más estudiado de esta familia es el NLRP3, que forma parte del inflamasoma, un complejo multiproteico citoplásmico con actividad enzimática. La inducción de la actividad de caspasa-1, una enzima proteolítica activada por el inflamasoma, es la responsable de activar la pro-IL-1β para dar origen a la molécula activa de IL-1β. La transcripción de la pro-IL-1β está asociada a señales generadas a partir de TLR2/TLR4 y dectina-1, y la liberación de la IL-1β a la actividad de los inflamasomas42,62. NLRP3 se encuentra expresado en macrófagos, monocitos, células dendríticas y CE. Debido a su rol en la producción de IL-1β, estos receptores cobran relevancia en la respuesta inmune antifúngica61.
Dentro de los linfocitos T CD4+ se encuentran las células Th17, que se diferencian en presencia de citocinas como IL-1β, IL-6 y TGFβ3,68. La IL-23 es necesaria para la expansión, el mantenimiento y la función efectora de esta población celular. Las células Th17 se caracterizan por producir IL-17A, IL-17F, IL-22 e IL-263,11. Las citocinas del perfil Th17 son importantes para las defensas del individuo, puesto que promueven el reclutamiento y la función de los PMN y tienen efecto sobre otras poblaciones celulares al inducir la liberación de alarminas, IL-37 y β-defensinas, entre otros11,64. Además de estas células que forman parte de la inmunidad adaptativa, algunos linfocitos innatos como las células NKT, linfocitos T γδ y las ILC3 producen abundantes cantidades de IL-17 y cumplen importantes roles en la defensa de la mucosa18,27.
El descubrimiento de mutaciones genéticas en individuos que poseen una mayor susceptibilidad a las infecciones por Candida aportan una nueva evidencia sobre los receptores, las citocinas, las vías de señalización y los mecanismos efectores que participan en el control de la candidiasis en el ser humano (tabla 1). Errores genéticos que afectan a los receptores de la inmunidad innata, como la molécula dectina-1, y en su proteína adaptadora, CARD9, fueron detectados en pacientes con CMC y CVVR20,28. Las mutaciones aisladas en TLR2 están involucradas en la susceptibilidad a la CVVR53. Lev-Sagie et al.36 describieron una asociación entre polimorfismos en el gen de NLRP3 y la presentación de CVVR, y recientemente Jaeger et al.31 profundizaron en este hallazgo al describir que el genotipo 12/9 del gen se encontraba presente de manera diferencial en pacientes con CVVR en comparación con controles; además, la concentración de IL-1β en el lavado vaginal de las pacientes con este genotipo se encontraba aumentada de manera significativa.
Mutaciones genéticas asociadas a la susceptibilidad de infecciones mucosas por C. albicans
| Gen | Mutación | Enfermedad | Referencia bibliográfica |
|---|---|---|---|
| IL4 | C589T | CVVR | Babula 2005 |
| CARD9 | Q295X | CMC, CVVR | Gloker 2009 |
| NLRP3 | Polimorfismos de longitud (alelo 7) | CVVR | Lev-Sagie 2009 Jaeger 2016 |
| Dectin1 | Y238X | CMC, CVVR | Ferwerda 2009 |
| TLR2 | P631H | CVVR | Rosentul 2014 |
| IL17F | S65L | CMC | Puel 2011 |
| IL17RA | Q284X | Dermatitis por C. albicans, CMC | Puel 2011 |
En relación con los mecanismos adaptativos se describió la asociación entre CMC y ciertas inmunodeficiencias como el síndrome poliendocrino autoinmune de tipo-I (APS-I), el síndrome de hiper-IgE, mutaciones en el gen STAT-1, defectos en el receptor de la IL-17 y deficiencia en la IL-17F33,37,40,49. Estos defectos convergen en una respuesta defectuosa de los linfocitos productores de IL-17, hecho que evidencia su importancia en la respuesta inmune de la mucosa frente a C. albicans. También se reportó que la sustitución de un nucleótido en el gen que codifica para IL-4 provoca en las pacientes que la presentan niveles aumentados de esta citocina, lo que conlleva una disminución en la producción de óxido nítrico por parte de los macrófagos. Esta polarización de los macrófagos al perfil M2 podría ser la responsable de la mayor susceptibilidad a la CVVR observada en estos individuos4.
Del tratamiento convencional a las nuevas estrategiasLa terapia recomendada para la CVVR, basada en un estudio aleatorizado controlado, es el fluconazol. Se inicia con la administración por vía oral de 150mg de fluconazol cada 72h (tres dosis), para continuar después con 150mg por la misma vía una vez a la semana durante seis meses58.
Las guías clínicas de Alemania del año 2015 recomiendan el uso local de clotrimazol (500mg) o ketoconazol (100mg), o fluconazol oral (150mg)39. Sin embargo, también se recalca que la mitad de las mujeres tendrán una recurrencia al terminar la terapia. Se prefiere el uso del fluconazol sobre el ketoconazol debido a su mejor tolerancia y menores interacciones medicamentosas. Para el tratamiento oral con fluconazol la guía clínica recomienda el protocolo de Donders que está planteado en cuatro etapas o fases. En la fase inicial se toma el fluconazol (200mg) por vía oral en los días 1, 3 y 5 durante la primera semana (fase de inducción de 600mg). La segunda fase del tratamiento se inicia cuando la paciente no presenta síntomas de vaginitis y el cultivo micológico del exudado vaginal resulta negativo. Esta fase, llamada de consolidación, comprende una duración de 2 a 8 semanas y consiste en la toma de 200mg de fluconazol una vez a la semana. La tercera fase tiene lugar entre los meses 3 a 6 de la terapia, durante los cuales se indica la toma de 200mg de fluconazol cada 2 semanas. La última fase del tratamiento corresponde al período entre los meses 7 a 12 del inicio del protocolo: la toma del antifúngico, a la misma concentración, se reduce a una vez al mes. Es necesario recalcar que el día de inicio del tratamiento mensual con fluconazol (fases 3 y 4) debe ser el primer día de la menstruación en mujeres regulares y el primer día del mes en aquellas pacientes con ciclos menstruales irregulares.
Las guías de la Sociedad Americana de Infectología 2016 recomiendan para la CVVR una terapia de inducción con un agente tópico o fluconazol por vía oral durante 14 días y mantenimiento durante 6 meses con 150mg por vía oral de fluconazol en pauta semanal. Este tratamiento se encuentra fuertemente recomendado debido a las sólidas evidencias obtenidas43.
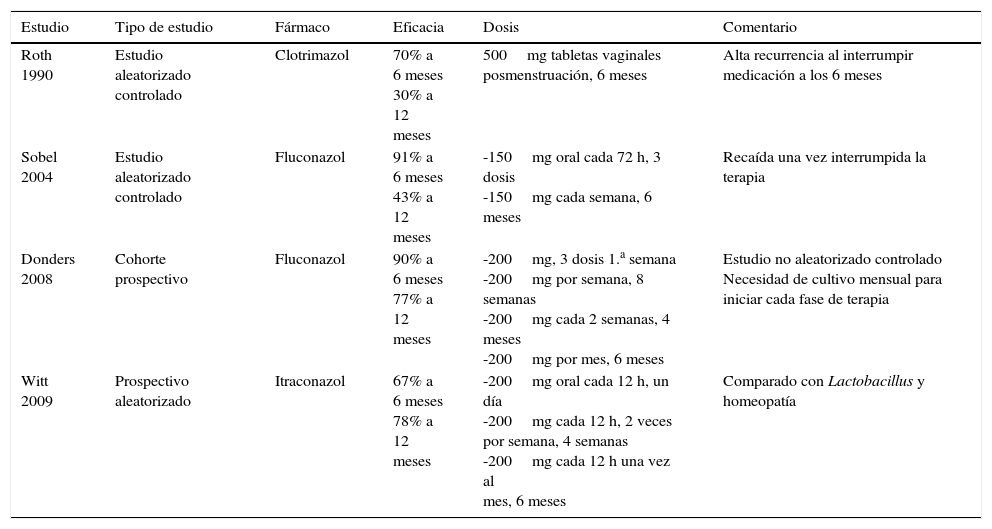
En un estudio sistemático y metaanálisis de la pauta semanal en la toma del fluconazol durante 6 meses como terapia supresiva, se evaluaron 407 pacientes de entre 18 y 65 años de edad que presentaban 4 o más episodios probados por cultivos para Candida en un año. El metaanálisis evaluó dos estudios aleatorizados con placebo. La eficacia del uso del fluconazol semanal al finalizar la terapia fue del 87,9%, del 64,3% a los tres meses de terminar la terapia y del 61,3% a los 6 meses de terminado el tratamiento. Estos datos demuestran que este antifúngico administrado de forma semanal resulta ser muy efectivo, si bien su eficacia disminuye paulatinamente con el tiempo52. La tabla 2 resume los protocolos más utilizados.
Tratamiento de candidiasis vulvovaginal recurrente
| Estudio | Tipo de estudio | Fármaco | Eficacia | Dosis | Comentario |
|---|---|---|---|---|---|
| Roth 1990 | Estudio aleatorizado controlado | Clotrimazol | 70% a 6 meses 30% a 12 meses | 500mg tabletas vaginales posmenstruación, 6 meses | Alta recurrencia al interrumpir medicación a los 6 meses |
| Sobel 2004 | Estudio aleatorizado controlado | Fluconazol | 91% a 6 meses 43% a 12 meses | -150mg oral cada 72 h, 3 dosis -150mg cada semana, 6 meses | Recaída una vez interrumpida la terapia |
| Donders 2008 | Cohorte prospectivo | Fluconazol | 90% a 6 meses 77% a 12 meses | -200mg, 3 dosis 1.a semana -200mg por semana, 8 semanas -200mg cada 2 semanas, 4 meses -200mg por mes, 6 meses | Estudio no aleatorizado controlado Necesidad de cultivo mensual para iniciar cada fase de terapia |
| Witt 2009 | Prospectivo aleatorizado | Itraconazol | 67% a 6 meses 78% a 12 meses | -200mg oral cada 12 h, un día -200mg cada 12 h, 2 veces por semana, 4 semanas -200mg cada 12 h una vez al mes, 6 meses | Comparado con Lactobacillus y homeopatía |
En relación con la CVVR en pacientes embarazadas se recomienda no usar terapia oral para evitar la toxicidad al feto. Se prefiere la terapia azólica tópica en cada episodio mientras dure el embarazo. La duración del tratamiento es de 7 días por episodio2.
Otro aspecto a tener en cuenta a la hora de definir el tratamiento está relacionado con el agente causante de la CVV. Si es otra especie diferente a C. albicans puede encontrarse resistencia a los antimicóticos habituales como ocurre con C. glabrata, que presenta mayor resistencia al fluconazol. En estas circunstancias se recomienda realizar una prueba in vitro de la sensibilidad antifúngica del aislamiento para decidir la terapia más apropiada. Las posibilidades terapéuticas, en este caso, son el ácido bórico, la nistatina, el voriconazol, la flucitocina en crema vaginal, la anfotericina B en óvulos vaginales y el fluconazol en dosis alta13,63. La nistatina (óvulos vaginales) se prescribe durante 14 días de cada mes, con un tratamiento total de 6 meses. Se administra una dosis inicial de 20 MU/día; se continúa cada mes con la misma dosis diaria los 7 días previos a la menstruación y los 7 siguientes a ella19.
Para algunos expertos existe una forma crónica de la CVV. Se trata de una vulvovaginitis no erosiva que se define por criterios diagnósticos específicos. La terapia recomendada es de pauta diaria supresiva con fluconazol o itraconazol según la opinión de los expertos, pero sin estudios clínicos realizados50.
La búsqueda de nuevas estrategias terapéuticas es un área de investigación en permanente expansión. El uso de modelos animales y los estudios in vitro aportan evidencias sobre los mecanismos de acción, actividad biológica, toxicidad y formulación. Varios agentes antifúngicos se encuentran en fase preclínica. Un nuevo compuesto, el VT-1161, que inhibe la CYP51 fúngica, ha demostrado recientemente su eficacia en el modelo murino de CVV26. En este escenario los productos naturales también ofrecen una interesante alternativa. Nuestro grupo ha evaluado la actividad antifúngica de extractos naturales de dos plantas originarias de América del Sur, Syngonanthus nitens y Leiothrix spiralis. Los extractos revelaron una potente actividad antifúngica sobre diferentes cepas de colección de Candida y sobre aislamientos clínicos de C. albicans provenientes de pacientes con CVV15,16. Solo los extractos de S. nitens no exhibieron citotoxicidad sobre las CE del tracto genital femenino. La crema que contenía el extracto de S. nitens presentó una actividad antifúngica similar a la del miconazol en un modelo in vivo de CVV16.
El uso de probióticos ha tenido interés para tratar o prevenir infecciones fúngicas mucosas e invasivas. El probiótico más estudiado en infecciones fúngicas es Lactobacillus, capaz de inhibir el crecimiento de C. albicans en estudios in vitro59. A pesar de estas evidencias experimentales no se encuentran estudios clínicos que demuestren de forma categórica la utilidad de estos compuestos. Para una revisión en profundidad de este tema se propone la lectura del estudio de Matsubara et al.38.
Vacunas para la candidiasis vulvovaginal recurrenteUna vacuna efectiva en la CVVR es una opción posible para resolver un problema crónico. Una vacuna ideal debería ser capaz de inducir una respuesta inmune eficiente que promueva la eliminación del hongo y la neutralización de los factores de virulencia sin provocar cambios perjudiciales en el microambiente vaginal. Dos vacunas recombinantes basadas en moléculas fúngicas relevantes en la patogenia de la infección han pasado satisfactoriamente la fase 1 de los ensayos clínicos: son la adhesina Als3, incorporada a alúmina como adyuvante, y la enzima Sap2, con múltiples roles durante la vaginitis, que se presenta en formulación virosomal10. En la actualidad solo la vacuna anti-Als3 se encuentra en fase clínica 2. En un futuro próximo se esperan importantes avances en esta área de estudio, pero todavía ninguna vacuna está aprobada para el uso en el ser humano9.
Conclusiones finalesDurante los últimos años diferentes líneas de investigación han permitido importantes avances en el conocimiento de la biología de los hongos y en los mecanismos que rigen la respuesta inmune a Candida en el tracto vaginal. El papel clave de los cambios morfogénicos experimentados por el hongo y la producción de Sap como factor de virulencia que activa la respuesta inflamatoria local, asociados al descubrimiento de mutaciones y polimorfismos genéticos en los PRR o en sus vías de activación, han rediseñado el escenario de la patogénesis de la CVV. El nuevo enfoque en el abordaje de esta dolencia plantea no solo controlar la carga fúngica sino también desarrollar estrategias orientadas a la modulación de la respuesta inmunopatogénica local. La resolución de estos nuevos desafíos permitirá importantes avances en la comprensión y manejo terapéutico de esta micosis.
Los autores agradecen a la Agencia Nacional de Promoción Científica y Tecnológica (FONCYT PICT-2012- 2949), al CONICET-PIP (2012-2014, 112 200801 02778), a la Secretaría de Ciencia y Tecnología de la Universidad Nacional de Córdoba (SECyT-UNC 162/14), y al Ministerio de Ciencia y Técnica de la provincia de Córdoba (MinCyT 2011-2014) la financiación recibida en nuestras líneas de investigación.