Las enfermedades cardiovasculares constituyen la principal causa de morbimortalidad en los pacientes diabéticos y uno de los principales factores de riesgo son las dislipidemias. Estos pacientes presentan un patrón de alteraciones lipídicas caracterizadas por elevación moderada del colesterol LDL, con aumento de las partículas de LDL densas y pequeñas, incremento de triglicéridos y reducción del colesterol HDL (dislipidemia aterogénica).
Las diversas guías de manejo de dislipidemias coinciden en que la reducción del colesterol LDL, es el principal objetivo terapéutico en estos pacientes. Así entonces, las intervenciones terapéuticas deben considerar, además de las modificaciones del estilo de vida, el uso de estatinas como droga de primera elección. Diversos estudios han evidenciado la gran efectividad de las estatinas en la reducción de eventos cardiovasculares en pacientes diabéticos. Sin embargo, en muchos casos es necesario el uso de otros fármacos asociados, principalmente ezetimibe y algunos fibratos con el fin de optimizar los niveles de lípidos plasmáticos y reducir el riesgo cardiovascular residual.
Cardiovascular diseases are the main cause of morbi-mortality in diabetic patients and the dyslipidemias are one of the main risk factors. Diabetic patients exhibit different lipid abnormalities including increase of LDL cholesterol, with predominance of small dense LDL particles, increase of triglycerides and low HDL-cholesterol plasma levels.
Different lipid guidelines have established that LDL cholesterol is the primary therapeutic target for diabetic patients. Therefore, in addition to lifestyle modifications, statins are the first line drug in these patients, and several studies have shown the effectiveness of statins in reduction of cardiovascular events in these patients. Nevertheless, in several cases, it is necessary to associate additional drugs, including ezetimibe and/or fibrates in order to optimize the lipid levels and reduce the cardiovascular residual risk.
La enfermedad cardiovascular (ECV) especialmente coronaria es la principal causa de muerte en los pacientes con diabetes mellitus (DM). Hasta el 80% de los diabéticos fallecerá por esta razón (75% de enfermedad coronaria y 25% de enfermedad cerebrovascular o complicaciones vasculares periféricas), y en un porcentaje similar las complicaciones cardiovasculares suponen el motivo más común de hospitalización en estos pacientes. De forma global, según el United Kingdom Prospective Diabetes Study (UKPDS), el 50% de los pacientes con diabetes tipo 2 presenta complicaciones cardiovasculares en el momento del diagnóstico1. Los pacientes diabéticos tienen un riesgo 2 a 4 veces mayor de padecer Ictus (enfermedad cerebrovascular) y de morir de enfermedad coronaria que los sujetos no diabéticos2,3. Por otra parte, existe cierta evidencia de que el riesgo cardiovascular en los pacientes diabéticos sin antecedentes de cardiopatía isquémica es similar a la de los sujetos no diabéticos con antecedentes previos de infarto4. La hiperglicemia no explica todo el riesgo CV en los diabéticos ya que un control glicémico intensivo no se asocia a una reducción importante en los episodios cardiovasculares o en la mortalidad5.
ALTERACIONES LIPÍDICAS EN LA DIABETES MELLITUS TIPO 2El patrón lipídico característico de la diabetes tipo 2 consiste en un aumento de la concentración de triglicéridos, disminución en los niveles de colesterol de las lipoproteínas de alta densidad (c-HDL) y aumento en el número de lipoproteínas de baja densidad (LDL) pequeñas y densas6 (Tabla 1). Las concentraciones de colesterol total y del colesterol transportado por las lipoproteínas de baja densidad (c-LDL) no suelen estar aumentados. Los niveles de triglicéridos suelen tener una buena correlación con el control glicémico; es decir, suelen disminuir con un adecuado control de la diabetes mellitus. Por otra parte, el predominio de partículas LDL pequeñas y densas (patrón B), se asocia con los niveles de triglicéridos, especialmente cuando estos están sobre los 150mg/dl7. Estas alteraciones lipídicas también conocidas como dislipidemia aterogénica, suelen preceder al diagnóstico de la diabetes en aquellos sujetos con factores de riesgo como la obesidad central y la resistencia a la insulina. En la dislipidemia diabética también se observa frecuentemente aumento en la concentración de la apolipoproteína B (ApoB) por sobre 120mg/dl, en el colesterol transportado por las partículas remanentes y por las lipoproteínas de muy baja densidad (VLDL), y aumento en la actividad enzimática de la proteína transferidora de ésteres de colesterol (CETP) y de la lipoprotein-lipasa6.
ALTERACIONES LIPOPROTEICAS Y ENZIMÁTICAS EN LA DISLIPIDEMIA DIABÉTICA
| Colesterol total | Normal o discretamente aumentado. |
| Triglicéridos | Aumentados. |
| Lipoproteínas de baja densidad | c-LDL normal o discretamente aumentado. Aumento de partículas pequeñas y densas. |
| Lipoproteínas de alta densidad | c-HDL bajo. Disminución del número de partículas. Aumento del contenido en triglicéridos. |
| Lipoproteínas ricas en triglicéridos | Aumento del número de partículas. Aumento del contenido en colesterol y triglicéridos. Aumento de lipemia postprandial. |
| Apolipoproteína B | Aumento de síntesis hepática. Aumento de concentración plasmática (>120mg/dL) |
| Apolipoproteína A1 | Disminución de síntesis hepática. Aumento en eliminación renal. Disminución concentración plasmáticas. |
| Enzimas | Aumento actividad CETP. Aumento actividad Lipoprotein-lipasa endotelial |
La hipertrigliceridemia es la dislipidemia más prevalente en la diabetes mellitus. En un estudio realizado en una población de 2.500 pacientes con diabetes tipo 2, cerca del 50% de los pacientes tuvo concentraciones de triglicéridos superiores a 150mg/dl y uno de cada cuatro los tenía por sobre 200mg/dl7. Por otra parte, en el estudio Framingham la prevalencia de hipercolesterolemia (>Percentil [P] 90) en varones (9%) y mujeres (15%) con diabetes tipo 2 fue similar a la de la población no diabética y la prevalencia de hipertrigliceridemia por sobre el P90 fue del 18%, más del doble de la hallada en la población sin diabetes2.
La prevalencia de colesterol HDL bajo (10) fue superior al 20% tanto en varones como en mujeres diabéticas, aproximadamente el doble que en los no diabéticos. Frecuencias similares se han descrito en el estudio UKPDS, con la única diferencia que el colesterol total y LDL fue más alto en las mujeres diabéticas comparadas con las no diabéticas8.
PATOGENIA DE LA DISLIPIDEMIA DIABÉTICALos pacientes con diabetes tipo 2 suelen tener obesidad de predominio central concentrando el exceso de grasa a nivel abdominal y visceral. El aumento de la grasa abdominal se asocia con insulinorresistencia, hiperinsulinemia y dislipidemia aterogénica.
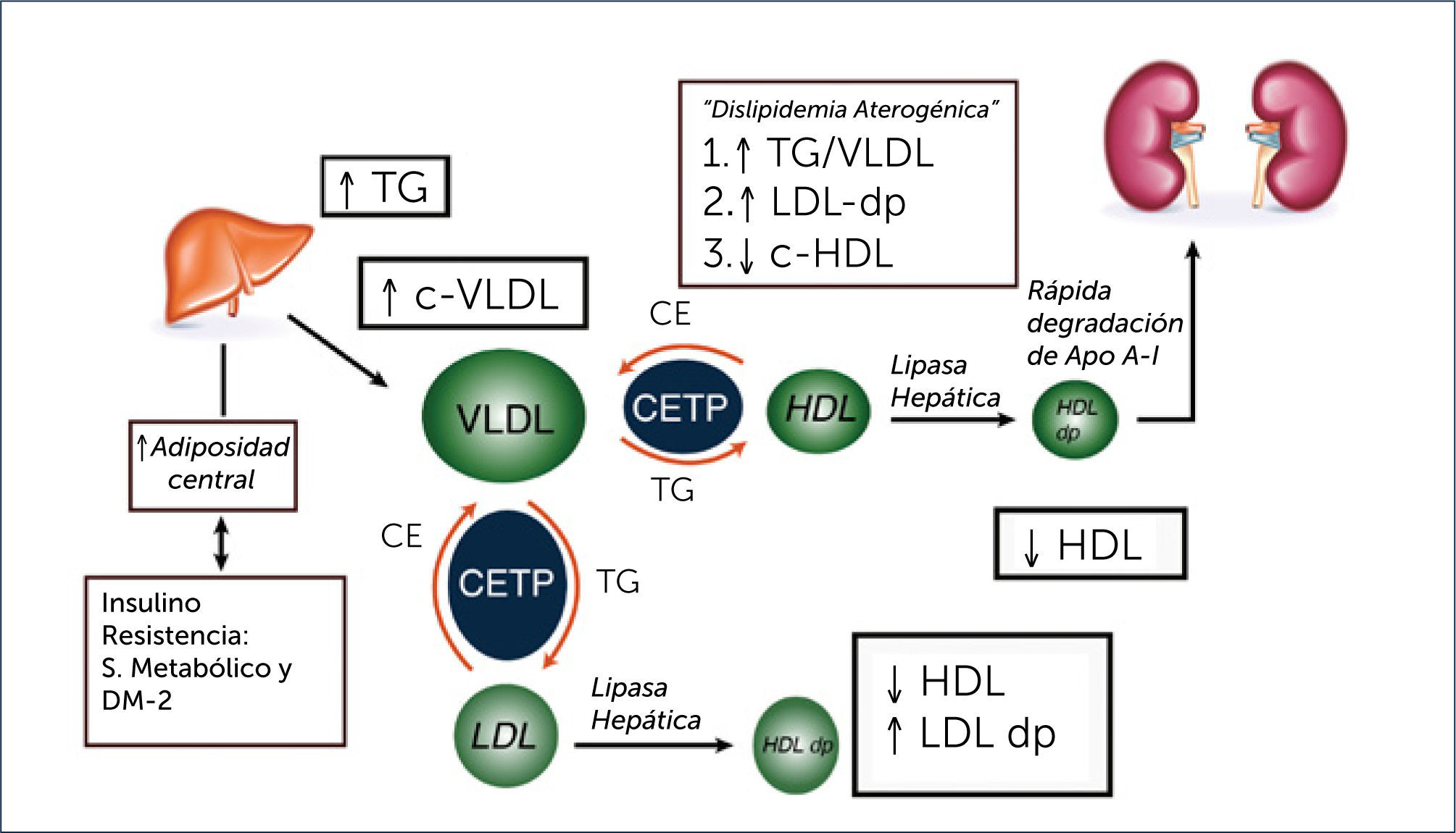
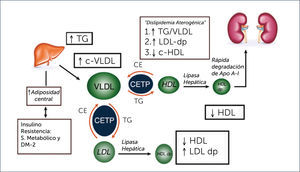
El mecanismo de la resistencia a la insulina inducida por la grasa visceral está mediado en parte por la liberación por parte del tejido adiposo de adipocinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) y la interleukina 6 (IL-6)6. Producto de la resistencia a la insulina, se produce un aumento de la liberación de ácidos grasos libres desde los adipocitos los que inducen la síntesis hepática de triglicéridos y estimulan la producción de Apo B. De este modo, la resistencia a la insulina promueve una sobreproducción de partículas VLDL ricas en triglicéridos, hecho que explica la hipertrigliceridemia en la diabetes mellitus. Este aumento de VLDL ricas en triglicéridos aumenta la expresión de la proteína transferidora de ésteres de colesterol (CETP en sus siglas en inglés)9,10. La CETP es una glicoproteína producida por el hígado y que se encuentra en el plasma unida a las HDL. Esta proteína promueve el intercambio de ésteres de colesterol de las HDL a las lipoproteínas ricas en Apo B (VLDL y LDL) y de triglicéridos desde las VLDL a las HDL y LDL11. De esta forma, en la diabetes, especialmente en presencia de hipertrigliceridemia, se produce un enriquecimiento en el contenido de triglicéridos de las partículas HDL, lo que va a afectar su catabolismo. Estas partículas de HDL ricas en triglicéridos son sustrato para la lipoprotein lipasa endotelial y para la lipasa hepática que hidrolizan sus triglicéridos, resultando en una partícula de HDL pequeña y con escaso contenido en colesterol. Además, la hidrólisis de los triglicéridos contenidos en las HDL induce la disociación de la apolipoproteina AI (ApoAI) principal proteína de las HDL, favoreciendo su filtrado y catabolismo renal. Estos dos efectos explican las concentraciones bajas de c-HDL en los sujetos con diabetes e hipertrigliceridemia (Figura 1).
Otros mecanismos propuestos para explicar los niveles bajos de HDL en la diabetes son una disminución en la síntesis hepática de Apo AI por la resistencia a la insulina12, inhibición de la expresión hepática de Apo AI en presencia de citocinas proinflamatorias, especialmente TNF-α que suele estar aumentada en los pacientes con diabetes tipo 213, y por último un efecto directo a través de un mecanismo no conocido de la adiponectina sobre HDL que es independiente de la concentración plasmática de triglicéridos14.
La sobreproducción hepática de VLDL y el enriquecimiento en triglicéridos de las mismas explica tanto el aumento en la concentración de Apo B como el de partículas LDL pequeñas y densas. El incremento de Apo B se debe al aumento de su síntesis hepática, y su elevación en plasma indica un aumento en el número total de partículas que la contienen (VLDL, IDL y LDL). Por otro lado, el enriquecimiento en triglicéridos se asocia con una mayor actividad de la lipoprotein-lipasa endotelial y de la lipasa hepática sobre las partículas ricas en triglicéridos, lo que induce al aumento en los remanentes de VLDL y de partículas LDL ricas en triglicéridos, que son sustrato de las lipasas, lo que favorece la presencia de partículas LDL pequeñas y densas9,10.
DISLIPIDEMIA DIABÉTICA Y ATEROESCLEROSISEn el estudio UKPDS, tanto c-LDL como c-HDL fueron las variables que mostraron una mayor asociación independiente con la enfermedad cardiaca coronaria en la diabetes tipo 215. En este punto hay que resaltar que el riesgo cardiovascular es muy dependiente de la concentración de LDL y HDL, pero rara vez la concentración de c-LDL está muy elevada en la diabetes.
Las partículas LDL pequeñas y densas son más aterogénicas debido a que tienden a la hiperagregación, a diferentes modificaciones como la glicosilación o la oxidación que las hacen más susceptibles a la fagocitosis por parte de los macrófagos subendoteliales, y por otra parte, tienen un catabolismo disminuido por su menor afinidad al receptor hepático de las LDL, lo que permite un mayor tiempo de residencia vascular y paso al espacio subendotelial16. Algo semejante ocurre con las partículas HDL, que no solamente se encuentran disminuidas en número, sino que son partículas más pequeñas y densas, pobres en Apo AI y con menor capacidad de captación periférica de colesterol y, por lo tanto, funcionalmente menos eficaces.
METAS DE LÍPIDOS EN PACIENTES DIABÉTICOSAún cuando los pacientes diabéticos frecuentemente presentan elevación de los niveles séricos de triglicéridos y bajos niveles de c-HDL, el objetivo primerio es la reducción del c-LDL.
Las guías del American Heart Association y American College of Cardiology (AHA/ACC) recomiendan que todo diabético tipo 1 o 2 entre la edad de 40 a 75 años y con niveles de c-LDL superiores a 70mg/dL debe recibir una estatina de moderada intensidad o alta intensidad, dependiendo del riesgo17. De igual forma, las recientes guías de la American Diabetes Association (ADA) están en línea con estas guías no estableciendo metas de c-LDL y recomiendan el uso de estatinas en todo diabético mayor de 40 años o menor de 40 años con enfermedad CV o presencia de factores de riesgo18.
Por otra parte, la International Atherosclerosis Society (IAS)19 la Sociedad Europea de Cardiología20 recomiendan metas de col-LDL bajo 100mg/dl en diabéticos sin enfermedad cardiovascular. En diabéticos de alto riesgo cardiovascular (portadores de enfermedad cardiovascular o factores de riesgo asociados), se debería lograr una meta de col-LDL de menos de 70mg/dL. El Consenso del Ministerio de Salud de nuestro país recomienda considerar a los pacientes diabéticos como de alto riesgo cardiovascular y establece como meta terapéutica lograr niveles plasmáticos de col-LDL de menos de 70mg/dL o al menos una reducción del 50% del nivel basal de col-LDL21.
Por otra parte y considerando que los diabéticos con gran frecuencia presentan elevación de triglicéridos y bajos niveles de c-HDL, se recomienda como objetivo terapéutico secundario el colesterol no-HDL (colesterol total menos c-HDL), que se ha visto tiene un muy buen poder predictivo de desarrollo de enfermedad cardiovascular. De acuerdo a las guías de IAS y de la ADA, las metas de c-no HDL debería ser de menos de 100mg/dl y 130mg/dl para diabéticos con y sin factores de riesgo o enfermedad cardiovascular respectivamente19,20. En forma similar, la National Lipid Association (NLA)22 recomienda una meta en c-LDL de menos de 70mg/dl y de c-no HDL de menos de 100mg/dl en diabéticos tipo 1 o 2 con ECV, dos o más factores de riesgo CV (edad >45 años para hombres, >55 años para mujeres; historia familiar de enfermedad coronaria prematura; tabaquismo; presión arterial >140/90mmHg; o c-HDL bajo <40mg/dl hombres, <50mg/dl mujeres), o evidencia de daño terminal de órgano (retinopatía, relación albumina/ creatinina en orina >30mg/g, o nefropatía crónica). En diabéticos sin alguna de estas condiciones la meta de c-LDL recomendada es de menos de 100mg/dl y de c-no HDL inferior a 130mg/dl.
En consecuencia, existen varias guías para el manejo de las dislipidemias en diabéticos, pero todas ellas establecen el uso de estatinas en la mayoría de los pacientes.
TRATAMIENTO1. Cambios de estilo de vidaEn pacientes diabéticos los cambios de estilo de vida son fundamentales en el control metabólico. En pacientes con sobrepeso u obesidad, una reducción moderada del peso corporal (5-10% del peso) se asocia a mejoría de la sensibilidad a la insulina, mejor control glicémico, reducción de los triglicéridos y aumento del c-HDL séricos23,24.
En cuanto a la composición de la dieta, para lograr reducir los niveles de c-LDL se recomienda una alimentación baja en grasas hidrogenadas y saturadas con aumento del consumo de grasas insaturadas, principalmente monoinsaturadas y de omega 319. También es importante el consumo diario de fibra y eventualmente de esteroles vegetales que reducen la absorción intestinal de colesterol. Dado que frecuentemente se observa aumento de triglicéridos y reducción de c-HDL, se debe restringir los carbohidratos refinados y el alcohol19,24.
Un patrón de alimentación que ha demostrado ser efectiva en la reducción de enfermedad CV es la dieta mediterránea. En el estudio PREDIMED (Prevención con Dieta Mediterránea), una intervención con este tipo de alimentación se asoció a una leve reducción de los niveles de triglicéridos y de c-LDL y aumento del c-HDL, con una reducción significativa de la incidencia de enfermedad cardiovascular. Aproximadamente el 50% de los individuos era diabético y el efecto beneficioso en estos pacientes fue comparable a los no diabéticos25.
2. Farmacoterapia EstatinasLas estatinas constituyen el tratamiento de elección en el manejo de las dislipidemias, y esta recomendación también incluye a los pacientes diabéticos.
La ADA recomienda el uso de estatinas, independiente de los niveles de lípidos séricos en diabéticos con ECV o diabéticos mayores de 40 años con algun factor de riesgo. También se recomienda el uso de estatinas en diabéticos menores de 40 años con múltiples factores de riesgo CV o un nivel de c-LDL superior a 100mg/d18. En forma similar las guías AHA/ACC recomiendan el uso de estatinas en cualquier diabético (tipo 1 y 2) entre 40 y 75 años con niveles de C-LDL superior a 70mg/dL17.
Diferentes estudios de intervención en pacientes diabéticos con y sin enfermedad CV han demostrado su efectividad en reducción de eventos. Un meta-analisis que incluyó 14 estudios randomizados de intervención con estatinas en pacientes diabéticos, mostró la efectividad de las estatinas en reducción de eventos cardiovasculares26.
No obstante, el uso de estatinas se ha asociado a un mayor riesgo de desarrollar diabetes27,28. El mecanismo de esta asociación aún no está claramente establecido, pero se han planteado algunas posibles hipótesis, incluyendo la activación de proteínas que inducen resistencia a la insulina29 o cambios en el metabolismo del colesterol en la célula beta del páncreas30.
A pesar de esto, los beneficios del uso de estatinas en pacientes diabéticos son muy superiores en comparación a un bajo riesgo de aparición de diabetes o empeoramiento del control metabólico.
Las estatinas son en general seguras. Los efectos adversos más frecuentes son el estreñimiento, la dispepsia, las náuseas, la cefalea y el dolor gastrointestinal, que suelen ser transitorios y leves. En <1% de los casos se produce un aumento de más de 3 veces el valor normal de las transaminasas que es dependiente de la dosis y prácticamente similar para todas las estatinas. El efecto adverso más importante está relacionado con la afección muscular, que puede manifestarse como mialgia, miositis, miopatía y muy raramente como rabdomiolisis. Lo más frecuente es la mialgia sin elevación de la creatinfosfoquinasa (CPK).
Inhibidores de la absorción del colesterol: EzetimibeEl uso de Ezetimibe reduce los niveles de c-LDL en aproximadamente un 13-15%31 y asociado al uso de estatinas se pueden lograr reducciones de los niveles de c-LDL en un 50-70%32. El asociar ezetimibe a una dosis fija de estatina, es más efectiva en reducir niveles de c-LDL y c-no-HDL en comparación a duplicar la dosis de la misma estatina33. Por otra parte el estudio IMPROVE-IT (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial) demostró la efectividad de la terapia combinada de simvastatina con ezetimibe en la reducción de eventos CV en pacientes de alto riesgo, y este beneficio fue mayor en los diabéticos en comparación a los no diabéticos34. Esto podría explicarse por el adicional efecto reductor de los trigliceridos del ezetimibe, o también algunos estudios han evidenciando una mayor expresión del transportador intestinal de colesterol NPCL1 (Niemann Pick C like 1) en individuos diabéticos35, lo cual podría sugerir un mayor beneficio hipolipemiante del ezetimibe en estos pacientes. Ezetmiba es bien tolerada y no se han comunicado efectos secundarios graves; los efectos secundarios más frecuentes son elevaciones moderadas de las enzimas hepáticas, dolor muscular y síntomas gastroiontestinales.
FibratosLos fibratos son los fármacos más efectivos para reducir los niveles de triglicéridos plasmáticos, y además incrementan los niveles de c-HDL36. Es por esto que el uso de terapia combinada de estatinas con fibratos es una razonable opción terapéutica para el manejo de la dislipidemia en pacientes diabéticos. No obstante, el estudio ACCORD no demostró un beneficio en reducción de eventos CV al combinar fibratos con estatinas, en comparación a la monoterapia con estatinas37. A pesar de esto, al analizar sólo el subgrupo de pacientes con triglicéridos en el tercil más alto y c-HDL en el tercil más bajo, si se observó un beneficio significativo en reducción de eventos cardiovasculares37, por lo cual es posible considerar la terapia combinada de fibratos con estatinas en algunos diabéticos, siempre teniendo precaución con el desarrollo de miopatía. En este sentido, solo se pueden usar el fenofibrato, bezafibrato o ciprofibrato y en ningún caso el gemfibrozilo en terapia combianda con estatinas38.
En general, los fibratos se toleran bien y tienen pocos efectos secundarios, como molestias digestivas (5%), erupciones cutáneas (2%), cefalea, elevación de las enzimas hepáticas y síntomas musculares como mialgias.
NiacinaEste fármaco aumenta los niveles de c-HDL y además reduce los niveles de c-LDL, triglicéridos y Lp(a)39. Es por esto que se podría pensar como una buena alternativa terapéutica en diabéticos. Sin embargo, la niacina reduce la sensibilidad a la insulina y puede empeorar el control metabólico de pacientes diabéticos40 y además en dos grandes estudios de intervención, la combinación de estatina con niacina no demostró un efecto beneficioso adicional en comparación a la monoterapia con estatinas41,42.
Las reacciones cutáneas (rubor o flushing), son el efecto secundario más frecuente de la niacina y es una de las principales causas de discontinuación del fármaco. Otros efectos secundarios de la niacina son la hiperuricemia, la hepatotoxicidad y un menor control de la glicemia en pacientes con diabetes mellitus.
Omega 3Los ácidos grasos Omega 3 reducen los trigliceridos, pero tienen poco efecto sobre los niveles de c-LDL y c-HDL, además no se ha demostrado un efecto beneficioso en reducción de eventos CV en pacientes diabéticos43,44.
La administración de Omega 3 es en general segura; sin embargo, en aquellas personas que toman aspirina o algún otro antiagregante hay que vigilar una posible mayor propensión al sangrado por el efecto antitrombótico de este tipo de ácidos grasos.
CONCLUSIÓNLa ECV especialmente coronaria es la principal causa de muerte en los pacientes con diabetes mellitus. Este mayor riesgo se explica en parte por el mal control metabólico de la diabetes y por la presencia de una dislipidemia caracterizada por niveles de triglicéridos aumentados, presencia de lipoproteínas de baja densidad pequeñas y densas que son muy aterogénicas, y concentraciones bajas de c-HDL. El manejo del paciente con diabetes mellitus debe ser multifactorial. Las estatinas son el tratamiento de elección en estos pacientes ya que han demostrado beneficio en reducir el riesgo cardiovascular en esta población, además de ser seguras. Algunos pacientes se beneficiarán del tratamiento combinado con ezetimiba y en el caso de hipertrigliceridemia, con algunos fibratos (a excepción del gemfibrozilo).