El síndrome de Tako-Tsubo, llamado también síndrome de discinesia apical transitoria, fue descrito por primera vez en Japón en los años noventa. Es una entidad poco frecuente cercana al 1% de todos los pacientes con sospecha de síndrome coronario agudo. Generalmente afecta a mujeres posmenopáusicas con pocos factores de riesgo cardiovascular. Se caracteriza por dolor precordial anginoso, cambios electrocardiográficos, elevación de enzimas de daño miocárdico, ausencia de obstrucción coronaria en la angiografía y una característica discinesia anteroapical del ventrículo izquierdo que se normaliza en unos pocos días. El estrés emocional severo es el desencadenante más común. La etiopatogenia de este síndrome está aún por definir. Este síndrome se considera entidad clínica desde el año 2001, cuando se publicó una serie de 88 casos. Tiene un mecanismo parcialmente conocido, caracterizado por la morfología que adopta el ventrículo izquierdo secundaria a hipocinesia o discinesia de los segmentos apicales e hipercontractilidad de los basales. A diferencia del síndrome coronario agudo, los pacientes con disfunción del ventrículo izquierdo no presentan enfermedad aterotrombótica en las arterias coronarias; además, las alteraciones descritas poseen un carácter reversible. Se han propuesto unos criterios clínicos diagnósticos, existiendo en la actualidad cierta controversia en los mismos, así como en las exploraciones complementarias necesarias para su diagnóstico.
The Takotsubo syndrome, also called transient apical dyskinesia syndrome, was first described in Japan in the 1990s. It is a rare entity found in almost 1% of all patients with suspicion of acute coronary syndrome. It usually affects postmenopausal women with a few cardiovascular risk factors. It is characterized by angina-type chest pain, electrocardiographic changes, elevation of the enzymes of myocardial injury, absence of coronary obstruction on angiography, and a characteristic left ventricular anteroapical dyskinesia, which returns to normal within a few days. Severe emotional stress is the most common trigger for this syndrome. The aetiopathogenesis of this syndrome remains to be defined. This syndrome has been considered a clinical condition since 2001, when a series of 88 cases was published. It is a disease with a partially known mechanism, characterised by the morphology adopted by the left ventricle secondary to hypokinesis or dyskinesia of the apical segments, and hypercontractility of basal segments. Unlike acute coronary syndrome, patients with left ventricle dysfunction do not have atherothrombotic disease in the coronary arteries. In addition, the alterations described are reversible. Some clinical diagnostic criteria have been proposed, although they are still controversial, as well as in the complementary examinations required for diagnosis.
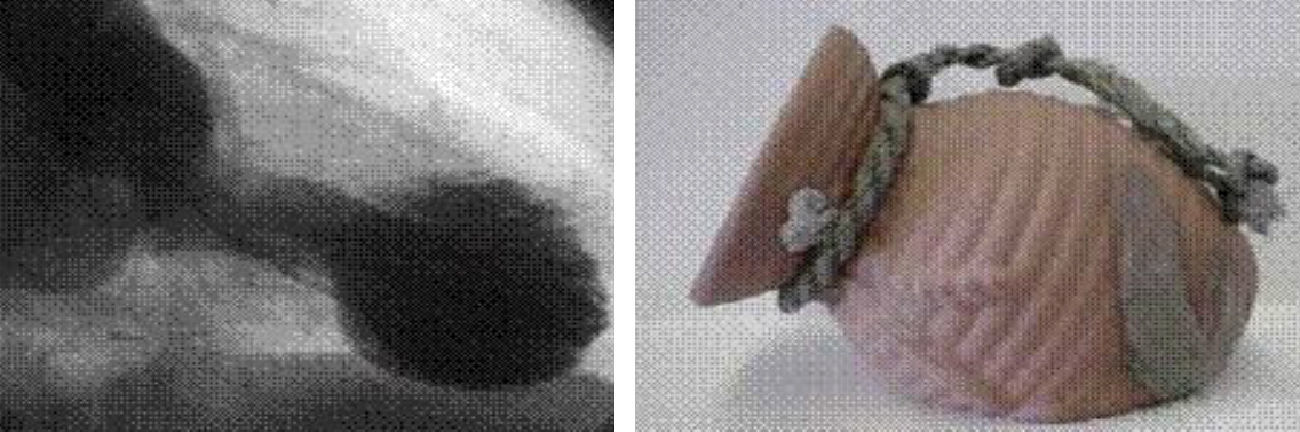
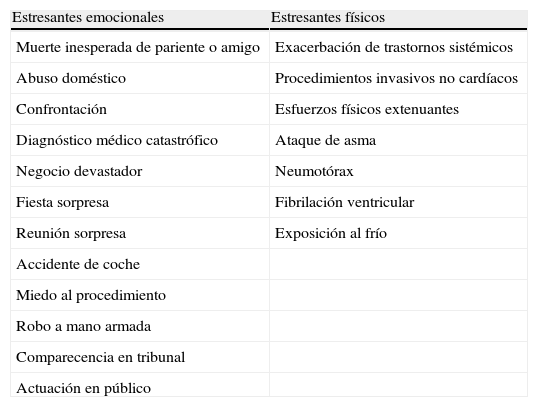
Sato et al.1,2, en 1990, describieron un cuadro de dolor torácico y elevación anterolateral del segmento ST, sin lesiones en la coronariografía. En la ventriculografía observaron discinesia anteroapical con hipercinesia basal, transitoria, que retorna a la normalidad en 1-3 semanas. Denominaron a este síndrome Tako-Tsubo al parecerse la imagen sistólica del ventrículo izquierdo (VI), en la ventriculografía, al antiguo recipiente con que los pescadores japoneses capturaban los pulpos (en japonés tako significa «pulpo» y tsubo, «recipiente») (fig. 1)
A la derecha, antiguo recipiente con que los pescadores japoneses capturaban los pulpos (en japonés tako significa «pulpo» y tsubo, «recipiente»). A la izquierda, imagen sistólica del ventrículo izquierdo en la ventriculografía, en la que se observa discinesia anteroapical con hipercinesia basal, característica del síndrome de Tako-Tsubo.
El síndrome de Tako-Tsubo es una entidad de reciente descripción, originariamente en Japón, y que posteriormente se ha descrito en otras zonas del mundo3. En los años noventa se describió como casos aislados en Japón. En el año 2001 se consolida como entidad clínica con la publicación de 88 casos en Japón por Tsuchihashi et al.4. Después se han documentado más series de casos en otros lugares, no existiendo asociación con áreas geográficas o grupos étnicos.
Ha recibido diferentes denominaciones: ampulla cardiomyopathy, apical ballooning, balonamiento apical del ventrículo izquierdo, síndrome del corazón roto, aturdimiento miocárdico, cardiomiopatía inducida por estrés, síndrome de discinesia apical transitoria y miocardiopatía Tako-Tsubo. En 2006, la American Heart Association incorpora el síndrome de Tako-Tsubo como miocardiopatía primaria adquirida en su clasificación de las miocardiopatías5.
El síndrome de Tako-Tsubo o de disfunción ventricular transitoria (SDAT) es una entidad clínicamente indistinguible del síndrome coronario agudo (SCA), con elevación enzimática de daño miocárdico, elevación anterolateral del segmento ST y extensa acinesia anterior con abombamiento apical del VI durante la angiografía, pero sin alteraciones significativas en las arterias coronarias y con recuperación de las alteraciones segmentarias de la contractilidad en las semanas siguientes. El diagnóstico diferencial con el infarto agudo de miocardio (IAM) se realiza mediante coronariografía urgente, fundamental para el tratamiento y pronóstico, que son muy diferentes. El tratamiento con fibrinólisis y/o nitratos puede ser perjudicial.
EpidemiologíaLa miocardiopatía de Tako-Tsubo puede ocurrir en alrededor del 1% de todos los IAM (alrededor de 12.000 americanos pudieron tener este síndrome en 20076). Bybee et al.7 informan de que el síndrome acontece en el 1,5 y 2,2% de los síndromes coronarios con onda Q y sin elevación del segmento ST, respectivamente. La edad media de los pacientes fue 68,5 años.
Un 82-100% de los casos se da en mujeres posmenopáusicas con pocos factores de riesgo cardiovascular4,7,8. Se desconoce la razón del predominio femenino, atribuyéndose a la deprivación de estrógenos, que puede influir en el sistema nervioso simpático y afectar a la reactividad vascular coronaria o tendencia al espasmo. Es posible que la disfunción endotelial, que empeora tras la menopausia, incremente la vulnerabilidad al aturdimiento miocárdico mediado simpáticamente8.
En un 50% de casos se ha identificado la hipertensión arterial como factor de riesgo asociado4. Hasta en el 75% de los casos es precedido de un factor estresante emocional o físico. El factor emocional más descrito suele ser el fallecimiento de una persona allegada. En el 34% no se encontró ningún factor estresante8 (tabla 1).
Factores estresantes físicos y emocionales asociados con la miocardiopatía de Tako-Tsubo
| Estresantes emocionales | Estresantes físicos |
| Muerte inesperada de pariente o amigo | Exacerbación de trastornos sistémicos |
| Abuso doméstico | Procedimientos invasivos no cardíacos |
| Confrontación | Esfuerzos físicos extenuantes |
| Diagnóstico médico catastrófico | Ataque de asma |
| Negocio devastador | Neumotórax |
| Fiesta sorpresa | Fibrilación ventricular |
| Reunión sorpresa | Exposición al frío |
| Accidente de coche | |
| Miedo al procedimiento | |
| Robo a mano armada | |
| Comparecencia en tribunal | |
| Actuación en público |
La etiología es desconocida3,9,10. Mediante PET y ecocardiografía con perfusión de contraste10 se ha evidenciado disminución del flujo sanguíneo en la región apical y distal del septo, estando preservada la perfusión sanguínea en las zonas media y mediolateral. Existe acuerdo general en considerar el síndrome de Tako-Tsubo una forma de aturdimiento miocárdico, de etiopatogenia aún desconocida en la que los mecanismos más frecuentemente invocados son los siguientes.
Espasmo de las arterias coronarias epicárdicasEra una de las primeras hipótesis11, debido a la coincidencia del espasmo coronario y el aturdimiento miocárdico en casos aislados. Sin embargo, la coronariografía precoz en el SDAT muestra espasmo espontáneo difuso en escasas ocasiones, y su reproducción mediante test de provocación con ergonovina o acetilcolina solo resultó positiva en el 15-30%4,12,13. Aunque el espasmo podría tener un papel en la miocardiopatía de Tako-Tsubo, no explica muchos casos.
Trastorno de la microvascularizaciónLa microvascularización coronaria inmediatamente después de la presentación del SDAT se encuentra difusamente afectada, existiendo una disminución transitoria en la reserva del flujo coronario4,7, que podría ser el mecanismo de la reversibilidad de este síndrome.
Disfunción miocárdica secundaria a catecolaminasLa hiperactividad aguda del sistema simpático local, secundaria a descarga masiva de catecolaminas, provocaría un aturdimiento miocárdico12. Parece apoyado por la frecuente presencia de estrés físico o emocional desencadenante del síndrome 14–20. Hay similitudes entre el SDAT y el aturdimiento miocárdico debido a la descarga de catecolaminas de otras enfermedades, como la hemorragia subaracnoidea o la crisis del feocromocitoma19. Otro argumento a favor es un modelo experimental de SDAT en el que el estrés continuado provoca hipocinesia en la región anteroapical del VI, atenuándose los cambios en animales que recibían estrógenos suplementarios, o normalizándose tras un bloqueo de los adrenorreceptores alfa o beta14.
Pero esta prometedora hipótesis no explica el origen del SDAT, al no haberse podido comprobar una elevada concentración de catecolaminas a nivel local (miocardio apical) durante la fase aguda del SDAT. Tampoco explica por qué la disfunción afecta solamente a los segmentos apicales, puesto que todo el miocardio recibe inervación simpática por igual.
Obstrucción dinámica aguda, severa y transitoria del tracto de salida del ventrículo izquierdoDesmet et al.12 y Kawai et al.13 observan en algunos pacientes un septo o «resalte» en la parte medial del tabique interventricular de morfología sigmoide y una orientación anormal en la inserción de la válvula mitral. Ambas variantes de la normalidad −más frecuente en mujeres−, ante una intensa estimulación adrenérgica o una deshidratación, condicionarían una reducción del volumen ventricular y predispondrían a obstrucción dinámica, grave y transitoria del tracto de salida del VI, al dividir este ventrículo en 2 cámaras funcionalmente diferentes, con un marcado aumento de la presión intraventricular en la pared ventricular distal de la cámara apical20–22. Esta obstrucción provoca isquemia subendocárdica secundaria a la reducción de la perfusión miocárdica, que no corresponde a un territorio específico de una arteria coronaria, sustrato del aturdimiento miocárdico de este síndrome.
Merli et al. han demostrado estos hallazgos mediante ecocardiografía de estrés con dobutamina, lo que tiene gran trascendencia, porque el tratamiento con nitratos podría aumentar dicho gradiente causando mayor deterioro, mientras que el tratamiento con beta-bloqueantes, volumen o estimulantes alfaadrenérgicos sería beneficioso al reducirlo20–22.
ClínicaLa clínica consiste en dolor torácico, no siempre típico, de intensidad leve a moderada, en ocasiones con insuficiencia cardíaca (IC). El solapamiento de síntomas hace difícil distinguir clínicamente el síndrome de Tako-Tsubo de un SCA. El 77% de los pacientes de Elesber presentó dolor torácico. Hasta un 44% de los pacientes presentaron signos de IC, necesitando un 10% de intubación y un 7% balón de contrapulsación. Una presentación inicial con disnea o insuficiencia cardíaca ocurre en un 7-20% de los pacientes, con shock4,6,8,23 que en la serie de Tsuchihashi4 llega hasta un 15%, presentando el 10% bradicardia importante y el 9% arritmias ventriculares graves (tabla 2).
Características clínicas de la miocardiopatía de Tako-Tsubo
| 1. Inicio súbito de dolor torácico o alteración de la respiración |
| 2. Estresante físico o emocional actuando como factor precipitante |
| 3. Predominante en mujeres posmenopáusicas |
| 4. Cambios electrocardiográficos indicativos de infarto agudo de miocardio |
| 5. De mínima a moderada elevación de biomarcadores cardíacos |
| 6. Acinesia o hipocinesia apical y medioventricular transitoria del ventrículo izquierdo, con hipercinesia basal |
| 7. Típica forma de recipiente para la recogida de pulpos en la ecocardiografía o ventriculografía izquierda |
| 8. Ausencia de lesiones coronarias en la coronariografía |
| 9. Ausencia de otros estados catecolaminérgicos como feocromocitoma, traumatismo craneoencefálico con sangrado intracraneal agudo, etc. |
| 10. Completa resolución de la disfunción ventricular izquierda a las pocas semanas del inicio del cuadro |
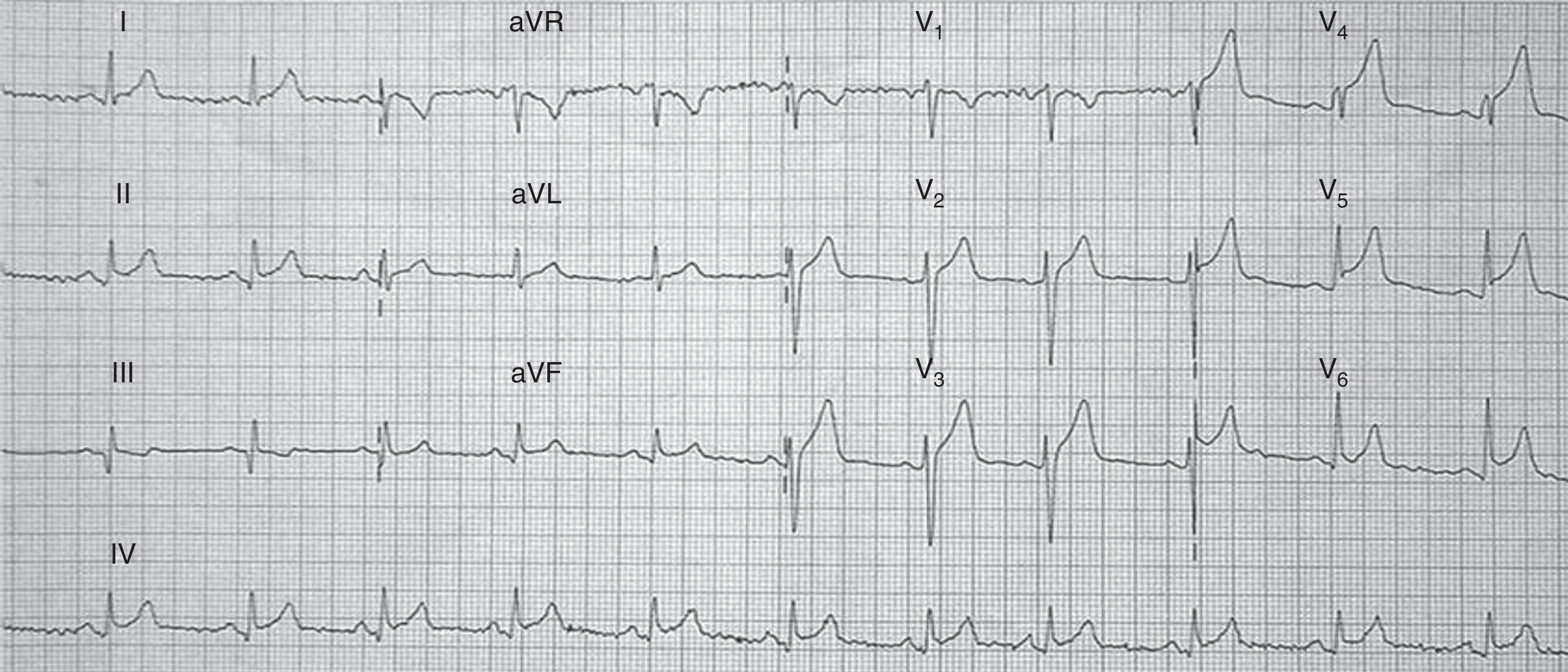
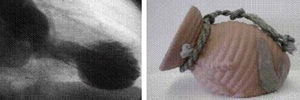
El electrocardiograma (ECG) inicial puede ser similar al del SCA con elevación del segmento ST en precordiales, ondas T negativas en precordiales y onda Q, siendo rara la imagen especular en cara inferior (fig. 2).
En una revisión de 59 pacientes con SDAT24, el 56% presentaba elevación del segmento ST, un 17% tenía ondas T invertidas y un 10% presentaba una cicatriz de infarto anterior. En un 8,5% de los pacientes no se encontraron alteraciones y en un 8,5% se observaron alteraciones poco específicas del ECG. El ECG puede ser normal.
Datos que ayudan a distinguir el SDAT son la mayor elevación del segmento ST en V4-V6 en relación con V1-V2, la ausencia de cambios recíprocos en cara inferior, la normalización progresiva del segmento ST en las primeras horas de evolución, con una inversión posterior de las ondas T. El alargamiento del QTc desde las primeras 24 h se prolonga a veces en las siguientes semanas.
Estos cambios se explican por la variabilidad entre la repolarización miocárdica de la zona discinética −que afecta a las zonas apicales− y las zonas basales habitualmente hipercinéticas.
Enzimas y marcadores de daño miocárdicoMuchos pacientes presentan elevación de los biomarcadores cardíacos, aunque no de una forma tan intensa como en el IAM clásico7. La elevación media de los biomarcadores cardíacos en el SCA fue 10 veces mayor que en la miocardiopatía de Tako-Tsubo, en la que la curva de los biomarcadores cardíacos evoluciona rápidamente hacia la normalidad.
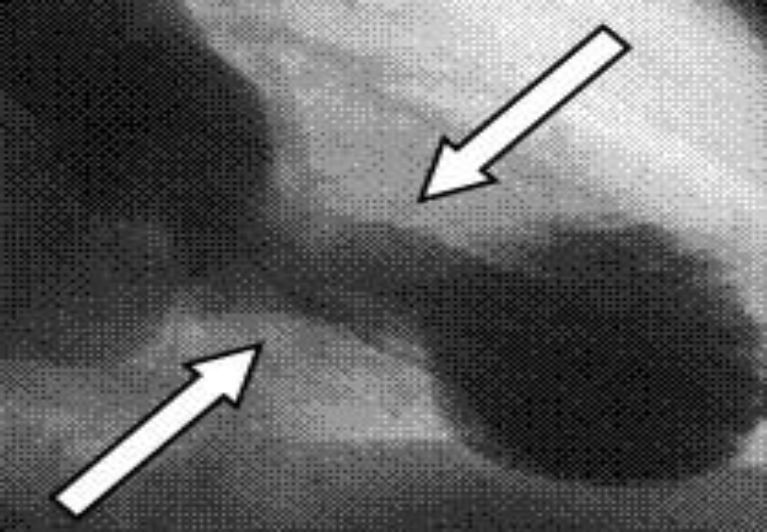
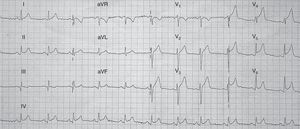
EcocardiografíaInicialmente muestra una discinesia o acinesia del ápex del VI, con normo o hipocinesia basal. La repetición tras la fase aguda confirmará que las anomalías han revertido (fig. 3).
Actualmente se admite la hipocinesia, acinesia o discinesia de los segmentos medios, con o sin afectación apical25,26. Esta situación se describió como variante (apical sparing variant).
En la ecografía puede encontrarse movimiento sistólico anterior de la válvula mitral (SAM). Hasta en un 20% de los casos se encuentra obstrucción dinámica en el flujo del tracto de salida del ventrículo izquierdo con gradiente intraventricular superior a 30mmHg4,27,28.
Se ha comunicado formación de trombo intraventricular con embolia cerebral durante la fase hospitalaria.
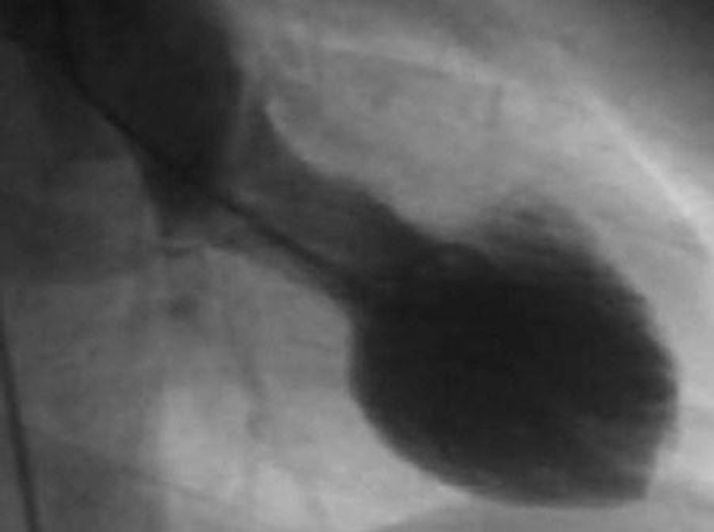
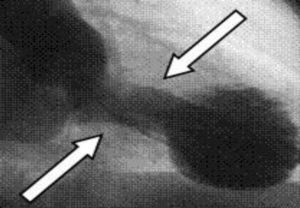
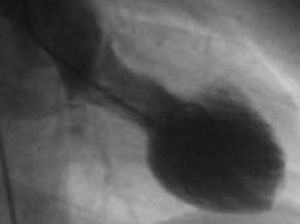
Coronariografía y ventriculografíaLa coronariografía no muestra lesiones coronarias. En la ventriculografía se observa una disfunción del VI con hipocinesia, acinesia o discinesia de los segmentos apicales con hipercontractilidad de los basales, dando como resultado la balonización durante la sístole (fig. 4).
En pocos pacientes se encontró espasmo multivaso espontáneo, y los resultados del test de provocación son controvertidos4,6,8. Aunque en pacientes con SDAT se ha encontrado alteración difusa de la microcirculación con disminución de la reserva de flujo, no se puede asegurar si es causa o fenómeno secundario. Según algunos autores, estaría producido por efecto tóxico de las catecolaminas, originado por la actividad simpática local, induciendo aturdimiento miocárdico.
Criterios diagnósticosSe han empleado diversos criterios. Aún no existe una definición de consenso del síndrome. Algunos autores como Abe y posteriormente Bybee7,29, de la Clínica Mayo (tabla 3), proponen 4 criterios basados fundamentalmente en su presentación clínica:
- 1.
Discinesia o acinesia transitoria de segmentos apicales y medios del VI de distribución vascular correspondiente a más de una arteria epicárdica.
- 2.
Ausencia de enfermedad coronaria obstructiva o evidencia de rotura aguda de la placa en la angiografía.
- 3.
Anomalías en el ECG de nueva aparición, como elevación del segmento ST o inversión de la onda T.
- 4.
Ausencia de traumatismo craneoencefálico reciente, hemorragia subaracnoidea, feocromocitoma, miocarditis, miocardiopatía hipertrófica o aturdimiento miocárdico de origen isquémico.
Criterios diagnósticos de la Clínica Mayo
| 1. Discinesia o acinesia transitoria de los segmentos apicales y medios del ventrículo izquierdo, con alteraciones de la motilidad regional de la pared con una distribución vascular correspondiente a más de una arteria epicárdica |
| 2. Ausencia de enfermedad coronaria oclusiva o evidencia de rotura aguda de placa en la angiografía |
| 3. Anomalías en el trazado electrocardiográfico de nueva aparición (como elevación del segmento ST o inversión de la onda T) |
| 4. Ausencia de traumatismo craneoencefálico, hemorragia subaracnoidea, feocromocitoma, miocarditis, miocardiopatía hipertrófica y aturdimiento miocárdico de origen isquémico |
Fuentes: Bybee et al.7,29.
Muchas complicaciones ocurren durante la fase aguda, siendo raras en fase tardía porque el síndrome es reversible. La tasa de complicaciones es de alrededor del 19%. El fallo cardíaco y el edema pulmonar ocurren en el 3 al 46% de los pacientes y la tasa de mortalidad es del 17 hasta el 3%. Otras complicaciones son: obstrucción dinámica del VI secundaria a un gradiente de presión7, regurgitación mitral por movimiento anterior sistólico del aparato valvular mitral7, arritmias ventriculares7, bloqueo auriculoventricular agudo transitorio30, formación de trombos intramurales en el VI7, accidente cerebrovascular de origen embólico, rotura de la pared libre del VI7,31 y muerte7.
TratamientoNo se dispone de datos a partir de ensayos clínicos. Dado que inicialmente es indistinguible del síndrome coronario agudo, el tratamiento inicial debería ser el de la isquemia coronaria con monitorización, antiagregación y/o anticoagulación, oxigenoterapia, inhibidores de la glucoproteína iib/iiia, y/o anticoagulantes con inhibición directa de la trombina, nitratos, betabloqueantes, IECA y diuréticos si lo precisa la situación clínica.
Con el rápido reconocimiento de este síndrome se evita la administración inútil de fibrinolíticos y la realización de cateterismo en la fase aguda32–34. Una vez diagnosticado SDAT, el tratamiento es de soporte. Akashi et al.6 observaron reversión completa y recuperación sin tratamiento. El AAS puede interrumpirse salvo que exista enfermedad coronaria o enfermedad vascular periférica concomitante.
Beta-bloqueantesSe pueden administrar a largo plazo para proteger de la sensibilidad a las catecolaminas. Su eficacia no ha sido formalmente probada aunque es razonable iniciarlos ya que el exceso de catecolaminas ha sido implicado en su patogenia3.
Los beta-bloqueantes o los agonistas alfa-adrenérgicos, añadidos a IECA, son de gran utilidad para disminuir o anular el gradiente dinámico en el tracto de salida del VI durante la fase aguda. También se han demostrado útiles durante la fase crónica y posiblemente de modo indefinido para prevenir las recurrencias12.
En ausencia de IC puede utilizarse la administración cautelosa de líquidos y beta-bloqueantes para reducir la hipercontractilidad de la base del VI y así aumentar el llenado cardíaco, reduciendo la obstrucción3.
Tratamiento de la insuficiencia cardíaca y del shock cardiogénicoDe haber IC se administran diuréticos y terapia estándar de la disfunción ventricular, incluyendo el uso de IECA y beta-bloqueantes. El shock cardiogénico se maneja con tratamiento estándar incluyendo inotropos y balón de contrapulsación3. Los inotropos están contraindicados en caso de obstrucción dinámica. Suelen evitarse agentes adrenérgicos para prevenir estimulación catecolaminérgica adicional.
Heparina y anticoagulantes oralesUn severo defecto apical hace probable la formación de trombos. La heparina y la warfarina se usan para tratar o prevenir los trombos apicales de VI igual que en la prevención de trombos en aneurismas ventriculares que complican el IAM clásico. Pueden usarse anticoagulantes si la disfunción del VI es grave durante varias semanas, especialmente si existe recuperación lenta. La warfarina puede dejarse una vez que la función ventricular ha retornado a la normalidad.
PronósticoUna vez pasada la fase aguda, el pronóstico sin comorbilidad significativa es bueno. Se recomienda ecocardiografía a las 4-6 semanas del alta para documentar la normalización de la función ventricular. Es característica la completa resolución de las alteraciones de la contractilidad en semanas; si persisten debería pensarse en otro diagnóstico. La mortalidad, menor del 1%, es muy baja comparada con la del IAM7.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.