La diabetes mellitus constituye un factor de riesgo cardiovascular independiente. Por tanto, el objetivo del tratamiento de la diabetes mellitus debe ser, además de normalizar la glucemia, prevenir sus complicaciones cardiovasculares. No obstante, la evidencia disponible sobre el papel cardioprotector de los diferentes hipoglucemiantes es escasa y poco sólida, especialmente en lo que se refiere al riesgo de episodios cardiovasculares mayores. En este contexto, las agencias reguladoras han modificado la normativa para la aprobación de los hipoglucemiantes de forma que establecen la necesidad de demostrar que los fármacos son capaces de disminuir la glucemia junto con una evaluación sólida de la seguridad cardiovascular. El objetivo de este trabajo es revisar los efectos cardiovasculares de los diferentes hipoglucemiantes haciendo especial hincapié en su impacto en el riesgo de episodios cardiovasculares mayores.
Diabetes mellitus is an independent cardiovascular risk factor. Therefore, in addition to normalising blood glucose, the aim of the treatment for diabetes mellitus should be to prevent cardiovascular complications. However, the evidence available on the cardio-protective role of the different glucose-lowering drugs is scarce and poor, particularly as regards with the risk of major cardiovascular events. In this context, the regulatory agencies have modified the regulations for the approval of glucose-lowering drugs, now requiring to demonstrate the glucose-lowering effect together with a robust assessment of the cardiovascular safety. The aim of this work is to review the cardiovascular effects of the different glucose-lowering drugs, focusing on their impact on the risk of major cardiovascular events.
La diabetes afecta alrededor de 350 millones de personas en todo el mundo y en torno a 6,6 millones de personas en nuestro país1,2. Con estas cifras, es obvio que se necesitan fármacos hipoglucemiantes potentes para controlar la pandemia y reducir su comorbilidad. En este sentido, es importante recordar que la enfermedad cardiovascular es la primera causa de muerte en la diabetes mellitus tipo 2, pudiendo llegar a explicar hasta el 70% de las muertes3. Por ello, considerando que el primer objetivo del tratamiento de la enfermedad no es normalizar la glucemia sino prevenir sus complicaciones4,5, llama la atención que los datos disponibles hasta el momento sobre el efecto cardiovascular de los diferentes hipoglucemiantes sean escasos y poco consistentes, especialmente para lo que podríamos llamar variables principales «duras». Este hecho, junto con la publicación de los datos que llevaron a la retirada de la rosiglitazona, provocó, a finales de la pasada década, el cambio de las condiciones necesarias para la aprobación de los diferentes fármacos por parte de las agencias reguladoras6,7. Desde entonces, se han modificado los diseños de los ensayos clínicos en fase iii de manera que permiten llevar a cabo metanálisis más consistentes y se han puesto en marcha megaensayos poscomercialización de seguridad cardiovascular. Este cambio de «política» ha generado y generará nuevos datos que quizás cambien el paradigma de tratamiento de la diabetes mellitus en el futuro.
En el artículo se revisan los efectos cardiovasculares de los diferentes hipoglucemiantes haciendo especial referencia en su impacto en el riesgo de episodios cardiovasculares mayores, la normativa actual para su desarrollo clínico y los diferentes estudios en curso cuyos resultados pueden suponer un cambio importante en los algoritmos de tratamiento de la diabetes mellitus. No se incluye la insulina pues supera los objetivos de este trabajo y debería ser motivo de un análisis individualizado.
MetforminaLa metformina disminuye de forma eficaz la glucemia en los pacientes con diabetes mellitus tipo 2. Este efecto se debe fundamentalmente a la disminución de la producción hepática de glucosa por inhibición de la gluconeogénesis. Además, estimula la captación de glucosa mediada por insulina en músculo esquelético y adipocitos. La metformina ha demostrado efectos beneficiosos en marcadores intermedios de riesgo cardiovascular8–13. Desde la publicación del United Kingdom Diabetes Prospective Study en 1998 (UKPDS 34)14, la metformina se recomienda como fármaco de primera línea en las guías clínicas más relevantes15–17. Cuando se comparó con la dieta sola, la metformina mostró una disminución de la mortalidad por cualquier causa en pacientes con sobrepeso (riesgo relativo [RR] = 0,64; intervalo de confianza [IC] 95%: 0,45-0,91). No obstante, se evidenció un aumento de mortalidad con metformina + sulfonilurea en comparación con sulfonilurea (RR = 1,6; IC 95%: 1,02-2,52). Los autores del UKPDS atribuyeron este resultado a la casualidad. Diversos metanálisis que concluyen que la metformina reduce la mortalidad cardiovascular no incluyen los resultados del UKPDS obtenidos en pacientes sin sobrepeso18–20. Un metanálisis reciente de 13 ensayos clínicos aleatorizados (9.560 pacientes asignados a metformina y 3.550 a comparadores o placebo) no pudo demostrar un efecto beneficioso de la metformina sobre la mortalidad por cualquier causa (RR = 0,99; IC 95%: 0,75-1,31) ni sobre la mortalidad cardiovascular (RR = 1,05; IC 95%: 0,67-1,64). Tampoco se vieron afectados objetivos secundarios como infarto, ictus, amputaciones, insuficiencia cardíaca y enfermedad vascular periférica. Cabe destacar que la inclusión de los diferentes subgrupos del UKPDS introdujo un componente importante de heterogeneidad21. El número relativamente bajo de ensayos y eventos en estos metanálisis hacen que estos resultados deban ser interpretados con cautela. Por tanto, podríamos decir que a pesar de que la metformina se considera el tratamiento de primera línea, su supuesto beneficio de disminución de la mortalidad cardiovascular sigue siendo incierto y haría falta un ensayo clínico específico dirigido a aclarar esta situación.
El efecto deletéreo de la combinación sulfonilurea-metformina tampoco está bien aclarado. El análisis de 5 estudios en los que se compara metformina con metformina asociada (add-on) a sulfonilurea muestra un incremento de la mortalidad en el grupo de metformina + sulfonilurea (RR = 1,55; IC 95%: 1,03-2,33)21, aunque este resultado se debe sobre todo a los efectos del UKPDS 3414. Por el contrario, en el estudio ADVANCE la combinación metformina + sulfonilurea no se asoció con un aumento de mortalidad22. El estudio RECORD tampoco encontró diferencias entre la combinación metformina + sulfonilurea vs. rosiglitazona23. Sin embargo, debemos destacar que la rosiglitazona se asocia a un aumento del riesgo cardiovascular por lo que en este caso no sería un buen comparador. Por otro lado, los estudios observacionales muestran resultados contradictorios24–26. Un metanálisis de estudios observacionales indica un aumento de riesgo de un objetivo final combinado que incluye hospitalización y muerte cardiovascular (RR = 1,43; IC 95%: 1,10-1,85)27.
Sulfonilureas y meglitinidasLas sulfonilureas y meglitinidas disminuyen la glucemia mediante su unión a los receptores de la sulfonilurea en la célula β (subunidades de los canales de K+-ATP sensibles de la membrana plasmática [KATPC]). Los miembros de estas familias tienen diferentes propiedades farmacocinéticas y farmacodinámicas28. Las diferencias entre moléculas en relación a sus acciones miocárdicas13 y riesgo de hipoglucemias20 podrían explicar los resultados de algunos estudios. Así, el aumento de mortalidad observado en la rama de tratamiento intensivo del estudio ACCORD no se observó en el estudio ADVANCE, con un diseño similar, siendo la glibenclamida la sulfonilurea más utilizada en el ACCORD y la glicazida la sulfonilurea prescrita por protocolo en el estudio ADVANCE22,29. Recientemente, Schramm et al.30 han realizado un estudio observacional en 107.806 individuos de los cuales 9.607 habían presentado un infarto previo. Estos autores han detectado un aumento del riesgo de mortalidad por cualquier causa en los pacientes sin infarto previo tratados con glimepirida, en comparación con metformina (hazard ratio [HR] = 1,32; IC 95%: 1,24-1,40), glibenclamida (HR = 1,19; IC 95%: 1,11-1,28), glipizida (HR = 1,27; IC 95%: 1,17-1,38) y tolbutamida (HR = 1,28; IC 95%: 1,17-1,39). Los resultados para los pacientes con infarto previo fueron similares para glimepirida (HR = 1,30; IC 95%: 1,11-1,44), glibenclamida (HR = 1,47; IC 95%: 1,22-1,76), glipizida (HR = 1,53; IC 95%: 1,23-1,89) y tolbutamida (HR = 1,47; IC 95%: 1,17-1,84). No se observaron diferencias para glicazida y repaglinida (meglitinida). Estos datos apoyan la existencia de diferencias individuales de seguridad entre los diferentes secretagogos que deberían ser aclaradas en ensayos clínicos.
Desgraciadamente, es probable que estos estudios no se lleven a cabo nunca ya que, al tratarse de fármacos comercializados hace años, será difícil obtener los fondos necesarios. Por otro lado, cabe decir que las guías clínicas más recientes colocan a los secretagogos en un segundo escalón terapéutico y hacen referencia a los inconvenientes de estos fármacos respecto a las hipoglucemias, el aumento de peso y las posibles interferencias en los mecanismos de protección miocárdica17. Así, es probable que el uso clínico de las sulfonilureas más problemáticas vaya perdiendo terreno frente a los secretagogos de acción más corta con mejor perfil de seguridad o frente a fármacos no secretagogos.
GlitazonasLas glitazonas activan el factor de transcripción nuclear PPAR-ϒ modulando la expresión de numerosos genes que intervienen en el metabolismo de la glucosa. Desde la retirada del mercado de la rosiglitazona, la única glitazona disponible en el mercado es la pioglitazona. La pioglitazona ejerce un gran número de efectos pleiotrópicos. Mejora la resistencia a la insulina, los niveles de múltiples marcadores de inflamación y el perfil lipídico, al disminuir el colesterol total, los triglicéridos, el colesterol LDL y aumentar el colesterol HDL. También reduce la progresión del engrosamiento de la íntima media carotídea en los pacientes con diabetes31.
La pioglitazona, a diferencia de la rosiglitazona, no ha mostrado un aumento del riesgo de eventos cardiovasculares en diversos metanálisis. Además, la pioglitazona es el único antidiabético que ha mostrado una disminución de episodios cardiovasculares en un ensayo clínico con un volumen considerable de pacientes en prevención secundaria. En el estudio PROactive se aleatorizaron 5.238 pacientes a pioglitazona o placebo. El objetivo primario final compuesto fue muerte de cualquier causa, infarto agudo de miocardio (IAM) no mortal, ictus, síndrome coronario agudo, intervención endovascular o quirúrgica sobre coronaria o arteria de extremidad inferior y amputación supramaleolar. Tras 5 años, no se observó disminución del objetivo primario con pioglitazona (RR = 0,9; IC 95%: 0,8-1,02). Sin embargo, la pioglitazona disminuyó un objetivo final secundario compuesto de muerte de cualquier causa, IAM no mortal e ictus (RR = 0,84; IC 95%: 0,72-0,98). El grupo de pioglitazona presentó mayor incidencia de insuficiencia cardíaca congestiva no mortal (11 vs. 8%; p < 0,0001)32. El análisis de subgrupos indicó que la pioglitazona reducía el riesgo de ictus en pacientes con riesgo elevado y el reinfarto en pacientes con IAM previo33,34. Sin embargo, la ausencia de diferencias en el objetivo primario hace que los resultados del PROactive hayan sido motivo de controversia35,36.
En el estudio más reciente sobre regresión de placa PERISCOPE que comparaba pioglitazona con glimepirida en 543 pacientes con enfermedad coronaria, a los 18 meses, la pioglitazona redujo la progresión de la placa respecto al comparador (–0,17 vs. +0,73%; p = 0,02), sin embargo, no se observaron diferencias respecto a objetivos secundarios de muerte cardiovascular e IAM no mortal, revascularización y hospitalización por insuficiencia cardíaca37.
En 2010, la US Food and Drug Administration (FDA) inició una revisión de seguridad por sospecha de aumento de cáncer de vejiga. En este momento, con la aparición de nuevos datos a favor de esta asociación, la pioglitazona ha sido retirada del mercado francés y no se permite iniciar tratamientos nuevos en Luxemburgo y Alemania38.
Inhibidores de las alfaglucosidasasLos inhibidores de las alfaglucosidasas (acarbosa, voglibosa y miglitol) son seudohidratos de carbono que disminuyen la glucemia al inhibir de forma competitiva las alfaglucosidasas intestinales. Esta inhibición retrasa la digestión de los hidratos de carbono complejos y, por tanto, la absorción de glucosa, limitando así la excursión posprandial de la glucemia39. A diferencia de otros antidiabéticos, los inhibidores de las alfaglucosidasas no muestran señales que hagan pensar en un posible aumento del riesgo cardiovascular. Por el contrario, afectan de forma favorable a múltiples factores de riesgo cardiovascular como la obesidad, la hipertensión, la disfunción endotelial y el IMT. Por otro lado, su riesgo de hipoglucemia en monoterapia es prácticamente nulo40.
El fármaco mejor estudiado del grupo ha sido la acarbosa. En el ensayo STOP-NIDDM la acarbosa no solo se asoció a una disminución del riesgo de desarrollar diabetes mellitus tipo 2 del 36% sino también a una disminución significativa del riesgo de sufrir episodios cardiovasculares del 49% (RR = 0,51; IC 95%: 0,28-0,95) y a una disminución del riesgo de HTA del 34% (RR = 0,66; IC 95%: 0,49-0,89)41. En concordancia con estos datos, un metanálisis de 7 ensayos clínicos con 2.180 pacientes con diabetes mellitus tipo 2 mostró una disminución significativa del riesgo de IAM (RR = 0,36; IC 95%: 0,16-0,80) y de cualquier episodio cardiovascular (RR = 0,65; IC 95%: 0,48-0,88). Además, el control metabólico, el peso y la presión arterial sistólica también mejoraron de forma significativa en los pacientes tratados con acarbosa42.
Es de destacar que, a pesar de estos datos, el documento de posicionamiento actual de la American Diabetes Association (ADA) y la Association for the Study of Diabetes (EASD) para el tratamiento de la diabetes mellitus tipo 2, a pesar de que nombra a estos fármacos como una posible opción terapéutica poco utilizada en Europa y en Estados Unidos, no los incluye en su algoritmo de tratamiento entre las 5 opciones preferentes de segunda línea. Por contra, destaca que tienen un efecto modesto sobre la HbA1c (−0,5 a 1,0%) y una elevada frecuencia de efectos adversos gastrointestinales (flatulencia y diarrea)17.
Inhibidores de la dipeptidilpeptidasa de tipo 4Los inhibidores de dipeptidilpeptidasa de tipo 4 (IDPP4) ejercen su efecto hipoglucemiante fundamentalmente por la inhibición de la degradación de la incretina GLP-1 (péptido similar a glucagón de tipo 1) por parte de la enzima DPP4. Esta inhibición provoca un aumento de las concentraciones del GLP-1 nativo producido por las células L ileales en respuesta a la ingesta. La GLP-1 estimula la secreción de insulina de un modo dependiente de la glucosa, suprime la secreción de glucagón y retrasa el vaciado gástrico43. Los IDPP4 se administran por vía oral en 1 o 2 dosis al día y consiguen disminuciones moderadas de HbA1c (0,6-1%) con un perfil de seguridad, hasta la fecha, aceptable44. En nuestro país se han comercializado sitagliptina, vildagliptina, saxagliptina y linagliptina.
El GLP-1ha demostrado efectos cardiovasculares beneficiosos en diferentes modelos experimentales45–48. En humanos, se ha observado cómo GLP-1 mejora la disfunción endotelial secundaria a la hiperglucemia posprandial y se ha indicado un efecto cardioprotector de GLP-149,50. Por tanto, podemos pensar que la elevación de GLP-1 secundaria a la inhibición de DPP4 puede tener efectos beneficiosos desde el punto de vista cardiovascular.
Se ha publicado un metanálisis de los 42 ensayos clínicos con IDPP4 con una duración mínima de 24 semanas (137 episodios de efectos adversos cardiovasculares mayores [MACE] en el grupo de IDDP4 y 120 en el grupo de comparadores). Los IDPP4 se asociaron a un riesgo significativamente menor de MACE (Mantel-Haensel odds ratio [MH-OR] = 0,689; IC 95%: 0,528-0,899). La significación se mantenía independientemente de la duración del ensayo clínico, tipo de DPP4 o comparador44. Se obtenían también resultados similares al excluirse como comparadores los agonistas del receptor de GLP-1 y la rosiglitazona (MH-OR = 0,717; IC 95%: 0,548-0,939). Los valores para placebo como comparador fueron: MH-OR = 0,705 (IC 95%: 0,500-0,993). De la misma manera, los datos de mortalidad (46 ensayos clínicos: 28 y 31 muertes para IDPP4 y comparadores, respectivamente) fueron MH-OR = 0,668 (IC 95%: 0,396-1,124) para muerte de cualquier causa y MH-OR = 0,505 (IC 95%: 0,252-1,011) para muerte de tipo cardiovascular44. Estos datos van en concordancia con los resultados del metanálisis realizado a nivel individual para sitagliptina y vildagliptina, si bien en estos estudios, por tener una muestra de pacientes menor, las diferencias para MACE con los comparadores no alcanzaron significación estadística51,52. Recientemente, se ha publicado un metanálisis de los estudios de la fase 3 del programa de desarrollo clínico de linagiptina. El RR de la linagliptina respecto a comparadores para un objetivo final primario combinado (muerte cardiovascular [IAM o ictus mortales], ictus no mortal, IAM no mortal y hospitalización por angina inestable) fue de 0,34 (IC 95%: 0,16-0,70)53. El análisis retrospectivo de MACE del programa de desarrollo clínico saxagliptina también ha mostrado una disminución significativa del riesgo (RR = 0,42; IC 95%: 0,23-0,80)54.
Así pues, la mayoría de datos indican que los IDPP4 probablemente son capaces de reducir los episodios cardiovasculares en los pacientes con diabetes. Serán los resultados futuros de los megaensayos de seguridad en población de riesgo los que permitirán la confirmación definitiva de esta hipótesis. La nueva actualización del documento de consenso ADA/EASD sobre el tratamiento de la hiperglucemia en la diabetes mellitus tipo 2 sitúa a estos fármacos en la segunda línea destacando su eficacia intermedia en la disminución de la HbA1c, su efecto neutro sobre el peso, su bajo riesgo de hipoglucemia, pocos efectos secundarios y un coste elevado17.
Agonistas del receptor del péptido similar a glucagón de tipo 1Los agonistas del receptor de GLP-1 (ARGLP1) son moléculas polipeptídicas resistentes a la acción de DPP4. Su unión al receptor de GLP-1 estimula la secreción de insulina dependiente de glucosa y suprime la secreción de glucagón. A diferencia de los IDPP4, el nivel de activación del receptor de GLP-1 con dosis farmacológicas de los ARGLP1 es muy superior al que se alcanza en condiciones fisiológicas en los individuos sanos. Ello explica en parte que, a diferencia de los IDPP4, retrasen el vaciamiento gástrico, aumenten la sensación de saciedad a nivel central y provoquen pérdida de peso55. Además de sus efectos metabólicos, se les atribuyen otros efectos pleiotrópicos favorables para el sistema cardiovascular que han sido demostrados básicamente en modelos experimentales56. Entre estos, cabe destacar la mejoría del acondicionamiento por isquemia con limitación del tamaño del infarto, mejoría de la función ventricular en modelos animales y pacientes con insuficiencia cardíaca, mejoría de la función endotelial y disminución del tono vascular periférico, e inhibición de la respuesta inflamatoria de los macrófagos en modelos in vitro y murinos57.
En nuestro país, existen 2 ARGLP1 comercializados: exenatida y liraglutida. Exenatida es un incretín-mimético que tiene una homología con GLP-1 nativo del 53%. Se administra por vía subcutánea 2 veces al día. Liraglutida es un análogo de GLP-1 cuya homología con el GLP-1 nativo es del 97%. Se administra por vía subcutánea una vez al día. Ambos fármacos tienen un impacto positivo en el perfil de riesgo cardiovascular al reducir el peso, disminuir la presión arterial y mejorar el perfil lipídico56. El análisis de datos de 6 ensayos clínicos y 2.171 individuos tratados con exenatida mostró una disminución de la presión sistólica de 2,8mm Hg en comparación con placebo58. De la misma manera, el metanálisis de los estudios Liraglutide Effect and Action in Diabetes (LEAD) encontró una disminución media de la presión sistólica de 2,5mm Hg en los pacientes asignados a liraglutida. Es interesante resaltar que con liraglutida esta disminución se aprecia a las 2 semanas de tratamiento, lo que apoya el concepto de que este efecto no es debido a la pérdida de peso59. Ambos fármacos han sido comparados frente a frente en un estudio a 26 semanas (LEAD-6) apreciándose una mayor reducción de HbA1c para liraglutida y una disminución similar de peso respecto a la situación basal (−3,24kg vs. −2,87kg para liraglutida y exenatida, respectivamente)60. En un estudio de extensión del LEAD-6, en el cual los pacientes que estaban en tratamiento con liraglutida continuaron con liraglutida y aquellos que estaban con exenatida cambiaron a liraglutida hasta completar 40 semanas, se observó, en el grupo de pacientes que cambió de exenatida a liraglutida, un descenso significativo de HbA1c (−0,32 ± 0,043%; p < 0,0001) y de peso (−0,9 ± 0,15kg; p < 0,0001)61. Un metanálisis de los 7 estudios de la fase iii de desarrollo clínico de liraglutida muestra disminuciones de colesterol total, LDL y TG (−0,17, −0,08 y −0,28 mmol/l, respectivamente). En el mismo estudio también se observa mejoría de los niveles de PAI-1, BNP y PCR ultrasensible (−7,2, −10 y 24%, respectivamente)62. Exenatida también ha demostrado efectos beneficiosos sobre el perfil lipídico. Datos de pacientes seguidos hasta 3,5 años (n = 151) muestran una disminución significativa de TG del 12%, colesterol LDL del 6% y un aumento de colesterol HDL del 24%63. De la misma manera, exenatida se asoció a una disminución de los niveles de PCR en un ensayo clínico frente a insulina glargina (n = 60) de un año de duración64.
Recientemente, se ha publicado el análisis de MACE (muerte de origen cardiovascular, IAM e ictus) de todos los ensayos de la fase ii y iii del desarrollo clínico de liraglutida en el cual el RR para MACE asociado a liraglutida vs. los comparadores fue 0,73 (IC 95%: 0,38-1,41)65. Los datos para exenatida en un estudio de similares características para MACE, sobre 12 ensayos clínicos con insulina o placebo como comparadores, mostraron un RR de 0,7 (IC 95%: 0,38-1,31)66. Finalmente, un análisis reciente con datos combinados para liraglutida y exenatida de 20 ensayos clínicos obtuvo un MH-OR para MACE de 0,74 (IC 95%: 0,50-1,08) (MH-OR = 0,85 [IC 95%: 0,5-1,45] para exenatida; MH-OR = 0,69 [IC 95%: 0,40-1,22] para liraglutida)67.
Los ARGLP1 son el grupo terapéutico que con mayor probabilidad puede conseguir en un mismo paciente que se cumpla el objetivo de control de HbA1c, sin hipoglucemias, sin aumento de peso y con un buen control de la presión arterial. En este sentido, el documento de consenso ADA/EASD sobre el tratamiento de la hiperglucemia en la diabetes mellitus tipo 2 sitúa a estos fármacos en la segunda línea de tratamiento destacando como ventajas su eficacia elevada en la disminución de la HbA1c, su capacidad para inducir pérdida de peso y su bajo riesgo de hipoglucemia. Como contrapartida subrayan la elevada frecuencia de efectos gastrointestinales y su coste elevado17.
Nuevas guías para el desarrollo de fármacos para el tratamiento de la diabetesEn diciembre de 2008, la FDA publicó una guía que modificaba las condiciones para la aprobación de fármacos para el tratamiento de la diabetes6. En esta guía se incluía, además de la necesidad de demostrar que los fármacos fueran capaces de disminuir la glucemia, la necesidad de una evaluación sólida de la seguridad cardiovascular. La publicación de este documento respondía, además de al elevado riesgo cardiovascular que acompaña a la diabetes mellitus, a la toma de conciencia de que algunos fármacos ya comercializados podían ser potencialmente peligrosos desde el punto de vista cardiovascular y de que, incluso, los datos de seguridad cardiovascular de fármacos que estaban en proceso de aprobación no eran concluyentes. En este sentido, cabe recordar la detención del desarrollo de muraglitazar tras observarse en un metanálisis que se asociaba a un exceso de riesgo cardiovascular y la retirada del mercado de la rosiglitazona68,69. La historia de estos 2 fármacos nos enseña que la evaluación del riesgo cardiovascular no debe basarse en marcadores intermedios sino en variables «duras». En 2010, la European Medicines Agency (EMA) emitió un documento con características similares al de la FDA7.
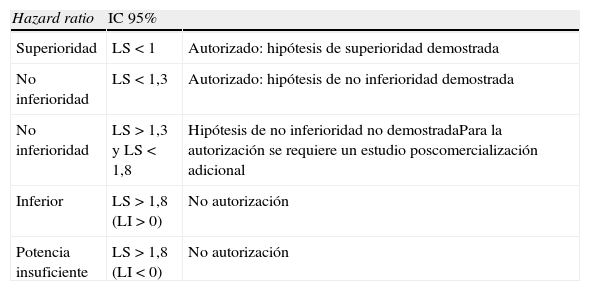
Las reglas del juego han cambiado en las siguientes líneas: a) los programas de desarrollo clínico fase ii y iii deben permitir el metanálisis; así pues, debe remitirse un protocolo que describa el análisis de subgrupos y los métodos estadísticos; deben incluirse subgrupos de pacientes que incluyan a las poblaciones diana (por ejemplo, ancianos, pacientes con riesgo cardiovascular elevado, etc.); deben recogerse obligatoriamente IAM, ictus y mortalidad cardiovascular como eventos adjudicados de forma independiente; además, se considerarán de forma opcional los eventos «hospitalización por síndrome coronario agudo» o «procedimientos de revascularización urgentes»; también debe disponerse de un comité independiente para adjudicar de manera prospectiva aquellos eventos que formen parte de los objetivos finales de seguridad cardiovascular, y b) el límite superior de IC 95% para el objetivo de seguridad cardiovascular del metanálisis se utilizará como parámetro para decidir la aprobación tal y como se describe en la tabla 170.
Criterios de la Food and Drugs Administration para determinar seguridad cardiovascular en el desarrollo clínico de antidiabéticos
| Hazard ratio | IC 95% | |
| Superioridad | LS < 1 | Autorizado: hipótesis de superioridad demostrada |
| No inferioridad | LS < 1,3 | Autorizado: hipótesis de no inferioridad demostrada |
| No inferioridad | LS > 1,3 y LS < 1,8 | Hipótesis de no inferioridad no demostradaPara la autorización se requiere un estudio poscomercialización adicional |
| Inferior | LS > 1,8 (LI > 0) | No autorización |
| Potencia insuficiente | LS > 1,8 (LI < 0) | No autorización |
IC: intervalo de confianza; LI: límite inferior; LS: límite superior.
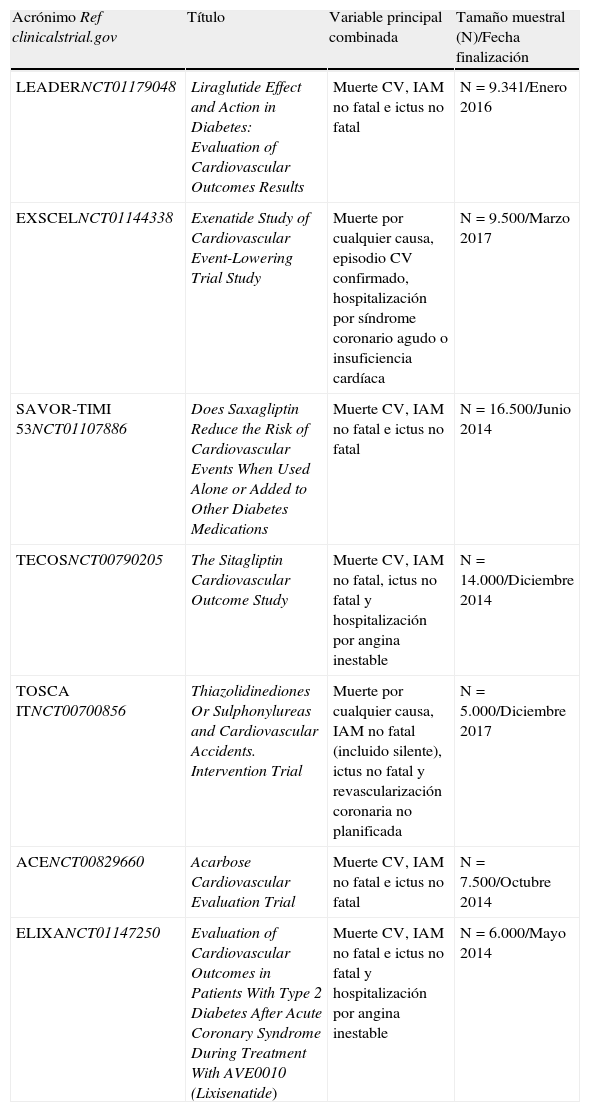
El cambio de las reglas del juego no ha tenido un impacto negativo en el número de ensayos clínicos registrados. Al contrario, desde 2008, el número de ensayos clínicos con objetivos cardiovasculares registrados en ClinicalTrials.gov se ha duplicado y el número de pacientes incluidos se ha sextuplicado. En la tabla 2 se detallan las características de los ensayos clínicos activos de seguridad cardiovascular más relevantes71. Variables combinadas, como «muerte por causas cardiovasculares, infarto agudo de miocardio no fatal e ictus no fatal» han desplazado a otras como «muerte de cualquier causa» en la evaluación del objetivo primario70,72. Esta tendencia probablemente es el resultado del reconocimiento de que la inclusión de objetivos más blandos en el objetivo final primario, con la intención de aumentar el número de eventos (que pueden estar sujetos a una variabilidad que no depende de la rama de tratamiento), quizás disminuya la especificidad y la potencia estadística para detectar diferencias entre tratamiento y comparador. Por otro lado, esta confluencia hacia objetivos combinados finales comunes facilitará los análisis futuros de comparación de eficacia y seguridad entre diferentes moléculas. En este sentido cabe destacar la aparición de iniciativas como la Standarized Data Collection for Cardiovascular Trials Initiative que está dirigida a estandarizar las definiciones de los objetivos finales (end-points) cardiovasculares73.
Ensayos clínicos aleatorizados actualmente en marcha para evaluar el riesgo de episodios cardiovasculares asociado a antidiabéticos
| Acrónimo Ref clinicalstrial.gov | Título | Variable principal combinada | Tamaño muestral (N)/Fecha finalización |
| LEADERNCT01179048 | Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcomes Results | Muerte CV, IAM no fatal e ictus no fatal | N = 9.341/Enero 2016 |
| EXSCELNCT01144338 | Exenatide Study of Cardiovascular Event-Lowering Trial Study | Muerte por cualquier causa, episodio CV confirmado, hospitalización por síndrome coronario agudo o insuficiencia cardíaca | N = 9.500/Marzo 2017 |
| SAVOR-TIMI 53NCT01107886 | Does Saxagliptin Reduce the Risk of Cardiovascular Events When Used Alone or Added to Other Diabetes Medications | Muerte CV, IAM no fatal e ictus no fatal | N = 16.500/Junio 2014 |
| TECOSNCT00790205 | The Sitagliptin Cardiovascular Outcome Study | Muerte CV, IAM no fatal, ictus no fatal y hospitalización por angina inestable | N = 14.000/Diciembre 2014 |
| TOSCA ITNCT00700856 | Thiazolidinediones Or Sulphonylureas and Cardiovascular Accidents. Intervention Trial | Muerte por cualquier causa, IAM no fatal (incluido silente), ictus no fatal y revascularización coronaria no planificada | N = 5.000/Diciembre 2017 |
| ACENCT00829660 | Acarbose Cardiovascular Evaluation Trial | Muerte CV, IAM no fatal e ictus no fatal | N = 7.500/Octubre 2014 |
| ELIXANCT01147250 | Evaluation of Cardiovascular Outcomes in Patients With Type 2 Diabetes After Acute Coronary Syndrome During Treatment With AVE0010 (Lixisenatide) | Muerte CV, IAM no fatal e ictus no fatal y hospitalización por angina inestable | N = 6.000/Mayo 2014 |
CV: cardiovascular; IAM: infarto agudo de miocardio.
La diabetes mellitus afecta a un gran número de personas en todo el mundo. Teniendo en cuenta que la principal causa de morbimortalidad en estos pacientes es la enfermedad cardiovascular, la seguridad cardiovascular de los antidiabéticos es un aspecto de importancia capital. Sin embargo, los datos disponibles de los fármacos comercializados son poco consistentes, especialmente para los más antiguos.
Así, incluso para el fármaco de primera línea metformina, supuestamente beneficioso desde el punto de vista cardiovascular, pueden existir dudas razonables, especialmente cuando se administra en combinación con sulfonilureas. De la misma manera, existen dudas para las sulfonilureas, fármacos ampliamente utilizados, para los que diferentes estudios indican que en algunos casos incluso podrían favorecer la aparición de episodios cardiovasculares. Por el contrario, los datos para los fármacos más modernos basados en incretinas señalan que tienen efectos cardiovasculares beneficiosos. Sin embargo, los niveles de evidencia disponibles para decir que estos fármacos son capaces de reducir la mortalidad cardiovascular y complicaciones como el IAM o el ictus son, a fecha de hoy, bajos. Los análisis post hoc difícilmente pueden determinar el riesgo o beneficio de uno u otro fármaco sobre un objetivo concreto cuando estos no han sido aleatorizados a tales efectos.
En este sentido, las agencias reguladoras han modificado la normativa para la aprobación de los hipoglucemiantes. Sus guías han evolucionado desde una normativa glucocéntrica hacia una normativa basada en variables principales «duras» de seguridad cardiovascular. Este cambio ha generado la puesta en marcha de ensayos clínicos mejor diseñados, a largo plazo, con más potencia estadística y de gran tamaño. Se ha sugerido que esta estrategia aumentará los costes y frenará la innovación farmacoterapéutica. Sin embargo los datos disponibles indican que el número de estudios registrados ha aumentado y el número de pacientes seleccionados se ha sextuplicado en los 3 últimos años.
El resultado de estos megaensayos aportará información fiable sobre seguridad y eficacia a largo plazo. Por tanto, es posible que en función de sus resultados cambie el paradigma de tratamiento de la diabetes mellitus. Una cuestión interesante será ver como la comunidad científica tratará la seguridad cardiovascular de los fármacos genéricos que no disponen de datos concluyentes como los que se generarán para los nuevos fármacos.
Conflicto de interesesEl autor ha recibido honorarios por ponencias y/o consultoría de Abbott, GSK, MSD, Lilly, Menarini, Novartis, Pfizer, Novonordisk, Sanofi-Aventis y Roche. El Dr. Masmiquel ha participado en ensayos clínicos esponsorizados por Novartis, Lilly, Abbott, Boehrnger-Ingelheim, MSD, Astra-Zeneca, Novonordisk y Sanofi-Aventis.
El autor ha contado con la ayuda editorial de Teresa Hernando de COCIENTE S.L. para este manuscrito, ayuda que ha sido financiada por Novo Nordisk Pharma, S.A. Nordisk Pharma, S.A. ha revisado la fidelidad de la información presentada en este manuscrito.