Realizar un estudio de coste-utilidad en pacientes asmáticos en tratamiento con beclometasona/formoterol en combinación fija en Atención Primaria de Salud.
Material y métodosSe seleccionó de forma no probabilística un grupo de pacientes asmáticos con severidad persistente moderada/grave (GEMA 2009), en tratamiento con beclometasona/formoterol a dosis fijas, mayores de 18 años, que habían otorgado su consentimiento informado. El período de observación del estudio fue de 6 meses. Las variables estudiadas fueron: edad, sexo, duración de la enfermedad, recursos sanitarios empleados, análisis de la calidad de vida relacionada con la salud mediante EQ-5D y SF-36, y el cuestionario específico Asthma Quality of Life Questionnaire. Para las variables cualitativas se analizó la frecuencia y la proporción. Para las cuantitativas, la media, la DE y el IC 95%. En la estadística inferencial se utilizaron los test de Chi-cuadrado, t de Student y ANOVA. Las comparaciones se realizaron con una significación estadística de 0,05.
ResultadosSesenta y cuatro pacientes completaron el estudio; el 59,4% eran mujeres. La edad media fue de 49 años y la duración media de la enfermedad fue de 93 meses. Para el control del asma el 53% de los pacientes tenían una pauta prescrita de uno/12h. Todas las escalas de calidad de vida relacionada con la salud se modificaron respecto del inicio del estudio y las diferencias fueron estadísticamente significativas. Nuestros pacientes lograron mejores puntuaciones en calidad de vida relacionada con la salud que la cohorte española de asma. El coste-utilidad incremental de beclometasona/formoterol frente a la opción habitual de tratamiento fue de 6.256€/AVAC.
To perform a cost-utility analysis on asthmatic patients on beclomethasone/formoterol fixed combination in Primary Health Care.
Material and methods Non-probability sampling was used to select a group of asthmatic patients with moderate/severe persistent severity (GEMA 2009), treated with beclomethasone/formoterol fixed combination, over 18 years, had given their informed consent. The study observation period was 6 months. The variables studied were: age, sex, duration of disease, health resources used, analysis of health related quality of life by EQ-5D and SF-36, and the specific Asthma Quality of Life Questionnaire. For the qualitative variables, the frequency and percentages were calculated, and for the quantitative variables, the mean, SD and 95% CI. Chi-square, Student t-test and ANOVA were used for statistical inference. Comparisons were made with a statistical significance of 0.05.
ResultsOf the 64 patients that completed the study, 59.4% were female. The mean age was 49 years, and mean disease duration was 93 months. For asthma control, 53% of patients had a prescription pattern of one/12h. All health related quality of life scales were modified with respect to the baseline and the differences were statistically significant. Our patients had a better health related quality of life than Spanish asthma cohort. The incremental cost utility beclomethasone/formoterol versus usual treatment option was € 6,256/QALY.
El asma es una enfermedad respiratoria crónica que tiene una alta prevalencia en nuestra sociedad; aproximadamente el 5% de la población española padece asma1, con impacto significativo en las personas, sus familias y la sociedad2. Aunque la mortalidad es baja, tiene una elevada morbilidad e importantes costes económicos (3.022 millones de euros al año en nuestro país)3, con una tendencia en aumento debido al incremento de su prevalencia, de la esperanza de vida y la aparición de nuevos medicamentos. La enfermedad se manifiesta con síntomas (tos, disnea, opresión torácica) diurnos y/o nocturnos, persistentes en el tiempo o intermitentes con agudizaciones que pueden poner en peligro la vida. Aunque las Guías de Práctica Clínica1,2 marcan como principal objetivo en el manejo del asma conseguir su control, definido como aquel grado en que las manifestaciones de la enfermedad están ausentes o se reducen al máximo por las intervenciones terapéuticas4, este no se consigue en el 72% de los pacientes5. Su mal control supone unas consecuencias negativas asociadas como disminución de la calidad de vida relacionada con la salud (CVRS), pérdida de productividad laboral, actividad diaria disminuida e incremento de la utilización de los recursos sanitarios6. Hay estudios que demuestran que cuando el control del asma se logra, mejora considerablemente la CVRS de los pacientes asmáticos7. En los últimos años se sostiene la importancia de considerar la CVRS como herramienta de evaluación de los tratamientos en las enfermedades crónicas; en los estudios clínicos, además de las variables clínicas tradicionales, el uso de otras basadas en el paciente es cada vez más frecuente y se considera cada vez más importante en la evaluación de intervenciones sanitarias.
Es precisamente en el asma donde más se ha desarrollado el estudio y evaluación de la CVRS, al menos en el terreno del ensayo clínico8–10. Conocer el grado de deterioro en CVRS que el asmático presenta en un momento dado y evaluar si las alternativas terapéuticas son capaces de reducir ese deterioro detectado permite cumplir un doble objetivo: a) evaluar de forma comprehensiva la gravedad real de esta enfermedad, y b) identificar qué modalidad de tratamiento resulta más eficaz en términos clásicos (reducción de síntomas, mejoría de la función pulmonar), y tomando en consideración el bienestar subjetivo del individuo11–13.
Las Guías de Práctica Clínica para el tratamiento farmacológico del asma recomiendan una terapia generalmente inhalada de una forma escalonada con los fármacos necesarios para conseguir el control. En el asma persistente moderado y grave se recomienda la terapia combinada de un broncodilatador de larga duración y un corticoide inhalado a dosis bajas, medias o altas según el estado de control, a los que se pueden asociar otros fármacos1,2. Entre las combinaciones corticoide inhalado/broncodilatador de larga duración, la combinación de beclometasona y formoterol (DPB/FOR), en un dispositivo de inhalación presurizado de dosis medida en partículas extrafinas, ha demostrado su eficacia en el control del asma14,15, siendo una de las alternativas para el tratamiento del asma, con mejor perfil coste-efectividad que otros tratamientos16.
El concepto de utilidad terapéutica de los medicamentos en el marco de las decisiones de política sanitaria y farmacéutica cobra cada día más interés con la valoración de la contribución de las innovaciones farmacéuticas al incremento marginal en el estado de salud y al incremento marginal en el consumo de recursos (relación coste-efectividad incremental)17. Por ello, se recomienda la realización de estudios de evaluación económica de los medicamentos empleados en el tratamiento del asma y, si es posible, en su ámbito natural, y quien mejor puede objetivar la realidad diaria del asma es el médico de familia por los valores de cercanía, accesibilidad, continuidad y seguimiento de los cuidados, características del primer nivel asistencial que hacen, además, de la prestación de servicios clínicos, el marco adecuado para investigar en condiciones reales (efectividad) y que debería convertirse en una prioridad18,19, recomendándose metodologías de investigación con estudios que midan los resultados de salud o la calidad de vida20.
Este trabajo tiene como objetivo principal realizar un estudio de coste-utilidad en pacientes asmáticos en tratamiento con DPB/FOR en combinación fija, en Atención Primaria de Salud, y como objetivo secundario, conocer la CVRS de los pacientes asmáticos y la utilización de recursos que estos pacientes generan en el ámbito de la Atención Primaria.
Material y métodosAprobación del estudio y protocoloEste estudio fue clasificado por la Dirección de la Agencia Española de Medicamentos y Productos Sanitarios como «estudio de postautorización de seguimiento prospectivo», con número de registro 17536/RG 31687 y fecha 19 de abril de 2010. Así mismo, este estudio postautorización contó con la aprobación del Comité Ético de Investigación Clínica de Andalucía para su realización (acta 05/10).
Criterios de selección de pacientesSe seleccionó de forma no probabilística un grupo de pacientes pertenecientes a diversos cupos y centros de salud de nuestra comunidad autónoma (Córdoba, Málaga y Sevilla). Los criterios de inclusión fueron: pacientes asmáticos con severidad persistente moderada/grave (criterios de la Guía Española para el Manejo del Asma –GEMA– 2009)1; en tratamiento con DPB/FOR en asociación a dosis fijas (al menos entre 1-3 meses antes del inicio del estudio); mayores de 18 años; que hubieran otorgado su consentimiento informado. Los criterios de exclusión fueron: hipersensibilidad conocida al medicamento y/o a alguno de los excipientes; arritmias cardíacas de cualquier tipo; estenosis aórtica subvalvular idiopática, miocardiopatía hipertrófica obstructiva, cardiopatía grave, prolongación del intervalo QTc conocida o sospechada, pacientes con tirotoxicosis, diabetes mellitus, feocromocitoma e hipopotasemia no tratada; pacientes con tuberculosis pulmonar latente o activa e infecciones fúngicas o víricas de las vías respiratorias; pacientes que estén en tratamiento con betabloqueantes (incluidos colirios) o algún fármaco que interaccione con el medicamento objeto de estudio; embarazo y lactancia.
Período de observaciónSeis meses desde la inclusión en el estudio.
Descripción del tratamiento y definición de la exposiciónTodos los pacientes recibieron la asociación a dosis fija de DPB/FOR para el tratamiento habitual del asma. Las dosis se ajustaron según las características de la sintomatología presentada, y la pauta posológica, según lo establecido en la ficha técnica del producto, de acuerdo con la respuesta a la terapia.
Con el objetivo de prevenir cualquier efecto de siembra no deseado (inducción a la prescripción) se evitó en todo momento el uso de nombres comerciales, utilizando solo los de los principios activos.
Variables estudiadasLas variables estudiadas fueron: edad, sexo, duración de la enfermedad (meses), recursos sanitarios empleados en los últimos 6 meses (visitas al médico de Atención Primaria y Enfermería; visitas al especialista; número de exacerbaciones; número de ingresos debidos al asma y grado de severidad del asma).
En una enfermedad crónica, como es el caso del asma, los factores psicosociales y los síntomas modulan de forma importante su impacto sobre el individuo, de tal forma que la medida de la CVRS puede ser de gran ayuda para evaluar la respuesta a un tratamiento. Así, en nuestro estudio se emplearon 2 cuestionarios genéricos: EuroQol-5D (EQ-5D) y Short Form 36 (SF-36), y un cuestionario específico, el Asthma Quality of Life Questionnaire (AQLQ). Este último cuestionario evalúa los trastornos que el asma ocasiona en la vida diaria de los pacientes. Es un instrumento de elevada sensibilidad al cambio, adecuado, por lo tanto, para evaluar la respuesta a los tratamientos en los ensayos clínicos. Los estudios de validación del AQLQ de Juniper demostraron que el cuestionario posee buenas propiedades discriminativas, por lo que puede ser utilizado en estudios tanto transversales como longitudinales21. El AQLQ de Juniper está formado por 32 ítems, que se agrupan en 4 dimensiones: limitación de las actividades habituales (11 ítems), síntomas (12 ítems), función emocional (5 ítems) y estímulos ambientales (4 ítems). El período recordatorio para todos los ítems es de 2 semanas.
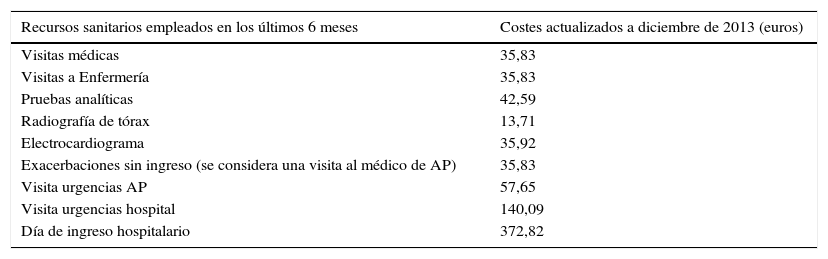
Costes de recursos sanitariosLos costes de los recursos sanitarios empleados en nuestra investigación se han obtenido del estudio AsmaCost3; todos los costes se actualizaron a diciembre de 2013 con el IPC de «medicinas» a partir de los datos ofrecidos por el Instituto Nacional de Estadística (http://www.ine.es/varipc/) (tabla 1).
Costes de los recursos sanitarios directos analizados
| Recursos sanitarios empleados en los últimos 6 meses | Costes actualizados a diciembre de 2013 (euros) |
|---|---|
| Visitas médicas | 35,83 |
| Visitas a Enfermería | 35,83 |
| Pruebas analíticas | 42,59 |
| Radiografía de tórax | 13,71 |
| Electrocardiograma | 35,92 |
| Exacerbaciones sin ingreso (se considera una visita al médico de AP) | 35,83 |
| Visita urgencias AP | 57,65 |
| Visita urgencias hospital | 140,09 |
| Día de ingreso hospitalario | 372,82 |
AP: Atención Primaria.
Para el análisis de coste-utilidad se han empleado 2 perspectivas de análisis diferentes, aunque complementarias, una mediante el EQ-5D y la otra mediante el SF-6D, índice de utilidad desarrollado a partir de una reducción a 6 dimensiones del SF-36.
A partir de las diferentes puntuaciones obtenidas en el EQ-5D se han calculado las utilidades (inicio y final) mediante un software específico22 y los AVAC ganados. El SF-6D, por otra parte, permite calcular un índice de utilidad a partir de la puntuación en 7 ítems del SF-36 de manera simple y rápida. Una posible ventaja del SF-6D frente al EQ-5D es que el sistema descriptivo es mucho mayor: permite describir 18.000 estados de salud, frente a los 243 del EQ-5D, lo que posibilitaría identificar pequeños cambios en el estado de salud percibido. Para adaptar el cálculo de las utilidades con el SF-6D en nuestro país se ha utilizado el algoritmo usado por Abellán et al.23.
Análisis estadísticoLa información correspondiente al cuaderno de recogida de datos se introdujo en soporte informático para su posterior examen y depuración; una vez verificados los datos se procedió al análisis estadístico mediante el software SPSS® v20 licenciado para la Universidad de Málaga.
En el análisis descriptivo de las variables cualitativas se analizó la frecuencia y la proporción; para las variables cuantitativas, la media, la desviación estándar (DE) y el intervalo de confianza al 95%.
En la estadística inferencial de las variables cualitativas se utilizó el test de Chi-cuadrado de Pearson; para las cuantitativas, el test t de Student (para muestras relacionadas); y para ambas, el test de ANOVA. Las comparaciones se realizaron con una significación estadística (error alfa bilateral) de 0,05.
ResultadosEl total de pacientes que completaron el estudio fue de 64, de los cuales el 40,6% fueron hombres y el 59,4% mujeres. La edad media de los pacientes analizados fue de 49 años (DE 17,5) y la duración media de la enfermedad fue de 93 meses (DE 148,6). No se encontraron diferencias estadísticamente significativas en estas variables respecto al sexo de los pacientes.
La situación laboral de los pacientes fue la siguiente: el 39,1% eran trabajadores activos; el 15,6%, parados; el 25,0%, jubilados, y el 20,3%, otros. No se encontraron diferencias estadísticamente significativas entre hombres y mujeres respecto a la situación laboral.
Respecto a los antecedentes clínicos o enfermedades concomitantes, el 20,3% fueron hipertensos; el 17,2% padecían artritis/artrosis; el 14,1% padecían depresión, y el 6,3% eran diabéticos.
Grado de severidad del asmaEl 93,5% de los pacientes tenían un asma persistente moderada, y el 6,5%, persistente grave. No se encontraron diferencias estadísticamente significativas respecto al sexo y el grado de severidad del asma.
Tratamiento con beclometasona/formoterolPara el control del asma el 1,8% de los pacientes de nuestro estudio tuvieron una pauta prescrita de uno/24h; en el 52,8% la pauta fue de uno/12h, y en el 45,3% la pauta fue de 2/12h. Estas pautas de prescripción fueron tenidas en cuenta para calcular el coste medio ponderado de la medicación en el análisis de coste-utilidad.
Recursos sanitarios utilizadosLos recursos sanitarios empleados por los pacientes durante el período de estudio (6 meses) fueron: número medio de visitas al médico de Atención Primaria 3,44 (DE 2,85); visitas a Enfermería 1,42 (DE 2,37); número de analíticas realizadas 0,63 (DE 0,75) por paciente en los 6 meses; a uno de cada 3 pacientes se le realizó una radiografía de tórax o un electrocardiograma (0,39 [DE 0,70]; 0,32 [DE 0,65], respectivamente).
El número de exacerbaciones sin ingreso fue de 1,05 (DE 1,47). El número de visitas a Urgencias en AP fue de 0,42 (DE 0,85) por paciente y a Urgencias hospitalarias de 0,08 (DE 0,37) por paciente, lo que supone el 18,5% de todas las urgencias debido a exacerbación de su enfermedad. El número de días de ingreso en el hospital fue de 0,17 (DE 1,25) por paciente durante el período estudiado.
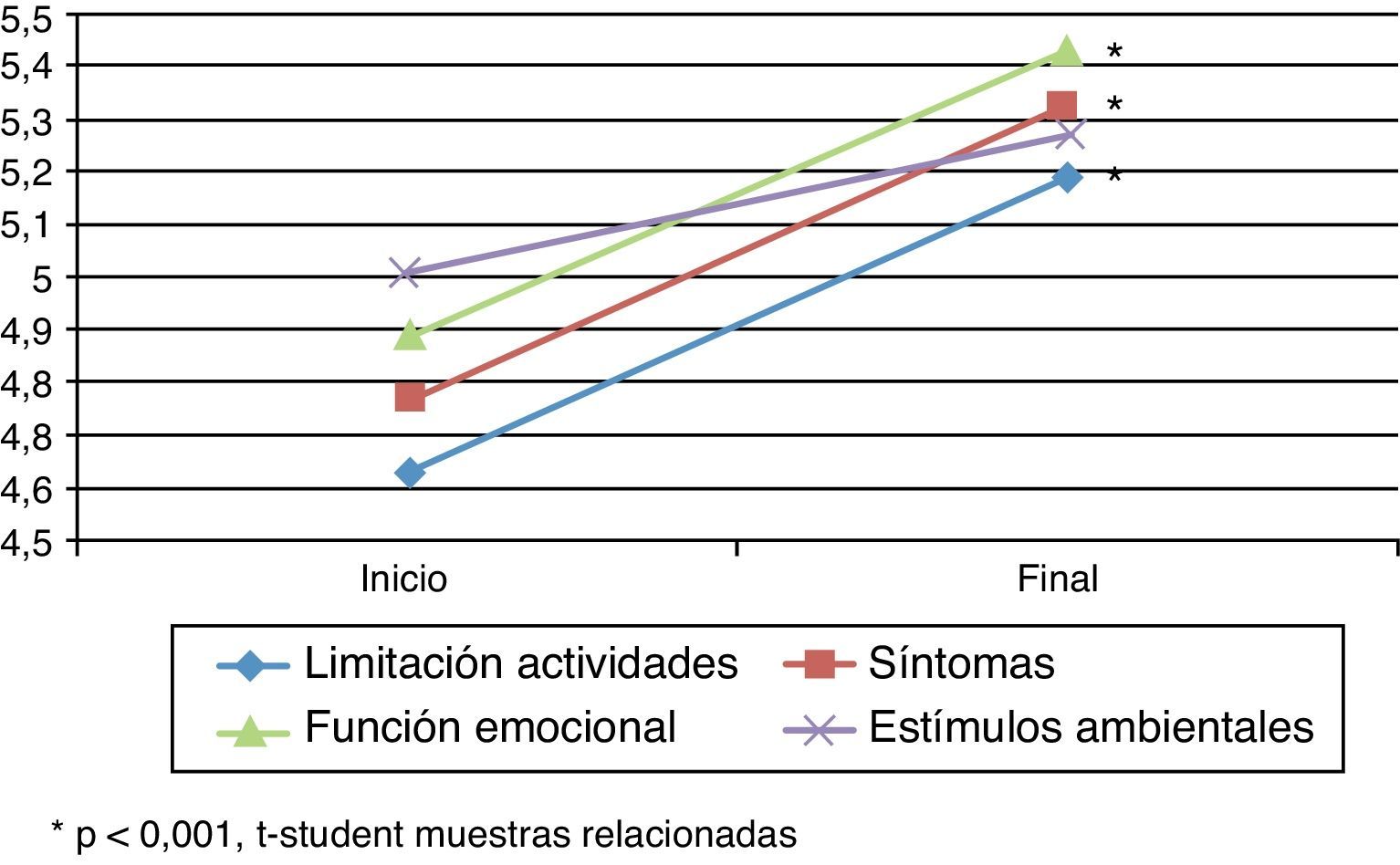
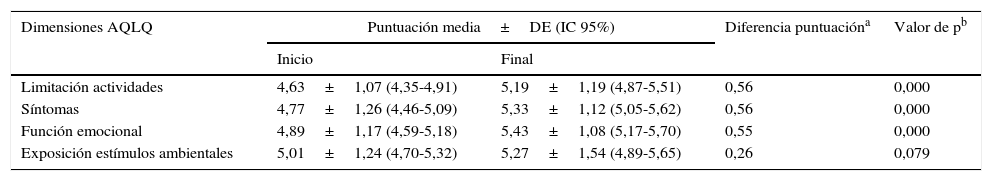
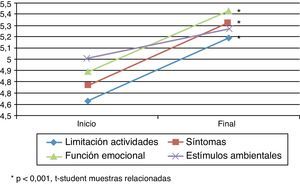
Cuestionarios de calidad de vidaAsthma Quality of Life QuestionnaireSe encontraron diferencias estadísticamente significativas (t de Student para muestras relacionadas: p<0,05) en el cuestionario específico de asma AQLQ (tabla 2) entre el inicio y el final del estudio (fig. 1). En la dimensión de estímulos por exposición ambiental estas diferencias no fueron significativas (p=0,079).
Puntuaciones obtenidas con el cuestionario específico para el asma Asthma Quality of Life Questionnaire
| Dimensiones AQLQ | Puntuación media±DE (IC 95%) | Diferencia puntuacióna | Valor de pb | |
|---|---|---|---|---|
| Inicio | Final | |||
| Limitación actividades | 4,63±1,07 (4,35-4,91) | 5,19±1,19 (4,87-5,51) | 0,56 | 0,000 |
| Síntomas | 4,77±1,26 (4,46-5,09) | 5,33±1,12 (5,05-5,62) | 0,56 | 0,000 |
| Función emocional | 4,89±1,17 (4,59-5,18) | 5,43±1,08 (5,17-5,70) | 0,55 | 0,000 |
| Exposición estímulos ambientales | 5,01±1,24 (4,70-5,32) | 5,27±1,54 (4,89-5,65) | 0,26 | 0,079 |
AQLQ: Asthma Quality of Life Questionnaire; DE: desviación estándar; IC 95%: intervalo de confianza al 95%.
La modificación media en las puntuaciones entre el inicio y el final del estudio fue superior a 0,5 puntos, lo que se corresponde con un cambio clínicamente significativo.
El aumento en las puntuaciones de la escala AQLQ en las dimensiones de limitaciones de la actividad por el asma, en los síntomas y en la función emocional fue superior al 11,5%.
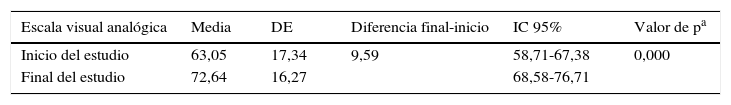
EuroQol-5DEntre el inicio y el final del estudio se produjo un aumento de la CVRS medida con la escala visual analógica de más de 9,5 puntos (tabla 3); estas diferencias fueron estadísticamente significativas (t de Student para muestras relacionadas, p=0,000).
Puntuaciones en pacientes asmáticos con EuroQol-5D
| Escala visual analógica | Media | DE | Diferencia final-inicio | IC 95% | Valor de pa |
|---|---|---|---|---|---|
| Inicio del estudio | 63,05 | 17,34 | 9,59 | 58,71-67,38 | 0,000 |
| Final del estudio | 72,64 | 16,27 | 68,58-76,71 |
DE: desviación estándar; IC 95%: intervalo de confianza al 95%.
Las puntuaciones en la escala visual analógica oscilan entre 0 (peor estado de salud) y 100 (mejor estado de salud).
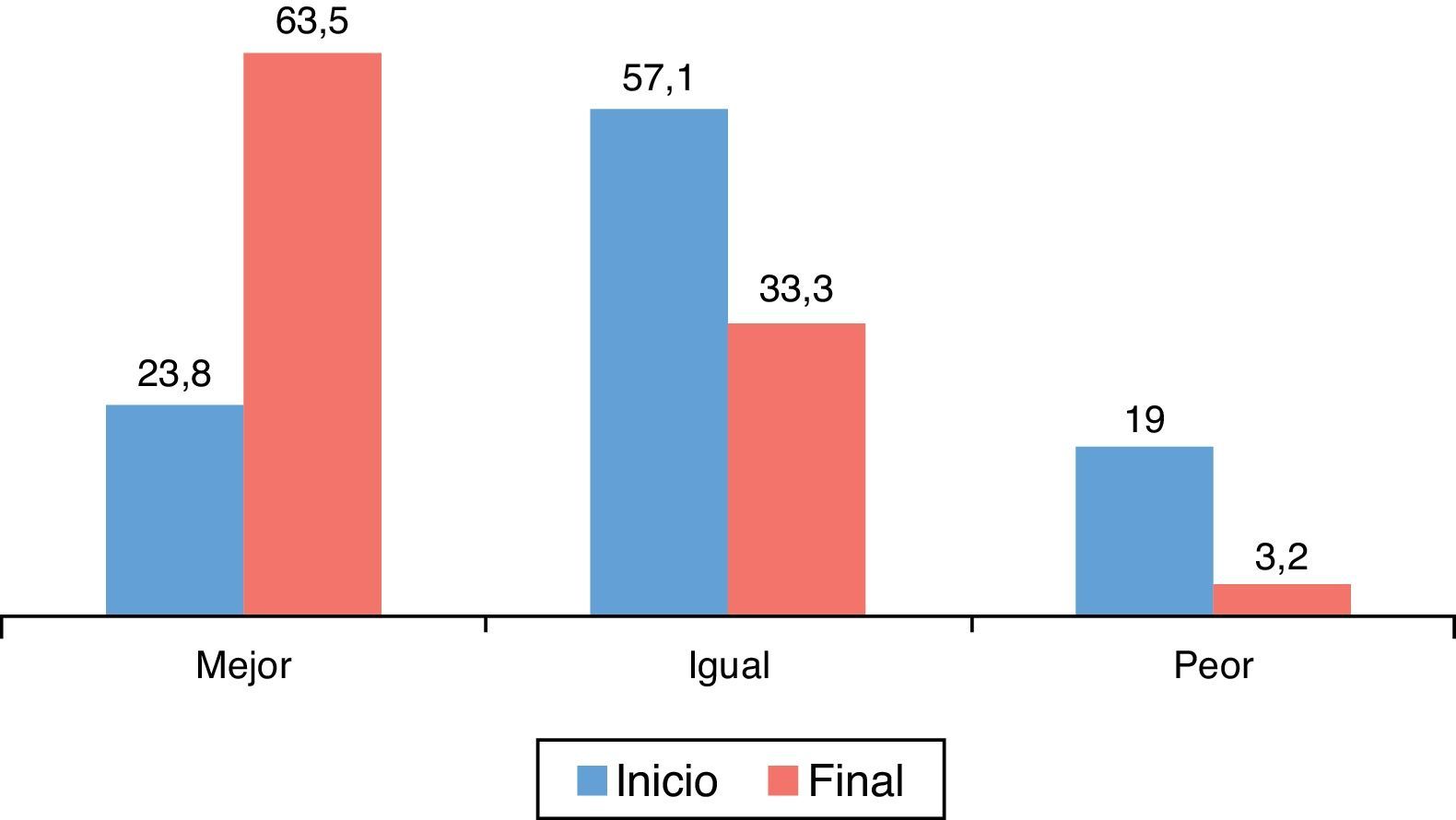
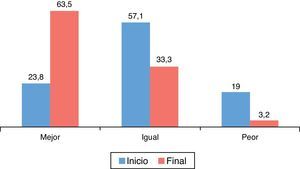
En relación con el estado de salud en general (fig. 2) medido con el EQ-5D respecto al inicio del estudio, el 63,5% de los pacientes consideraron que era mejor, el 33,3% igual y el 3,2% peor. Estas diferencias fueron estadísticamente significativas (p=0,000; prueba de los rangos con signo de Wilcoxon).
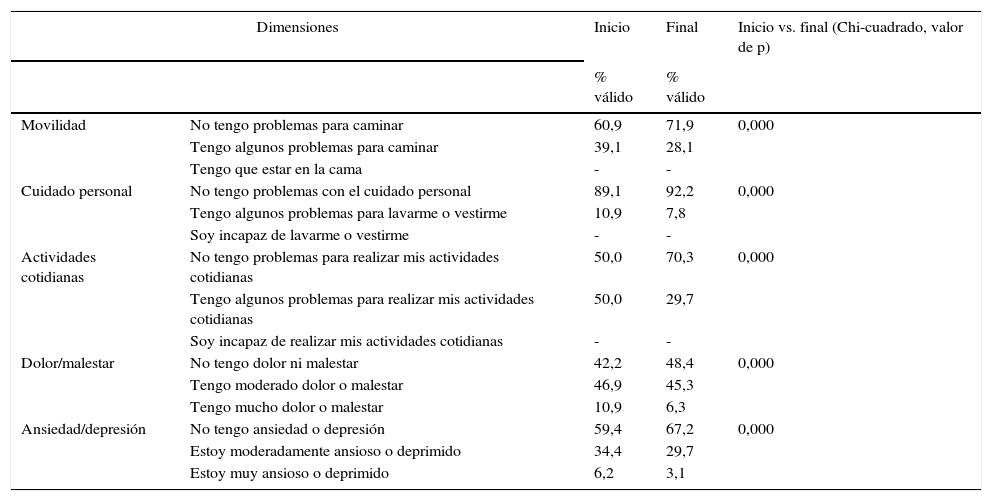
Hubo una mejoría clínica y estadísticamente significativa (Chi-cuadrado, p<0,001) en cada una de las dimensiones del EQ-5D (tabla 4).
Dimensiones del EuroQol-5D en pacientes asmáticos en tratamiento con beclometasona/formoterol
| Dimensiones | Inicio | Final | Inicio vs. final (Chi-cuadrado, valor de p) | |
|---|---|---|---|---|
| % válido | % válido | |||
| Movilidad | No tengo problemas para caminar | 60,9 | 71,9 | 0,000 |
| Tengo algunos problemas para caminar | 39,1 | 28,1 | ||
| Tengo que estar en la cama | - | - | ||
| Cuidado personal | No tengo problemas con el cuidado personal | 89,1 | 92,2 | 0,000 |
| Tengo algunos problemas para lavarme o vestirme | 10,9 | 7,8 | ||
| Soy incapaz de lavarme o vestirme | - | - | ||
| Actividades cotidianas | No tengo problemas para realizar mis actividades cotidianas | 50,0 | 70,3 | 0,000 |
| Tengo algunos problemas para realizar mis actividades cotidianas | 50,0 | 29,7 | ||
| Soy incapaz de realizar mis actividades cotidianas | - | - | ||
| Dolor/malestar | No tengo dolor ni malestar | 42,2 | 48,4 | 0,000 |
| Tengo moderado dolor o malestar | 46,9 | 45,3 | ||
| Tengo mucho dolor o malestar | 10,9 | 6,3 | ||
| Ansiedad/depresión | No tengo ansiedad o depresión | 59,4 | 67,2 | 0,000 |
| Estoy moderadamente ansioso o deprimido | 34,4 | 29,7 | ||
| Estoy muy ansioso o deprimido | 6,2 | 3,1 | ||
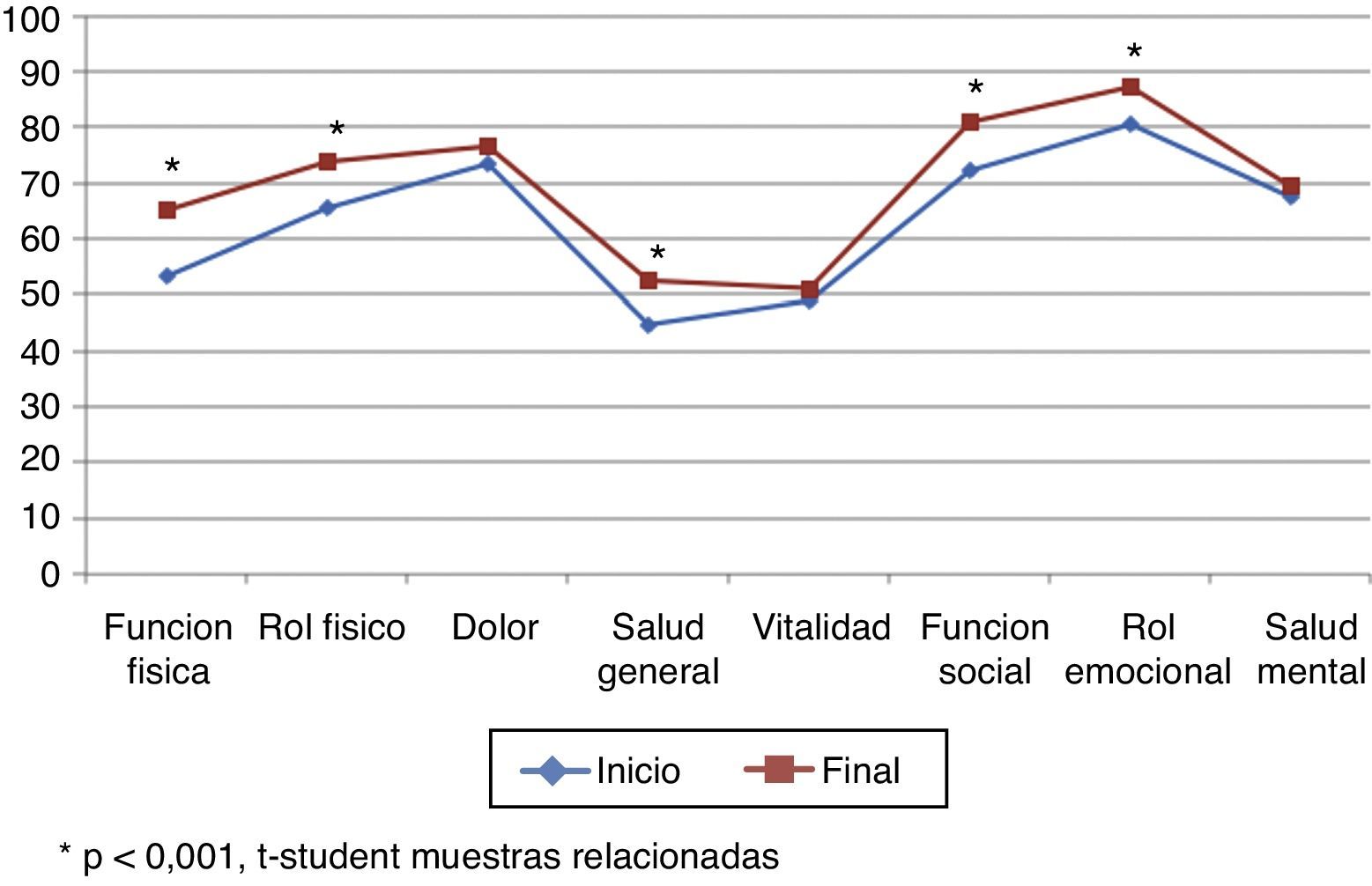
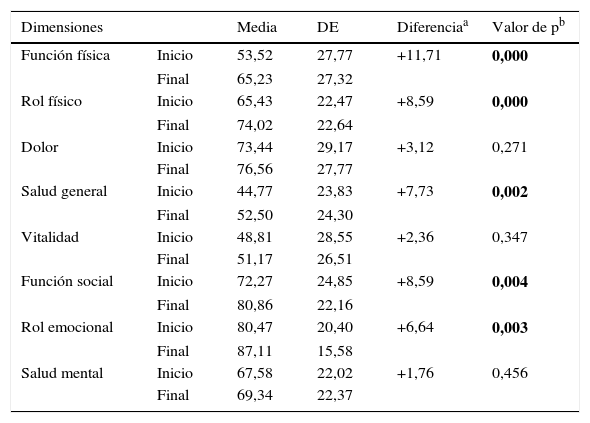
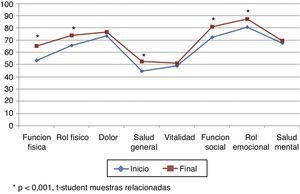
La puntuación total al inicio del estudio fue de 63,22 (DE 17,80), y al final, de 70,11 (DE 17,5), siendo estas diferencias estadísticamente significativas (p<0,001), lo que demuestra una mejoría en los pacientes, aunque no en todas las dimensiones (tabla 5; fig. 3). Hubo diferencias estadísticamente significativas (p<0,001) entre el inicio y el final del estudio en: función física, limitación por problemas físicos, percepción general de la salud, funcionamiento o rol social y en la limitación por problemas emocionales (rol emocional).
Dimensiones del Short Form 36 obtenidas en nuestro estudio
| Dimensiones | Media | DE | Diferenciaa | Valor de pb | |
|---|---|---|---|---|---|
| Función física | Inicio | 53,52 | 27,77 | +11,71 | 0,000 |
| Final | 65,23 | 27,32 | |||
| Rol físico | Inicio | 65,43 | 22,47 | +8,59 | 0,000 |
| Final | 74,02 | 22,64 | |||
| Dolor | Inicio | 73,44 | 29,17 | +3,12 | 0,271 |
| Final | 76,56 | 27,77 | |||
| Salud general | Inicio | 44,77 | 23,83 | +7,73 | 0,002 |
| Final | 52,50 | 24,30 | |||
| Vitalidad | Inicio | 48,81 | 28,55 | +2,36 | 0,347 |
| Final | 51,17 | 26,51 | |||
| Función social | Inicio | 72,27 | 24,85 | +8,59 | 0,004 |
| Final | 80,86 | 22,16 | |||
| Rol emocional | Inicio | 80,47 | 20,40 | +6,64 | 0,003 |
| Final | 87,11 | 15,58 | |||
| Salud mental | Inicio | 67,58 | 22,02 | +1,76 | 0,456 |
| Final | 69,34 | 22,37 |
DE: desviación estándar; IC 95%: intervalo de confianza al 95%.
Las puntuaciones en todas las dimensiones oscilan entre 0 (peor estado de salud) y 100 (mejor estado de salud).
También hubo diferencias significativas en el componente estandarizado físico entre el inicio y el final del estudio (p<0,001); las puntuaciones fueron: 40,34 (DE 8,80) y 44,16 (DE 8,85), respectivamente. Por el contrario, en el componente estandarizado mental no hubo diferencias entre el inicio y el final del estudio (p>0,05), siendo las puntuaciones de 47,03 (DE 10,17) y 48,51 (DE 8,85), respectivamente.
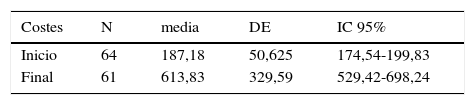
Costes de recursos sanitarios empleadosEn la tabla 6 se muestran los costes medios obtenidos en nuestro estudio al inicio y tras la implementación de DPB/FOR para el control del asma; estos incluyen la medicación para el asma y los costes de los recursos sanitarios empleados durante la fase de estudio.
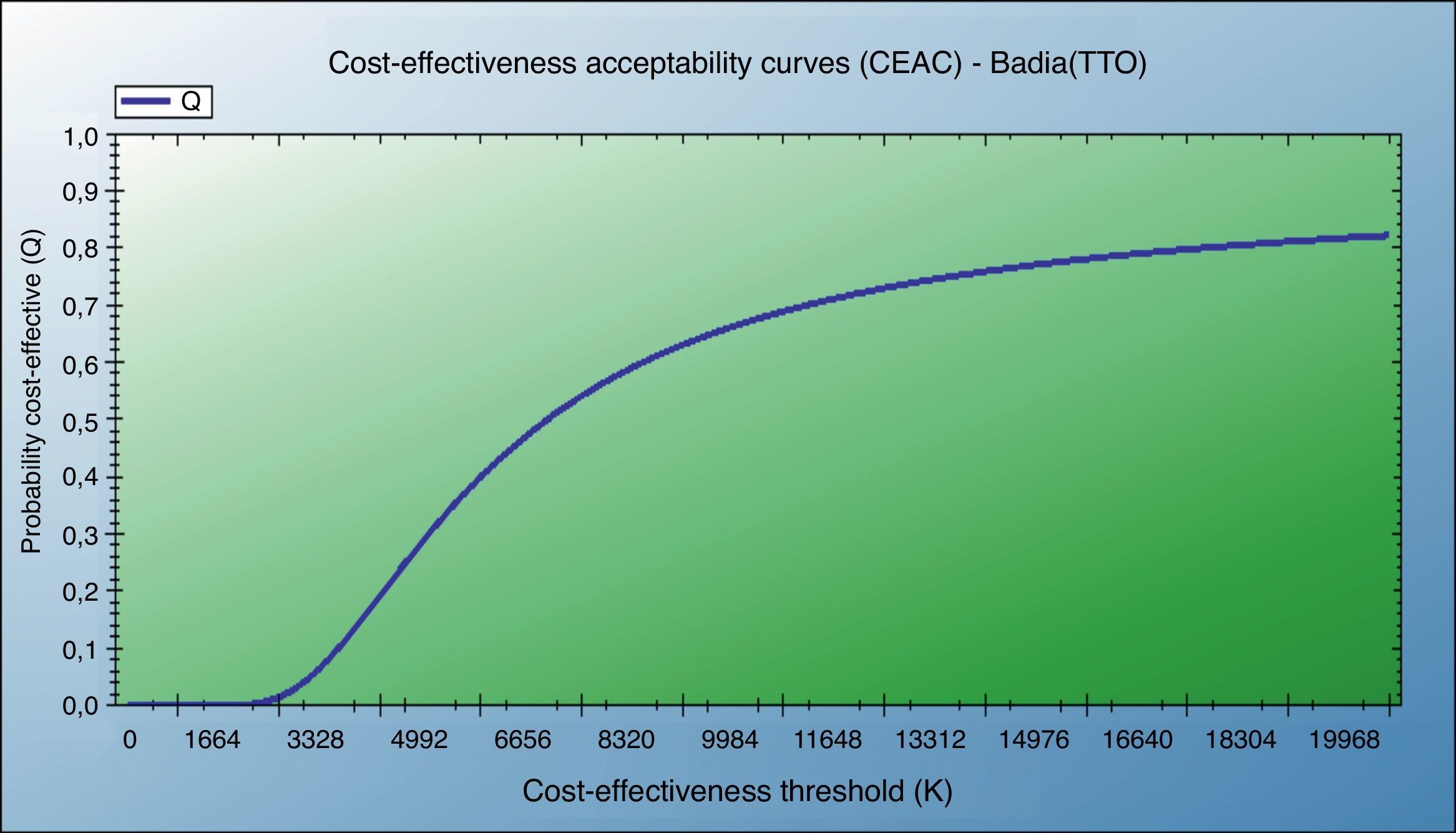
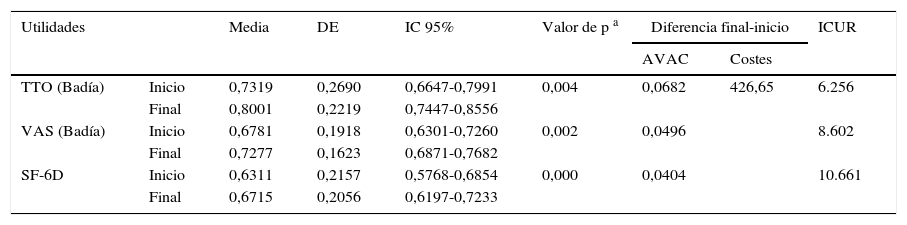
Análisis de coste-utilidadEn la tabla 7 se muestran las utilidades ganadas por nuestros pacientes entre el inicio y el final de nuestro estudio; estas se han obtenido a partir de los cuestionarios EQ-5D y SF-6D. Para su análisis se ha tenido en cuenta la adaptación española para comparaciones a nivel nacional24–26.
Utilidades y costes obtenidos mediante EuroQol-5D y SF-6D
| Utilidades | Media | DE | IC 95% | Valor de p a | Diferencia final-inicio | ICUR | ||
|---|---|---|---|---|---|---|---|---|
| AVAC | Costes | |||||||
| TTO (Badía) | Inicio | 0,7319 | 0,2690 | 0,6647-0,7991 | 0,004 | 0,0682 | 426,65 | 6.256 |
| Final | 0,8001 | 0,2219 | 0,7447-0,8556 | |||||
| VAS (Badía) | Inicio | 0,6781 | 0,1918 | 0,6301-0,7260 | 0,002 | 0,0496 | 8.602 | |
| Final | 0,7277 | 0,1623 | 0,6871-0,7682 | |||||
| SF-6D | Inicio | 0,6311 | 0,2157 | 0,5768-0,6854 | 0,000 | 0,0404 | 10.661 | |
| Final | 0,6715 | 0,2056 | 0,6197-0,7233 | |||||
AVAC: años de vida ajustados por calidad; DE: desviación estándar; IC 95%: intervalo de confianza al 95%; ICUR: coste-utilidad incremental (€/AVAC) final respecto del inicial; TTO: time trade-off («equivalencia temporal»); EVA: escala visual analógica.
El método de Badía es la adaptación española tanto del TTO como de la EVA.
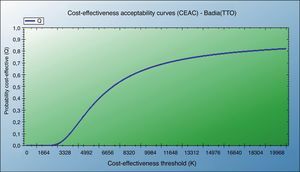
También se muestran el análisis de coste-utilidad incremental según el escenario contemplado y test de CVRS empleado, y la curva de aceptabilidad del coste-utilidad (fig. 4).
DiscusiónLa situación general de la investigación en Atención Primaria aún resulta exigua, con muy pocos estudios sobre calidad de vida, y no digamos ya de coste-efectividad (o utilidad), incluso en asma17,25–27; por eso, nuestro estudio, a pesar de sus limitaciones y sesgos, cobra gran valor, pues aporta conocimiento sobre la efectividad real de los fármacos en su ámbito natural de utilización, como es la Atención Primaria. Como decíamos al inicio, es el médico de familia quien, por cercanía, accesibilidad y continuidad asistencial, debería asumir gran parte de la investigación en enfermedades crónicas.
Otro aspecto destacado de nuestro estudio ha sido la ardua tarea que han asumido los investigadores, pues no solo se trataba de recoger datos de la historia clínica del paciente, sino que además había que entrevistarlos y completar los cuestionarios de CVRS, que si bien no eran difíciles, sí representaban un esfuerzo extra.
Uno de los posibles sesgos y limitaciones que puede tener nuestro estudio es el de ser una muestra relativamente pequeña, pues solo 64 pacientes de los más de 100 calculados completaron con éxito el estudio. Es evidente que esto va en detrimento de la extrapolación de los resultados hallados. Sin embargo, esto no es privativo de la Atención Primaria, pues en nuestro país la tasa de selección en ensayos clínicos muestra que hay un 40% de ECC que no logran alcanzar la mitad de los pacientes previstos, y cerca de un 22% que no logran ni la quinta parte, según datos de Farmaindustria28.
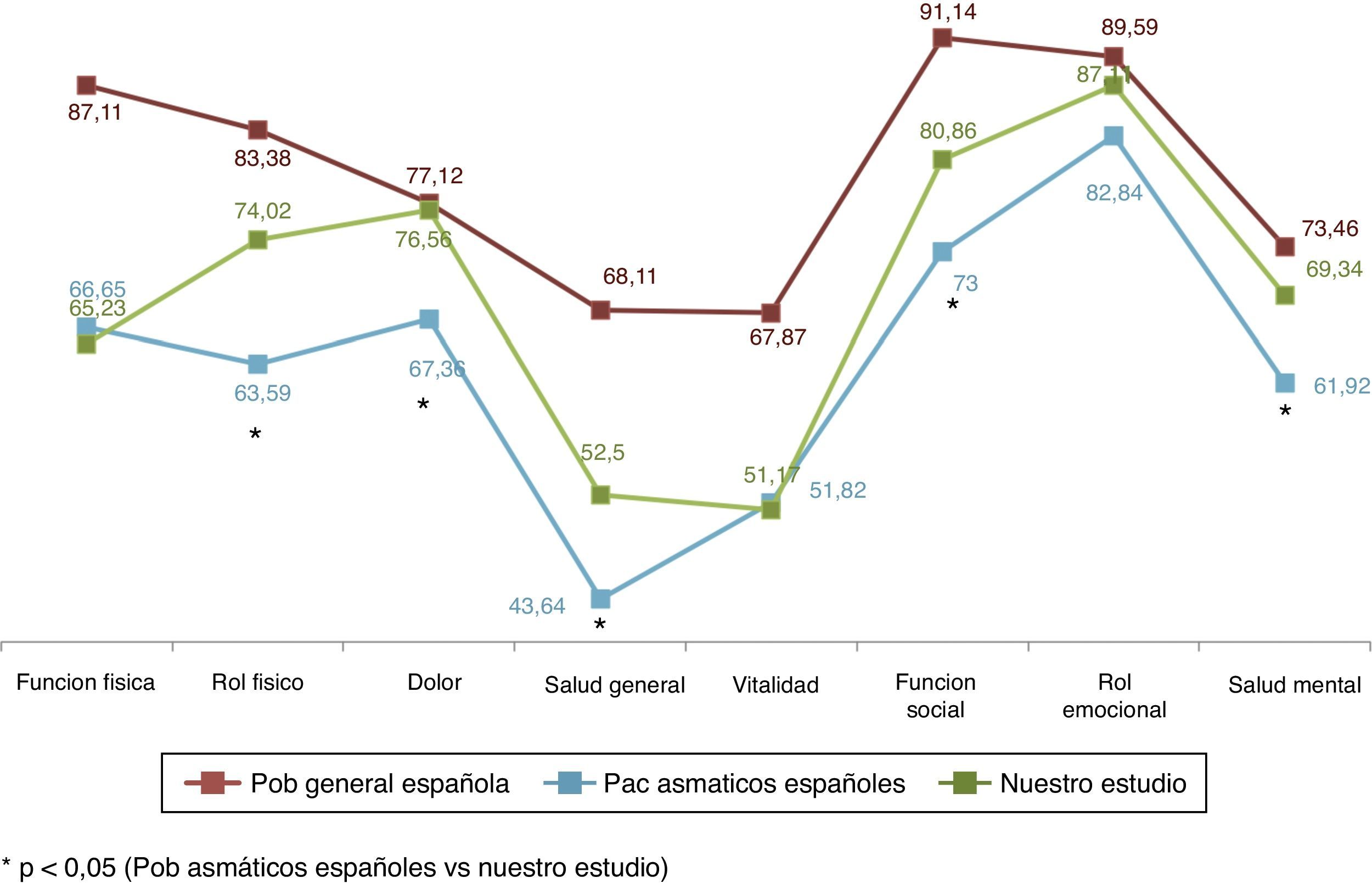
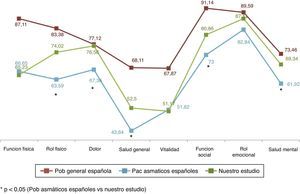
Respecto a los resultados obtenidos en nuestros pacientes asmáticos en CVRS medidos con el SF-36 podemos destacar que en su comparación con la población general española29 observamos diferencias importantes y relevantes como cabría esperar. Así, mientras que la población española con asma30 redujo su CVRS medida con el SF-36 en más de 15 puntos de media respecto a la población general, los pacientes de nuestro estudio solo la redujeron en algo más de 10 puntos (10,11 puntos) (fig. 5). En nuestro estudio todos los pacientes presentaron mejor CVRS que los asmáticos de la serie española, sobre todo en el rol físico, dolor, salud general, función social, rol emocional y salud mental; estas diferencias fueron siempre superiores a 4 puntos (diferencia mínima clínicamente relevante).
ConclusionesA partir de los resultados obtenidos se puede concluir que:
Los médicos de familia son y deberían ser los actores principales en la investigación de resultados en salud, y aun cuando los protocolos de estudio suponen un esfuerzo extra en sus actividades cotidianas, estos responden adecuada y satisfactoriamente a la convocatoria para realizar investigación en su ámbito de trabajo.
El uso de DPB/FOR en pacientes asmáticos moderados en Atención Primaria produce un aumento en la CVRS de estos pacientes medida tanto con cuestionarios específicos de la enfermedad (AQLQ) como con genéricos (EQ-5D y SF-36).
Si comparamos nuestro estudio con la población general de pacientes asmáticos en España, nuestros pacientes lograron mejores puntuaciones que la cohorte española de asma en rol físico, dolor, salud general, función social y salud metal; y estas fueron estadísticamente significativas.
El coste-utilidad incremental de DPB/FOR frente a la opción habitual de tratamiento fue de 6.256€/AVAC, lo que se puede considerar como una opción muy eficiente (muy por debajo de los 30.000€/AVAC).
Responsabilidades éticasProtección de personas yanimalesLos autores declaran que para esta investigación no se hanrealizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio ha sido patrocinado por Chiesi España S. A. mediante contrato de investigación con la Universidad de Málaga a través de la Oficina de Transferencia de Resultados de Investigación (OTRI) 806/579.3590.
AutoríaTodos los autores han contribuido por igual al contenido intelectual y la redacción del manuscrito, y todos han aprobado su versión final.
Conflicto de interesesLos autores declaran la independencia del órgano promotor y financiador en el análisis de resultados y la elaboración de las conclusiones.
A.J. García-Ruiz y J.A. Quintano Jiménez han recibido ocasionalmente honorarios por su participación en conferencias o ponencias en actos científicos patrocinados por diversas firmas farmacéuticas o instituciones dependientes de las administraciones sanitarias. Igualmente, la Universidad de Málaga, a través de la OTRI, ha recibido financiación de diversas firmas e instituciones para el desarrollo de actividades científicas o de difusión de resultados científicos.
F. del Moral es empleado de Chiesi España S. A. Ninguno de los demás autores mantiene ni tiene relaciones contractuales económicas con la industria farmacéutica, o de otro tipo, que pudieran ser motivo de conflicto de interés.
Investigadores colaboradores: I. Araujo Ramos, P.M. Correa de la Calle, M. Fernandez Berchez, D.J. Melero Fernandez, J.J. Muñoz Gavilan, D. Ocaña Rodriguez, J.A. Ordoñez Pozo, C. Pavón López, J. Peralta Mateos, R. Rodriguez Fernandez, G. Romera Carmona, A.M. Ruiz de la Concha.