Una de las principales limitaciones en los estudios sobre la EPOC en bases de datos sanitarias podría ser la baja calidad de la información contenida en ellas. Nuestro principal objetivo fue evaluar la fiabilidad del diagnóstico de EPOC en Atención Primaria. En segundo término, describir las características de los pacientes en función de la conformidad del diagnóstico.
Material y métodosEstudio transversal usando bases de datos sanitarias de Cantabria. De una muestra preseleccionada se obtuvieron 1.457 pacientes etiquetados con EPOC en la historia clínica. Se verificó el diagnóstico en las mismas bases de datos y se crearon 3 grupos: EPOC-confirmada, EPOC no confirmada-no descartada y error-diagnóstico. Fueron recogidas variables descriptivas, clínicas, comorbilidades y tratamientos.
ResultadosEl diagnóstico de EPOC fue confirmado en 766 pacientes: 52,6% (IC 95%: 50,0-55,2). La frecuencia del error-diagnóstico fue del 7,2% (IC 95%: 5,8-8,6). El porcentaje de este sobrediagnóstico fue mayor en mujeres. La edad, el hábito tabáquico, la severidad en función del FEV1 y la frecuencia y gravedad de las agudizaciones fueron mayores en el grupo de EPOC-confirmada (p<0,001). En los errores-diagnósticos se registraron una media de 1,95 episodios en los últimos 4 años. Los corticoides inhalados estaban prescritos en el 76,9% de los pacientes con EPOC-confirmada y en el 41,9% de los errores-diagnósticos.
ConclusionesLa fiabilidad del registro del diagnóstico de EPOC fue deficiente, con solo un 52,6% de certeza diagnóstica. En todos los grupos constó la prescripción de tratamientos para la EPOC de forma estable, destacando el uso de corticoides inhalados.
One of main limitations in studies of COPD in health databases could be the low quality of the information. Our first aim was evaluate reliability of the registry of COPD diagnosis register in Primary Care. A description and comparison is also presented of the characteristics of the patients according to the diagnostic confirmation.
Material and methodsA cross-sectional study using healthcare databases of Cantabria. A pre-selected sample of 1,457 patients was obtained in which COPD diagnosis was specifically registered. COPD confirmation was classified into confirmed COPD, not confirmed-not rejected COPD, and diagnostic error (over-diagnosis). Descriptive and clinical characteristics, comorbidities, and treatments were collected in each group.
ResultsCOPD was confirmed in 766 patients: 52.6% (95%CI: 49.9-55.2). Prevalence of over-diagnosis was 7.2% (95%CI: 5.9-8.6). There were statistically significant gender differences. In the COPD confirmed group age, tobacco consumption and severity according to FEV1 was higher. An average of 1.95 bronchial exacerbations during the last 4years was observed among diagnostic errors. Inhaled corticosteroids were prescribed in 74.9% of COPD confirmed patients, and in 41.9% of over-diagnosed patients.
ConclusionsThe reliability of the COPD register was deficient, with only 52.6% with a confirmed diagnosis. Stable treatment for COPD was prescribed in all groups, highlighting the use of inhaled corticosteroids.
La enfermedad pulmonar obstructiva crónica (EPOC) es el proceso respiratorio crónico que origina una mayor alteración de la calidad de vida de los pacientes, ingresos hospitalarios y gasto farmacéutico1,2.
Según consenso de sociedades médicas y guías internacionales3,4, el proceso diagnóstico de la EPOC se basa en: sospecha clínica, confirmación por espirometría, caracterización del fenotipo clínico y valoración de la gravedad. El diagnóstico clínico ha de considerarse en mayores de 35 años con exposición a factores de riesgo, sobre todo tabaquismo, que presenten tos crónica, expectoración o disnea. La espirometría forzada con prueba broncodilatadora (PB) realizada en la fase estable de la enfermedad se considera diagnóstica cuando el cociente del volumen espiratorio forzado en un segundo (FEV1) entre la capacidad vital forzada (FVC) es inferior a 0,73,4.
Es característico de la EPOC la presencia de agudizaciones periódicas (AEPOC) que afectan más a un grupo de pacientes que a otros (fenotipo agudizador) y la coexistencia de comorbilidades3–5. Ambas circunstancias están relacionadas con mala calidad de vida, peor pronóstico y mayor gasto6,7. La guía GesEPOC5 promueve un tratamiento individualizado con relación a fenotipos clínicos y recomienda la vacunación antigripal anual en este colectivo de pacientes.
Según el estudio EPISCAN la prevalencia de la EPOC en la población española de 40-80 años es del 10,2% (15,1% en varones y 5,7% mujeres)2. A nivel mundial, también se ofrecen resultados entre el 8 y el 10%8. El infradiagnóstico detectado en EPISCAN fue de un 73%.
El uso de registros sanitarios permite tener una visión descriptiva poblacional de enfermedades prevalentes como la EPOC, al menos de los usuarios sanitarios (aquellos pacientes que acuden a las consultas). Los registros sanitarios también han sido usados con éxito en estudios de cohortes retrospectivos con el objetivo de investigar factores de riesgo de agudizaciones por EPOC en el ámbito de la Atención Primaria9. Sin embargo, una de las principales limitaciones podría ser la baja calidad de la información: pueden clasificarse como EPOC errores diagnósticos que conducen a un sobrediagnóstico y, con ello, a un sesgo de selección10,11. Este análisis de calidad previo no es frecuente en este tipo de estudios. En España, la fiabilidad del diagnóstico de EPOC ha sido investigada en el estudio IDENTEPOC12 que muestra un porcentaje de errores diagnósticos (sobrediagnóstico) del 10%.
El objetivo principal del presente estudio fue evaluar la fiabilidad del registro del diagnóstico de la EPOC en Atención Primaria, estableciendo 3 grupos en función de la conformidad del diagnóstico: 1) EPOC-confirmada, 2) EPOC no confirmada-no descartada, 3) error-diagnóstico (sobrediagnóstico). Adicionalmente, estudiar las características de cada grupo en función de la descripción de ciertas variables que pudieran estar relacionadas con el pronóstico de la EPOC3,4.
Material y métodosDiseño y población de estudioEstudio transversal. La población de estudio ha sido descrita anteriormente13. Entre los 362.372 usuarios sanitarios de ≥35 años registrados con tarjeta sanitaria en Cantabria, a 31 de diciembre de 2011, se identificaron los códigos de la Clasificación Internacional de Atención Primaria (CIAP)14 R91 (bronquitis crónica, bronquiectasias: N=2.049) y R95 (EPOC, enfisema: N=7.285). Entre estos, se llevó a cabo un muestreo aleatorizado simple que reclutó 2.000 códigos de pacientes (R91 N=446; R95 N=1.554).
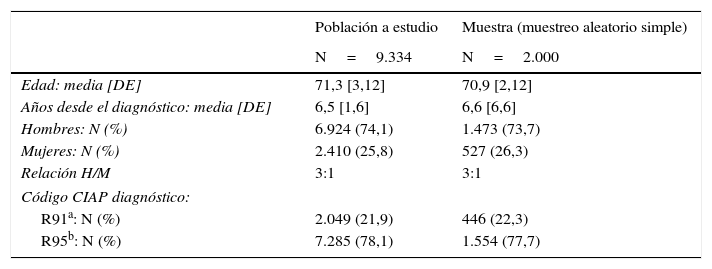
En la tabla 1 se presentan las características básicas de los 9.334 pacientes con códigos CIAP R91 y R95 junto a los datos de la muestra seleccionada aleatoriamente, que permiten comprobar su representatividad en cuanto a edad, sexo, tipo de código CIAP registrado y años desde el registro del diagnóstico.
Características básicas de la población a estudio y representatividad de la muestra (N=2.000), en cuanto a edad, años desde el registro del diagnóstico, sexo y tipo de código CIAP diagnóstico
| Población a estudio | Muestra (muestreo aleatorio simple) | |
|---|---|---|
| N=9.334 | N=2.000 | |
| Edad: media [DE] | 71,3 [3,12] | 70,9 [2,12] |
| Años desde el diagnóstico: media [DE] | 6,5 [1,6] | 6,6 [6,6] |
| Hombres: N (%) | 6.924 (74,1) | 1.473 (73,7) |
| Mujeres: N (%) | 2.410 (25,8) | 527 (26,3) |
| Relación H/M | 3:1 | 3:1 |
| Código CIAP diagnóstico: | ||
| R91a: N (%) | 2.049 (21,9) | 446 (22,3) |
| R95b: N (%) | 7.285 (78,1) | 1.554 (77,7) |
En 11 casos, no fue posible acceder al historial clínico individualizado de estos pacientes sin poder filiar la causa, ni siquiera consultando en el sistema CIVITAS de información poblacional donde se registran altas, bajas (fallecimientos, traslados, pérdida de cobertura, etc.). Por lo tanto, la potencial población de estudio la conforman los 1.989 pacientes con historias accesibles (R91 N=441; R95 N=1.548).
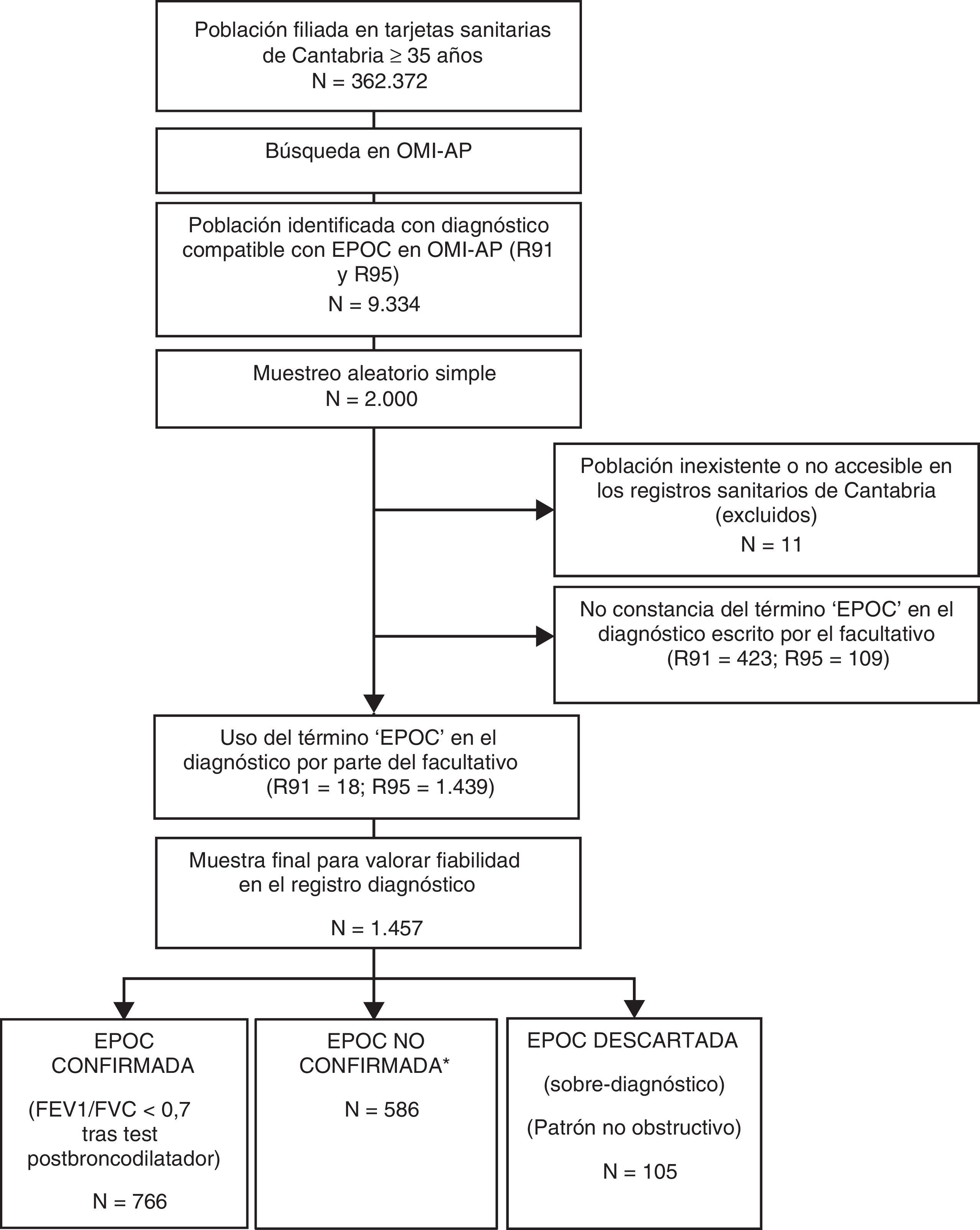
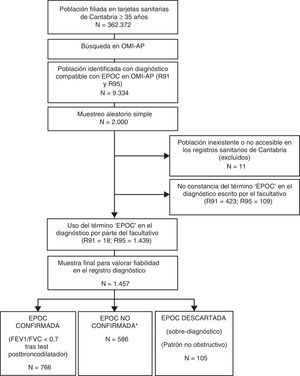
Para contextualizar esta población en el ámbito del estudio de la fiabilidad del registro del diagnóstico de EPOC, en cada paciente se comprobó que en el diagnóstico escrito por el facultativo constase la palabra «EPOC». En los R95 este término constó en 1.439 de los 1.548 registros estudiados (93%) y en los R91 en 18 de los 441 registros estudiados (0,04%). Por este motivo, la muestra resultante para valorar el objetivo planteado corresponde a los 1.457 pacientes con diagnóstico subjetivo de EPOC (ver fig. 1).
Esquema general del estudio. Diagrama de flujo hasta llegar a la muestra final.
*No existe constancia de espirometría realizada. Constancia de espirometría realizada con patrón obstructivo pero sin test post-broncodilatador (PB) o tipo de espirometría desconocida (sin especificar con/sin PB).
El protocolo de investigación fue aprobado por el Comité Ético de Investigación Clínica de Cantabria. La información se recogió a partir de la revisión individualizada de las historias clínicas de los centros de salud, usando la base de datos OMI-AP y complementada con los registros hospitalarios a través del visor corporativo (eVISOR), que muestra informes de urgencias, altas y consultas externas de los hospitales de Cantabria.
Según los datos diagnósticos obtenidos, se clasificó a cada paciente en EPOC-confirmada en caso de constancia de espirometría realizada con PB, con datos espirométricos registrados compatibles (FEV1/FVC<0,7 tras PB); o error-diagnóstico en caso de datos espirométricos registrados incompatibles con el diagnóstico de EPOC (patrón no obstructivo). Se consideraron como EPOC no confirmada-no descartada el resto de las situaciones. Ver el esquema general del estudio en la figura 1.
Se recogieron las variables descriptivas y estilos de vida: sexo, edad, IMC, hábito tabáquico, consumo de alcohol de riesgo (40g/día en hombres y 24g/día en mujeres); características clínicas: número y gravedad de los episodios de AEPOC, FEV1 (en %), así como las principales comorbilidades3,4 y el tratamiento inhalador basal de cada paciente, para lo cual debía constar como prescripción habitual en el último año. Se definió la AEPOC como aquel episodio de agudización que distara entre sí más de 4 semanas y que provocara en el paciente un aumento de síntomas basales (tos, expectoración o disnea), y que conllevara la prescripción de un antibiótico y/o un corticoide sistémico (agudización moderada), o que acarreara un ingreso hospitalario de más de 24h (agudización grave)15,16. Se cuantificó la frecuencia de agudizaciones totales (moderadas+graves) el año previo (año 2011) y en los últimos 4 años (2008-2011). Se definió el concepto de «fenotipo agudizador» como el paciente que presentó al menos 2 agudizaciones el año previo4,5.
Análisis estadísticoPara las variables categóricas se estimaron proporciones con sus correspondientes intervalos de confianza al 95% (IC 95%), utilizando la prueba chi cuadrado de Pearson para realizar comparaciones o, alternativamente, el test exacto de Fisher. Para las variables continuas se estimaron medias con su desviación estándar (DE) usando los test t de Student o ANOVA para las comparaciones. El error alfa se fijó en 0,05 y todas las p fueron bilaterales. Todos los análisis estadísticos se hicieron con el paquete SPSS v. 22.0 de IBM.
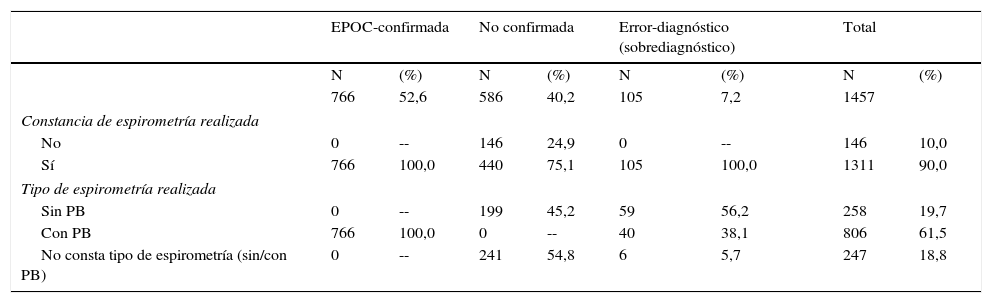
ResultadosConformidad diagnósticaEn la tabla 2 se presenta la información relativa a los registros espirométricos para cada grupo en función de la veracidad comprobada en el diagnóstico.
Registros espirométricos para cada grupo en función de los grupos de confirmación diagnóstica
| EPOC-confirmada | No confirmada | Error-diagnóstico (sobrediagnóstico) | Total | |||||
|---|---|---|---|---|---|---|---|---|
| N | (%) | N | (%) | N | (%) | N | (%) | |
| 766 | 52,6 | 586 | 40,2 | 105 | 7,2 | 1457 | ||
| Constancia de espirometría realizada | ||||||||
| No | 0 | -- | 146 | 24,9 | 0 | -- | 146 | 10,0 |
| Sí | 766 | 100,0 | 440 | 75,1 | 105 | 100,0 | 1311 | 90,0 |
| Tipo de espirometría realizada | ||||||||
| Sin PB | 0 | -- | 199 | 45,2 | 59 | 56,2 | 258 | 19,7 |
| Con PB | 766 | 100,0 | 0 | -- | 40 | 38,1 | 806 | 61,5 |
| No consta tipo de espirometría (sin/con PB) | 0 | -- | 241 | 54,8 | 6 | 5,7 | 247 | 18,8 |
PB: posbroncodilatación.
Tras una búsqueda activa en las historias clínicas de los 1.457 pacientes accesibles con códigos R95 y R91 diagnosticados como EPOC, en 146 pacientes (10%) no constó la realización de ninguna espirometría, por lo que el diagnóstico de EPOC no se pudo ni confirmar ni descartar. En 440 (30,2%) pacientes constó la realización de al menos una espirometría con patrón obstructivo, pero o bien fue sin PB o no constó si fue o no con PB, por lo que el diagnóstico tampoco se pudo confirmar.
En 806 (55,3%) pacientes constó haberse realizado al menos una espirometría con PB, que permitió confirmar el diagnóstico de EPOC en 766 pacientes y descartarlo en 40. Las espirometrías de otros 65 pacientes (4,4%) mostraron un patrón no obstructivo que permitieron también descartar el diagnóstico.
Así pues, en 105 de los 1.457 pacientes el diagnóstico de EPOC fue descartado (errores diagnósticos), por lo que nuestra frecuencia de sobrediagnóstico fue del 7,2% (IC 95%: 5,8-8,6). El diagnóstico de EPOC fue confirmado en el 52,6% de los pacientes (N=766; IC 95%: 50,0-55,2) y no se pudo confirmar ni descartar en el resto: 40,2%: (N=586; IC 95%: 37,7-42,8).
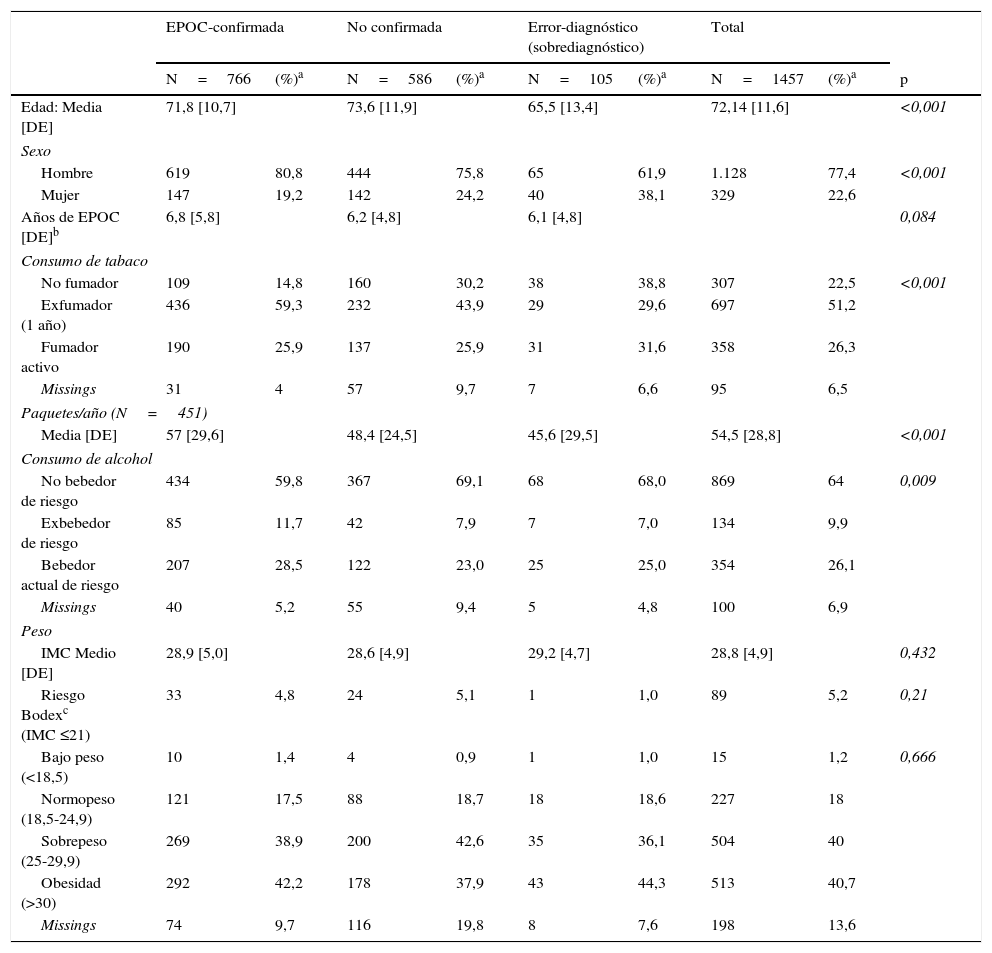
Variables descriptivasLa edad media de la muestra final fue de 72,1 años [DE 11,6], con un 77,4% de hombres. La confirmación diagnóstica fue diferente en función del género. Entre los casos de EPOC descartados el porcentaje de mujeres fue mayor (38,1%) y entre los de EPOC confirmados, menor (19,2%; p<0,001) (tabla 3).
Características descriptivas y estilos de vida de la muestra, en función de los grupos de confirmación diagnóstica
| EPOC-confirmada | No confirmada | Error-diagnóstico (sobrediagnóstico) | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N=766 | (%)a | N=586 | (%)a | N=105 | (%)a | N=1457 | (%)a | p | |
| Edad: Media [DE] | 71,8 [10,7] | 73,6 [11,9] | 65,5 [13,4] | 72,14 [11,6] | <0,001 | ||||
| Sexo | |||||||||
| Hombre | 619 | 80,8 | 444 | 75,8 | 65 | 61,9 | 1.128 | 77,4 | <0,001 |
| Mujer | 147 | 19,2 | 142 | 24,2 | 40 | 38,1 | 329 | 22,6 | |
| Años de EPOC [DE]b | 6,8 [5,8] | 6,2 [4,8] | 6,1 [4,8] | 0,084 | |||||
| Consumo de tabaco | |||||||||
| No fumador | 109 | 14,8 | 160 | 30,2 | 38 | 38,8 | 307 | 22,5 | <0,001 |
| Exfumador (1 año) | 436 | 59,3 | 232 | 43,9 | 29 | 29,6 | 697 | 51,2 | |
| Fumador activo | 190 | 25,9 | 137 | 25,9 | 31 | 31,6 | 358 | 26,3 | |
| Missings | 31 | 4 | 57 | 9,7 | 7 | 6,6 | 95 | 6,5 | |
| Paquetes/año (N=451) | |||||||||
| Media [DE] | 57 [29,6] | 48,4 [24,5] | 45,6 [29,5] | 54,5 [28,8] | <0,001 | ||||
| Consumo de alcohol | |||||||||
| No bebedor de riesgo | 434 | 59,8 | 367 | 69,1 | 68 | 68,0 | 869 | 64 | 0,009 |
| Exbebedor de riesgo | 85 | 11,7 | 42 | 7,9 | 7 | 7,0 | 134 | 9,9 | |
| Bebedor actual de riesgo | 207 | 28,5 | 122 | 23,0 | 25 | 25,0 | 354 | 26,1 | |
| Missings | 40 | 5,2 | 55 | 9,4 | 5 | 4,8 | 100 | 6,9 | |
| Peso | |||||||||
| IMC Medio [DE] | 28,9 [5,0] | 28,6 [4,9] | 29,2 [4,7] | 28,8 [4,9] | 0,432 | ||||
| Riesgo Bodexc (IMC ≤21) | 33 | 4,8 | 24 | 5,1 | 1 | 1,0 | 89 | 5,2 | 0,21 |
| Bajo peso (<18,5) | 10 | 1,4 | 4 | 0,9 | 1 | 1,0 | 15 | 1,2 | 0,666 |
| Normopeso (18,5-24,9) | 121 | 17,5 | 88 | 18,7 | 18 | 18,6 | 227 | 18 | |
| Sobrepeso (25-29,9) | 269 | 38,9 | 200 | 42,6 | 35 | 36,1 | 504 | 40 | |
| Obesidad (>30) | 292 | 42,2 | 178 | 37,9 | 43 | 44,3 | 513 | 40,7 | |
| Missings | 74 | 9,7 | 116 | 19,8 | 8 | 7,6 | 198 | 13,6 | |
En un 6,5% de los pacientes (N=95) no se encontraron registros sobre el antecedente tabáquico (missings). El porcentaje de fumadores fue mayor entre los EPOC-confirmados, si bien un 14,8% constaron como no fumadores. Únicamente se registró la información sobre paquetes/año en 355 (33,6%) de los 1.055 pacientes con antecedente de tabaquismo.
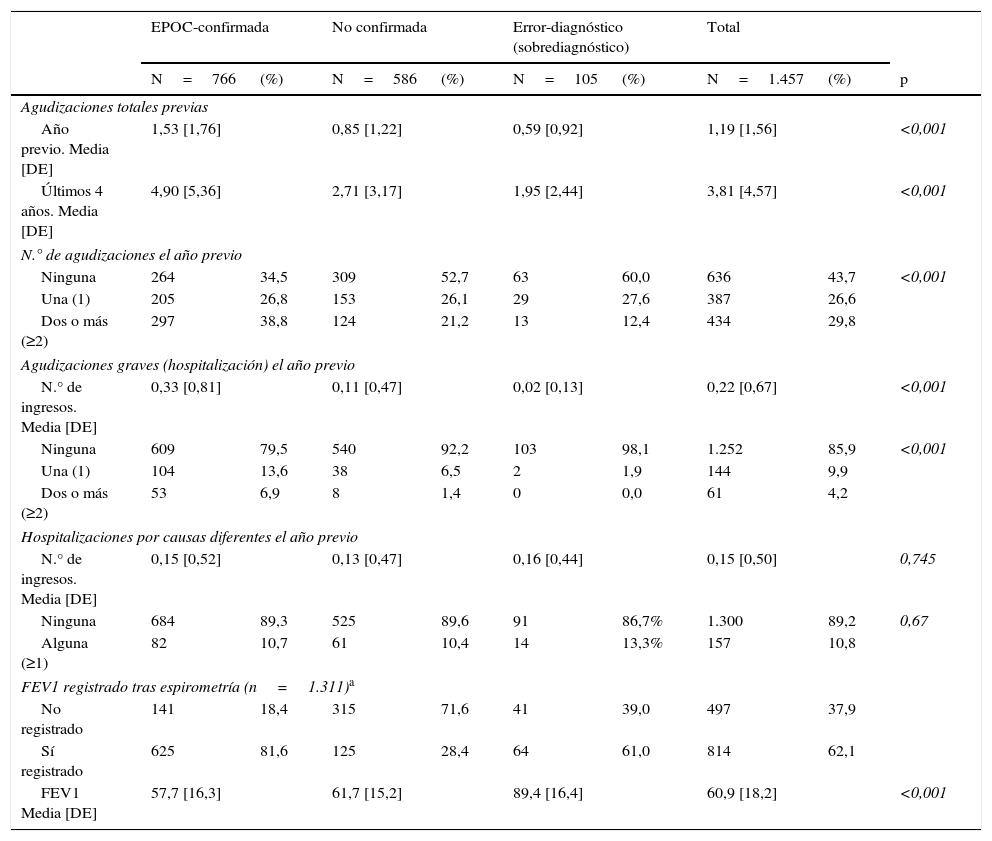
Características clínicasEn el grupo de EPOC-confirmada se registraron de media 1,53 agudizaciones el año previo y 4,90 en los últimos 4 años. Aunque no se pueda considerar la existencia de agudizaciones, en el grupo de error-diagnóstico se registraron una media de 1,95 episodios similares a una agudización en los últimos 4 años (tabla 4).
Características clínicas de la muestra, en función de los grupos de confirmación diagnóstica
| EPOC-confirmada | No confirmada | Error-diagnóstico (sobrediagnóstico) | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N=766 | (%) | N=586 | (%) | N=105 | (%) | N=1.457 | (%) | p | |
| Agudizaciones totales previas | |||||||||
| Año previo. Media [DE] | 1,53 [1,76] | 0,85 [1,22] | 0,59 [0,92] | 1,19 [1,56] | <0,001 | ||||
| Últimos 4 años. Media [DE] | 4,90 [5,36] | 2,71 [3,17] | 1,95 [2,44] | 3,81 [4,57] | <0,001 | ||||
| N.° de agudizaciones el año previo | |||||||||
| Ninguna | 264 | 34,5 | 309 | 52,7 | 63 | 60,0 | 636 | 43,7 | <0,001 |
| Una (1) | 205 | 26,8 | 153 | 26,1 | 29 | 27,6 | 387 | 26,6 | |
| Dos o más (≥2) | 297 | 38,8 | 124 | 21,2 | 13 | 12,4 | 434 | 29,8 | |
| Agudizaciones graves (hospitalización) el año previo | |||||||||
| N.° de ingresos. Media [DE] | 0,33 [0,81] | 0,11 [0,47] | 0,02 [0,13] | 0,22 [0,67] | <0,001 | ||||
| Ninguna | 609 | 79,5 | 540 | 92,2 | 103 | 98,1 | 1.252 | 85,9 | <0,001 |
| Una (1) | 104 | 13,6 | 38 | 6,5 | 2 | 1,9 | 144 | 9,9 | |
| Dos o más (≥2) | 53 | 6,9 | 8 | 1,4 | 0 | 0,0 | 61 | 4,2 | |
| Hospitalizaciones por causas diferentes el año previo | |||||||||
| N.° de ingresos. Media [DE] | 0,15 [0,52] | 0,13 [0,47] | 0,16 [0,44] | 0,15 [0,50] | 0,745 | ||||
| Ninguna | 684 | 89,3 | 525 | 89,6 | 91 | 86,7% | 1.300 | 89,2 | 0,67 |
| Alguna (≥1) | 82 | 10,7 | 61 | 10,4 | 14 | 13,3% | 157 | 10,8 | |
| FEV1 registrado tras espirometría (n=1.311)a | |||||||||
| No registrado | 141 | 18,4 | 315 | 71,6 | 41 | 39,0 | 497 | 37,9 | |
| Sí registrado | 625 | 81,6 | 125 | 28,4 | 64 | 61,0 | 814 | 62,1 | |
| FEV1 Media [DE] | 57,7 [16,3] | 61,7 [15,2] | 89,4 [16,4] | 60,9 [18,2] | <0,001 | ||||
En 497 pacientes no se registró el valor exacto del FEV1 a pesar de que el clínico había dejado constancia en la historia clínica de que el paciente realizó la prueba. Esto representa un 37,9% con respecto al total de pacientes con constancia de espirometría realizada (N=1.311).
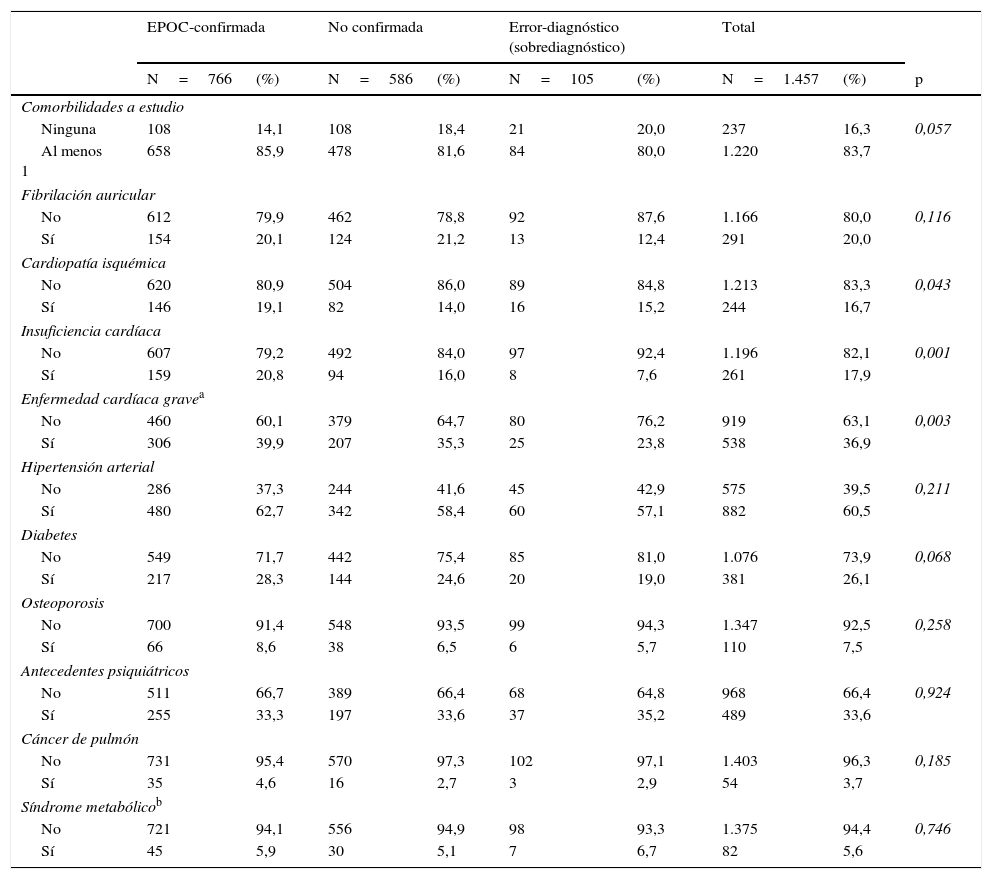
ComorbilidadesLa comorbilidad más frecuente en todos los grupos fue la hipertensión arterial, presente en el 62,7% de los casos de EPOC confirmados. En estos, la diabetes constó en los registros del 28,3%, y un 39,9% presentó al menos una de las enfermedades cardíacas consideradas como graves en el estudio (cardiopatía isquémica, insuficiencia cardíaca, fibrilación auricular) (tabla 5).
Comorbilidades a estudio en función de los grupos de confirmación diagnóstica
| EPOC-confirmada | No confirmada | Error-diagnóstico (sobrediagnóstico) | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N=766 | (%) | N=586 | (%) | N=105 | (%) | N=1.457 | (%) | p | |
| Comorbilidades a estudio | |||||||||
| Ninguna | 108 | 14,1 | 108 | 18,4 | 21 | 20,0 | 237 | 16,3 | 0,057 |
| Al menos 1 | 658 | 85,9 | 478 | 81,6 | 84 | 80,0 | 1.220 | 83,7 | |
| Fibrilación auricular | |||||||||
| No | 612 | 79,9 | 462 | 78,8 | 92 | 87,6 | 1.166 | 80,0 | 0,116 |
| Sí | 154 | 20,1 | 124 | 21,2 | 13 | 12,4 | 291 | 20,0 | |
| Cardiopatía isquémica | |||||||||
| No | 620 | 80,9 | 504 | 86,0 | 89 | 84,8 | 1.213 | 83,3 | 0,043 |
| Sí | 146 | 19,1 | 82 | 14,0 | 16 | 15,2 | 244 | 16,7 | |
| Insuficiencia cardíaca | |||||||||
| No | 607 | 79,2 | 492 | 84,0 | 97 | 92,4 | 1.196 | 82,1 | 0,001 |
| Sí | 159 | 20,8 | 94 | 16,0 | 8 | 7,6 | 261 | 17,9 | |
| Enfermedad cardíaca gravea | |||||||||
| No | 460 | 60,1 | 379 | 64,7 | 80 | 76,2 | 919 | 63,1 | 0,003 |
| Sí | 306 | 39,9 | 207 | 35,3 | 25 | 23,8 | 538 | 36,9 | |
| Hipertensión arterial | |||||||||
| No | 286 | 37,3 | 244 | 41,6 | 45 | 42,9 | 575 | 39,5 | 0,211 |
| Sí | 480 | 62,7 | 342 | 58,4 | 60 | 57,1 | 882 | 60,5 | |
| Diabetes | |||||||||
| No | 549 | 71,7 | 442 | 75,4 | 85 | 81,0 | 1.076 | 73,9 | 0,068 |
| Sí | 217 | 28,3 | 144 | 24,6 | 20 | 19,0 | 381 | 26,1 | |
| Osteoporosis | |||||||||
| No | 700 | 91,4 | 548 | 93,5 | 99 | 94,3 | 1.347 | 92,5 | 0,258 |
| Sí | 66 | 8,6 | 38 | 6,5 | 6 | 5,7 | 110 | 7,5 | |
| Antecedentes psiquiátricos | |||||||||
| No | 511 | 66,7 | 389 | 66,4 | 68 | 64,8 | 968 | 66,4 | 0,924 |
| Sí | 255 | 33,3 | 197 | 33,6 | 37 | 35,2 | 489 | 33,6 | |
| Cáncer de pulmón | |||||||||
| No | 731 | 95,4 | 570 | 97,3 | 102 | 97,1 | 1.403 | 96,3 | 0,185 |
| Sí | 35 | 4,6 | 16 | 2,7 | 3 | 2,9 | 54 | 3,7 | |
| Síndrome metabólicob | |||||||||
| No | 721 | 94,1 | 556 | 94,9 | 98 | 93,3 | 1.375 | 94,4 | 0,746 |
| Sí | 45 | 5,9 | 30 | 5,1 | 7 | 6,7 | 82 | 5,6 | |
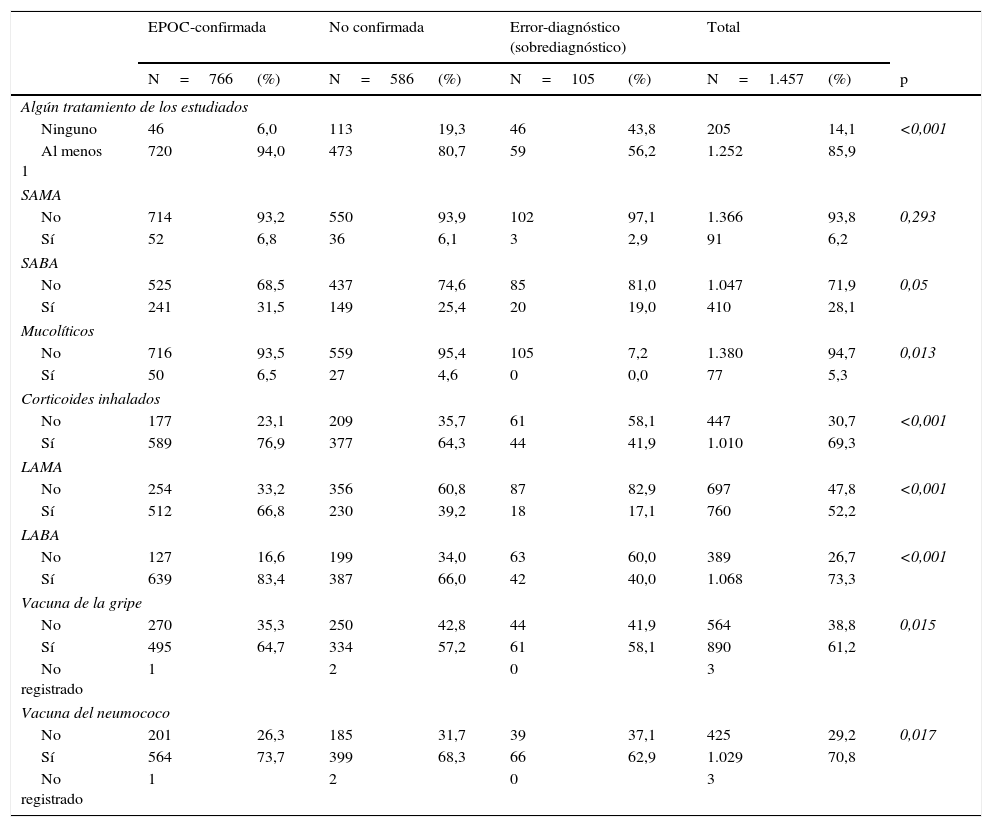
En el grupo de EPOC-confirmada, el tipo de fármaco más frecuentemente usado fueron los LABA (83,4%), seguidos de los corticoides inhalados (CI) (76,9%) y los LAMA (66,8%). Los CI fueron el tratamiento más prescrito (41,9%) en el grupo de pacientes con EPOC descartada y se prescribieron en el 64,3% de los pacientes en los que no se pudo confirmar ni descartar el diagnóstico (tabla 6).
Frecuencia de uso de los tratamientos estudiados, en función de los grupos de confirmación diagnóstica
| EPOC-confirmada | No confirmada | Error-diagnóstico (sobrediagnóstico) | Total | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N=766 | (%) | N=586 | (%) | N=105 | (%) | N=1.457 | (%) | p | |
| Algún tratamiento de los estudiados | |||||||||
| Ninguno | 46 | 6,0 | 113 | 19,3 | 46 | 43,8 | 205 | 14,1 | <0,001 |
| Al menos 1 | 720 | 94,0 | 473 | 80,7 | 59 | 56,2 | 1.252 | 85,9 | |
| SAMA | |||||||||
| No | 714 | 93,2 | 550 | 93,9 | 102 | 97,1 | 1.366 | 93,8 | 0,293 |
| Sí | 52 | 6,8 | 36 | 6,1 | 3 | 2,9 | 91 | 6,2 | |
| SABA | |||||||||
| No | 525 | 68,5 | 437 | 74,6 | 85 | 81,0 | 1.047 | 71,9 | 0,05 |
| Sí | 241 | 31,5 | 149 | 25,4 | 20 | 19,0 | 410 | 28,1 | |
| Mucolíticos | |||||||||
| No | 716 | 93,5 | 559 | 95,4 | 105 | 7,2 | 1.380 | 94,7 | 0,013 |
| Sí | 50 | 6,5 | 27 | 4,6 | 0 | 0,0 | 77 | 5,3 | |
| Corticoides inhalados | |||||||||
| No | 177 | 23,1 | 209 | 35,7 | 61 | 58,1 | 447 | 30,7 | <0,001 |
| Sí | 589 | 76,9 | 377 | 64,3 | 44 | 41,9 | 1.010 | 69,3 | |
| LAMA | |||||||||
| No | 254 | 33,2 | 356 | 60,8 | 87 | 82,9 | 697 | 47,8 | <0,001 |
| Sí | 512 | 66,8 | 230 | 39,2 | 18 | 17,1 | 760 | 52,2 | |
| LABA | |||||||||
| No | 127 | 16,6 | 199 | 34,0 | 63 | 60,0 | 389 | 26,7 | <0,001 |
| Sí | 639 | 83,4 | 387 | 66,0 | 42 | 40,0 | 1.068 | 73,3 | |
| Vacuna de la gripe | |||||||||
| No | 270 | 35,3 | 250 | 42,8 | 44 | 41,9 | 564 | 38,8 | 0,015 |
| Sí | 495 | 64,7 | 334 | 57,2 | 61 | 58,1 | 890 | 61,2 | |
| No registrado | 1 | 2 | 0 | 3 | |||||
| Vacuna del neumococo | |||||||||
| No | 201 | 26,3 | 185 | 31,7 | 39 | 37,1 | 425 | 29,2 | 0,017 |
| Sí | 564 | 73,7 | 399 | 68,3 | 66 | 62,9 | 1.029 | 70,8 | |
| No registrado | 1 | 2 | 0 | 3 | |||||
LABA: broncodilatadores β2, de acción larga; LAMA: anticolinérgicos de acción larga; SABA: broncodilatadores β2, de acción corta; SAMA: anticolinérgicos de acción corta.
Profundizando en el uso de CI en los pacientes con EPOC confirmada: un 72,7% de los pacientes clasificados como fenotipo no agudizador en el último año (<2 agudizaciones, n=469) los tenían prescritos de forma habitual. Revisando las agudizaciones de los últimos 4 años, de los 84 pacientes con EPOC que no tuvieron registrada ninguna agudización durante ese periodo, un 54,8% tenían prescrito un CI (datos no presentados en tablas).
DiscusiónEn nuestra muestra se ha encontrado un sobrediagnóstico de EPOC del 7,2% y un porcentaje de «indefinición» (EPOC no confirmada-no descartada) por encima del 40%. El porcentaje de sobrediagnóstico está algo por debajo del ofrecido en el estudio IDENTEPOC12, donde el 10,2% de los pacientes no presentaron un patrón obstructivo. El porcentaje de indefinición en IDENTEPOC fue bastante inferior (26,5%), probablemente porque la mayor parte de los pacientes fueron reclutados en consultas de neumología. Las diferencias de género entre los diferentes grupos de confirmación diagnóstica son también apoyadas por el estudio IDENTEPOC12, lo que puede dar a entender la existencia de una desigualdad de género que debe ser estudiada en profundidad.
La realización de las espirometrías de forma incorrecta o una deficiente interpretación de sus valores, junto al infrarregistro de los datos espirométricos, podrían ser las causas principales de este resultado, que coinciden con otros estudios a nivel nacional17–19. En este sentido, creemos que sería de ayuda la implantación de programas de control y seguimiento individualizados de los pacientes con EPOC a través de los registros sanitarios. En la comunidad de Cantabria, con posterioridad al inicio de este estudio se puso en marcha la «Ruta de la EPOC», con el objetivo de mejorar la continuidad asistencial. En próximas revisiones podremos comprobar la efectividad de este plan en cuanto a la mejora en la realización, interpretación y registro de las pruebas espirométricas.
El grupo de pacientes con EPOC-confirmada se comportó de modo distinto al grupo de error-diagnóstico. El grupo de EPOC no confirmada presentó en general unos valores intermedios entre los del grupo EPOC-confirmada y los del grupo error-diagnóstico. Se puede sospechar, entonces, que en este grupo habría pacientes con y sin EPOC. Esto sucedió tanto para variables descriptivas y estilos de vida como para características clínicas, algunas comorbilidades y tratamientos.
El tabaquismo apareció más frecuentemente en el grupo de EPOC-confirmada. No obstante, incluso en el grupo de EPOC descartada el porcentaje de fumadores y exfumadores estuvo por encima de lo esperado para la población general. La encuesta nacional de Salud (ENSE) publicó que en ese mismo año el porcentaje de personas «nunca fumadoras» fue del 53,5%20, muy por encima de los resultados obtenidos en este grupo. Por otro lado, un 14,8% de pacientes con EPOC-confirmada constaron como no fumadores en los registros consultados. Una revisión reciente cifra la prevalencia de EPOC en no fumadores en España sobre el 23% y sobre el 25% en Estados Unidos21.
Desde un punto de vista clínico en el grupo error-diagnóstico (sobrediagnóstico) hubo más antecedente tabáquico y síntomas respiratorios de origen bronquial que en la población general y, a pesar de que no se cumplieran los criterios diagnósticos de EPOC, habría que tenerlos en consideración ya que podría tratarse de pacientes en estadios preenfermedad (GOLD 0), en los que sería muy interesante intervenir antes de que esta se desarrollara.
A pesar de ser considerado un importante factor pronóstico3–5, no encontramos registrado el valor exacto del grado de obstrucción (FEV1) en el 38% del total de las historias donde al médico le constaba la realización de la espirometría. Sin este dato no se pueden estimar los índices de gravedad BODEx/BODE/GOLD y, por lo tanto, no se puede brindar un adecuado seguimiento y tratamiento de la enfermedad según las guías clínicas actuales3–5. El FEV1 es un dato relevante en la historia clínica del paciente con EPOC, y debería ser realizado y registrado de forma periódica, para valorar tanto la evolución de la enfermedad como la respuesta al tratamiento.
El número de AEPOC por paciente/año fue de 1,5, en consonancia con los 1,5 recogidos en el estudio nacional IMPAC22. ECLIPSE ofrece una media 1,2116 y una cohorte británica basada en registros sanitarios de atención primaria, de 0,899. El número de hospitalizaciones por paciente/año a causa de AEPOC fue de 0,33, en consonancia con los 0,22 que reportó ECLIPSE16.
Nuestros resultados apoyan la hipótesis de que las comorbilidades son más frecuentes en los pacientes con EPOC que en la población general3–6. Encontramos un registro de hipertensión arterial en el grupo de EPOC-confirmada en más del 60% de los pacientes, cuando los datos poblacionales en grupos ≥65 años estiman una prevalencia conocida o registrada en torno al 50% en España y en Europa23,24. Igualmente, la prevalencia de diabetes, estimada en el 13,8% en la población española en un reciente estudio25, en nuestro grupo de EPOC-confirmada es de casi el 30%. Nuestros datos avalan igualmente una asociación entre cardiopatías y EPOC, enfermedades muy relacionadas con el deterioro de la calidad de vida y con factores de riesgo independientes de mortalidad6. La insuficiencia cardíaca aparece en aproximadamente un 10% de la población con edades similares a las de nuestra muestra26, mientras que en nuestro grupo de EPOC-confirmada estaba registrada en más del 20% de los pacientes. Esta es una cifra que se corresponde con la prevalencia de insuficiencia cardíaca reportada en pacientes EPOC a nivel internacional27. En conjunto, estos resultados apoyan la necesidad de un manejo clínico integral de la EPOC que incluya las comorbilidades asociadas4,5.
Referente a los tratamientos prescritos de forma estable, el porcentaje de uso de CI en los pacientes con EPOC de nuestra muestra fue similar al reportado en ECLIPSE16 (76,9 vs. 72%). El estudio fue realizado un año antes de que GesEPOC recomendara en su guía el tratamiento personalizado con relación al fenotipo. Desde entonces se viene preconizando un uso más racional de los CI, que están actualmente indicados en casos de «fenotipo EPOC-asma u overlap»4,5 o en pacientes con EPOC con fenotipo agudizador frecuente. En cualquier caso, el porcentaje de pacientes con indicación de CI sería muy inferior al reportado: en nuestra muestra identificamos un sobreuso, como se ha publicado también en otros estudios28,29.
El alto porcentaje de CI prescrito en los EPOC descartados y en los que no se pudo confirmar el diagnóstico, además de un aumento del gasto, podría, asimismo, conllevar un aumento de efectos adversos innecesarios30.
En estudios retrospectivos basados en información secundaria (registros) una de las principales limitaciones podría ser la baja calidad de la información. Esta baja calidad se debería a una falta de concordancia en la información proporcionada, o a una cumplimentación insuficiente de los registros. Para minimizar estos sesgos se escogieron aquellas variables que a priori se recogen de una forma más homogénea, sistemática y objetiva en las historias clínicas electrónicas. Asimismo, la información se cruzó con los registros hospitalarios informatizados. En cualquier caso, como limitación principal conviene volver a señalar el carácter retrospectivo en la recogida de información a partir de bases de datos, cuyo diseño y objetivo no es la investigación sino la clínica. Como ventaja, el hecho de basarse en registros secundarios garantizaría el manejo de una información sin manipulación consciente o inconsciente, pues esta información ha sido introducida en las bases de datos por el personal sanitario como parte de su rutina de trabajo. Por último, el hecho de que en nuestro estudio se parta de una base poblacional, así como de una muestra aleatoria representativa de esta población, minimizaría la posibilidad de un sesgo de selección.
ConclusionesEn conclusión, la fiabilidad del registro del diagnóstico de EPOC en Atención Primaria en el ámbito del estudio fue deficiente: ya que se pudo confirmar solo en el 52,6% de los pacientes. En el 10% de los pacientes no constó la realización de ninguna espirometría. Sería deseable un mejor uso y registro de la que es la principal prueba de diagnóstico y seguimiento. El porcentaje de sobrediagnóstico fue del 7,2%. En más de la mitad de estos pacientes sobrediagnosticados constó la prescripción de tratamientos para la EPOC de forma estable, entre los que destaca el uso de CI.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autoría/colaboradoresContribución específica de cada uno de los autores:
MS, RG, JMH, SA y JLGR diseñaron el estudio. MS y RG llevaron a cabo el análisis estadístico. RG escribió el manuscrito. MS, JMH, MR, SA, CB y CL contribuyeron a la adquisición de los datos, análisis e interpretación de resultados, revisaron críticamente el manuscrito con contribuciones intelectuales y dieron la aprobación final para su publicación. JLGR y MM supervisaron el análisis, contribuyeron a la redacción y edición del manuscrito y dieron la aprobación final para su publicación.
Conflicto de interesesEl estudio no ha recibido financiación. No obstante se describen las relaciones financieras que tienen los autores y que pudieran dar lugar a un conflicto de intereses en relación con el artículo publicado: el Dr. García Rivero ha recibido honorarios por asesoría científica o por impartir conferencias de Almirall, Boehringer Ingelheim, Pfizer, Astra Zeneca, Chiesi, GlaxoSmithKline, Menarini, Takeda, Teva, Ferrer y Novartis. El Dr. Helguera ha recibido honorarios por impartir conferencias de GlaxoSmithKline, Boehringer, Novartis, Mundipharma y Astral Zeneca. La Dra. Bonnardeaux ha recibido honorarios por impartir conferencias de GlaxoSmithKline, Boehringer, Ferrer, Astra Zeneca, Teva y Chiesi. El Dr. Miravitlles ha recibido honorarios por asesoría científica o por impartir conferencias de Almirall, AstraZeneca, Boehringer Ingelheim, Ferrer Group, GlaxoSmithKline, Grifols, Esteve, Pfizer, Teva, Cipla, Novartis, Gebro Pharma y Takeda. El resto de los autores declaran no tener ningún conflicto de intereses.
Al Servicio Cántabro de Salud por el apoyo y las facilidades recibidas.