La disección aórtica aguda (DAA) es una emergencia cardiovascular con una mortalidad operatoria hasta del 30%. Se estima que cerca del 80% de los pacientes mueren antes de llegar a un hospital, y la mortalidad sin intervención quirúrgica alcanza el 60%. La optimización de estos resultados depende de un trabajo mancomunado entre los equipos médicos de los departamentos de urgencias y centros de referencia que cuenten con equipos multidisciplinarios expertos en el manejo de la aorta y la disección aguda.
La disección se produce por un desgarro en la íntima de la aorta que permite el flujo de sangre a través de las capas de la aorta, extendiéndose de manera anterógrada y retrograda con el consecuente compromiso de los vasos secundarios. El diagnóstico temprano y certero depende de un alto grado de sospecha clínica en asociación con algoritmos para la utilización de exámenes invasivos y no invasivos que permitan establecer el diagnóstico definitivo. Los dos sistemas de clasificación de la DAA más utilizados son la de DeBakey y la de Stanford. De acuerdo con ellos, se define el manejo médico inicial, el cual busca controlar el dolor, la presión arterial y la frecuencia cardíaca, con el fin de frenar la progresión de la disección, mientras el paciente es trasladado a un centro de referencia o sometida a una intervención quirúrgica definitiva.
Este artículo provee una revisión del enfoque diagnóstico y principios terapéuticos de la disección aórtica para médicos, enfermeras y estudiantes.
Acute aortic dissection is a cardiovascular emergency with an operative mortality of up to 30%. It is estimated that about 80% of patients die before reaching a hospital, and mortality without surgical intervention reaches 60%. The optimization of these results depends on the collaboration between the medical teams of the emergency departments and reference centers that have multidisciplinary teams specializing in the management of the aorta and acute dissection.
The dissection is produced by a tear in the intima of the aorta that allows blood to flow in between the layers of the aorta, extending in an anterograde and retrograde fashion, with the consequent involvement of branch vessels. A timely and accurate diagnosis depends on a high degree of clinical suspicion together with algorithms for the use of invasive and non-invasive tests that ultimately help establish a definitive diagnosis. The two classification systems most commonly used, are DeBakey's and Stanford's. Depending on the classification of the dissection, initial medical management is defined, seeking to control pain, blood pressure and heart rate in order to limit progression of the dissection, while the patient is transferred to a reference center or undergoes definitive surgical intervention.
This article provides a review of the diagnostic approach and therapeutic principles of aortic dissection for physicians, nurses, and students.
La disección aórtica (DA) hace parte del espectro de síndromes aórticos agudos que incluyen la úlcera aórtica penetrante y el hematoma intramural, siendo la DA aguda (DAA) la patología más catastrófica1, por lo que requiere un diagnóstico temprano y tratamiento adecuado. La prevalencia de DAA es de 4,4 casos por cada 100.000 personas/año en Estados Unidos2, llegando en promedio a 7,2 casos por cada 100.000 pacientes en Suecia3. Sin embargo, la verdadera incidencia de DAA está subestimada en los reportes poblacionales4, pues una gran proporción de los pacien- tes muere sin causa conocida antes de llegar al hospital5.
2FisiopatologíaLa aorta normal está compuesta por tres capas: íntima, media y adventicia que le otorgan la capacidad de soportar los cambios de presión propios del ciclo cardíaco y mantener el flujo durante la diástole por el efecto Windkessel. La DA consiste en una dis- rupción de la túnica intima de la aorta, la cual resulta en paso de la sangre hacia la túnica media generando una luz falsa que se puede propagar de forma anterógrada y retrógrada compro- metiendo la totalidad de la aorta y extendiéndose hacia los vasos secundarios.
En dos terceras partes de los casos el desgarro intimal primario ocurre en la aorta ascendente proximal6, dado que esta porción de la aorta está sujeta a mayores fluctuaciones en la presión ar- terial a lo largo del ciclo cardíaco. Las complicaciones de la DAA incluyen ruptura aórtica, taponamiento cardíaco, insuficiencia aórtica aguda y síndromes de malperfusión visceral y periférica7. El riesgo de mortalidad se estima en 1% a 2% por hora y el ma- nejo no-quirúrgico se asocia a una mortalidad del 60%8.
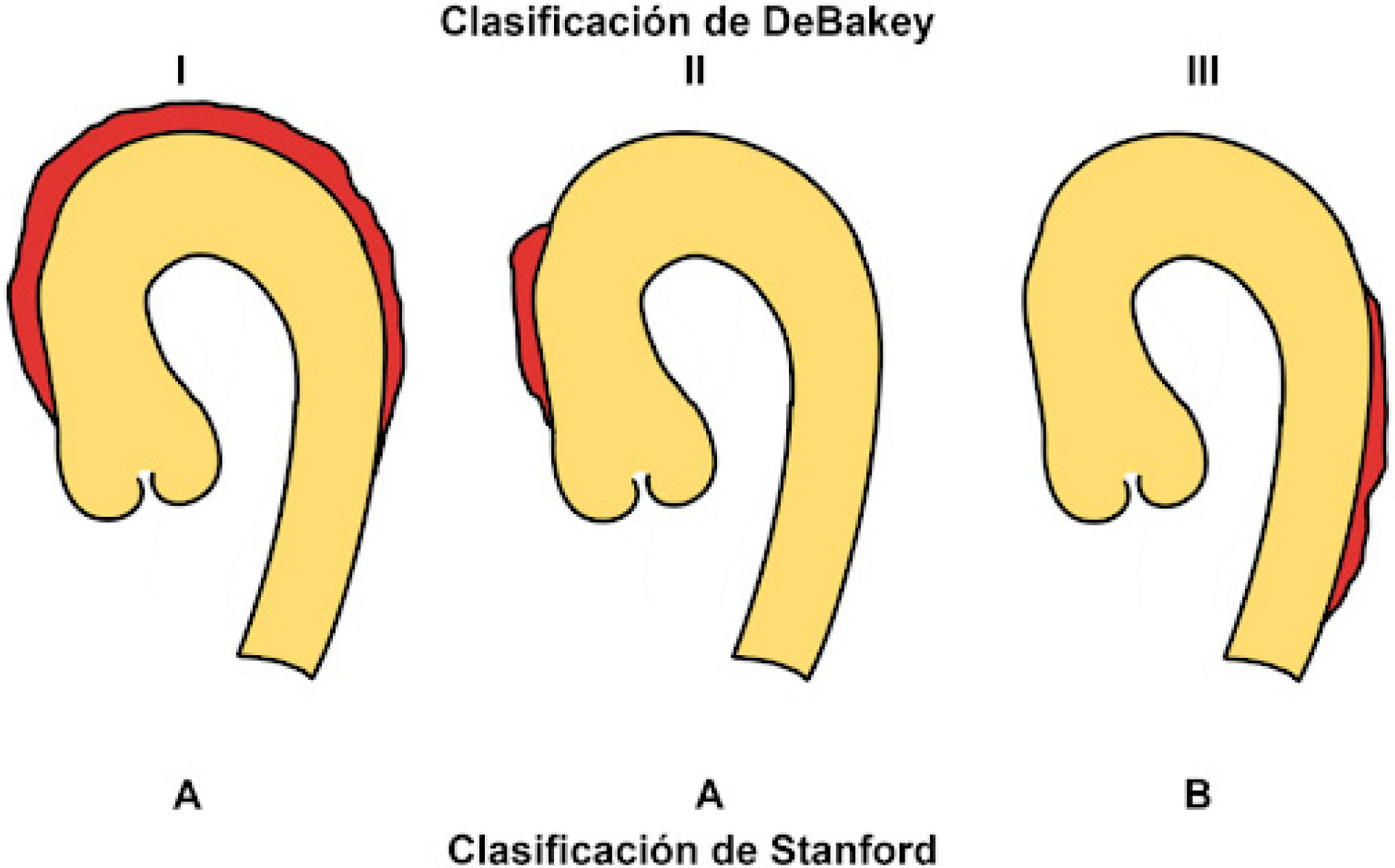
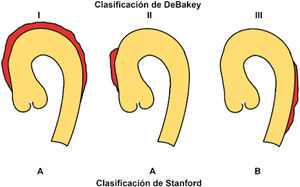
La extensión anatómica de la DAA impacta de manera muy im- portante el pronóstico y manejo de la condición y se clasifica por el segmento de la aorta comprometido. En la actualidad no hay un consenso claro en la clasificación de la DAA, sin embargo, las dos clasificaciones más utilizadas son las de DeBakey9 y la de Stanford10. La clasificación de DeBakey describe tres tipos de DAA (Fig. 1):
Tipo I: el desgarro intimal se origina en la aorta ascendente y se extiende de manera anterógrada con compromiso al menos del arco aórtico y típicamente de la aorta torácica descendente.
Tipo II: el desgarro intimal se origina en la aorta ascendente y se confina a este segmento (sin extensión al arco aórtico o la aorta torácica descendente).
Tipo III: el desgarro intimal se origina en la aorta torácica descen- dente (usualmente justo delante del origen de la arteria subclavia izquierda). Se subclasifica en IIIa si el desgarro se confina a la aorta torácica descendente o IIIb si el desgarro se extiende hacia abajo del diafragma.
La clasificación de Stanford10 simplifica este concepto en los ti- pos A y B dependiendo del compromiso de la aorta ascendente (Fig. 1):
Tipo A: la DA compromete la aorta torácica ascendente, inde- pendiente del sitio donde se origine y si hay o no compromiso de otros segmentos.
Tipo B: la DA no compromete la aorta torácica ascendente (aquí se incluye la presencia de compromiso del arco aórtico sin com- promiso de la aorta torácica ascendente).
La localización del desgarro primario debería adicionarse a la estratificación aguda de la DA aguda tipo B siempre que pueda tener un impacto en la estrategia inicial de tratamiento. Weiss et al.11, han sugerido una terminología modificada donde si el des- garro de entrada se localiza en la convexidad de la aorta, lo deno- minan como B1 y si está en la concavidad (circunferencia interna a partir del arco) de la aorta descendente, lo denominan como B2. En este, la carencia de barrera anatómica permite la propagación retrógrada de la DA12.
Por su temporalidad, la DA puede clasificarse en cuatro categorías según el tiempo desde el inicio de los síntomas:
Hiperaguda: menos de 24 horas. Aguda: 2 a 7 días.
Subaguda: 8 a 30 días. Crónica: más de 30 días.
Finalmente, la DA puede clasificarse según si es complicada o no. Se considera complicada cuando cumple alguno de los siguientes criterios10:
- •
Presencia de ruptura aórtica (o signos de ruptura inminente).
- •
Compromiso de perfusión visceral.
- •
Hipertensión refractaria.
- •
Hipotensión.
- •
Shock.
- •
Síntomas recurrentes.
- •
Diámetro aórtico máximo ≥55mm o con incremento>4mm en imágenes seriadas.
- •
Desarrollo de hematoma periaórtico o derrame pleural hemo- rrágico.
Los pacientes con DAA típicamente se encuentran entre la sex- ta y séptima década de la vida. En el registro IRAD (International Registry of Acute Aortic Dissection)13, la edad promedio fue de 63,1 años siendo un poco menores los pacientes con DA tipo A vs. B (61,2 vs. 66,3 años respectivamente). La hipertensión arterial se considera un factor de riesgo típico y se observa en cerca del 70% de los pacientes. El 17,9% de los pacientes tienen antecedente de cirugía cardíaca, siendo los procedimientos previos más fre- cuentes el reemplazo valvular aórtico (5,4%) y el reparo de aneu- risma/disección aórtica (9,7%). Otros factores de riesgo incluyen la presencia de aterosclerosis, el diagnóstico previo de aneurisma y la historia previa de disección aórtica, los cuales se observaron en el 31,0%, 16,1% y 6,4% de los casos respectivamente. El an- tecedente de síndrome de Marfan se observó en el 4,9% de los pacientes, siendo mayor en la DAA tipo A (DAATA) (6,7%) que en la tipo B (1,8%)8.
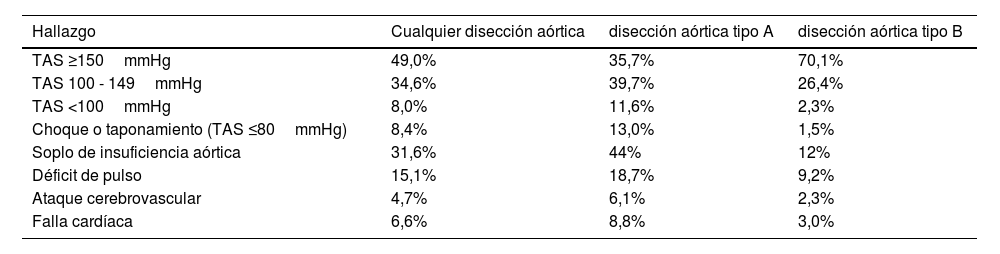
La manifestación clínica central es el dolor torácico, presente en más del 95% de los pacientes. La descripción semiológica tradi- cional es la de un dolor “desgarrador” que va migrando a medida que la disección progresa. Sin embargo, en el registro IRAD6 la naturaleza del dolor más frecuente fue la de un dolor severo, ob- servado en el 84,8%; el 64,4% lo definían como un dolor agudo y tan solo el 50,6% lo describían como desgarrador6. La localización más frecuente del dolor también varía según el tipo de disección (tipo A o tipo B), con una localización torácica/lumbar/abdomi- nal en el 78,9%/46,6%/21,6% y 62,9%/63,8%/42,7% respectiva- mente, siendo estas diferencias estadísticamente significativas. Los hallazgos a la exploración física también difieren entre los pacientes con DA tipo A y tipo B (Tabla 1).
Diferencias entre el examen físico de pacientes con disección aórtica (DA) tipo A versus tipo B en el registro
| Hallazgo | Cualquier disección aórtica | disección aórtica tipo A | disección aórtica tipo B |
|---|---|---|---|
| TAS ≥150mmHg | 49,0% | 35,7% | 70,1% |
| TAS 100 - 149mmHg | 34,6% | 39,7% | 26,4% |
| TAS <100mmHg | 8,0% | 11,6% | 2,3% |
| Choque o taponamiento (TAS ≤80mmHg) | 8,4% | 13,0% | 1,5% |
| Soplo de insuficiencia aórtica | 31,6% | 44% | 12% |
| Déficit de pulso | 15,1% | 18,7% | 9,2% |
| Ataque cerebrovascular | 4,7% | 6,1% | 2,3% |
| Falla cardíaca | 6,6% | 8,8% | 3,0% |
TAS: tensión arterial sistólica.
Traducido del International Registry of Acute Aortic Dissection (IRAD)6.
Es importante recordar que las manifestaciones clínicas no son suficientes para diferenciar entre las patologías que comprenden el síndrome aórtico agudo por lo que ante una presentación clíni- ca compatible debe procederse indistintamente con un aborda- je diagnóstico estandarizado que permita confirmar o descartar esta patología12.
4DiagnósticoEn los Estados Unidos, cada año entre 5 y 10 millones de pacien- tes consultan a los servicios de urgencias con dolor torácico14. De estos, solo una pequeña proporción tiene patologías cardiovascu- lares y apenas una fracción corresponden a DAA. Por este motivo, la utilización indiscriminada de ayudas diagnósticas avanzadas en este grupo de pacientes es una estrategia ineficiente en tiempo y costos. Desde el punto de vista clínico, menos de la mitad de los pacientes tiene una sospecha inicial correcta de DAA (tan bajo como el 15%) y hasta el 39% tienen una demora diagnóstica de 24 horas o superior15, puesto que los hallazgos “clásicos” de DA se observan en menos del 50% de los pacientes. En consecuencia, es imperativo desarrollar o implementar algoritmos diagnósticos que sean conocidos por el equipo multidisciplinario a cargo del manejo de este complejo grupo de pacientes6. Se debe sospechar DAA en presencia de dolor torácico, dorsal o abdominal en asociación con síncope y síntomas sugestivos de compromiso de perfusión, tales como ausencia de pulsos distales, déficit neuroló- gico, infarto agudo de miocardio (IAM), o isquemia mesentérica6. La presencia de uno de estos hallazgos produce una relación de probabilidad de 0,5, la cual aumenta a 5,3 cuando son dos y 66 cuando se encuentran tres hallazgos simultáneos. (Tablas 2 y 3).
Sensibilidad de distintos hallazgos en el interrogatorio, el examen físico y la radiografía de tórax6
| Hallazgo | Sensibilidad (IC 95%) |
|---|---|
| Anamnesis | |
| Antecedente de hipertensión arterial | 64% (54 - 72%) |
| Antecedente de síndrome de Marfan | 5% (4 - 7%) |
| Dolor torácico | 67% (56 - 77%) |
| Dolor de inicio súbito | 84% (80 - 99%) |
| Dolor severo | 90% (88 - 92%) |
| Dolor desgarrador | 39% (14 - 69%) |
| Dolor migratorio | 31% (12 - 55%) |
| Examen físico | |
| Hipertensión arterial | 49% (41 - 57%) |
| Soplo diastólico | 28% (21 - 36%) |
| Déficit de pulso | 31% (24 - 39%) |
| Radiografía de tórax | |
| Alteración del contorno aórtico | 71% (56 - 84%) |
| Mediastino ensanchado | 64% (44 - 80%) |
| Signo del calcio | 9% (6 - 13%) |
| Cualquier anormalidad | 90% (87 - 92%) |
Relación de probablilidad (RP) de diversos hallazgos clínicos para el diagnóstico de disección aórtica (DA)6
| Hallazgo | RP positivo (IC 95%) | RP negativo (IC 95%) |
|---|---|---|
| Antecedente de hipertensión | 1,6 (1,2 - 2,0) | 0,5 (0,3 - 0,7) |
| Dolor torácico de inicio súbito | 1,6 (1,0 - 2,4) | 0,3 (0,2 - 0,5) |
| Dolor desgarrador | 10,8 (5,2 - 22,0) | 0,4 (0,3 - 0,5) |
| Dolor migratorio | 7,6 (3,6 - 16,0) | 0,6 (0,5 - 0,7) |
| Déficit de pulso | 5,7 (1,4 - 23,0) | 0,7 (0,6 - 0,9) |
| Déficit neurológico focal | 33,0 (2,0 - 549,0) | 0,87 (0,8 - 0,9) |
| Soplo diastólico | 1,4 (1,0 - 2,0) | 0,9 (0,8 - 1,0) |
| Aorta agrandada o mediastino ensanchado | 2,0 (1,4 - 3,1) | 0,3 (0,2 - 0,4) |
La utilidad de los marcadores séricos es limitada para confirmar el diagnóstico de DAA, aunque puede ser de utilidad para descartar- la. Un metaanálisis de 298 pacientes demostró que la utilización de un corte de dímero-D de 0,5μg/ml puede ser útil para el ta- mizaje en urgencias, con una sensibilidad de 97%, un valor pre- dictivo negativo de 96% y una relación de probabilidad negativa de 0,06. En contraste, su especificidad es del 56%, con un valor predictivo positivo de 60% y una relación de probabilidad posi- tiva de 2,4316. La medición de troponina puede ser de utilidad para la evaluación de isquemia miocárdica, teniendo siempre en cuenta que una medición positiva no explica el mecanismo por el cual ocurre. En la DAATA puede haber compromiso de los ostias coronarios (más frecuentemente de la derecha) y por ende una troponina positiva no debe “descartar” el diagnóstico de DA sino incluirse en la evaluación diagnóstica global del paciente12.
Aunque la radiografía de tórax es el estudio inicial en la ma- yoría de los pacientes, su sensibilidad no es suficiente para descartar el diagnóstico en un contexto clínico sugestivo. Las anomalías más frecuentemente observadas son el mediastino ensanchado (en menos de dos tercios de los pacientes), anor- malidades en el contorno aórtico (en casi el 50% de los casos) y las anormalidades en el contorno cardíaco (observados en un 25% de los casos). Sin embargo, aun en presencia de estas, la sensibilidad reportada es del 64% al 71%15. El signo del calcio (una separación entre el borde aórtico y una calcificación in- timal de 10 o más milímetros) se observa en menos del 15% de los pacientes. El electrocardiograma tiene un rendimiento diagnóstico aún peor, con un tercio de los pacientes teniendo electrocardiogramas normales. La anormalidad más frecuente son las alteraciones inespecíficas de la repolarización (en un 40% de los pacientes). La presencia de elevación del segmento ST se observa en menos del 5% de los pacientes y más frecuen- temente ocurre en la DAATA por el compromiso mencionado del ostium coronario6.
La confirmación diagnóstica requiere la utilización de técnicas más avanzadas incluyendo el ecocardiograma transtorácico (ETT) o transesofágico (ETE), la tomografía axial computarizada (TAC) y, en casos selectos, la resonancia magnética nuclear (RMN). En el estudio IRAD, la modalidad diagnóstica inicial más frecuente fue la TAC en el 62% de los casos, seguido del ETE en 32% y resonancia en tan solo el 1%6.
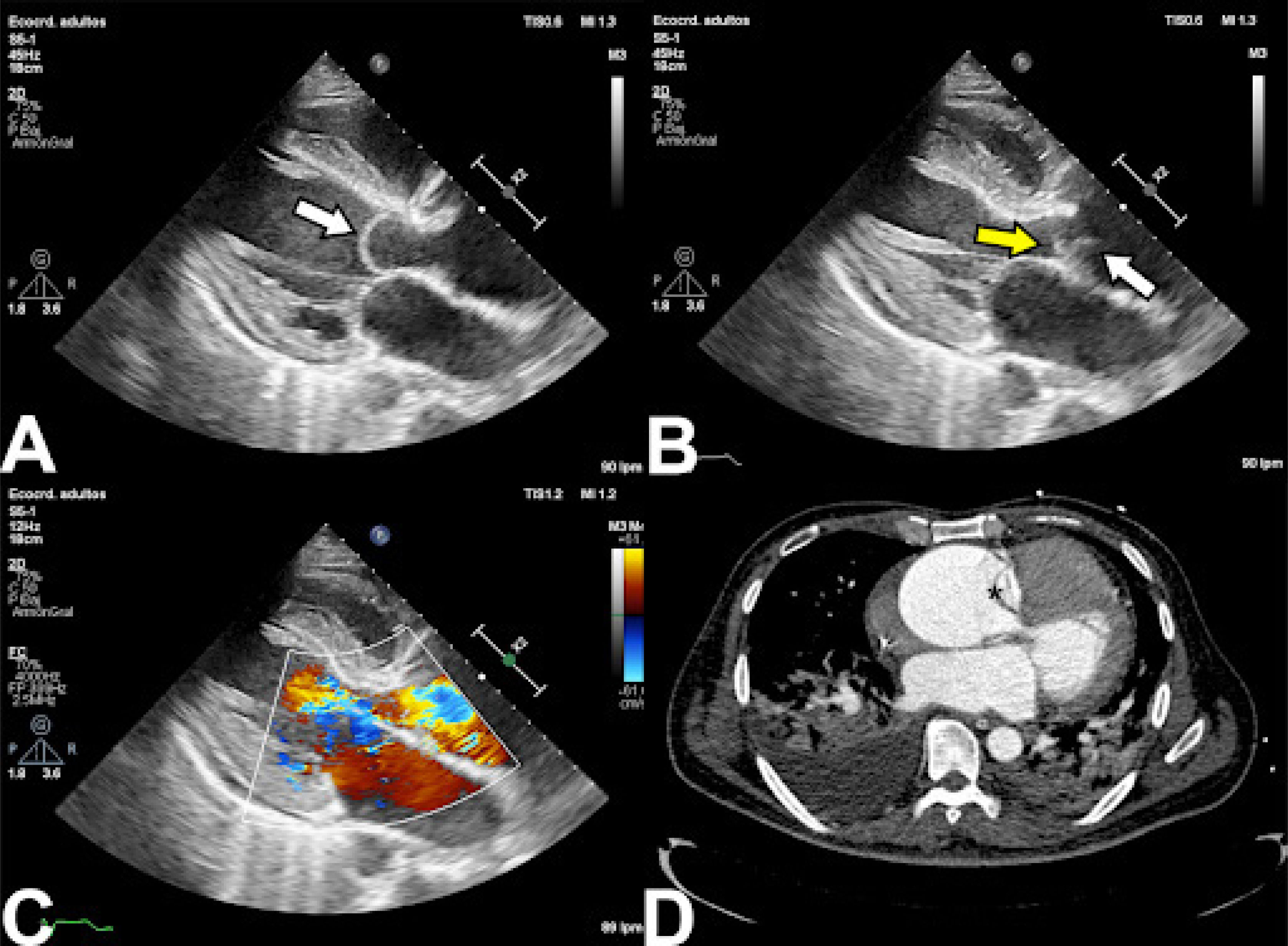
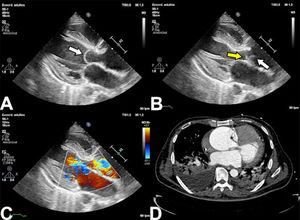
En el ecocardiograma puede observarse el flap de disección como una estructura libre con movimiento independiente de las es- tructuras adyacentes generando alteraciones en el flujo a la eva- luación con doppler color17 (Fig. 2).
Hallazgos en ecocardiografía en síndrome aórtico agudo. A: Se observa el desgarro intimal que cruza la válvula aórtica en diástole (flecha blanca). B: En sístole se observan dos estructuras (flecha blanca y amarilla) con movimiento independiente. C: Con doppler color se observa insuficiencia de la válvula causada por la distorsión de la coaptación valvular. D: En TAC se confirma la presencia de DA aguda tipo A.
El ETT tiene la ventaja de poder realizarse rápidamente a la ca- becera del paciente y es especialmente útil para evaluar la pre- sencia de disfunción valvular aórtica, la presencia de derrame pericárdico y de trastornos segmentarios de la contractilidad. Su valor en la evaluación de la aorta está limitado hasta la unión sinotubular por la ventana acústica e interposición de estruc- turas18.
El ETE es una alternativa superior al ETT, permitiendo la localiza- ción de los desgarros intimales en el 78 al 100% de los casos, con limitación para evaluar la aorta ascendente distal y el arco aórtico por interposición de la vía aérea. Con respecto al diagnóstico de complicaciones, no solo puede identificar la presencia de insufi- ciencia aórtica, sino que además puede aclarar el mecanismo de la misma, lo cual facilita la planeación del procedimiento quirúr- gico. Debido al riesgo de una respuesta catecolaminérgica que cause un pico hipertensivo, el ETE debe realizarse bajo sedación o anestesia general18.
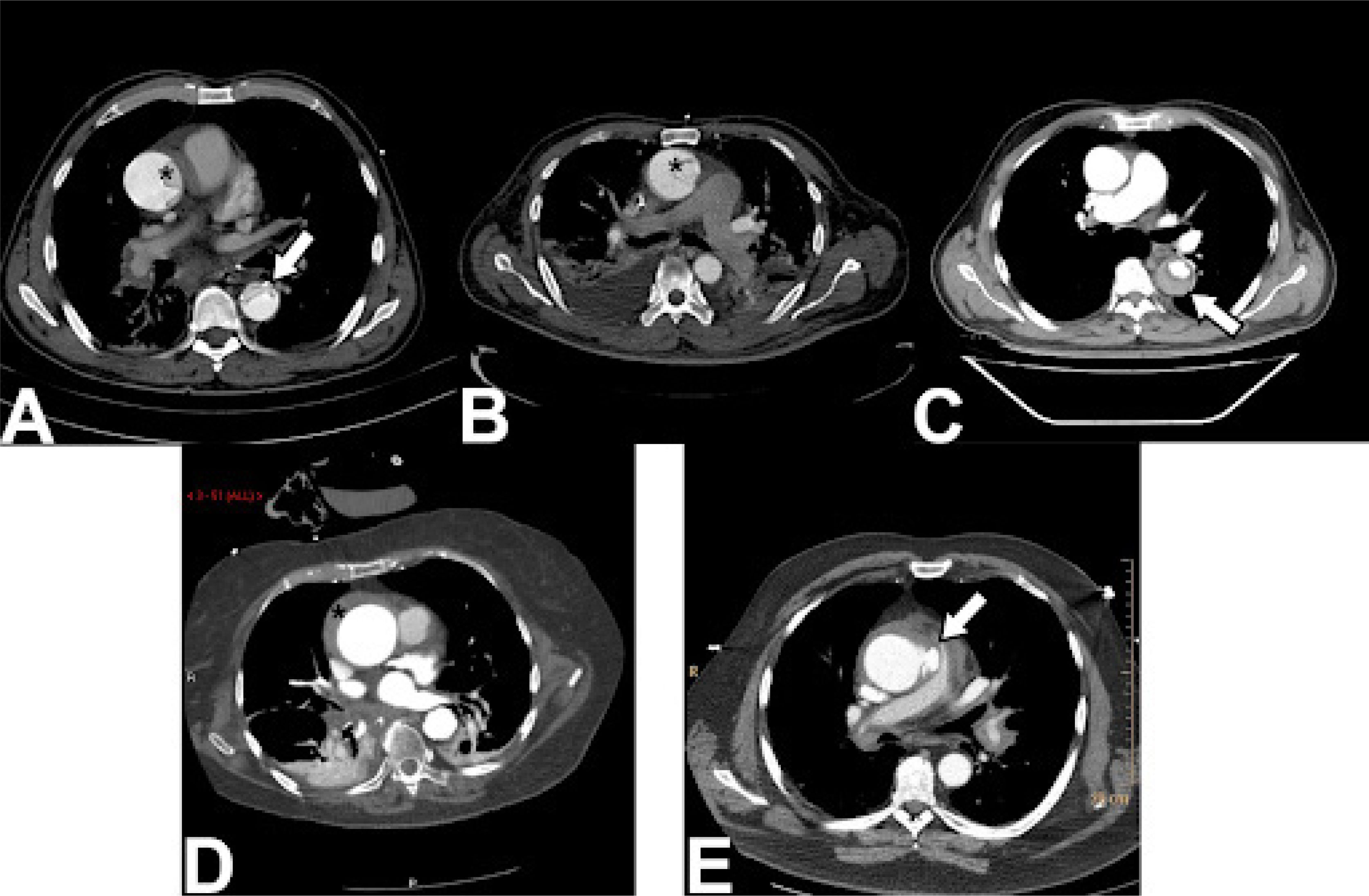
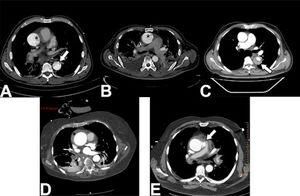
La modalidad diagnóstica superior es la TAC (Fig. 3), con una sen- sibilidad y especificidad cercana al 98%. Tiene la ventaja no solo de localizar los sitios de desgarro intimal sino de evaluar la extensión total de la aorta para identificar la progresión de la DA, determinar el compromiso de las ramas arteriales, establecer el compromiso coro- nario (si el estudio es gatillado con ECG) y es útil para el seguimiento seriado de los pacientes4. La TAC debe siempre incluir un estudio sin contraste para evaluar la presencia de hemorragia mediastinal, he- matoma intramural, derrame pericárdico hemorrágico y calcificacio- nes. Posteriormente debe realizarse un estudio contrastado con un adecuado bolo de contraste que genere una adecuada opacificación de la fase arterial. La TAC tiene la ventaja de ser un estudio amplia- mente disponible, de rápida realización con los equipos modernos y compatible con la presencia de prótesis metálicas y los equipos de soporte vital que pueda requerir el paciente18.
Hallazgos en TAC de pacientes con síndromes aórticos agudo. A: Se observa el desgarro intimal en la aorta ascendente (asterisco) que se extiende hasta la descendente (flecha). B: Se observa el desgarro intimal limitado a la aorta ascendente (asterisco). C: Se observa la disección con falsa luz parcialmente trombosada en la aorta descendente (flecha). D: Hema- toma intramural en la aorta ascendente con la característica forma creciente (asterisco). Caso cortesía Dr David Preston, Radiopaedia.org, rID: 27746. E: Úlcera aórtica penetrante ubicada en el borde lateral izquierdo de la aorta ascendente (flecha). Caso cortesía Dr. Jens Christian Fischer, Radiopaedia. org, rID: 12810.
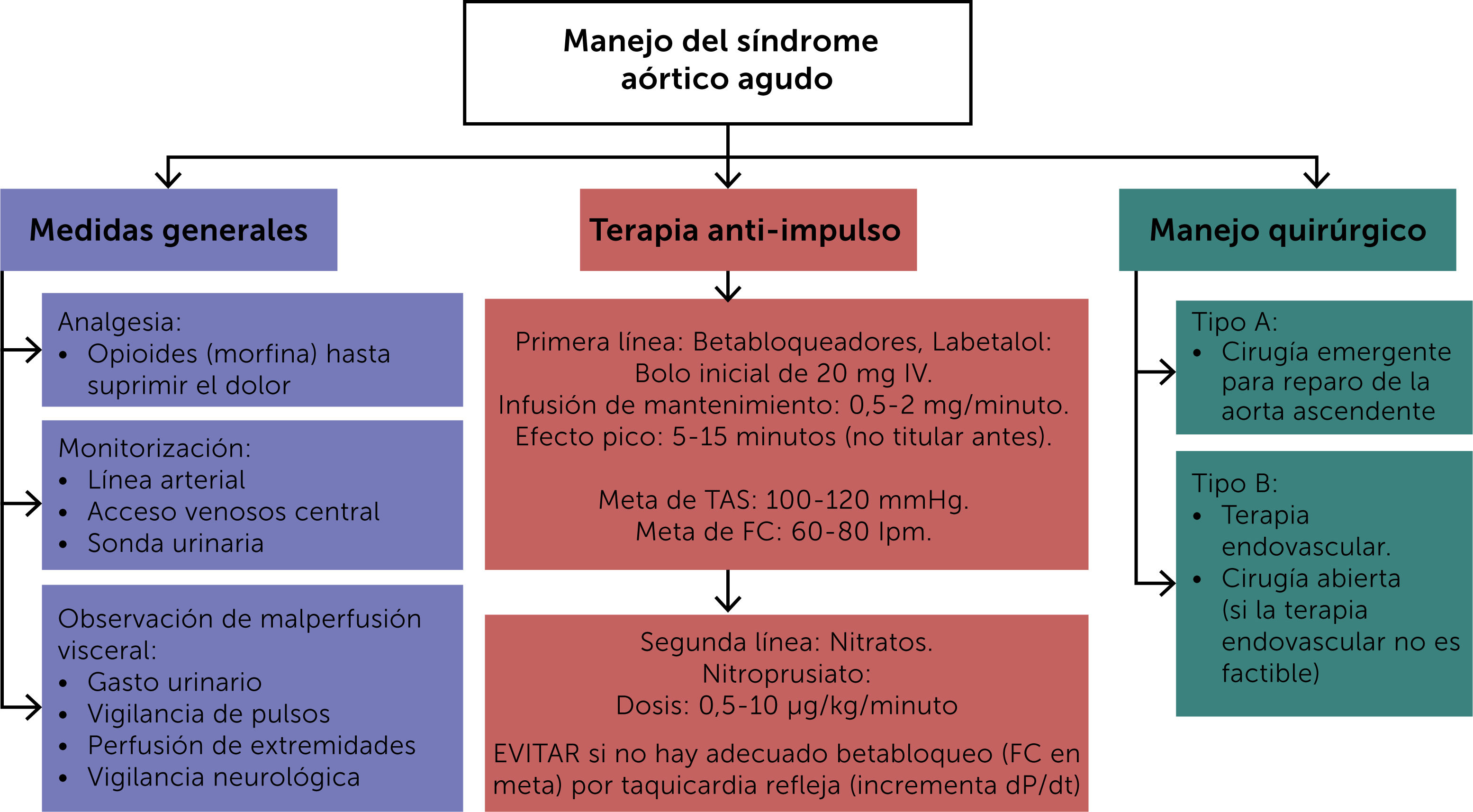
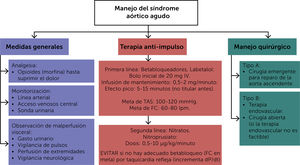
Una vez establecido el diagnóstico de DAA, los pacientes deben ser trasladados a un centro especializado en el manejo del síndro- me aórtico agudo, en donde equipos multidisciplinarios tratan los pacientes de acuerdo con protocolos establecidos (Fig. 4). Esta conducta está soportada por evidencia creciente que demuestra una relación entre experiencia del cirujano y la institución19 con una disminución en mortalidad y complicaciones20. Un metaaná- lisis de 30 estudios con más de 16.000 pacientes mostró que los pacientes tienen un menor riesgo de mortalidad intrahospitalaria y a 30 días si son tratados en centros de alto volumen (reducción del 49%), si son operados por cirujanos experimentados (reduc- ción del 59%), y manejados por “equipos aórticos” multidisciplina- rios (reducción del 69%)21.
El primer paso en el tratamiento de la DAA debe ser el control del dolor, tensión arterial y frecuencia cardíaca. El manejo médico inicial está encaminado a disminuir la fuerza de cizallamiento con el fin de limitar la extensión de la disección y la propagación de la luz falsa. Si bien la terapia médica no reemplaza la intervención quirúrgica, si ayuda en la estabilización inicial de los pacientes. Los agentes beta-bloqueadores disminuyen la frecuencia cardía- ca, la fuerza contráctil del corazón y la presión arterial, buscando cifras de frecuencia cardíaca de 60 latidos por minuto o menos y presión arterial sistólica de 100 a 120 mmHg22. Al disminuir la frecuencia cardíaca y la post carga, estos agentes tienen un efecto benéfico sobre la perfusión miocárdica18. Los beta bloqueadores de primera línea son metoprolol, esmolol, propanolol y labetalol. Por su efecto crono e inotrópico negativo, junto con efecto al- fa-bloqueante, el labetalol es la droga de elección como primera línea en nuestra institución. En pacientes con contraindicación para el uso de beta bloqueadores, los calcio-antagonistas como verapamilo o diltiazem pueden ser utilizados. Medicamentos de segunda línea pueden adicionarse una vez se logre un adecua- do control de la frecuencia cardíaca, evitando de esa manera una taquicardia refleja. Los dos medicamentos más utilizados son el nicardipino y el nitroprusiato. Con este último es importante te- ner en cuenta el riesgo de toxicidad por cianuro en casos de uso prolongado. Por último, es de suma importancia controlar el dolor mediante la utilización de opiáceos intravenosos como adyuvante de la terapia anti-impulso.
Los pacientes en quienes se confirme la presencia de una DAATA con o sin complicaciones, deben ser llevados a cirugía de manera urgente para reemplazar la aorta ascendente.
Una revisión completa de las técnicas y consideraciones quirúr- gicas va más allá de los objetivos de este capítulo; se enumeran algunos principios generales del manejo quirúrgico23:
El manejo actual debe incluir la transección completa del des- garro intimal primario, con reconstitución de los extremos proximal y distal de la aorta. El segmento resecado debe reem- plazarse con un injerto de dacrón.
La anatomía y función de la válvula aórtica debe evaluarse pre- e intraoperatoriamente para determinar si hay compromiso. En casos de insuficiencia secundaria a dilatación de la unión sino-tubular, la corrección de la disección y reemplazo de la porción tubular de la aorta ascendente pueden ser suficientes para restaurar la competencia valvular.
En pacientes con destrucción de la raíz aórtica, con colage- nopatías, válvula aórtica bicúspide, dilatación marcada de los senos de Valsalva o ectasia anulo-aórtica, se recomienda el re-emplazo de la raíz y la válvula aórtica (cirugía de Bentall modifi- cada) o el reemplazo de la raíz aórtica con reimplantación de la válvula (cirugía de Tirone David).
En pacientes con un desgarro intimal primario en el arco aórtico dis- tal o en proximidad de los troncos supra-aórticos, ruptura o aneu- risma del arco aórtico, debe considerarse la realización de un reem- plazo total del arco utilizando una prótesis híbrida con trompa de elefante congelada (endoprótesis en la aorta descendente). Esta téc- nica debe ser aplicada solamente en centros de alta experiencia en el manejo de pacientes con disección aórtica, pues puede resultar en altas tasas de isquemia medular con el resultante déficit neuroló- gico. El tratamiento más distal de la aorta torácica descendente con este injerto tiene un menor riesgo de degeneración aneurismática del falso lumen, pero se acompaña de mayor riesgo de lesión espinal y puede incrementar la mortalidad intraoperatoria. La decisión de utilizarla debe ser individualizada caso a caso.
En el periodo postoperatorio deben vigilarse el sangrado y los pa- rámetros de perfusión tisular mientras se mantienen la presión arterial y frecuencia cardíaca en cifras similares a las preopera- torias. Ante cualquier sospecha de síndrome de malperfusión, se debe estudiar el paciente con una nueva TAC y definir si se re- quiere de una nueva intervención o tratamiento con prótesis en- dovasculares, fenestración del desgarro intimal con balón o con stent directo al lumen verdadero de las ramas comprometidas4.
En pacientes con síndromes aórticos agudos tipo B el eje del tra-tamiento es la terapia médica siguiendo los principios menciona-dos previamente. A menos que haya criterios de complicación, es ideal obtener estabilización médica antes de definir intervencio- nes directamente dirigidas a la disección. Una vez se haya deci- dido indicación para intervención (idealmente diferido posterior al egreso hospitalario), los resultados han mostrado que la tera- pia endovascular es altamente efectiva, con un menor riesgo de morbilidad peri procedimental y por ende se considera la opción preferida4.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.